Похожие презентации:
Непредельные (ненасыщенные) углеводороды
1.
НЕПРЕДЕЛЬНЫЕ (НЕНАСЫЩЕННЫЕ)УГЛЕВОДОРОДЫ
- УГЛЕВОДОРОДЫ, В
МОЛЕКУЛАХ КОТОРЫХ МЕЖДУ
АТОМАМИ С СУЩЕСТВУЮТ
ДВОЙНЫЕ И (ИЛИ) ТРОЙНЫЕ
СВЯЗИ
2.
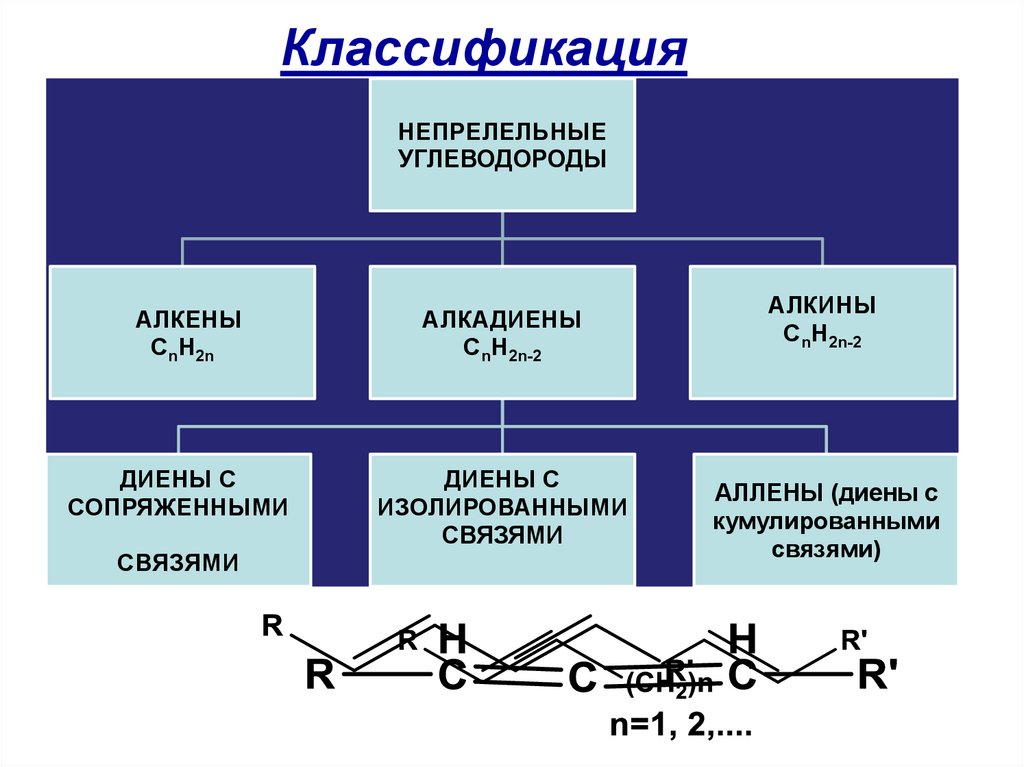
КлассификацияНЕПРЕЛЕЛЬНЫЕ
УГЛЕВОДОРОДЫ
АЛКЕНЫ
СnH2n
ДИЕНЫ С
СОПРЯЖЕННЫМИ
СВЯЗЯМИ
АЛКАДИЕНЫ
СnH2n-2
ДИЕНЫ С
ИЗОЛИРОВАННЫМИ
СВЯЗЯМИ
АЛКИНЫ
СnH2n-2
АЛЛЕНЫ (диены с
кумулированными
связями)
3.
Номенклатура.• Тривиальная:
•Рациональная: алкены рассматривают
как производные этилена
C C
H
H
C C
CH3
CH2CH3
4.
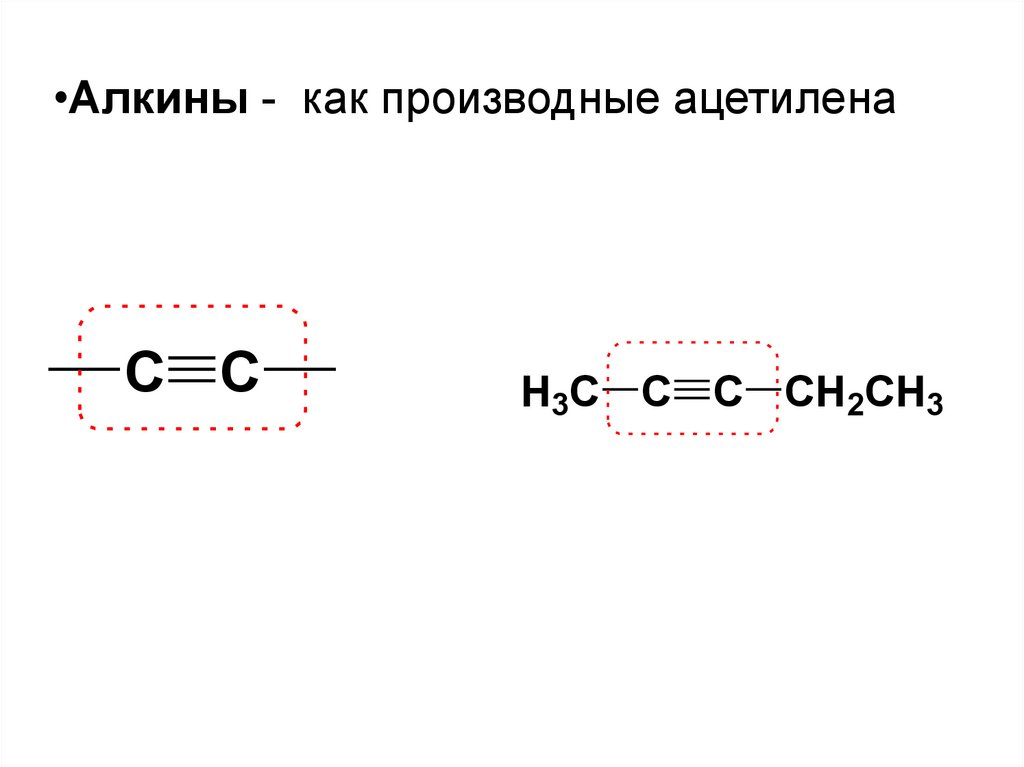
•Алкины - как производные ацетиленаC C
H3C C C CH2CH3
5.
Систематическаяноменклатура ИЮПАК
• выбирают главную цепь, включающую
кратную связь (даже если цепь не
самая длинная);
• нумеруют так, чтобы атом C при
кратной связи получил наименьший
номер;
• указывают цифрой положение кратной
связи и в названии основы суффикс -ан
меняют на: -ен (для алкенов) и -ин (для
алкинов).
6.
бут-1ен2-метилпропен
(этилэтилен) (несим-диметилэтилен)
2-метилбута-1,3-диен
7.
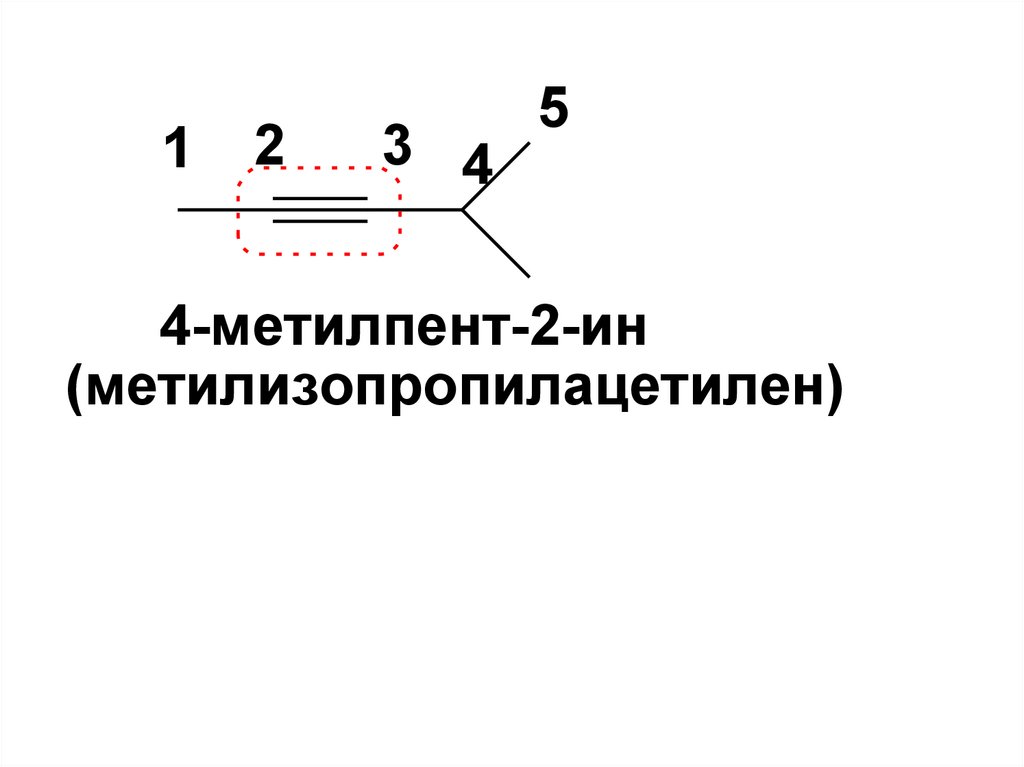
12
3 4
5
4-метилпент-2-ин
(метилизопропилацетилен)
8.
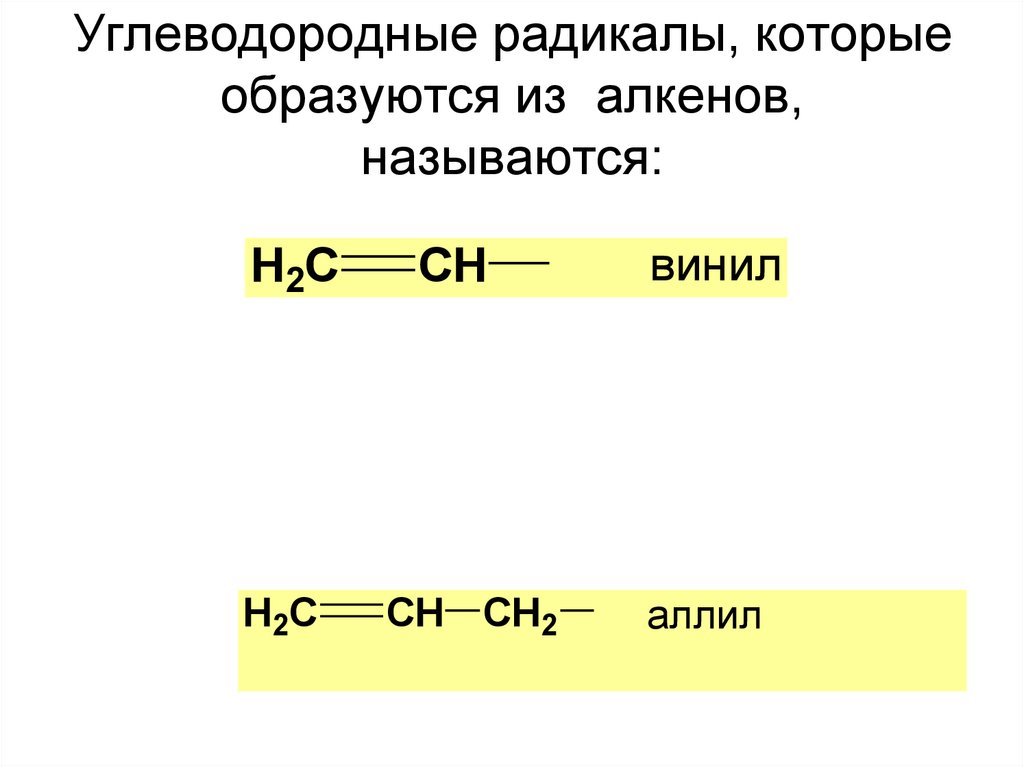
Углеводородные радикалы, которыеобразуются из алкенов,
называются:
H2C
H2C
CH
CH CH2
винил
аллил
9.
от алкинов:HC C
этинил
10.
Изомерия:• структурная – обусловлена: строением УС; положением кратной
связи .
• Пространственная (Z, E (цис-,
транс-)) – наблюдается при наличии
различных заместителей у каждого из
атомов C при двойной связи
11.
Е-бут-2-енZ-бут-2-ен
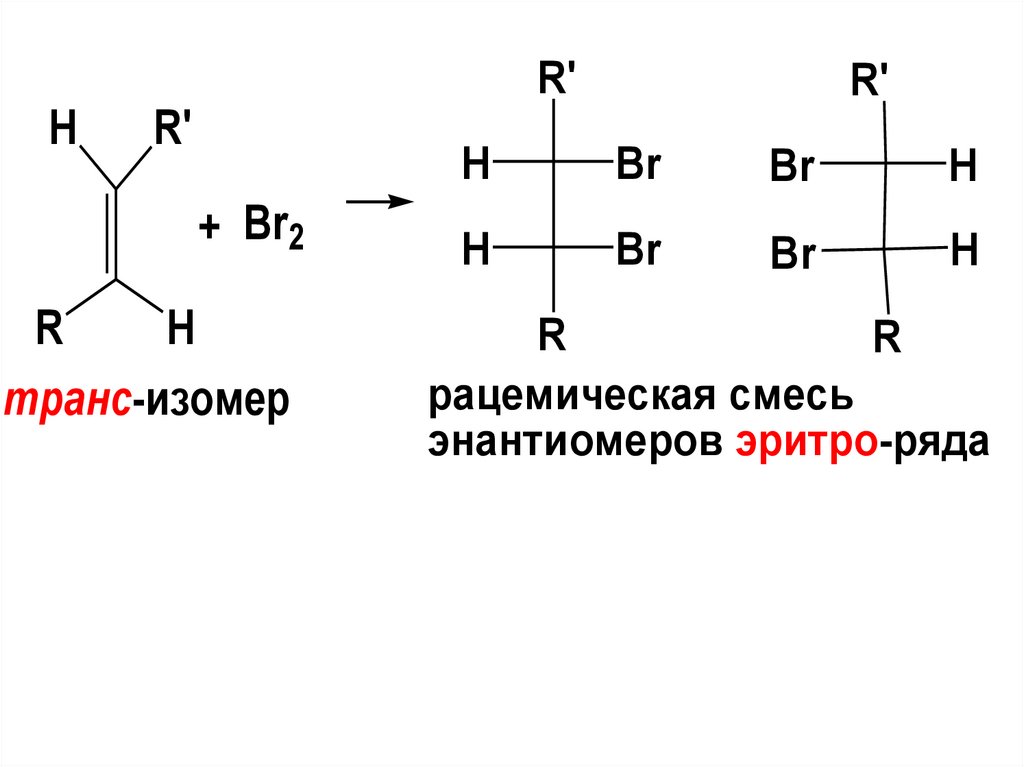
12.
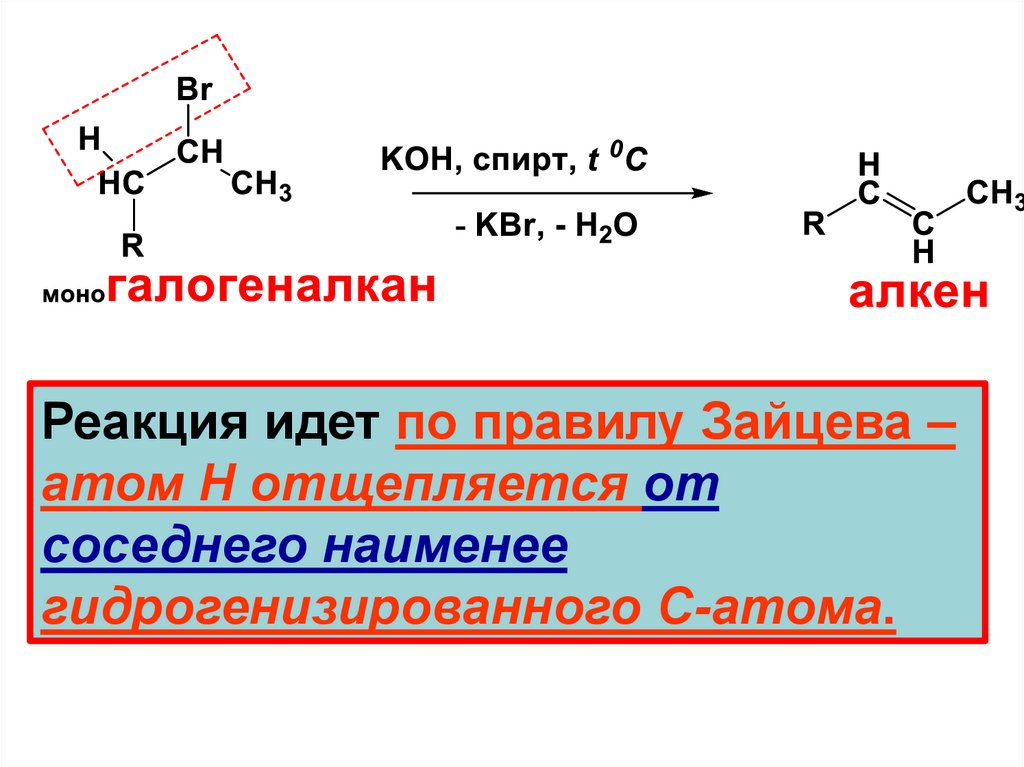
CПОСОБЫ ПОЛУЧЕНИЯ1. Общий метод введения кратной
связи (лабораторный метод) дегидрогалогенирование
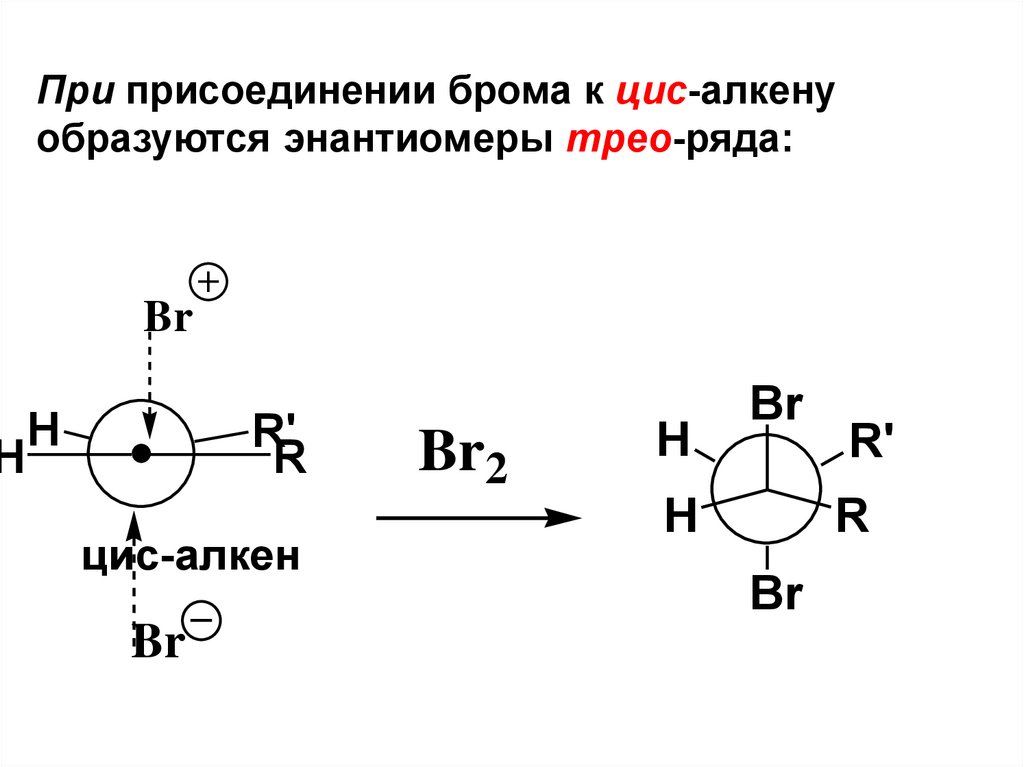
галогенопроизводных алканов
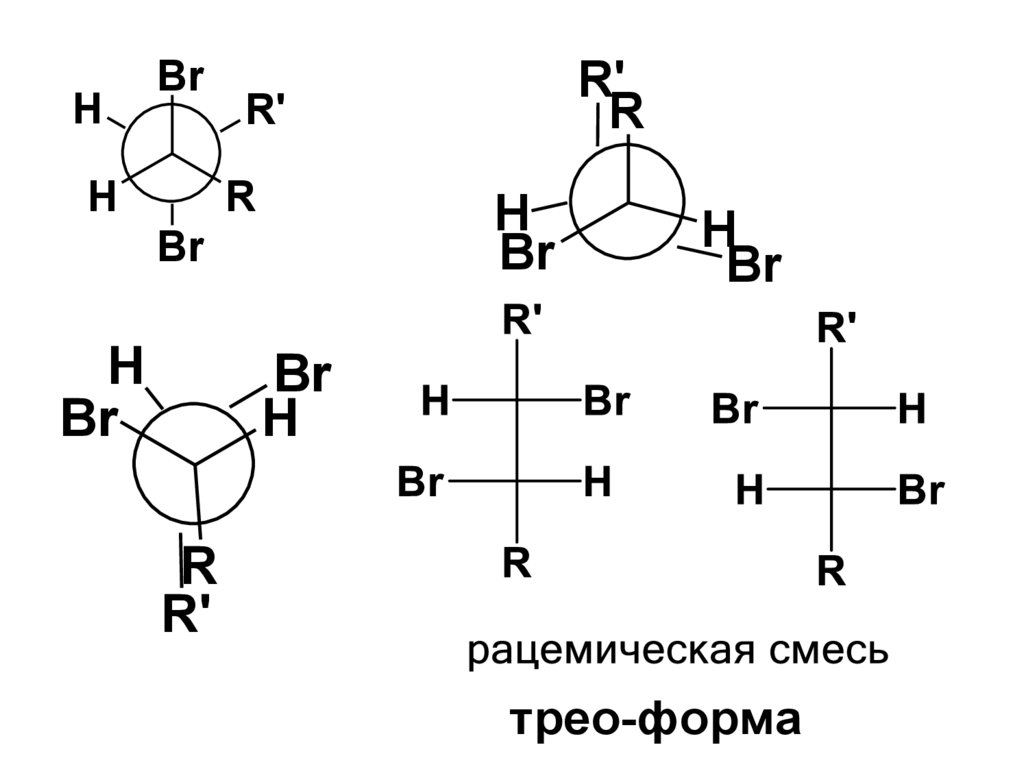
• Дегидрогалогенирование –
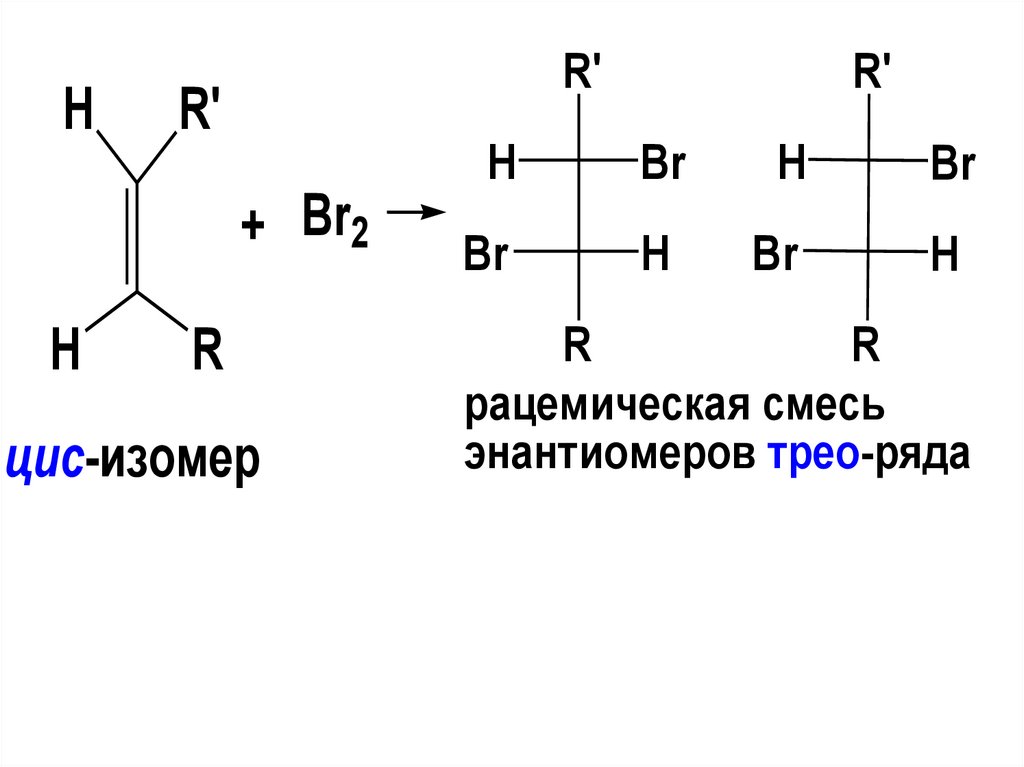
отщепление НХ
13.
Реакция идет по правилу Зайцева –атом Н отщепляется от
соседнего наименее
гидрогенизированного С-атома.
14.
RH2
Cl KOH, спирт, t 0C
C CH
R
- KBr, - H2O
Cl
C C H
гем-дигалогеналкан
CH2CH2CH2CH2
H
C
0
KOH, спирт, t C
Cl
Cl
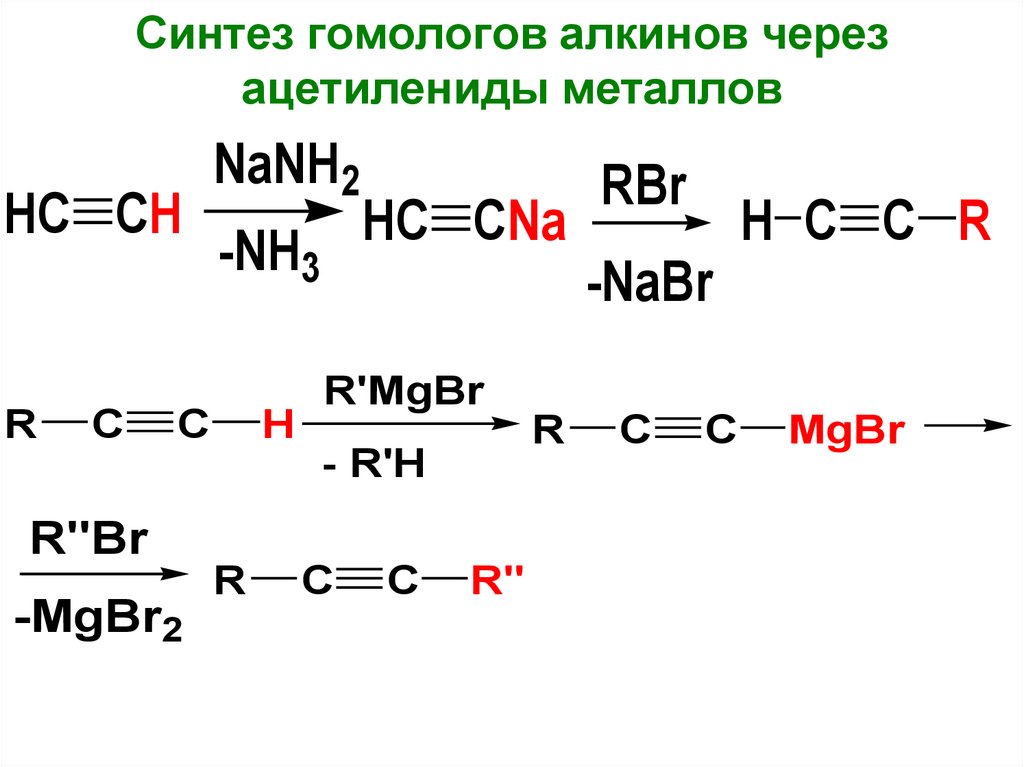
1,4-дихлорбутан
- KBr, - H2O
H2C
CH2
C
H
бутадиен-1,3
15.
2)Дегидрирование алканов(промышленный метод)
• Дегидрирование – отщепление водорода
CH3CH2CH2CH3
Cr2O3/Al2O3
450 оС
CH3HC CHCH3
H2
Cr2O3,600oC
450 оС
H2
H
C
H2C
H2C CHCH2CH3
CH2
C
H
16.
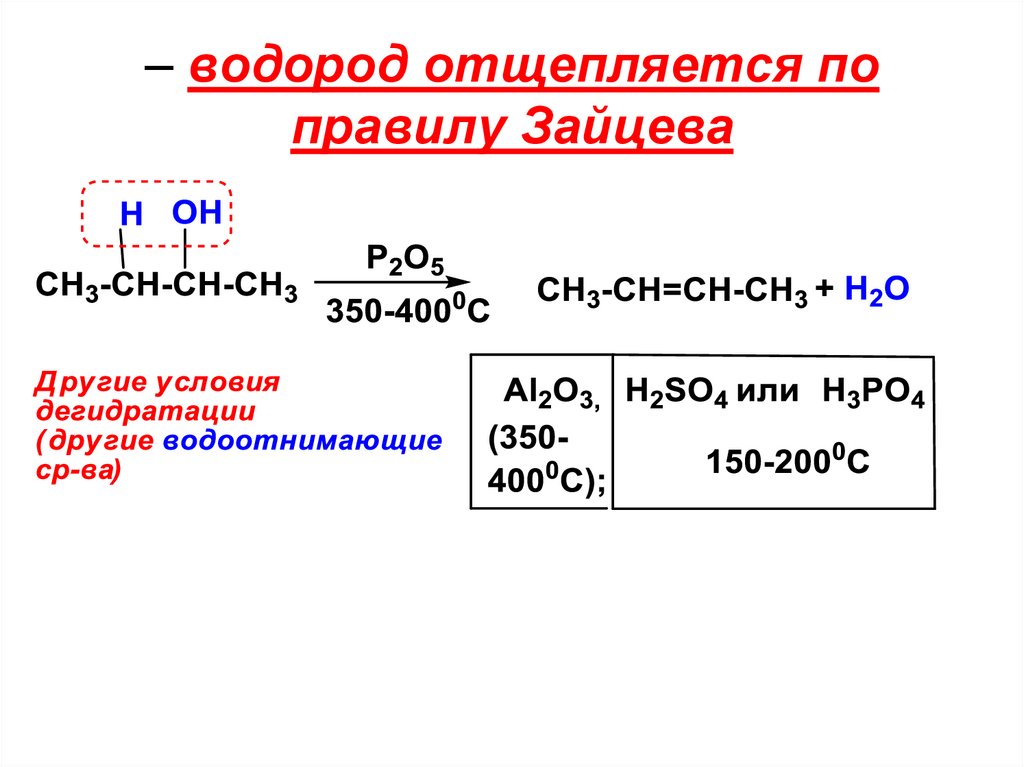
3). Дегидратация спиртов – широкоиспользуется
Дегидратация – отщепление воды
17.
– водород отщепляется поправилу Зайцева
18.
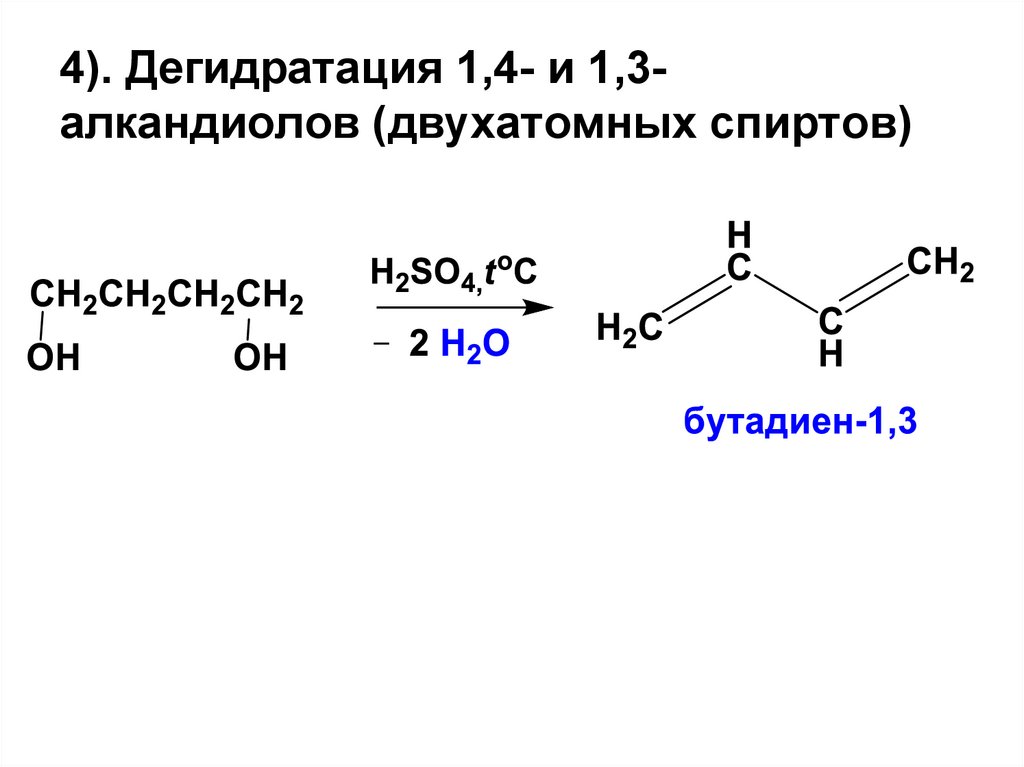
4). Дегидратация 1,4- и 1,3алкандиолов (двухатомных спиртов)19.
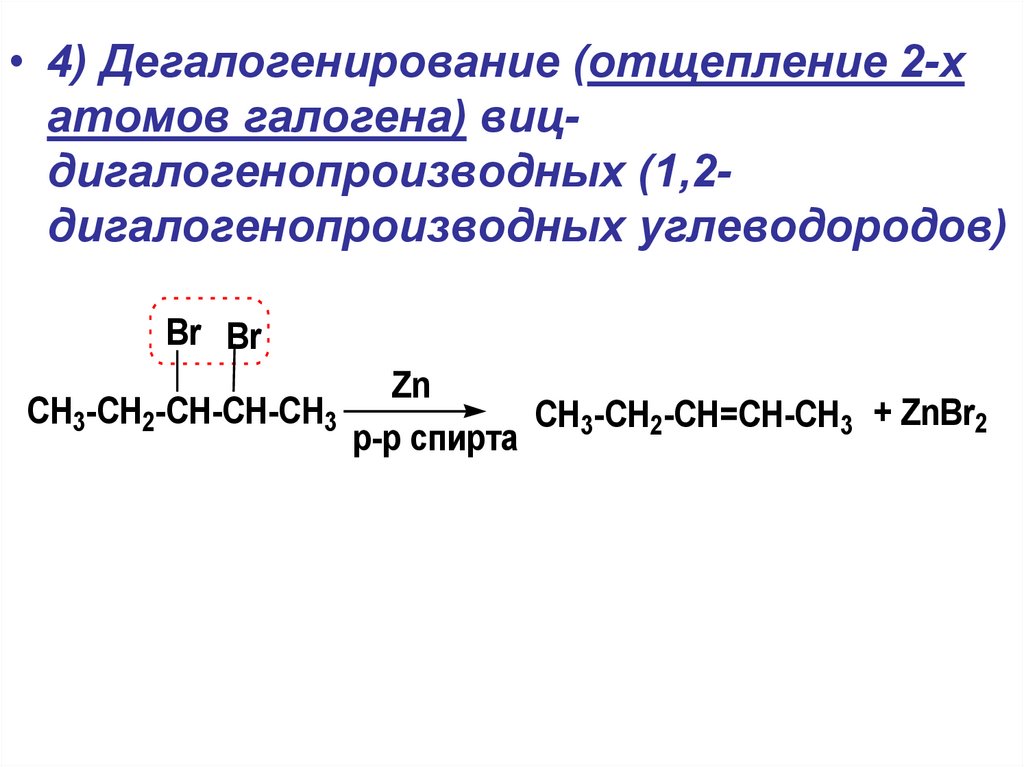
• 4) Дегалогенирование (отщепление 2-хатомов галогена) вицдигалогенопроизводных (1,2дигалогенопроизводных углеводородов)
Br Br
Zn
CH3-CH2-CH-CH-CH3
CH3-CH2-CH=CH-CH3 + ZnBr2
р-р спирта
20.
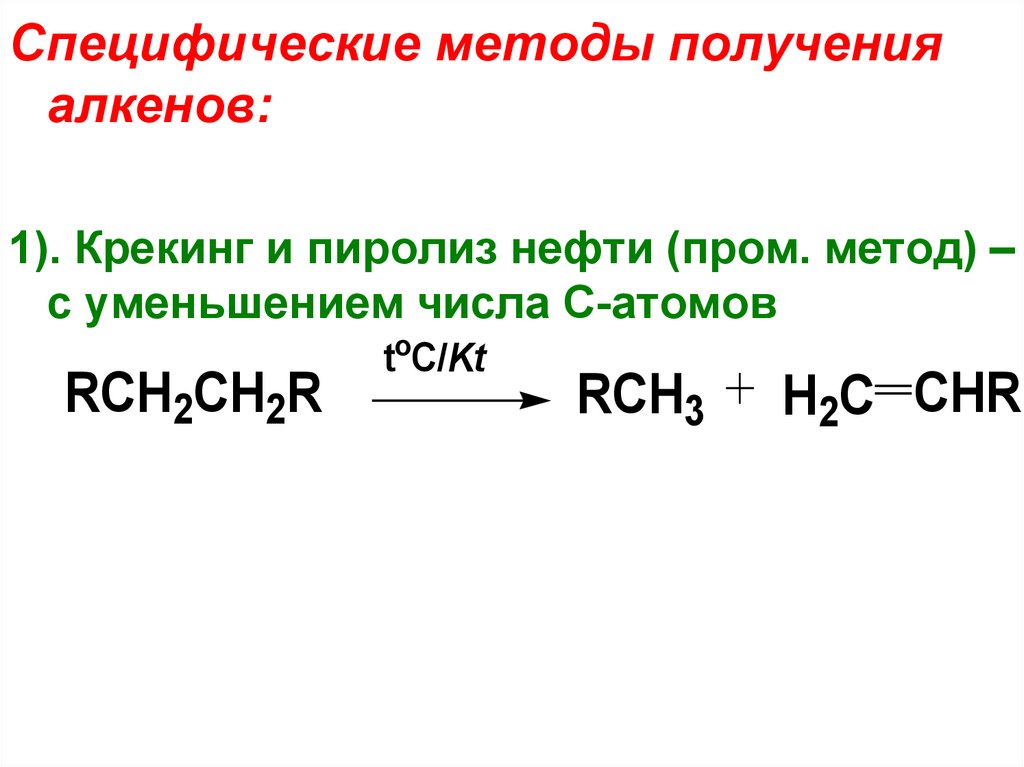
Специфические методы полученияалкенов:
1). Крекинг и пиролиз нефти (пром. метод) –
с уменьшением числа С-атомов
RCH2CH2R
toC/Kt
RCH3
H2C CHR
21.
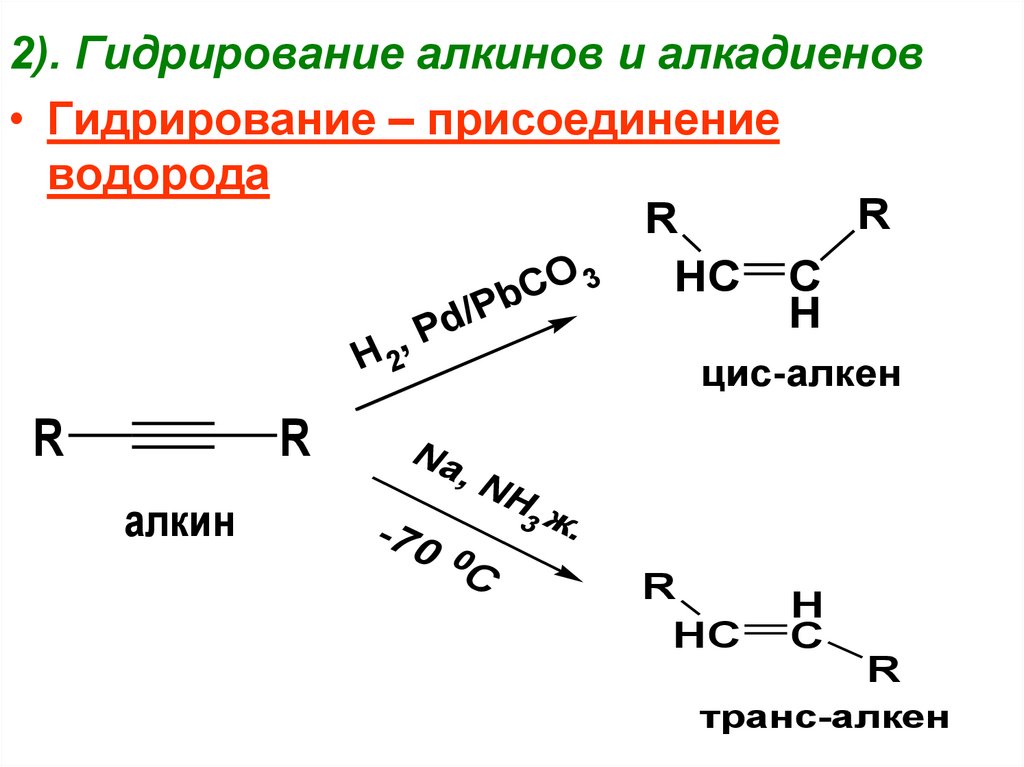
2). Гидрирование алкинов и алкадиенов• Гидрирование – присоединение
водорода
O3
C
b
P
/
d
P
,
H2
R
R
алкин
Na
,N
H
-70
3
0
C
R
HC
R
C
H
цис-алкен
ж.
R
HC
H
C
R
транс-алкен
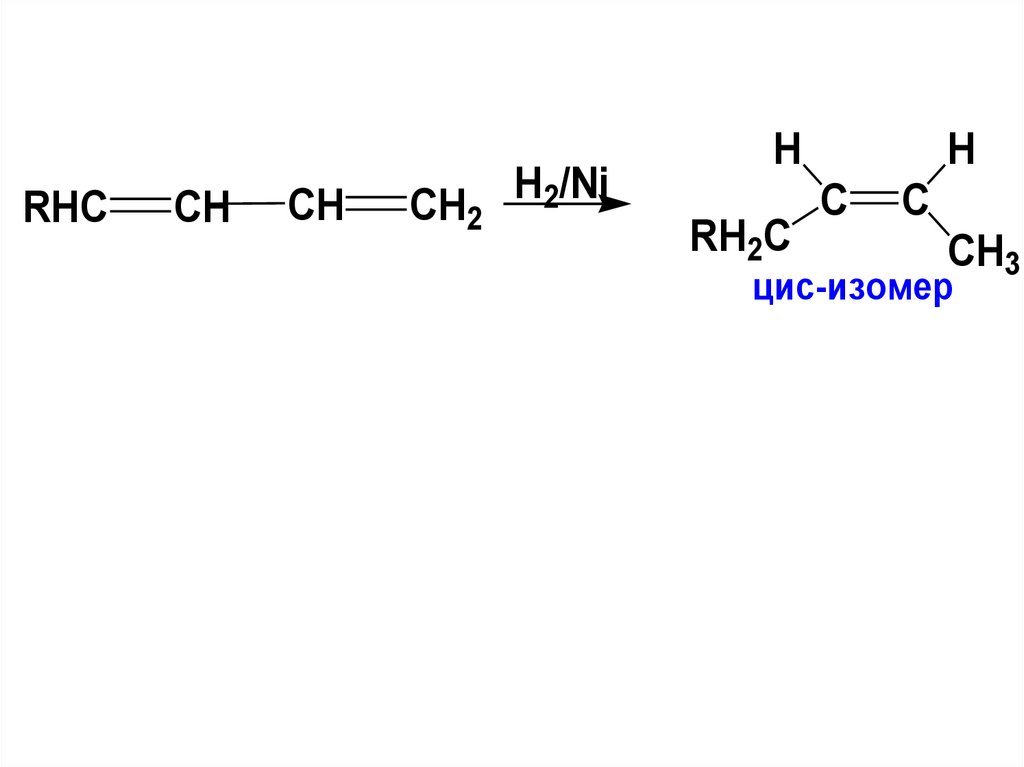
22.
RHCCH
CH
CH2
H2/Ni
H
RH2C
H
C
C
CH3
цис-изомер
23.
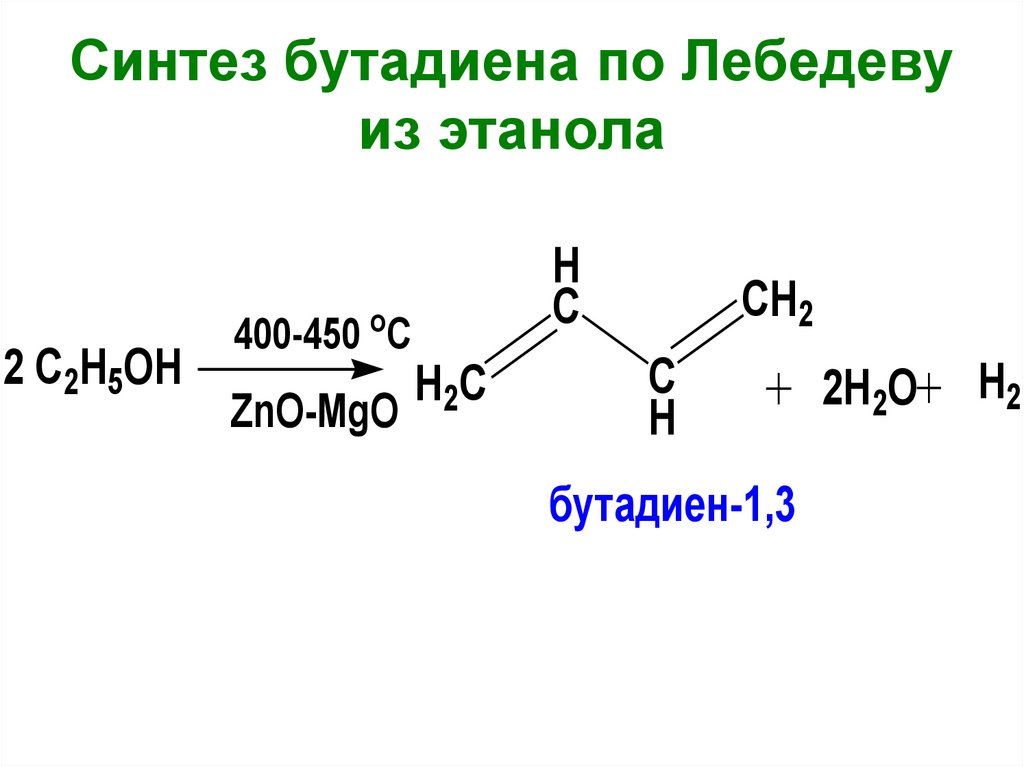
Синтез бутадиена по Лебедевуиз этанола
H
C
о
2 C2H5OH
400-450 С
ZnO-MgO
H2C
CH2
C
H
бутадиен-1,3
2H2O
H2
24.
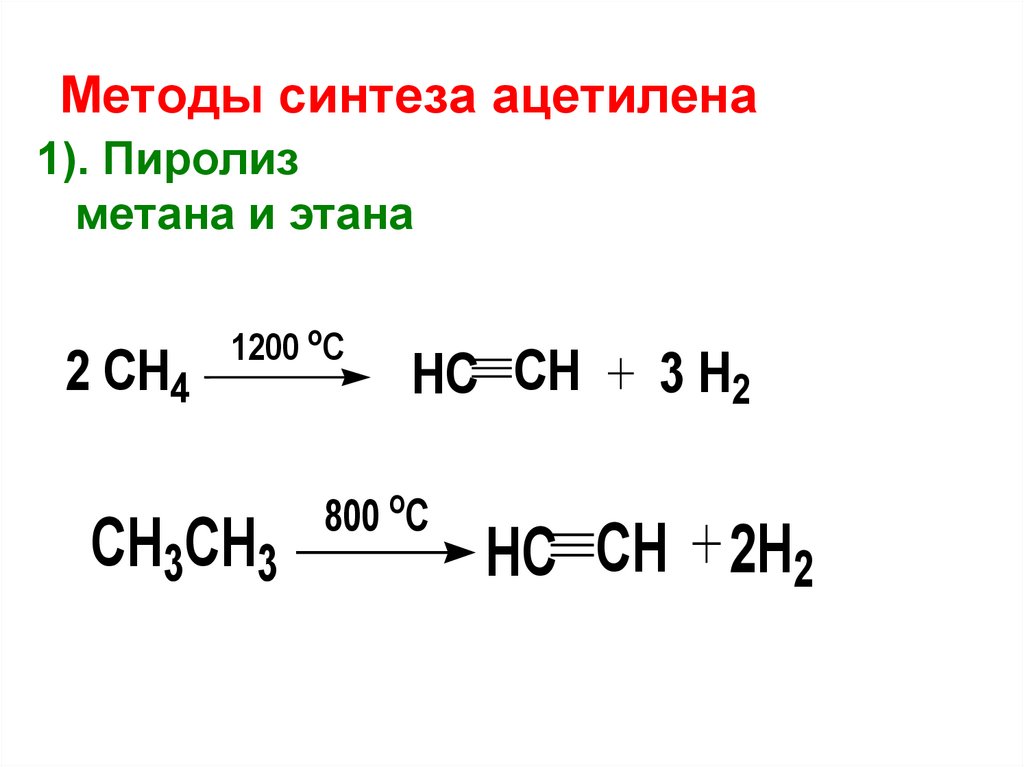
Методы синтеза ацетилена1). Пиролиз
метана и этана
2 CH4
1200 оС
CH3CH3
HC CH
800 оС
3 H2
HC CH 2H2
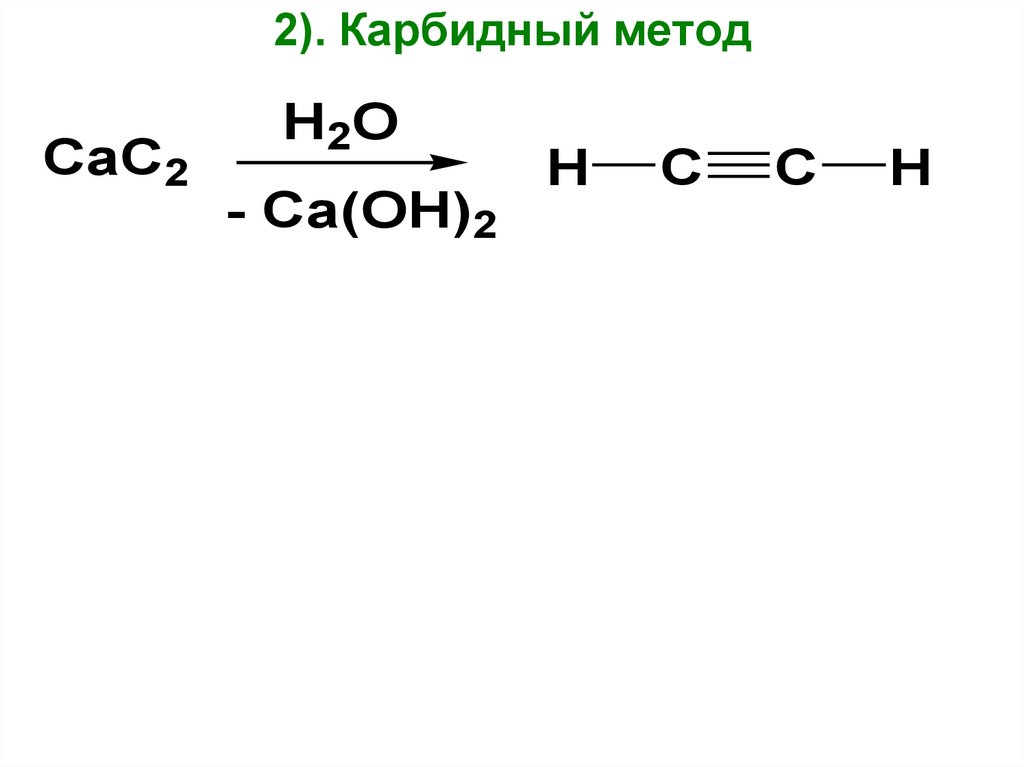
25.
2). Карбидный методCaC2
H2O
- Ca(OH)2
H
C
C
H
26.
Синтез гомологов алкинов черезацетилениды металлов
HC CH
R
C
NaNH2
-NH3
C
H
HC CNa
R
R"Br
-MgBr2
-NaBr
H C C R
R'MgBr
- R'H
R
RBr
C
C
R"
C
C
MgBr
27.
ЭЛЕКТРОННОЕ СТРОЕНИЕ алкенов уч.с.132этилен
H
C
H
C
28.
CC
29.
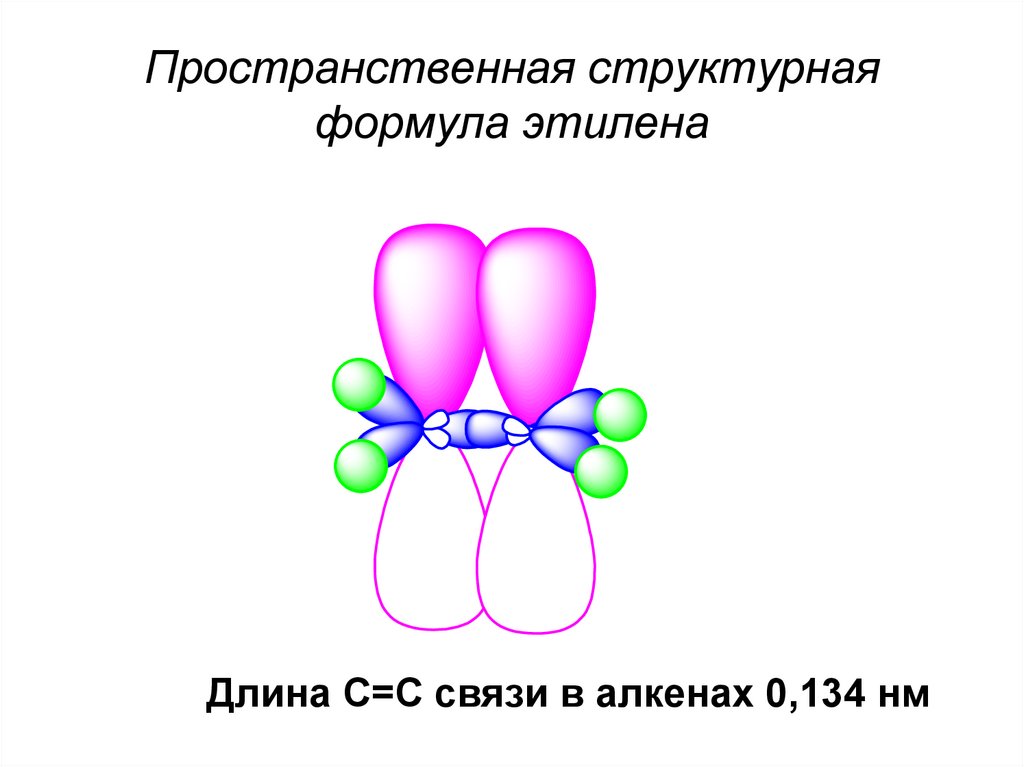
Пространственная структурнаяформула этилена
Длина С=С связи в алкенах 0,134 нм
30.
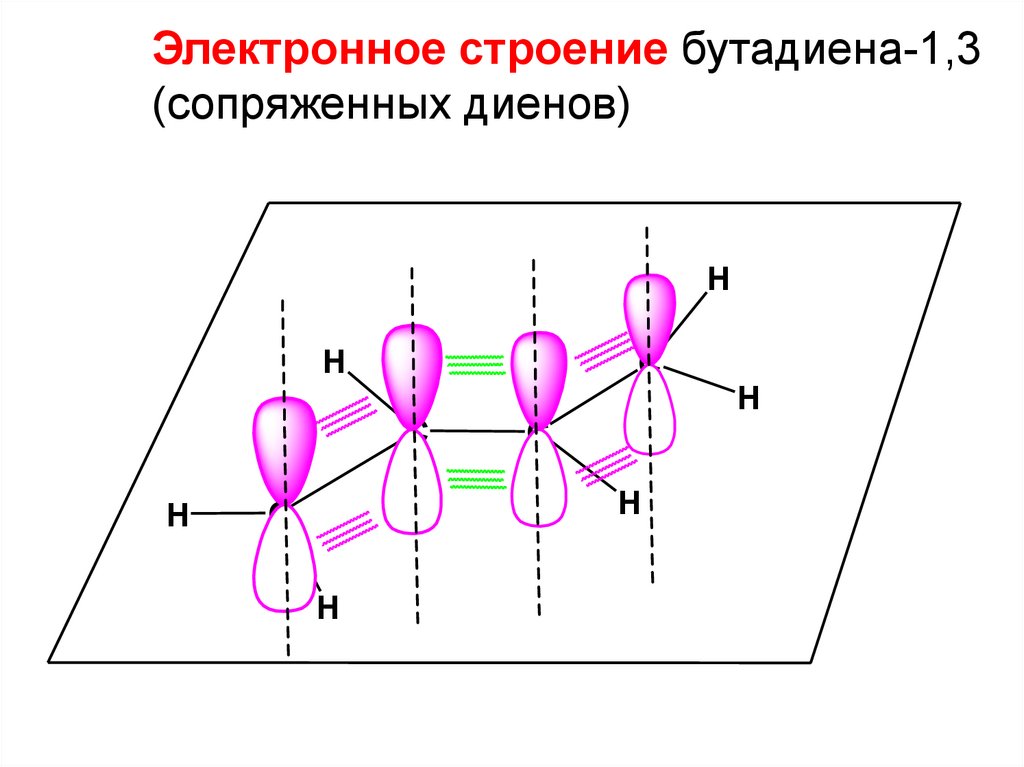
Электронное строение бутадиена-1,3(сопряженных диенов)
H
H
C
H
C
H
C
H
C
H
31.
Вид сверхуH
H
C
H
C
H
C
C
H
C
H
32.
Резонансные структуры 1,3бутадиена:CH2 CH CH CH2
CH2 CH CH CH2
CH2 CH CH CH2
• Δ Е(делок) = 16,3 кДж/моль
33.
• Параметры связейH2C
H
C
C
H
0,135
0,146
CH2
0,135
34.
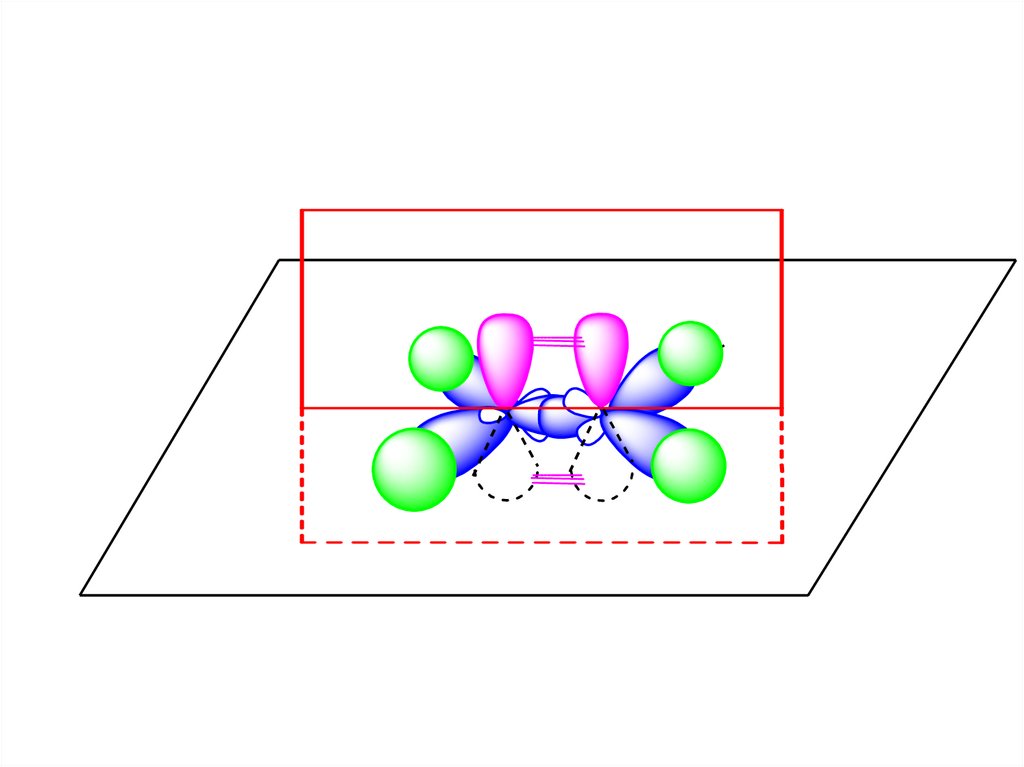
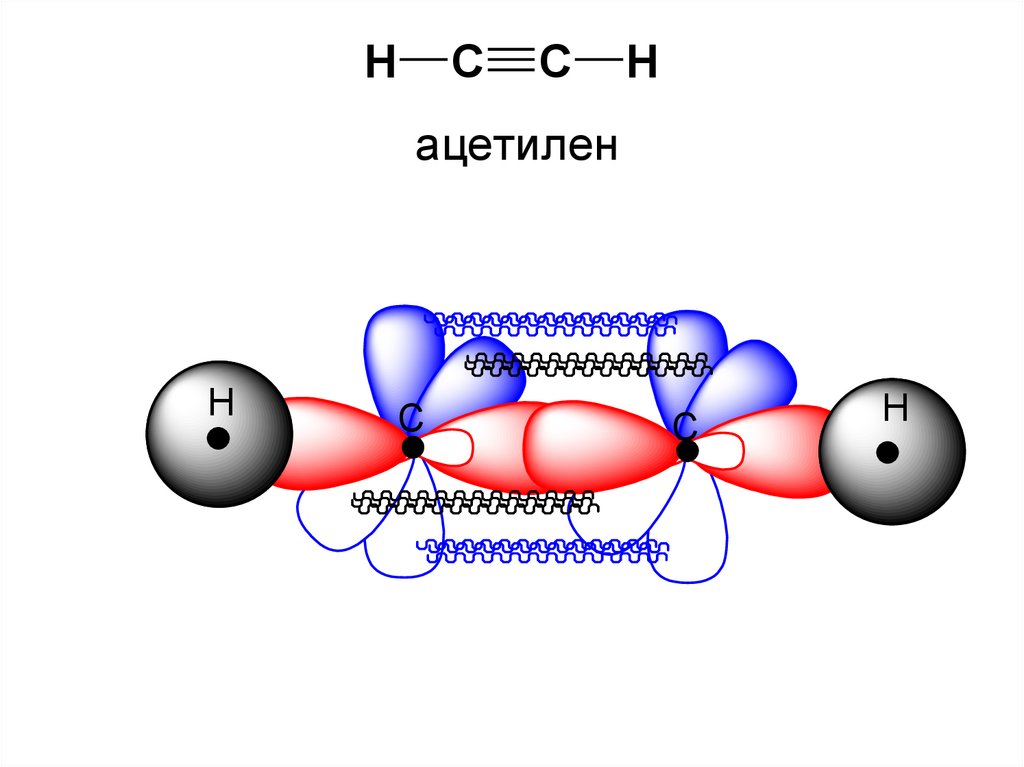
Электронное строение алкинов35.
HC
C
H
ацетилен
H
C
C
H
36.
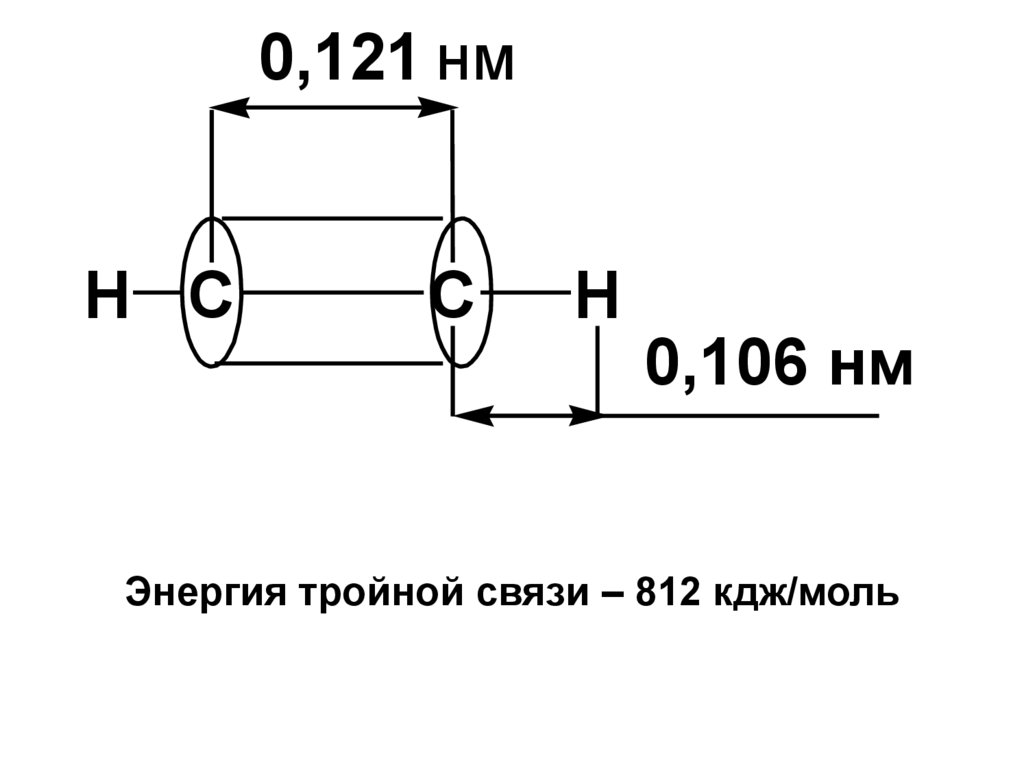
0,121 нмH C
C
H
0,106 нм
Энергия тройной связи – 812 кдж/моль
37.
Химические свойстванепредельных углеводородов
Поскольку -электроны больше удалены
от ядра, чем -электроны –
-связь менее прочная, легче
поляризуется и легко вступает в реакцию
с электрофилами, которые вызывают
гетеролитический разрыв этой связи. (Е
-связи = 348 кДж/моль; -связи – 270
кДж/моль).
Поэтому наиболее типичны реакции
электрофильного присоединения А
38.
Характерны реакции:• Реакции присоединения (АЕ, АR, АN,
циклоприсоединение).
• Реакции окисления
• Реакции полимеризации
• Аллильное замещение
• Кислотные свойства терминальных
алкинов (замещение Н при концевой
тройной связи)
39.
• I. Гидрирование (см. получениеалканов, алкенов)
H
C
R
R
C
H
алкен
H2, Ni, t0C
R
R
алкан
40.
II. Реакции электрофильногоприсоединения
AE
• Электроны π-связи алкенов
могут выступать в роли доноров
электронов по отношению к
электрофильным реагентам (т.е.
они могут быть нуклеофилами)
41.
РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ (АЕ)АЛКЕНОВ
42.
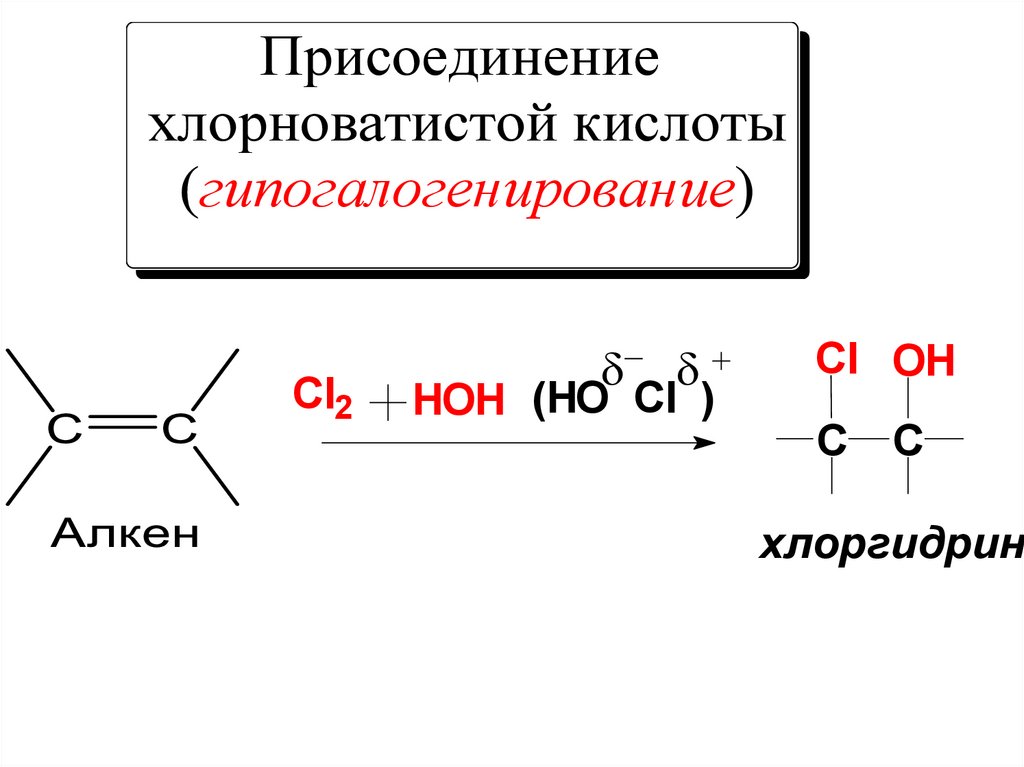
Присоединениехлорноватистой кислоты
(гипогалогенирование)
Cl2
HOH (HO Cl )
Cl OH
C
C
хлоргидрин
43.
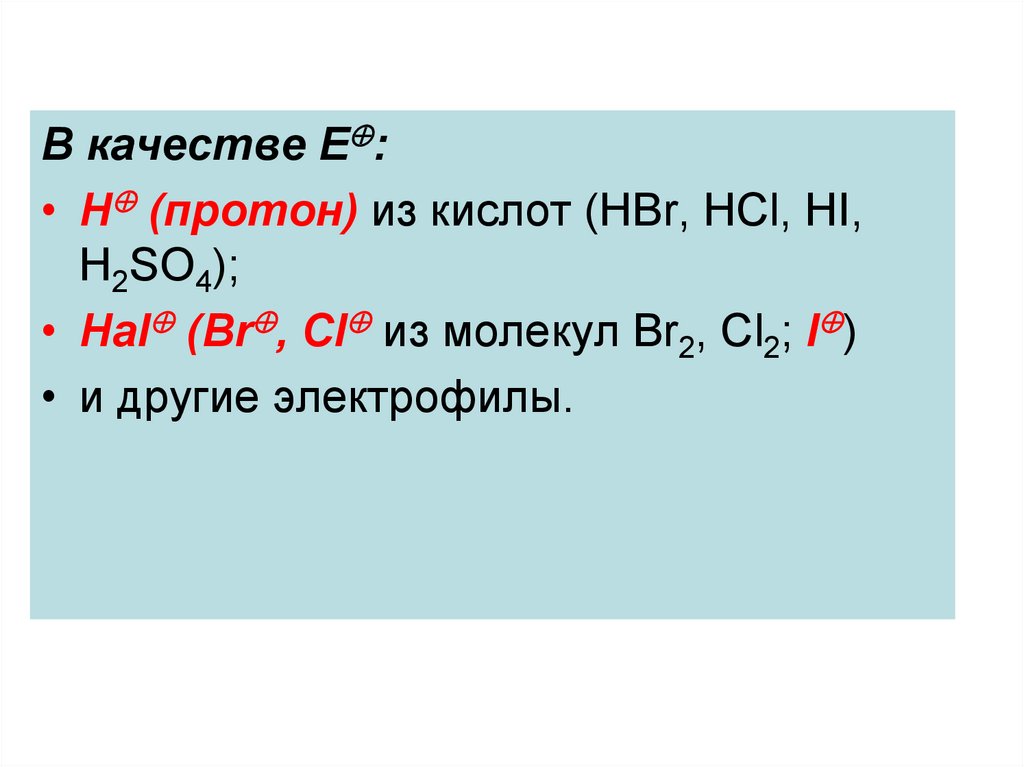
В качестве Е :• Н (протон) из кислот (HBr, HCl, HI,
H2SO4);
• Hal (Br , Cl из молекул Br2, Cl2; I )
• и другие электрофилы.
44.
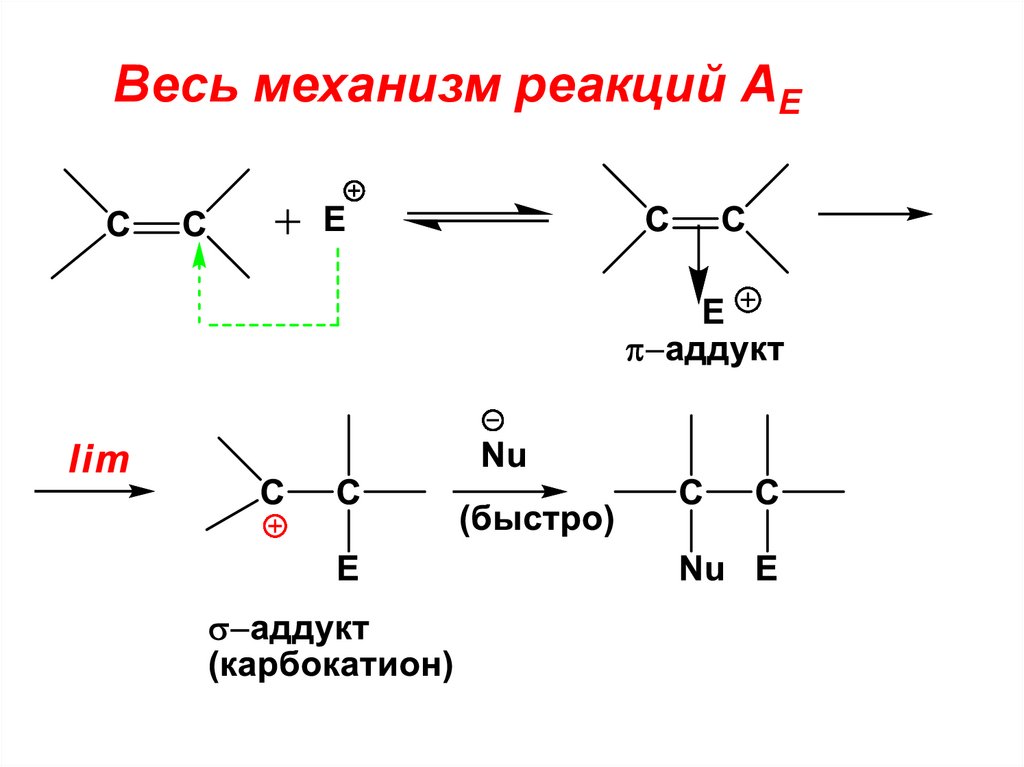
Механизм реакции АЕ, включает 3промежуточные стадии:
1. Образование π-аддукта (π-комплекса) –
электроны π-связи вступают во
взаимодействие с электрофильной
частицей Е+ (притягиваются за счет сил
электростатического притяжения,
электроны π-связи переходят на
вакантные орбитали электрофила)
45.
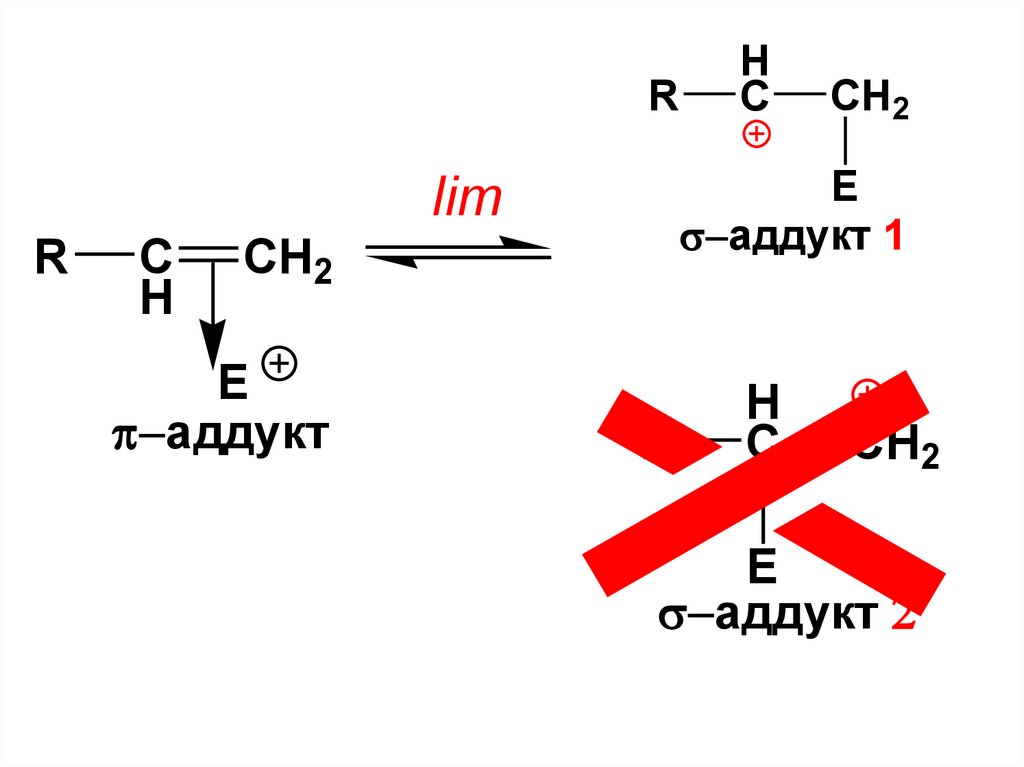
1. Первая стадия – образованиеπ-аддукта
46.
2. Вторая стадия механизмаАЕ –реакции стадия образования σаддукта
Именно эта стадия является
лимитирующей (самой медленной).
σ-аддукт – это новая частица, в
которой электрофил образует новую
σ-связь с одним из атомов С=С
σ-аддукт это карбокатион
47.
limR
C
H
CH2
E
аддукт
Эта стадия
реакции
определяет
её скорость
48.
• Из этих двух σ-аддуктов(карбокатионов) необратимо будет
образовываться преимущественно
тот, который является более
стабильным. Сравним полученные
карбокатионы
49.
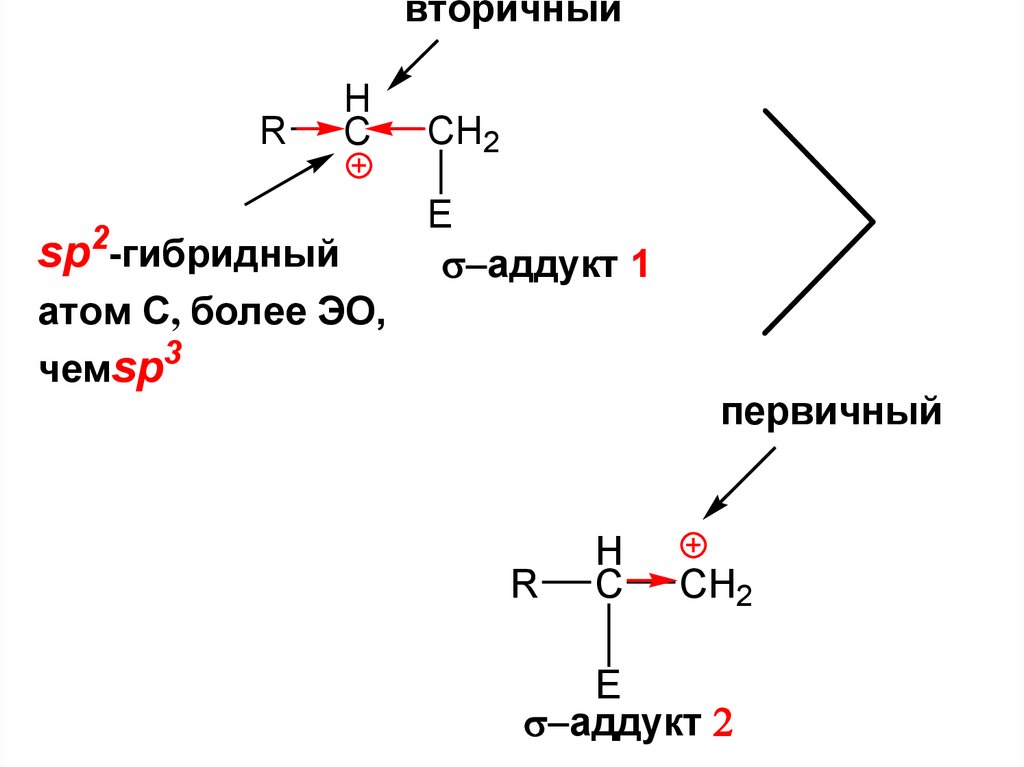
вторичныйR
H
C
2
sp -гибридный
CH2
E
аддукт 1
атом С, более ЭО,
чемsp3
первичный
R
H
C
CH2
E
аддукт
50.
RC
H
CH2
E
аддукт
CH2
E
аддукт 1
lim
R
H
C
R
H
C
CH2
E
аддукт
51.
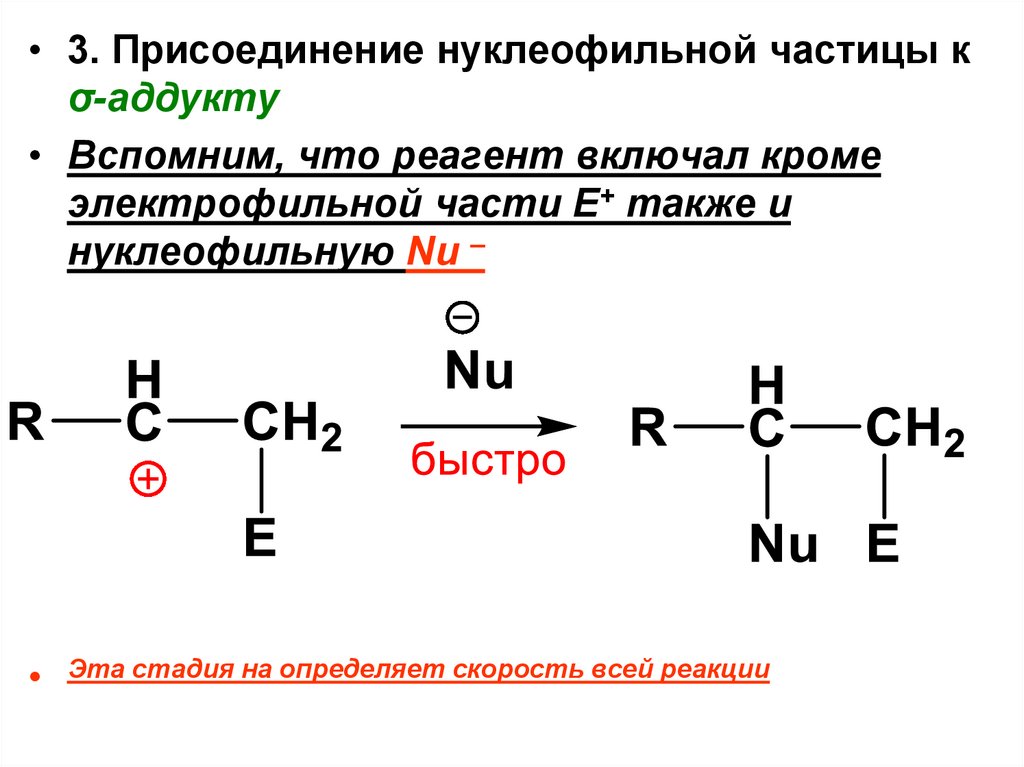
• 3. Присоединение нуклеофильной частицы кσ-аддукту
• Вспомним, что реагент включал кроме
электрофильной части Е+ также и
нуклеофильную Nu –
Эта стадия на определяет скорость всей реакции
52.
Реакционная способностьнепредельных углеводородов
Правило: реакция всегда протекает с
большей
скоростью
в
направлении
образования
в
lim
стадии
более
устойчивой промежуточной частицы.
Поскольку в lim стадии АЕ-реакций
образуется карбокатион (КК), то скорость и
направление
реакций
АЕ
будет
определяться
строением
и
стабильностью образующихся КК. Чем
больше степень делокализации (+)- заряда,
тем стабильнее КК.
53.
Геометрия КК - атом С, имеющий (+)заряд, находится в sp2-гибридномсостоянии, плоский, вакантная рорбиталь перпендикулярна
плоскости sp2-гибридных орбиталей.
Чем больше степень делокализации
+заряда, тем стабильнее КК.
54.
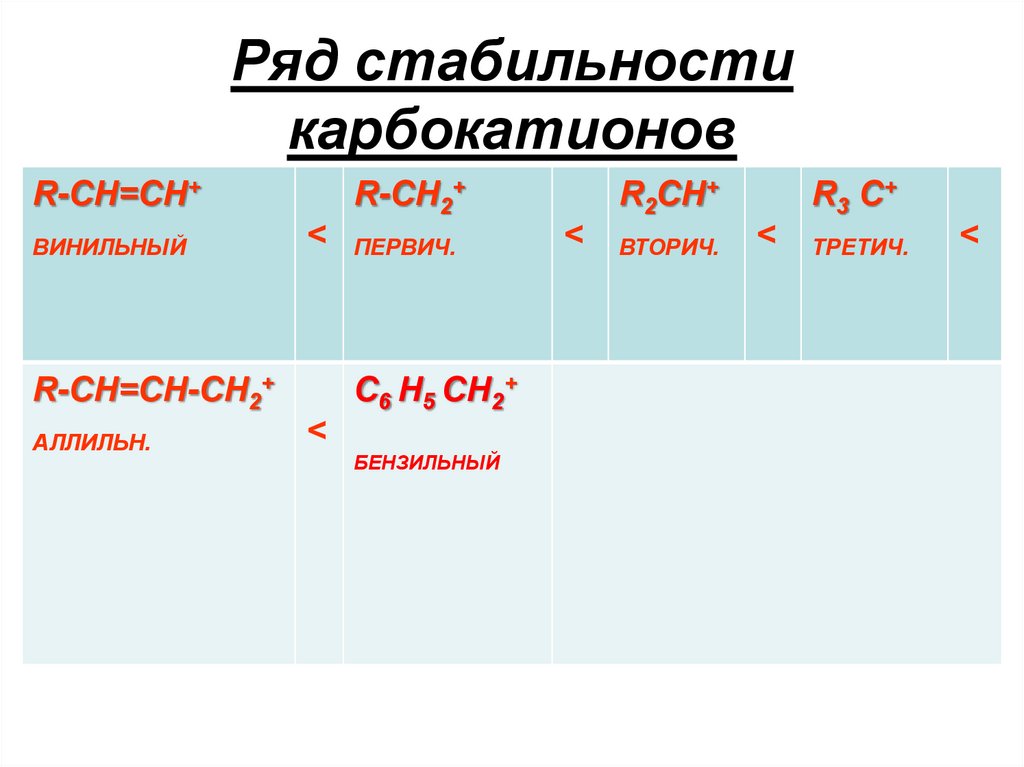
Ряд стабильностикарбокатионов
R-СН=СН+
ВИНИЛЬНЫЙ
<
ПЕРВИЧ.
С6 Н5 СН2+
R-СН=СН-СН2+
АЛЛИЛЬН.
R2СН+
R-СН2+
<
БЕНЗИЛЬНЫЙ
<
ВТОРИЧ.
R3 C+
<
ТРЕТИЧ.
<
55.
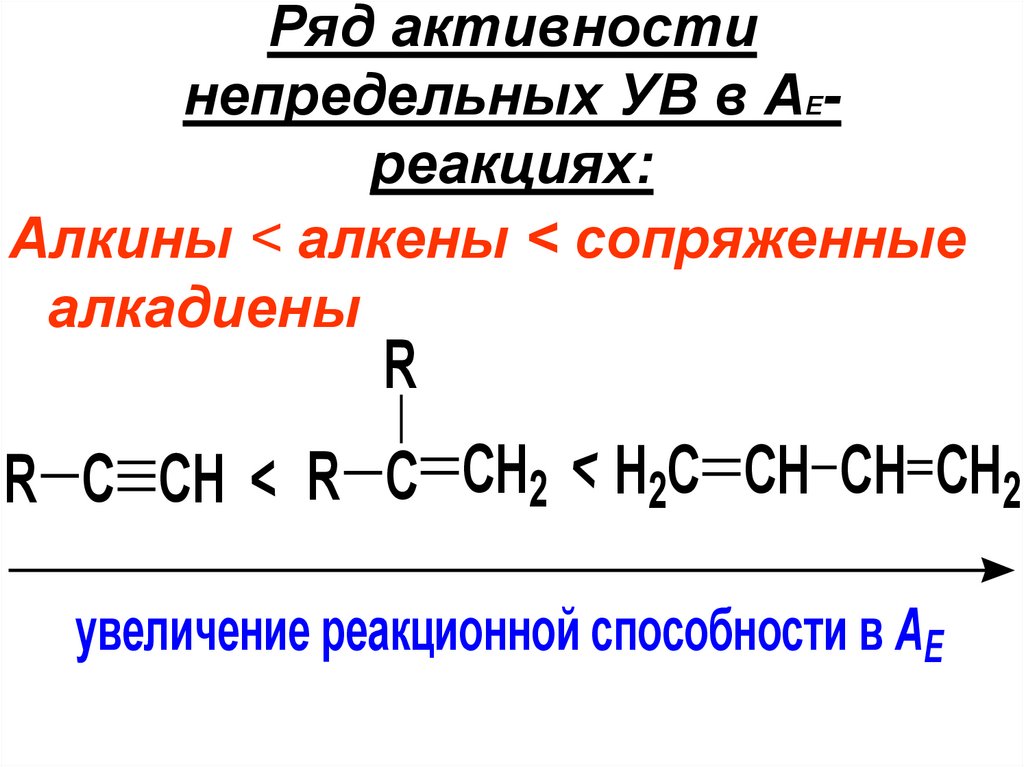
Ряд активностинепредельных УВ в АЕреакциях:
Алкины < алкены < сопряженные
алкадиены
R
R C CH2 H2C CH CH CH2
>
>
R C CH
увеличение реакционной способности в АЕ
56.
Направление присоединенияПравило Марковникова – протон (водород)
присоединяется к тому углеродному атому, у
которого уже имеется большее число атомов
водорода (более гидрогенизированному
атому С)
Такое направление преимущественного
присоединения определяется относительной
стабильностью образующихся в лимитирующей
стадии карбокатионов.
57.
Рассмотрим на примере гидрогалогениования (присоединения HBr кпропену)
CH3 CH CH2
H
медленно
Br
CH3CH
>
CH3-CH=CH2
H
первичный
Br
CH3 CH CH2
вторичный
CH2
H
H
58.
Современная трактовкаправила Марковникова:
Катионная частица реагента
присоединяется к более
гидрогенизированному С-атому
при двойной связи с
образованием более
стабильного интермедиата в
лимитирующей стадии.
59.
Весь механизм реакций АЕ60.
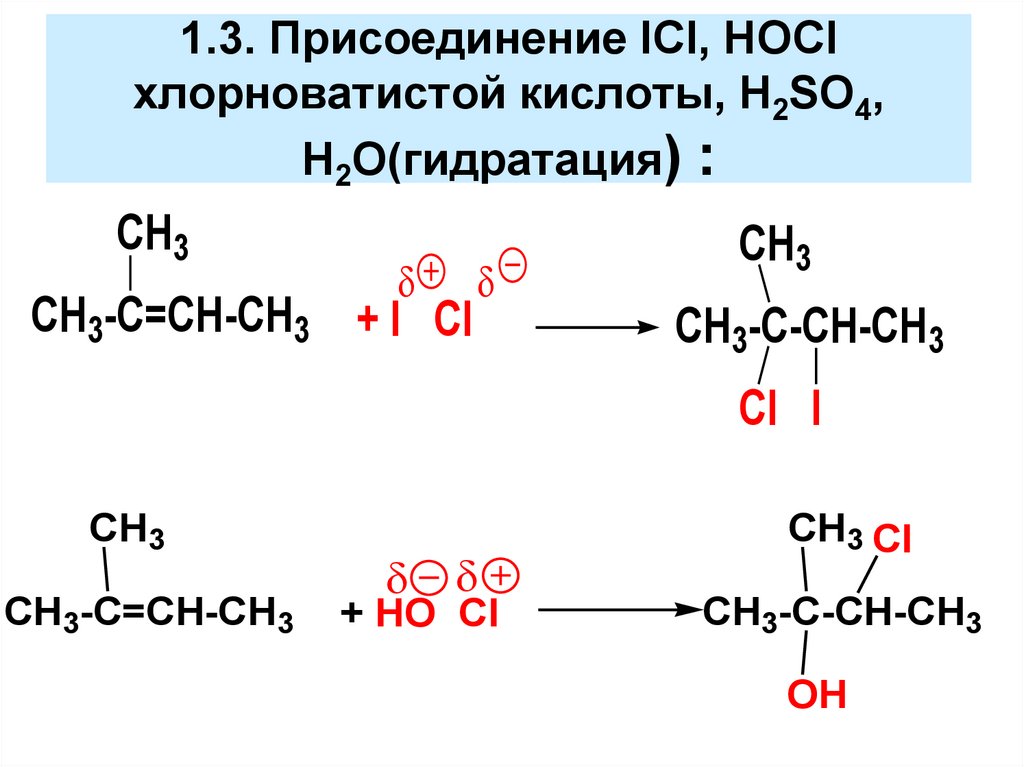
1.3. Присоединение ICl, HOClхлорноватистой кислоты, H2SO4,
H2O(гидратация) :
CH3
CH3-C=CH-CH3 + I Cl
CH3
CH3-C-CH-CH3
Cl I
CH3
CH3-C=CH-CH3
+ HO Cl
CH3 Cl
CH3-C-CH-CH3
OH
61.
CH3CH3-C=CH-CH3
CH3
+ H
OSO3H
холод
CH3-C-CH2-CH3
OSO3H
CH3
CH3-C=CH-CH3 + HOH
CH3
H2SO4
CH3-C-CH2-CH3
OH
62.
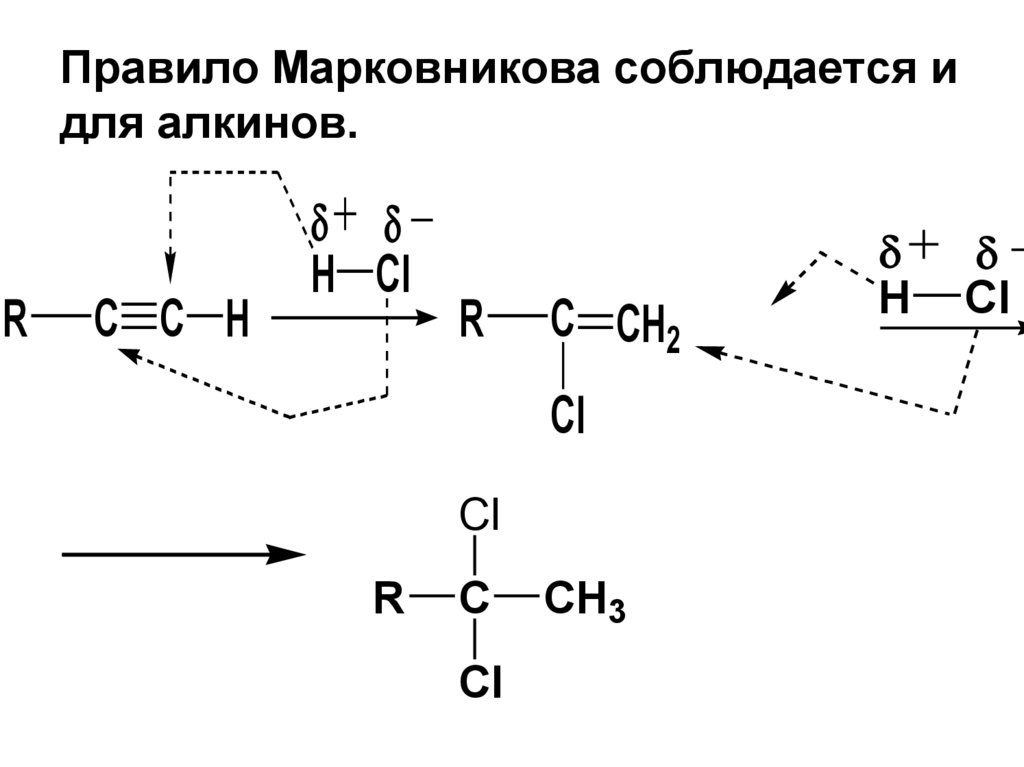
Правило Марковникова соблюдается идля алкинов.
R
C C H
H Cl
R
C CH2
Cl
Cl
R
C
Cl
CH3
H
Cl
63.
Присоединение электрофильныхреагентов к сопряженным алкадиенам
может протекать по двум
направлениям:
1) с образованием продукта 1,2присоединения;
2) с образованием продукта 1,4присоединения.
Соотношение этих продуктов зависит
от температуры проведения реакции.
64.
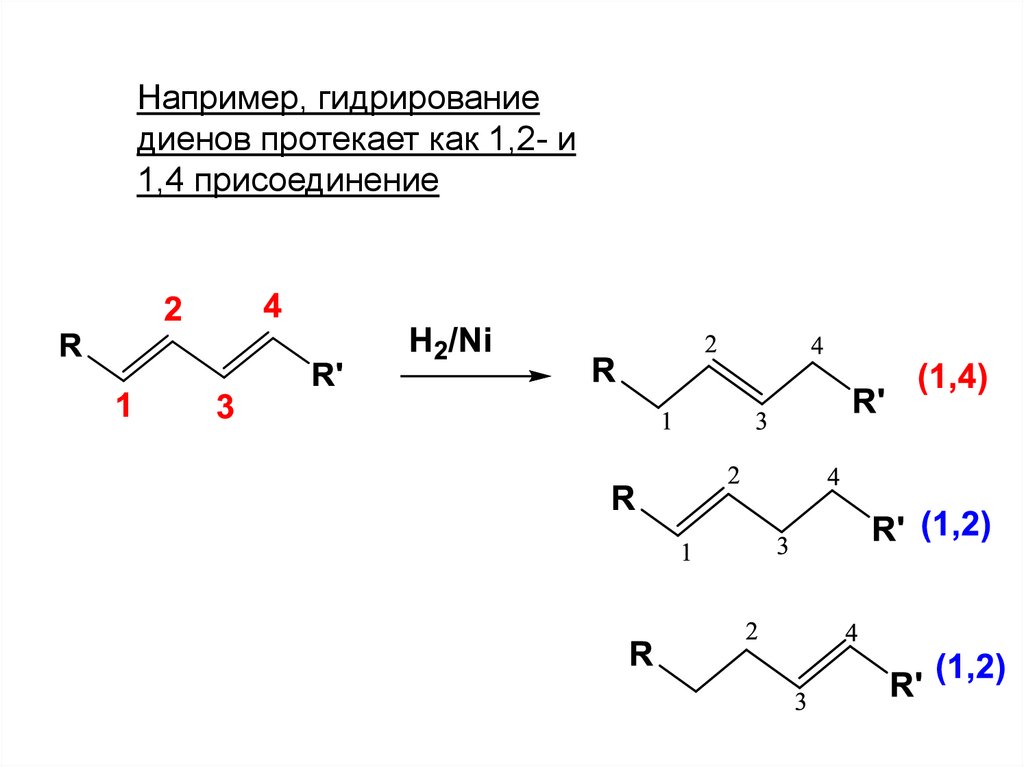
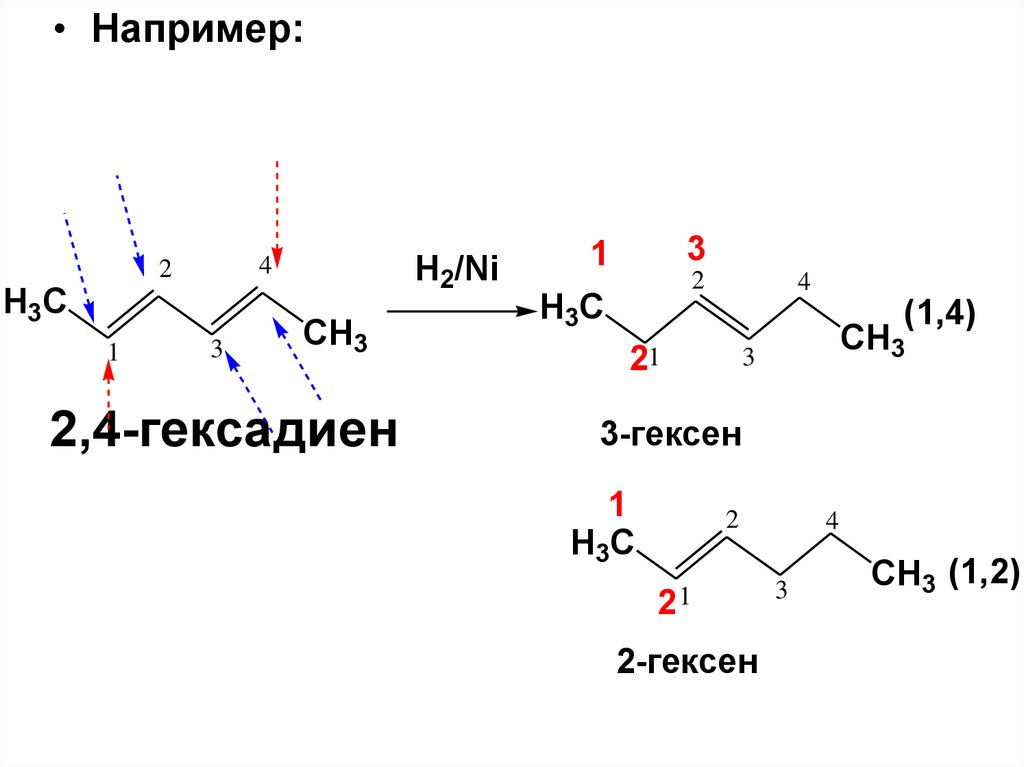
Например, гидрированиедиенов протекает как 1,2- и
1,4 присоединение
65.
• Например:H3C
1
H2/Ni
4
2
3
CH3
2,4-гексадиен
3
1
2
H3C
4
(1,4)
21
CH3
3
3-гексен
1
H3C
2
21
2-гексен
4
3
CH3 (1,2)
66.
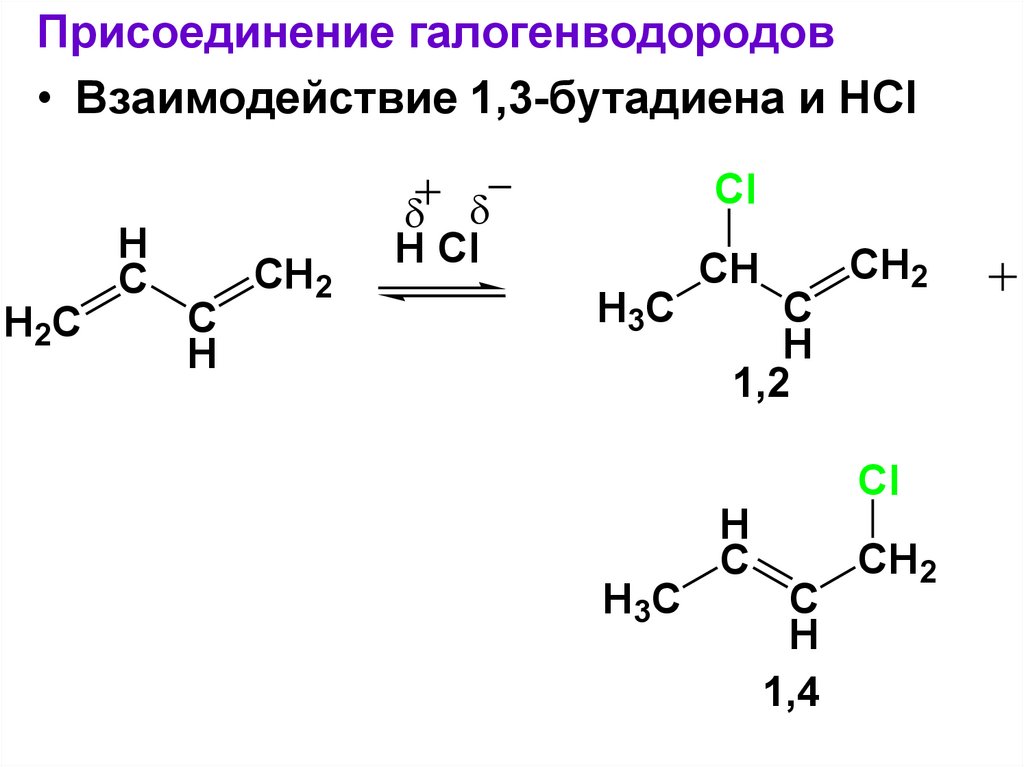
Присоединение галогенводородов• Взаимодействие 1,3-бутадиена и HCl
H
C
H2 C
C
H
CH2
Cl
H Cl
CH
H3C
C
H
1,2
CH2
Cl
H
C
H3C
C
H
1,4
CH2
67.
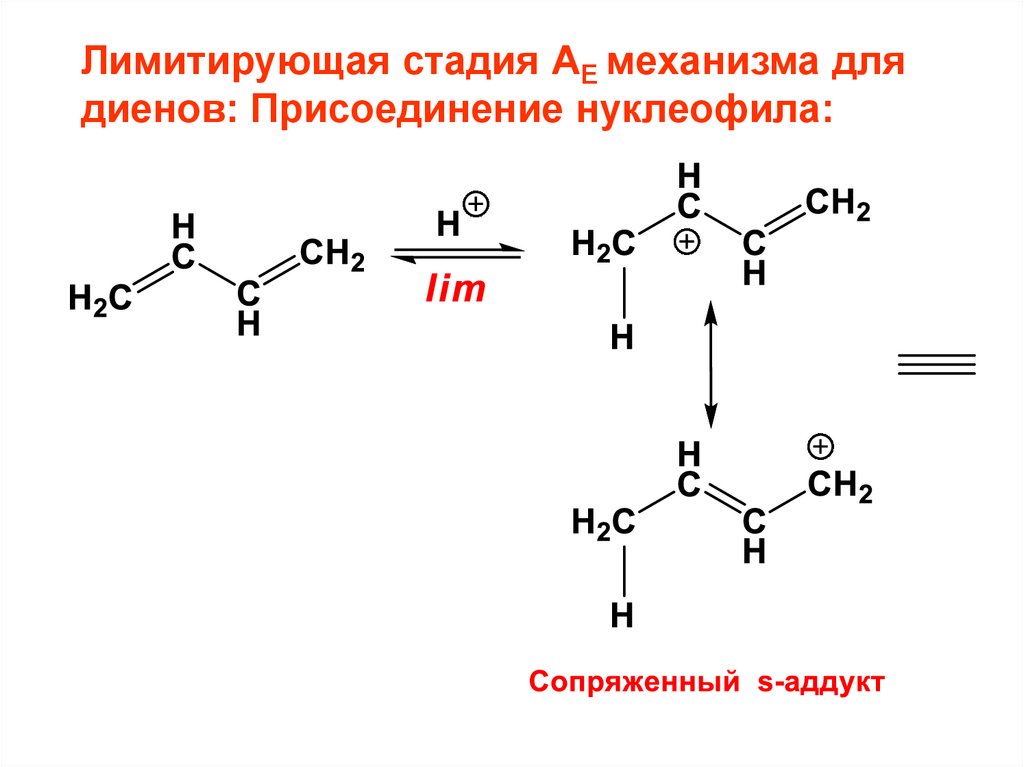
Лимитирующая стадия АЕ механизма длядиенов: Присоединение нуклеофила:
68.
Присоединение нуклеофила:Cl
CH
H2C C
H
H
C
H
Cl
H3C
CH2
C
H
1,2
CH2
Cl
H
C
H3C
C
H
1,4
CH2
69.
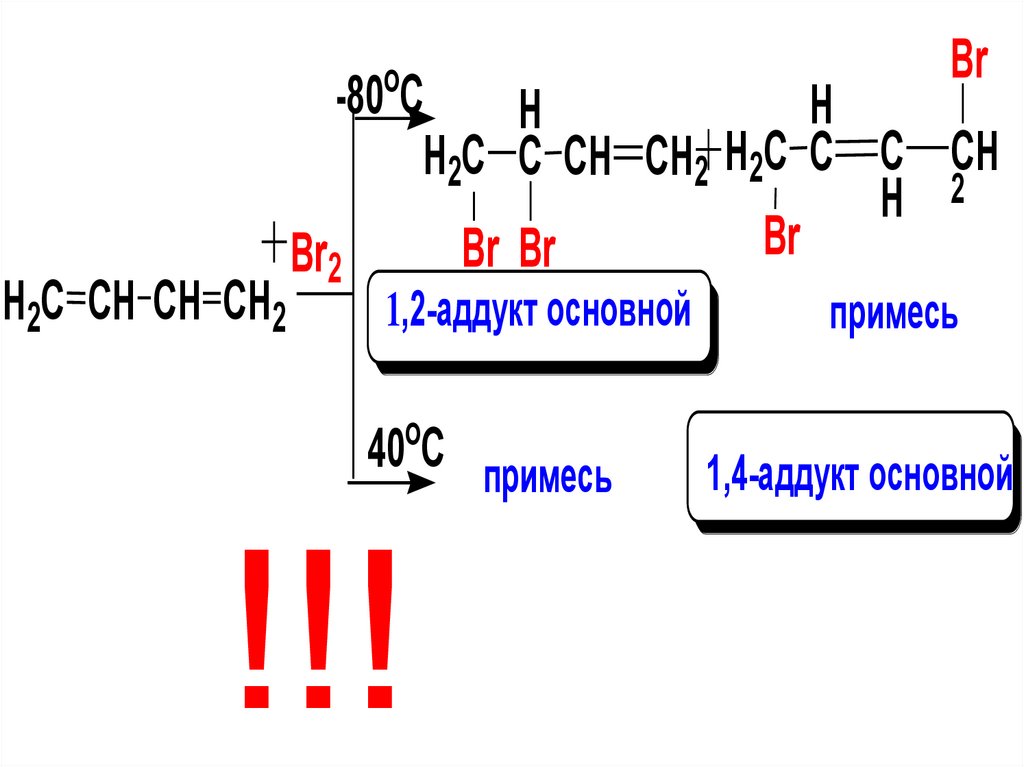
• При низкой Т (< 0oC) образуется тотпродукт, скорость образования которого
выше – продукт 1,2-присоединения. Он
называется кинетически
контролируемым.
• При высокой Т (> 0oC) образуется тот
продукт, который является
термодинамически более стабильным –
продукт 1,4 присоединения. Он
называется термодинамически
контролируемым.
70.
• Стереохимия АЕ-реакцийПрименительно к реакциям, которые
сопровождаются образованием
асимметрического атома С в
продукте, следует отметить, что
стереохимическим результатом в
таком случае является оптически
неактивная рацемическая смесь
(смесь обоих возможных
энантиомеров в отношении 1:1).
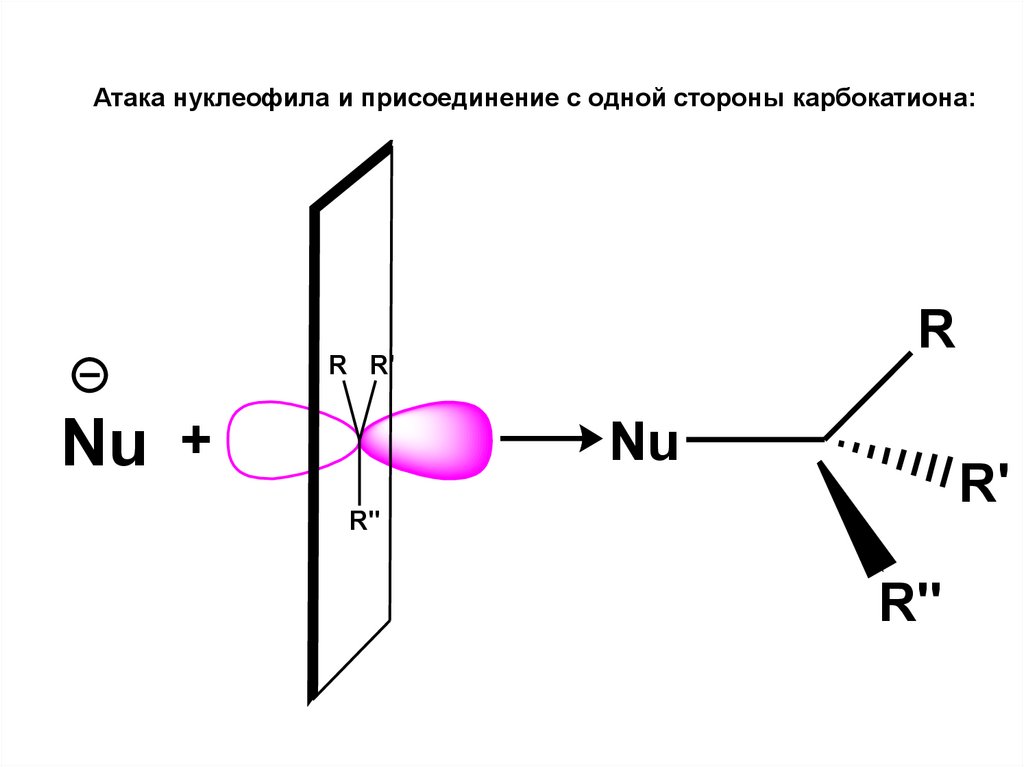
71.
• Такой результат объясняется тем,что в lim стадии данных реакций
образуется карбокатион – частица, в
которой C-атом, несущий «+» заряд
является sp2-гибридным.
• Как и в случае SR реакций, атака
нуклеофильной частицы на такой
катион происходит равновероятно с
обеих сторон плоскости в которой
находятся σ-связи карбокатиона.
72.
Атака нуклеофила и присоединение с одной стороны карбокатиона:R
R R'
Nu +
Nu
R'
R''
R''
73.
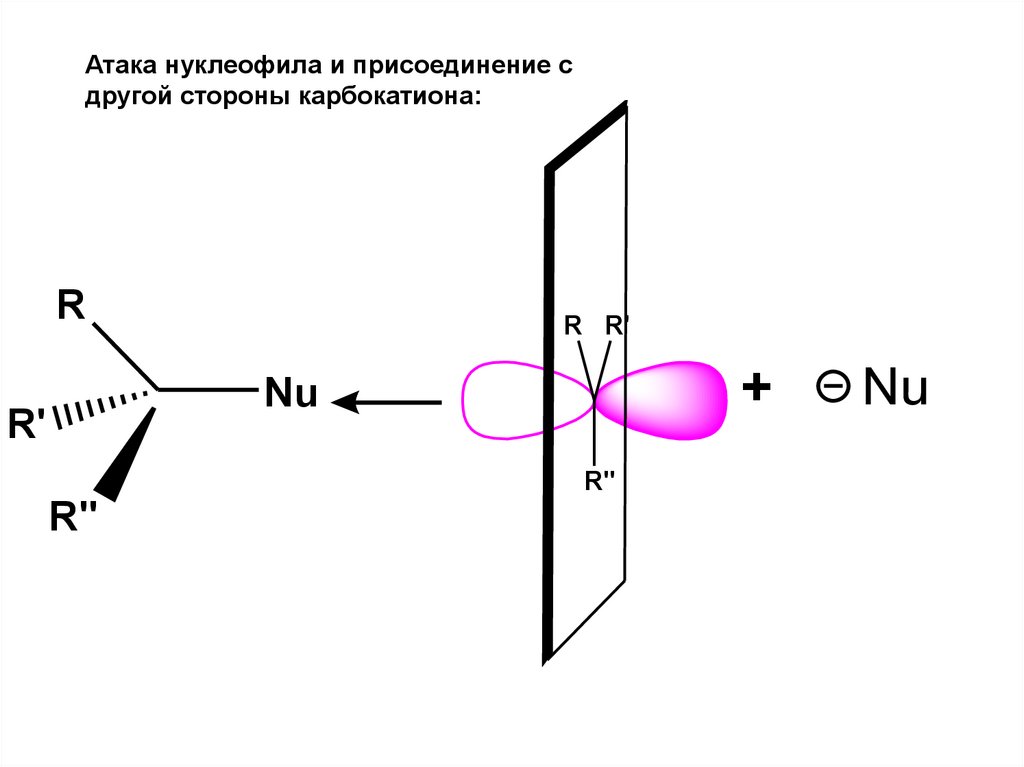
Атака нуклеофила и присоединение сдругой стороны карбокатиона:
R
R R'
+
Nu
R'
R''
R''
Nu
74.
Итог присоединения – рацемическая смесь:75.
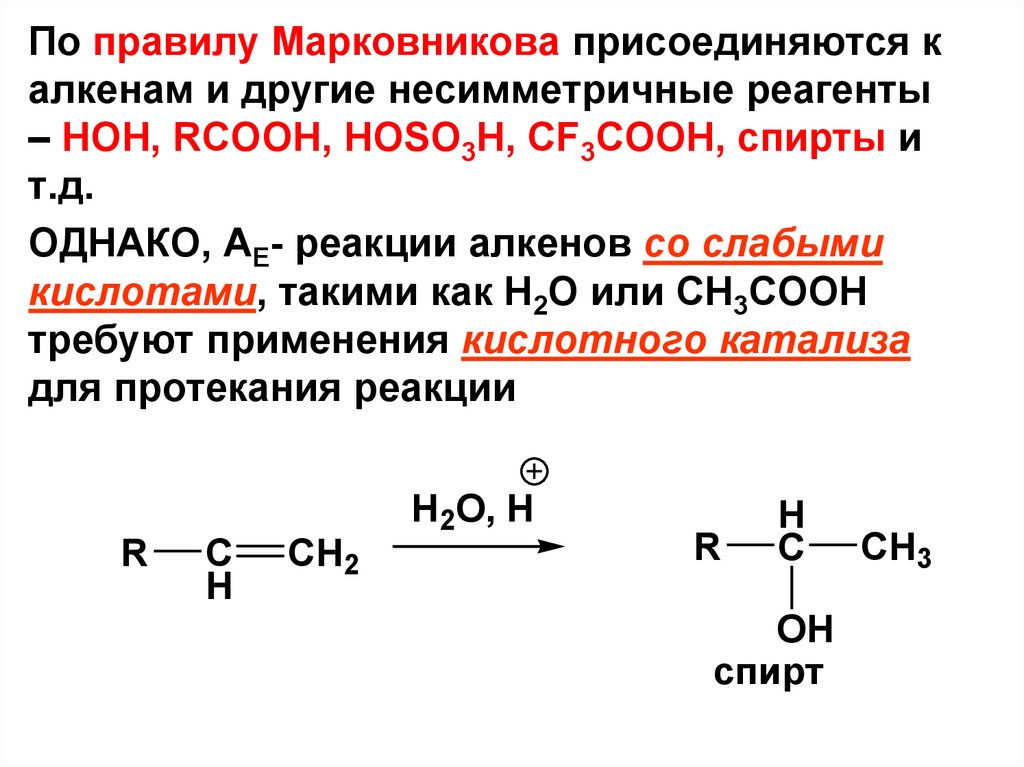
По правилу Марковникова присоединяются калкенам и другие несимметричные реагенты
– НОН, RCOOH, HOSO3H, CF3COOH, спирты и
т.д.
ОДНАКО, АE- реакции алкенов со слабыми
кислотами, такими как Н2О или CH3COOH
требуют применения кислотного катализа
для протекания реакции
H2O, H
R
C
H
CH2
R
H
C
OH
спирт
CH3
76.
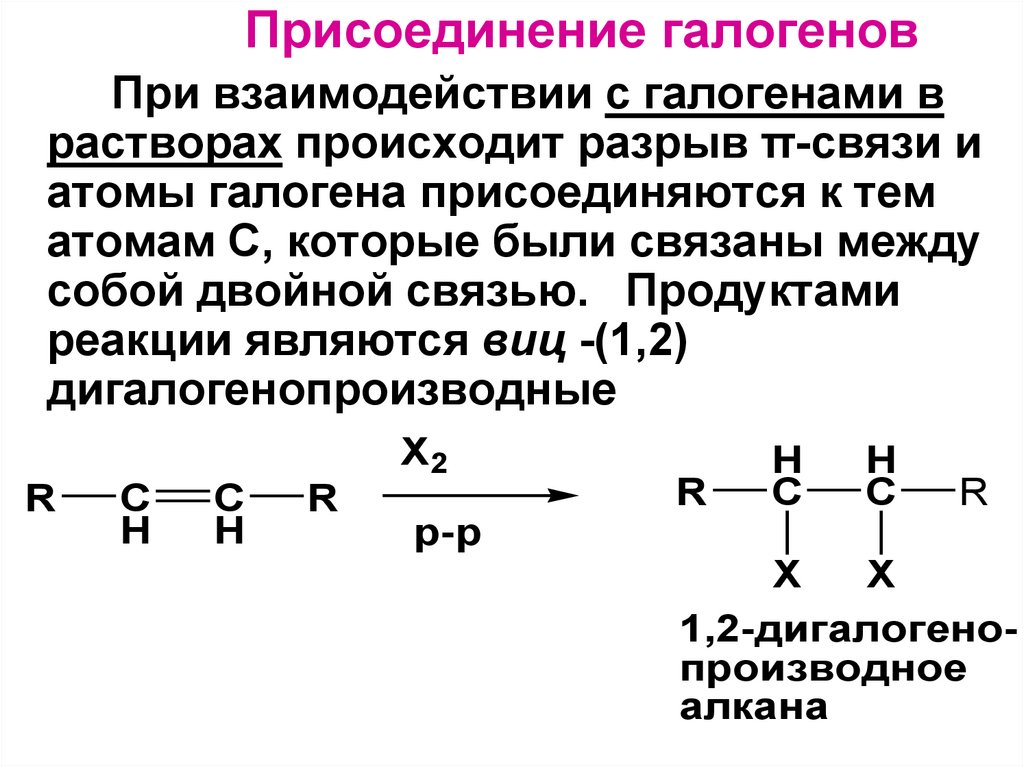
Присоединение галогеновПри взаимодействии с галогенами в
растворах происходит разрыв π-связи и
атомы галогена присоединяются к тем
атомам C, которые были связаны между
собой двойной связью. Продуктами
реакции являются виц -(1,2)
дигалогенопроизводные
X2
R
C
H
C
H
R
р-р
R
H
C
H
C
R
X
X
1,2-дигалогенопроизводное
алкана
77.
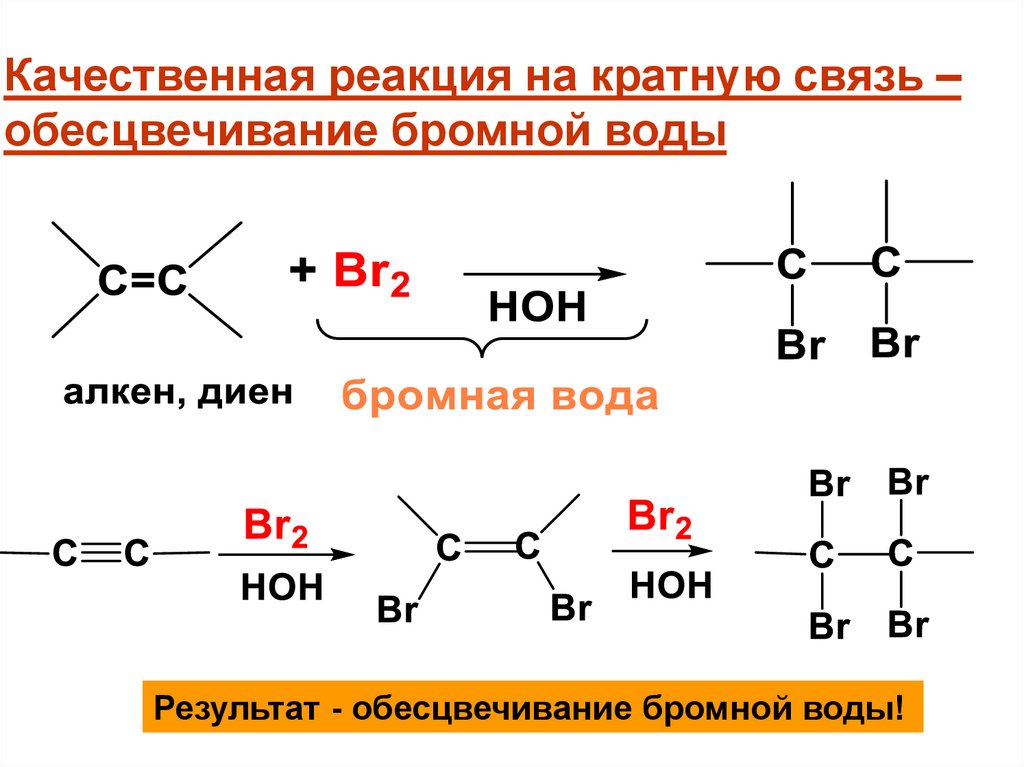
Качественная реакция на кратную связь –обесцвечивание бромной воды
Результат - обесцвечивание бромной воды!
78.
Bro
H2C CH CH CH2
-80 C
H
H
H2C C CH CH2 H2C C C CH
H 2
Br
Br Br
Br
2
1,2-аддукт основной
o
40 C примесь
!!!
примесь
1,4-аддукт основной
79.
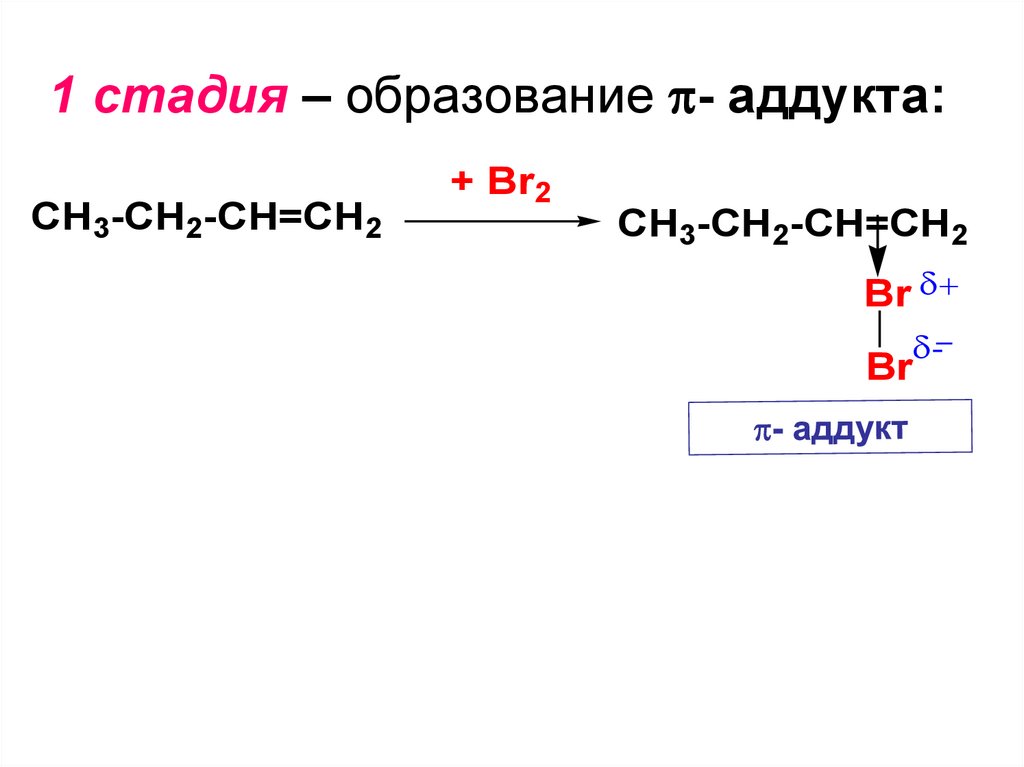
Механизм реакции(АЕ) :
Образование активного электрофила
Е (поляризация молекулы Br2 под
действием полярного растворителя
и электронов π-связи)
Br Br
Br
Br
80.
1 стадия – образование - аддукта:CH3-CH2-CH=CH2
+ Br2
CH3-CH2-CH=CH2
Br
Br
-
81.
2 стадия: образованиепромежуточного - комплекса:
медленно CH CH CH
CH3-CH2-CH=CH2
3
2
Br
вторичный
Br
CH3 CH2 CH
CH3
Br
бромоний-катион
CH2
Br
82.
3 стадия: присоединение бромиданиона к бромониевому катиону:
CH3 CH2 CH
CH2
Br
Br
быстро
Br
Реакция протекает как
анти-присоединение
Стереохимия - см. уч. С.149
CH3-CH2-CH-CH2
Br
83.
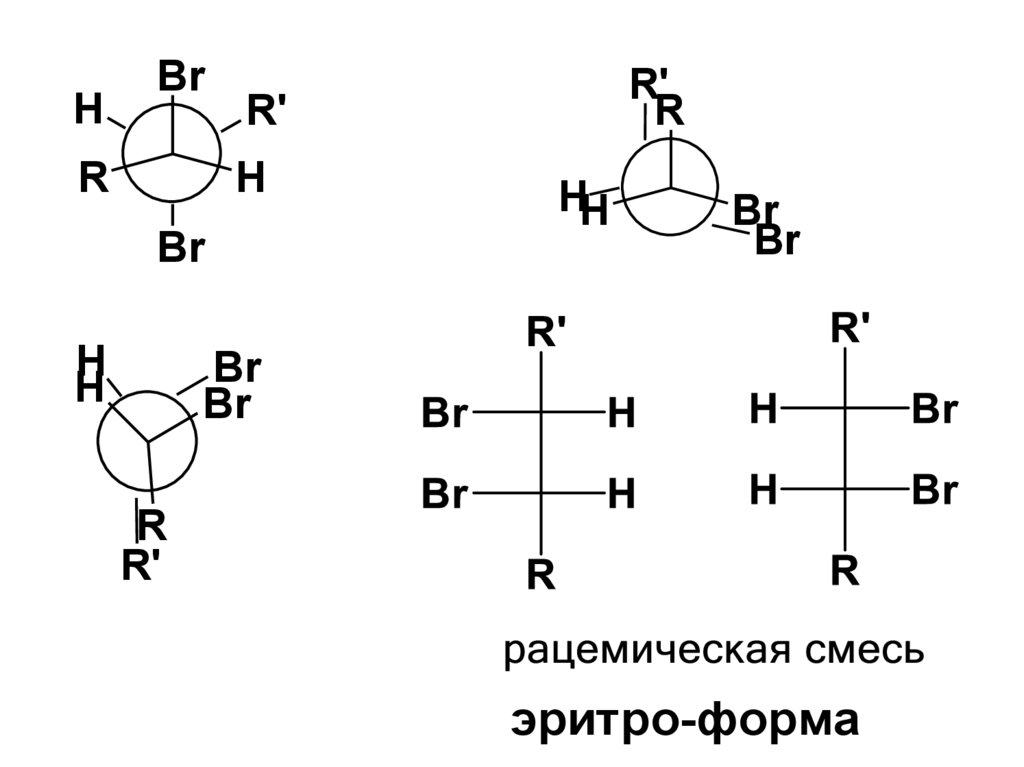
При присоединении брома к транс-алкенуобразуются энантиомеры эритро-ряда:
Br
R
H
R'
H
транс-алкен
Br2
H
Br
R
H
Br
Br
R'
84.
HBr
R
R'
H
Br
H
H
R'
R
HH
Br
Br
Br
Br
R
R'
эритро-форма
85.
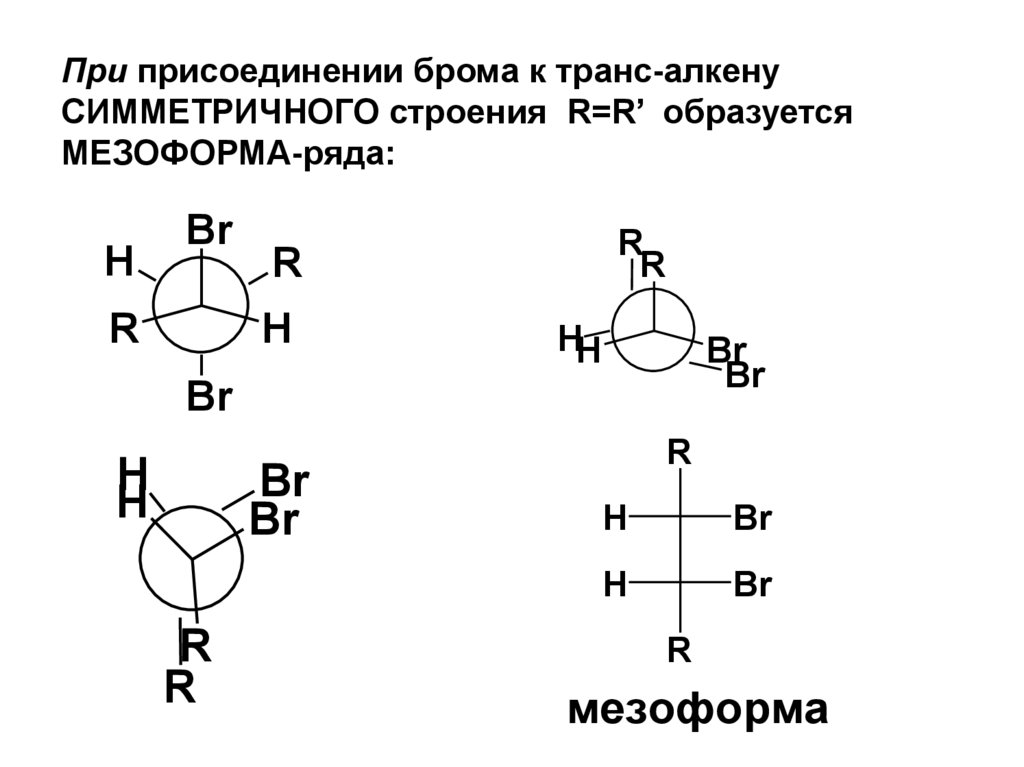
При присоединении брома к транс-алкенуСИММЕТРИЧНОГО строения R=R’ образуется
МЕЗОФОРМА-ряда:
H
Br
R
R
R
R
H
HH
Br
Br
Br
H
H
Br
Br
R
R
R
H
Br
H
Br
R
мезоформа
86.
HПри присоединении брома к цис-алкену
образуются энантиомеры трео-ряда:
Br
H
R'
R
цис-алкен
Br
Br2
H
Br
H
R'
R
Br
87.
HBr
H
R'
R
H
Br
Br
H
Br
R'
R
H
Br
Br
H
R
R'
трео-форма
88.
HR'
R'
H
+ Br2
H
R
цис-изомер
Br
R'
Br
H
H
Br
Br
H
R
R
рацемическая смесь
энантиомеров трео-ряда
89.
R'H
R'
+ Br2
R
H
транс-изомер
R'
H
Br
Br
H
H
Br
Br
H
R
R
рацемическая смесь
энантиомеров эритро-ряда
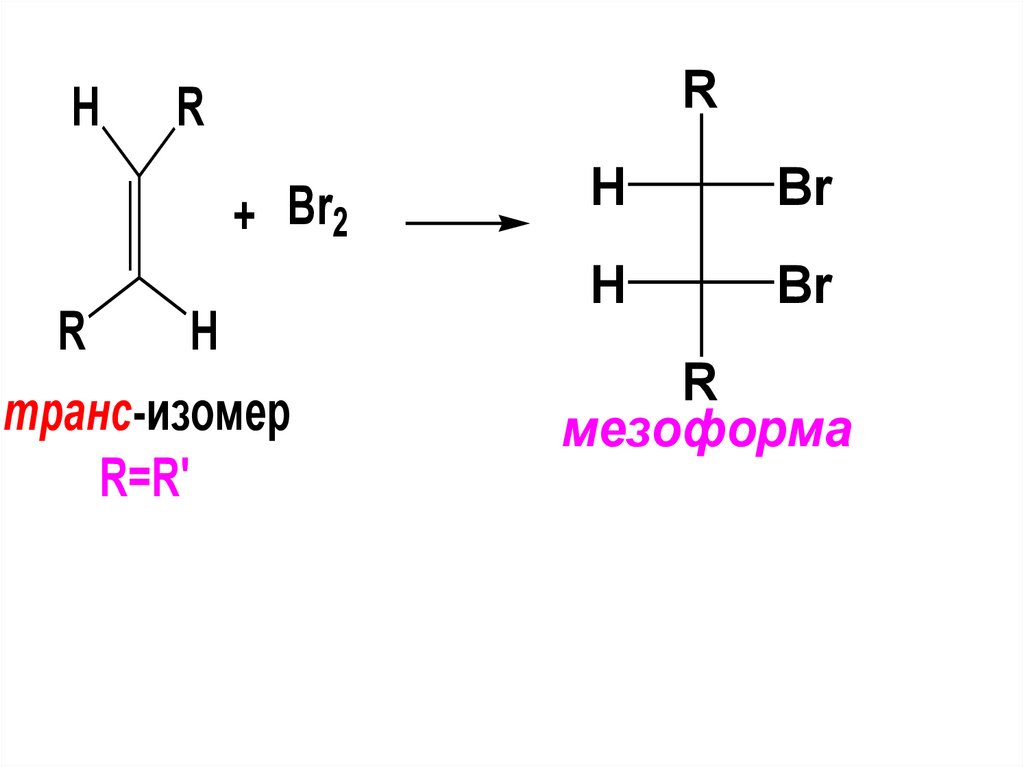
90.
HR
R
+ Br2
R
H
транс-изомер
R=R'
H
Br
H
Br
R
мезоформа
91.
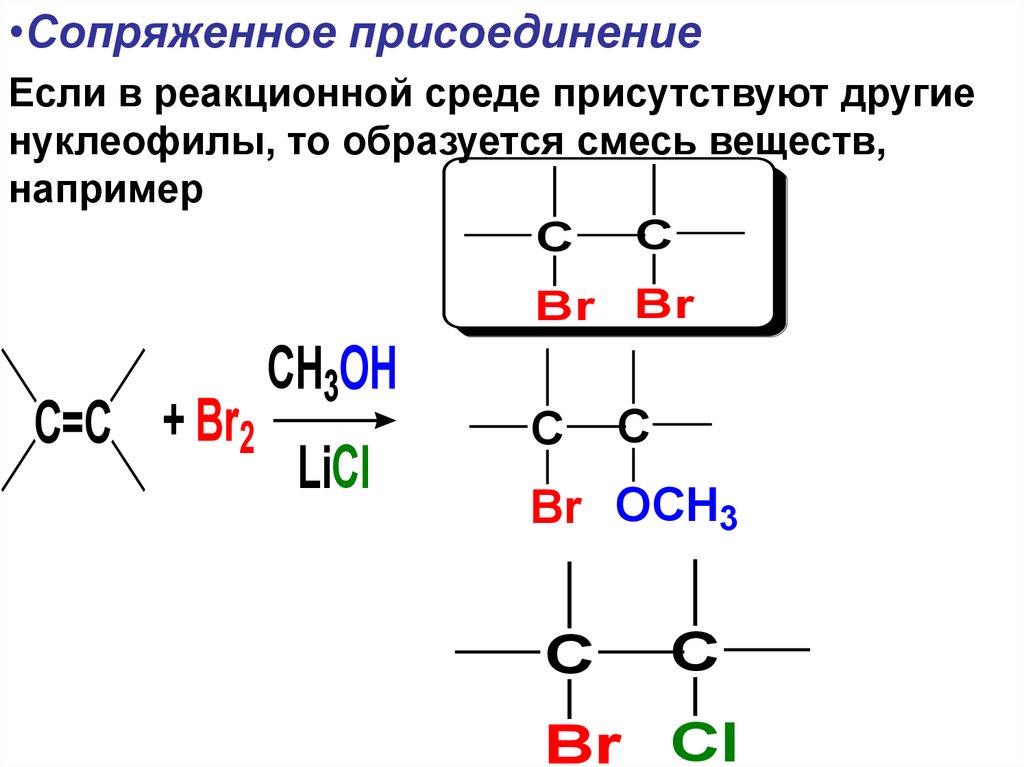
•Сопряженное присоединениеЕсли в реакционной среде присутствуют другие
нуклеофилы, то образуется смесь веществ,
например
C C
Br Br
C=C + Br2
CH3OH
LiCl
C
C
Br OCH3
C
C
Br Cl
92.
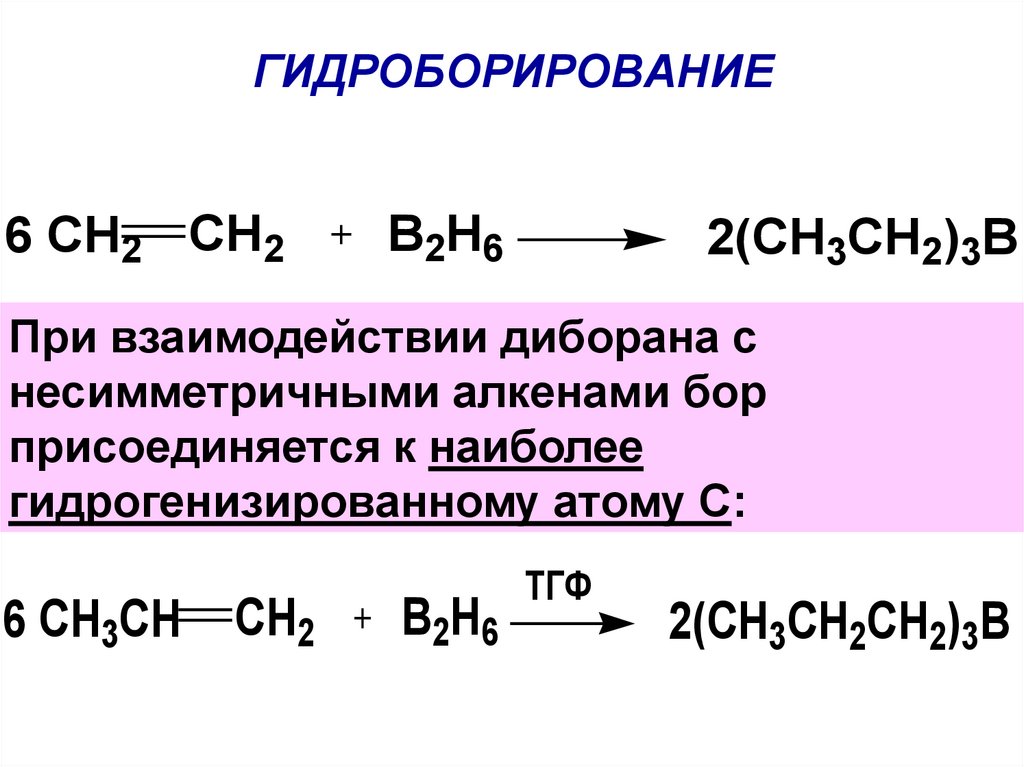
ГИДРОБОРИРОВАНИЕ6 CH2 CH2
B2H6
2(CH3CH2)3B
При взаимодействии диборана с
несимметричными алкенами бор
присоединяется к наиболее
гидрогенизированному атому C:
6 CH3CH
CH2
B2H6
ТГФ
2(CH3CH2CH2)3B
93.
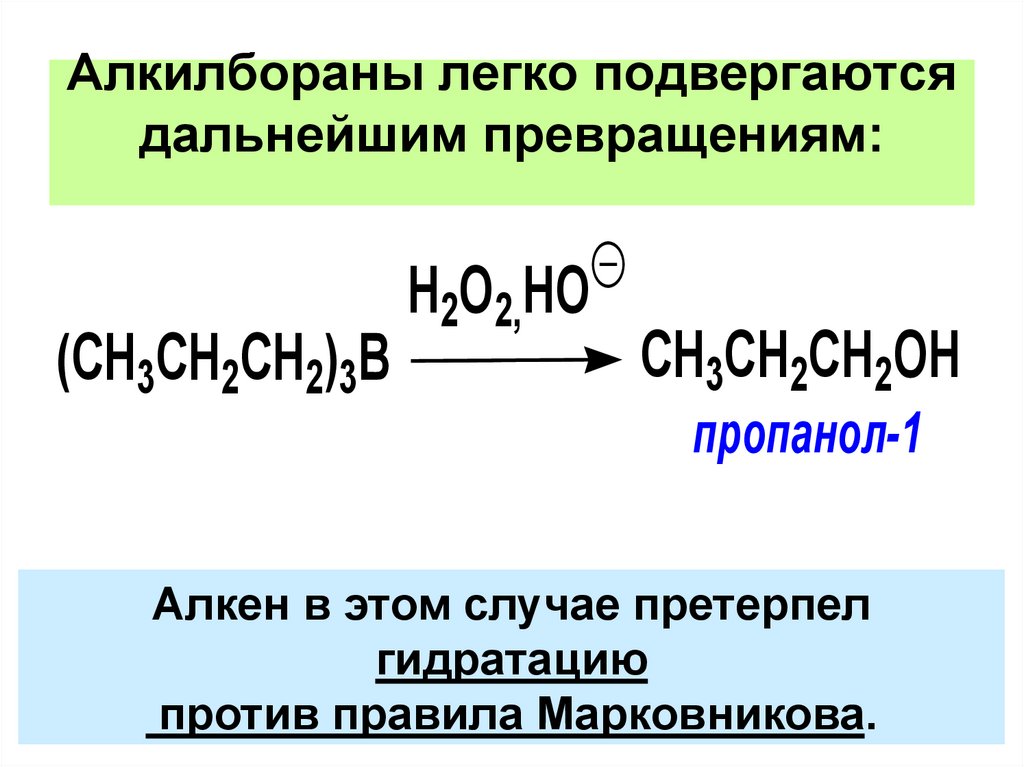
Aлкилбораны легко подвергаютсядальнейшим превращениям:
(CH3CH2CH2)3B
H2O2,HO
CH3CH2CH2OH
пропанол-1
Aлкен в этом случае претерпел
гидратацию
против правила Марковникова.
94.
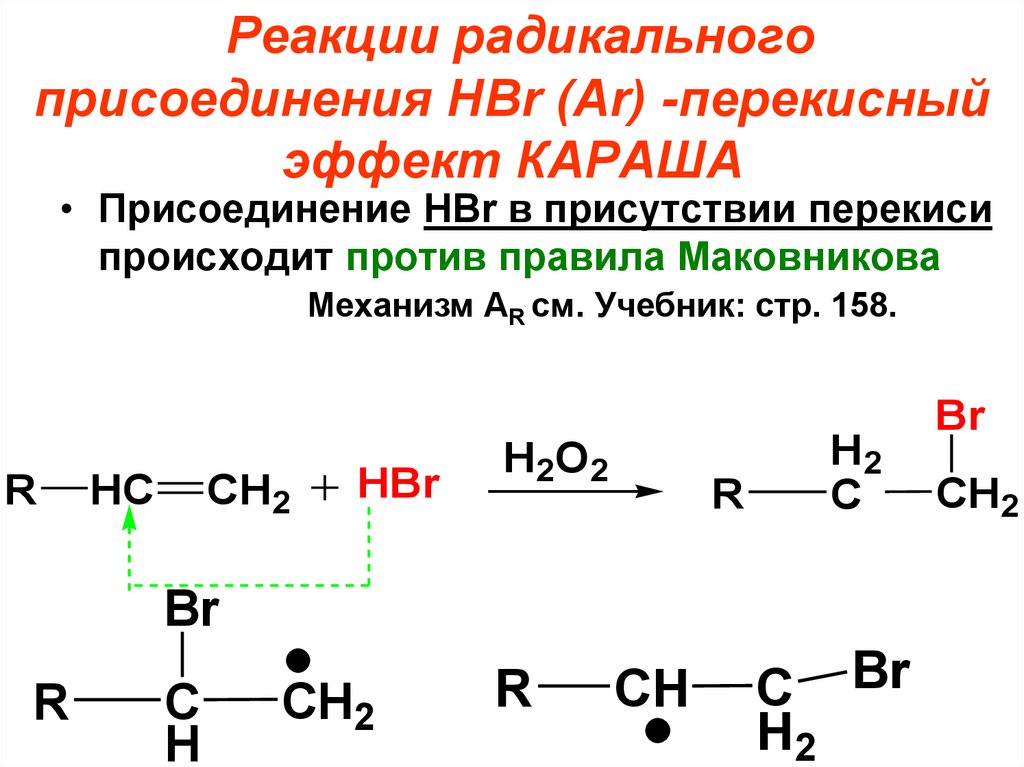
Реакции радикальногоприсоединения HBr (Аr) -перекисный
эффект КАРАША
• Присоединение HBr в присутствии перекиси
происходит против правила Маковникова
Механизм AR см. Учебник: стр. 158.
R
HC
CH2
HBr
H2O2
R
H2
C
Br
R
C
H
CH2
R
CH
C Br
H2
Br
CH2
95.
Реакции нуклеофильногоприсоединения (AN)
• Характерны для алкинов.
• Относятся реакции присоединения
таких нуклеофилов, как вода,
спирты, анионы карбоновых кислот,
цианистый водород.
• Реакции, как правило, протекают
только в присутствии катализаторов
– соли Сu(I) или Hg(II) и др.
96.
• а) Гидратация (реакция Кучерова)• Протекает в кислой среде в присутствии
катионов Hg2+.
• Из ацетилена в этой реакции образуется
уксусный альдегид
HC
CH
ацетилен
HgSO4, H
HOH
O
H3C
C
H
уксусный
альдегид
97.
• Все другие алкины кроме ацетилена вреакции Кучерова превращаются в
кетоны, т.к. присоединение воды
происходит в соответствии с правилом
Марковникоа (водород присоединяется к
более гидрогенизированному атому
углерода). Промежуточно образуются
ненасыщенные спирты (енолы), которые
перегруппировываются в кетоны по
схеме:
98.
HOHR C CH
алкин
HgSO4, H
R C CH2
OH
O
R C CH3
кетон
енол
99.
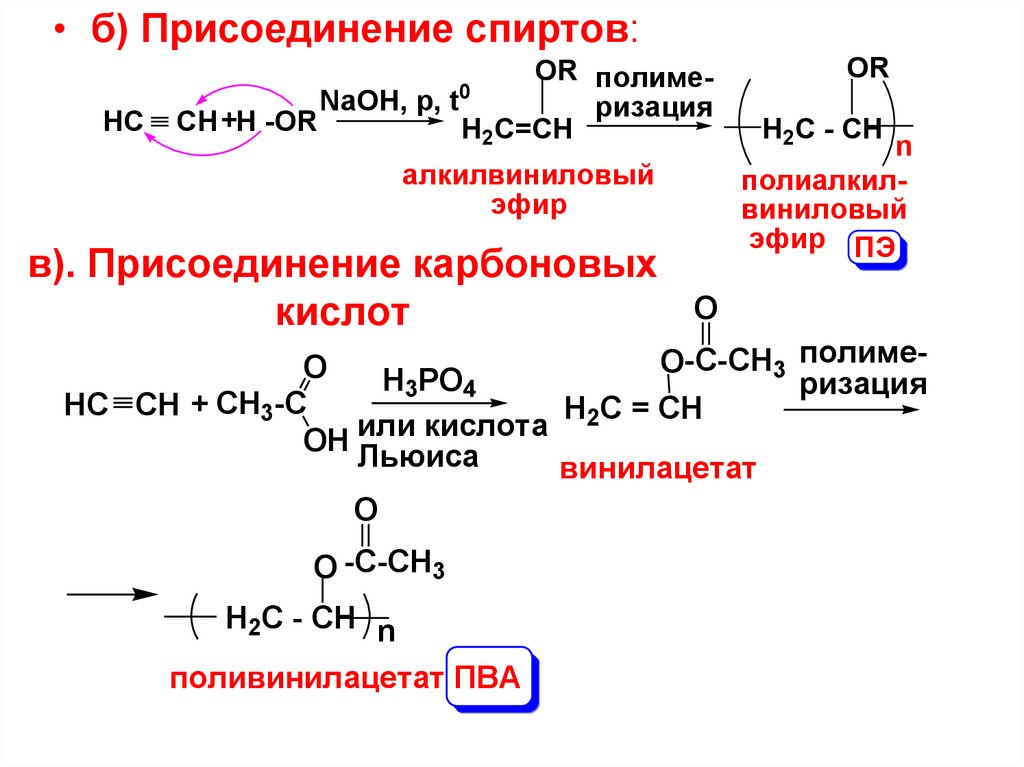
• б) Присоединение спиртов:HC
OR полиме0
NaOH, p, t
ризация
CH +H -OR
H2C=CH
алкилвиниловый
эфир
в). Присоединение карбоновых
кислот
OR
H2C - CH
n
полиалкилвиниловый
эфир ПЭ
O
O-C-CH3 полимеO
H3PO4
ризация
-C
CH
HC CH +
H2C = CH
3
кислота
или
OH
Льюиса
винилацетат
O
O -C-CH3
H2C - CH n
поливинилацетат ПВА
100.
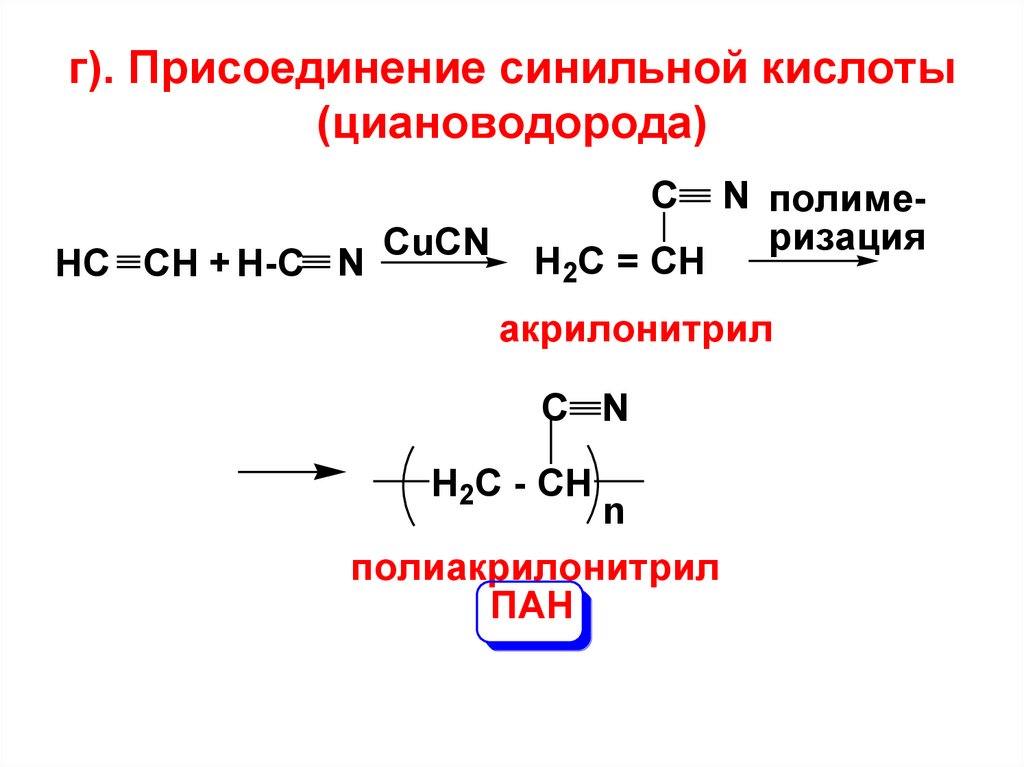
г). Присоединение синильной кислоты(циановодорода)
C
HC CH + H-C N
CuCN
H2C = CH
N полимеризация
акрилонитрил
C N
H2C - CH
n
полиакрилонитрил
ПАН
101.
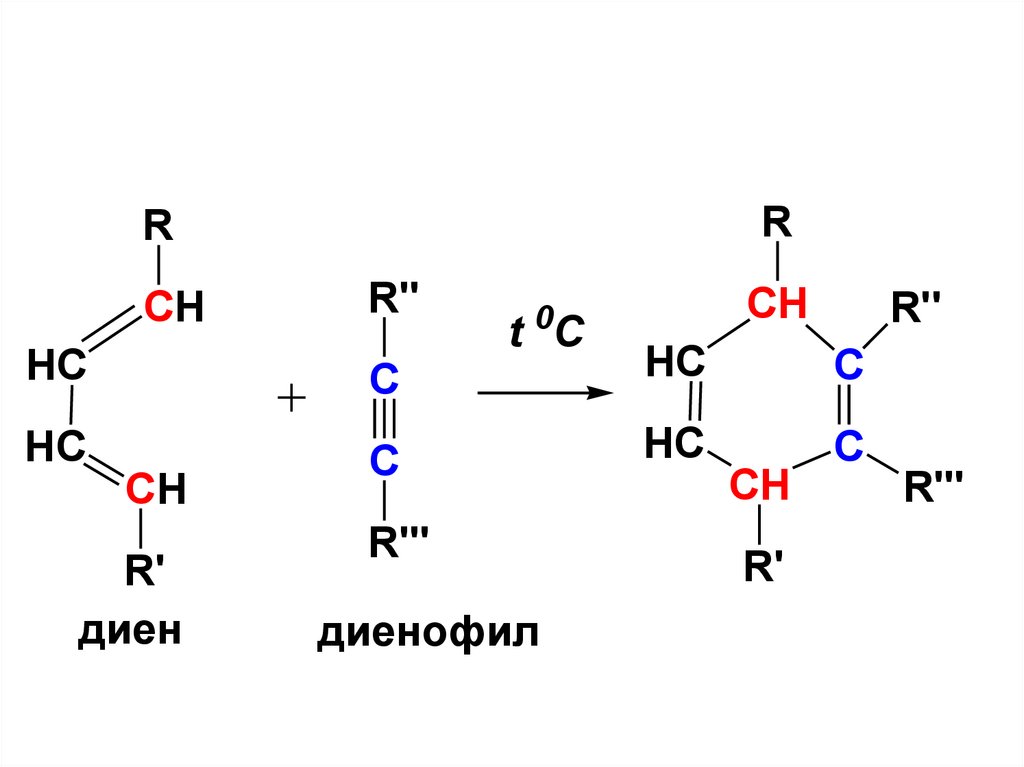
Циклоприсоединение. Реакция ДильсаАльдераРеакции циклоприсоединения протекают с
образованием продуктов циклического
строения без отщепления каких-либо
атомов и групп. К числу этих реакций
относится [4π+2π]-циклоприсоединения
(р-ция Дильса-Альдера).
toC
1,3-бутадиен
этилен
(диен)
(диенофил)
циклогексен
(аддукт)
102.
RR
CH
R''
CH
0
t C
R''
HC
C
HC
C
HC
C
HC
C
CH
R'
диен
R'''
диенофил
CH
R'
R'''
103.
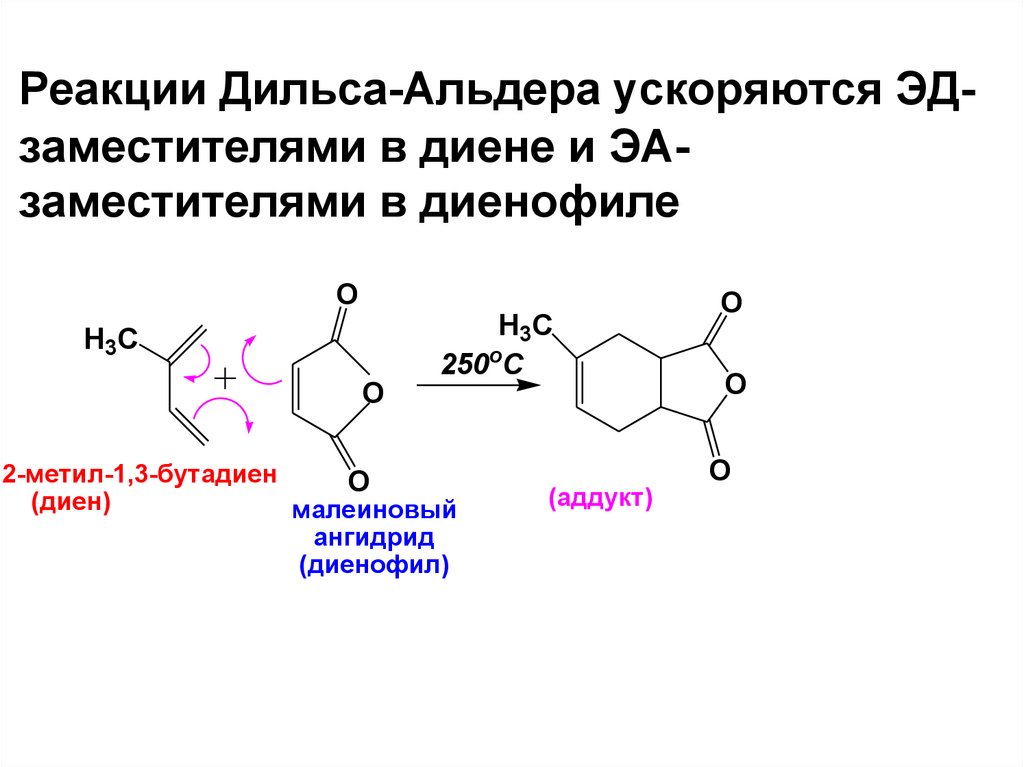
Реакции Дильса-Альдера ускоряются ЭДзаместителями в диене и ЭАзаместителями в диенофилеO
H3C
O
H3C
250oC
2-метил-1,3-бутадиен
O
(диен)
малеиновый
ангидрид
(диенофил)
(аддукт)
O
O
O
104.
Реакции алкенов в -положение кдвойной связи (аллильное
замещение)
Взаимодействие гомологов этилена с
галогенами (Cl2, Br2) при высоких
температурах ( выше 400о С) ведет к
замещению атома водорода в аллильном
положении на галоген и называется
аллильным замещением.
105.
аллильноеположение
o
CH3CH
Cl
CH2
CH2CH
Cl2
CH2
>400 C
HCl
аллилхлорид
Реакция идет как радикальный цепной процесс SR
106.
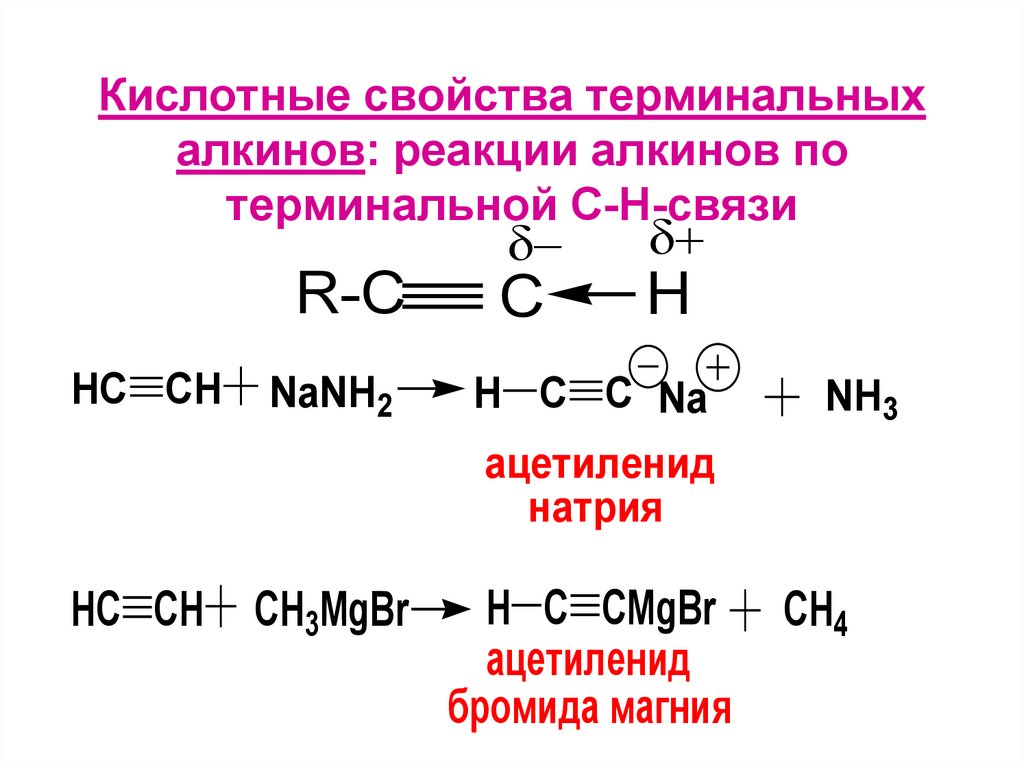
Кислотные свойства терминальныхалкинов: реакции алкинов по
терминальной С-Н-связи
R-C
C
H
HC CH
NaNH2
H C C Na
ацетиленид
натрия
HC CH
CH3MgBr
H C CMgBr
ацетиленид
бромида магния
NH3
CH4
107.
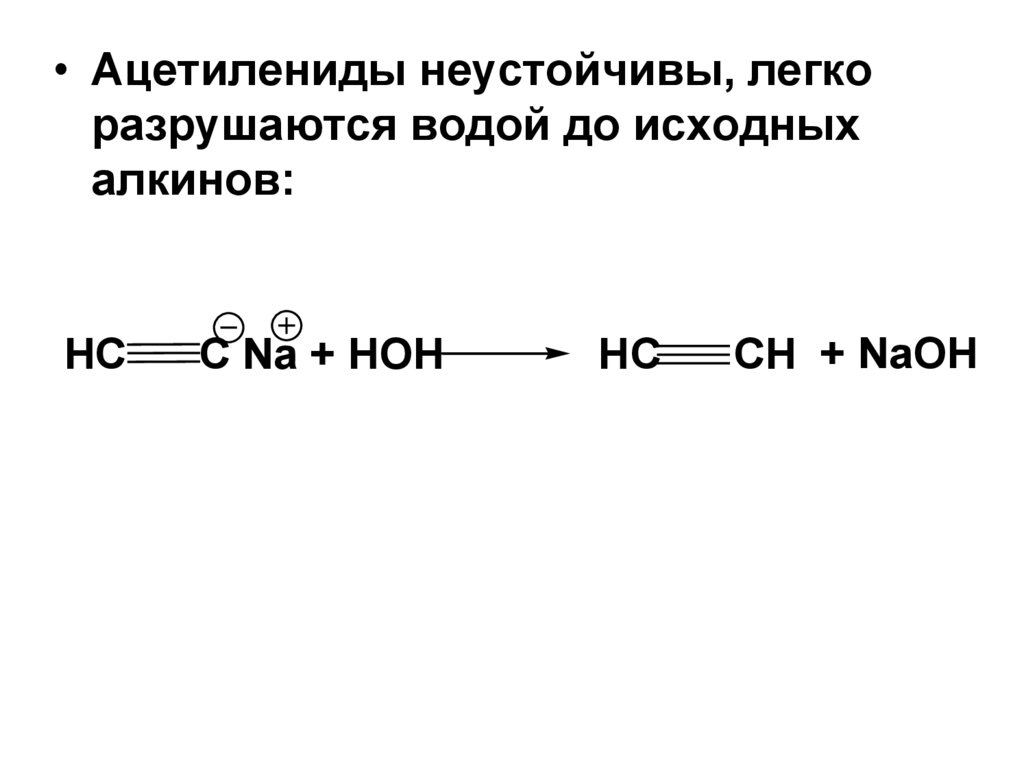
• Ацетилениды неустойчивы, легкоразрушаются водой до исходных
алкинов:
HC
C Na + HOH
HC
CH + NaOH
108.
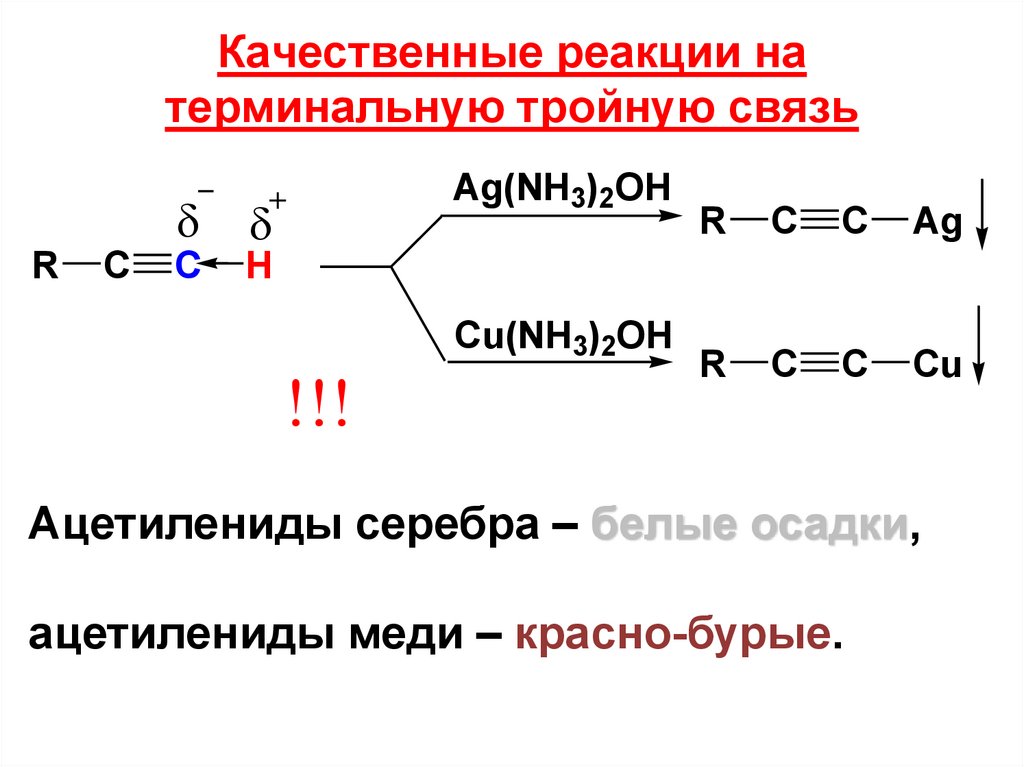
Качественные реакции натерминальную тройную связь
R
C
C
H
Ag(NH3)2OH
Cu(NH3)2OH
!!!
R
C
C
Ag
R
C
C
Cu
Ацетилениды серебра – белые осадки,
ацетилениды меди – красно-бурые.
109.
Ацетилениды металлов – сильныенуклеофильные реагенты. Их
используют для введения тройной
связи в молекулу галогеналкана,
в результате С-цепь удлиняется:
HC
C Na + R Br
R-C CH + NaBr
110.
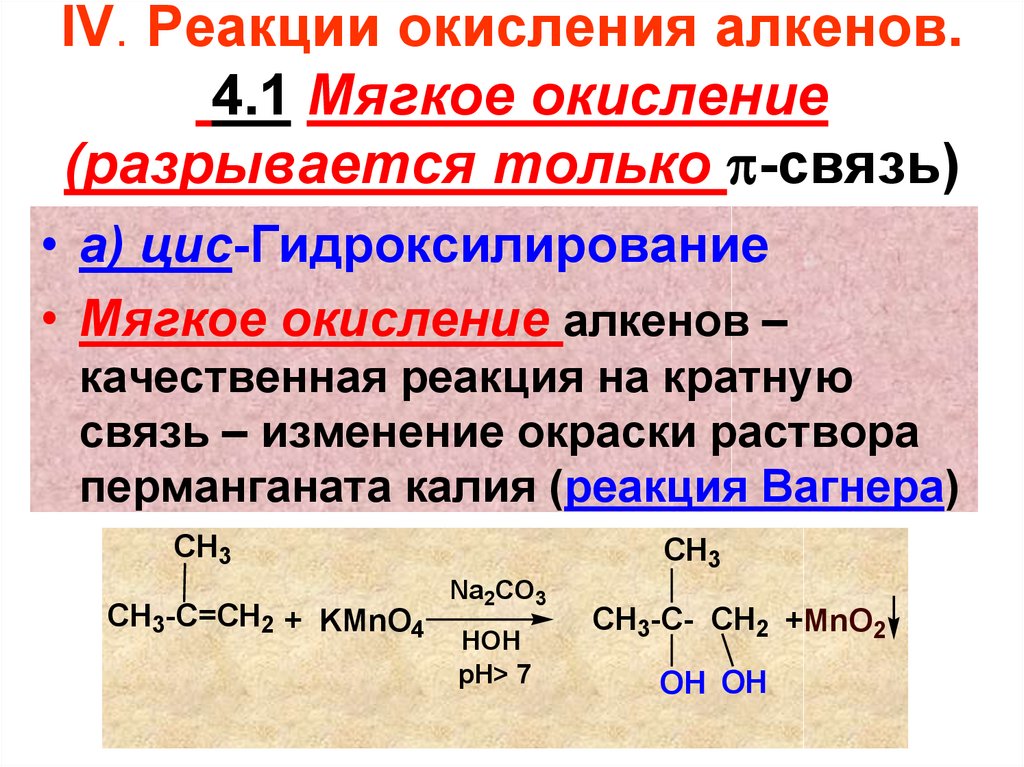
IV. Реакции окисления алкенов.4.1 Мягкое окисление
(разрывается только -связь)
• а) цис-Гидроксилирование
• Мягкое окисление алкенов –
качественная реакция на кратную
связь – изменение окраски раствора
перманганата калия (реакция Вагнера)
CH3
CH3-C=CH2 + KMnO4
CH3
Na2CO3
HOH
pH> 7
CH3-C- CH2 +MnO2
OH OH
111.
Реакция циклоприсоединенияO
R
C
H
C
H
R +
O
H
R C
O
Mn
O
OK
H
C
H2O
R
O
Mn
KO
R
H
C
H
C
OH OH
HO
R +
O
O
Mn
HO
цис-гидроксилирование
OK
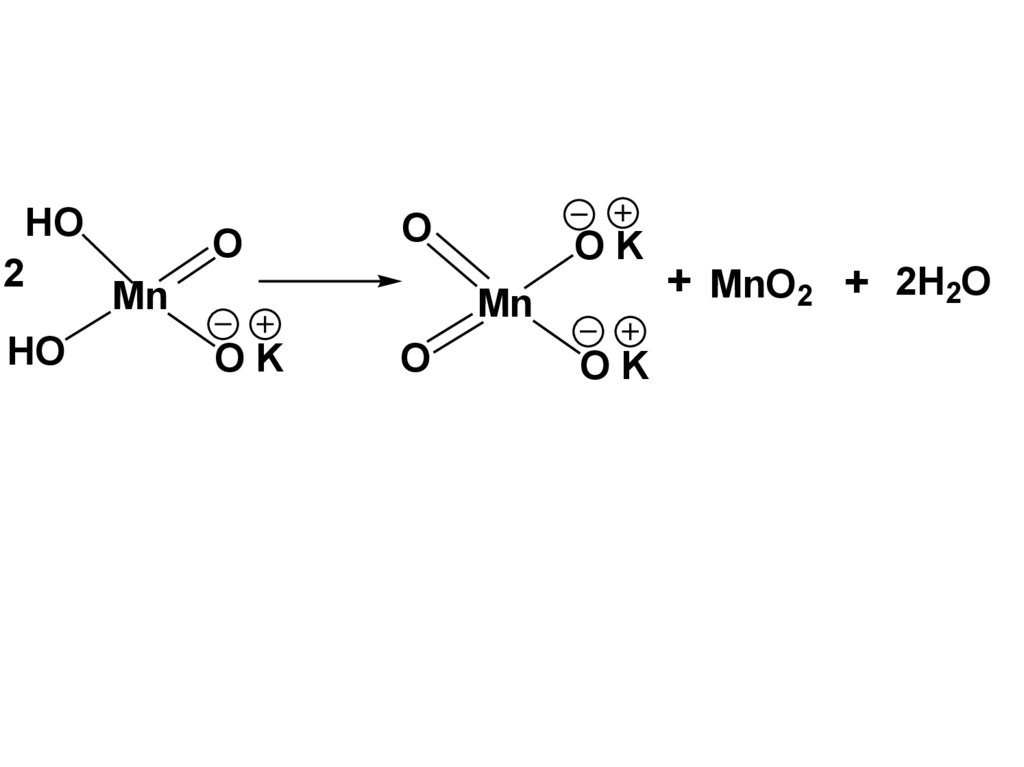
112.
HO2
HO
O
O
Mn
OK
Mn
OK
O
OK
+ MnO2 + 2H2O
113.
114.
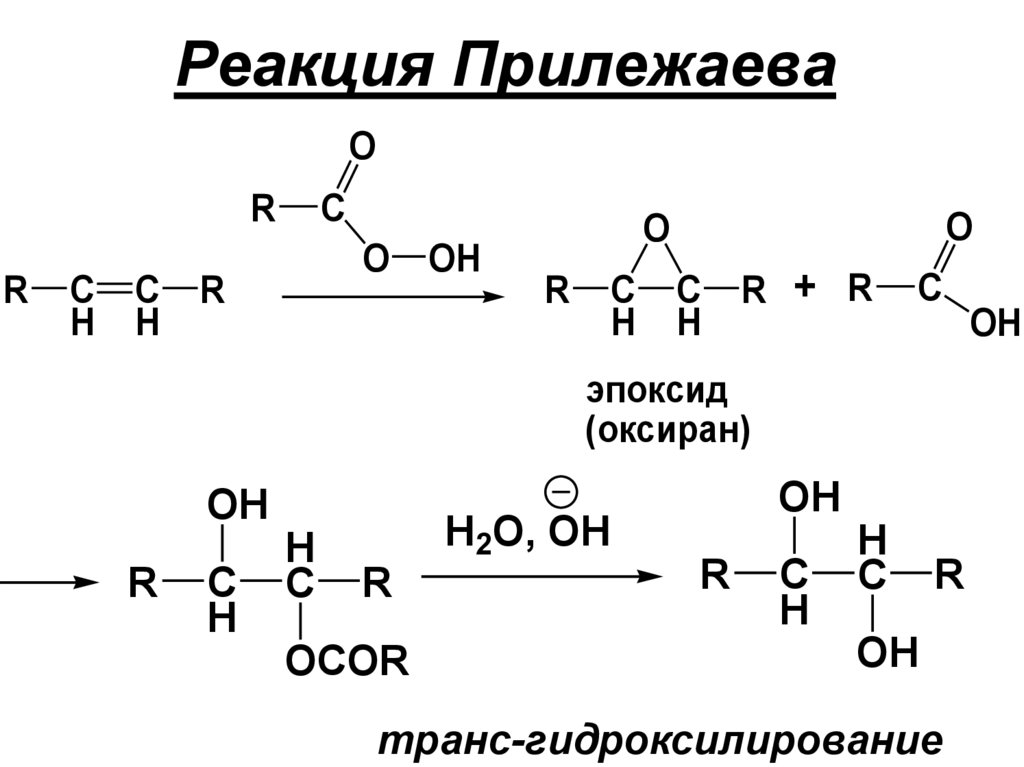
б) транс-Гидроксилирование – действиепероксида водорода, реакция
Прилежаева (см. ниже)
115.
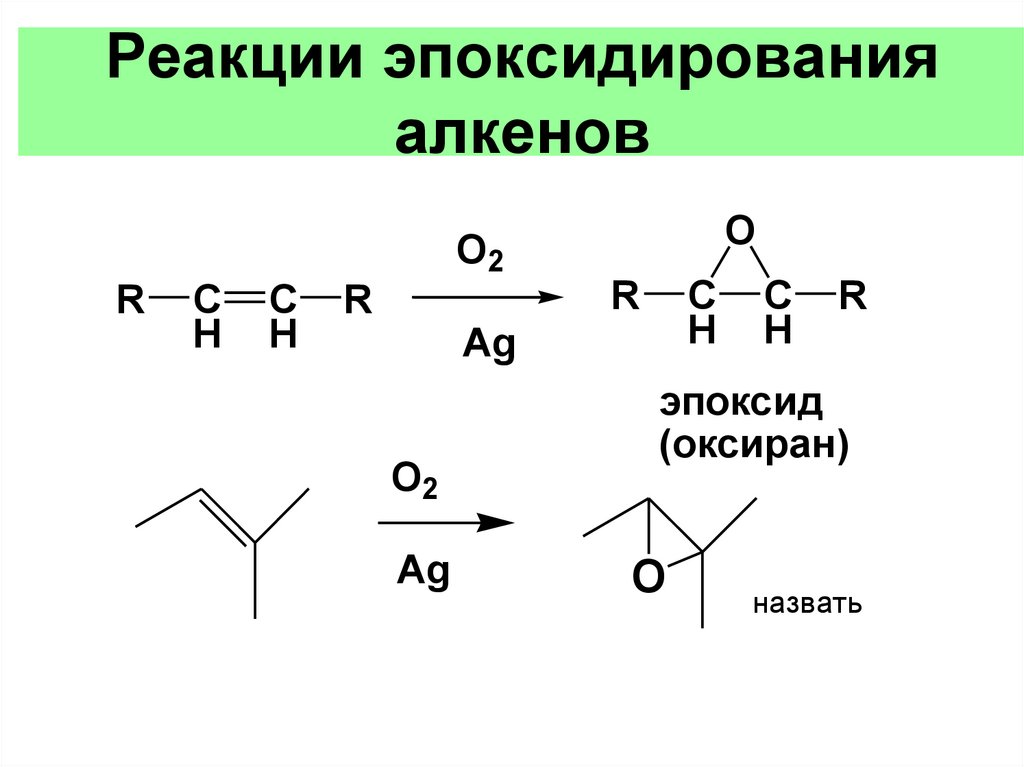
Реакции эпоксидированияалкенов
O
O2
R
C
H
C
H
R
R
C
H
Ag
O2
Ag
C
H
R
эпоксид
(оксиран)
O
назвать
116.
Реакция ПрилежаеваO
R
R
C
H
C
H
C
O
R
OH
O
O
R
C
H
C
H
R + R
C
эпоксид
(оксиран)
OH
R
C
H
H
C
H2O, OH
R
OCOR
OH
R
C
H
H
C
R
OH
транс-гидроксилирование
OH
117.
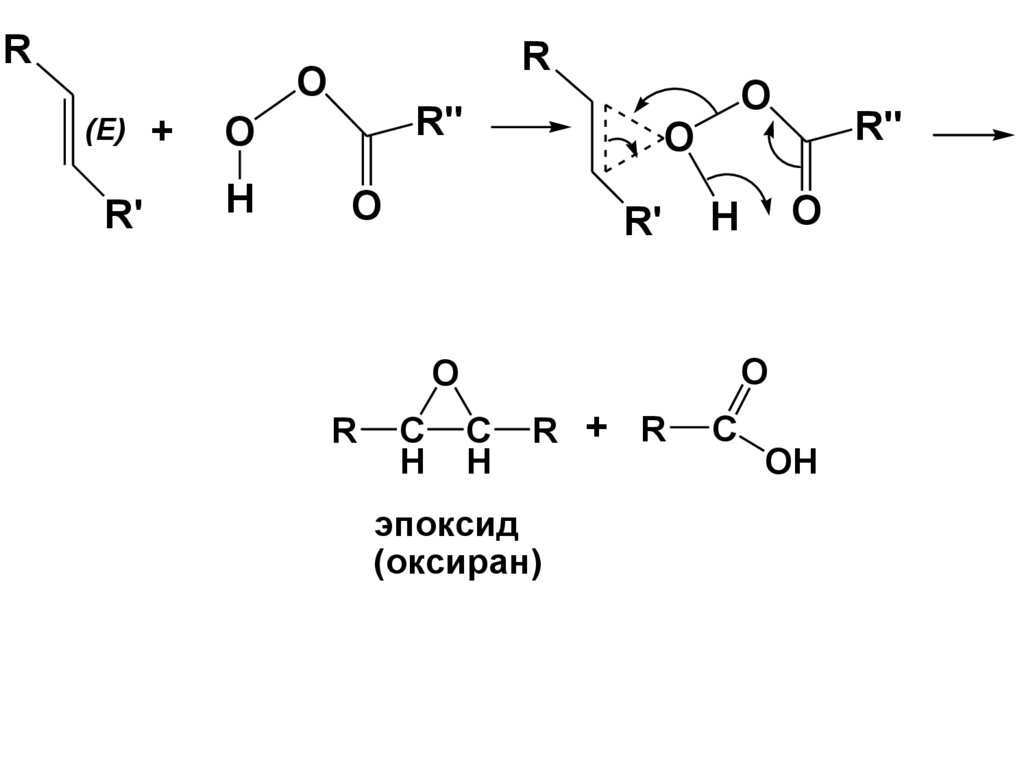
RR
O
(E)
R'
+
R''
O
H
O
O
R'
C
H
O
H
O
O
R
R''
O
C
H
R + R
эпоксид
(оксиран)
C
OH
118.
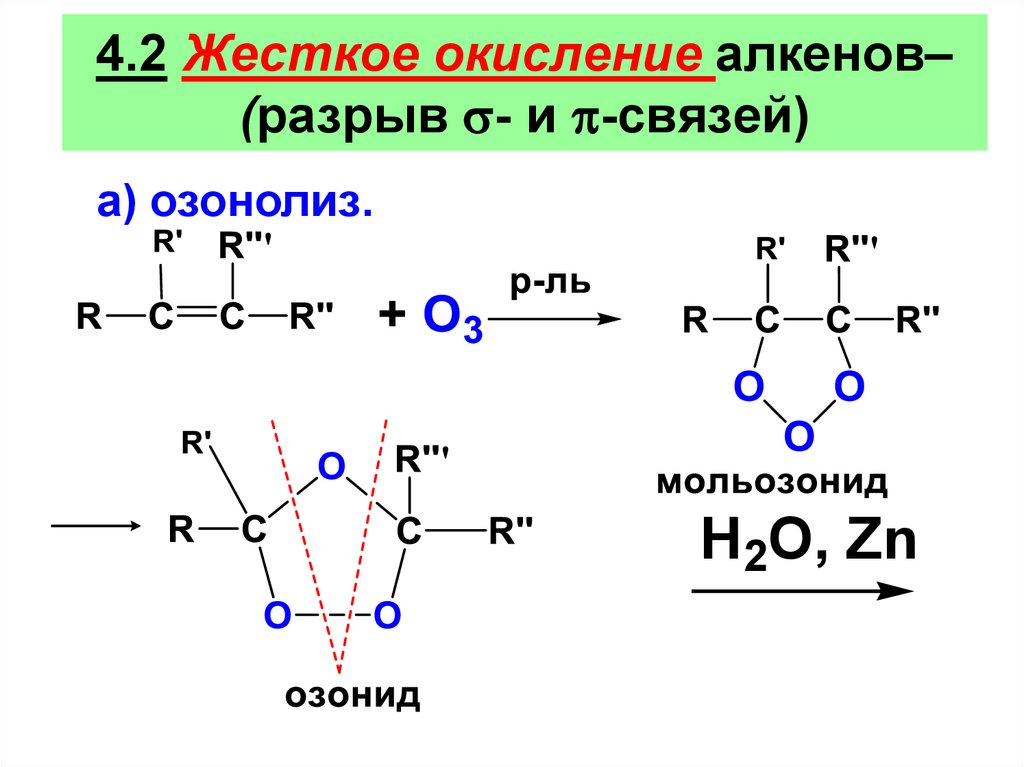
4.2 Жесткое окисление алкенов–(разрыв - и -связей)
a) озонолиз.
H2O, Zn
119.
• Озонид неустойчивое вещество, поэтому его невыделяют,
• а обрабатывают цинковой пылью (связывает
перекись водорода), затем водой.
120.
121.
б) Жесткое окисление алкеновKMnO4 в кислой среде (KMnO4/ H+)
Характер образующихся веществ зависит от
строения алкенов – это могут быть либо
карбоновые кислоты, либо кетоны или их
смеси, но НИКОГДА - АЛЬДЕГИДЫ
( См. Учебник. Стр. 163-167.)
CH3
CH3-C=CH-CH3 + KMnO4
O
O
CH3-C-CH3 + H3C
C
H2SO4
+MnO2
OН
122.
123.
4.3.алкенов
4.4Окисление
Окисление алкенов
в в
присутствии солей
присутствии
солейпалладия
палладия
Промышленное получение ацетальдегида :
CH2 CH2
O
PdCl2/H2O
1/2O2
CH
C
3
(CuCl2)
H
Окисление гомологов этилена идет по менее
гидрогенизированному атому углерода ( из
пропилена получается ацетон).
124.
V. Реакции полимеризации• Полимеризация – химический процесс, в
котором молекулы ненасыщенного
углеводорода присоединяются одна к другой
за счет развыва π-связей и образования
новых σ-связей.
n CH2 CH2
Kt
CH2 CH2
n
Полимер, получаемый из одинаковых молекул
называют гомополимером, из различных
молекул
– гетерополимером или сополимером.
( См. Учебник. стр. 172-177.)
125.
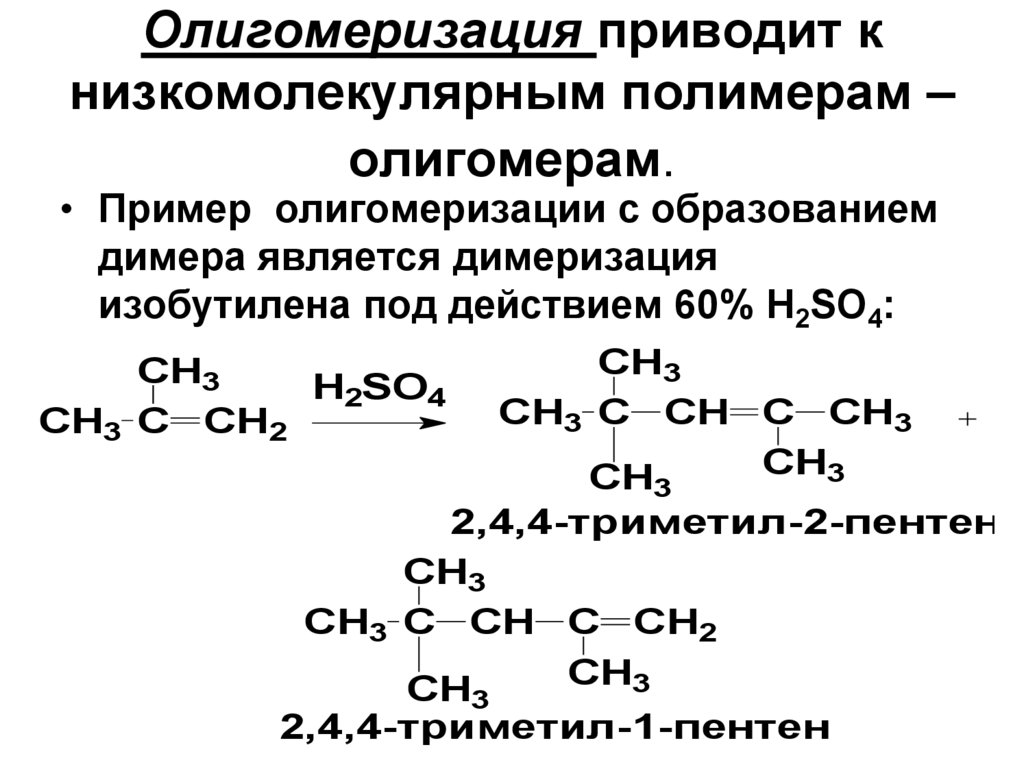
Олигомеризация приводит книзкомолекулярным полимерам –
олигомерам.
• Пример олигомеризации с образованием
димера является димеризация
изобутилена под действием 60% H2SO4:
CH3
СH3 C CH C CH3
CH3
CH
CH3
H2SO4
СH3 C CH2
3
2,4,4-триметил-2-пентен
CH3
СH3 C CH C CH2
CH3
CH
3
2,4,4-триметил-1-пентен
126.
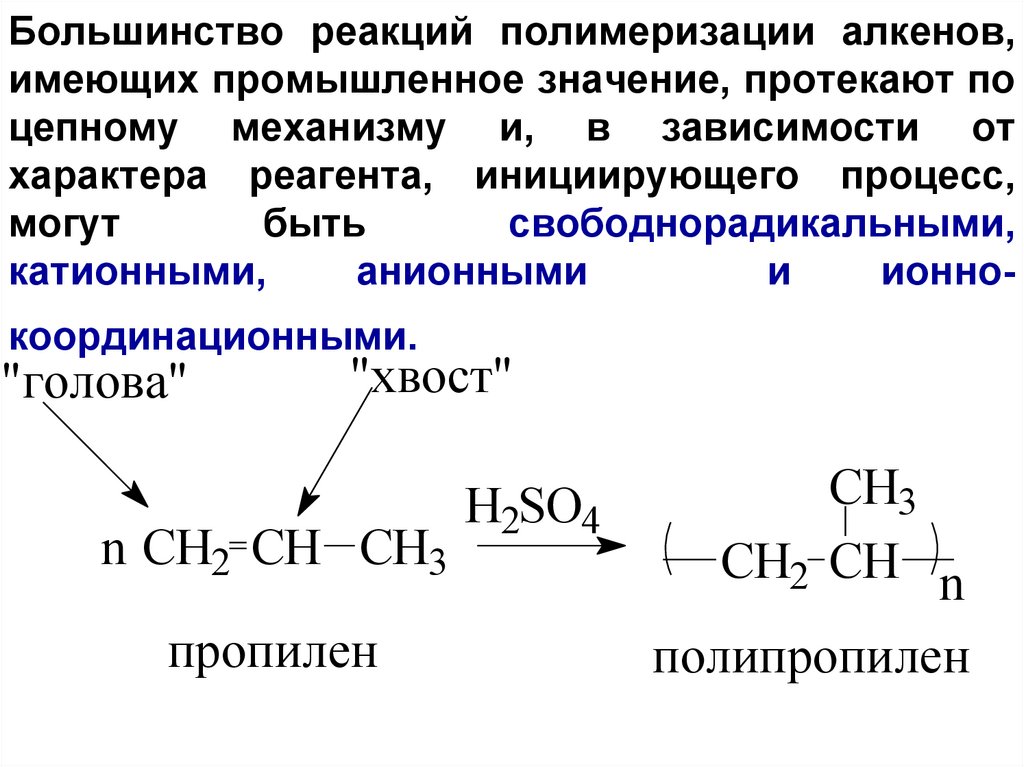
Большинство реакций полимеризации алкенов,имеющих промышленное значение, протекают по
цепному механизму и, в зависимости от
характера реагента, инициирующего процесс,
могут
быть
свободнорадикальными,
катионными,
анионными
и
ионнокоординационными.
"голова"
"хвост"
n СH2 CH CH3
пропилен
H2SO4
CH3
CH2 CH n
полипропилен
127.
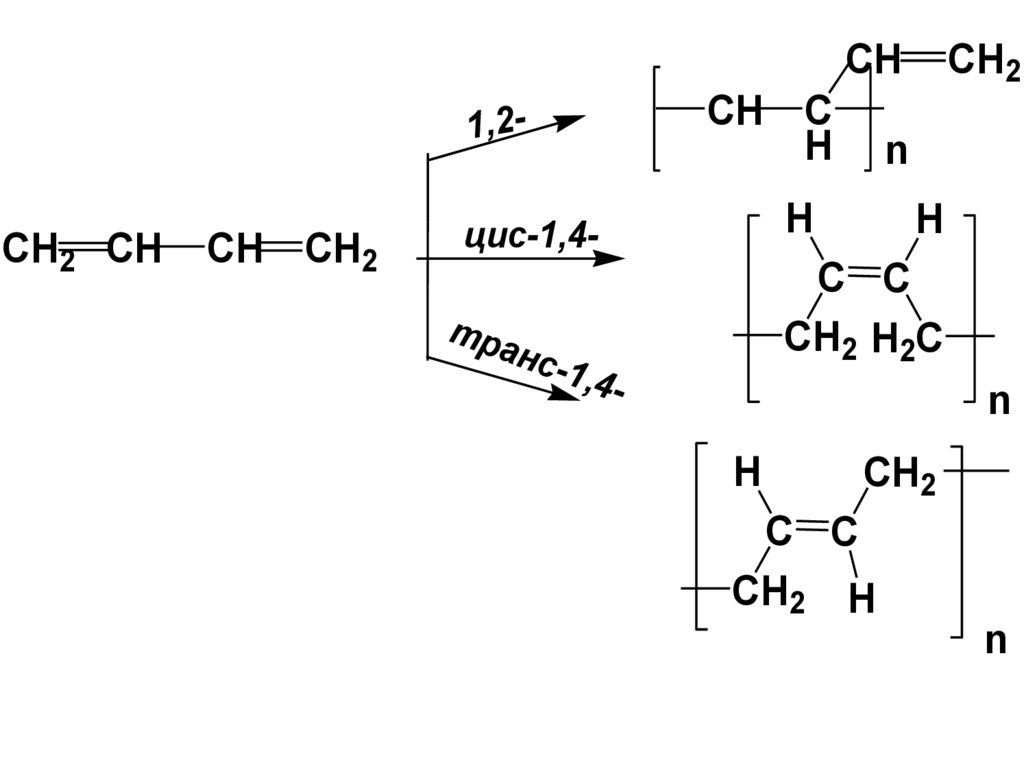
CH1,2-
CH2 CH
CH CH2
CH C
H
n
H
цис-1,4-
CH2
H
C C
CH2 H2C
тра
нс-1
,4-
n
H
CH2
C C
CH2 H
n
128.
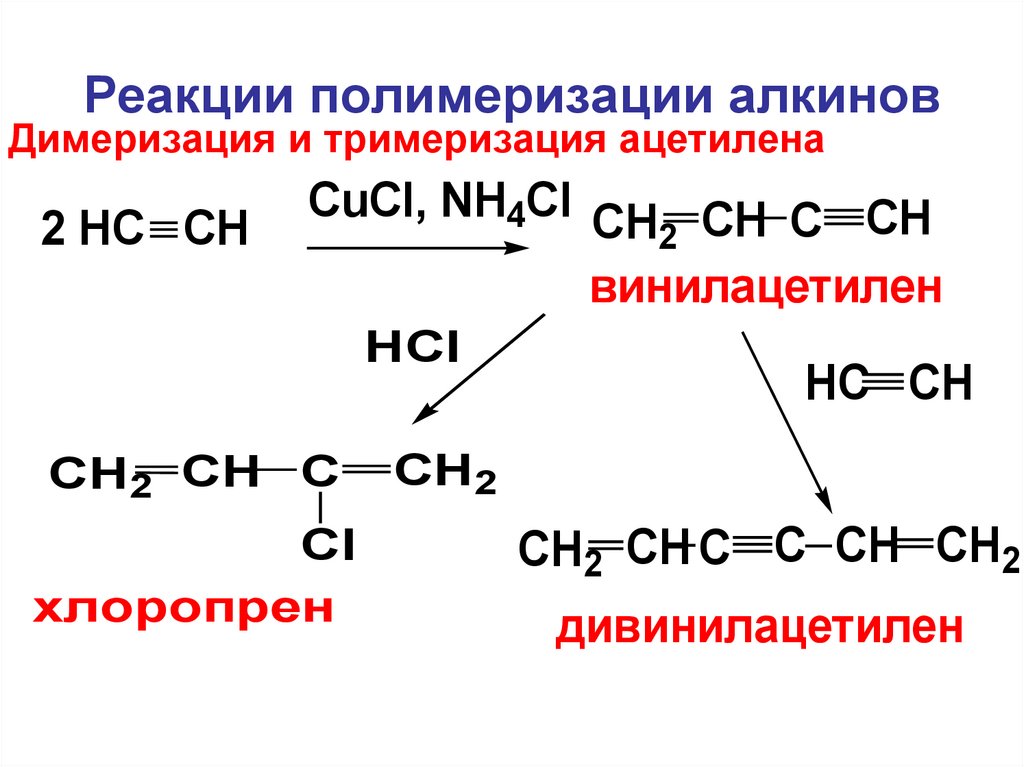
Реакции полимеризации алкиновДимеризация и тримеризация ацетилена
2 HC CH
CuCl, NH4Cl CH CH C CH
2
винилацетилен
HCl
CH2 CH C
Cl
хлоропрен
HC CH
CH2
CH2 CH C C CH CH2
дивинилацетилен
129.
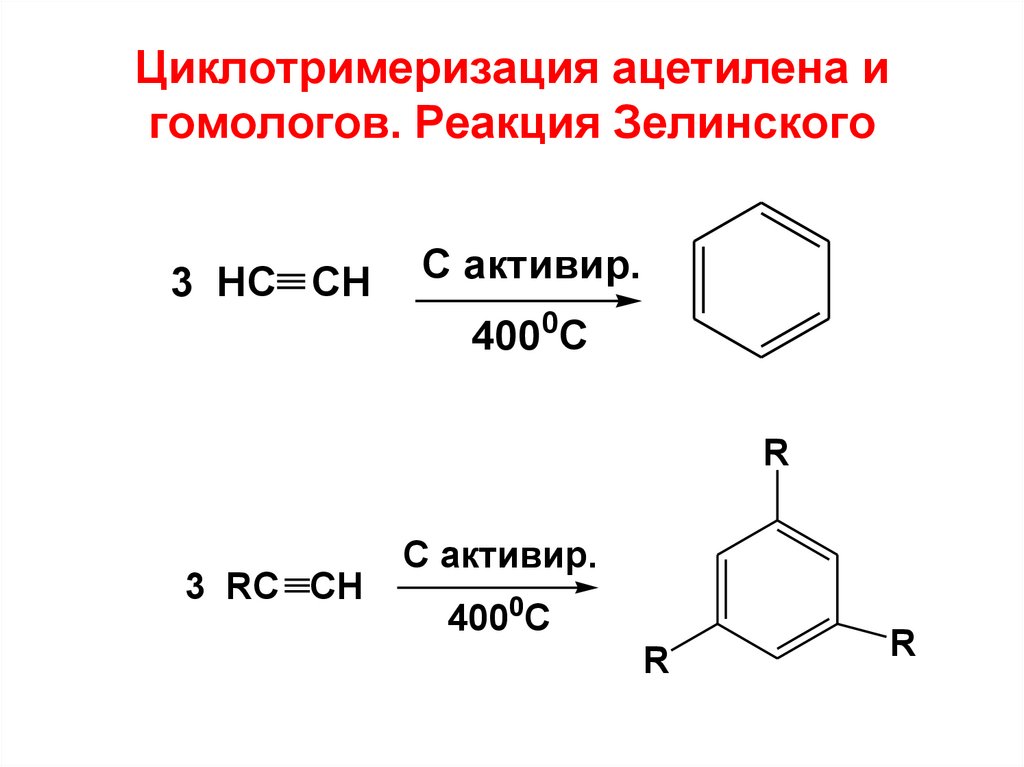
Циклотримеризация ацетилена игомологов. Реакция Зелинского
3 HC CH
C активир.
4000C
R
3 RC CH
C активир.
4000C
R
R
130.
Полимеризация алкиновn RC CR
1
катализ
R
R
R
C C C C C C
n
R1
R1
R1
сопряженные полиены
n HC CH
Cu
[O]
C C C C
n
карбин (полиацетилен)
131.
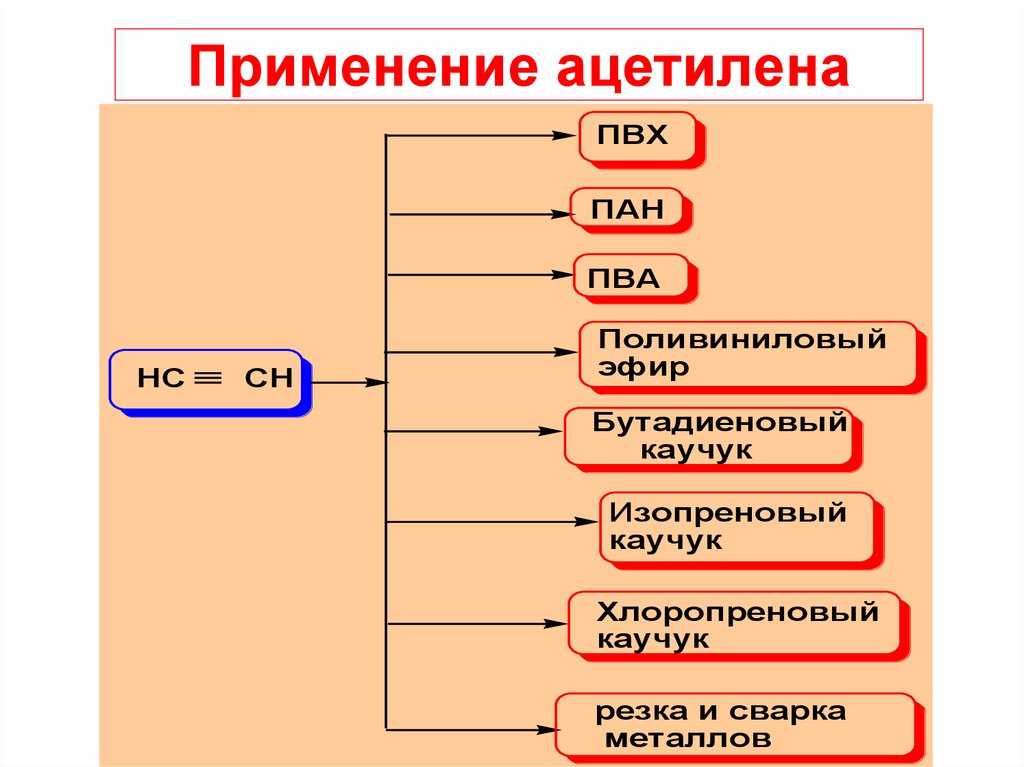
Применение ацетиленаПВХ
ПАН
ПВА
HC
CH
Поливиниловый
эфир
Бутадиеновый
каучук
Изопреновый
каучук
Хлоропреновый
каучук
резка и сварка
металлов



























































 Химия
Химия








