Похожие презентации:
Тепловое равновесие. Температура и ее измерение. Модель идеального газа. Основное уравнение молекулярно-кинетической теории идеально
1. Цельзанятия: знать понятия: тепловое равновесие, температура, идеальный газ, абсолютная температура, изопроцессы; знать
Тепловое равновесие. Температура и ее измерение.Модель идеального газа. Основное уравнение
молекулярно-кинетической теории идеального газа.
Абсолютная температура как мера средней
кинетической энергии теплового движения частиц
газа. Газовые законы. Уравнение МенделееваКлапейрона. Закон Дальтона. Изопроцессы.
ЦЕЛЬЗАНЯТИЯ:
ЗНАТЬ ПОНЯТИЯ: ТЕПЛОВОЕ РАВНОВЕСИЕ,
ТЕМПЕРАТУРА, ИДЕАЛЬНЫЙ ГАЗ, АБСОЛЮТНАЯ
ТЕМПЕРАТУРА, ИЗОПРОЦЕССЫ;
ЗНАТЬ УРАВНЕНИЕ МЕНДЕЛЕЕВА –КЛАЙПЕРОНА,
ЗАКОН ДАЛЬТОНА, ГАЗОВЫЕ ЗАКОНЫ,
ГРАФИЧЕСКОЕ ПРЕДСТАВЛЕНИЕ ИЗОПРОЦЕССОВ
Физика - Российская электронная школа
2.
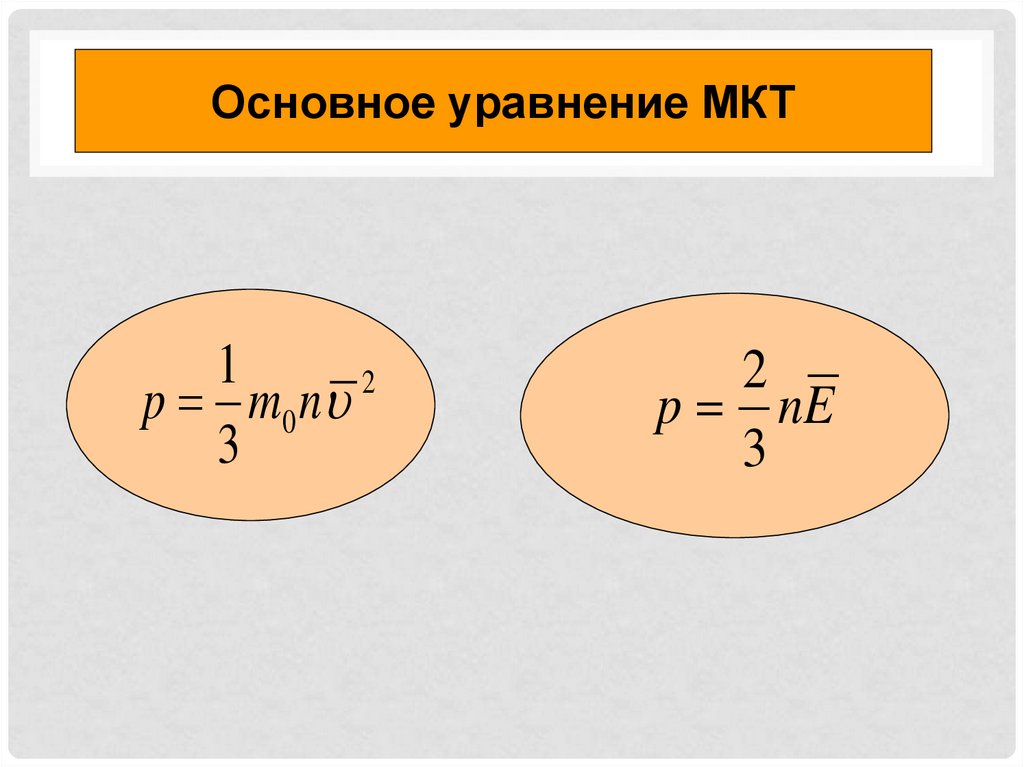
ИДЕАЛЬНЫЙ ГАЗ — ЭТО ГАЗ, ВЗАИМОДЕЙСТВИЕ, МЕЖДУМОЛЕКУЛАМИ КОТОРОГО ПРЕНЕБРЕЖИМО МАЛО
Диаметр молекул много меньше
среднего расстояния между ними
Собственный объем
молекул
пренебрежимо мал по
сравнению с объемом
газа
Средняя кинетическая энергия
молекул много больше средней
потенциальной энергии их
взаимодействия на расстоянии,
большем диаметра молекул
Между
столкновениями
молекулы движутся
практически по
прямолинейным
траекториям
Столкновения молекул газа
между собой и со стенками
сосуда абсолютно упругие
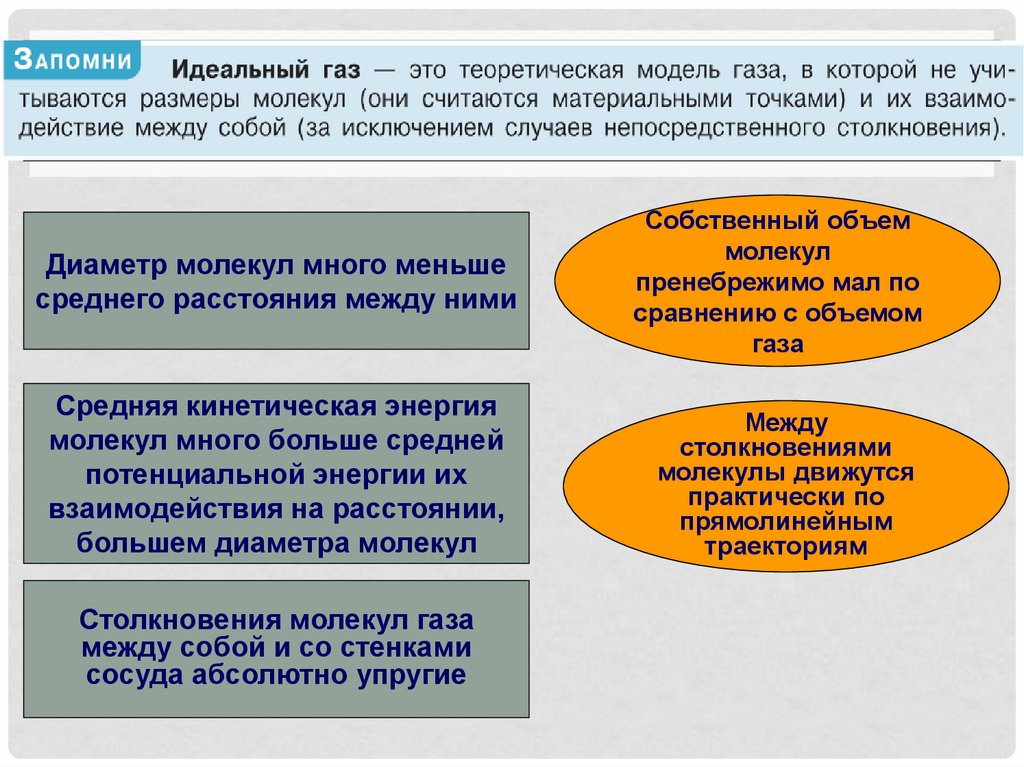
3.
Основное уравнение МКТ1
2
p m 0 n
3
2
p nE
3
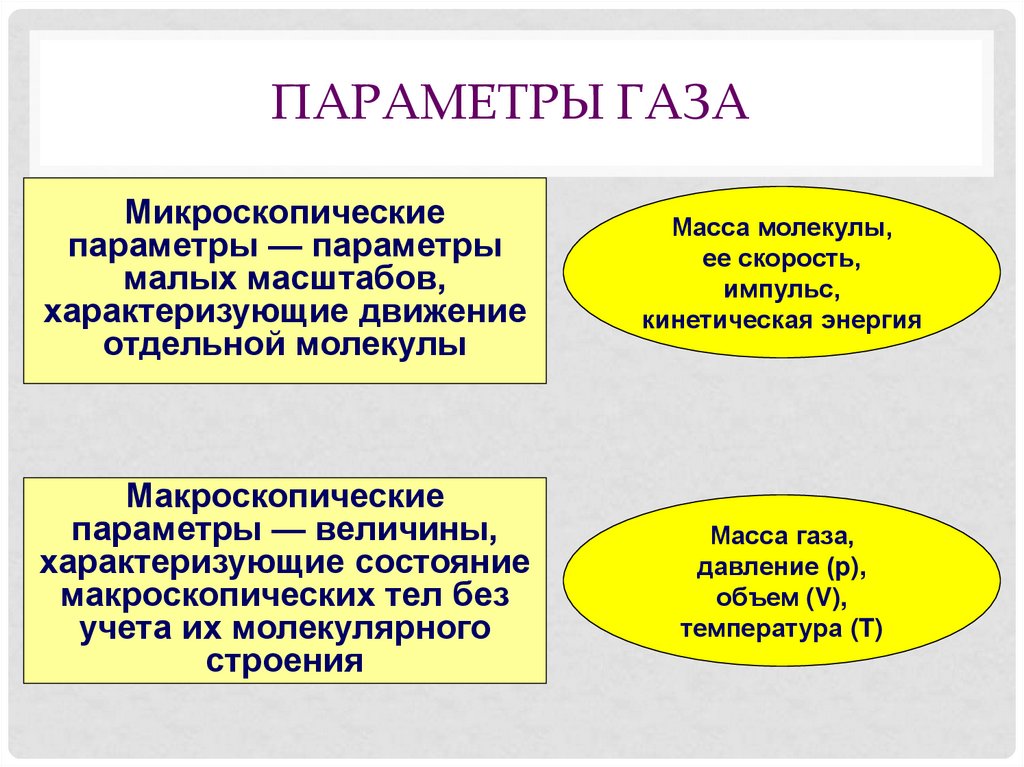
4. Параметры газа
ПАРАМЕТРЫ ГАЗАМикроскопические
параметры — параметры
малых масштабов,
характеризующие движение
отдельной молекулы
Масса молекулы,
ее скорость,
импульс,
кинетическая энергия
Макроскопические
параметры — величины,
характеризующие состояние
макроскопических тел без
учета их молекулярного
строения
Масса газа,
давление (p),
объем (V),
температура (T)
5.
Тепловым равновесием называют такое состояние тел,при котором температура во всех точках системы
одинакова
6.
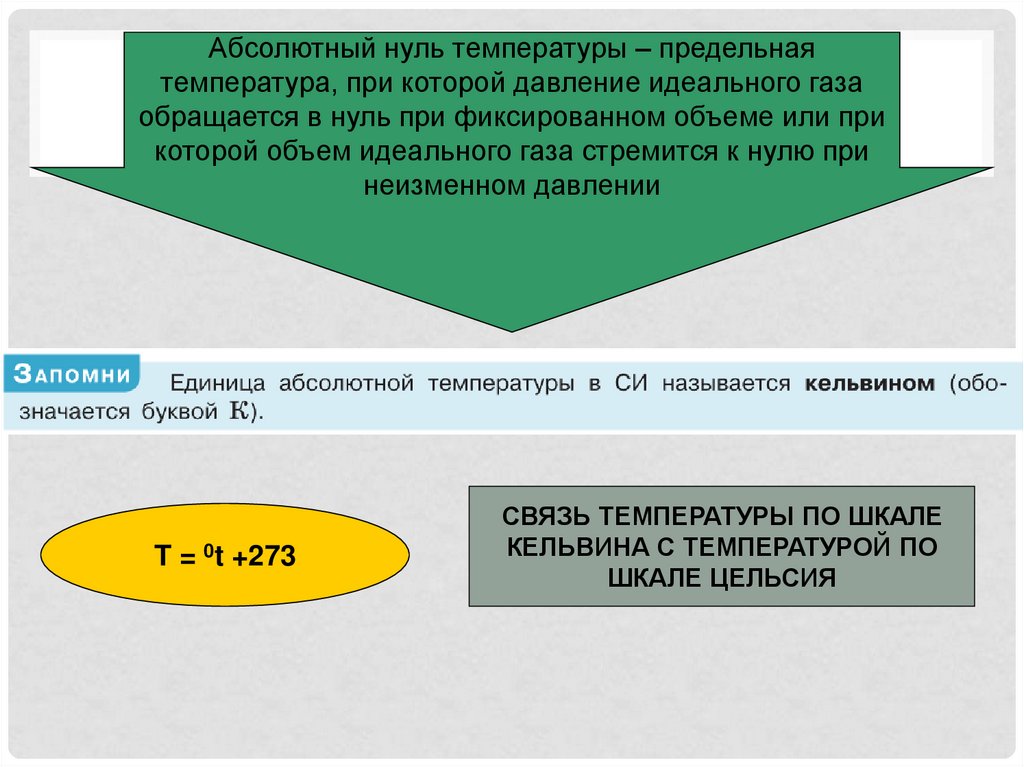
Абсолютный нуль температуры – предельнаятемпература, при которой давление идеального газа
обращается в нуль при фиксированном объеме или при
которой объем идеального газа стремится к нулю при
неизменном давлении
T = 0t +273
СВЯЗЬ ТЕМПЕРАТУРЫ ПО ШКАЛЕ
КЕЛЬВИНА С ТЕМПЕРАТУРОЙ ПО
ШКАЛЕ ЦЕЛЬСИЯ
7.
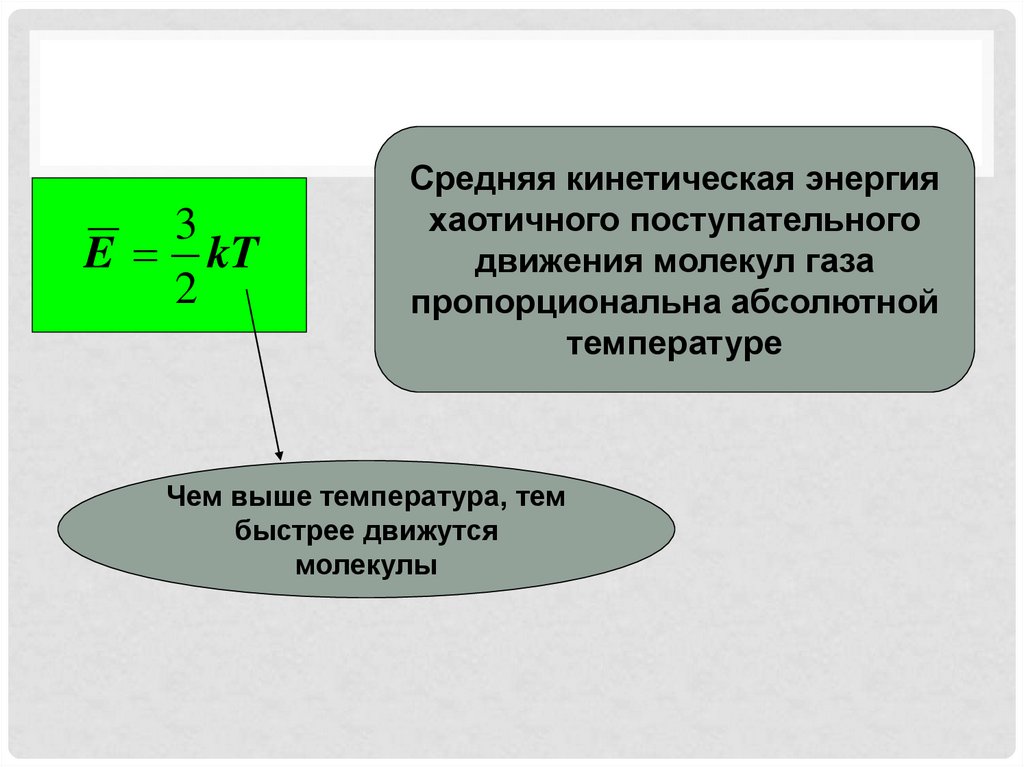
3E kT
2
Средняя кинетическая энергия
хаотичного поступательного
движения молекул газа
пропорциональна абсолютной
температуре
Чем выше температура, тем
быстрее движутся
молекулы
8.
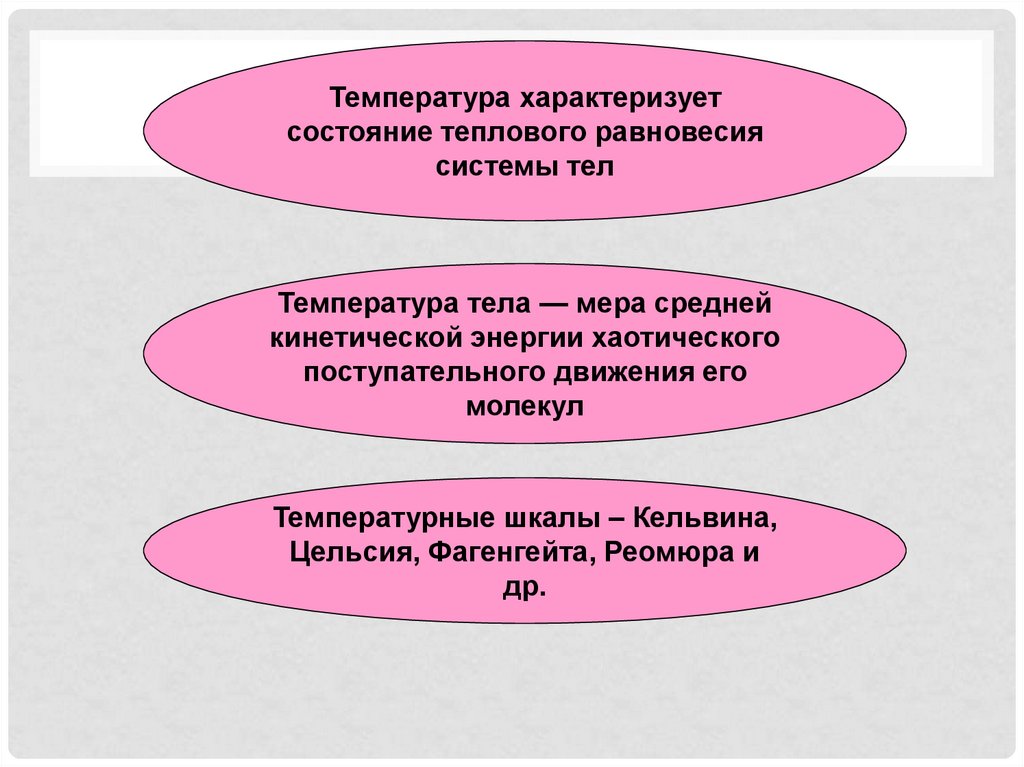
Температура характеризуетсостояние теплового равновесия
системы тел
Температура тела — мера средней
кинетической энергии хаотического
поступательного движения его
молекул
Температурные шкалы – Кельвина,
Цельсия, Фагенгейта, Реомюра и
др.
9.
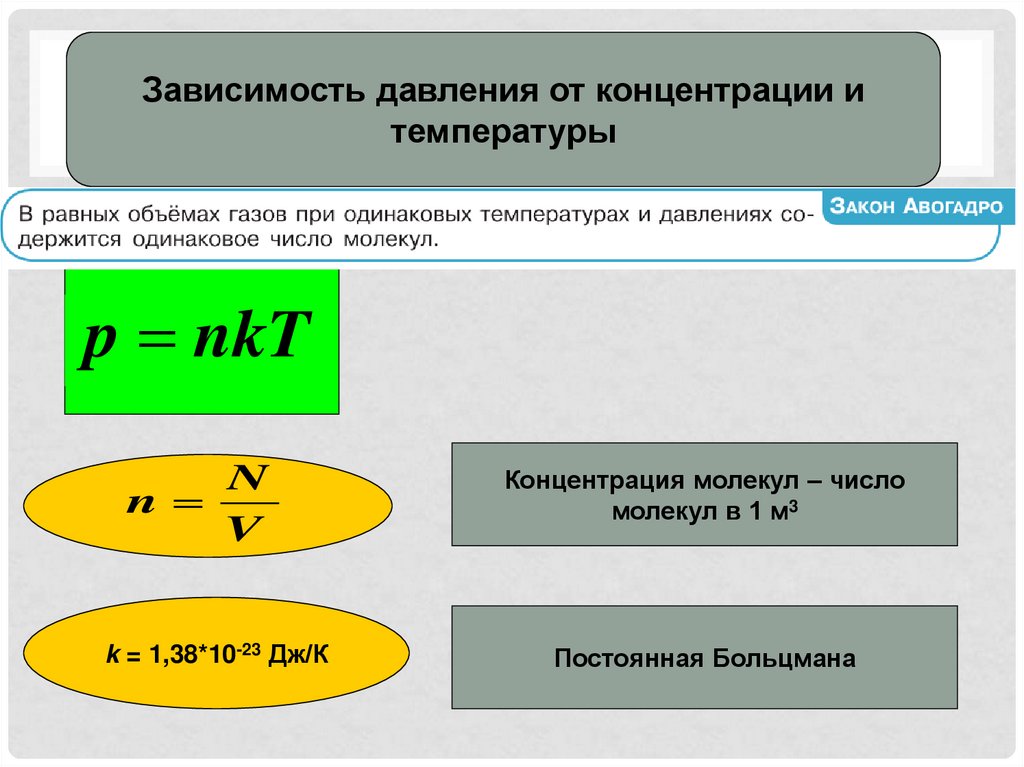
Зависимость давления от концентрации итемпературы
p nkT
N
n
V
k = 1,38*10-23 Дж/К
Концентрация молекул – число
молекул в 1 м3
Постоянная Больцмана
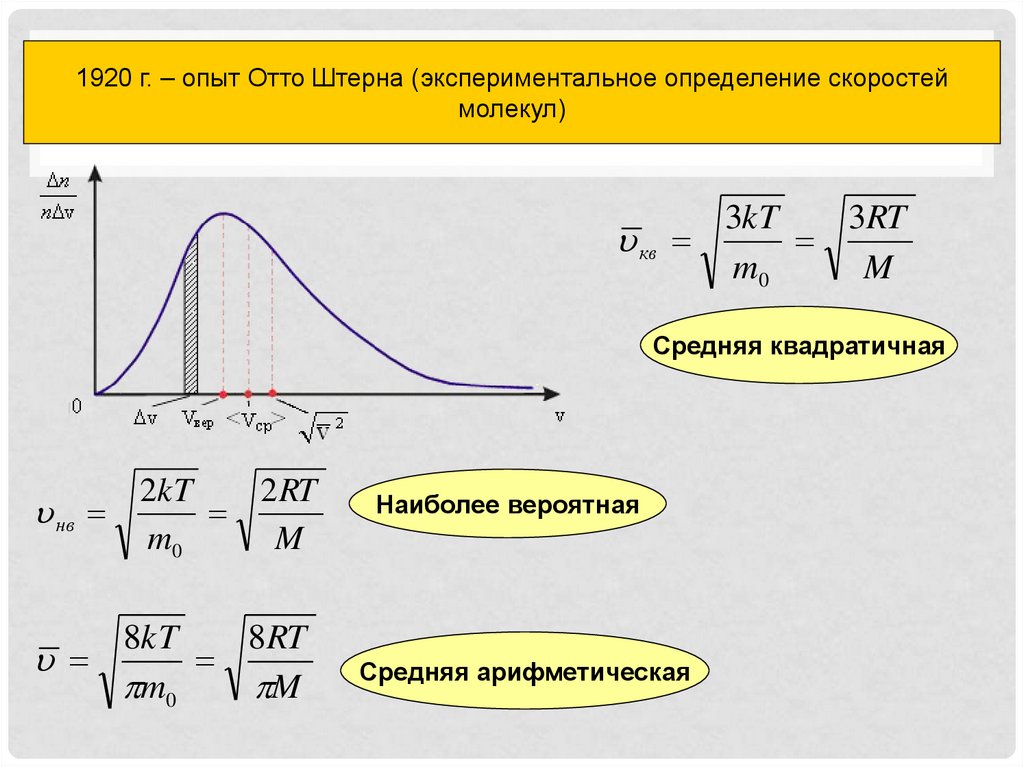
10. Распределение молекул газа по скоростям
1920 г. – опыт Отто Штерна (экспериментальное определение скоростеймолекул)
Распределение молекул газа по скоростям
3kT
3RT
кв
m0
M
Средняя квадратичная
нв
2kT
2 RT
m0
M
8kT
8RT
m0
M
Наиболее вероятная
Средняя арифметическая
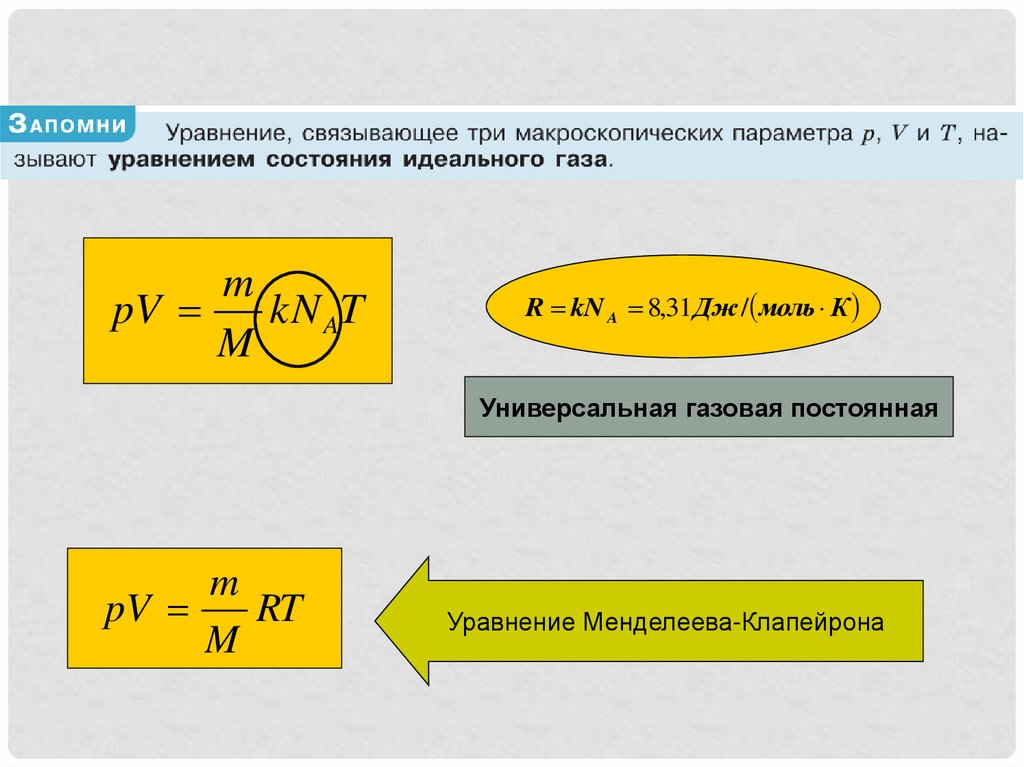
11.
mpV
kN AT
M
R kN A 8,31Дж / моль К
Универсальная газовая постоянная
m
pV
RT
M
Уравнение Менделеева-Клапейрона
12.
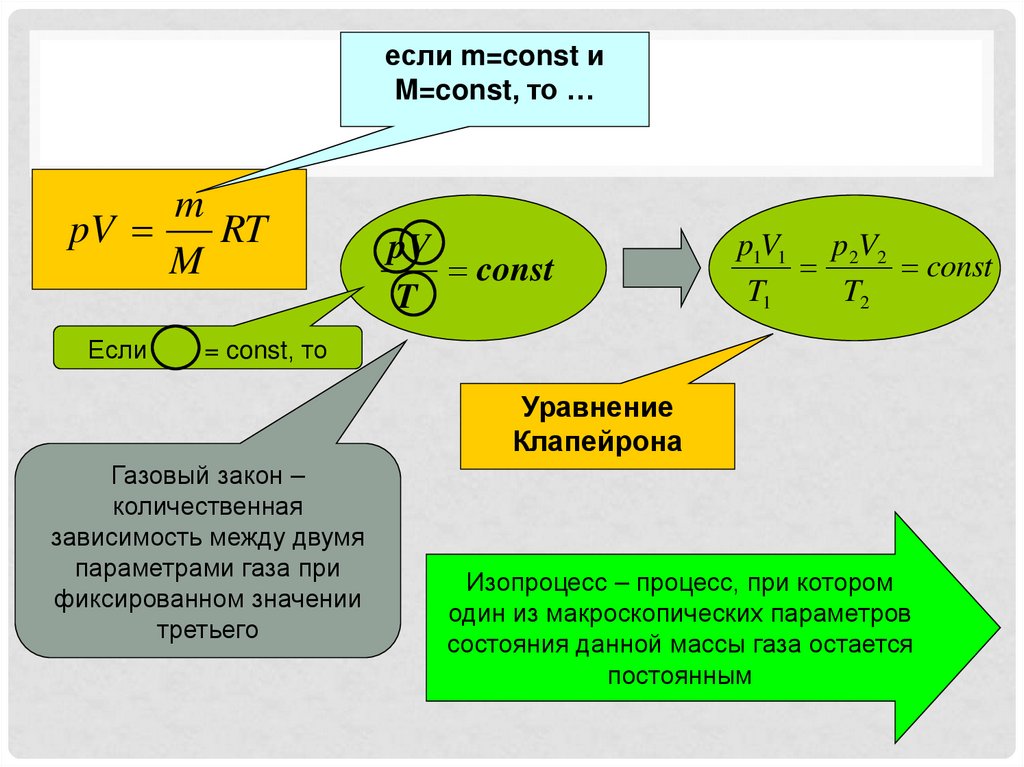
если m=const иM=const, то …
m
pV
RT
M
Если
pV
const
T
p1V1 p2V2
const
T1
T2
= const, то
Уравнение
Клапейрона
Газовый закон –
количественная
зависимость между двумя
параметрами газа при
фиксированном значении
третьего
Изопроцесс – процесс, при котором
один из макроскопических параметров
состояния данной массы газа остается
постоянным
13.
14.
15.
p1V1 p2V2const
T1
T2
Если T=const (не
изменяется)
Закон Бойля-Мариотта: для данной
массы газа при постоянной
Изотермический процесс
температуре произведение давления
газа на его объем есть величина
постоянная
pV const
16.
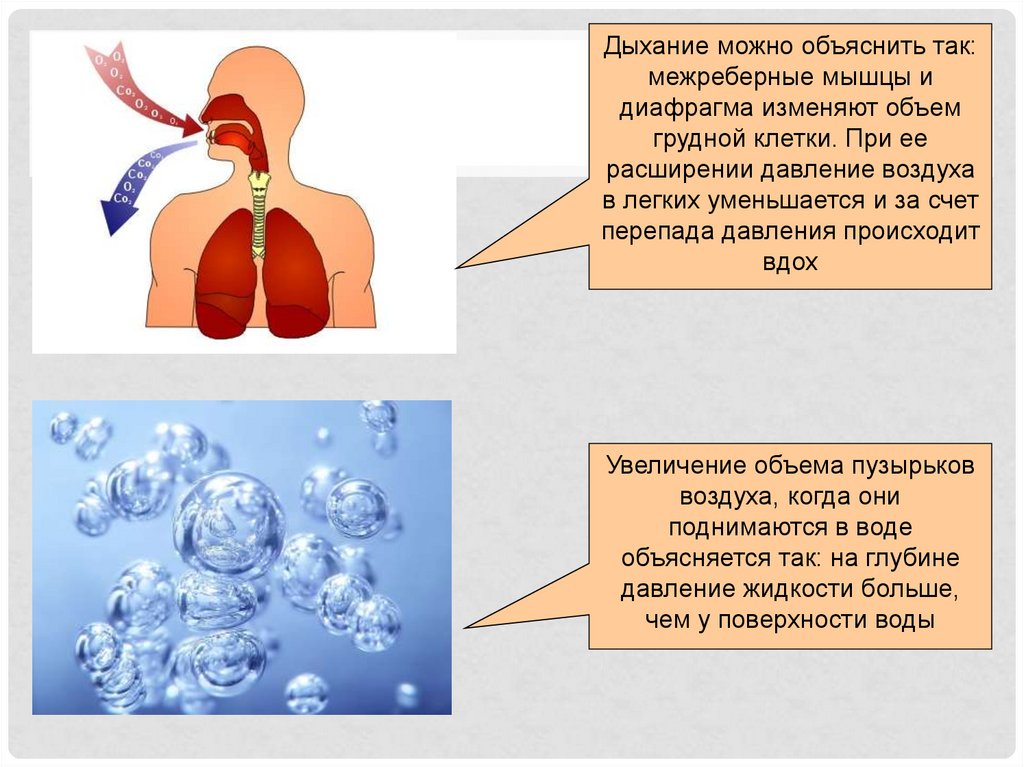
Дыхание можно объяснить так:межреберные мышцы и
диафрагма изменяют объем
грудной клетки. При ее
расширении давление воздуха
в легких уменьшается и за счет
перепада давления происходит
вдох
Увеличение объема пузырьков
воздуха, когда они
поднимаются в воде
объясняется так: на глубине
давление жидкости больше,
чем у поверхности воды
17.
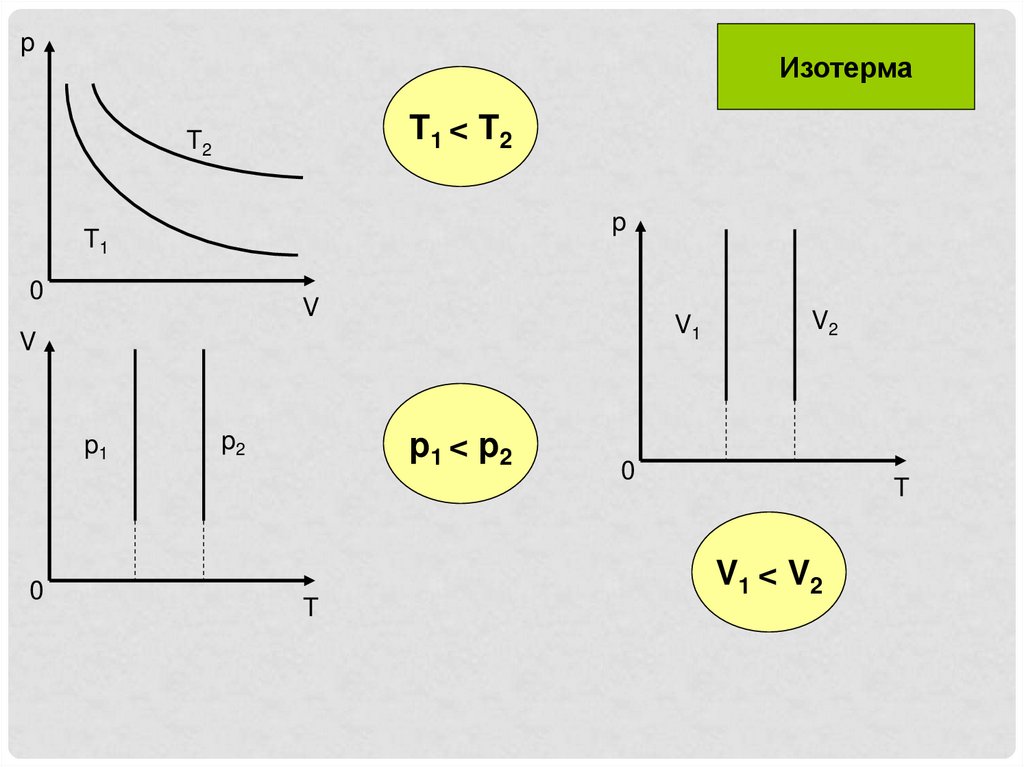
pИзотерма
T1 < T2
T2
p
T1
0
V
V1
V
p1
0
p2
p1 < p2
T
V2
0
T
V1 < V2
18.
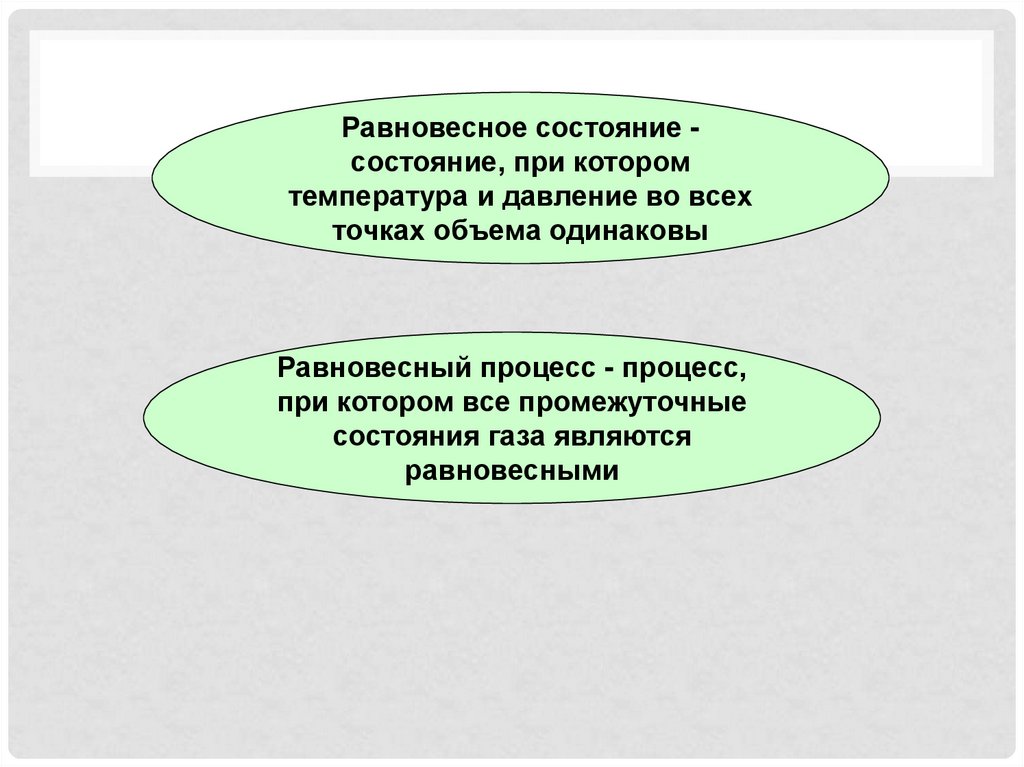
Равновесное состояние состояние, при которомтемпература и давление во всех
точках объема одинаковы
Равновесный процесс - процесс,
при котором все промежуточные
состояния газа являются
равновесными
19.
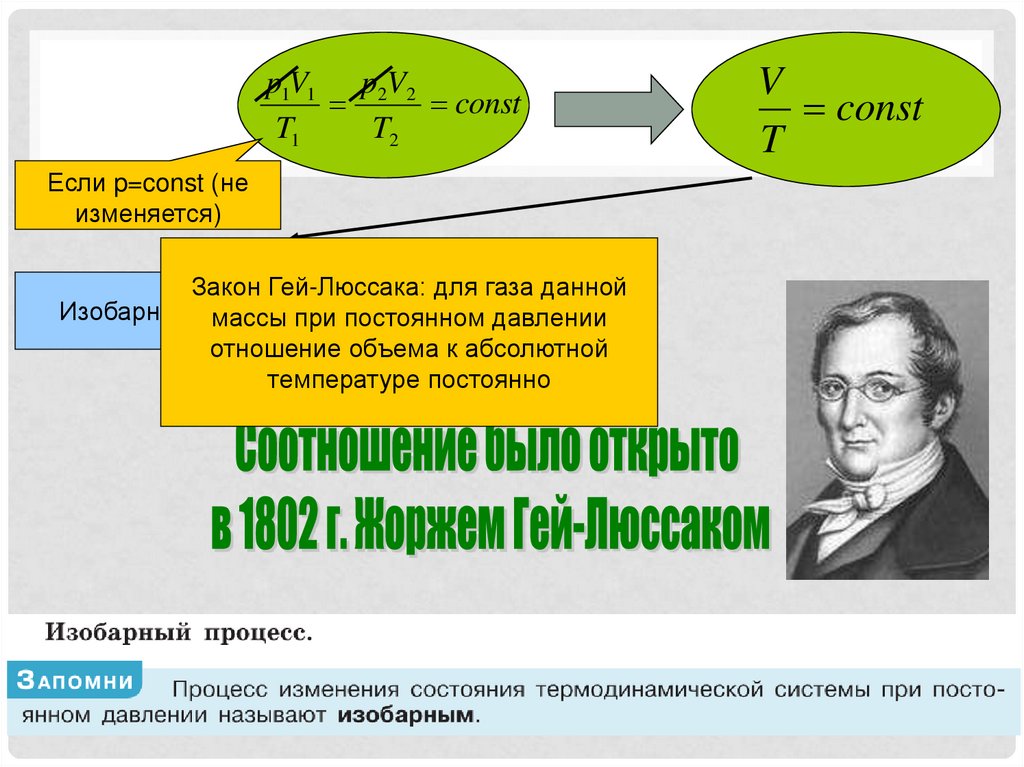
p1V1 p2V2const
T1
T2
Если p=const (не
изменяется)
Закон Гей-Люссака: для газа данной
Изобарный процесс
массы при постоянном давлении
отношение объема к абсолютной
температуре постоянно
V
const
T
20.
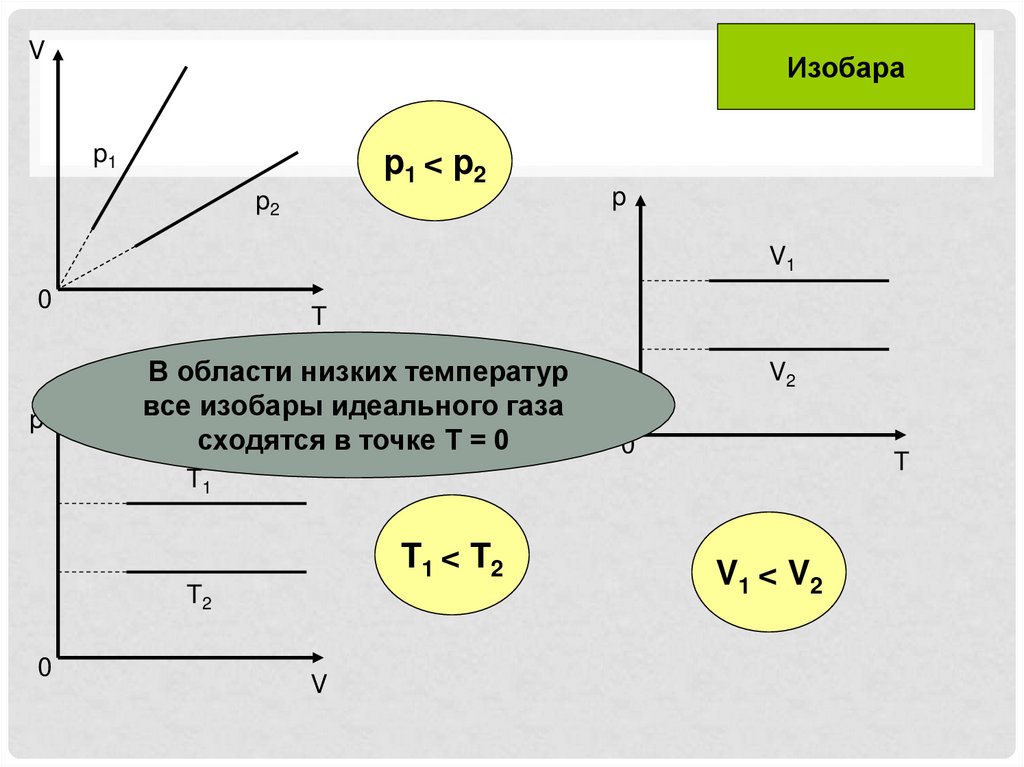
VИзобара
p1
p1 < p2
p2
p
V1
0
p
T
•В области низких температур
все изобары идеального газа
сходятся в точке Т = 0
V2
0
T
T1
T1 < T2
T2
0
V
V1 < V2
21.
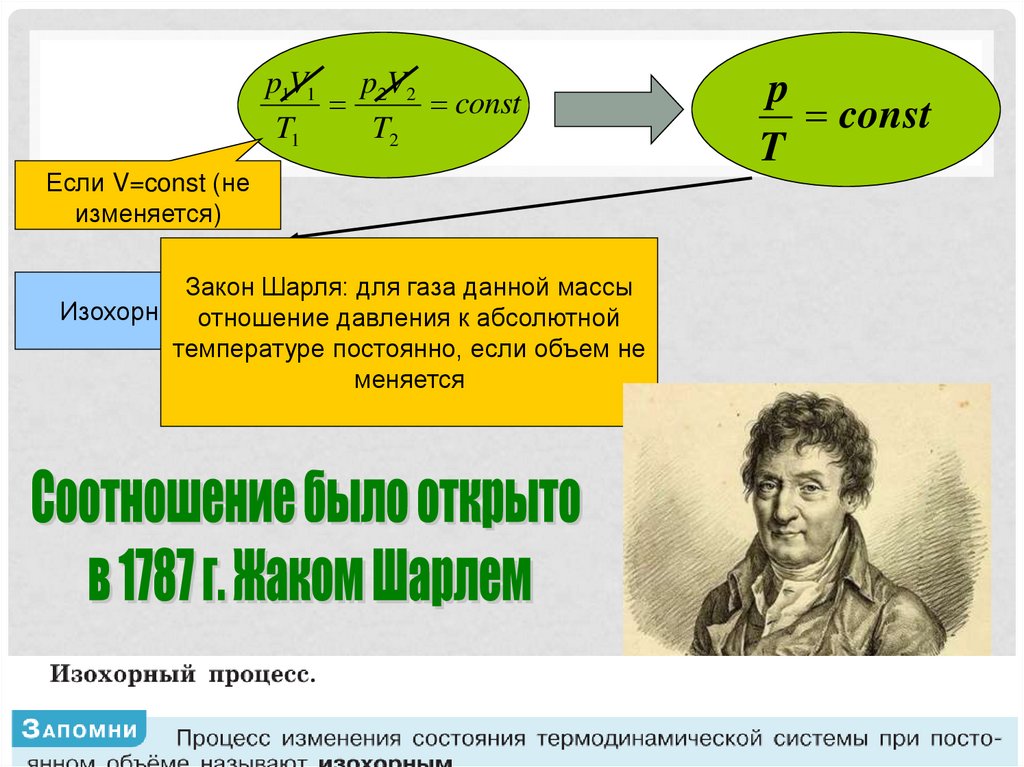
p1V1 p2V2const
T1
T2
Если V=const (не
изменяется)
Закон Шарля: для газа данной массы
Изохорный отношение
процесс
давления к абсолютной
температуре постоянно, если объем не
меняется
p
const
T
22.
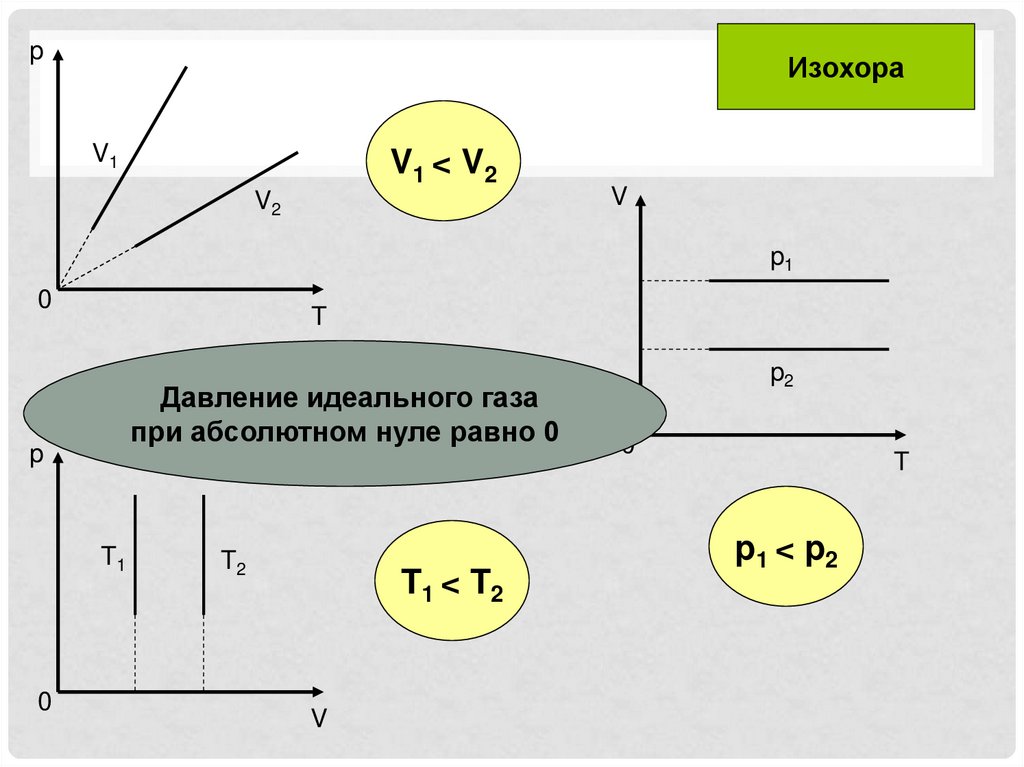
pИзохора
V1
V1 < V2
V2
V
p1
0
T
•Давление идеального газа
при абсолютном нуле равно 0
p
T1
0
T2
T1 < T2
V
p2
0
T
p1 < p2









 Физика
Физика