Похожие презентации:
2025г_лекция_2_Физико_химические_основы_водно_электролитного_баланса
1.
Физико-химическиеосновы водноэлектролитного
баланса организма.
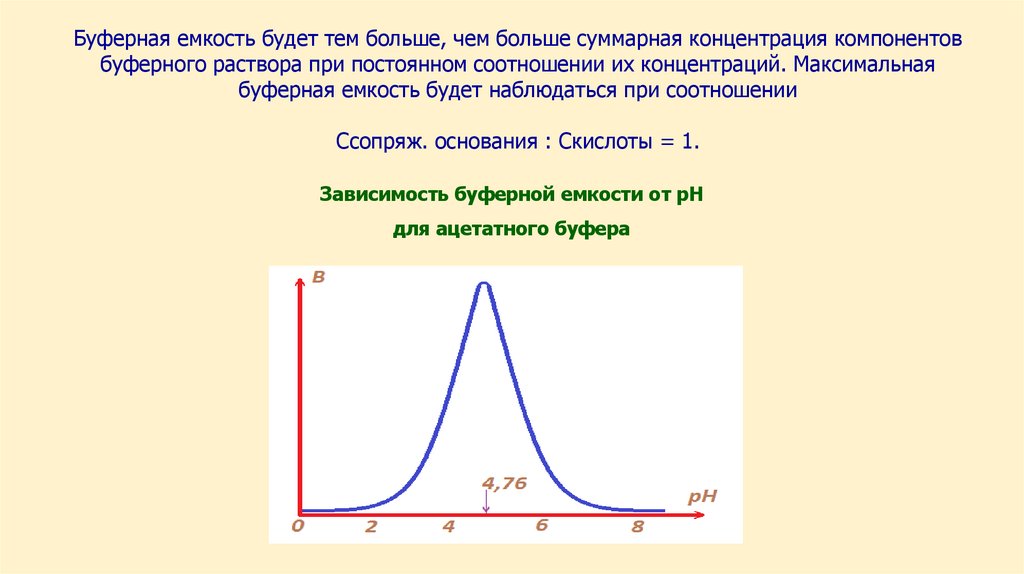
Буферные растворы
2.
3.
4.
5.
Теория Бренстеда-Лоури (протонная)+
НА = Н + А , кислота – донор протона
+
+
В + Н = ВН , основание – акцептор протона
«Кислота» и «основание» – относительные понятия, одни
и те же вещества могут быть и кислотами и основаниями
6.
СН3СООН / СН3СОО- и Н3О+ / Н2О – кислотноосновные пары (сопряженные кислоты иоснования)
Реакции диссоциации, нейтраллизации,
гидролиза – реакции протолиза.
Протолитические равновесия – равновесия,
устанавливающиеся в растворах между
кислотами и сопряженными основаниями.
7.
Электронная теория ЛьюисаОграниченность протонной теории – не объясняет
кислотно-основные свойства водороднесодержащих
веществ (BCl3, SiCl4 и др.)
Теория Льюиса объясняет кислотно-основные свойства на
электронном уровне (не на молекулярно-ионном).
Основание – донор электронной пары
Кислота – акцептор электронной пары
Кислотно-основное взаимодействие - образование
донорно-акцепторной связи
H3N:
основание1
+
HCl
кислота2
[H3N- H]+ +
кислота1
:Clоснование2
8.
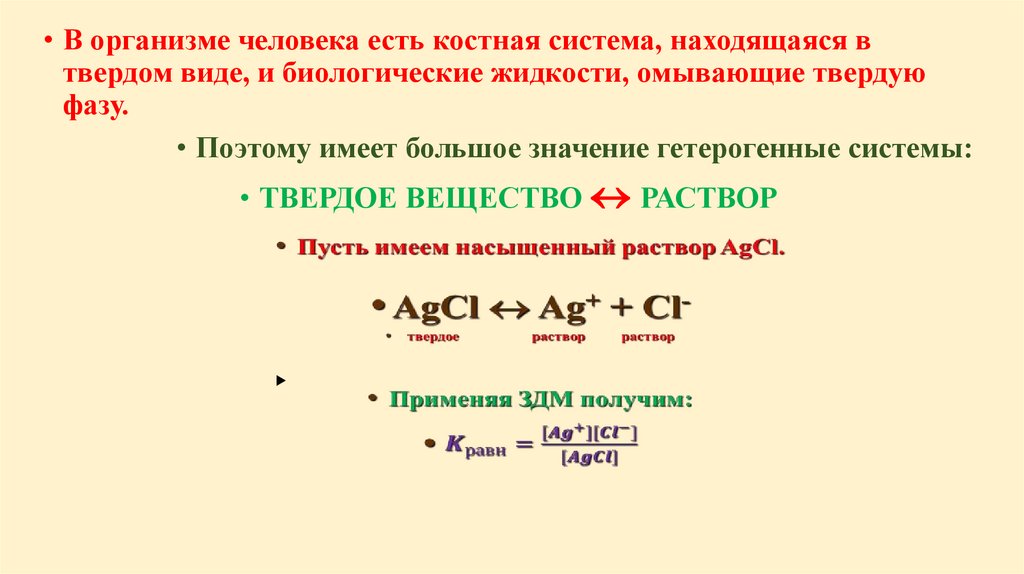
Автопротолиз - реакция самоионизации+
Н2О + Н2О Н3О + ОНПо закону действующих масс (ЗДМ)

































 Химия
Химия








