Похожие презентации:
Второй закон термодинамики. Обратимые и необратимые процессы. Энтропия
1. Термодинамика и теплопередача
Второй закон термодинамикиОбратимые и необратимые
процессы
Энтропия
2. Постулаты второго начала термодинамики:
1.Тепло не может переходить от холодного тела ктеплому без компенсации (Клаузиус);
2. Природа стремится к переходу от менее
вероятных состояний к более вероятным
(Больцман);
3. Осуществление вечного двигателя второго рода
невозможно (Клаузиус);
4. Невозможно осуществление цикла теплового
двигателя без переноса некоторого колличества
теплоты от источника тепла с более высокой
температурой к источнику с более низкой
температурой (Томпсон).
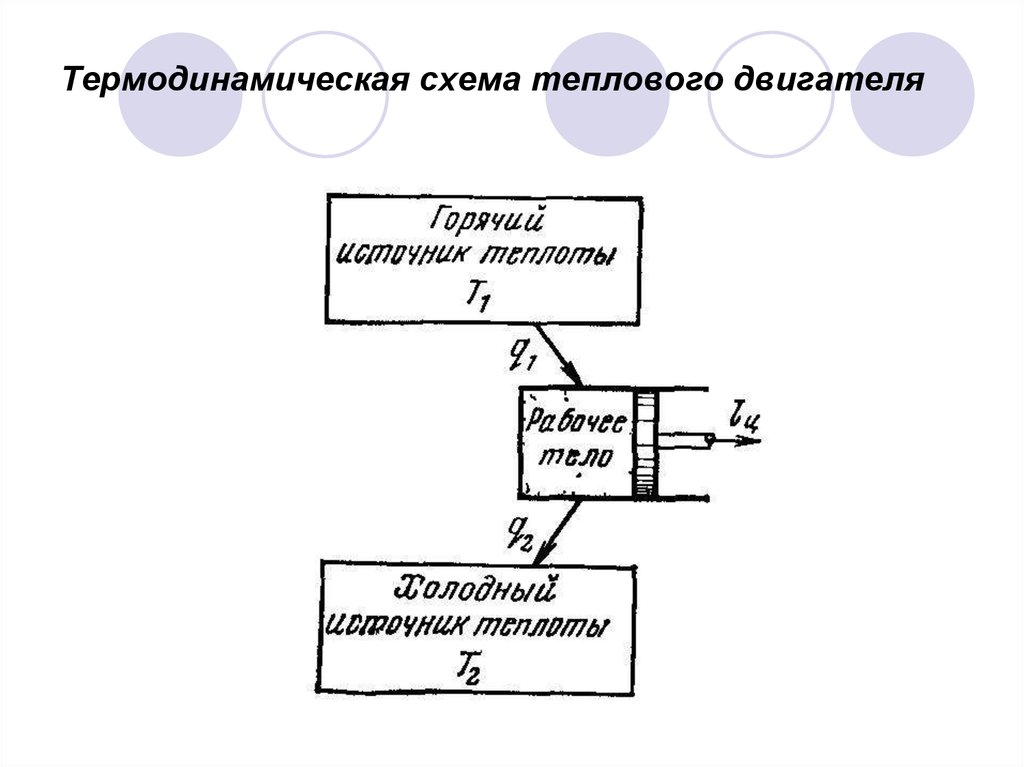
3. Термодинамическая схема теплового двигателя
4.
В тепловом двигателе всегда должновыполняться неравенство: L Q1
По первому закону термодинамики:
L Q1 Q2
Поэтому в тепловых двигателях какой
бы конструкции они не были всегда
должно выполняться неравенство:
Q2 0
5. Термический коэффициент полезного действия:
Lt
1
Q1
t
lц
q1
q1 q 2
q1
Т.о. термический кпд теплового двигателя всегда должен быть
меньше единицы. Так же кпд можно рассчитать:
Т2
t 1
1
Т1
6. Энтропия
Уравнение изменения параметровидеального газа в равновесных процессах:
q
cv dT pdv
dT
dv
cv
R
T
T
T
v
ds q / T
S – энтропия [Дж/К];
s – удельная энтропия [Дж/кг*К].
7.
Энтропия как функция состояния можетбыть представлена в виде функции
любых двух параметров состояния:
s 1 ( p, v)
s 2 ( p, T )
s 3 (v, T )
Уравнение, связывающее энтропию с
другими параметрами, записывают в
виде:
Tds du pdv dh vdp
8.
Значение энтропии для заданного состоянияопределяется:
q
s s0
,
T
.
В технической термодинамике используют как
правило не абсолютное значение энтропии, а
ее изменение в каком либо процессе:
2
s s 2 s1
1
q
T
Получим формулы позволяющие вычислить
изменение энтропии идеального газа:
s 2 s1 c p ln( T2 / T1 ) R ln( p 2 / p1 )
s 2 s1 cv ln( p2 / p1 ) c p ln( v2 / v1 )
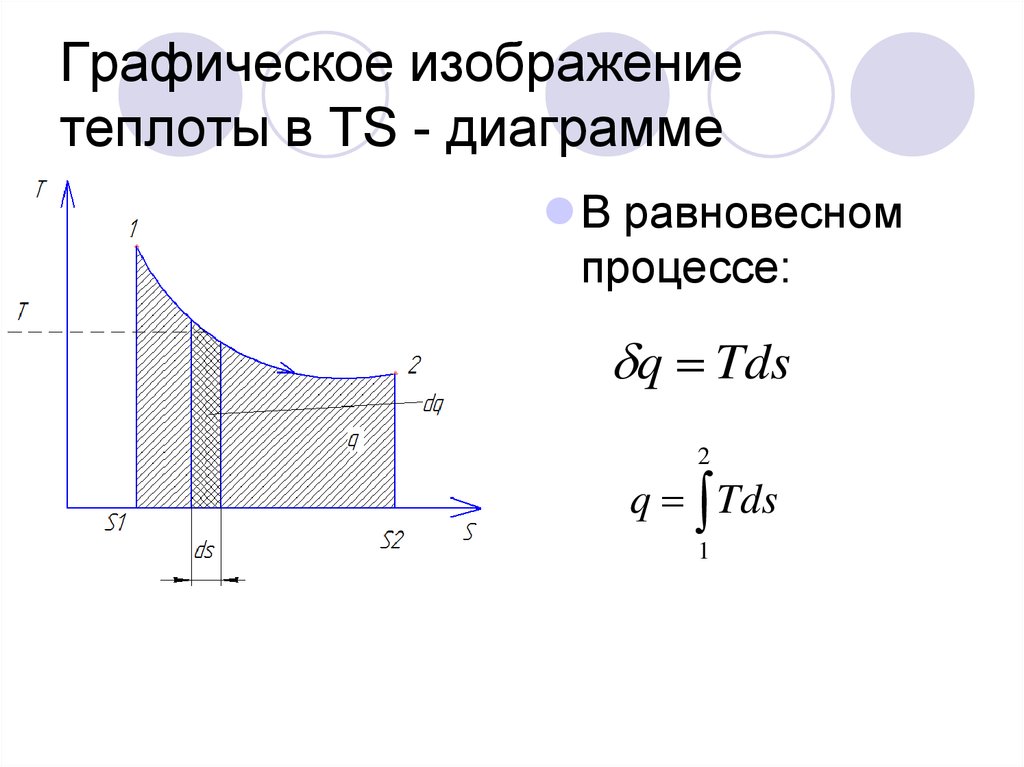
9. Графическое изображение теплоты в TS - диаграмме
В равновесномпроцессе:
q Tds
2
q Tds
1







 Физика
Физика








