Похожие презентации:
Тема 11 РИО
1.
Реакцииионного
обмена.
Важнейшие
классы
Окислительно-восстановительные
неорганических соединений.
реакции
КИСЛОТЫ
Составители: к.х.н. Махмутова Г.Ф.,
к.х.н. Ефимова И.Г.
2.
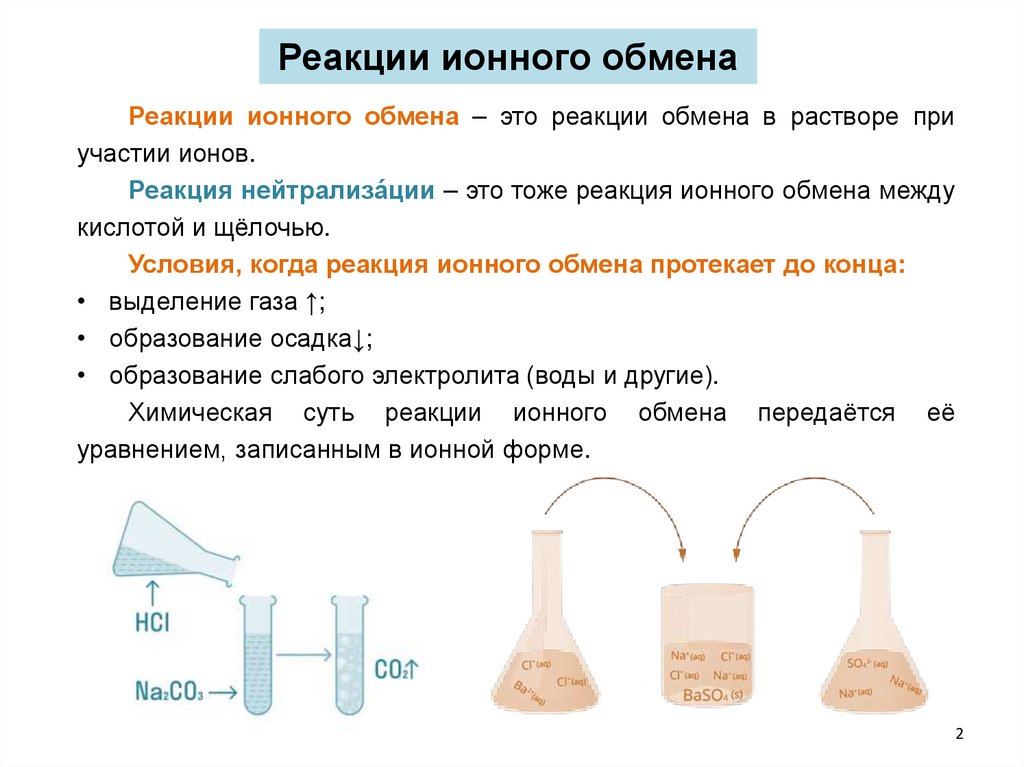
Реакции ионного обменаРеакции ионного обмена – это реакции обмена в растворе при
участии ионов.
Реакция нейтрализа́ции – это тоже реакция ионного обмена между
кислотой и щёлочью.
Условия, когда реакция ионного обмена протекает до конца:
• выделение газа ↑;
• образование осадка↓;
• образование слабого электролита (воды и другие).
Химическая суть реакции ионного обмена передаётся её
уравнением, записанным в ионной форме.
2
3.
Алгоритм получения ионной формы уравнения1. Перепишите уравнение реакции, расписав сильные электролиты в
виде ионов.
В виде ионов записывают сильные электролиты:
• сильные кислоты
• сильные основания
• растворимые в воде соли
В виде молекул записывают слабые электролиты:
• H2O;
• слабые и средние кислоты
• нерастворимые основания, NH4OH
• нерастворимые и малорастворимые соли
• газы, оксиды
Получите ионное уравнение в полной форме.
2. Сократите одинаковые ионы, которые стоят в левой и правой
частях уравнения. Получите сокращённую форму ионно-молекулярного
уравнения.
3
4.
Пример 1Напишите уравнение реакции ионного обмена (в молекулярной, полной
ионной и сокращенной ионной формах) сульфата натрия и хлорида бария
1) Молекулярное уравнение:
Nа2SO4 + ВаCl2 = ВаSO4↓ + 2NaCl
2) Полное ионно-молекулярное уравнение:
2Nа+ + SO42– + Ва2+ + 2Сl– = ВаSO4↓ + 2Nа+ + 2Сl–
Сокращаем одинаковые ионы слева и справа:
2Nа+ + SO42– + Ва2+ + 2Сl– = ВаSO4↓ + 2Nа+ + 2Сl–
3) Сокращённое ионно-молекулярное уравнение:
Ва2+ + SO42– = ВаSO4↓ (+ 2 – 2 = 0)
Необходимо проверять её правильность сокращенного уравнения, используя закон
сохранения заряда: заряд всех частиц, которые стоят в левой части уравнения, равняется
заряду частиц в правой части.
4
5.
Пример 2Напишите уравнение реакции ионного обмена (в молекулярной, полной
ионной и сокращенной ионной формах) карбоната калия и азотной
кислоты.
Молекулярное уравнение:
K2CO3 + 2HNO3 = 2KNO3 + CO2↑ + H2O
Полное ионное уравнение:
2K+ + CO32– + 2H+ + 2NO3– = 2K+ + 2NO3– + CO2↑ + H2O
Сокращённое ионно-молекулярное уравнение:
2H+ + CO32– = CO2↑ + H2O (– 2 + 2 = 0)
5
6.
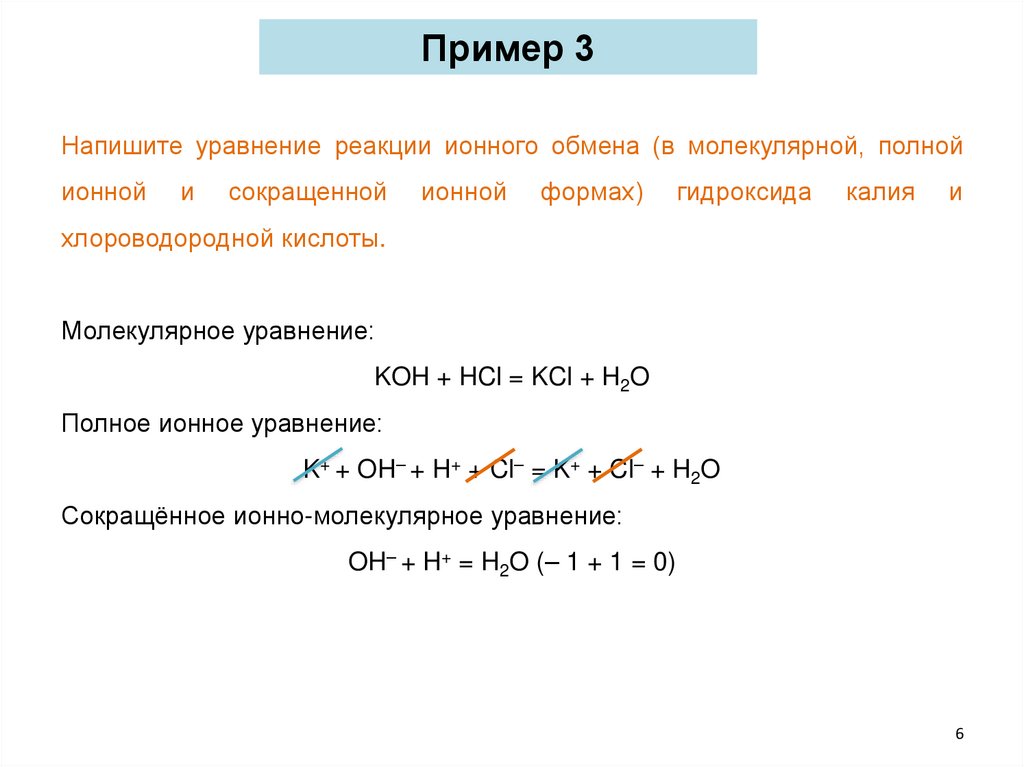
Пример 3Напишите уравнение реакции ионного обмена (в молекулярной, полной
ионной
и
сокращенной
ионной
формах)
гидроксида
калия
и
хлороводородной кислоты.
Молекулярное уравнение:
KOH + HCl = KCl + H2O
Полное ионное уравнение:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O
Сокращённое ионно-молекулярное уравнение:
OH– + H+ = H2O (– 1 + 1 = 0)
6
7.
Пример 4Запишите
следующее
ионно-молекулярное
уравнение
реакции
в
молекулярной форме: Рb2+ + 2I– →
1) Напишем сокращённое ионное уравнение:
Рb2+ + 2I– → PbI2↓
2) Определим какие сильные электролиты при диссоциации дают данные ионы, используя
таблицу растворимости. Например, Рb2+ из Pb(OH)2↓ получить нельзя, так как это
нерастворимое основание – слабый электролит, в таком случае необходимо использовать
растворимые соли свинца (II). Йодоводородная кислота или растворимые соли-йодиды
являются сильными электролитами, поэтому при диссоциации дают I–.
Молекулярное уравнение:
Pb(NO3)2 + CaI2 = PbI2↓ + Ca(NO3)2
Cоставим полное ионно-молекулярное уравнение для проверки:
Рb2+ + 2NO3- + Ca2+ + 2I– → PbI2↓ + Ca2+ + 2NO3-
7
8.
Домашнее заданиеЗапишите молекулярные, полные и сокращенные ионномолекулярные уравнения реакций взаимодействия
водных растворов следующих соединений:
1)Ba(OH)2 и HNO3
2)H2S и FeCl2
3)Mg(OH)2 и HBr
4)AgNO3 и HI
5)Fe2(SO4)3 и KOH
8







 Химия
Химия








