Похожие презентации:
Л 6 МКТ часть 2 (1)
1. Объяснение изменений агрегатных состояний вещества на основе молекулярно-кинетических представлений.
Объяснение измененийагрегатных состояний
вещества
на основе молекулярнокинетических
представлений.
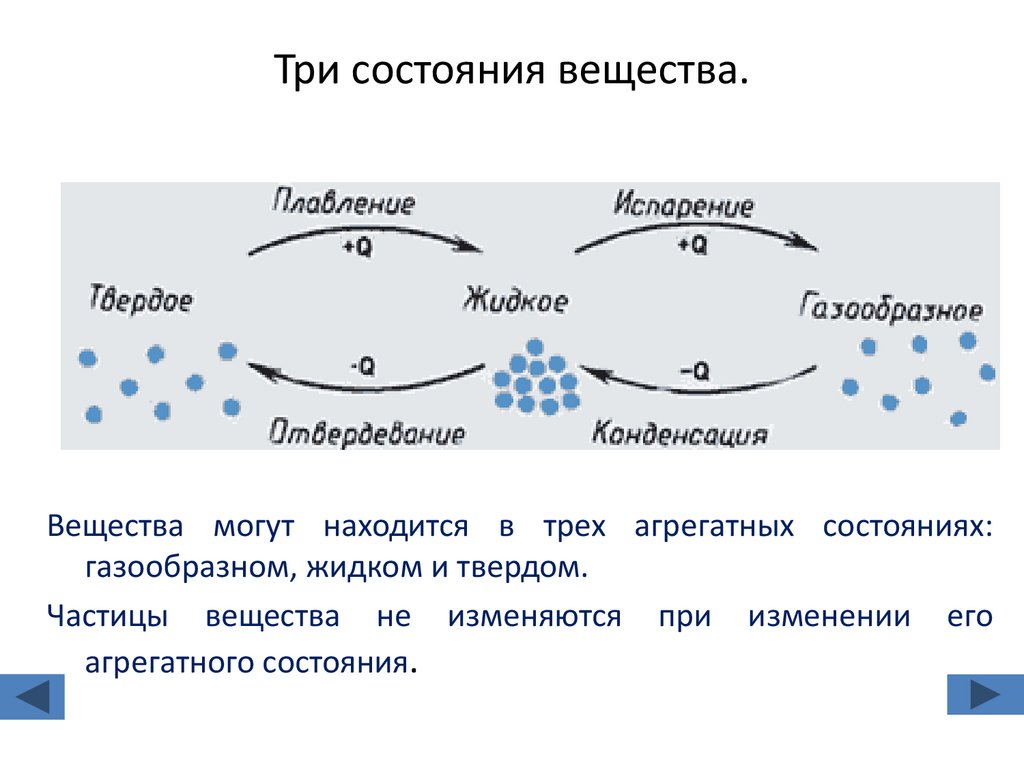
2. Три состояния вещества.
Вещества могут находится в трех агрегатных состояниях:газообразном, жидком и твердом.
Частицы вещества не изменяются при изменении его
агрегатного состояния.
3. Основные положения МКТ:
• Все тела состоят из частиц (молекул, атомов);• частицы непрерывно хаотически движутся;
• скорость движения зависит от температуры;
• между частицами существуют промежутки;
• частицы взаимодействуют между собой
(притягиваются и отталкиваются).
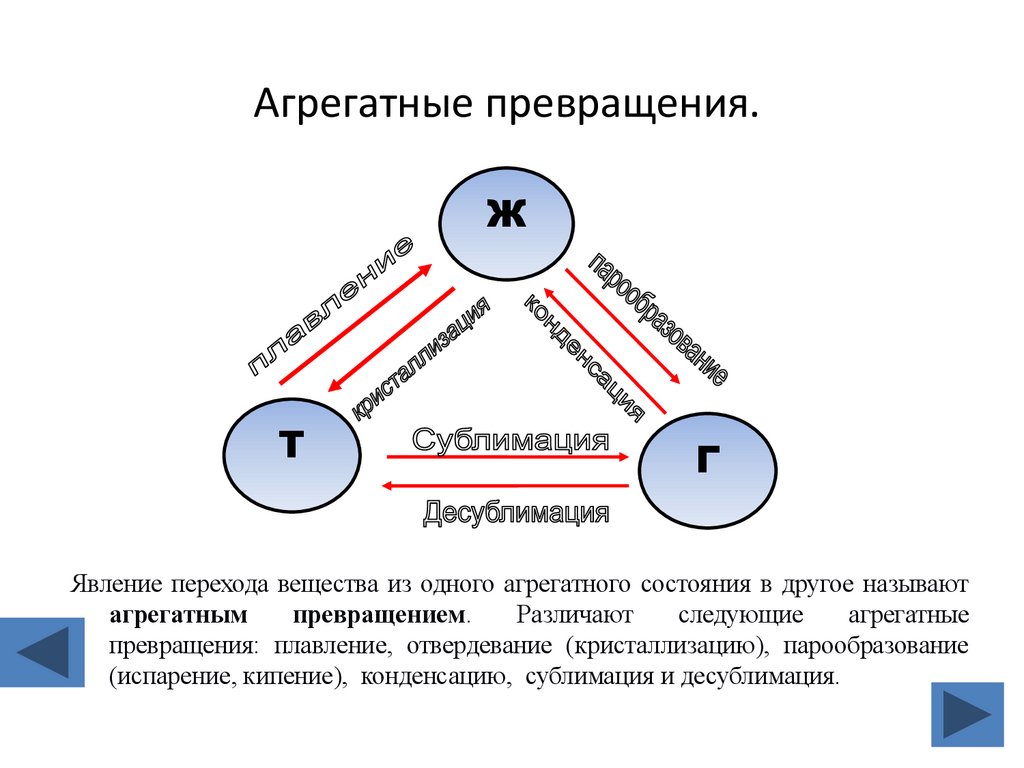
4. Агрегатные превращения.
ЖТ
Г
Явление перехода вещества из одного агрегатного состояния в другое называют
агрегатным
превращением.
Различают
следующие
агрегатные
превращения: плавление, отвердевание (кристаллизацию), парообразование
(испарение, кипение), конденсацию, сублимация и десублимация.
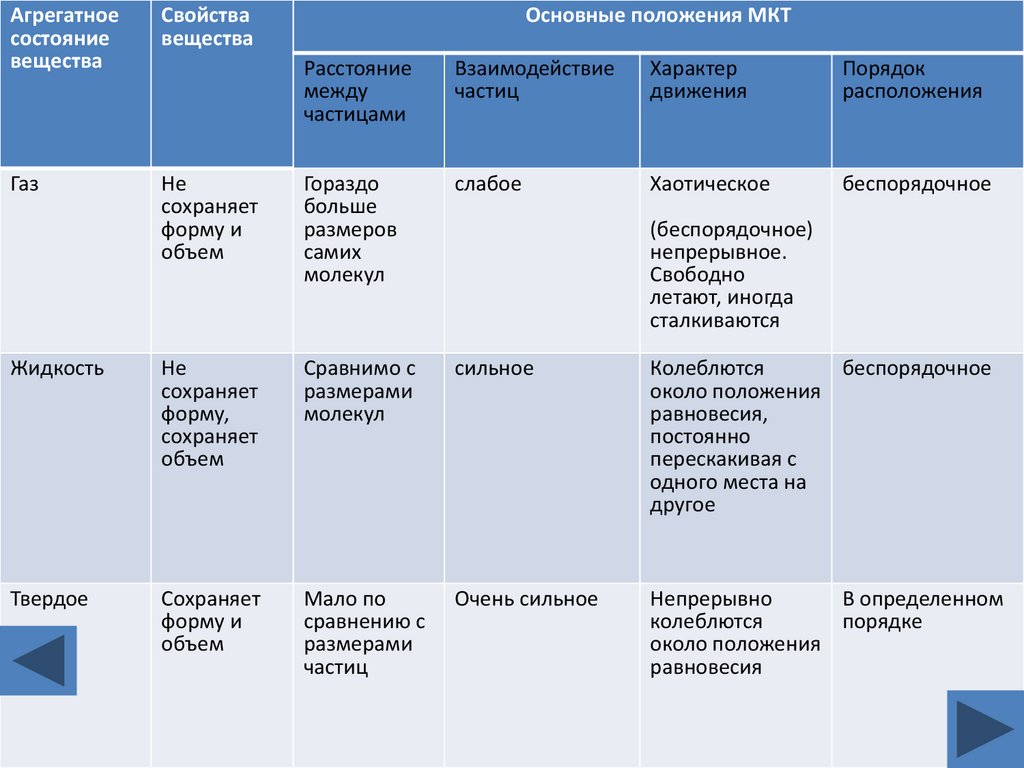
5.
Агрегатноесостояние
вещества
Свойства
вещества
Газ
Основные положения МКТ
Расстояние
между
частицами
Взаимодействие
частиц
Характер
движения
Порядок
расположения
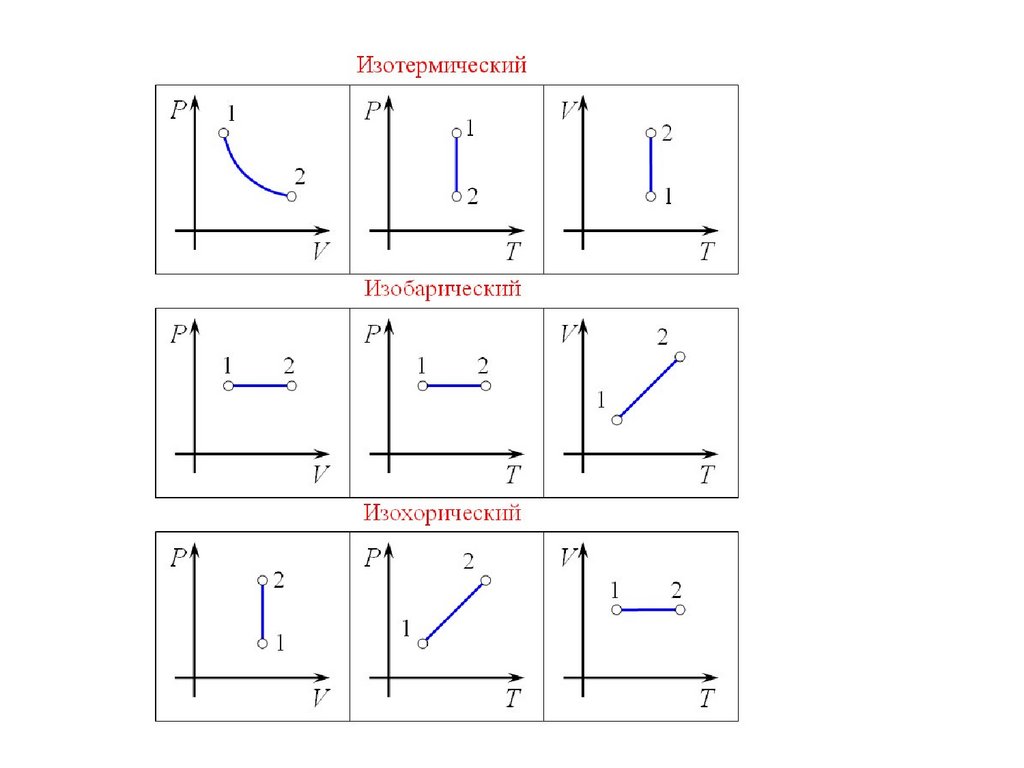
Не
сохраняет
форму и
объем
Гораздо
больше
размеров
самих
молекул
слабое
Хаотическое
беспорядочное
Жидкость
Не
сохраняет
форму,
сохраняет
объем
Сравнимо с
размерами
молекул
сильное
Колеблются
беспорядочное
около положения
равновесия,
постоянно
перескакивая с
одного места на
другое
Твердое
Сохраняет
форму и
объем
Мало по
сравнению с
размерами
частиц
Очень сильное
Непрерывно
В определенном
колеблются
порядке
около положения
равновесия
(беспорядочное)
непрерывное.
Свободно
летают, иногда
сталкиваются
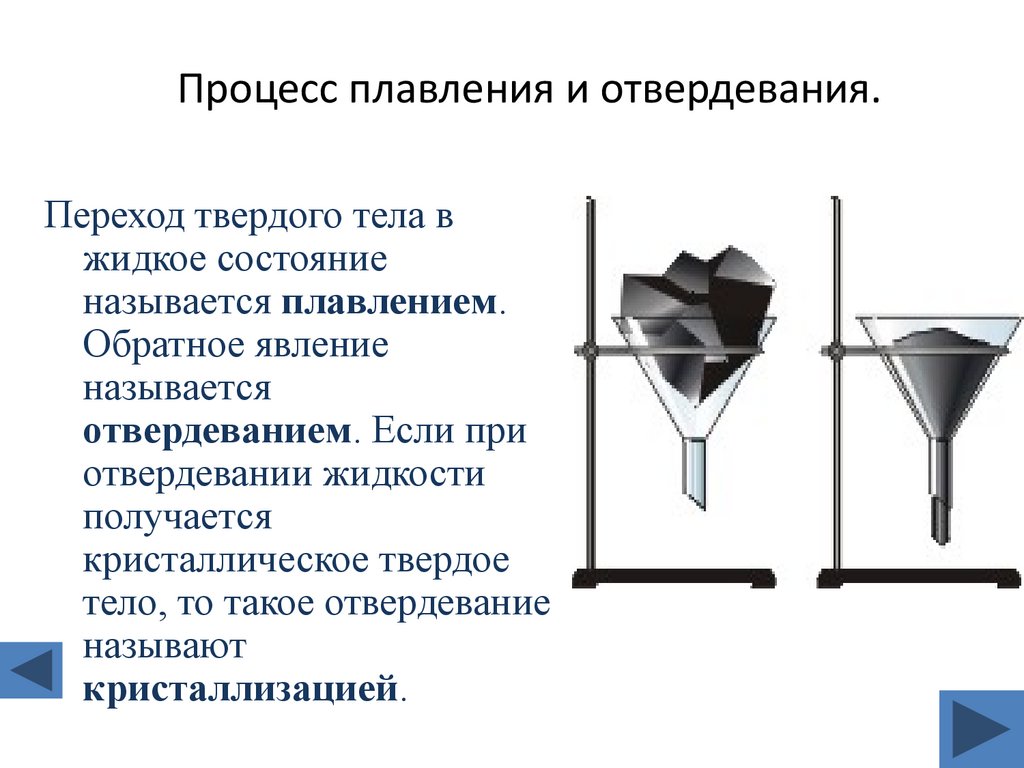
6. Процесс плавления и отвердевания.
Переход твердого тела вжидкое состояние
называется плавлением.
Обратное явление
называется
отвердеванием. Если при
отвердевании жидкости
получается
кристаллическое твердое
тело, то такое отвердевание
называют
кристаллизацией.
7. Температура плавления и кристаллизации.
• Температурой плавления данноговещества называют температуру,
при
которой
одновременно
сосуществуют твердое и жидкое
состояния
этого
вещества.
Температура плавления не зависит
от скорости нагревания. До
окончания плавления температура
тела
и
расплава
остается
одинаковой.
• Температура,
при
которой
происходит
процесс
перехода
вещества из жидкого состояние в
твердое, называется температурой
кристаллизации.
Температуры
плавления/кристаллизации,°С
Алюминий
660
Олово
232
Вода (лед)
0
Ртуть
– 39
Глицерин
18
Свинец
327
Железо
1539
Спирт
–114
Золото
1064
Стеарин
72
Нафталин
80
Цинк
420
8.
9. Сублимация и десублимация.
• Например, графит можно нагретьдо тысячи градусов, и тем не менее
в жидкость он не превратится: он
будет СУБЛИМИРОВАТЬСЯ, т.е.
из твёрдого состояния сразу
переходить в газообразное. Все
запахи, которыми обладают
твёрдые тела, также обусловлены
возгонкой: вылетая из твёрдого
тела молекулы образуют над ним
газ (или пар), который и вызывает
ощущение запаха.
• Пример ДЕСУБЛИМАЦИИ - узоры на окнах.
10. Объяснение процесса плавления.
Жидкому состоянию вещества посравнению с твердым
кристаллическим присущи :
• большая скорость движения молекул;
• большее расстояние между
молекулами;
• отсутствие строгого расположение
молекул.
Поэтому для превращения твердого
тела в жидкость его молекулам
необходимо сообщить
дополнительную энергию.
Жидкому состоянию соответствует
большая внутренняя энергия.
11. Молекулярный механизм плавления:
При нагревании тела возрастаеткинетическая энергия колебательного
движения молекул. Она начинает
превышать их потенциальную энергию,
значит молекулы начинают свободно
перемещаться в теле, что и означает
превращение в жидкость.
12. Молекулярный механизм отвердевания:
При охлаждении расплава до температурыкристаллизации за счет уменьшения
потенциальной энергии взаимодействия частиц
среде отдается такое количество теплоты, какое
необходимо в процессе плавления твердого тела,
при этом кинетическая энергия атомов и молекул
не меняется, температура кристаллизации
вещества остается постоянной до завершения
отвердевания.
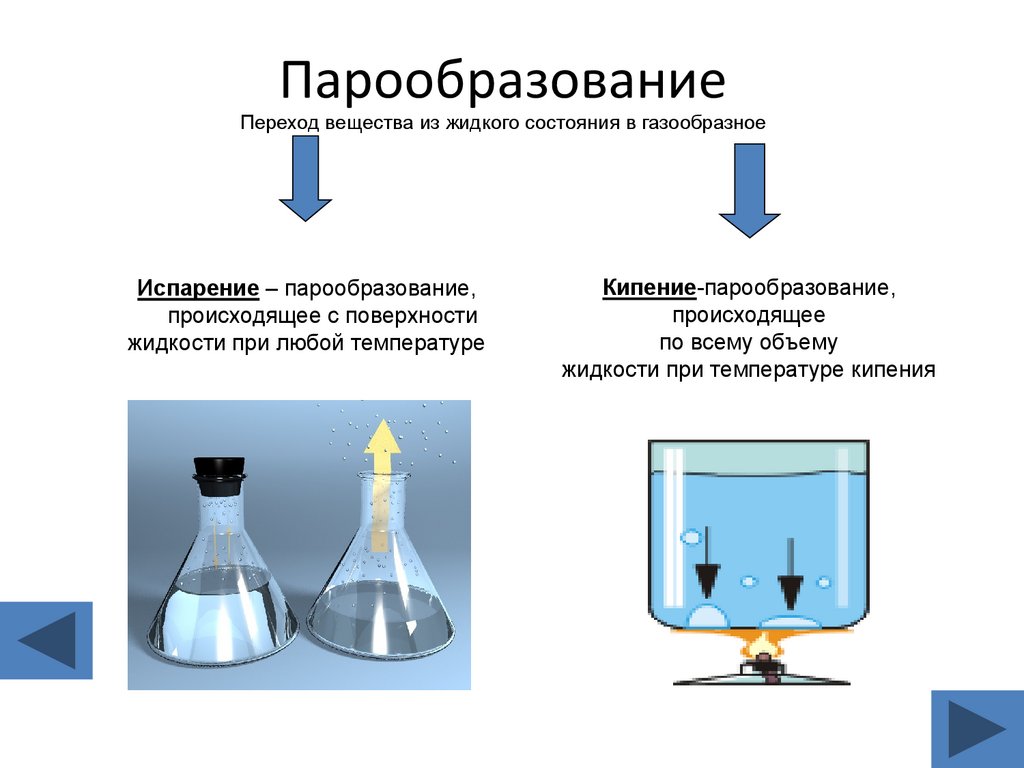
13. Парообразование Переход вещества из жидкого состояния в газообразное
Испарение – парообразование,происходящее с поверхности
жидкости при любой температуре
Кипение-парообразование,
происходящее
по всему объему
жидкости при температуре кипения
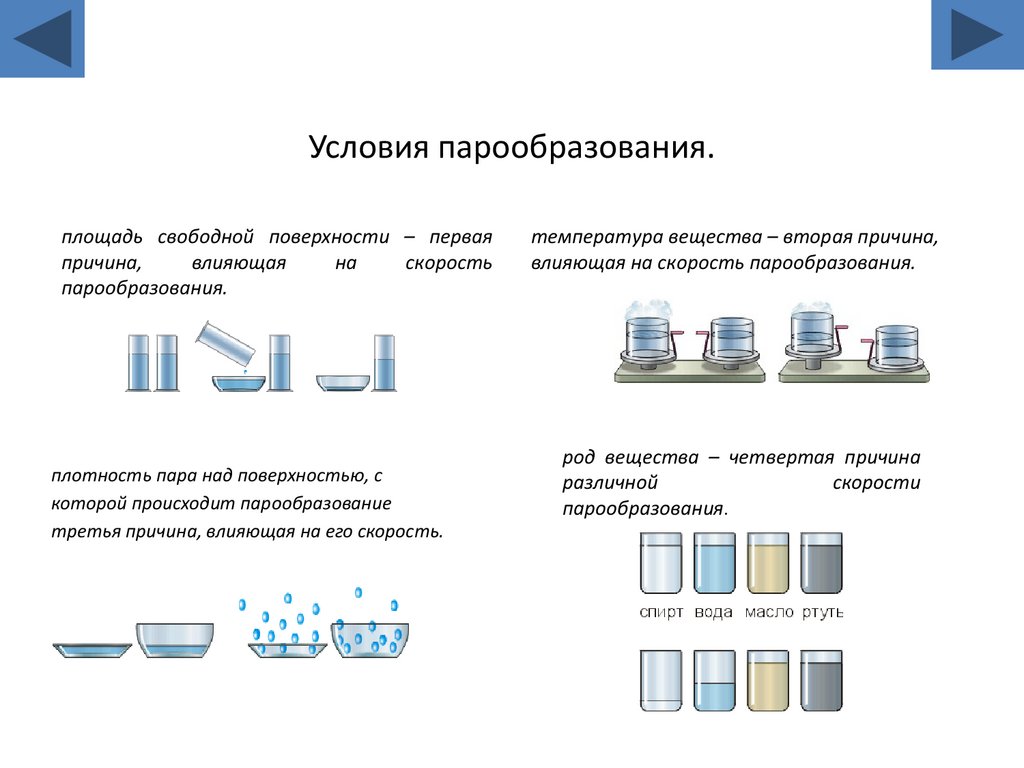
14. Условия парообразования.
площадь свободной поверхности – перваяпричина,
влияющая
на
скорость
парообразования.
плотность пара над поверхностью, с
которой происходит парообразование
третья причина, влияющая на его скорость.
температура вещества – вторая причина,
влияющая на скорость парообразования.
род вещества – четвертая причина
различной
скорости
парообразования.
15. Кипение.
Парообразование, происходящее по всемуобъему жидкости вследствие
возникновения и всплытия на
поверхность многочисленных пузырей
насыщенного пара, называется
кипением.
Кипение происходит с поглощением
теплоты.
Большая часть подводимой теплоты
расходуется на разрыв связей между
частицами вещества,
остальная часть - на работу,
совершаемую при расширении пара.
В результате энергия взаимодействия
между частицами пара становится
больше, чем между частицами жидкости,
поэтому внутренняя энергия пара
больше, чем внутренняя энергия
жидкости при той же температуре.
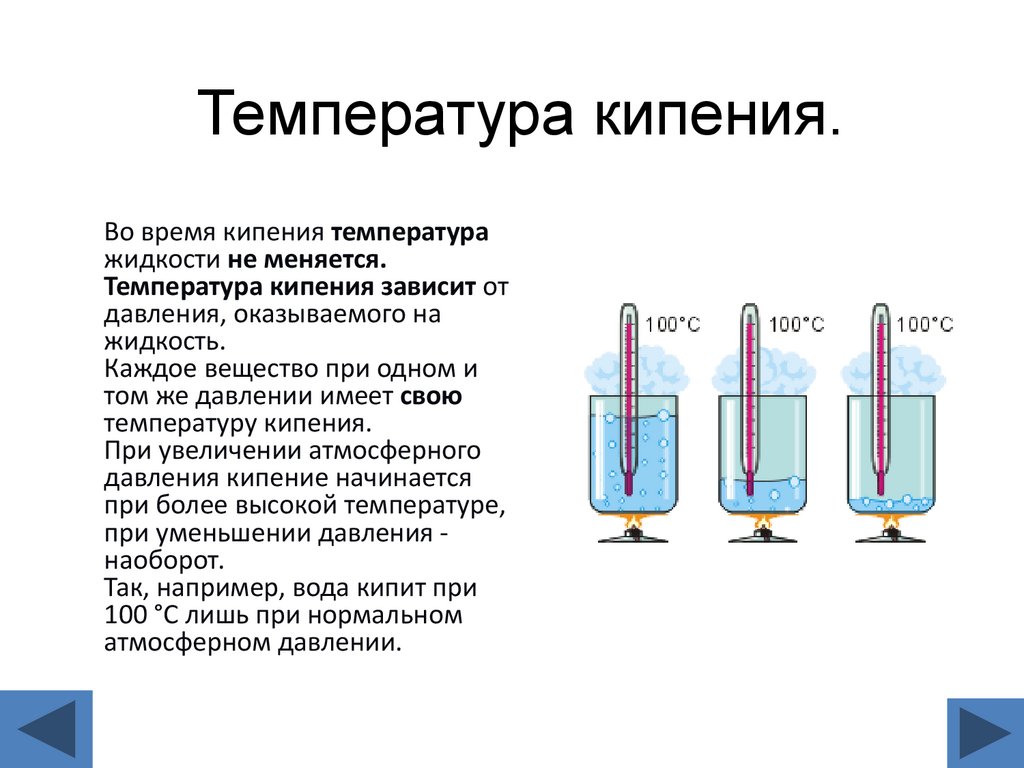
16. Температура кипения.
Во время кипения температуражидкости не меняется.
Температура кипения зависит от
давления, оказываемого на
жидкость.
Каждое вещество при одном и
том же давлении имеет свою
температуру кипения.
При увеличении атмосферного
давления кипение начинается
при более высокой температуре,
при уменьшении давления наоборот.
Так, например, вода кипит при
100 °С лишь при нормальном
атмосферном давлении.
17. Молекулярный механизм парообразования:
Наиболее быстрые молекулы, которые всегда естьв теле, имеют кинетическую энергию,
превышающую их потенциальную энергию
притяжения к другим молекулам. Оказавшись
вблизи поверхности тела, такие молекулы
способны преодолеть притяжение остальных
молекул и вылететь за пределы тела.
При конденсации происходит наоборот: при
охлаждении молекулы пара замедляются,
расстояния между молекулами уменьшаются
образуя жидкости.
18.
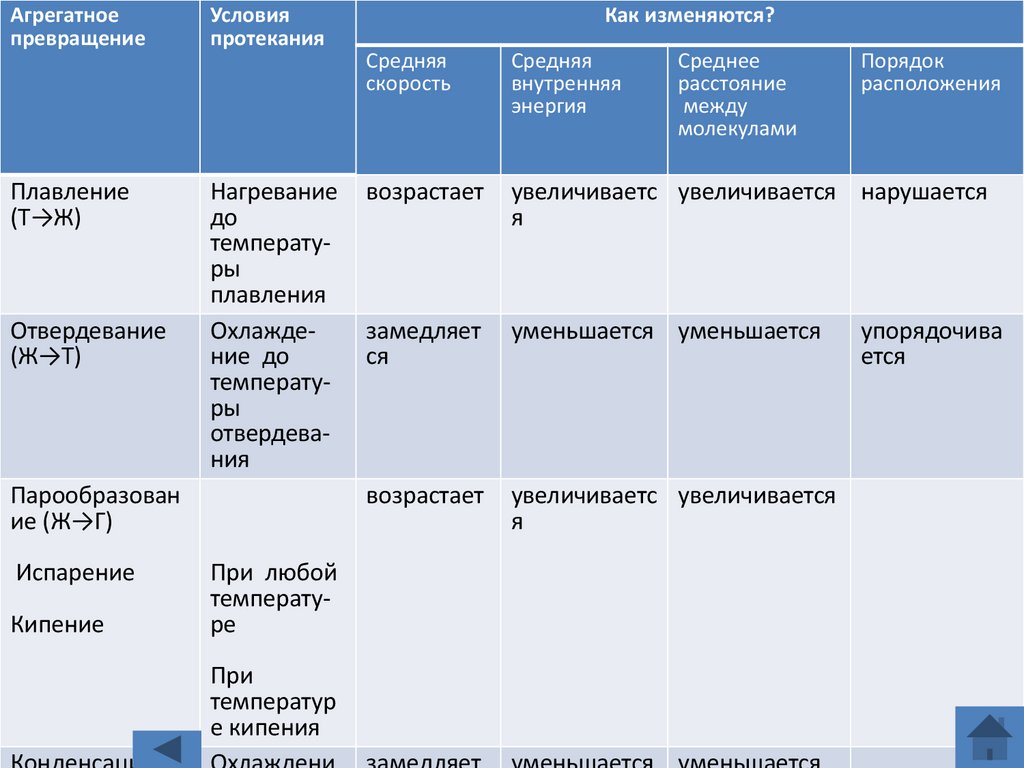
Агрегатноепревращение
Условия
протекания
Плавление
(Т→Ж)
Нагревание
до
температуры
плавления
Охлаждение до
температуры
отвердевания
Отвердевание
(Ж→Т)
Парообразован
ие (Ж→Г)
Испарение
Кипение
При любой
температуре
При
температур
е кипения
Как изменяются?
Средняя
скорость
Средняя
внутренняя
энергия
Среднее
расстояние
между
молекулами
Порядок
расположения
возрастает
увеличиваетс увеличивается нарушается
я
замедляет
ся
уменьшается уменьшается
возрастает
увеличиваетс увеличивается
я
упорядочива
ется
19. Температура и энергия теплового движения молекул
20. температура
• Температу́ра (от лат. temperatura —надлежащее смешение, нормальное
состояние) — физическая величина,
характеризующая термодинамическую
систему и количественно выражающая
интуитивное понятие о различной степени
нагретости тел.
21. температура
• До изобретения термометра людимогли судить о тепловом состоянии
только по своим непосредственным
ощущениям: тепло, холодно,
прохладно, горячо…
22.
• Историятермодинамики
началась, когда в
1592 году Галилео
Галилей создал
первый прибор для
наблюдений за
изменениями
температуры, назвав
его термоскопом.
23.
• У термоскопа Галилея небыло шкалы, он представлял
собой небольшой
стеклянный шарик с
припаянной стеклянной
трубкой. Шарик нагревали, а
конец трубки опускали в
воду. Когда шарик
охлаждался, давление в нем
уменьшалось, и вода в
трубке под действием
атмосферного давления
поднималась на
определенную высоту вверх.
При потеплении уровень
воды в трубки опускался
вниз.
24.
ИЗМЕРЕНИЕТЕМПЕРАТУРЫ.
Для измерения
температуры служат
специальные приборы термометры. Их
действие основано на
том факте, что при
изменении
температуры,
изменяются и другие
физические параметры
тела, например, такие,
как давление и объем.
25. Виды термометров
• Жидкостные термометры основаны напринципе изменения объема
жидкости, которая залита в термометр
(ртуть, спирт), при изменении
температуры окружающей среды
26. Виды термометров
Механические термометрыдействуют по тому же
принципу, что и жидкостные, но
в качестве датчика обычно
используется металлическая
спираль или лента из биметалла
Электрический термометр.
Принцип работы
электрических термометров
основан на изменении
сопротивления проводника при
изменении температуры
окружающей среды.
27.
• Газовый термометр. В конце XVIII в. Шарльустановил, что одинаковое нагревание
любого газа приводит к одинаковому
повышению давления, если при этом объем
остается постоянным. При изменении
температуры зависимость давления газа
при постоянном объёме выражается
линейным законом. А отсюда следует, что
давление газа (при V=const) можно принять
в качестве количественной меры
температуры.
• Оптические термометры. Оптические
термометры позволяют регистрировать
температуру благодаря изменению уровня
светимости.
28. Пирометр
— прибор длябесконтактного
измерения температуры
тел
( изобретен в 1692—
1761 гг.).
29. Термометр Фаренгейта
• В 1714 годуголландский ученый
Фаренгейт сделал
ртутный термометр.
• Он поместил термометр в
смесь льда и поваренной
соли и обозначил высоту
столбика ртути за 0
градусов. Следующей
точкой у Фаренгейта была
температура
человеческого тела – 96
градусов. Сам
изобретатель определял
вторую точку как
«температуру под мышкой
здорового англичанина»
30. Термометр Цельсия
• шведский астрономАндерс Цельсий
использовал ртутный
термометр Фаренгейта
с собственной шкалой,
где температура
кипения воды была
принята за 100
градусов, а таяния
льда – за 0 градусов
31. Термометр Кельвина (Абсолютная шкала температур)
• введена англ. физикомУ. Кельвином
- нет отрицательных
температур
32. Термометр Реомюра
• В 1730 годуфранцузский физик Р.
Реомюр предложил
спиртовой термометр
с постоянными
точками таяния льда
(0 °R) и кипения воды
(80 °R).
33. Шкала температур
34.
В технике, медицине,метеорологии и в быту в
качестве единицы
измерения температуры
используется шкала Цельсия.
В настоящее время в системе
СИ термодинамическую
шкалу Цельсия определяют
через шкалу Кельвина:
t(°С) = Т(К) — 273,15 (точно),
т. е. цена одного деления в
шкале Цельсия равна цене
деления шкалы Кельвина.
35.
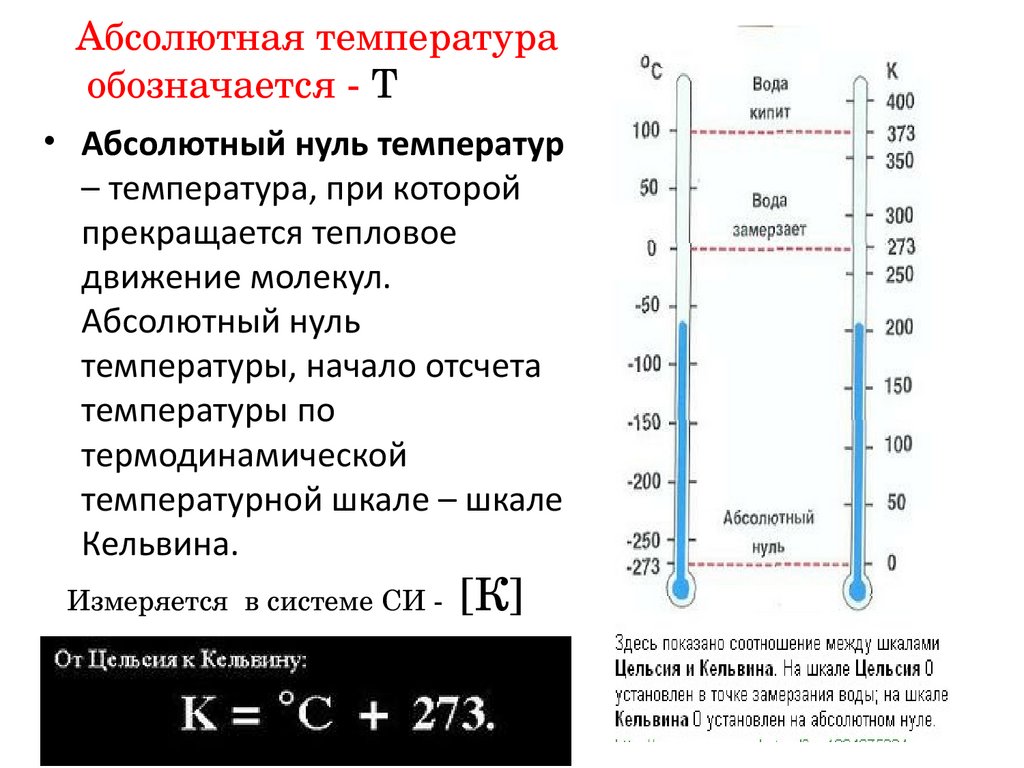
Абсолютная температураобозначается - Т
• Абсолютный нуль температур
– температура, при которой
прекращается тепловое
движение молекул.
Абсолютный нуль
температуры, начало отсчета
температуры по
термодинамической
температурной шкале – шкале
Кельвина.
Измеряется в системе СИ - [К]
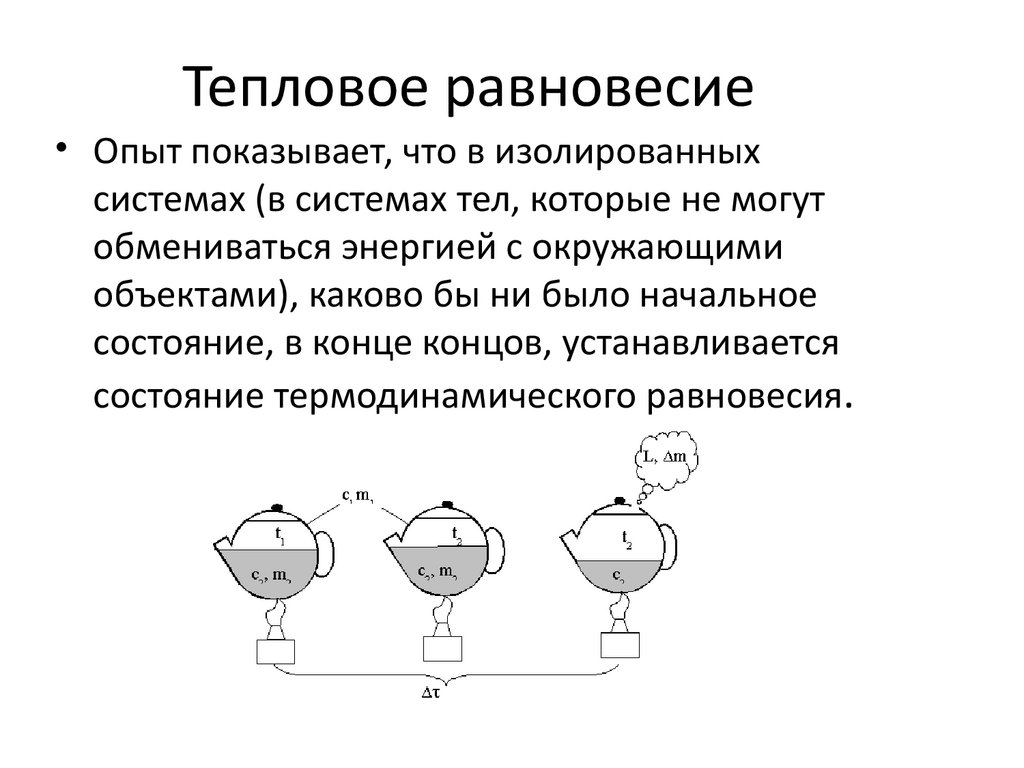
36. Тепловое равновесие
• Опыт показывает, что в изолированныхсистемах (в системах тел, которые не могут
обмениваться энергией с окружающими
объектами), каково бы ни было начальное
состояние, в конце концов, устанавливается
состояние термодинамического равновесия.
37. Тепловое равновесие
• Термодинамическое равновесие —состояние системы, при котором
остаются неизменными по времени
макроскопические величины этой
системы (температура, давление,
объём) в условиях изолированности от
окружающей среды.
38. Связь кинетической энергии и температуры
2p
n Ек
3
pV
2
Eк
N
3
pV
kT
N
Давление газа - основное
уравнение МКТ
39. Постоянная Больцмана
k = 1,38 10 Дж/К-23
связывает температуру в энергетических
единицах с температурой Т в кельвинах.
40. Уравнение состояния идеального газа
• p — давление
• V—объём
• R— универсальная
газовая постоянная
• R = 8,31 Дж⁄моль∙К
• T— абсолютная
p1температура,
V1 p2V2 К.
T1
T2
const
41.
Количественная зависимость между двумяпараметрами газа при фиксированном
значении третьего параметра называют
газовыми законами.
Процессы, протекающие при неизменном значении одного
из параметров
T,V или p
называют изопроцессами.
42.
ИДЕАЛЬНЫЙ ГАЗИзвестно, что частицы в газах, в отличие от
жидкостей и твердых тел, располагаются друг
относительно друга на расстояниях,
существенно превышающих их собственные
размеры. В этом случае взаимодействие
между молекулами пренебрежимо мало и
кинетическая энергия молекул много больше
энергии межмолекулярного взаимодействия.
Для выяснения наиболее общих свойств,
присущих всем газам, используют упрощенную
модель реальных газов идеальный газ
43.
Идеальный газ(модель)
Реальный газ
1. Совокупность большого числа молекул
массой m0, размерами молекул
пренебрегают (принимают молекулы
за материальные точки).
2. Молекулы находятся на больших
расстояниях друг от друга и движутся
хаотически.
3. Молекулы взаимодействуют по
законам упругих столкновений ,
силами притяжения между
молекулами пренебрегают.
4. Скорости молекул разнообразны, но
при определенной температуре
средняя скорость молекул остается
постоянной.
1. Молекулы реального газа не
являются точечными
образованиями, диаметры
молекул лишь в десятки раз
меньше расстояний между
молекулами.
2. Молекулы не взаимодействуют по законам
упругих столкновений.
44.
p constИзобарный процесс
p1V1 p2V2
const
T1
T2
V1
V2
const
T1
T2
45.
p constДля данной массы данного вещества,
отношение объема газа к его
температуре
постоянно, если давление не меняется.
Закон Гей-Люссака
46.
V constИзохорный процесс
p1V1 p2V2
const
T1
T2
p1
p2
const
T1
T2
47.
V constДля данной массы данного вещества,
отношение давления газа к
температуре
постоянно, если объем не меняется.
Закон Шарля
48.
T constИзотермический процесс
p1V1 p2V2
const
T1
T2
p1V1 p2V2 const
49.
T constДля данной массы данного
вещества, произведение давления
газа на его объем постоянно, если
температура газа не меняется.
Закон Бойля - Мариотта
50.
51. Коэффициент полезного действия (КПД) тепловых двигателей
52.
Развитие техники зависит от уменияиспользовать громадные запасы внутренней
энергии. Использовать эту энергию - это
значит совершать за ее счет полезную работу.
Рассмотрим источники, которые совершают
работу за счет внутренней энергии.
53.
54.
Всяли тепловая энергия превращается в
тепловых двигателях в механическую энергию?
Любой тепловой двигатель превращает в
механическую энергию только часть той
энергии, которая выделяется топливом.
Для характеристики экономичности различных
двигателей введено понятие КПД
(коэффициент полезного действия) двигателя.
55.
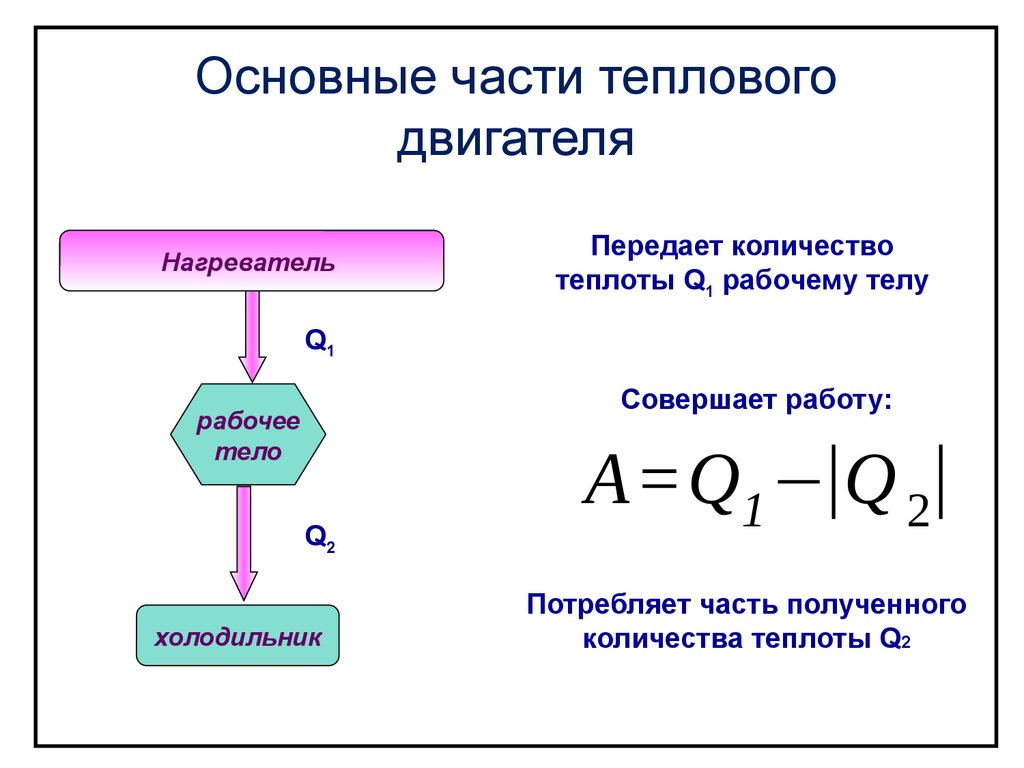
Основные части тепловогодвигателя
Нагреватель
Передает количество
теплоты Q1 рабочему телу
Q1
Совершает работу:
рабочее
тело
Q2
холодильник
A=Q1 −|Q 2|
Потребляет часть полученного
количества теплоты Q2
56.
КПД замкнутого цикла|Q 2|
A Q 1 −|Q 2|
η=
=
=1−
|Q 1|
Q1
Q1
Q1 – количество теплоты полученное от нагревания
Q1>Q2
Q2 - количество теплоты отданное холодильнику
Q 2<Q 1
A’ = Q 1- |Q 2| - работа совершаемая двигателем за цикл
η<1
57.
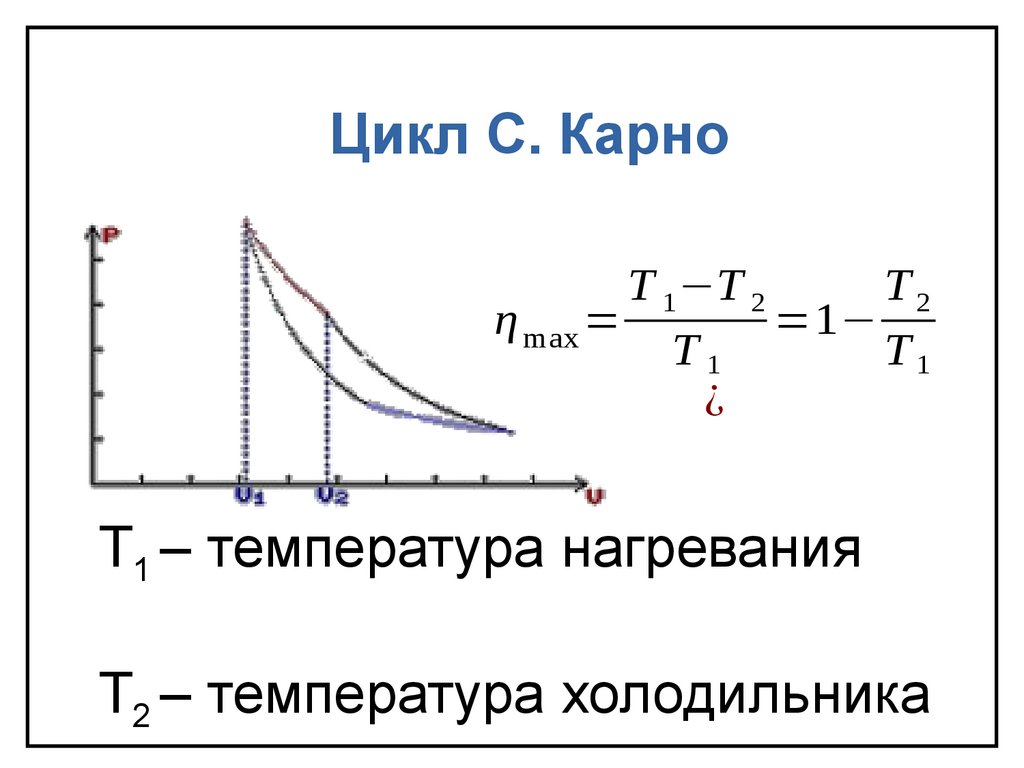
Цикл C. КарноT 1 −T 2
T2
η max =
=1−
T1
T1
¿
T1 – температура нагревания
Т2 – температура холодильника
58.
Виды тепловых двигателейПаровой
двигатель
Двигатель
внутреннего
сгорания
Паровая
турбина
Дизельный
двигатель
Газовая
турбина
Реактивный
двигатель
59.
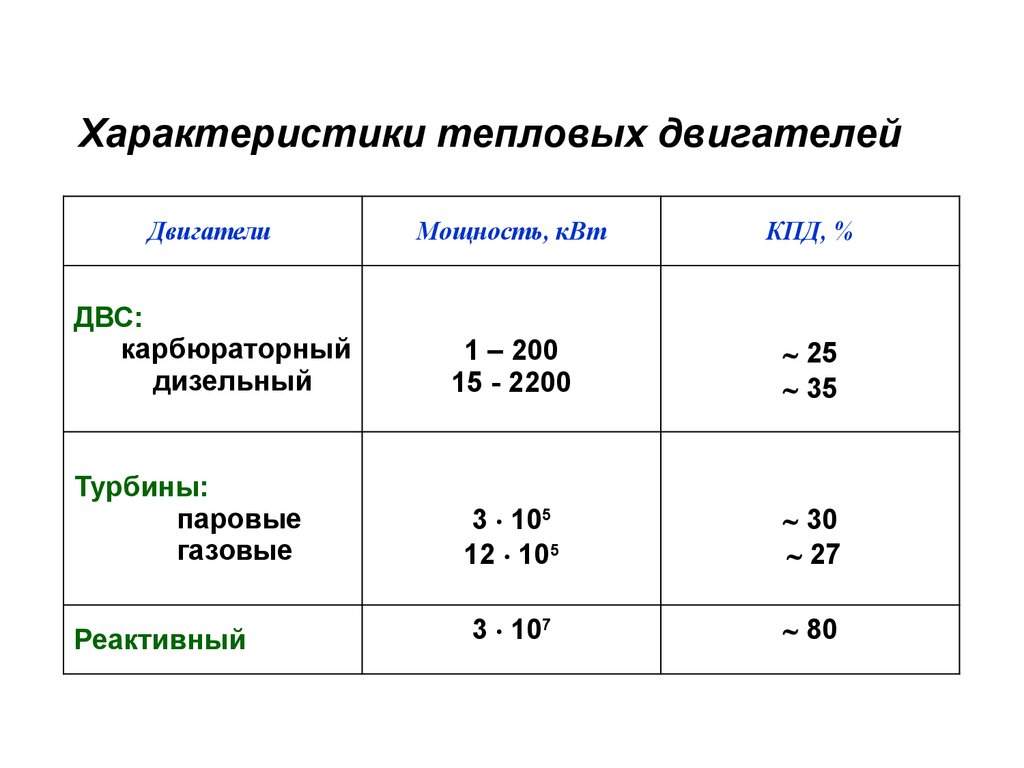
Характеристики тепловых двигателейДвигатели
Мощность, кВт
КПД, %
ДВС:
карбюраторный
дизельный
1 – 200
15 - 2200
25
35
Турбины:
паровые
газовые
3 105
12 105
30
27
Реактивный
3 107
80
60.
КПД теплового двигателя= (А / Q1 ) 100%
= А п/ Аз
= ( Q1-Q2 / Q1 ) 100%
= А п/ Аз
ВСЕГДА!
= А п/ Аз
00%

































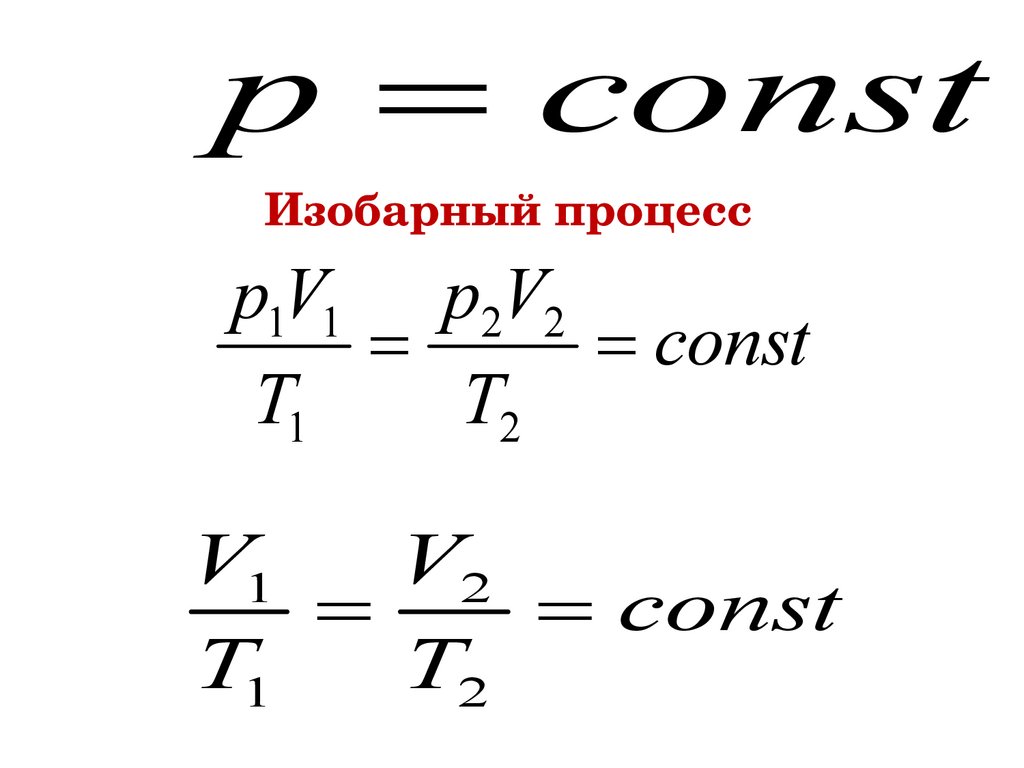



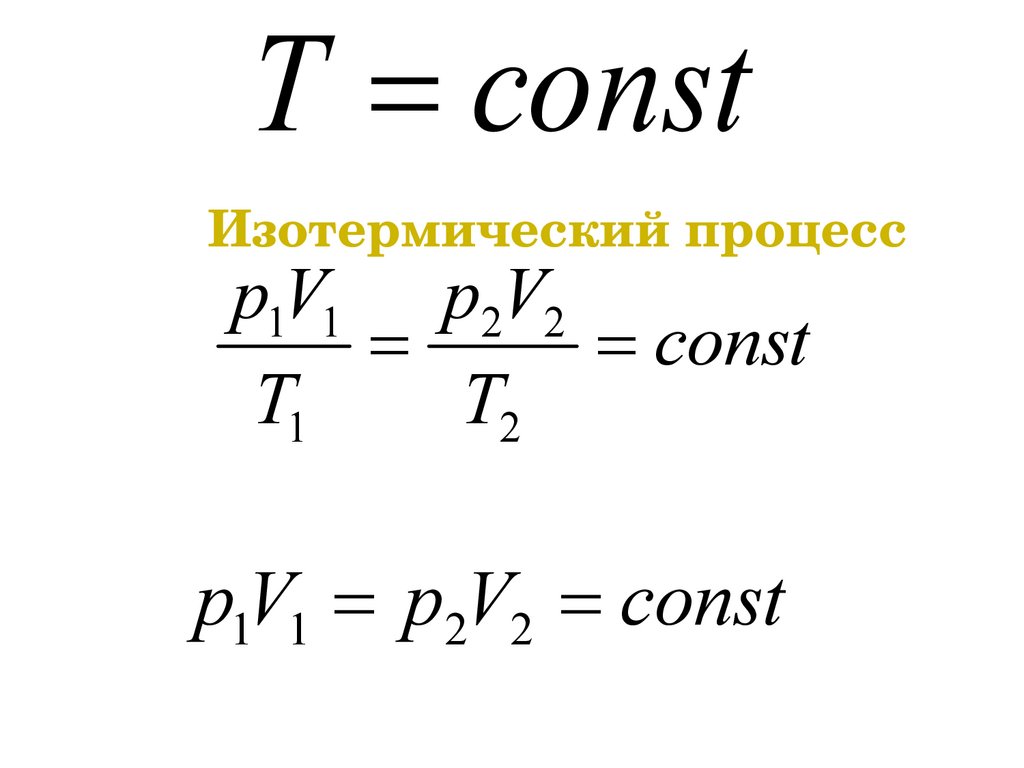








 Физика
Физика








