Похожие презентации:
слайд ГИдролиз 2025
1. Тақырыбы: Тұздар гидролизі «Химия» пәні
Дайындаған:Х және ХТ кафедрасыныңаға оқытушысы Карилхан А
..
2. Жоспар
• Гидролиз;• Жіктелуі;
• Қасиеттері;
• Мысалдар.
• https://himya.ru/
• https://himya.kz
• https://scholarzhub.com/
3.
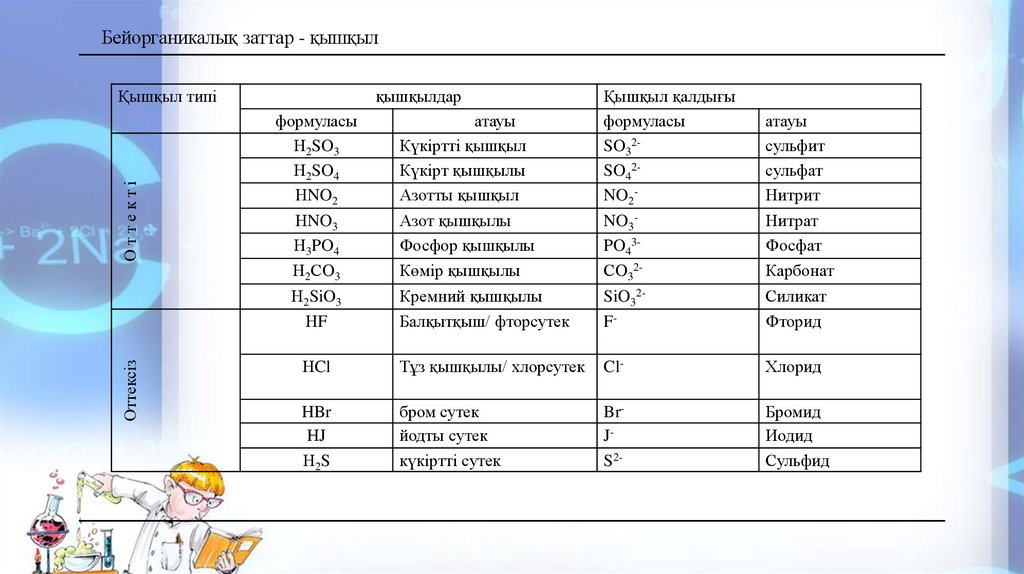
Бейорганикалық заттар - қышқылОттексіз
Оттекті
Қышқыл типі
қышқылдар
формуласы
Н2SO3
Н2SO4
НNO2
НNO3
Н3PO4
Н2СO3
Н2SiO3
НF
атауы
Күкіртті қышқыл
Күкірт қышқылы
Азотты қышқыл
Азот қышқылы
Фосфор қышқылы
Көмір қышқылы
Кремний қышқылы
Балқытқыш/ фторсутек
Қышқыл қалдығы
формуласы
SO32SO42NO2NO3PO43СO32SiO32F-
НCl
Тұз қышқылы/ хлорсутек
Cl-
Хлорид
HBr
HJ
Н2S
бром сутек
йодты сутек
күкіртті сутек
BrJS2-
Бромид
Иодид
Сульфид
атауы
сульфит
сульфат
Нитрит
Нитрат
Фосфат
Карбонат
Силикат
Фторид
4.
5.
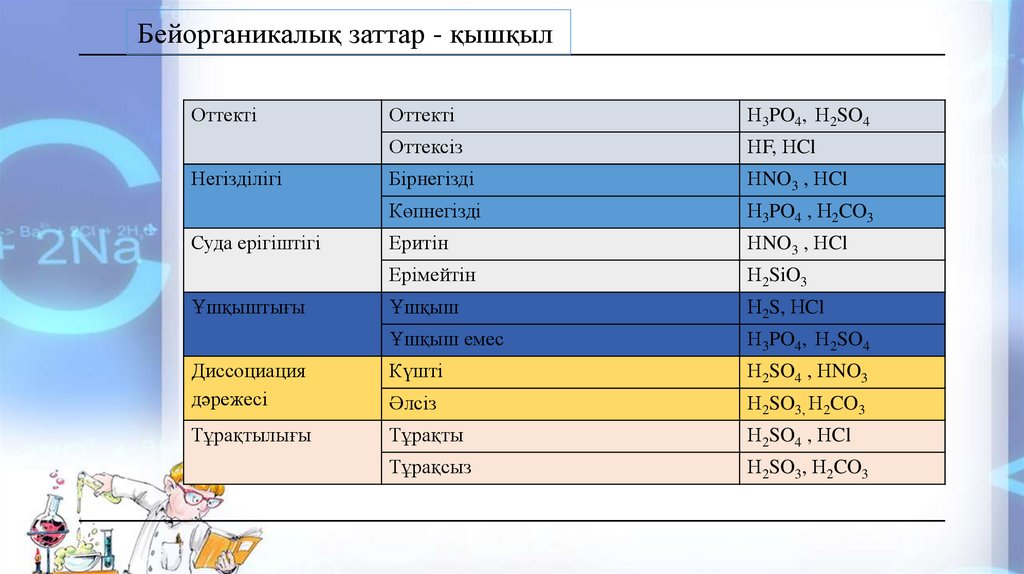
Бейорганикалық заттар - қышқылОттекті
Оттекті
Н3PO4, Н2SO4
Оттексіз
НF, НCl
Бірнегізді
НNO3 , НCl
Көпнегізді
Н3PO4 , Н2CO3
Еритін
НNO3 , НCl
Ерімейтін
Н2SiO3
Ұшқыш
Н2S, НCl
Ұшқыш емес
Н3PO4, Н2SO4
Диссоциация
дәрежесі
Күшті
Н2SO4 , НNO3
Әлсіз
Н2SO3, Н2CO3
Тұрақтылығы
Тұрақты
Н2SO4 , НCl
Тұрақсыз
Н2SO3, Н2CO3
Негізділігі
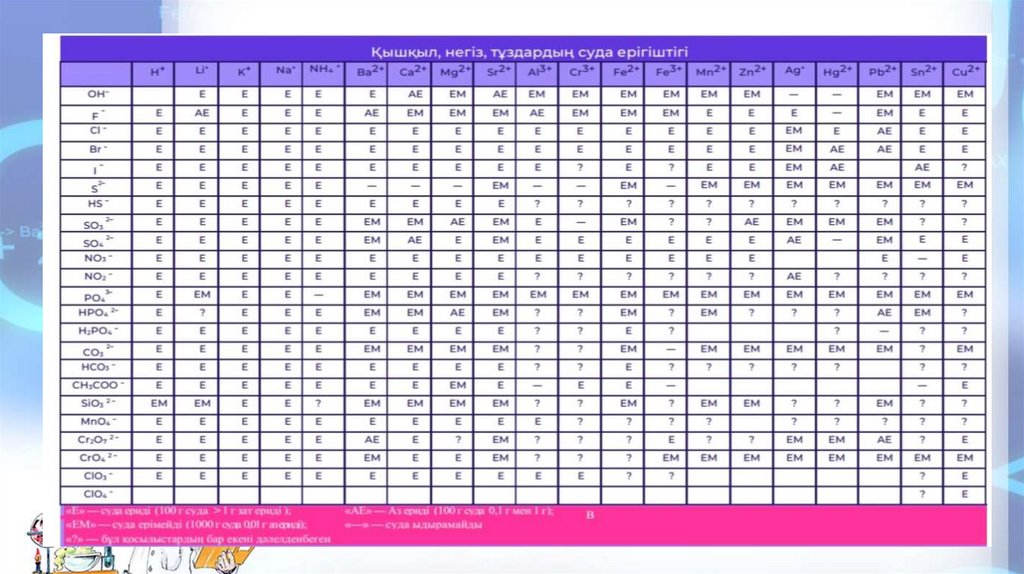
Суда ерігіштігі
Ұшқыштығы
6.
Қышқылдар қасиеттері7.
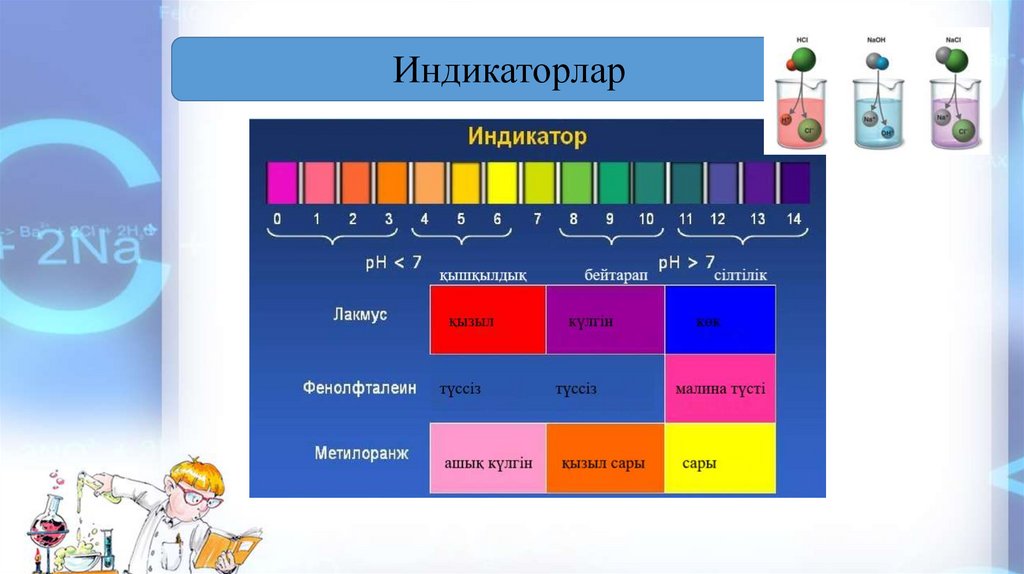
Индикаторлар8.
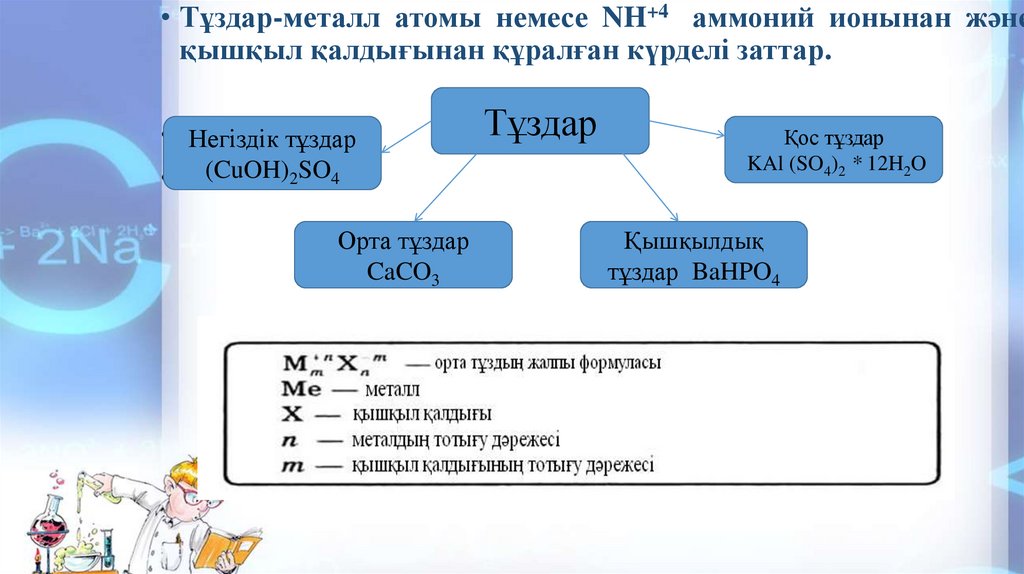
• Тұздар-металл атомы немесе NH+4 аммоний ионынан жәнеқышқыл қалдығынан құралған күрделі заттар.
• Негіздік тұздар
• ∙ (CuOH)2SO4
Орта тұздар
CaCO3
Тұздар
Қос тұздар
KAl (SO4)2 * 12H2O
Қышқылдық
тұздар BaHPO4
9.
10. Тұз ерітінділерінің гидролизі
Тұздар гидролизі деп тұздың сумен әрекеттесуін атайдыжәне оның барысында кейбір өзгерістерге ұшырайды:
• ортаның рН көрсеткіші қышқылдық немесе сілтілі ортаға
ығысады;
• әлсіз электролиттің молекуласы немесе ионы (катион
немесе анион) түзіледі.
11. Гидролиз түрлері
12.
Гидролиз типтері13.
ТҰЗДАР ГИДРОЛИЗІНегіз
Тұз түзушілер
Катиондар
Қышқыл
1. Күшті
Күшті
2. Күшті
Әлсіз
3. Әлсіз
Күшті
4. Әлсіз
Әлсіз
Сілтілік және
жер сілтілік
металдар
катиондары
Сілтілік және
жер сілтілік
металдар
катиондары
аниондар
SO42-; NО3-; CI; Br-; J-; CIO4-;
MnO4- и др.
Гидролиз
өнімдері
Реакция
ортасы,
pH мәні
-
бейтарап
pH = 7
Қышқылдық
сілтілік
тұздар,
pH > 7
иондары:
HSO3-; HPO42-;
H2PO4- т.б.
Cu2+; Fe3+; Zn2+; SO42-; NО3-; CI- Негіздік тұздар қышқылдық
Mn2+; AI3+; Ni3+ ; Br-; J-; CIO4-;
иондарыы:
pH < 7
MnO4- и др.
[Cu(OH)]+;
[Fe(OH)]2+ т.б.
Cu2+; Fe3+; Zn2+; CO32-; SO32-; S2Негіз және
бейтарап
Mn2+; AI3+; Ni3+ ; PO43-; CN- т.б.
қышқыл
pH ≈ 7
CO32-; SO32-; S2; PO43-; CN- и
др.
14.
Анион бойынша гидролизЛитий ортофосфатының гидролизінің молекулалық және иондық теңдеулерін жазыңыз.
1) Li3PO4, рН (рН ≥7, рН ≤ 7) мәні қандай, ортасы қандай?
Шешімі:
1) Li3PO4 – күшті негіз бен әлсіз қышқылдан түзілген тұз, анион бойынша гидролиз
жүріледі
Диссоциация:
Li3PO4 → 3Li+ + PO43Li3PO4
LiOH
H3PO4
күшті негіз
әлсіз қышқыл
I саты
PO43- + HOH HPO42- + OH—, pH > 7
Li3PO4 + HOH Li2HPO4+ LiOH
II саты
HPO42- + HOH H2PO4— + OH—, pH > 7
Li2HPO4+ HOH LiH2PO4 + LiOH
III саты
H2PO4— + HOH H3PO4 + OH—, pH > 7
LiH2PO4+ HOH H3PO4 + LiOH
15.
Катион бойынша гидролиз2) CuCl2 — әлсіз негіз бен күшті қышқылдан түзілген тұз, катион бойынша гидролиз
Диссоциация:
CuCl2 → Cu2+ + 2Cl—
CuCl2
Cu(OH)2
HСl
әлсіз негіз
күшті қышқыл
I саты
Cu2+ + HOH ↔ (CuOH)+ + H+, pH<7
CuCl2 + HOH ↔ CuOHCl + HCl
II саты
(CuOH)+ + HOH ↔ Cu(OH)2 + H+, pH<7
(CuOH)Cl + HOH↔ Cu(OH)2 + HCl
16.
Катион бойынша гидролизCr2(SO4)3 гидролизі
1) Cr2(SO4)3 – әлсіз негіз бен күшті қышқылдан түзілген тұз, катион бойынша гидролиз
Диссоциация:
Cr2(SO4)3 → 2Cr3+ + 3SO42-
Сr2(SO4)3
Cr(OH)3
H2SO4
Әлсіз негіз
күшті қышқыл
I саты
Cr3+ + HOH ↔ (CrOH)2+ + H+, pH<7
Cr2(SO4)3 + 2HOH ↔ 2(CrOH)SO4 + H2SO4
II саты
(CrOH)2+ + HOH ↔ Cr(OH)2+ + H+, pH<7
2(CrOH)SO4+ HOH ↔ (Cr(OH)2)2SO4 + H2SO4
III саты
Cr(OH)2++ HOH ↔ Cr(OH)3+ H+, pH<7
(Cr(OH)2)2SO4+ 2HOH ↔ 2Cr(OH)3+ H2SO4
17.
Анион бойынша гидролиз2) Na2SiO3 – күшті негіз бен әлсіз қышқылдан түзілген тұз, анион бойынша гидролиз
Диссоциация:
Na2SiO3 → 2Na+ + SiO32-
Na2SiO3
NaOH
H2SiO3
күшті негіз
әлсіз қышқыл
I саты
SiO32- + HOH = HSiO3— + OH—, pH > 7
Na2SiO3 + HOH = NaHSiO3 + NaOH
II саты
HSiO3— + HOH = H2SiO3 + OH—, pH > 7
NaHSiO3 + HOH = H2SiO3 + NaOH
18.
Катион бойынша гидролизPb(NO3)2,
катион бойынша гидролиз
1) Pb(NO3)2 – әлсіз негіз бен күшті қышқылдан түзілген тұз, катион бойынша гидролиз
Диссоциация:
Pb(NO3)2 → Pb2+ + 2NO3—
Pb(NO3)2
Pb(OH)2
әлсіз негіз
HNO3
күшті қышқыл
I саты
Pb2+ + HOH ↔ (PbOH)+ + H+, pH <7
Pb(NO3)2 + HOH ↔ (CrOH)NO3 + HNO3
II саты
(PbOH)+ + HOH ↔ Pb(OH)2 + H+, pH <7
(CrOH)NO3 + HOH ↔ Pb(OH)2 + HNO3
2) NaNO3 – күшті негіз бен күшті қышқылдан түзілген тұз, гидролизге ұшырамайды, рН ≈ 7
NaNO3
NaOH
күшті негіз
HNO3
күшті қышқыл
19.
Анион бойынша гидролизK2SO3 — күшті негіз бен әлсіз қышқылдан түзілген тұз, анион бойынша гидролиз
Диссоциация:
K2SO3 → 2K+ + SO32-
I саты
SO32- + HOH HSO3— + OH—, pH > 7
K2SO3 + HOH KHSO3 + KOH
II саты
HSO3— + HOH H2SO3 + OH—, pH > 7
KHSO3 + HOH H2SO3 + KOH
20.
Определите константу, степень гидролиза и pH 0,1 М раствора NH4Cl. KNH4Cl =1,8·10-5
шешімі:
NH4Cl → NH4+ + Cl— диссоциация
Гидролиз катион бойынша:
NH4+ + HOH ↔ NH4OH + Н+
NH4 Сl + HOH ↔ NH4OH + Н+
21.
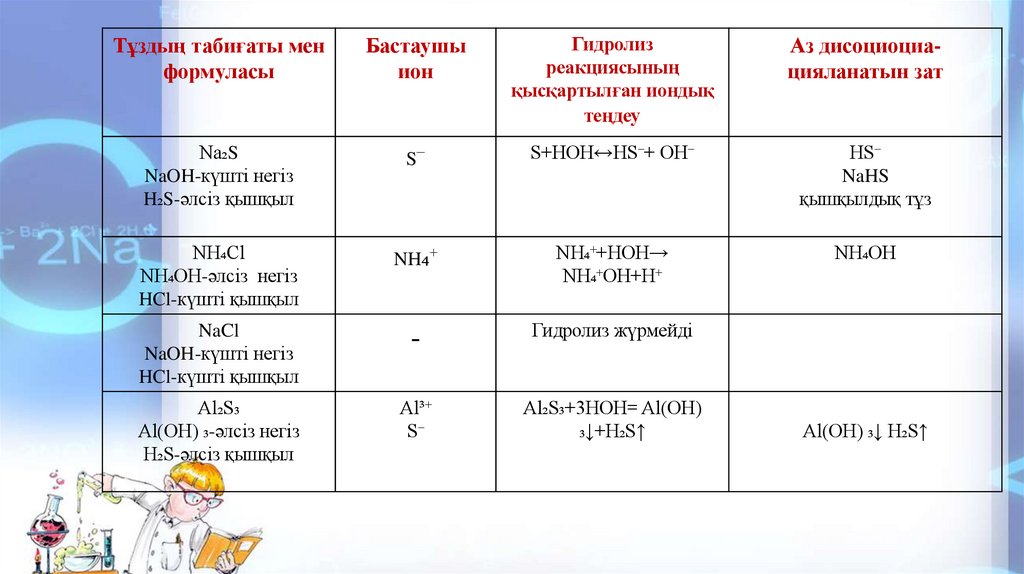
Тұздың табиғаты менформуласы
Бастаушы
ион
Гидролиз
реакциясының
қысқартылған иондық
теңдеу
Аз дисоциоциацияланатын зат
Na₂S
NaOH-күшті негіз
H₂S-әлсіз қышқыл
S⁻
S+HOH↔HS⁻+ OH⁻
HS⁻
NaHS
қышқылдық тұз
NH₄Cl
NH₄OH-әлсіз негіз
HCl-күшті қышқыл
NH₄⁺
NH₄⁺+HOH→
NH₄⁺OH+H⁺
NH₄OH
NaCl
NaOH-күшті негіз
HCl-күшті қышқыл
-
Гидролиз жүрмейді
Al₂S₃
Al(OH) ₃-әлсіз негіз
H₂S-әлсіз қышқыл
Al³⁺
S⁻
Al₂S₃+3HOH= Al(OH)
₃↓+H₂S↑
Al(OH) ₃↓ H₂S↑
22.
Гидролиз қорытынды1. Әлсіз негізбен күшті қышқылдан түзілген тұздар гидролизденеді.
NH4CI + HOH ↔ NH4OH + HCI қайтымды процесс.
NH4+ + CI- + HOH ↔ NH4OH + H+ + CINH4+ + HOH ↔ NH4OH + H+
орта қышқылдық
Ортаның өзгеруі тұз ионының сумен әрекеттесуінің нәтижесінде пайда болады.
2. Күшті негізбен әлсіз қышқылдан түзілген тұздар гидролизденеді
Na2 CO3 + HOH ↔ NaHCO3 + NaOH
2Na + + CO32- + HOH ↔ Na+ + HCO3- + Na + + OHCO32- + HOH ↔ HCO32- + OHОрта сілтілік
3. Әлсіз негізбен әлсіз қышқылдан түзілген тұздар гидролизденеді.
Бұл жағдайда гидролиз реакциясы соңына дейін жүріп, қышқыл мен негіз түзіледі. Яғни
гидролиз реакциясы қайтымсыз болады:
AI2S3 + 6H2O → 2AI(OH)3↓ + 3H2S↑ орта бейтарап.
4. Күшті қышқылмен күшті негізден түзілген тұздар гидролизге ұшырамайды.
23.
Кез келген ерітіндінің ортасының қышқылдығын, сілтілігін, нейтралдығынанықтайтын құрал қолданылады.
Сутектік көрсеткіш дегеніміз теріс таңбамен алынған сутегі иондарының
концентрациясының ондық логарифмін айтады.
pH = - lg [ H+] Сутектік көрсеткіш түсінігін
1909 жылы дат химигі Серенсен енгізді.
рН арқылы ерітінділердің реакциясы былай сипатталады:
нейрал рН = 7, қышқыл рН < 7, сілті рН > 7
24.
ҚорытындыКүшті негіз бен күшті қышқылдан түзілген тұз сумен әрекеттеспейді
(гидролизге ұшырамайды). Орта бейтарап қалпын сақтайды.
Әлсіз негіз және күшті қышқылдан түзілген тұз құрамындағы металл
катионы гидроксид ОН-ионымен байланысатындықтан, ерітіндіге
Н+ иондары жиналып қышқылдық орта береді.
Күшті негіз бен әлсіз қышқылдан түзілген тұз анионы сутек катионымен
Н+ байланысатындықтан, ерітіндіге ОН- иондары жиналып сілтілік орта
береді.
Әлсіз негіз бен әлсіз қышқылдан түзілген тұз құрамындағы иондар
Н+ және ОН- иондарымен байланысатындықтан, гидролиздену реакциясы
соңына дейін жүреді.
25. Бақылау сұрақтары
1. Гидролиз деген не?2. Тұздарды атаңдар.Тұздар гидролизінің иондық және
молекулалық теңдеуін жазыңдар, реакция ортасын
анықтаңдар. K2SO3, AgNO3, Na2SiO3, FeS, К2SO4,
Na2CO3, MgCI2, K3PO4, CuNO3, KBr, Li2SiO3, K2S.



















 Химия
Химия








