Похожие презентации:
Основы МКТ
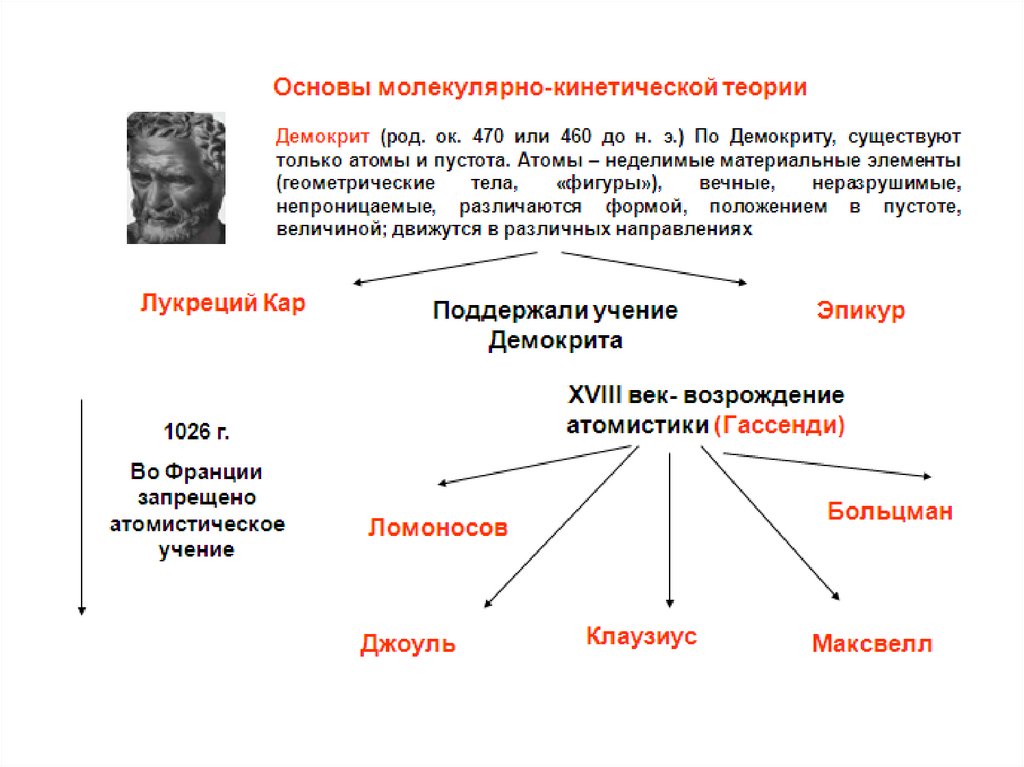
1.
Основные положения молекулярнокинетической теории (МКТ)Размеры молекул.
Масса молекул. Количество вещества
Среднеквадратичная скорость теплового
движения молекул, абсолютная температура
2.
3.
4.
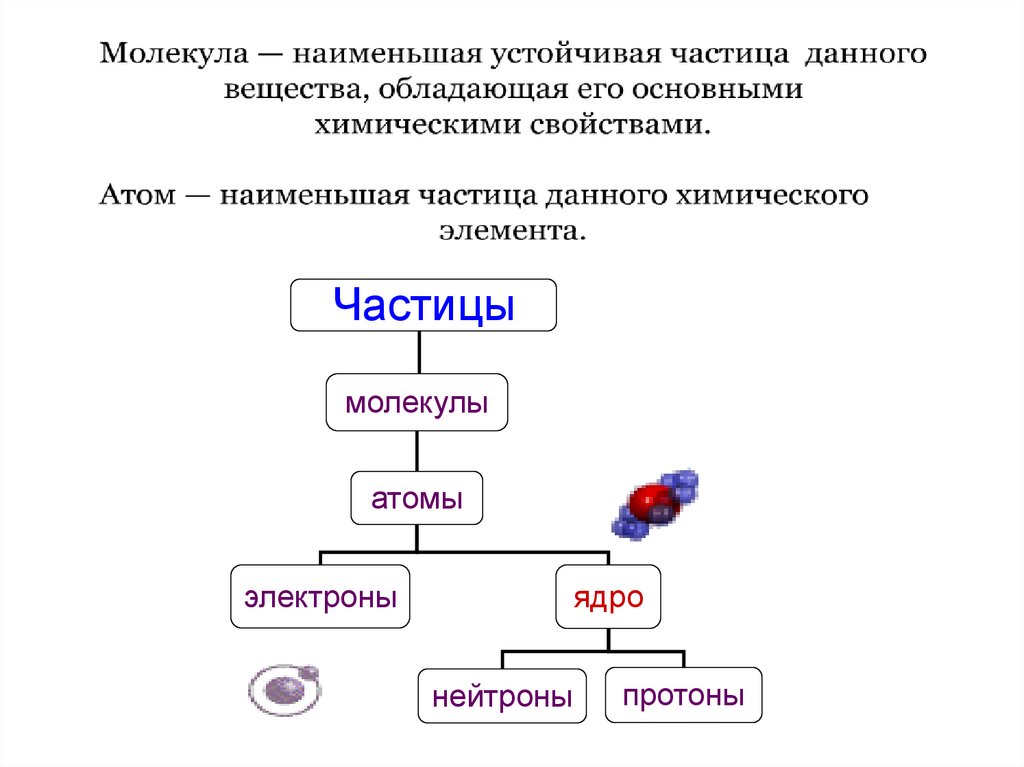
Частицымолекулы
атомы
электроны
ядро
нейтроны
протоны
5.
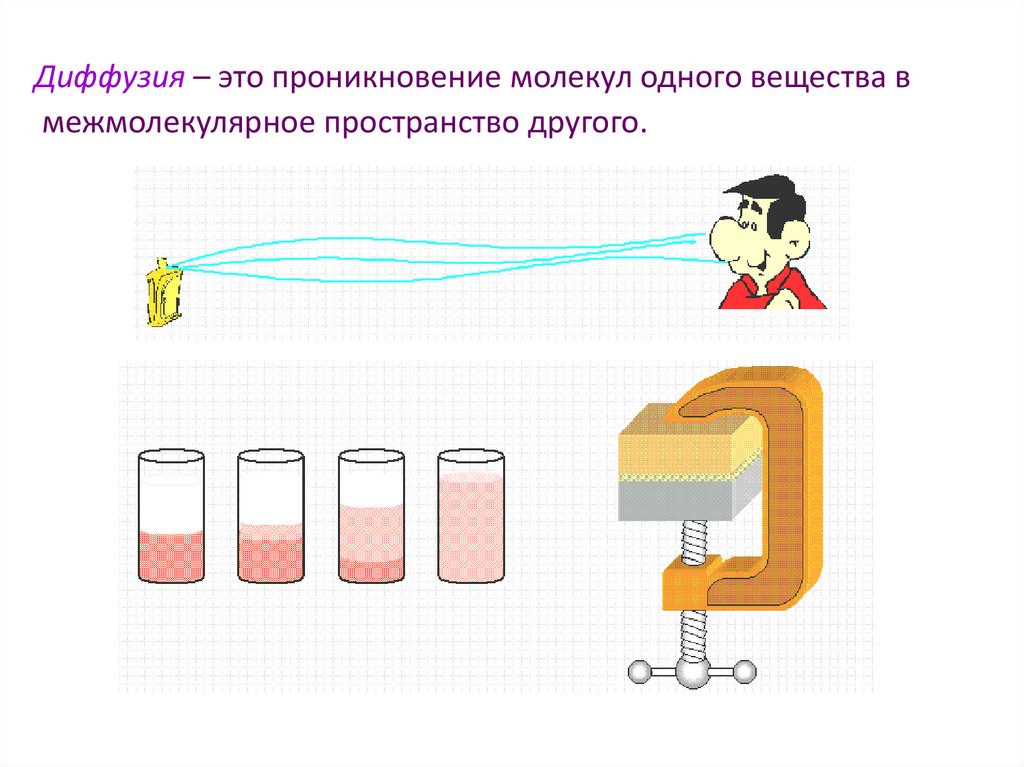
Диффузия – это проникновение молекул одного вещества вмежмолекулярное пространство другого.
6.
Броуновское движение- это беспорядочное непрерывноедвижение мельчайших, взвешенных в жидкости или газе частиц
твердого тела под ударами молекул жидкости или газа
Характер движения
движения зависит
от
Характер
зависит
Характер движения зависит от
видажидкости,
жидкости,
от вида
вида жидкости, размера и
размера
и формы
частиц,
формы
частиц,
температуры.
размера
и формы
частиц,
температуры.
температуры.
Причина: удары молекул
жидкости
о частицу не
компенсируют
друг друга
Р. Броун 1827 г.
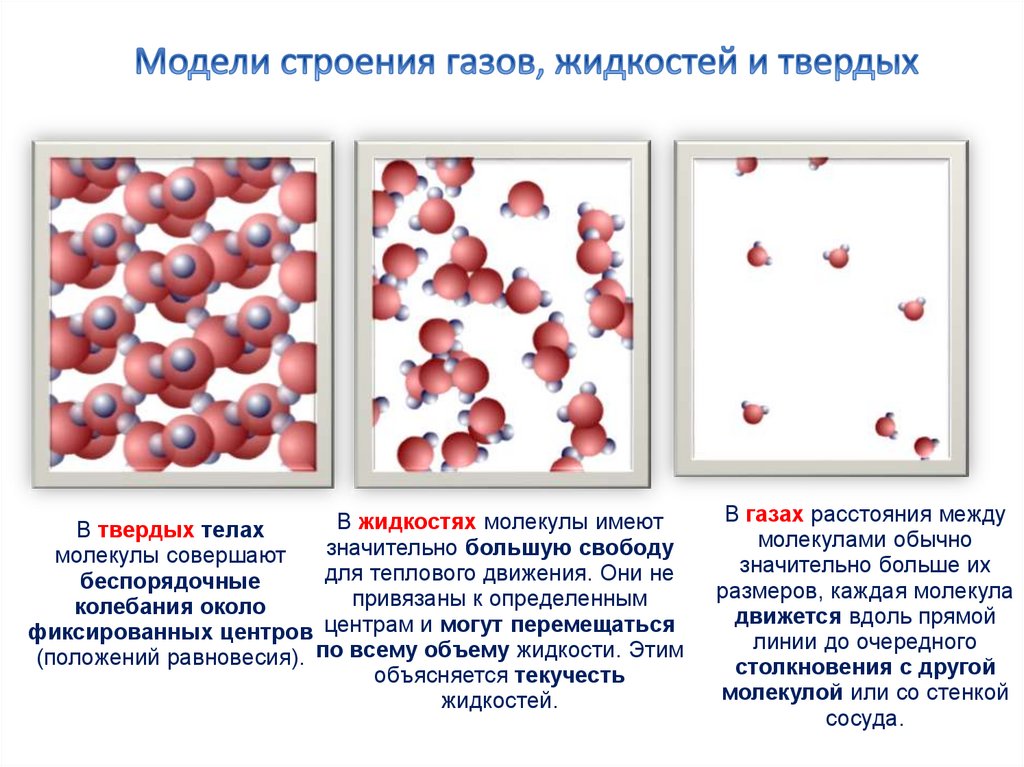
7. Модели строения газов, жидкостей и твердых
В жидкостях молекулы имеютВ твердых телах
значительно большую свободу
молекулы совершают
для теплового движения. Они не
беспорядочные
привязаны к определенным
колебания около
фиксированных центров центрам и могут перемещаться
(положений равновесия). по всему объему жидкости. Этим
объясняется текучесть
жидкостей.
В газах расстояния между
молекулами обычно
значительно больше их
размеров, каждая молекула
движется вдоль прямой
линии до очередного
столкновения с другой
молекулой или со стенкой
сосуда.
8.
9.
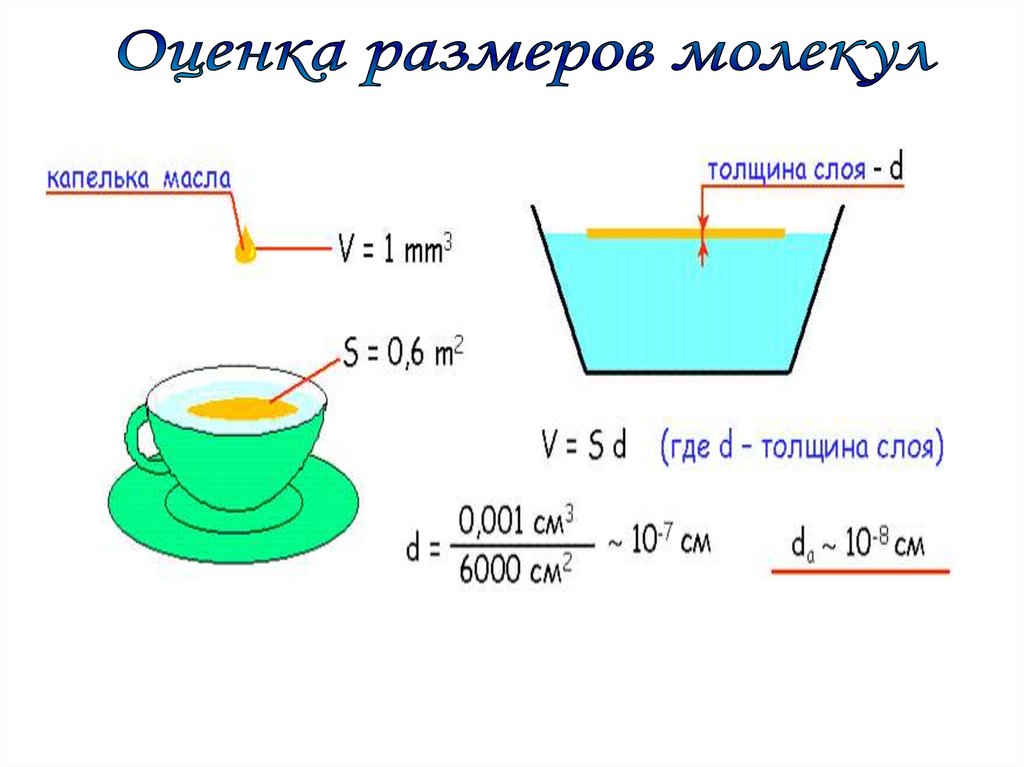
Подсчитаем приблизительное число молекул в капле водымассой 1 г и, следовательно объемом 1 см3.
8 3
d
3
10см VH 2O (3 10 ) cм
H
O
2
8
3
Vкапл и
1 см
22
N
3,7 10
8 3
3
V м ол екул ы (3 10 ) см
3
10.
Вычислим массу одной молекулы воды.В 1 г воды содержится 3,7·1022 молекул.
m
m0
N
1 г
23
mOH 2O
2
,
7
10
г
22
3,7 10
11.
Относительной молекулярной (или атомной) массойвещества Мr называют отношение массы молекулы (или
атома) m0 данного вещества к 1/12 массы атома углерода
m0C
m0
Mr
1
m0C
12
Вычислим Mr воды Н2О (для этого воспользуемся таблицей Менделеева)
Mr (Н2О)= 2·1+16=18 а.е.м.
Атомная единица массы (а.е.м.) ≈ 1,66·10-27 кг
12.
Один моль – это количествовещества,
в
котором
содержится столько же молекул
или атомов, сколько атомов
содержится в углероде массой
12 г.
1 моль любого вещества содержится одно и то
же число атомов или молекул. Это число
атомов
обозначают
NA
и
называют
постоянной Авогадро в честь итальянского
ученого (XIX в.).
NA = 6·1023 моль-1
13.
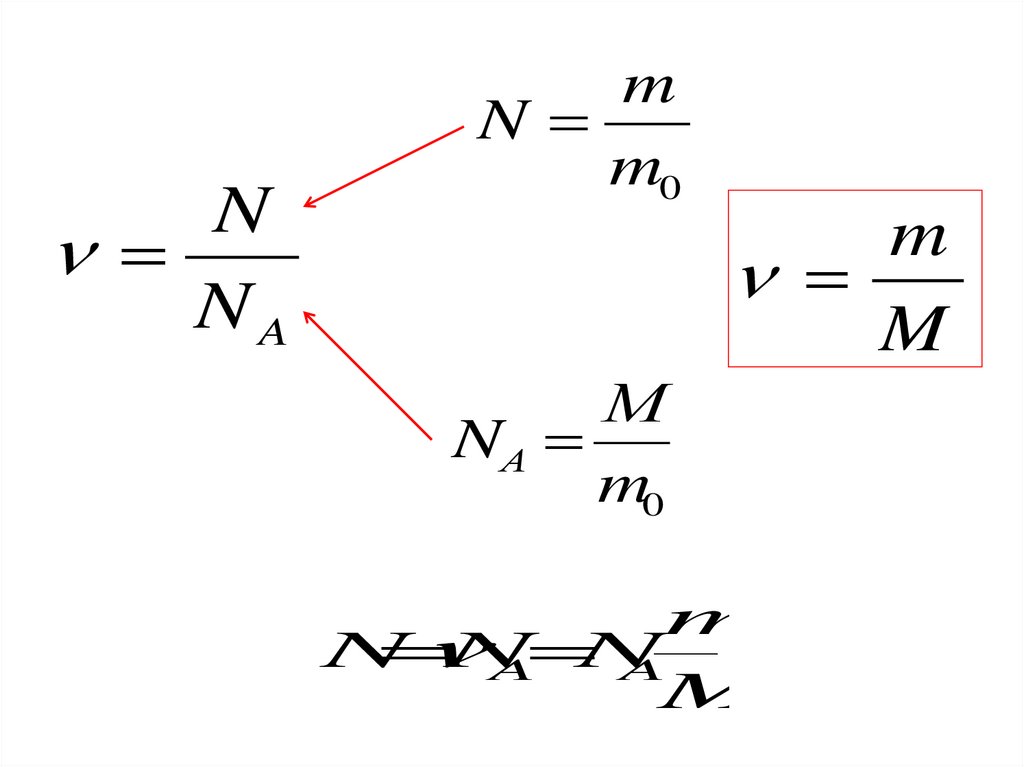
Количество вещества ν равно отношениючисла молекул N в данном теле к постоянной
Авогадро NA, т. е. к числу молекул в 1 моль
вещества:
N
NA
14.
Молярной массой М вещества называют массу вещества,взятого в количестве 1 моль.
M = m0 NA
М
NА
m0
Масса т любого количества вещества равна произведению
массы одной молекулы на число молекул в теле:
m = m0N
m
N
m0
M M r 10 3 кг / моль
15.
NNA
m
N
m0
m
M
М
NА
m0
m
N
N
N
A
A
M
16. Среднеквадратичная скорость теплового движения молекул
Т – абсолютная температура [K]k - 1,38·10-23Дж/К – постоянная Больцмана
R = NA·k = 8.31 Дж/моль·К- универсальная
газовая постоянная
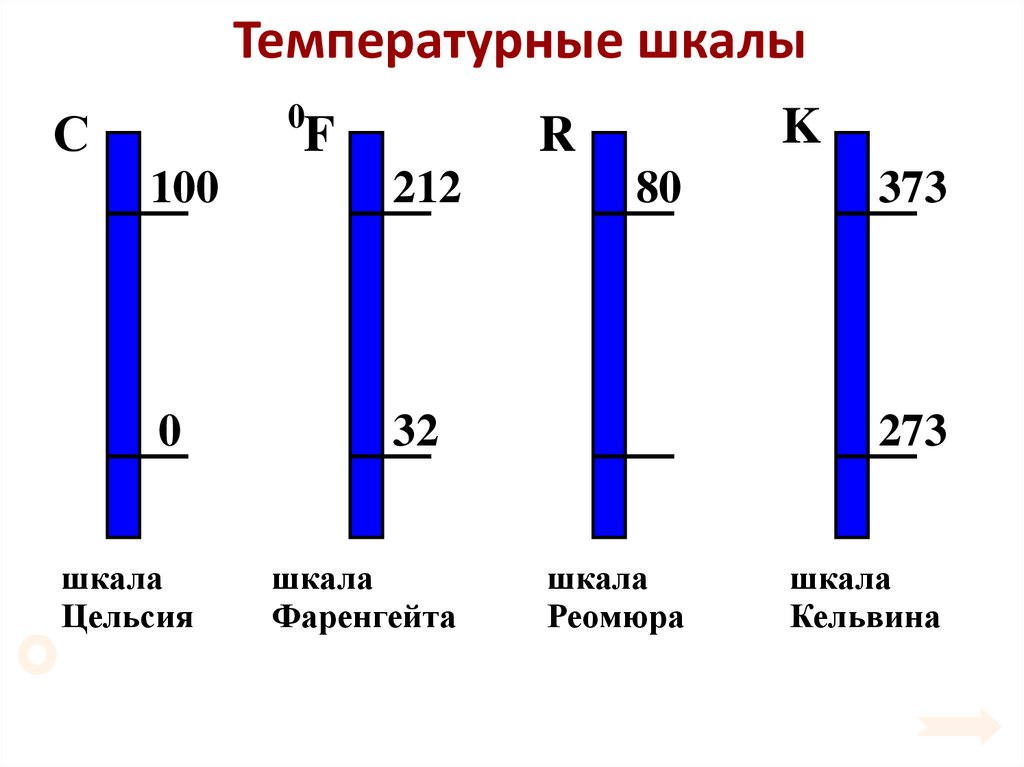
17. Температурные шкалы
00
С
0
F
K
R
100
212
80
373
0
32
0
273
шкала
Цельсия
шкала
Фаренгейта
шкала
Реомюра
шкала
Кельвина
18.
19. Задача 1. Какова масса 50 моль углекислого газа
20. Задача 2. Какое количество вещества содержится в алюминиевой отливке массой 5,4 кг.
21. Задача 3. Сколько молекул содержится в 100г воды.
22. Задача 4. На изделие, площадь которого 20 см2, нанесен слой серебра толщиной 1 мкм. Сколько атомов серебра содержится в
покрытии.23. Задача 5. При какой температуре средняя квадратичная скорость молекул азота 830 м/с
24. Задача 6. Средняя квадратичная скорость молекул кислорода при комнатной температуре равна 500 м/с. Определить в СИ среднюю
квадратичную скорость молекул водорода при этойже температуре.
















 Физика
Физика








