Похожие презентации:
лекция 2-25
1. АНАЛИТИЧЕСКАЯ ХИМИЯ
ЛЕКЦИЯ 2Химические равновесия в растворах
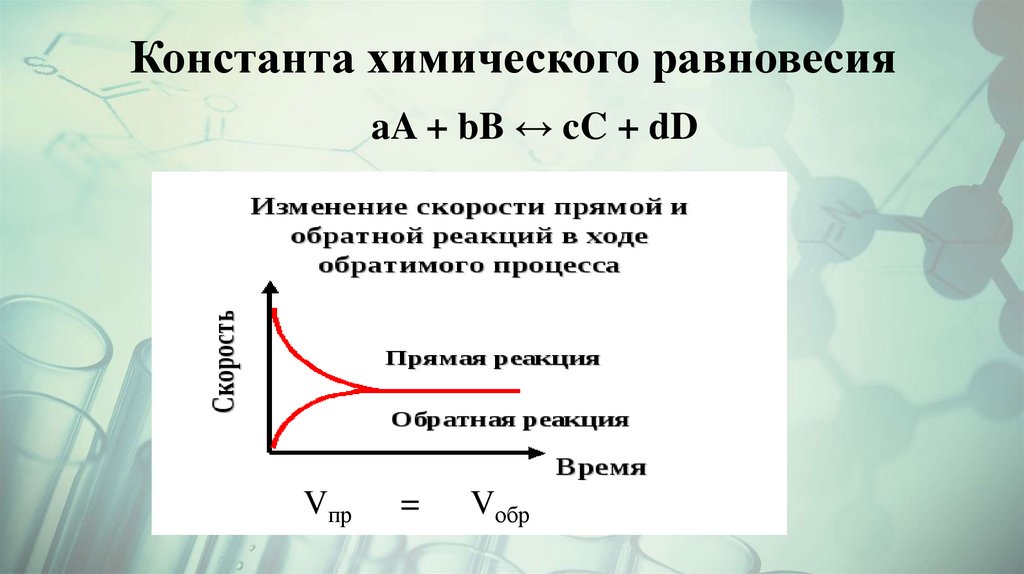
2. Константа химического равновесия
aA + bB ↔ cC + dDVпр
=
Vобр
3.
С кинетической точки зренияХимическое равновесие – состояние динамического равновесия
реакций в растворе, при котором каждый компонент образуется
точно с такой же скоростью, с которой и расходуется.
4.
5.
Закон действующих масс справедлив для идеальных растворовэлектролитов.
С увеличением концентрации компонентов химической
реакции наблюдаются отклонения от ЗДМ, связанные с:
1. Электростатическими взаимодействиями;
2.Взаимодействиями, обусловленными вандерваальсовыми
силами;
3.Слабыми химическими взаимодействиями, например,
образованием
водородных связей между частицами системы.
6.
7.
8.
Константа химического равновесия↙
↘
термодинамическая Kт/д
I ≠0
концентрационная Kc
I=0
9. Равновесие в растворах комплексных соединений
10.
11.
12.
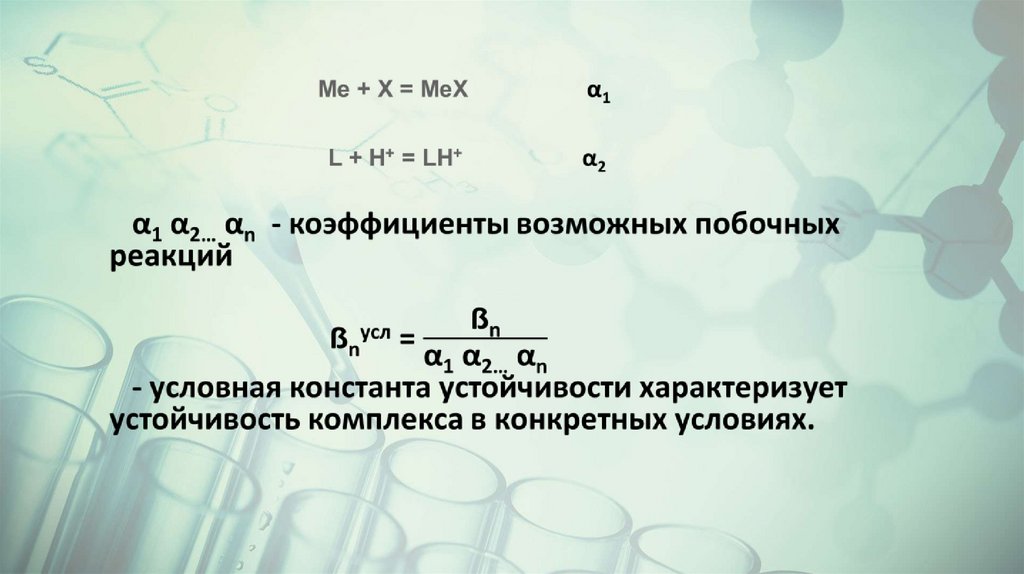
Константа↙
I=0
Отсутствие побочных
реакций-
концентрационная
ẞn
устойчивости
комплекса
↓
↘
I ≠0
Присутствие побочных
реакций -условная
Термодинамическая
ẞт/д
ẞnусл
13. Равновесие в гетерогенных системах Гетерогенные системы – это системы, состоящие из двух или более фаз, разделенных
поверхностью раздела14.
15.
16. Условие образования осадков
Осадок образуется, если СA. CB ˃Ks(AB)Условие
образования
осадков
СA. CB ˃ ИП – ионное произведение
концентраций.
ИП˃ Ks(AB) – осадок выпадает
ИП< Ks(AB) – осадок не образуется
17. Факторы, влияющие на растворимость осадков 1. Концентрация ионов водорода
Растворимость осадков, образованных анионами слабых кислот,увеличивается с увеличением концентрации ионов водорода.
CaF2 = Ca2+ + 2F
↓
+H+
↕
HF
18.
MAn ⇄ M2+ + An2Ks(MAn) = [M2+][An2- ]
При добавлении сильной кислоты в раствор над осадком An2 связываются с
ионами H+ , образуя слабую двухосновную кислоту H2An:
An2 + H+ ⇄ HAn
Ka(2) = [An2-][H+] /[HAn-]
HAn + H+ ⇄ H2An
Ka(1) = [HAn-][H+] /[H2An];
CAn = [An2-]+[HAn-]+[H2An]
Степень взаимодействия An2 с H+ характеризуется коэффициентом
побочной реакции αA
αAn =CAn/[An2-],
αAn = 1+ [H+]/Ka(2) + [H+]2/Ka(2)Ka(1)
19.
20.
21.
22.
23.
αA = [A]+[AL]+[AL2]+…+[ALn] /[A]ẞ1 = [AL]/[A][L];
[AL]= ẞ1[A][L]
ẞ2 =[AL2]/[A][L]2
[AL2]= ẞ2][A][L]2
--------------------------------------------------------------ẞn=[ALn]/[A][L]n
[ALn]= ẞn/[A][L]n
αA= 1+ ẞ1[L] + ẞ2[L]2 + … + ẞn][L]
24.
25.
26.
27.
28.
средаH2O
A
B
растворимость
29.
30. Протолитические равновесия
Теория Бренстеда-ЛауриКислоты – вещества, способные отщеплять ионы водорода.
Основания – вещества, способные принимать ионы водорода.
Обе группы веществ получили название протолиты, а их
взаимодействие протолитическим.
Кислоты: HCl, H2SO4 , NH4+, HCO3Основания: NaOH, NH3 , HCO3-
31.
Вещества, способные при определенных условиях отдавать илипринимать ионы водорода, называются амфипротонными или
амфолитами (HCO3-)
HAn = H+ + Anк-та
сопряженное
B + H+ = BH+
основаниe
основание
сопряженная
кислота
HAn / An- ; B/ BH+ - сопряженные протолитические пары
H2O + H2O = H3O+ + OH- - Реакция авторотолиза
к-та
осн. сопр.к-та сопр.осн.
Kw = 10-14
32.
HAn + H2O = An- + H3O+Ka = [H3O+][An-]/[HAn]
B + H2O = BH+ + OH-
Kb = [BH+] [OH-]/[B]
KaKb´ = Kw
Kb(NH3) = 1,8.10-5
KbKa´ = Kw
Ka ´ (NH4+) = Kw /Kb(NH3) = 10-14/1,8, 10-5 = 5,5. 10-10
Чем сильнее кислота (основание), тем слабее
основание (кислота)
сопряженное
33.
Расчет концентрации ионов водорода1.
В растворах сильных кислот и оснований
Кислота
Основание
[H+] ≈ C(HAn)
[OH-] ≈ C(KtOH)
Пример.
Рассчитать рН в растворе 0,01 М HCl.
HCl – сильная кислота, следовательно, [H+] = c(HCl) = 0,01 моль/л.
рН = -lg[H+] = -lg 10-2 = 2
34.
35.
36.
37.
3. В растворах кислых солей типа NaHAn (амфолитов)Для соли, образованной двухосновной кислотой H2An
38.
39.
40.
41.
42.
43.
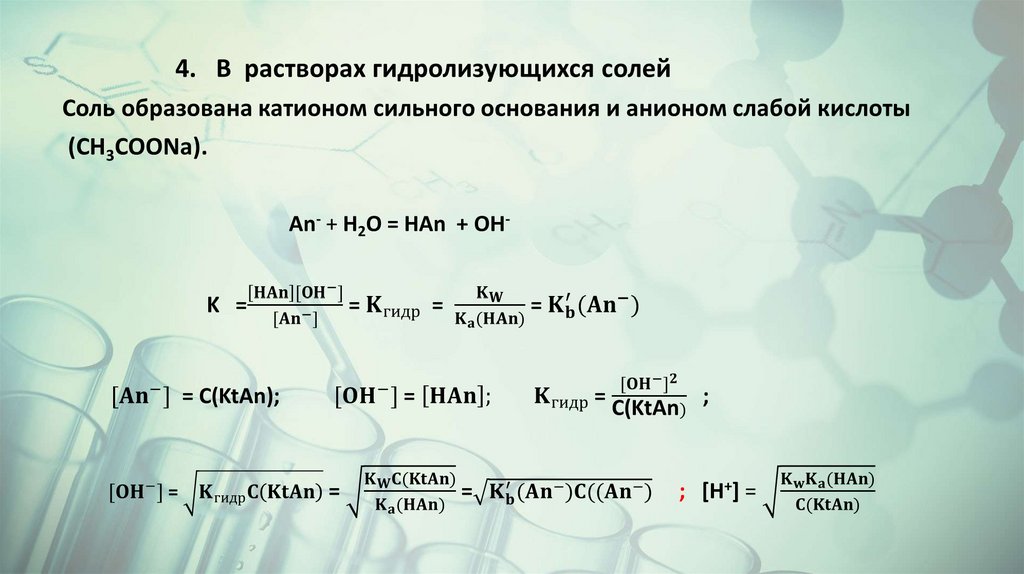
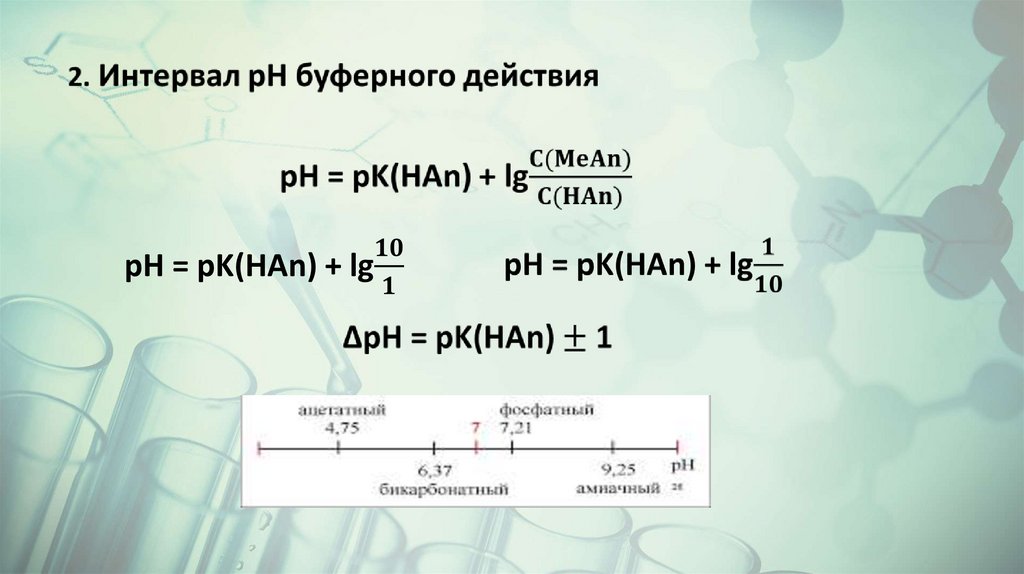
Буферные растворыБуферные растворы – это растворы, рН которых не изменяется
при добавлении небольших количеств сильных кислот или
оснований.
Состоят буферные растворы из слабой кислоты и сопряженного с
ней основания или слабого основания и сопряженной с ним
кислоты ( слабой кислоты и ее соли с сильным основанием или
слабого основания и его соли со слабой кислотой.
CH3COOH + OH- ↔ CH3COO- + H2O
CH3COO- + H+ ↔ CH3COOH
















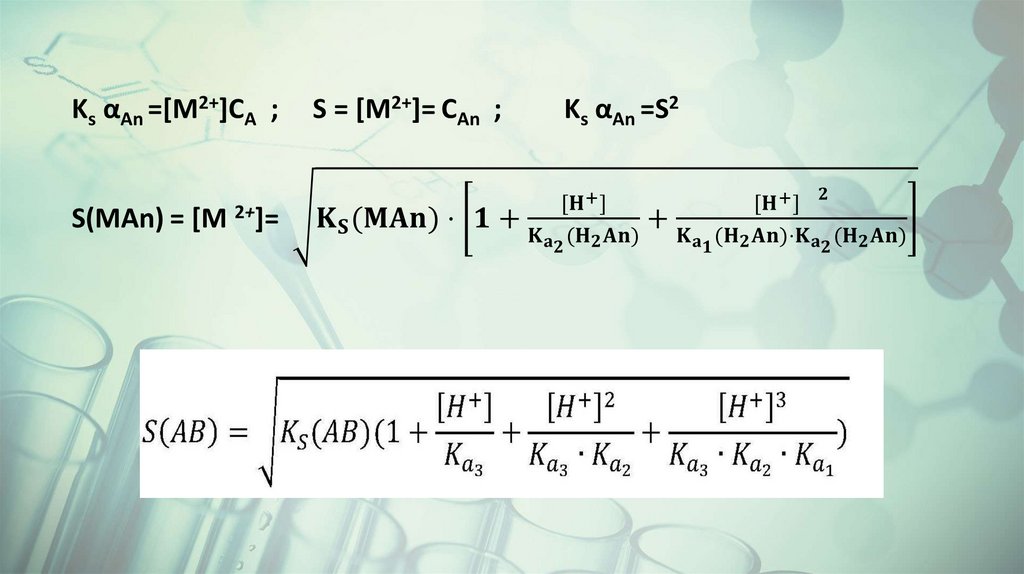



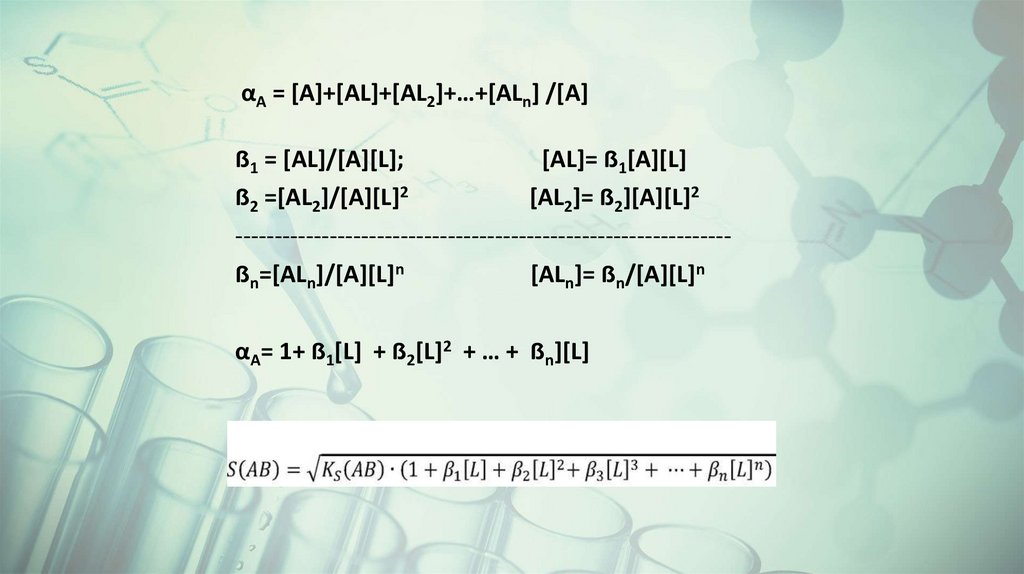











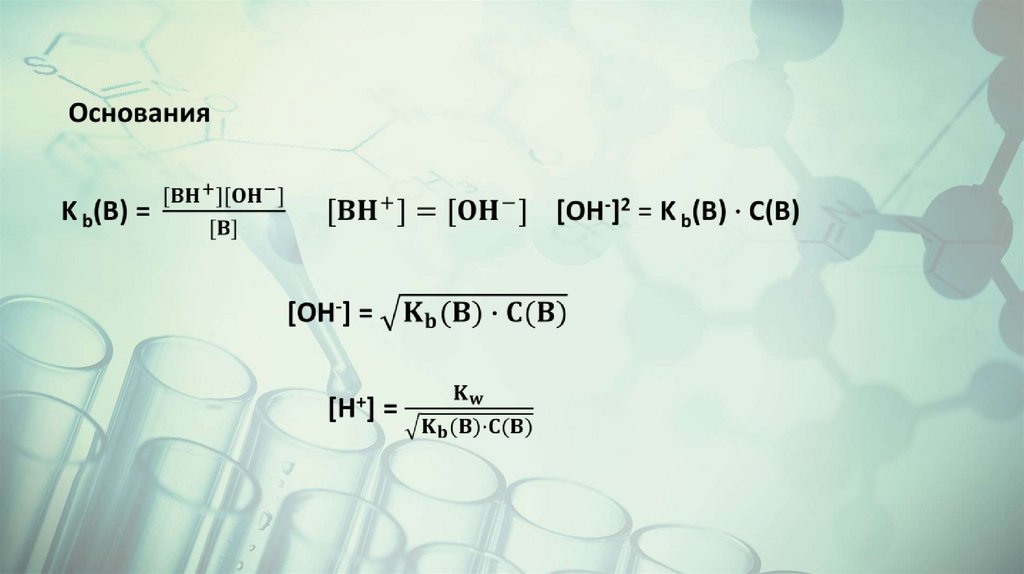


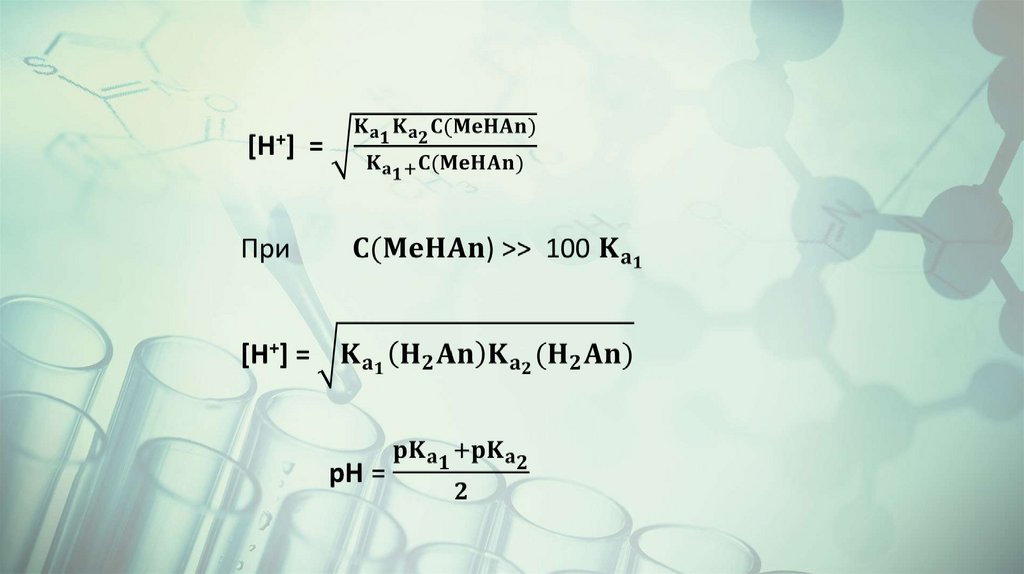







 Химия
Химия








