Похожие презентации:
Лекция 9 Термодинамика_изопроцессы
1.
Кафедра физикиЛекция 9
ТЕРМОДИНАМИКА
ПЛАН ЛЕКЦИИ
1. Работа, теплота в термодинамике
2. Первое начало термодинамики
3. Изопроцессы идеального газа.
Общая физика. "Основы статистической
физики"
1
2.
Кафедра физикиНекоторые наиболее употребляемые буквы греческого алфавита
- альфа - каппа - ро
- эта
- сигма
- бета
- ламбда - кси
- гамма
- дзета
- дельта - мю
- тэта
- эпсилон - пси
- фи
Общая физика. "Основы статистической
физики"
2
3.
Кафедра физикиТЕРМОДИНАМИКА
Термодинамика – это наука о теплоте и о превращениях
теплоты.
Одно из практически полезных превращений теплоты – это
превращение теплоты в механическую работу.
Машины, превращающие тепло в работу - тепловые
машины
В термодинамике используют два типа величин:
1. Функции состояния
2. Функции процесса
3
4.
Функция состояния - это физическая величина, значениекоторой однозначно определяется состоянием системы.
Примеры функций состояния: объем V, давление p, температура T,
внутренняя энергия U
- изменение объёма ΔV=V2 –V1
где V1 – объём системы в начале процесса, а V2 –в конце процесса.
- изменение давления Δp=p2 –p1
- изменение температуры ΔT=T2 –T1
- изменение внутренней энергии ΔU=U2 –U1
Внутренняя энергия U – энергия теплового (хаотического)
движения частиц, а также энергия их взаимодействия между
собой.
Приращение dU>0, если U возрастает и наоборот.
4
5.
Работа и теплота в термодинамикеФизическая
величина,
значение
которой
однозначно
определяется
процессом,
произошедшим
в
системе,
называется функцией процесса.
Функции процесса:
работа;
тепло (количество теплоты) Q, получаемое системой;
теплоёмкость C.
Взаимодействие термодинамических систем с окружающей средой
сопровождается обменом энергией.
В термодинамике все способы энергообмена подразделяются на две
формы: работу и теплоту.
Работа в термодинамике имеет тот же смысл, что и в механике, т.е.
произведение силы на перемещение.
5
6.
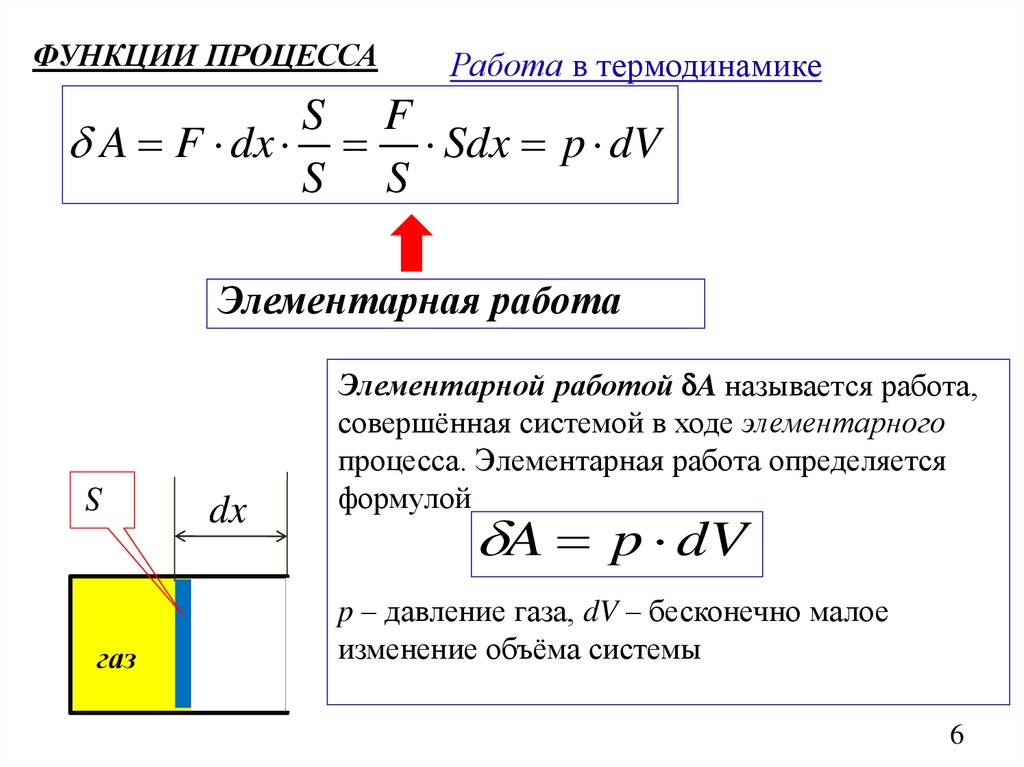
ФУНКЦИИ ПРОЦЕССАРабота в термодинамике
S F
A F dx Sdx p dV
S S
Элементарная работа
S
газ
dx
Элементарной работой A называется работа,
совершённая системой в ходе элементарного
процесса. Элементарная работа определяется
формулой
A p dV
p – давление газа, dV – бесконечно малое
изменение объёма системы
6
7.
ФУНКЦИИ ПРОЦЕССАРабота в термодинамике
Если газ расширяется, то dV>0. Элементарная работа газа A>0. Газ
совершает работу. Если газ сжимается, то dV<0 и A <0. Над газом
совершается работа.
dV- бесконечно малое изменение объёма системы,
A - элементарная работа, бесконечно малая величина, функция
процесса.
Символ d означает бесконечно малое изменение, а символ
– бесконечно малую порцию.
2
V2
1
V1
A12 δA pdV
- работа газа в ходе произвольного процесса
7
8.
ФУНКЦИИ ПРОЦЕССАТепло (теплота) в термодинамике
Пусть A и B - две замкнутые равновесные системы с
температурами Ta и Tb. Пусть Ta > Tb. Приведем A и B в контакт.
Новая замкнутая система AB - не является равновесной. В системе
начнётся процесс выравнивания температур. Установится
температура T, причем Т > Tb и Т < Ta.
Изменение температур произошло за счет того, что системы
обменялись энергией. Этот обмен называется теплообменом.
Энергия, которую получает (отдает) система при теплообмене с
другой системой, называется теплом (количеством теплоты) δQ
δQ>0, если система получает тепло. δQ<0, если отдает.
8
9.
ФУНКЦИИ ПРОЦЕССАТепло (теплота) в термодинамике
δQ>0, если система получает тепло. δQ<0, если отдает.
Тепло Q является функцией процесса. Система в каждом своём
состоянии не обладает теплом, у неё есть функция состояния внутренняя энергия U . Система лишь имеет возможность передать
тепло.
Работа и теплота – не виды энергии, а формы ее передачи.
9
10.
Первый принцип (первое начало) термодинамикиЕсли система получает тепло Q из окружающей среды и не
совершает работы, то происходит возрастание dU внутренней энергии
системы. dU = Q при V=const. Если система расширяется, то она
совершает работу A. Тогда
Q расходуется на увеличение
внутренней энергии dU и на совершение работы системой.
Первое начало термодинамики:
В каждом элементарном процессе тепло Q, приобретённое
системой, расходуется на увеличение внутренней энергии системы
dU и работу A, совершаемую системой в этом процессе.
Q dU A
Q dU pdV
10
11.
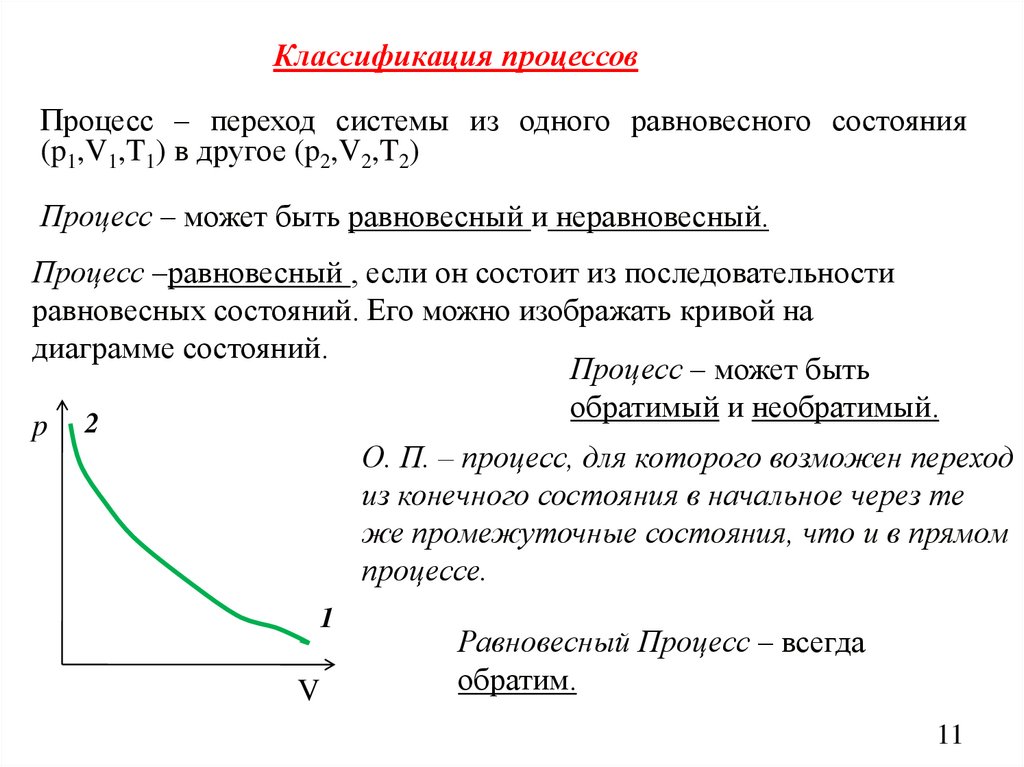
Классификация процессовПроцесс – переход системы из одного равновесного состояния
(p1,V1,T1) в другое (p2,V2,T2)
Процесс – может быть равновесный и неравновесный.
Процесс –равновесный , если он состоит из последовательности
равновесных состояний. Его можно изображать кривой на
диаграмме состояний.
Процесс – может быть
обратимый и необратимый.
p 2
О. П. – процесс, для которого возможен переход
из конечного состояния в начальное через те
же промежуточные состояния, что и в прямом
процессе.
1
V
Равновесный Процесс – всегда
обратим.
11
12.
Кафедра физикиТеплоемкость идеального газа
Теплоемкостью тела называется величина, равная количеству
теплоты, которое нужно сообщить телу, чтобы повысить его
температуру на один кельвин
Cтела
Q
Теплоемкость тела измеряется в Дж/К
dT
1 Q Удельная теплоемкость измеряется в Дж/(кг .К)
C уд
M dT
1 Q Молярная теплоемкость измеряется в Дж/(моль.К)
C
dT
Теплоемкость газа различна в разных процессах, т.е. является
функцией процесса
12
13.
Чаще используют молярную теплоемкость.При ссылке на теплоемкость необходимо указывать процесс.
Принято использовать две теплоемкости:
C V - теплоемкость при постоянном объеме
C p - теплоемкость при постоянном давлении
Q dU pdV
dU
CV
dT
Вспомним:
pdV RdT
C P СV R
Q
CV
dT
V
Q
Cp
dT p
Q dU при V const
pV RT
для 1 моля. Тогда при p= const
dU RdT
Q
Cp
CV R
dT
dT p
- Уравнение Майера
Справедливо для молярных теплоемкостей
13
14.
Изопроцессы идеального газаПроцесс, в котором параметр или функция состояния остается
неизменным, называется изопроцессом (ИП).
Различают 4 ИП: 1. Изохорический процесс. V=const.
2. Изобарический процесс. p=const.
3. Изотермический процесс. Т=const.
4. Адиабатический процесс. δQ=0. Изоэнтропийный: S=const.
Проанализируем эти процессы.
Структура анализа:
Уравнение, график,
Первое начало,
теплоемкость,
работа.
14
15.
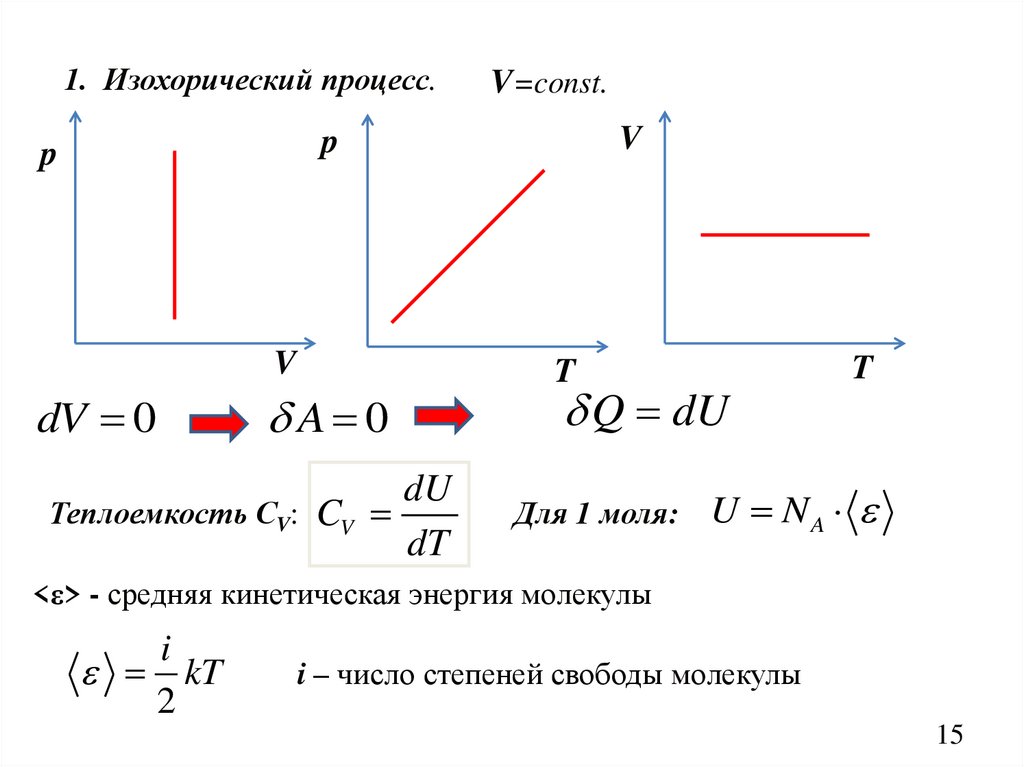
1. Изохорический процесс.V=const.
V
p
p
V
dV 0
A 0
dU
Теплоемкость СV: CV
dT
T
Q dU
Для 1 моля:
T
U NA
<ε> - средняя кинетическая энергия молекулы
i
kT
2
i – число степеней свободы молекулы
15
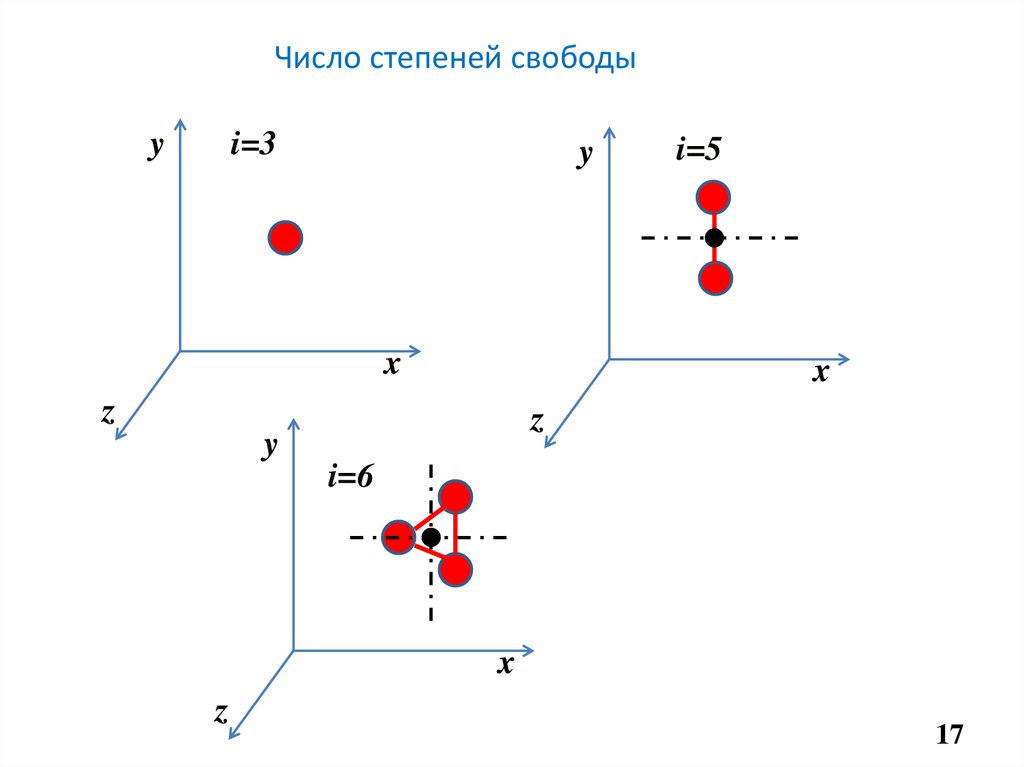
16.
Под числом i степеней свободы понимают число независимыхкоординат, однозначно характеризующих положение молекулы в
пространстве. Либо число независимых видов движения.
Тип молекулы
i
Одноатомная
3
Двухатомная
5
Многоатомная
6
Для моля:
i
i
U N A kT RT
2
2
Отсюда следует:
dU i
CV
R – молярная
теплоемкость
dT 2
i
dU CV dT RdT
2
16
17. Число степеней свободы
yi=3
y
x
i=5
x
z
z
y
i=6
x
z
17
18.
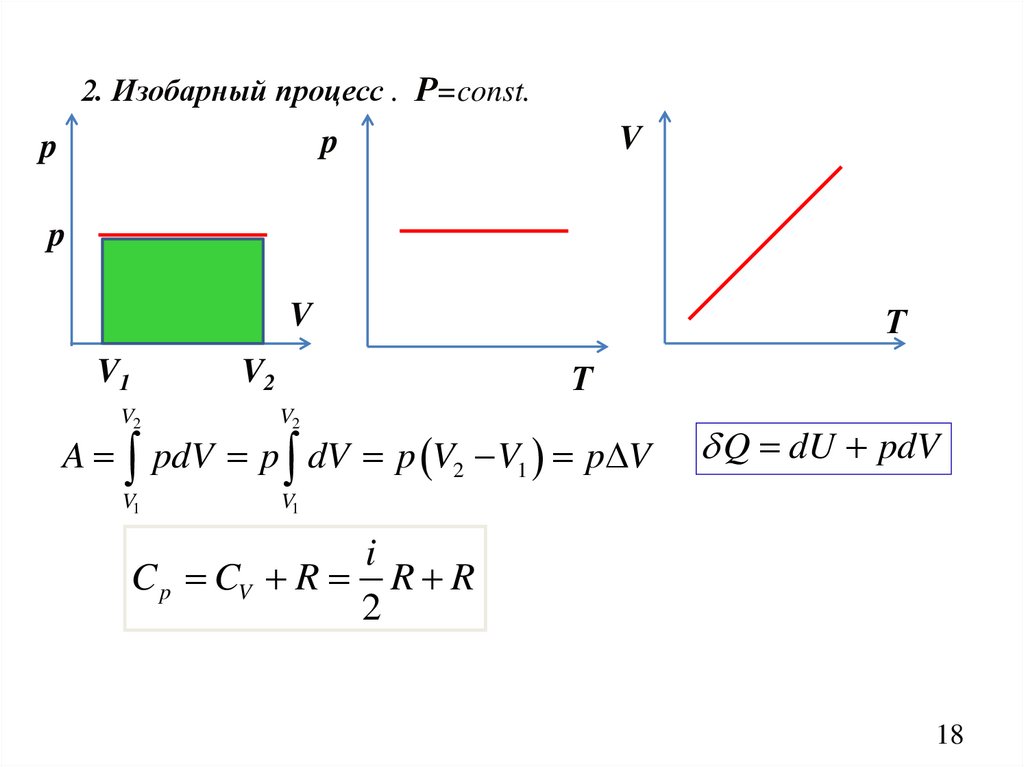
2. Изобарный процесс . Р=const.V
p
p
p
V
V1
V2
Т
Т
V2
V2
V1
V1
A pdV p dV p V2 V1 p V
Q dU pdV
i
C p CV R R R
2
18
19.
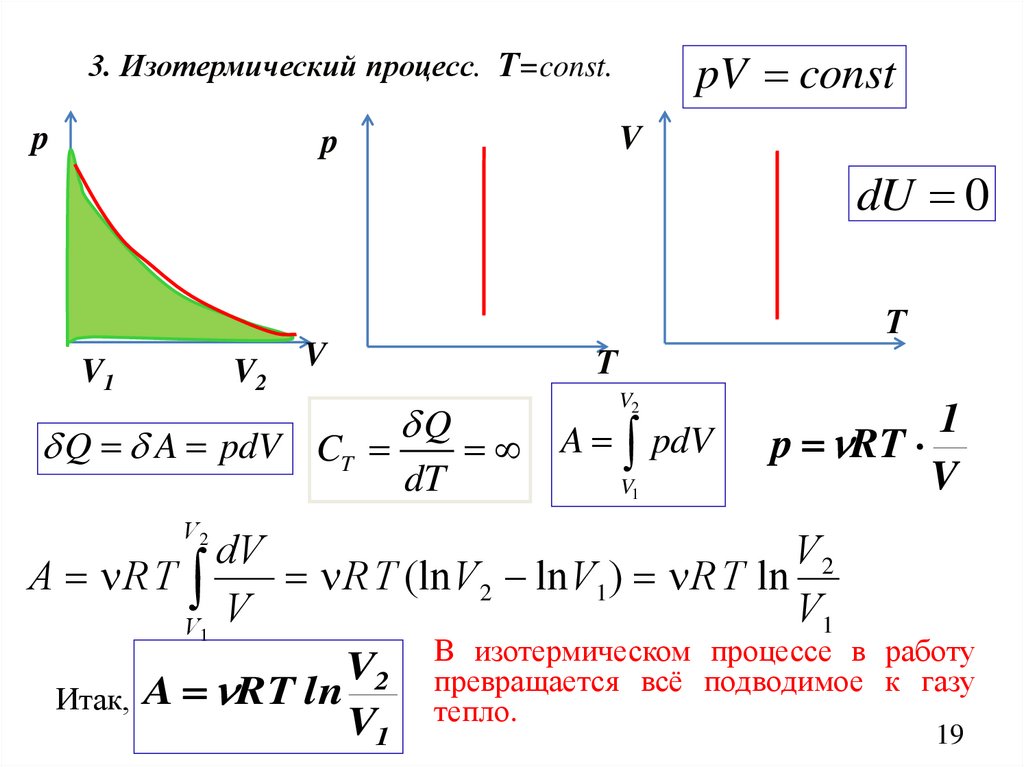
pV const3. Изотермический процесс. Т=const.
p
V
p
dU 0
Т
V1
V2
V
Q A pdV CT
V2
Т
Q
dT
V2
A pdV
V1
1
p RT
V
dV
V2
A R T
R T (ln V 2 ln V1) R T ln
V
V1
V1
изотермическом процессе в работу
V2 В
превращается всё подводимое к газу
Итак, A RT ln
V1 тепло.
19
20.
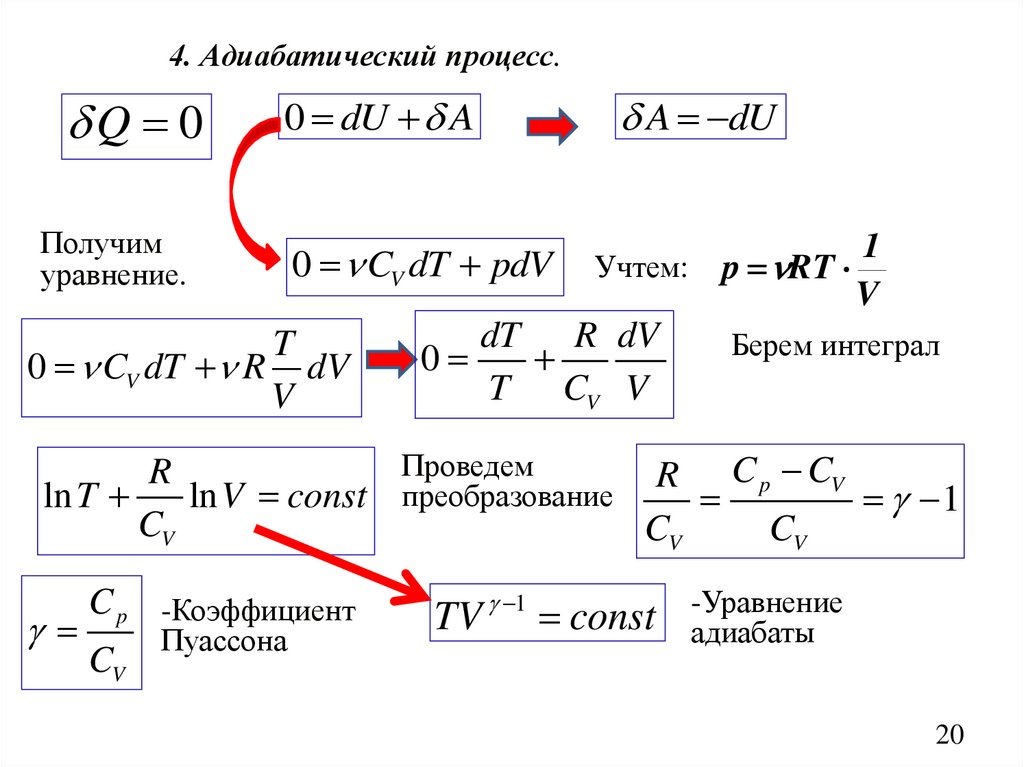
4. Адиабатический процесс.Q 0
Получим
уравнение.
0 dU A
0 CV dT pdV
T
0 CV dT R dV
V
A dU
Учтем:
dT R dV
0
T CV V
1
p RT
V
Берем интеграл
Проведем
R
R C p CV
ln T
ln V const преобразование
1
CV
CV
CV
C p -Коэффициент
Пуассона
CV
TV 1 const
-Уравнение
адиабаты
20
21.
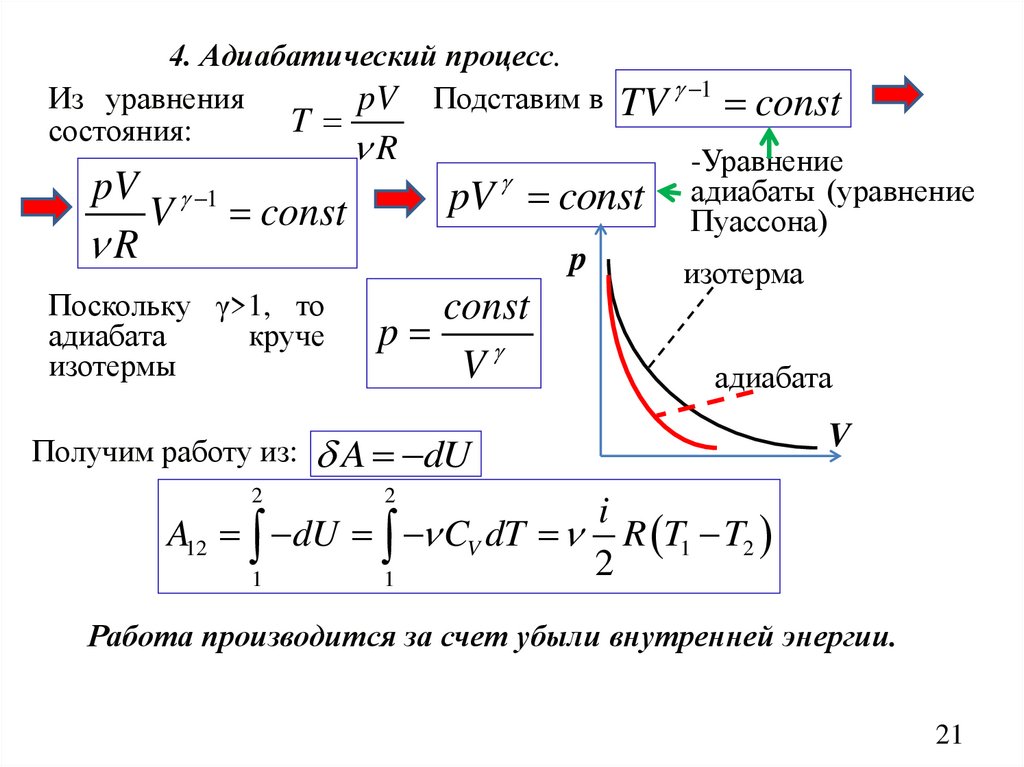
4. Адиабатический процесс.Из уравнения
pV Подставим в TV 1 const
T
состояния:
R
-Уравнение
pV 1
адиабаты (уравнение
pV
const
V const
Пуассона)
R
p
Поскольку γ>1, то
адиабата
круче
изотермы
const
p
V
изотерма
адиабата
Получим работу из: A dU
2
V
2
i
A12 dU CV dT R T1 T2
2
1
1
Работа производится за счет убыли внутренней энергии.
21
22.
Политропный процесс.Политропным называется процесс, в котором теплоемкость
остается постоянной.
pV
pV
Получим уравнение политропы.
T
Q CdT
R C p CV
Для 1 моля:
CdT CV dT pdV
CV C dT pdV
0
*
CV T
CV T
CV C dT pdV C p CV
0
CV T
CV pV
Поделим на CVdT
Выразим T из уравнения
состояния и подставим в (*):
dT C p CV dV
0
T
CV C V
После
интегрирования ln T n 1 ln V const где
получаем:
n 1
C p CV
CV C
22
23.
Политропный процесс.ln T n 1 ln V const
Преобразуя левую часть, получаем:
TV n 1 const. Выразим Т из уравнения состояния: pV RT
pV n 1
n
pV
pV const.
V const.
T
R
R
Уравнения политропы
Следовательно, все
изопроцессы являются частными случаями политропного
n=1, - изотермический
n=0, - изобарический
n=∞, - изохорический
Преобразуем (*), возведя в степень 1/n:
1
При
V const. n=∞
p nV const.
n=γ, - адиабатический
Из n 1
C p CV
CV C
C
nCV C p
n 1
23
24.
Лекция 9Преобразование тепла в работу
ПЛАН ЛЕКЦИИ
1. Устройство тепловой машины
2. Коэффициент полезного действия тепловой машины
3. Цикл Карно. Коэффициент полезного действия цикла
dx
S
газ
24
25.
Что такое тепловая машина?Тепловой машиной называется устройство,
в котором тепловая энергия превращается
в механическую.
Примеры тепловых машин:
Двигатель внутреннего сгорания (ДВС)
а) карбюраторный двигатель
б) дизельный двигатель
в) реактивный двигатель
Паровые и газовые турбины.
26.
Первые тепловые двигатели• Кто и когда изобрёл?
Деви Папин – английский физик,
один из изобретателей парового
двигателя.
1680г. –
Изобрёл паровой котёл
1681г. –
Снабдил его предохранительным клапаном
1690г. –
Первым использовал пар для поднятия поршня и
описал замкнутый термодинамический цикл парового
двигателя.
• 1707г. –
• Представил описание своего двигателя
27.
Кто и когда построил?• Конец 18 века –
• построены первые паровые машины.
• 1774 год –
• английским изобретателем Джеймсом Уаттом
построена первая универсальная паровая
машина.
• С 1775 по 1785 г. –
• фирмой Уатта построено 56 паровых машин.
• С 1785 по 1795г. –
• той же фирмой поставлено уже 144 такие
машины.
28.
Ползунов Иван Иванович1728, Екатеринбург
1766,Барнаул
Построил паровую машину
в 1766 году в Барнауле
28
29.
Первый паровой автомобиль• 1770г.
• Жан Кюньо –
• французский
• инженер, построил
• первую
• самодвижущуюся тележку,
предназначенную
• для передвижения
• артиллерийских орудий
30.
«Младший брат» - паровоз• 1803г. –
• Английский изобретатель Ричард Тревитик
сконструировал первый паровоз.
• Через 5 лет Тревитик построил новый паровоз.
• он развивал скорость до 30 км/ч
• 1816г. –
• Не имея поддержки,
• Тревитик разорился и уехал
• в Южную Америку
31.
Решающая роль• 1781-1848г. –
• Английский конструктор и изобретатель
Джордж Стефенсон
• 1814г. –
• Начал заниматься строительством паровозов.
• 1823г. –
• Основал первый в мире паровозостроительный
завод
• 1829г. –
• На соревновании лучших локомотивов первое
место занял паровоз Стефенсона «Ракета».
• Его мощность составляла 13 л.с., а скорость 47
км/ч.
32.
Двигатель внутреннегосгорания
• 1860г. –
• Французским механиком Ленуаром был
изобретён двигатель внутреннего сгорания
• 1876г. –
• Немецким изобретателем Отто
• сконструирован четырёхтактный двигатель
внутреннего сгорания.
• 1879г. –
• Немецким изобретателем Бенцом был создан
бензиновый двухтактный двигатель
• Примерно в то же время
• Бензиновый двигатель был разработан
Костовичем в России.
33.
Двигатели Дизеля• 1896г. –
• Немецкий инженер Рудольф Дизель
• сконструировал двигатель внутреннего сгорания в
котором сжималась не горючая смесь, а воздух.
Это наиболее экономичные тепловые
двигатели 1)работают на дешёвых видах топлива 2)
имеют КПД 31-44%
34.
Если при получении тепла Q тело расширяется, то оно совершаетработу A.
A Q dU
Тепло Q превращается в работу A наилучшим образом при
условии dU=0, т.е. при изотермическом расширении.
Это возможно лишь в однократном процессе
Практический интерес представляют устройства, работающие
циклически.
Тело, совершающее работу, должно возвращаться в исходное
состояние.
Процесс, возвращающий тело в исходное состояние, называется
замкнутым процессом или циклом.
Площадь внутри кривой есть работа за цикл.
p
A
a
pdV
A
b
B
AaBbA
V
34
35.
Можно ли и в циклическом процессе получить работу, равную теплу?Опыт дает отрицательный ответ.
Кельвин сформулировал постулат:
Невозможно осуществить циклический процесс, единственным
результатом которого было бы превращение в механическую работу
теплоты, отнятой у какого-либо тела, без того, чтобы произошли
изменения в других телах.
Это – принцип Кельвина
Следовательно, превращение тепла в работу, кроме источника тепла
(нагревателя) и рабочего тела, требует наличия третьего тела.
В чем его роль?
A pdV pdV
AaB
p
A
a
b
BbA
Для получения работы за цикл нужно, чтобы
кривая BbA прошла ниже кривой AaB.
Значит, рабочее тело
перед сжатием нужно
B
V охладить.
35
pV RT
36.
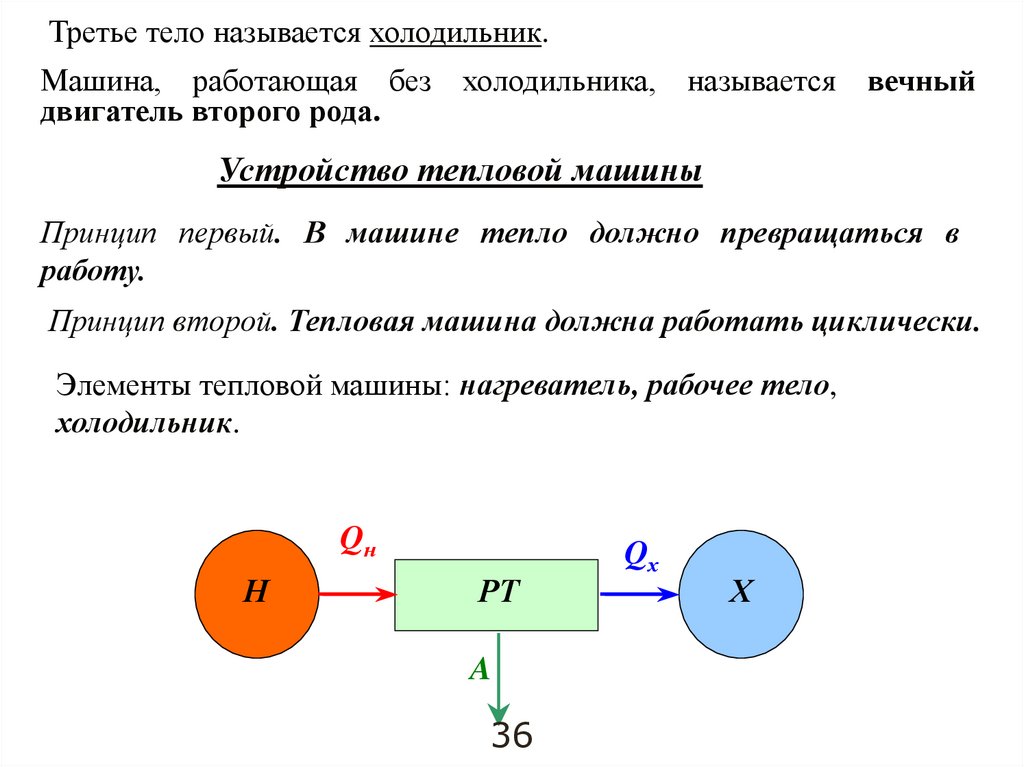
Третье тело называется холодильник.Машина, работающая без холодильника, называется
двигатель второго рода.
вечный
Устройство тепловой машины
Принцип первый. В машине тепло должно превращаться в
работу.
Принцип второй. Тепловая машина должна работать циклически.
Элементы тепловой машины: нагреватель, рабочее тело,
холодильник.
Qн
Н
РТ
A
36
Qх
Х
37.
Принцип работытепловой машины
Qн
Н
РТ
Qх
Х
A
Рабочее тело, получая тепло от нагревателя, изменяет своё состояние.
Изменяется объём рабочего тела V, совершается работа А. Объём –
это параметр состояния.
Состояние рабочего тела меняется циклически.
Графиком процесса, происходящего с рабочим телом, является в
любых координатах замкнутая линия, называемая циклом.
КАКИМ должен быть цикл для наиболее эффективного
превращения тепла в работу?
Как и в какой последовательности должны изменяться в цикле
параметры состояния рабочего тела – давление, объём, температура и
т.д.
37



























 Физика
Физика