Похожие презентации:
87915d5411a14898b6a9abb189d5de4b
1.
Теория электролитической диссоциацииАйрапетян Л.Р.
2023 г
Теория электролитической диссоциации
1
2. ПЛАН УРОКА
•1. Постановка цели урока.•2. Актуализация знаний.
•2. Изучение нового материала.
•3. Закрепление нового материала.
•4. Подведение итогов.
Теория электролитической диссоциации
2
3. ЦЕЛЬ УРОКА
•Углубить и обобщить знания, основные положениятеории электролитической диссоциации, научить
применять
их
при
составлении
уравнений
диссоциации, дать представление об универсальности
теории электролитической диссоциации, применении
ее для неорганической и органической химии.
Теория электролитической диссоциации
3
4. Актуализация знаний
•1. Какие смеси называют растворами? Какиеизвестны виды растворов?
•2. Что такое растворитель и растворенное вещество?
Какие
бывают
растворы
по
содержанию
растворенного вещества?
•3. Охарактеризуйте понятие растворимость. В каких
единицах
выражается
растворимость?
Как
классифицируются вещества по растворимости?
•4. Как влияет температура на растворимость газов,
жидкостей, твердых веществ?
Теория электролитической диссоциации
4
5. Актуализация знаний
•5. Растворение — это физический или физикохимический процесс? Назовите признаки. Приведитеточное определение раствора.
•6.
Что
такое
кристаллогидраты?
Какие
кристаллогидраты вам известны?
•7. Что такое концентрация? Какие способы
выражения концентрации вы знаете?
Теория электролитической диссоциации
5
6. Теория электролитической диссоциации
Теория электролитической диссоциации6
7.
Теория электролитической диссоциации7
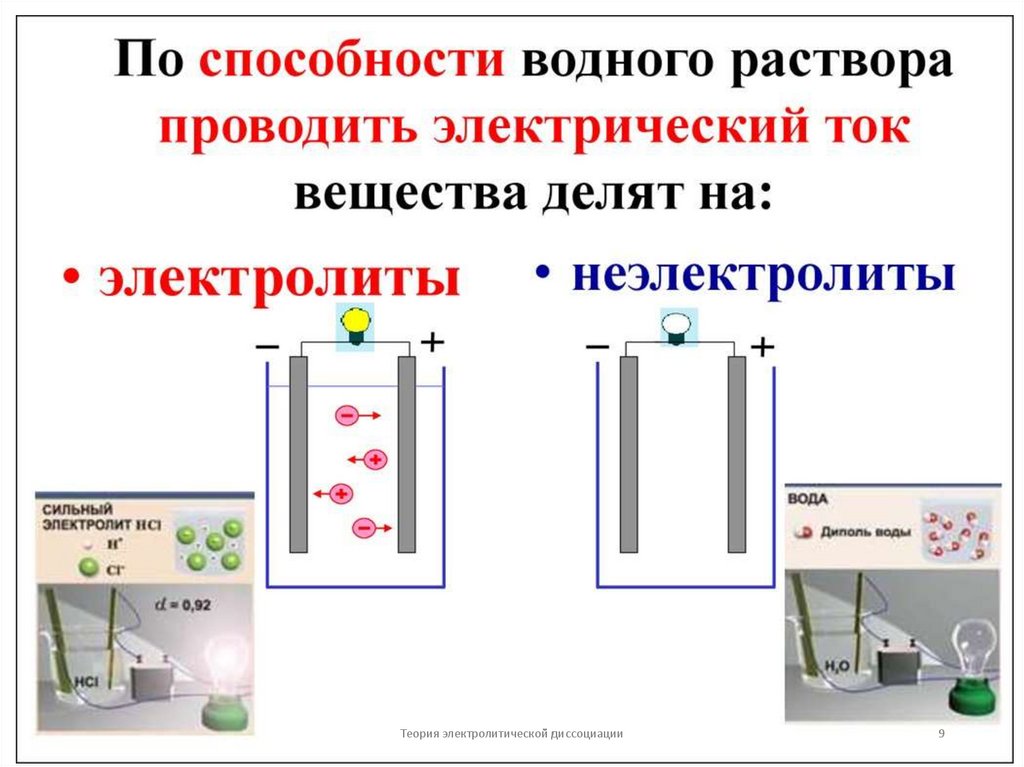
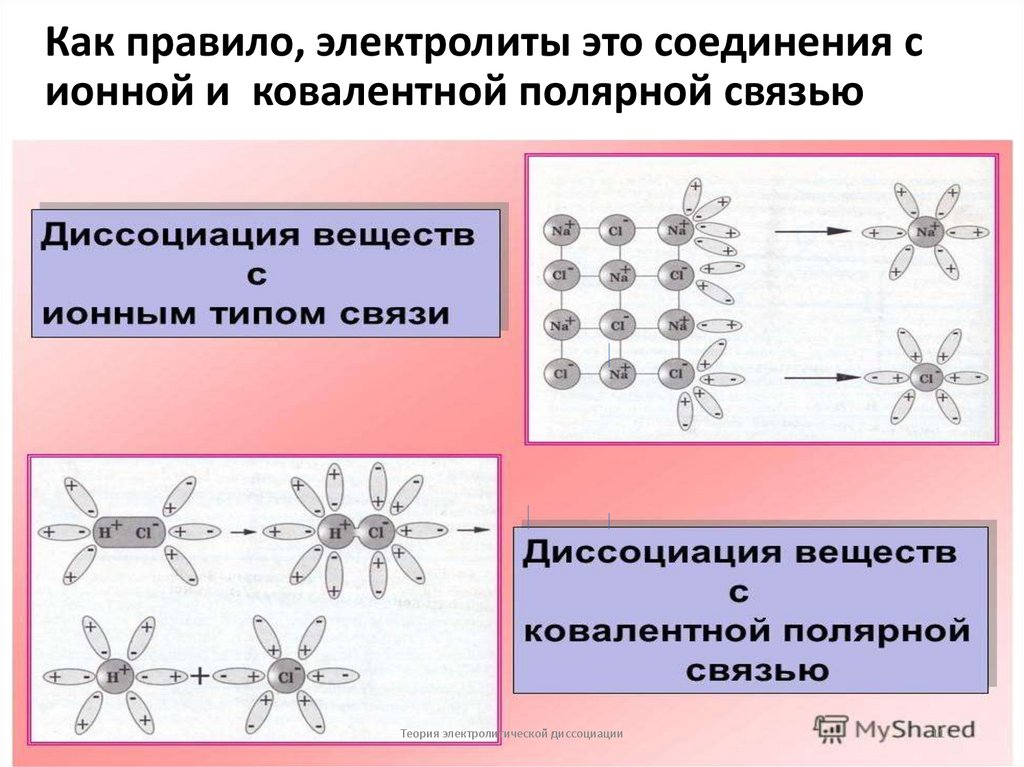
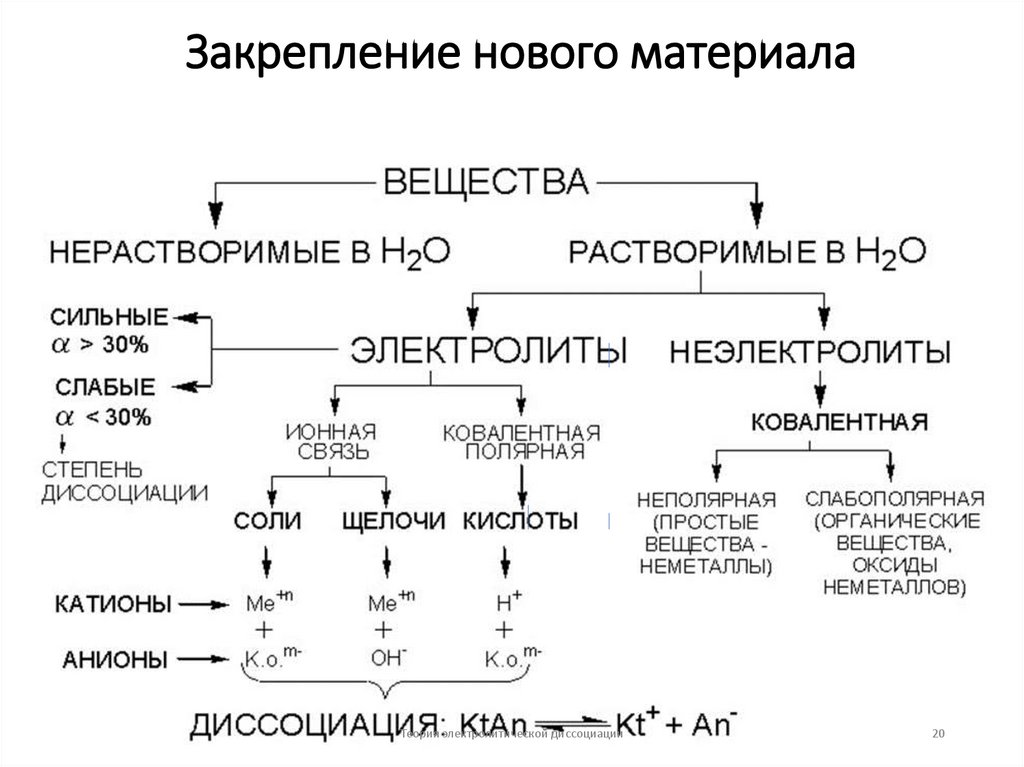
8. Основные положения теории электролитической диссоциации
•Неэлектролиты — вещества, растворыкоторых не проводят электрический ток
(органические соединения, газы): С6Н12О6 —
глюкоза, С2Н5ОН — этанол, О2, Н2 .
•Электролиты — вещества, растворы которых
проводят электрический ток. Как правило, это
соединения с ионной и ковалентной
полярной связью:
•NaCl — ионная связь
•HCl— ковалентная полярная связь.
Теория электролитической диссоциации
8
9. Теория электролитической диссоциации
Теория электролитической диссоциации9
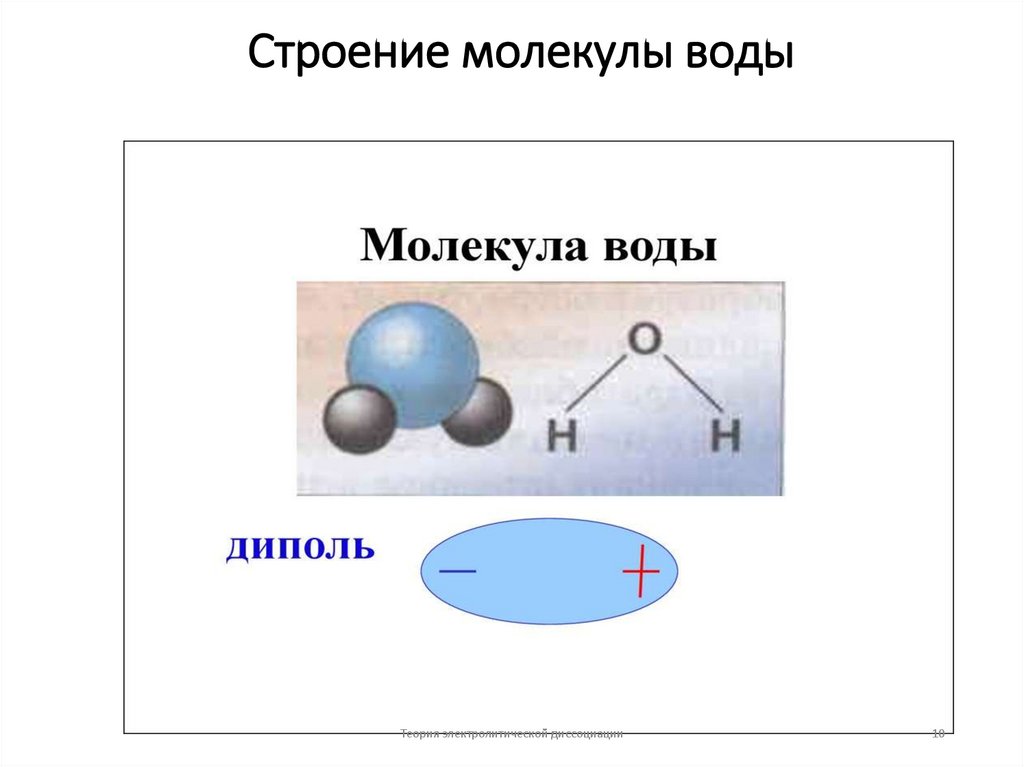
10. Строение молекулы воды
Теория электролитической диссоциации10
11. Как правило, электролиты это соединения с ионной и ковалентной полярной связью
Теория электролитической диссоциации11
12. Основные положения теории электролитической диссоциации
Теория электролитической диссоциации12
13. Основные положения теории электролитической диссоциации
•Кислоты — электролиты, которыедиссоциируют на катионы водорода и
анионы кислотного остатка.
•HCl = H+ + Cl•H2CО3 ˂=˃ 2H + + CО32•CH3CООH ˂=˃ H + + CH3CОО -
Теория электролитической диссоциации
13
14. Основные положения теории электролитической диссоциации
•Основания (Щелочи) — электролиты,которые диссоциируют на катионы
металлов и анионы гидроксигруппы.
•NaOH = Na+ + OH•Вa (OH)2 = Вa2+ + 2OH-
Теория электролитической диссоциации
14
15. Основные положения теории электролитической диссоциации
•Соли — электролиты, которыедиссоциируют на катионы металлов (или
ион аммония) и анионы кислотных
остатков.
•NaCl = Na+ + Cl •NH4NО3 = NH4+ + NО3-
Теория электролитической диссоциации
15
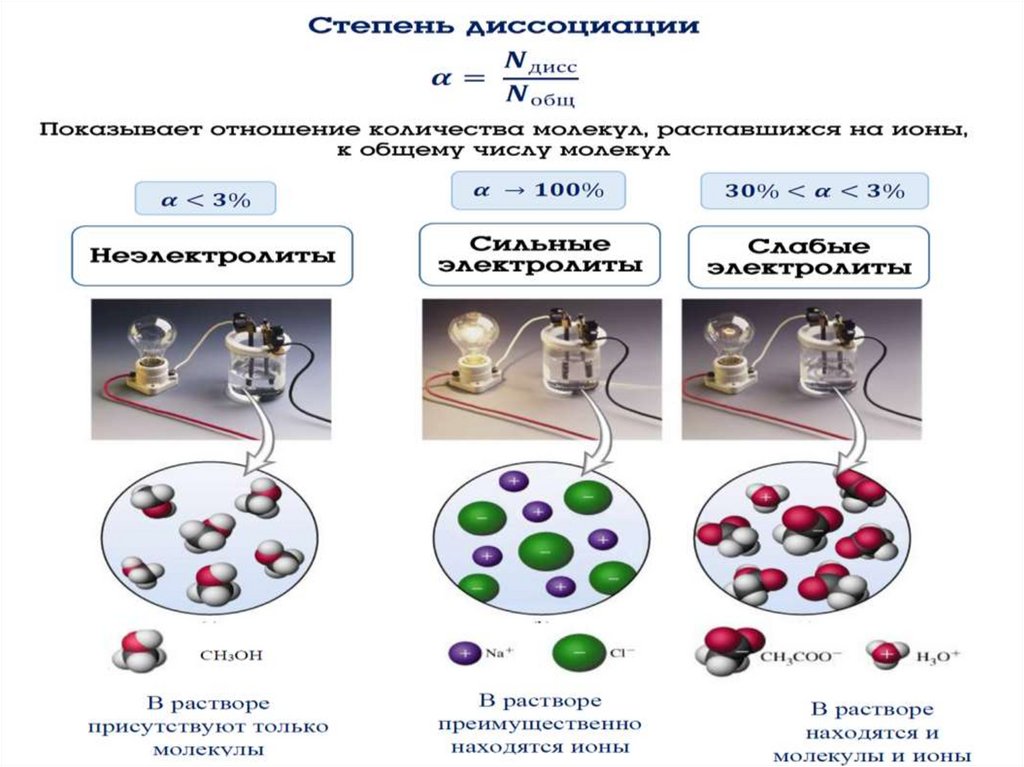
16. Основные положения теории электролитической диссоциации
•Степень электролитической диссоциации (α)это отношение количества вещества,
распавшегося на ионы (nД), к общему
количеству растворенного вещества (nР).
•α = nД / nР
•По степени электролитической диссоциации
все электролиты делятся на сильные и слабые.
Теория электролитической диссоциации
16
17. Основные положения теории электролитической диссоциации
•Степень электролитической диссоциации (α)это отношение количества вещества,
распавшегося на ионы (nД), к общему
количеству растворенного вещества (nР).
•α = nД / nР
•По степени электролитической диссоциации
все электролиты делятся на сильные и слабые.
Теория электролитической диссоциации
17
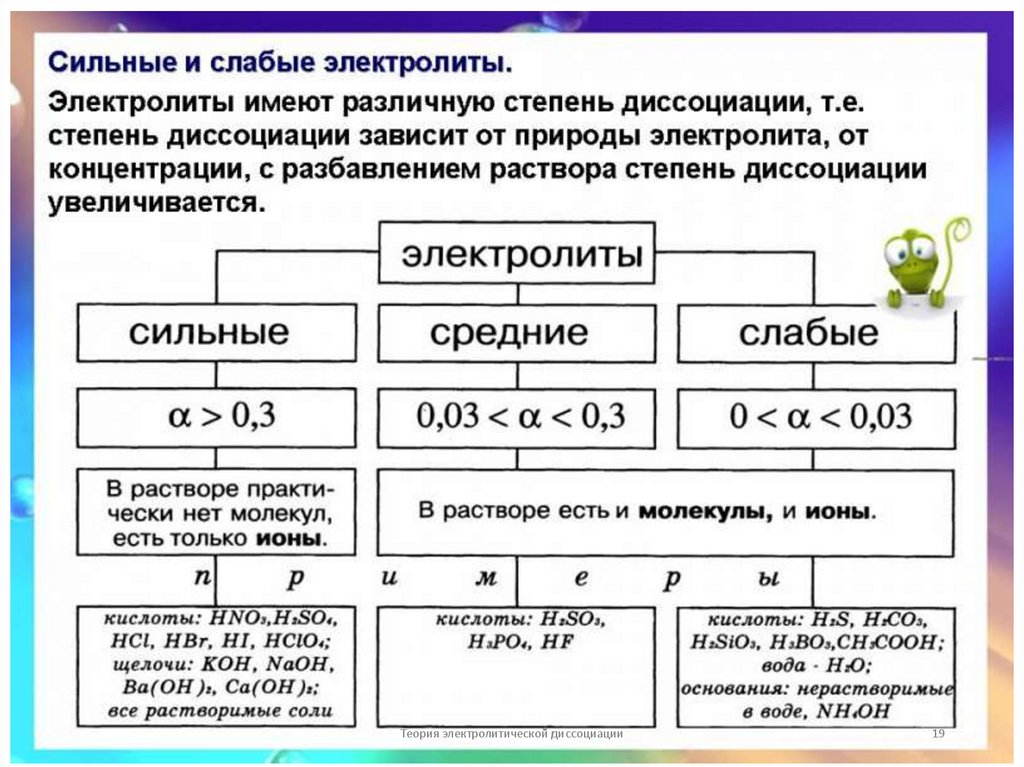
18. Основные положения теории электролитической диссоциации
• а) сильные электролиты (α→1 или 100%, α ˃ 0,3 или30%) HNО3; Na2S; КОН. Сильные электролиты при
растворении почти полностью распадаются на ионы. В
их растворах равновесие полностью смещается в
сторону прямой реакции.
•HNО3 = H+ + NО3-
Na2S = 2Na+ + S2-
• б) слабые электролиты (α→0, α ˂ 0,3 или 30%)
Н3РО4; H2CО3 ; NH3∙ H2О . В растворах слабых
электролитов равновесие смещается в сторону
образования молекул, т.е. в сторону обратной
реакции.
• NH3∙ H2О ˂=˃ NH4 + + OH -
H2CО3 ˂=˃ 2H + + CО32-
Теория электролитической диссоциации
18
19.
Теория электролитической диссоциации19
20. Закрепление нового материала
Теория электролитической диссоциации20
21. Рефлексия
• 1. Сегодня я узнал…• 2. Было трудно...
• 3. Было интересно…
• 4. Я почувствовал, что...
• 5. Урок мне дал для жизни…
Теория электролитической диссоциации
21
22. Домашнее задание
• Раздел 4.2.• Контрольные вопросы и задания 1-6 стр. 67.
• Изучить биографию (научная и общественная
деятельность) И.А. Каблукова и В.А. Кистяковского.
• Презентацию и задания смотрите в школьном портале
в разделе Д/З.
Теория электролитической диссоциации
22
23. Литература
• 1. О.С. Габриелян, И.Г. Остроумов «Химия дляпрофессий и специальностей технического профиля»,
Москва, Издательский центр «Академия», 2018.
Теория электролитической диссоциации
23
24.
Теория электролитической диссоциации24


















 Химия
Химия








