Похожие презентации:
Электролитическая диссоциация. 9 класс
1.
Урок 9 класса.Электролитическая
диссоциация.
14.09.2016
1
2.
ЭлектролитыКогда электролит попадает в воду он «разваливается» на
составляющие его катионы и анионы.
NaCl = Na+ + ClCH3COOH =H+ + CH3COO-
14.09.2016
2
3.
РастворениеNaCl = Na+ + ClДолгое время считалось, что процесс растворения имеет
только физическую природу.
Например, при разбавлении серной кислоты сосуд со
смесью нагревается. Поэтому существует правило:
серную кислоту наливают тонкой струйкой в воду при
постоянном перемешивании!
14.09.2016
3
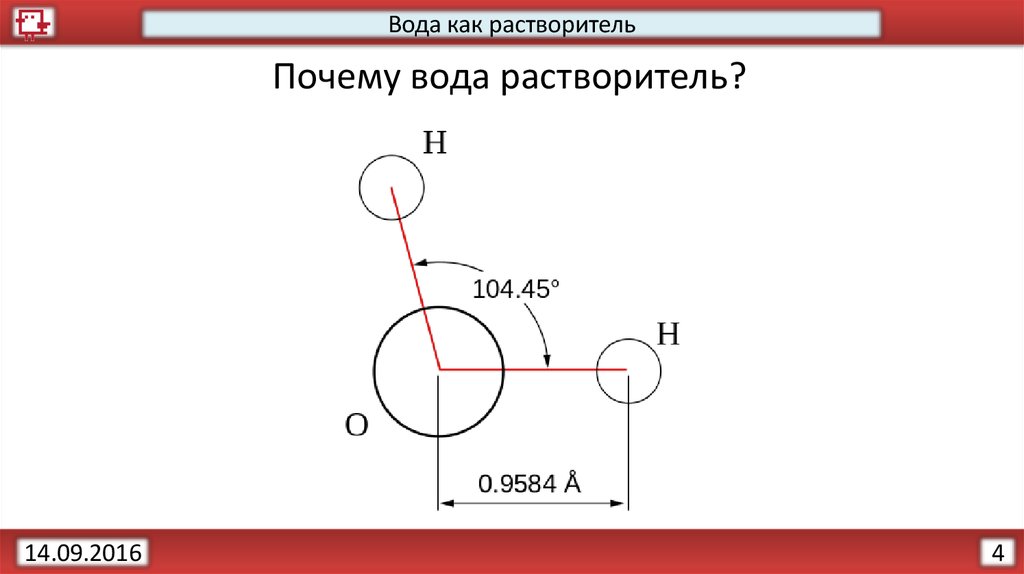
4.
Вода как растворительПочему вода растворитель?
14.09.2016
4
5.
Вода как растворитель14.09.2016
5
6.
Урок 9 класса.Электролитическая
диссоциация.
Продолжение…
15.09.2016
1
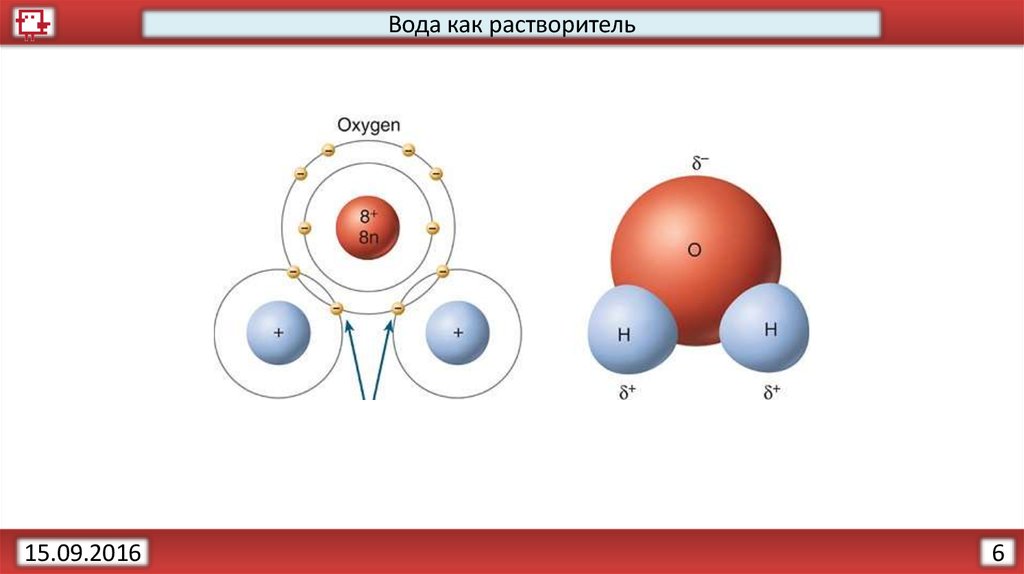
7.
Вода как растворитель15.09.2016
6
8.
Вода как растворительВещества с какой связь лучше будут
растворяться в воде?
• С ковалентной неполярной
• С ковалентной полярной
• С ионной
• С металлической
16.09.2016
7
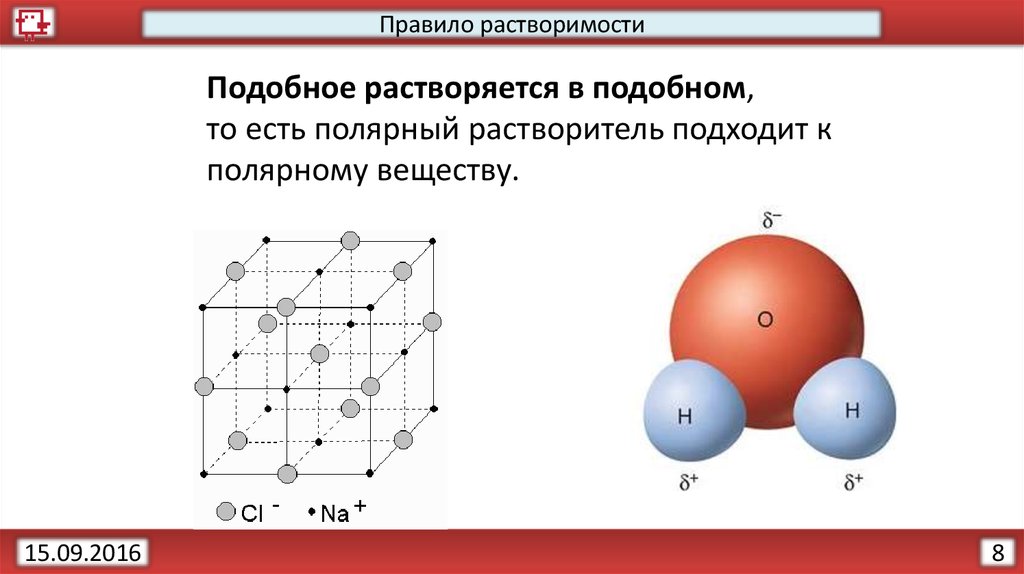
9.
Правило растворимостиПодобное растворяется в подобном,
то есть полярный растворитель подходит к
полярному веществу.
15.09.2016
8
10.
ГидратацияГидратация – присоединение воды к ионам, атомам или
молекулам. Продукты такого процесса называют гидратами.
Обратная реакция называется дегидратацией.
15.09.2016
9
11.
ГидратацияКристаллогидраты – кристаллические вещества, в состав которых
входит химически связанная вода. Такую воду называют
кристаллизационной водой.
15.09.2016
10
12.
Основные положения электролитической диссоциацииОсновные положения теории электролитической диссоциации:
1. Электролиты при растворении или плавлении распадаются на
ионы (диссоциируют) – положительные и отрицательные.
2. Под действием электрического тока ионы приобретают
направленное движение: положительные ионы стремятся к
катоду, отрицательные - к аноду.
3. Направленное движение происходит в результате притяжения
их противоположно заряженными электродами.
4. Диссоциация – обратимый процесс: одновременно вещество
распадается на ионы и ионы собираются в вещество.
15.09.2016
11
13.
Диссоциация разных веществДиссоциировать могут соли, кислоты, щелочки.
Наиболее хорошо диссоцируют вещества с ионной связью
(большой разностью электроотрицательностей).
2H2O
К
и
с
л
о
т
ы
15.09.2016
H3O+
Ион гидроксония
HCl
H+ + ClHCl + H2O
H3O+ + ClHNO3 + nH2O
H3O+ + NO3- + mH2O
HNO3 NO3- + H+
12
14.
Диссоциация кислотКислоты – такие вещества, при диссоциации в водных растворах
которых в качестве катиона отщепляется только водород (или
гидроксония ион).
2H2O
К
и
с
л
о
т
ы
15.09.2016
H+ + OH-
HCl
H+ + ClHCl + H2O
H3O+ + ClHNO3 + nH2O
H3O+ + NO3- + mH2O
HNO3 NO3- + H+
13
15.
Диссоциация кислот15.09.2016
H2SO4
HSO4-
HSO4- + H+
SO42- + H+
H3PO4
H2PO4HPO42-
H+ +H2PO4- дигидроортофосфат ион
H+ +HPO42- гидроортофосфат ион
H+ + PO43- ортофосфат ион
14
16.
Диссоциация щелочейОснованиями называются электролиты, при диссоциации которых
в качестве анионов образуются только гидроксид-ионы (OH -).
Щ
е
л
о
ч
и
15.09.2016
2H2O
H+ + OH-
NaOH
Na+ + OH-
Гидроксид-ион
Ba(ОН)2 Bа(ОН)+ + OHBa(OH)+ Ba2++OH15
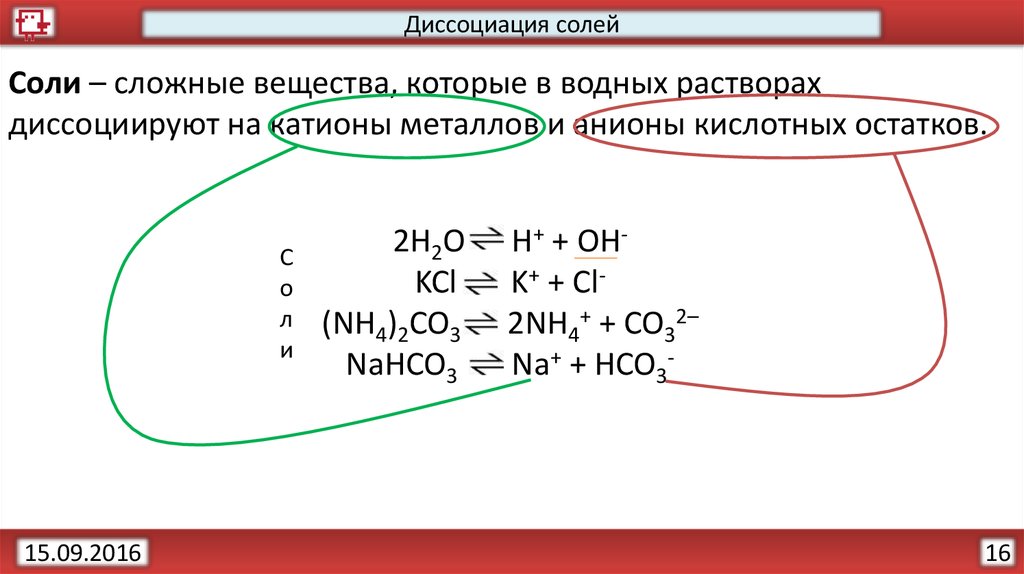
17.
Диссоциация солейСоли – сложные вещества, которые в водных растворах
диссоциируют на катионы металлов и анионы кислотных остатков.
С
о
л
и
15.09.2016
2H2O
KCl
(NH4)2CO3
NaHCO3
H+ + OHK+ + Cl2NH4+ + CO32–
Na+ + HCO3-
16
18.
Сильные и слабые электролитыБывают электролиты распадающиеся полностью, например:
NaOH
Na+ + OHБывают электролиты распадающиеся не полностью:
H2CO3 H+ + HCO3Сильные электролиты – химические соединения, которые при
растворении в воде полностью распадаются на ионы.
Слабые электролиты – соединения, которые незначительно
диссоциируют на ионы.
15.09.2016
17
19.
Степень диссоциацииРазличить слабые электролиты и сильные электролиты помогает
показатель степень диссоциации (α).
α=
15.09.2016
















 Химия
Химия








