Похожие презентации:
3a069aa2efa24dba9d348228151bb727
1.
Классификация неорганическихсоединений и их свойства.
Кислоты в свете теории ЭД
Айрапетян Л.Р.
2020 г
2. Кислоты в свете теории ЭД
Кислоты — это электролиты, которыедиссоциируют на катионы водорода и анионы
кислотного остатка.
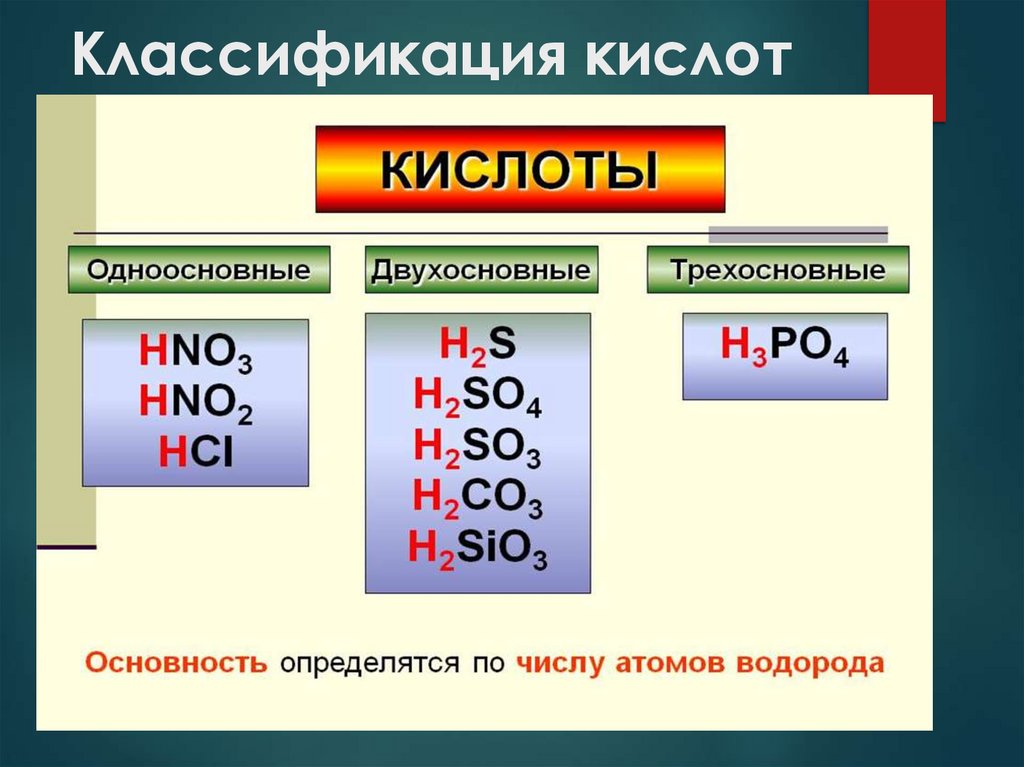
3. Классификация кислот
4. Классификация кислот
5. Классификация кислот
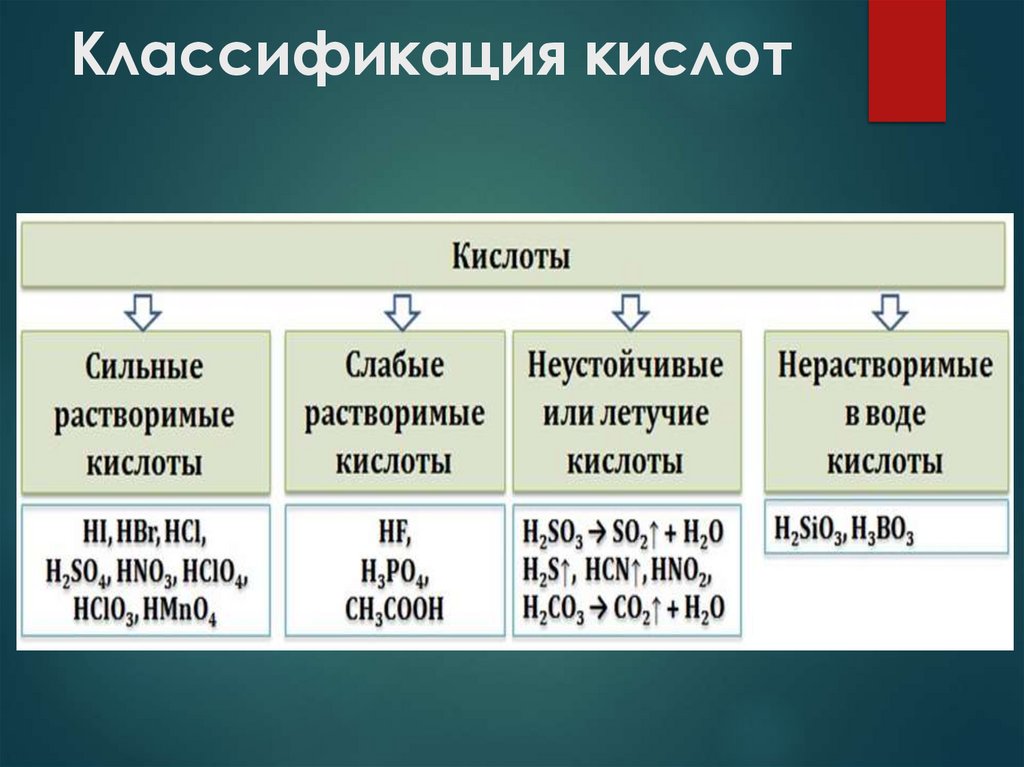
6. Классификация кислот
ПризнакНаличие
кислорода
Группа кислот
Примеры
атома Кислородсодержащие H2SO4, HNO3, H3PO4
Бескислородные
H2S, HCl, HCN
Основность
(число Одноосновные
атомов водорода)
Двухосновные
Трехосновные
Растворимость
Растворимые
Нерастворимые
HCl, HNO3
H2S, H2SO4, H2CO3
H3PO4
H2SO4, HNO3, HBr
H2SiO3
Летучесть
Летучие
Нелетучие
H2S, HCl
H2SO4, H2SiO3
Степень ЭД
Сильные (α→1)
Слабые (α→0)
H2SO4, HCl, HNO3
H2S, H2CO3
Стабильность
Стабильные
Нестабильные
H2SO4, H3PO4, HCl
H2CO3, H2SO3, H2SiO3
7. Химические свойства кислот
1. Растворы кислот действуют на индикаторы.Все кислоты (кроме кремниевой) хорошо
растворяются в воде. Специальные вещества –
индикаторы позволяют определить присутствие
кислоты.
Индикаторы меняют свою окраску в зависимости
от взаимодействия с разными химическими
веществами. В нейтральных растворах — они
имеют одну окраску, в растворах оснований –
другую. При взаимодействии с кислотой они
меняют свою окраску: индикатор метиловый
оранжевый окрашивается в красный цвет,
индикатор лакмус – тоже в красный цвет.
8. Химические свойства кислот
2. Взаимодействуют с металлами. Для взаимодействиякислот с металлами должны выполнятся некоторые
условия:
1. металл должен быть достаточно активным по
отношению к кислотам (в ряду активности металлов он
должен располагаться до водорода). Чем левее находится
металл в ряду активности, тем интенсивнее он
взаимодействует с кислотами;
2. кислота должна быть достаточно сильной (то есть
способной отдавать ионы водорода H+).
9. Химические свойства кислот
10. Химические свойства кислот
2. Взаимодействуют с металлами.При протекании химических реакций кислоты с
металлами образуется соль и выделяется водород
(кроме взаимодействия металлов с азотной и
концентрированной серной кислотами):
Zn + 2HCl = ZnCl2 + H2↑
Cu + 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O.
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2 NO2↑ + 2H2O.
11. Химические свойства кислот
3. Взаимодействуют с основными и амфотернымиоксидами с образованием воды и соли (реакция
нейтрализации). Соль содержит кислотный остаток той
кислоты, которая использовалась в реакции
нейтрализации:
CuO + H2SO4 = CuSO4 + H2O.
CuO + 2HNO3 = Cu(NO3)2 + H2O.
4. Взаимодействуют с основаниями с образованием
воды и соли, в которой содержится неизменный
кислотный остаток (реакция нейтрализации):
Cu(OH)2 +H2SO4 = CuSO4 + 2H2O.
NaOH + HNO3 = NaNO3 + H2O.
12. Химические свойства кислот
5. Взаимодействуют с солями, если в результатереакции образуется осадок или газ.
5.1. Качественная реакция на галогенид-ионы (Cl-, Br-,
I-)
AgNO3 +HCl = AgCl↓ + HNO3 (реакция серебряного
зеркала)
5.2. Качественная реакция на серную кислоту и ее
соли
H2SO4 +BaCl2 = BaSO4↓ + 2HCl.
5.3. Качественная реакция на соли угольной кислоты
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑ .
13. Способы получения кислот
Бескислородные1. Прямой синтез из водорода и неметалла с
последующим растворением полученного
соединения в воде
H2 + Cl2 = 2HCl (промышленный способ)
2. Реакция обмена между солью и менее летучей
кислотой
2NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl
14. Способы получения кислот
Кислородсодержащие1. Растворение ангидридов в воде. (Слово ангидрид
означает безводный, то есть кислота без воды).
SO3 + H2O = H2SO4
2. Реакция обмена между солью и кислотой
Ca3(PO4)2 + 3H2SO4 (конц.) = 3CaSO4 + 2H3PO4
15. Физические свойства кислот
Многие кислоты, например, серная, азотная,соляная – это бесцветные жидкости. Известны также
твёрдые кислоты: ортофосфорная H3PO4,
метафосфорная HPO3, борная H3BO3. Почти все
кислоты растворимы в воде. Пример
нерастворимой кислоты – кремниевая H2SiO3.
Растворы кислот имеют кислый вкус. Так,
например, многим плодам придают кислый вкус
содержащиеся в них кислоты. Отсюда названия
кислот: лимонная, яблочная и т.д.
16. Домашнее задание
Раздел 5.1.Упр.1- 4 стр. 77.















 Химия
Химия








