Похожие презентации:
Антибиотики как ЛС
1. Антибиотики как ЛС
Государственное образовательное учреждение высшего профессионального образованияНИЖЕГОРОДСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
Федерального агентства по здравоохранению и социальному развитию
КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ И ФАРМАКОГНОЗИИ
Антибиотики как ЛС
Доцент кафедры фармацевтической химии и
фармакогнозии, к.х.н.,
Жильцова Ольга Евгеньевна
2.
История открытия антибиотиков•1910-1913 г.г. выделение пеницилловой кислоты (О. Блэк и У. Альсберг);
•1929 г. открытие пенициллина из штамма плесневого гриба Penicillium
notatum (А.Флеминг)
•1940-1941 г.г. выделение в кристаллическом виде пенициллина (Х.
Флори, Э.Чейн и Н.Хитли);
•1945 г. доказательство строение методом РСА пенициллина;
•1948 г. использование пенициллина в клинике (Э.Чейн).
•1937
г.
открытие
актиномицетина
первого
антибиотика
стрептимицетного происхождения (М.Вельш)
•1939 г. получение мицетина (Н.А.Красильников и А.И.Кореняко) и
тиротрицина (Р.Дюбо)
•1944 г. выделение стрептомицина (Шатц, Ваксман)
•1948 г. выделение левомицитина (Bartz), хлортетрациклина (Duggar), и
цефалоспорина С из плесени Cephalosporium acremonium (Brotzu)
3. Понятие об антибиотиках
Понятие антибиотиков ввел Ваксман (США) в 1942 году.Антибиотики – это химические вещества, образуемые
микроорганизмами, обладающие способностью подавлять рост
или даже разрушать бактерии и другие микроорганизмы.
Антибиотики — специфические продукты жизнедеятельности
или их модификации, обладающие высокой физиологической
активностью по отношению к определенным группам
микроорганизмов (вирусам, бактериям, грибам, водорослям,
протозоа) или к злокачественным опухолям, избирательно
задерживающие их рост либо полностью подавляющие развитие
(Егоров Н.С.)
3
4. Химическая классификация
Основана на выделении групп антибиотиков с характернымструктурным признаком (Навашин).
1. алициклического строения (тетрациклин и его производные);
2. ароматического ряда (левомицетин и его препараты);
3. гетероциклического строения (пенициллины, цефалоспорины);
4. аминогликозиды (неомицин, гентамицин);
5. макролиды (олеандомицин);
6. полиены (нистатин);
7. противоопухолевые (хиноидной структуры) (доксорубицин,
актиномицин);
а) производные алуриоловой кислоты (олигомицин);
б) антрациклины (прогомицин);
в) производные хинолин-5,8-диона (брунеомицин);
8. полипептидной структуры (грамицидины);
4
9. различного строения (линкомицин, фугидин).
5. Биохимическая классификация
Основана на различном механизме действия1.
Специфические ингибиторы биосинтеза клеточной стенки
бактерий (пенициллины, цефалоспорины);
2.
ингибиторы функциональной мембраны (полиены, полимиксины,
аминогликозиды);
3.
ингибиторы синтеза белка и функций рибосом (тетрациклины,
макролиды, левомицетин, линкозамиды);
4.
ингибиторы синтеза РНК (доксорубицин, актиномицин,
производные алуриоловой кислоты);
5.
ингибиторы синтеза ДНК (доксорубицин, брунеомицин).
5
6. Фармакологическая классификация
Основана на различном спектре действия.1.
Преимущественно на Гр(+)-микроорганизмы (пенициллины,
цефалоспорины);
2.
широкий спектр действия (левомицетин, цефалоспорины);
3.
противогрибковые (нистатин, леворин);
4.
противоопухолевые (брунеомицин);
5.
по типу антимикробного действия:
• бактерицидное (пенициллины, цефалоспорины,
полимиксины, аминогликозиды);
• бактериостатическое (тетрациклины, макролиды,
левомицетин, линкозамиды).
6
7. Требования к эффективности и безопасности
1.Высокая избирательность действия.
2.
Отсутствие или медленное развитие резистентности возбудителя
к препарату.
3.
Сохранение антимикробного эффекта в жидкостях и тканях
организма.
4.
Отсутствие или уменьшение уровня инактивации белками
сыворотки крови.
5.
Хорошее всасывание, распределение и выведение из организма.
6.
Удобная лекарственная форма, обеспечивающая наилучшее
хранение.
7
8. Способы получения антибиотиков
Микробиологический синтез на основе плесени и лучистыхгрибов (природные пенициллины, гликозидные антибиотики,
макролиды).
2. Химический синтез (левомицетин и его препараты).
3. Сочетание первого и второго способов (полусинтетические
пенициллины и цефалоспорины, тетрациклины).
1.
Промышленное получение антибиотиков включает стадии:
1. Выбор высокопроизводительных штаммов продуцента (до 45 000
ЕД/мл) и питательных сред для него;
2. Процесс биосинтеза;
3. Выделение из культуральной жидкости и его очистка
8
9. Единицы биологической активности антибиотиков
Единица действия – минимальное количествоантибиотика (мкг), подавляющее развитие тест-организма в
определенном объеме питательной среды. Используют ГСО (ГФ
ХI, т. 2, с. 60).
Активность ГСО устанавливают в соответствии с
международным стандартом.
Международный стандарт – максимально очищенный
антибиотик, выпускаемый в ампулах нейтрального стекла,
хранится при температуре < 0 °С.
9
10. Причины создания больших количеств антибиотиков
1.Высокая резистентность микроорганизмов.
2.
Повышение селективности действия.
3.
Неустойчивость многих препаратов к действию ферментов
4. Применение в сельском хозяйстве.
5. Использование в пищевой промышленности.
10
11. Антибиотики как ЛС β-лактамные антибиотики
Государственное образовательное учреждение высшего профессионального образованияНИЖЕГОРОДСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
Федерального агентства по здравоохранению и социальному развитию
КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ И ФАРМАКОГНОЗИИ
Антибиотики как ЛС
β-лактамные антибиотики
Доцент кафедры фармацевтической химии и
фармакогнозии, к.х.н.,
Жильцова Ольга Евгеньевна
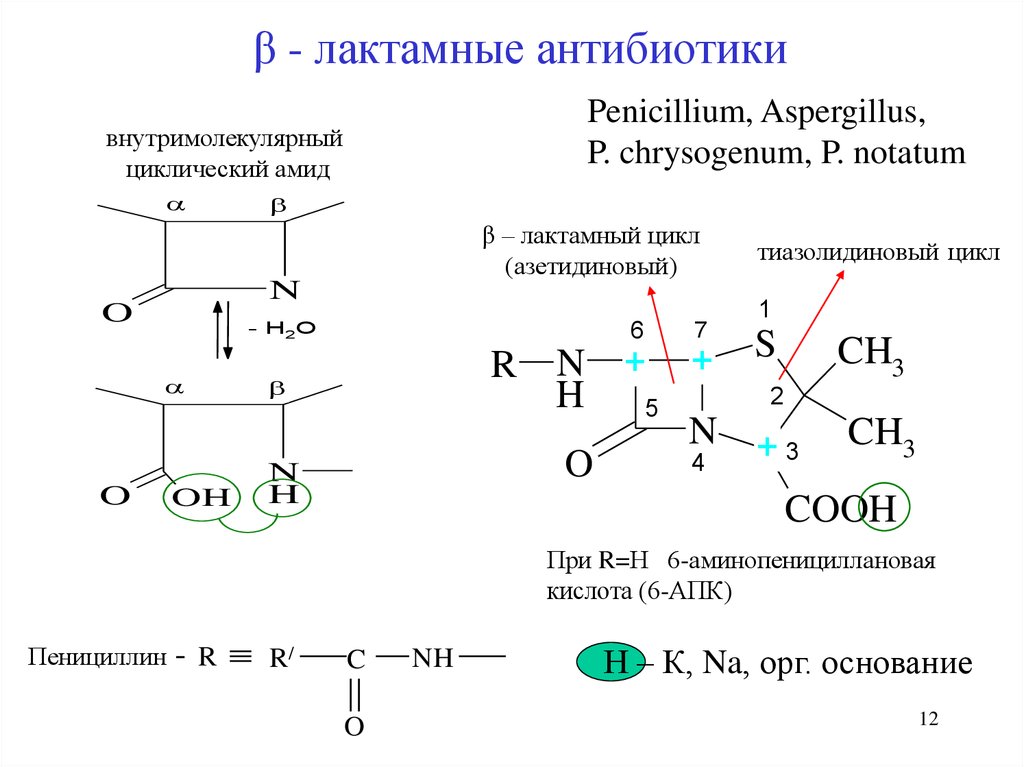
12. β - лактамные антибиотики
Penicillium, Aspergillus,P. chrysogenum, P. notatum
внутримолекулярный
циклический амид
β – лактамный цикл
(азетидиновый)
N
O
- H2O
O
OH
R
N
H
O
N
H
6
7
+
+
5
тиазолидиновый цикл
1
S
CH3
2
N +3
4
CH3
COOH
При R=Н 6-аминопенициллановая
кислота (6-АПК)
Пенициллин
-R
R/
C
O
NH
Н – К, Na, орг. основание
12
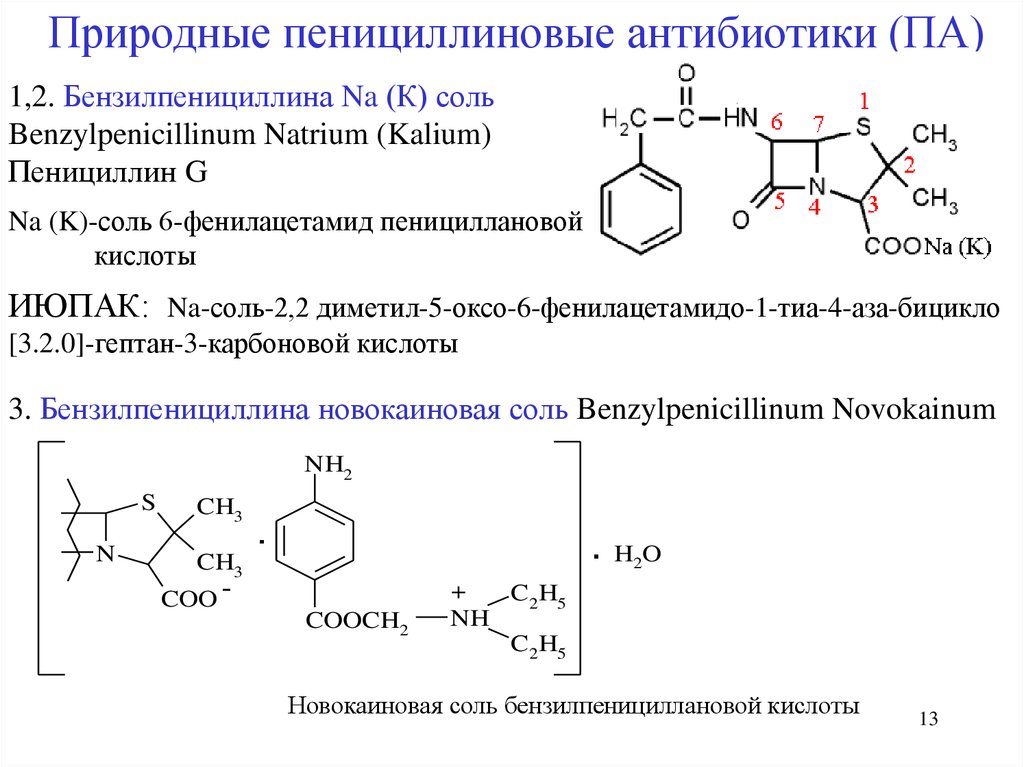
13.
Природные пенициллиновые антибиотики (ПА)1,2. Бензилпенициллина Na (К) соль
Benzylpenicillinum Natrium (Kalium)
Пенициллин G
Na (K)-соль 6-фенилацетамид пенициллановой
кислоты
ИЮПАК: Na-соль-2,2 диметил-5-оксо-6-фенилацетамидо-1-тиа-4-аза-бицикло
[3.2.0]-гептан-3-карбоновой кислоты
3. Бензилпенициллина новокаиновая соль Benzylpenicillinum Novokainum
NH2
S
N
CH3
CH3
COO -
.
.HO
2
COOCH2
+
C2 H5
NH
C2 H5
Новокаиновая соль бензилпенициллановой кислоты
13
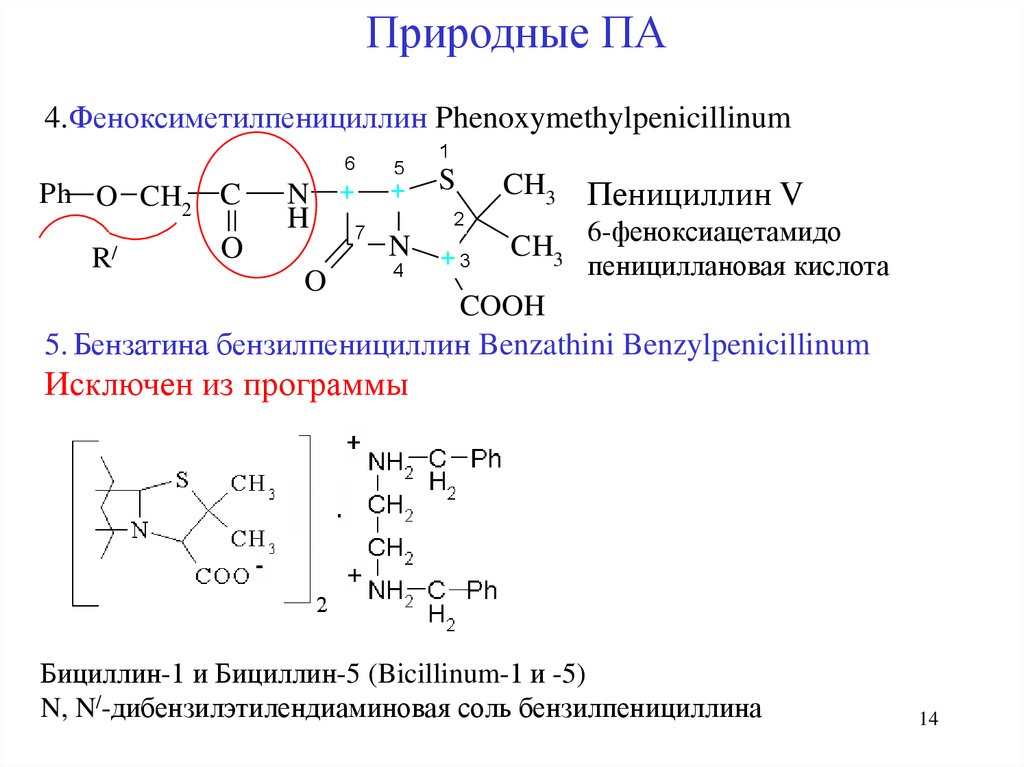
14.
Природные ПА4.Феноксиметилпенициллин Phenoxymethylpenicillinum
6
5
1
CH3 Пенициллин V
N + + S
2
H
7
6-феноксиацетамидо
CH
N
O
/
3 пенициллановая кислота
R
+3
4
O
COOH
5. Бензатина бензилпенициллин Benzathini Benzylpenicillinum
Ph O CH2 C
Исключен из программы
Бициллин-1 и Бициллин-5 (Bicillinum-1 и -5)
N, N/-дибензилэтилендиаминовая соль бензилпенициллина
14
15.
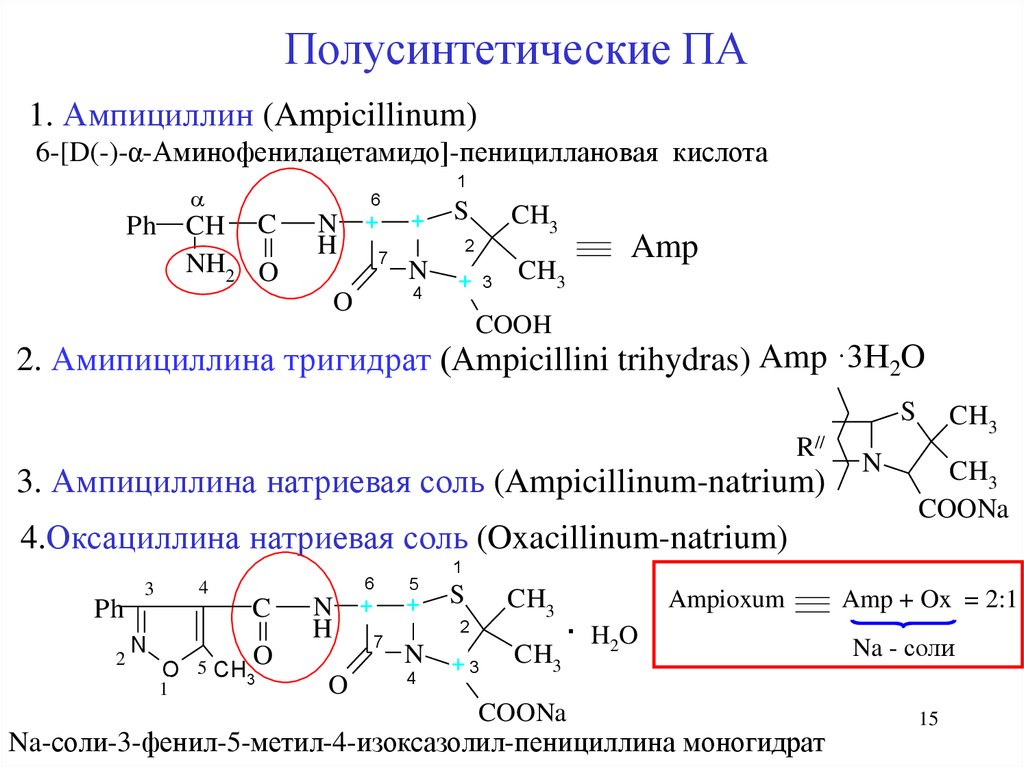
Полусинтетические ПА1. Ампициллин (Ampicillinum)
6-[D(-)-α-Аминофенилацетамидо]-пенициллановая кислота
1
6
CH C
NH2 O
Ph
N + + S
2
H
7
N +
4
O
CH3
3
CH3
Amp
COOH
2. Амипициллина тригидрат (Аmpicillini trihydras) Amp ·3H2O
S
R//
3. Ампициллина натриевая соль (Ampicillinum-natrium)
4.Оксациллина натриевая соль (Oxacillinum-natrium)
N
CH3
CH3
COONa
1
Ph
2
4
3
N
6
C
O
O 5 CH3
1
5
CH3
N + + S
2
H
H2 O
7
N + 3 CH3
4
O
COONa
.
Ampioxum
Na-соли-3-фенил-5-метил-4-изоксазолил-пенициллина моногидрат
Amp + Ox = 2:1
Na - соли
15
16.
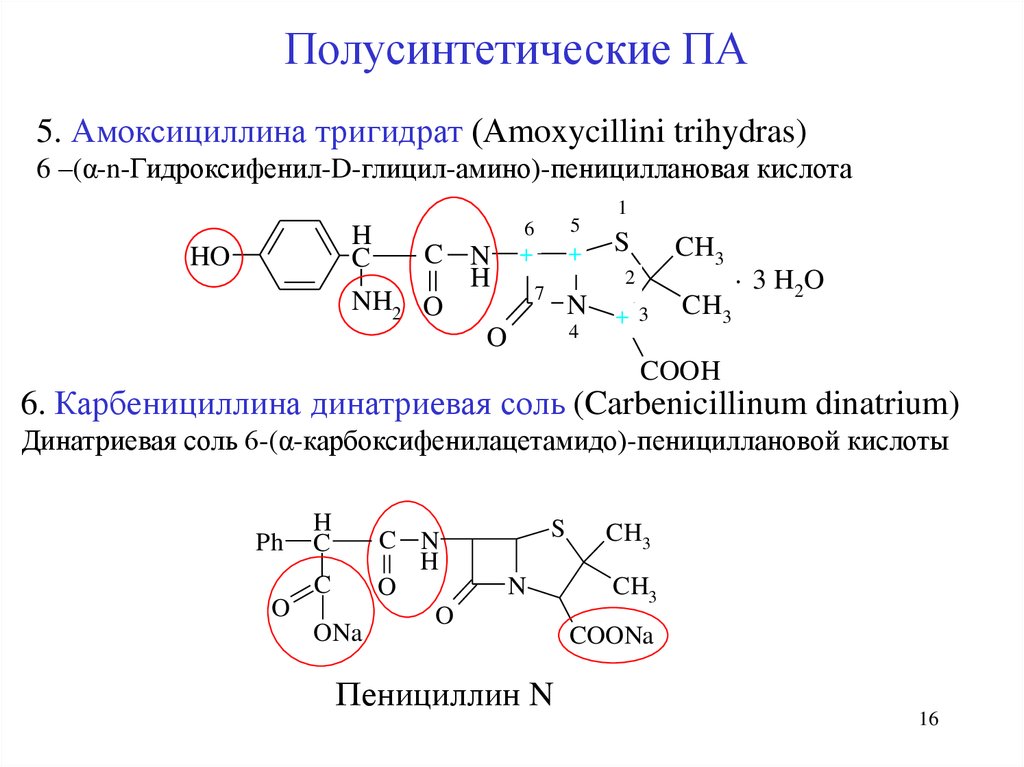
Полусинтетические ПА5. Амоксициллина тригидрат (Аmoxycillini trihydras)
6 –(α-n-Гидроксифенил-D-глицил-амино)-пенициллановая кислота
6
H
C
HO
5
NH2
1
CH3
C N + + S
. 3 H2 O
2
H
7
N + 3 CH3
O
4
O
COOH
6. Карбенициллина динатриевая соль (Carbenicillinum dinatrium)
Динатриевая соль 6-(α-карбоксифенилацетамидо)-пенициллановой кислоты
Ph
H
C
C
O
ONa
C N
H
O
O
S
N
Пенициллин N
CH3
CH3
COONa
16
17.
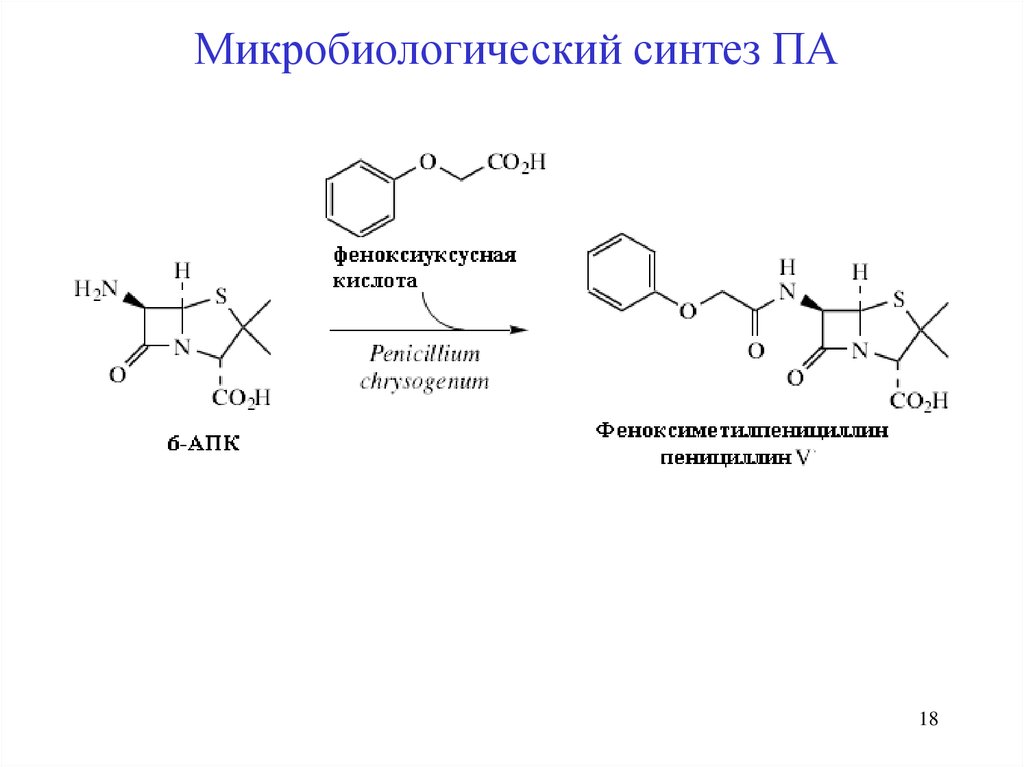
Микробиологический синтез ПАPenicillium, Aspergillus,
P. chrysogenum, P. notatum
1. Подготовка питательной среды и проращивание пор
2. Ферментация, асептические условия, t = 24-260C, рН 6,0-6,5;
τ =2-3 суток, непрерывная аэрация воздуха
3. Отделение мицеллий, экстракция
БПК NaHCO3 Na-соль БПК HCl
Экстракция CHCl3
БПК
4. Очистка и сушка
17
18.
Микробиологический синтез ПА18
19.
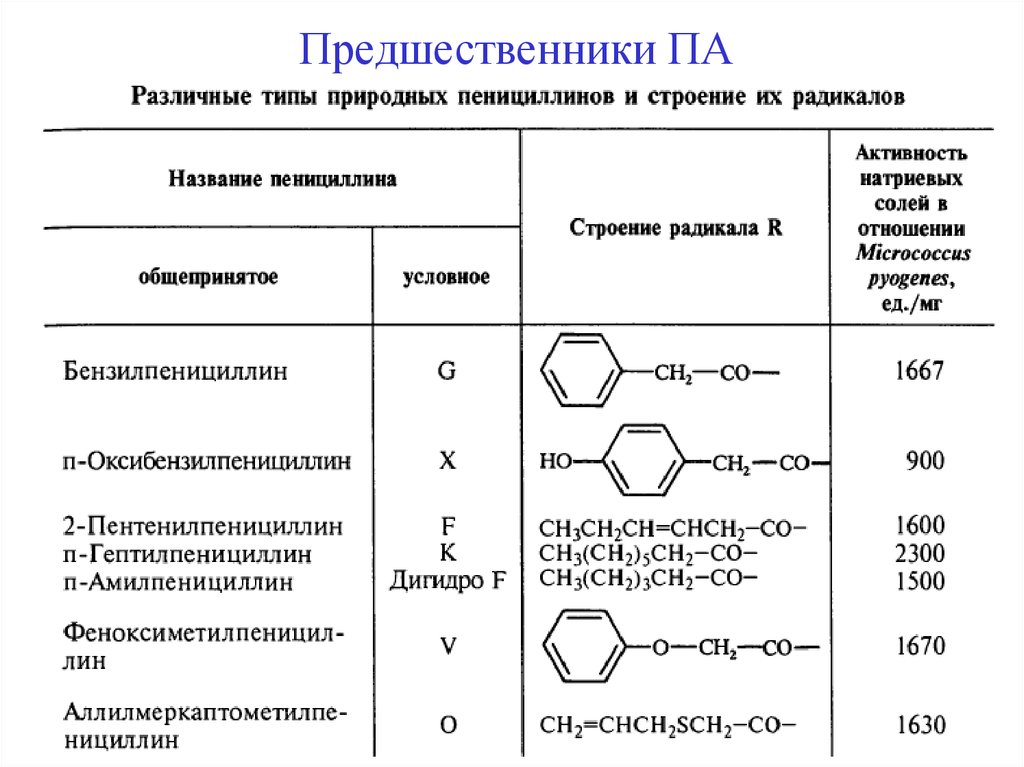
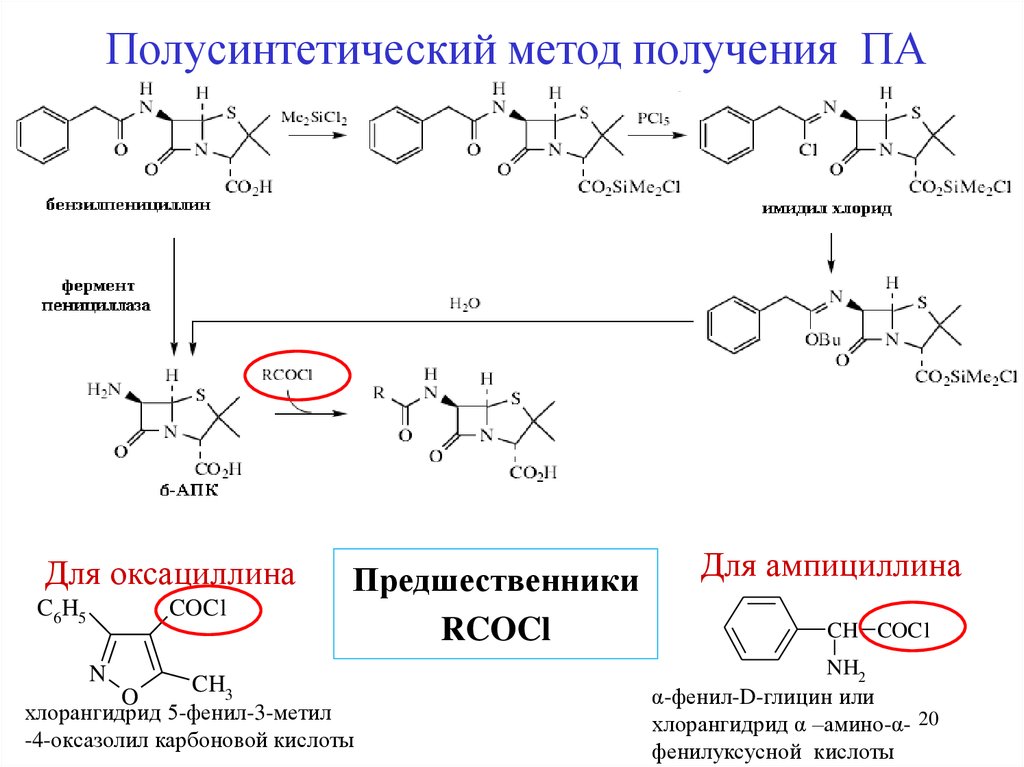
Предшественники ПА20.
Полусинтетический метод получения ПАДля оксациллина
C6 H5
COCl
N
O
CH3
Предшественники
RCOCl
хлорангидрид 5-фенил-3-метил
-4-оксазолил карбоновой кислоты
Для ампициллина
CH COCl
NH2
α-фенил-D-глицин или
хлорангидрид α –амино-α- 20
фенилуксусной кислоты
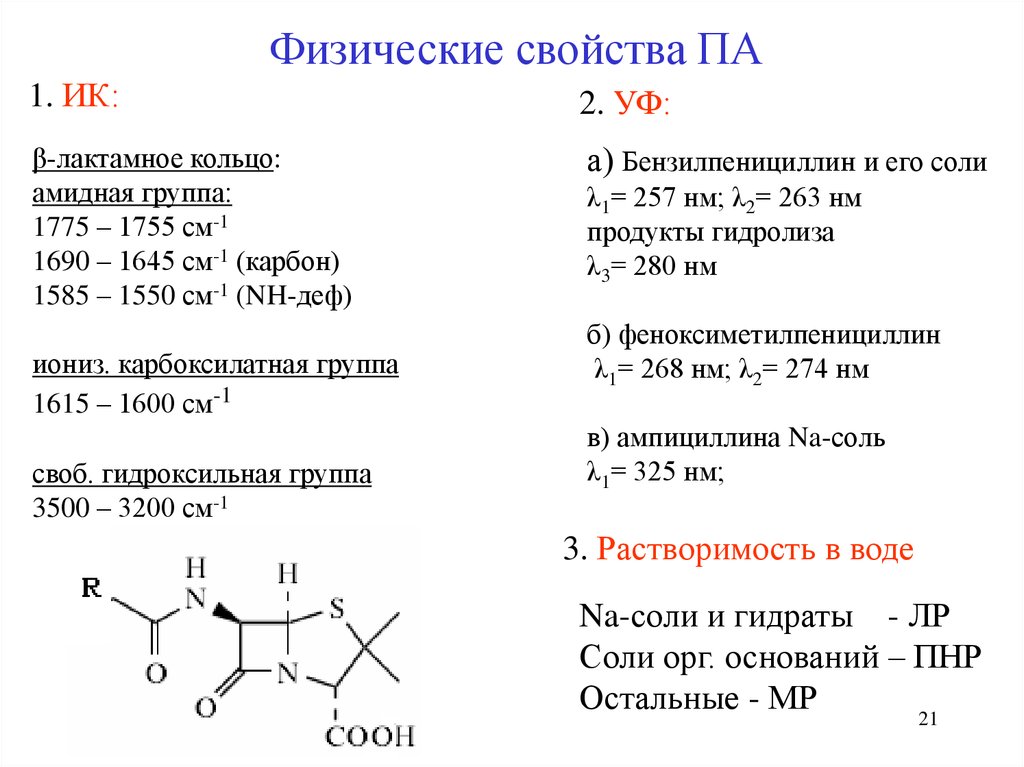
21.
Физические свойства ПА1. ИК:
2. УФ:
β-лактамное кольцо:
амидная группа:
1775 – 1755 см-1
1690 – 1645 см-1 (карбон)
1585 – 1550 см-1 (NH-деф)
а) Бензилпенициллин и его соли
иониз. карбоксилатная группа
1615 – 1600 см-1
своб. гидроксильная группа
3500 – 3200 см-1
λ1= 257 нм; λ2= 263 нм
продукты гидролиза
λ3= 280 нм
б) феноксиметилпенициллин
λ1= 268 нм; λ2= 274 нм
в) ампициллина Na-соль
λ1= 325 нм;
3. Растворимость в воде
Na-соли и гидраты - ЛР
Соли орг. оснований – ПНР
Остальные - МР
21
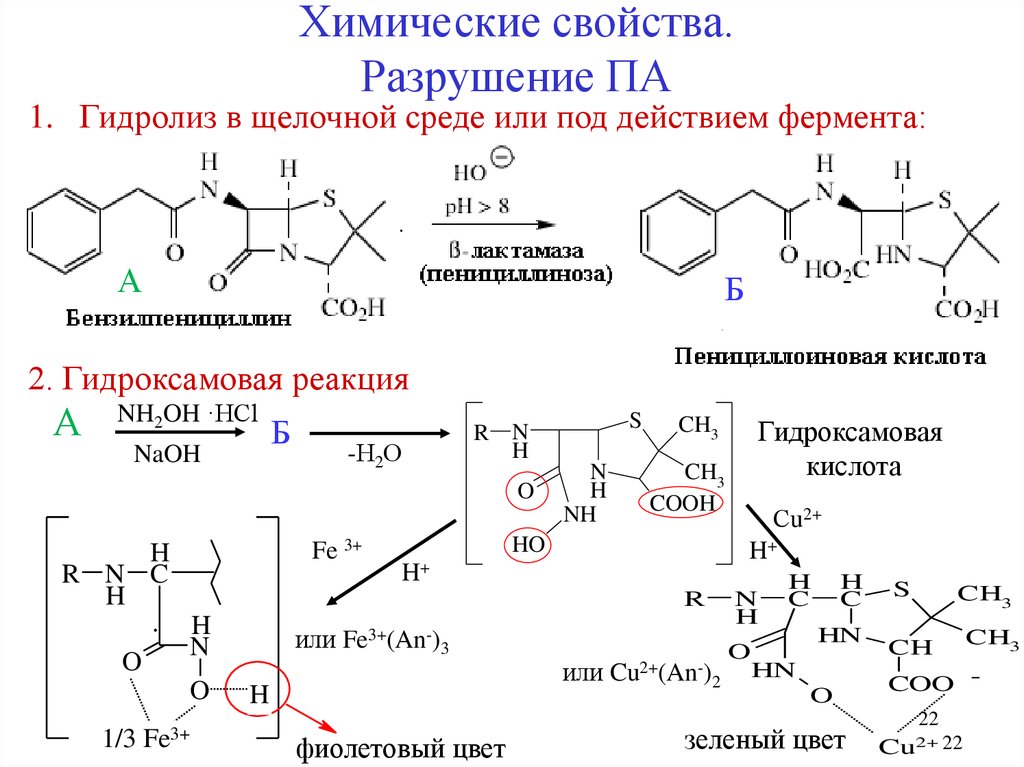
22.
Химические свойства.Разрушение ПА
1. Гидролиз в щелочной среде или под действием фермента:
А
Б
2. Гидроксамовая реакция
А
NH2OH ·HCl
NaOH
Б
-Н2О
O
Fe 3+
H
R N C
H
O
1/3
Fe3+
N
H
NH
CH3
COOH
HO
или Fe3+(An-)3
или Cu2+(An-)2
фиолетовый цвет
Сu2+
H+
H+
H
Гидроксамовая
кислота
CH3
R
H
N
O
S
R N
H
N
H
O
H
C
H
C
HN
HN
O
зеленый цвет
S
CH3
CH
CH3
COO 22
Cu2+ 22
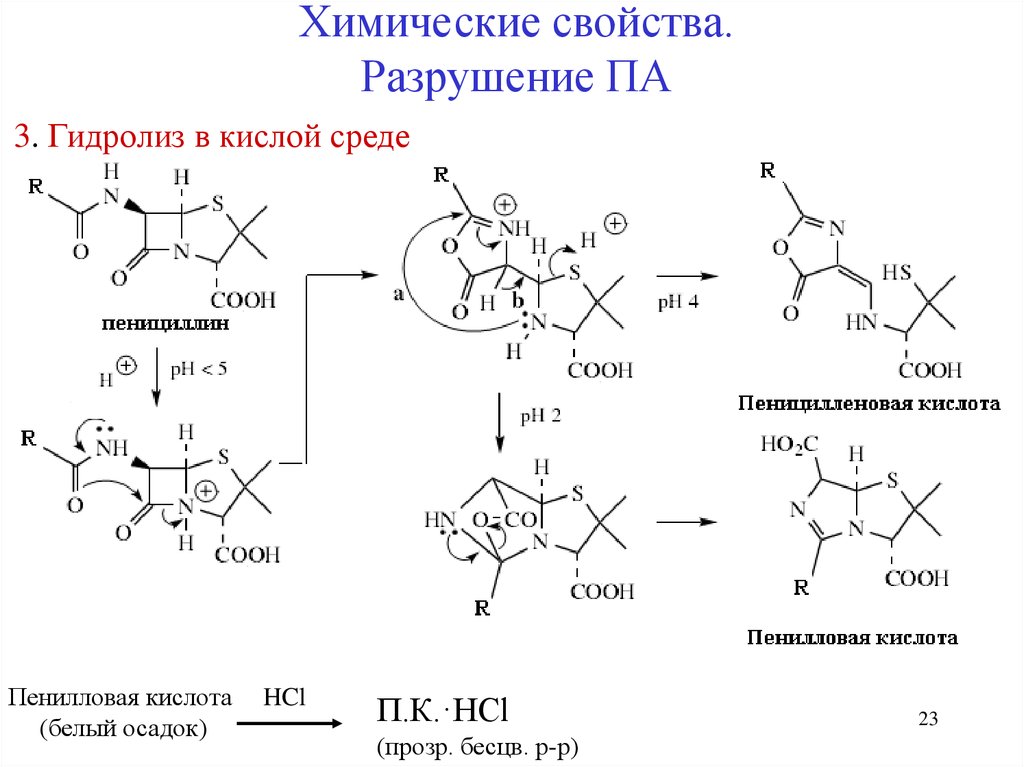
23.
Химические свойства.Разрушение ПА
3. Гидролиз в кислой среде
Пенилловая кислота
(белый осадок)
HCl
П.К.·HCl
(прозр. бесцв. р-р)
23
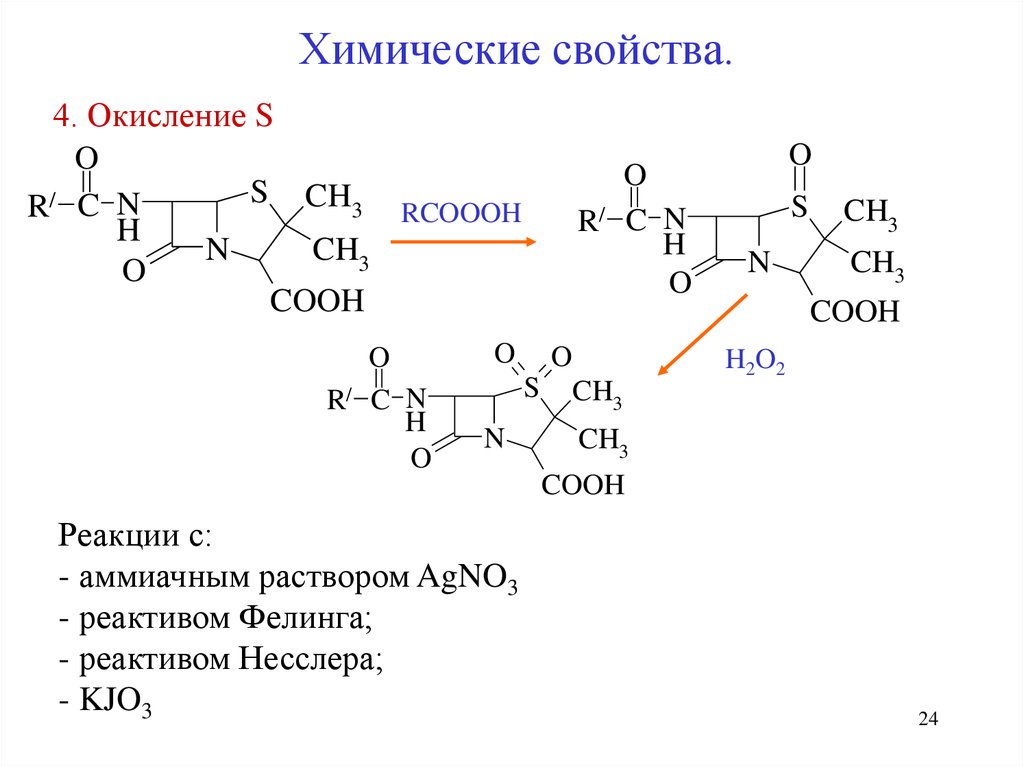
24. 4. Окисление S
Химические свойства.4. Окисление S
O
S CH3
R/ C N
RCOOOH
H
N
CH3
O
COOH
O
R/ C N
H
O
O
R/ C N
H
O
S
N
CH3
CH3
COOH
O
O
S
N
O
H2O2
CH3
CH3
COOH
Реакции с:
- аммиачным раствором AgNO3
- реактивом Фелинга;
- реактивом Несслера;
- KJO3
24
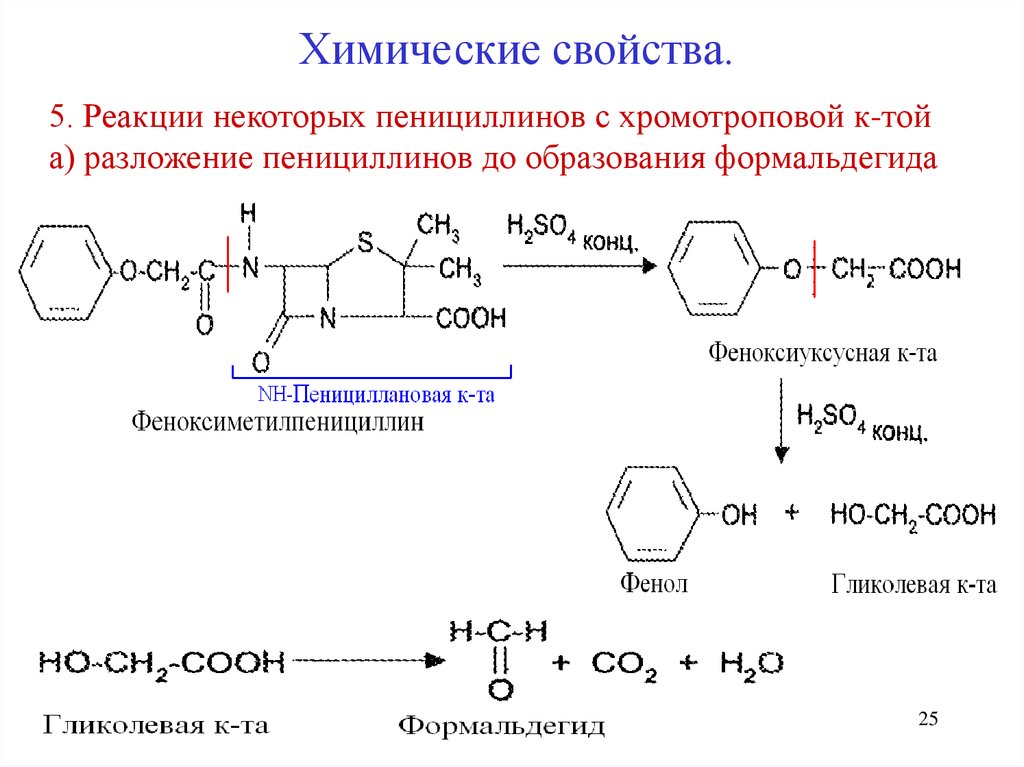
25. 5. Реакции некоторых пенициллинов с хромотроповой к-той а) разложение пенициллинов до образования формальдегида
Химические свойства.5. Реакции некоторых пенициллинов с хромотроповой к-той
а) разложение пенициллинов до образования формальдегида
25
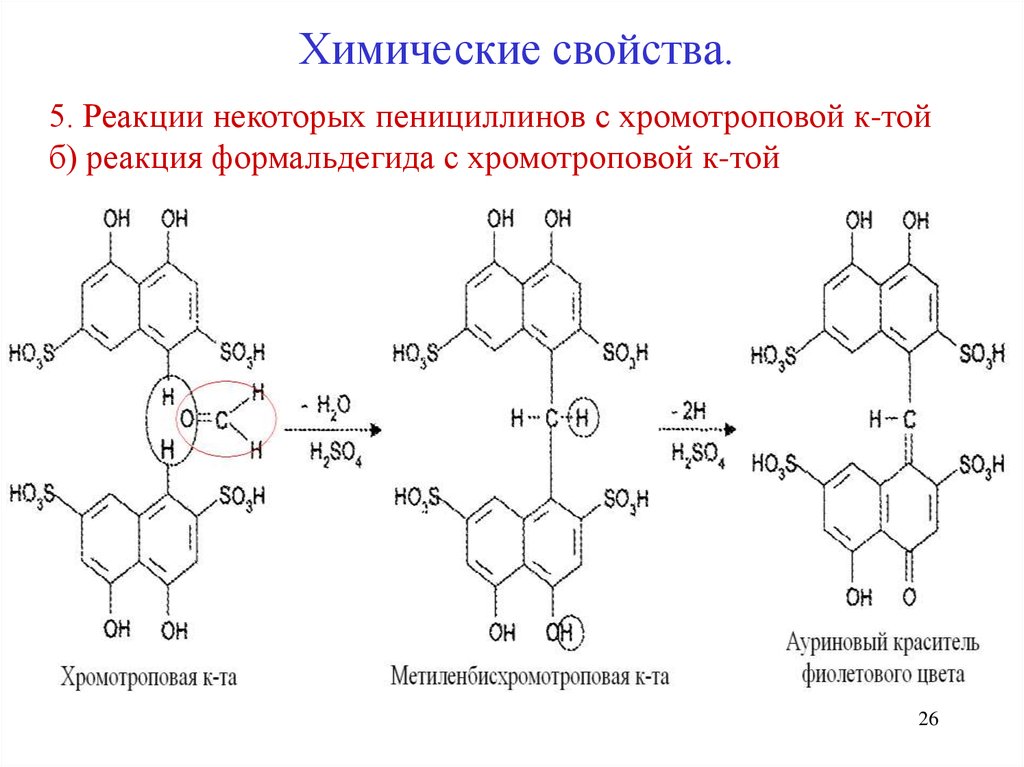
26.
Химические свойства.5. Реакции некоторых пенициллинов с хромотроповой к-той
б) реакция формальдегида с хромотроповой к-той
26
27.
Химические свойства.5. Реакции некоторых пенициллинов с хромотроповой к-той
27
28.
Химические свойства.5. Реакции некоторых пенициллинов с реактивом Марки
Лекарственное вещество
Эффект реакции (окрашивание)
При комн. температуре
При нагревании
Бензилпенициллина натриевая
соль
-
Желто-оранжевое или
желто-бурое
Оксациллино нариевая соль
Слабо-желтое
Желто-оранжевое или
розово-бурое
Ампициллина тригидрат
-
Желто-оранжевое или
коричневато-бурое
Феноксиметилпенициллин
Красное
Углубление окраски
6. Частные реакции некоторых пенициллинов
- Витали-Морена (бензилпенициллин натриевая соль)
- с реактивом Фелинга и нингидрином (ампициллин, амоксициллин);
- образование азокрасителя (амоксициллин)
28
29.
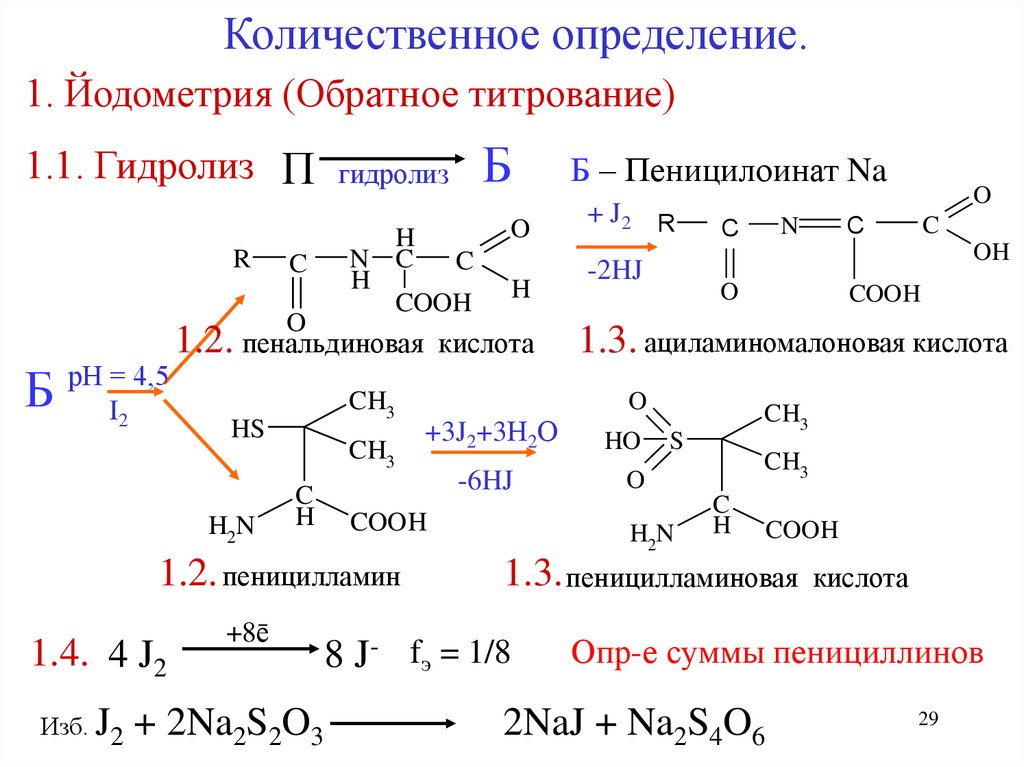
Количественное определение.1. Йодометрия (Обратное титрование)
1.1. Гидролиз П
R
C
O
Б
рН = 4,5
I2
H
N C
C
H
COOH
CH3
HS
CH3
C
H
H
+8ē
+ 2Na2S2O3
Б – Пеницилоинат Na
+ J2 R
+3J2+3Н2О
-6HJ
C
OH
-2HJ
O
COOH
1.3. ациламиномалоновая кислота
HO
CH3
S
CH3
O
H2N
C
H
COOH
1.3. пеницилламиновая
8 J- fэ = 1/8
O
C
N
C
O
COOH
1.2. пеницилламин
Изб. J2
O
1.2. пенальдиновая кислота
H2N
1.4. 4 J2
Б
гидролиз
кислота
Опр-е суммы пенициллинов
2NaJ + Na2S4O6
29
30.
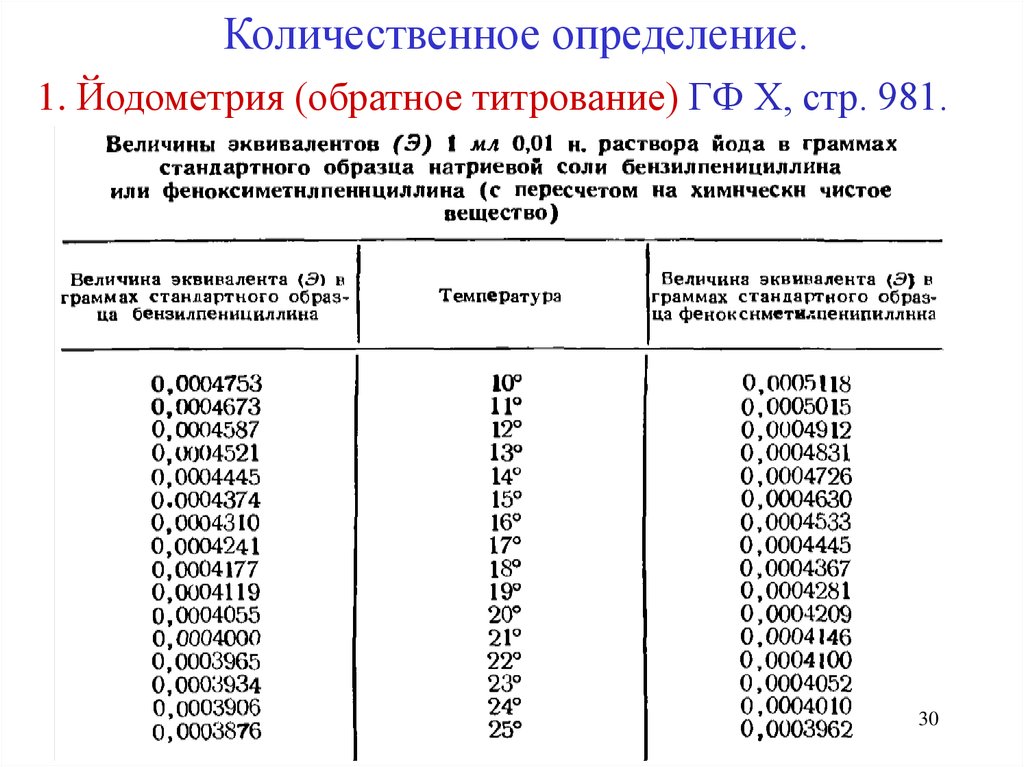
Количественное определение.1. Йодометрия (обратное титрование) ГФ Х, стр. 981.
30
31.
Количественное определение.1. Йодометрия (обратное титрование) ГФ Х, стр. 980.
С
М .м.ан.преп
М .м. Б / Пнатр.соли
31
32.
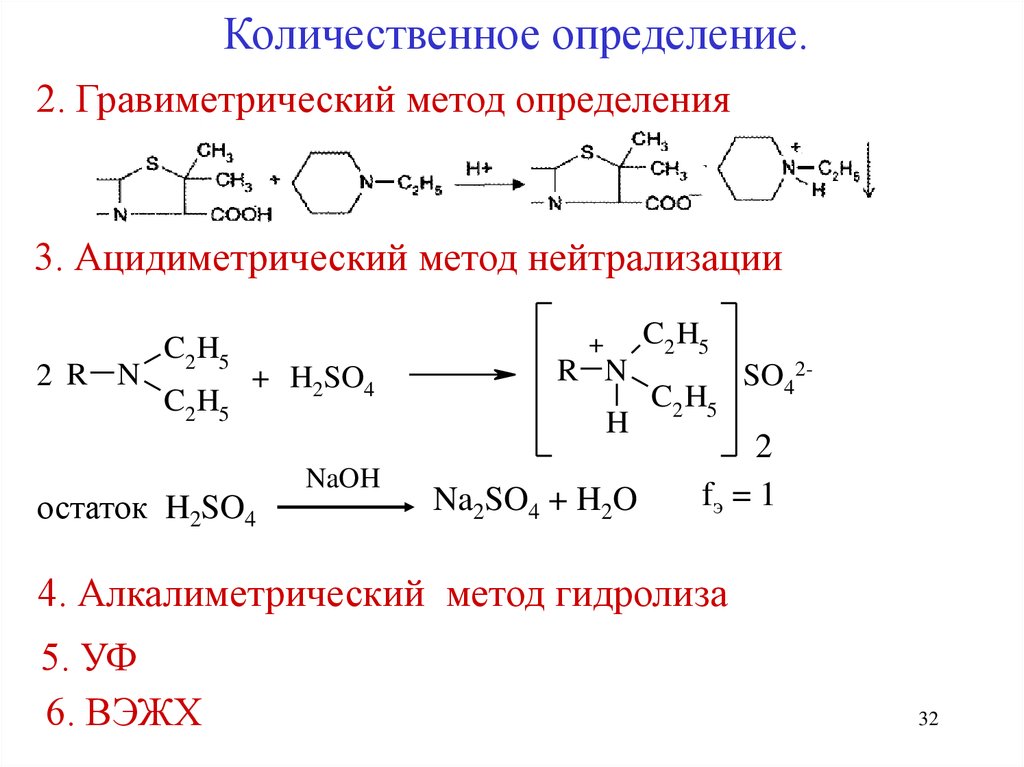
Количественное определение.2. Гравиметрический метод определения
3. Ацидиметрический метод нейтрализации
2 R N
C2 H5
C2 H5
C2 H5
+
+ H2SO4
остаток H2SO4
R N
H
NaOH
Na2SO4 + H2O
C2 H5
SO42-
2
fэ = 1
4. Алкалиметрический метод гидролиза
5. УФ
6. ВЭЖХ
32
33.
Сравнительная оценка ряда пенициллиновБиосинтетические пенициллины
Для парентерального введения (разрушаются в кислой среде желудка)
• Непродолжительного действия (Бензилпенициллина
натриевая/калиевая соль)
• Продолжительного действия (Бензилпенициллина новокоиновая
соль, Бициллин-1, Бициллин-5
Для энтерального введения (кислотоустойчивы)
Феноксиметилпенициллин
Полусинтетические пенициллины
Для парентерального и энтерального введения (кислотоустойчивы)
• Устойчивые к действию пенициллиназы (Оксациллина натриевая
соль, Нафциллин)
• Широкого спектра действия (Ампициллин, Амоксициллин)
Для парентерального введения (разрушаются в кислой среде желудка)
• Широкого спектра действия, включая синегнойную палочку
(Карбенициллина динатриевая соль, Тикарциллин, Азлоциллин)
Для энтерального введения (кислотоустойчивы) (Карбенициллин 33
инданил натрий, Карфециллин).
34.
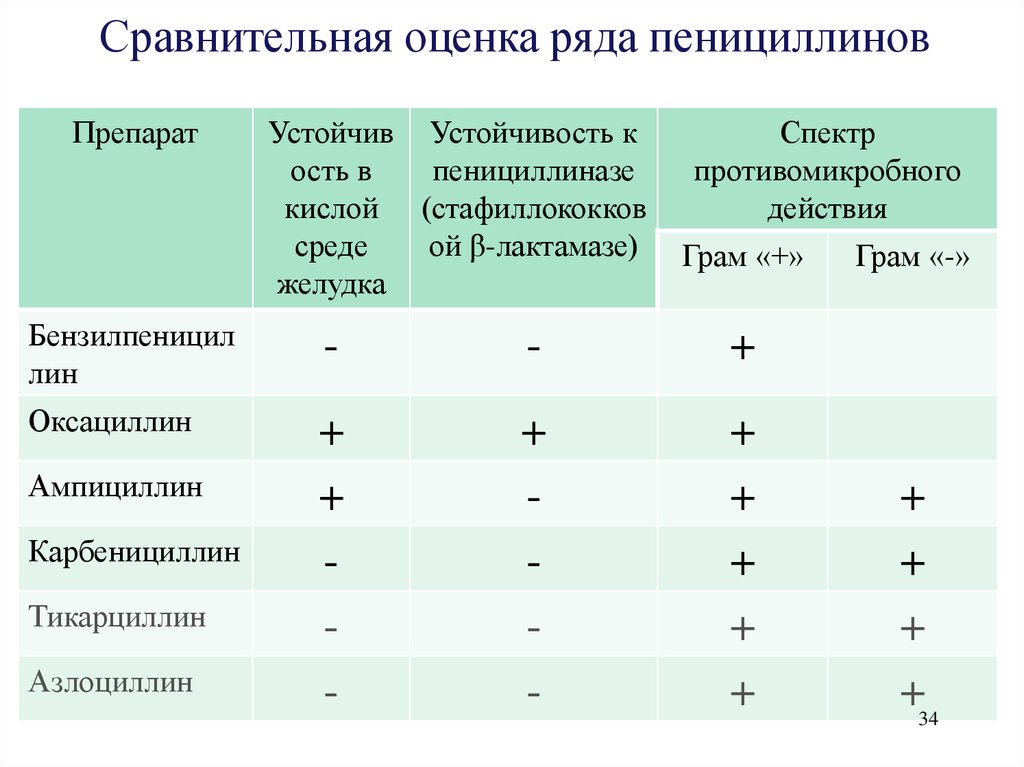
Сравнительная оценка ряда пенициллиновПрепарат
Устойчив Устойчивость к
ость в
пенициллиназе
кислой (стафиллококков
среде
ой β-лактамазе)
желудка
Спектр
противомикробного
действия
Грам «+»
Бензилпеницил
лин
-
-
+
Оксациллин
+
+
-
+
-
+
+
+
+
+
Ампициллин
Карбенициллин
Тикарциллин
Азлоциллин
Грам «-»
+
+
+
+34
35.
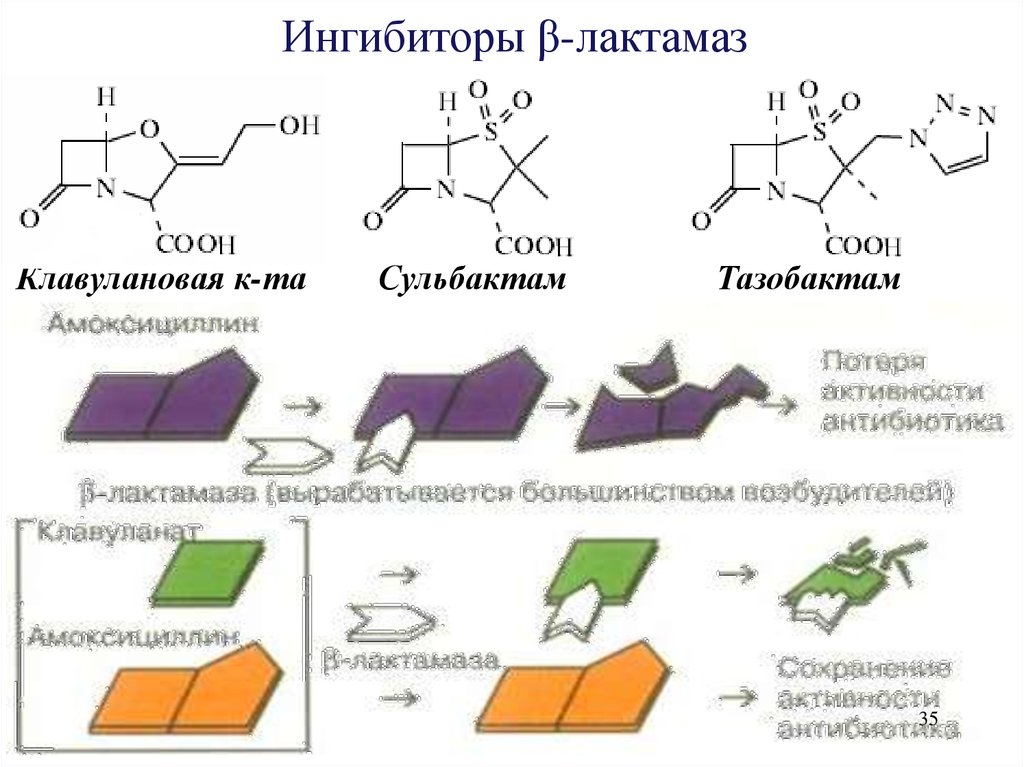
Ингибиторы β-лактамазКлавулановая к-та
Сульбактам
Тазобактам
35
36.
Ингибиторзащищённые пенициллиныАмоксиклав
Каждая таблетка 625 мг содержит 500 мг амоксициллина в форме
тригидрата и 125 мг клавулановой киcлоты в форме калиевой соли.
Каждые 5 мл суспензии (одна дозировочная ложка) содержат 125 мг
амоксициллина в форме тригидрата и 31 мг клавулановой киcлоты в
форме калиевой соли.
Каждый 1 мл капель содержит 50 мг амоксициллина в форме
тригидрата и 13 мг клавулановой киcлоты в форме калиевой соли.
Каждый флакон 1.2 г содержит 1.0 г амоксициллина в форме
натриевой соли и 0.2 г клавулановой киcлоты в форме калиевой соли
Показания к применению.
Лечение инфекционно-воспалительных заболеваний,
вызванных чувствительными к препарату микроорганизмами: инфекции верхних
отделов дыхательных путей (в т.ч. острый и хронический синусит, заглоточный
абcцесс); инфекции нижних отделов дыхательных путей (в т.ч. хронический бронхит,
пневмония); острый и хронический отит; инфекции мочевыводящих путей;
гинекологические инфекции; инфекции кожи и мягких тканей (в т.ч. укусы животных);
инфекции костей и суставов; шанкроид; гонорея.
36
37.
Ингибиторзащищённые пенициллиныАугментин
Таблетки
Активные ингредиенты:
тригидрат амоксициллина, эквивалентный 250 мг, 500 мг, 875 мг амоксициллина,
клавуланат калия, эквивалентный 125 мг клавулановой кислоты.
Вспомогательные ингредиенты:
магния стеарат, гликоллат натриевого
крахмала, коллоидный безводный кремний, микрокристаллическая целлюлоза.
Состав пленочного покрытия:
титана диоксид, гидроксипропилметилцеллюлоза ( 5 cps и 15 cps), полиэтиленовый гликоль
4000, полиэтиленовый гликоль 6000, силиконовое масло, очищенная вода.
Порошок для приготовления суспензии
Активные ингредиенты:
В 5 мл суспензии содержится тригидрат амоксициллина, эквивалентный 125
мг амоксициллина, и клавуланат калия, эквивалентный 31,25 мг клавулановой кислоты.
Вспомогательные ингредиенты:
ксантановая смола, аспартам, янтарная кислота, коллоидный кремний,
гидроксипропилметилцеллюлоза, двуокиси кремний, ароматизаторы.
Показания к применению.
Инфекции верхних (рецидивирующий тонзиллит,
синусит, средний отит) и нижних (острый бронхит, обострения хронического бронхита, долевая
и бронхопневмония) отделов дыхательных путей; инфекции урогенитального тракта
(рецидивирующий и осложненный цистит, уретрит, пиелонефрит, гинекологические инфекции,
гонорея); инфекции кожи и мягких тканей, в т.ч. инфицированные укусы животных,
одонтогенные абсцессы и целлюлит, остеомиелит, септицемия, перитонит, абдоминальный
сепсис, лечение и профилактика (в т.ч. интраоперационная) послеоперационных инфекций при
хирургических вмешательствах на ЖКТ, органах малого таза, сердце, почках , желчевыводящих
путях, в области головы, шеи и при восстановительных реконструктивных операциях. 37
38.
Ингибиторзащищённые пенициллиныПанклав
38
39.
Ингибиторзащищённые пенициллиныТрифамокс ИБЛ®
39
40.
Ингибиторзащищённые пенициллиныУназин
Состав и форма выпуска
Порошок для приготовления раствора
1 фл.
для инъекций 0,75 г
сульбактам натрия стерильный
0,274 г
ампициллин натрия стерильный
0,531 г
в коробке картонной 1 флакон.
Показания к применению.
Применяют при пневмонии, бронхите, отите, синусите, гнойных хирургических
инфекциях (абсцессы, флегмоны, остеомиелит и др.), перитоните, урологических и
гинекологичегких инфекциях, для профилактики послеоперационных гнойных
осложнений, при гонорее и других инфекциях.
Вводят внутримышечно или внутривенно.
40
41.
Ингибиторзащищённые пенициллиныТазоцин
Состав и форма выпуска
Порошок для приготовления
раствора для инъекций 0,75 г
пиперациллин
тазобактам
1 фл.
0,274 г
0,531 г
в коробке картонной 1 флакон.
Показания к применению.
Инфекции среднетяжелого и тяжелого течения, вызванные чувствительными к
препарату микроорганизмами: бактериальные инфекции верхних и нижних
дыхательных путей (пневмонии только средней тяжести, вызванные не
пиперациллин-резистентными беталактамазопродуцируюшими
штаммами Haemophilus influenzae; инфекции органов брюшной полости, в
частности, осложненный аппендицит; перитонит; неосложненные и
осложненные инфекции кожи и мягких тканей, абсцесс, инфицированные
трофические язвы, в частности, у больных с диабетической ангиопатией; инфекции
41
органов малого таза.
42.
Цефалоспорины (ЦС)Сephalosporum acremonium
дигидротиазиновый
O
R2
R
2
C N
H
8
6
2
N5
3
O
3
*C
N
H
O
S
1
7
8
6
N5
2
3
4
COOH
α-аминоадипиновая
кислота
R1
4
COOH
COOH
NH2
1
7
O
β-лактамный цикл
(азетидиновый)
HC CH2
S
C O
H2
цистеин
Цефалоспорин С «цефем»
C CH3
O
валин
42
43.
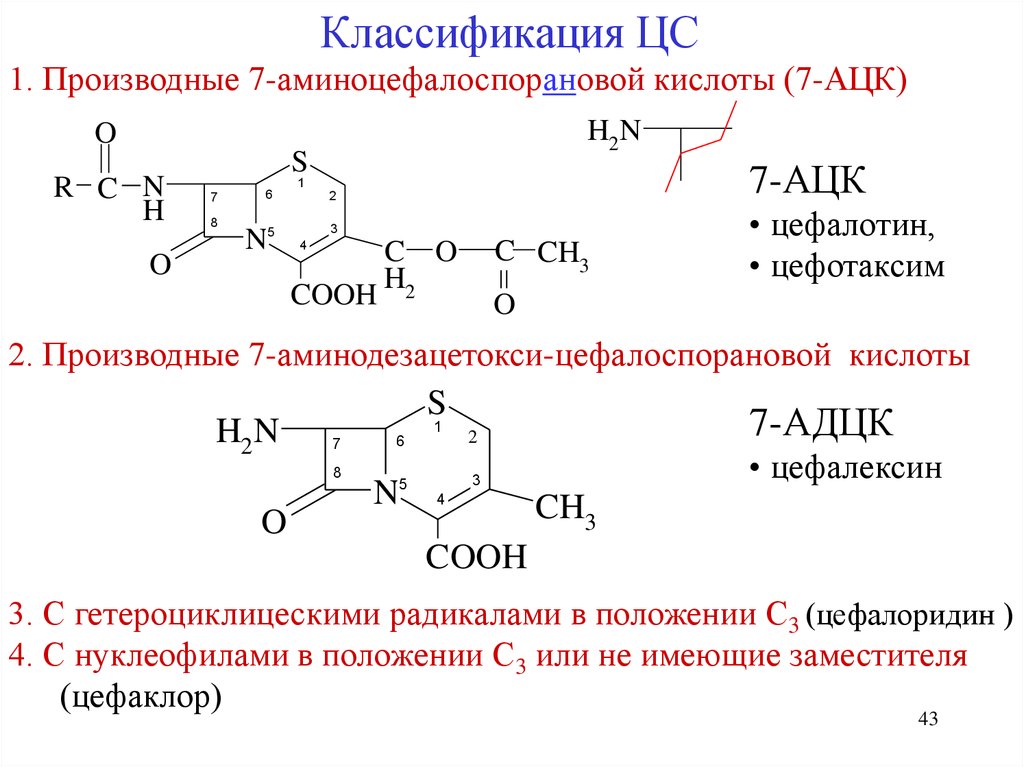
Классификация ЦС1. Производные 7-аминоцефалоспорановой кислоты (7-АЦК)
H2N
O
R C N
H
O
S
7-АЦК
1
7
8
6
N5
2
3
4
COOH
C O
H2
C CH3
• цефалотин,
• цефотаксим
O
2. Производные 7-аминодезацетокси-цефалоспорановой кислоты
S
1
7-АДЦК
H2N
2
6
7
• цефалексин
8
3
5
N 4
CH3
O
COOH
3. С гетероциклицескими радикалами в положении С3 (цефалоридин )
4. С нуклеофилами в положении С3 или не имеющие заместителя
(цефаклор)
43
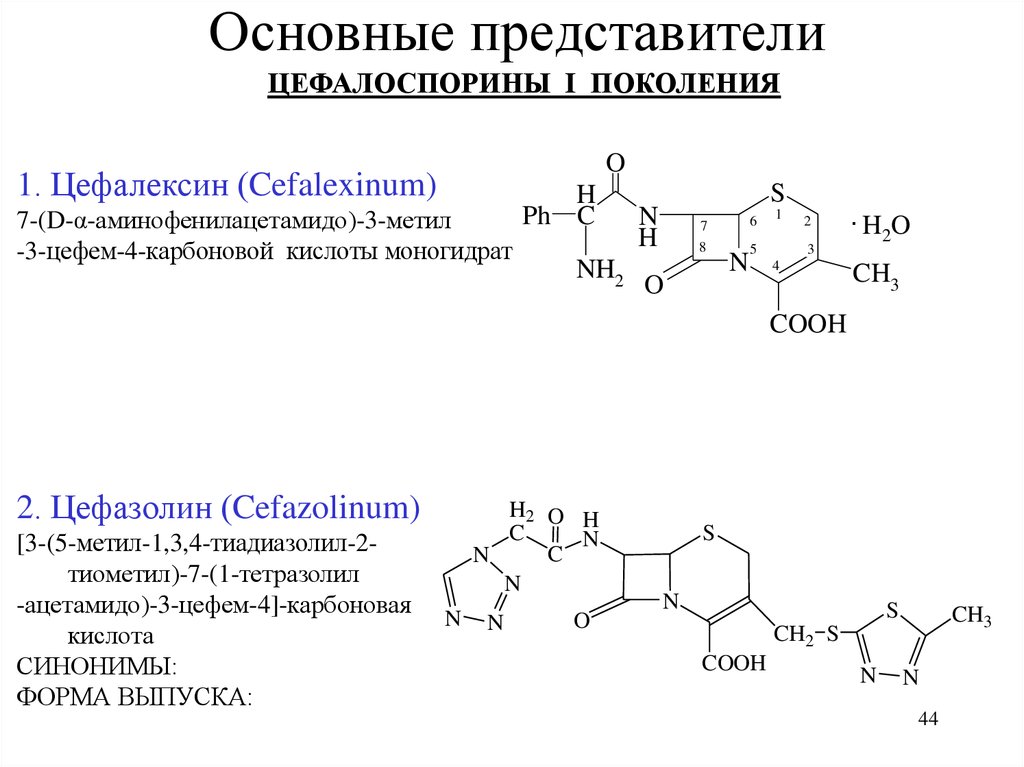
44. Основные представители
ЦЕФАЛОСПОРИНЫ I ПОКОЛЕНИЯO
1. Цефалексин (Cefalexinum)
7-(D-α-аминофенилацетамидо)-3-метил
-3-цефем-4-карбоновой кислоты моногидрат
H
Ph C
NH2
S
N
H
6
7
8
O
N
1
5
2
3
4
.H O
2
CH3
COOH
2. Цефазолин (Cefazolinum)
[3-(5-метил-1,3,4-тиадиазолил-2тиометил)-7-(1-тетразолил
-ацетамидо)-3-цефем-4]-карбоновая
кислота
СИНОНИМЫ:
ФОРМА ВЫПУСКА:
H2 O H
C
N
C
N
N
N
N
O
S
N
S
CH3
CH2 S
COOH
N
N
44
45.
Основные представителиЦЕФАЛОСПОРИНЫ II ПОКОЛЕНИЯ
3. Цефуроксим (Cefuroxim)
Синонимы: Кетоцеф, Аltacef,
Сеfаmаr, Сеfoge, Сеfорrim,
Сеfurex, Сеfuri, Gibicef, Iрасеf,
Itorex, Кеfurox, Lаfurех,
Sресtrаzol, Ultrохim, Zеасеf,
Ziаcef и др
H3CO
N
C
C
O
H
N
O
O
S
O
N
CH2
COOH
NH2
C
O
4. Цефаклор (Cefaclor)
NH2
CH
C
H
N
O
O
S
N
Cl
COOH
45
46.
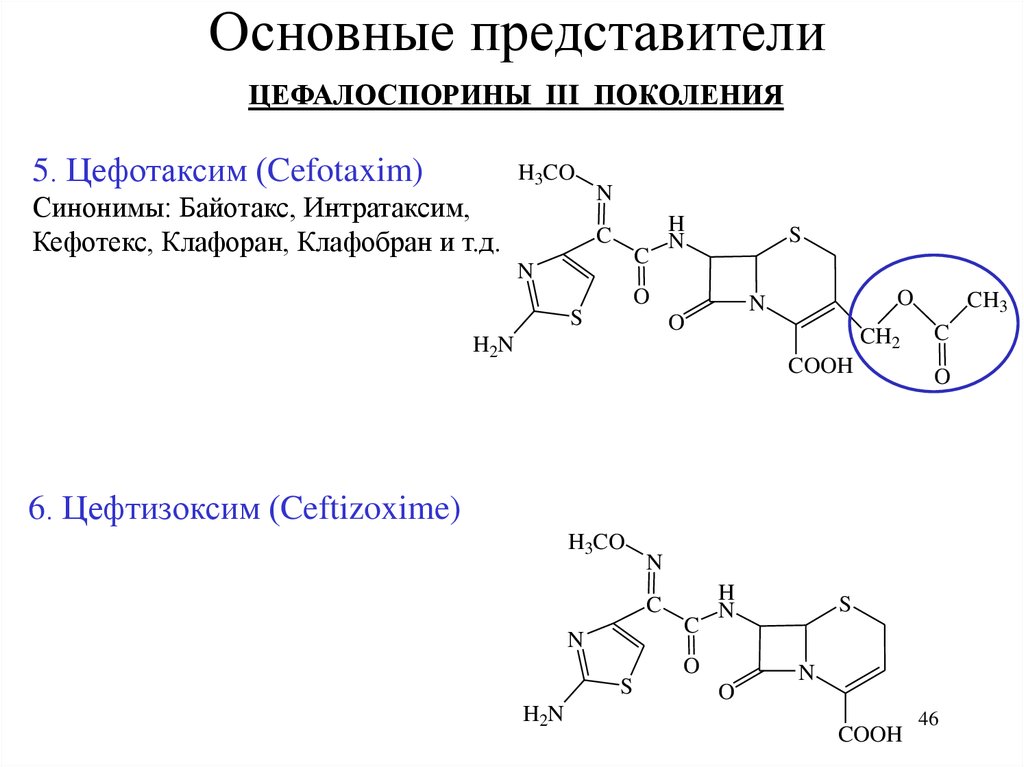
Основные представителиЦЕФАЛОСПОРИНЫ III ПОКОЛЕНИЯ
5. Цефотаксим (Cefotaxim)
H3CO
Синонимы: Байотакс, Интратаксим,
Кефотекс, Клафоран, Клафобран и т.д.
N
C
C
N
H
N
S
O
S
O
N
O
CH2
H2N
COOH
CH3
C
O
6. Цефтизоксим (Ceftizoxime)
H3CO
N
C
N
C
H
N
O
S
H2N
O
S
N
COOH
46
47.
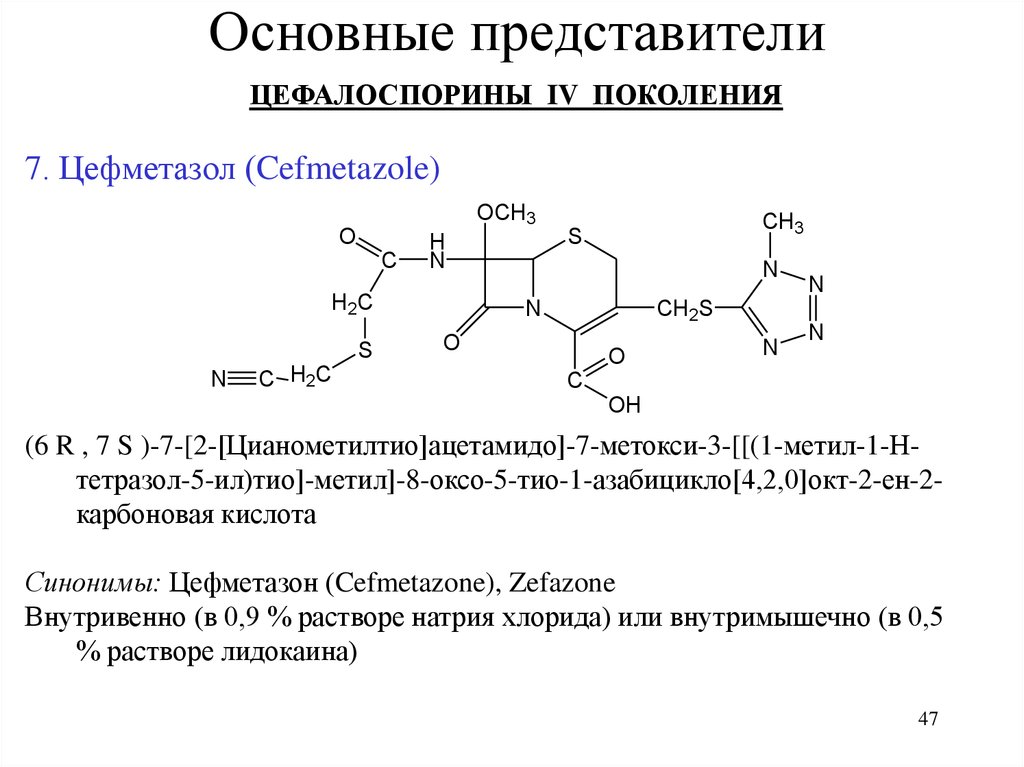
Основные представителиЦЕФАЛОСПОРИНЫ IV ПОКОЛЕНИЯ
7. Цефметазол (Cefmetazole)
OCH3
O
C
H
N
H2C
S
N
C H2C
CH3
S
N
N
CH2S
O
O
N
N
N
C
OH
(6 R , 7 S )-7-[2-[Цианометилтио]ацетамидо]-7-метокси-3-[[(1-метил-1-Нтетразол-5-ил)тио]-метил]-8-оксо-5-тио-1-азабицикло[4,2,0]окт-2-ен-2карбоновая кислота
Синонимы: Цефметазон (Cefmetazone), Zefazone
Внутривенно (в 0,9 % растворе натрия хлорида) или внутримышечно (в 0,5
% растворе лидокаина)
47
48.
Основные представителиЦЕФАЛОСПОРИНЫ IV ПОКОЛЕНИЯ
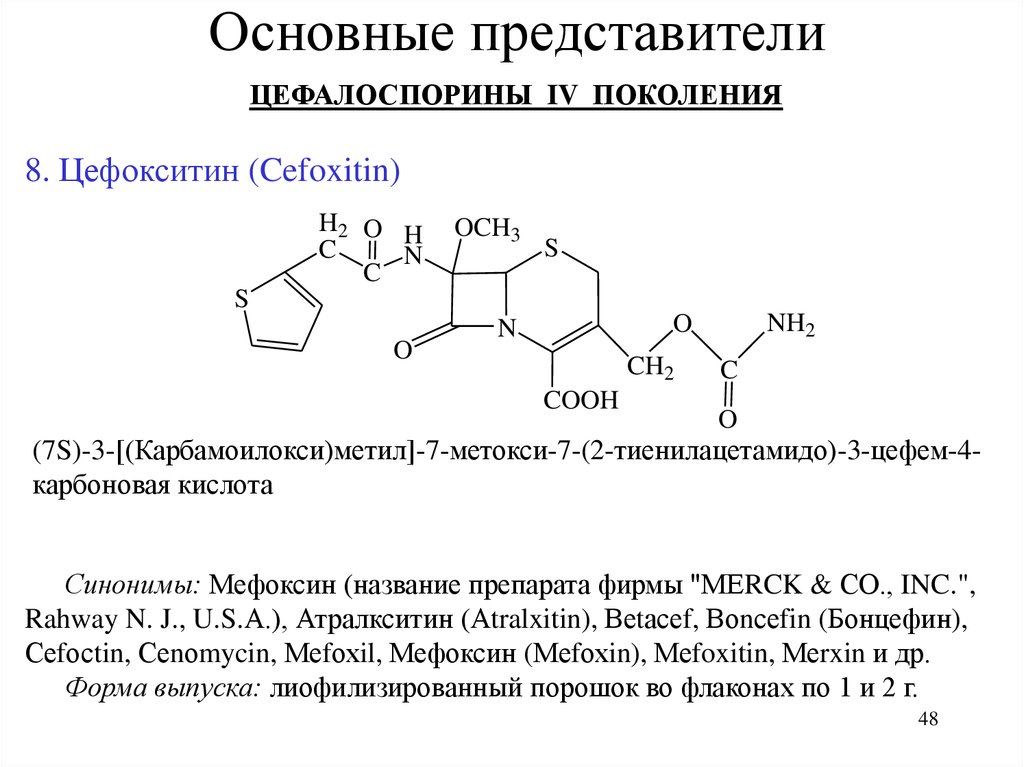
8. Цефокситин (Cefoxitin)
H2 O H
C
N
C
OCH3
S
S
O
NH2
O
N
CH2
COOH
C
O
(7S)-3-[(Карбамоилокси)метил]-7-метокси-7-(2-тиенилацетамидо)-3-цефем-4карбоновая кислота
Синонимы: Мефоксин (название препарата фирмы "МЕRCK & СО., INC.",
Rahway N. J., U.S.А.), Атралкситин (Аtralxitin), Веtасеf, Воnсеfin (Бонцефин),
Сеfосtin, Сеnоmycin, Меfохil, Мефоксин (Меfохin), Меfoxitin, Меrxin и др.
Форма выпуска: лиофилизированный порошок во флаконах по 1 и 2 г.
48
49.
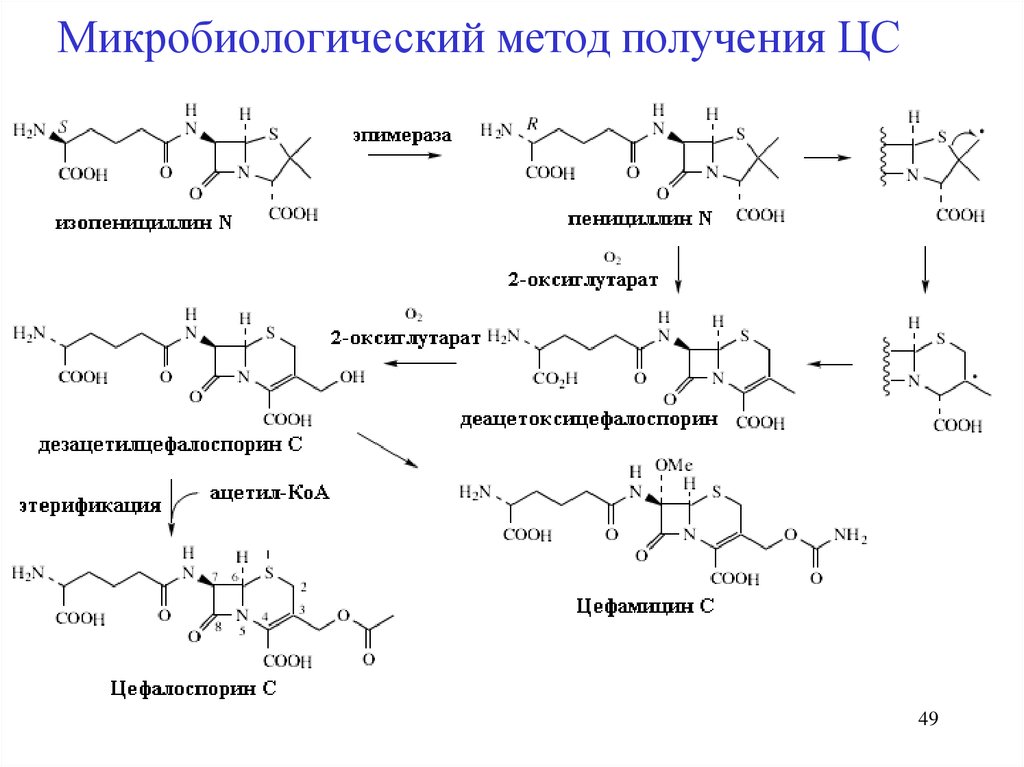
Микробиологический метод получения ЦС49
50.
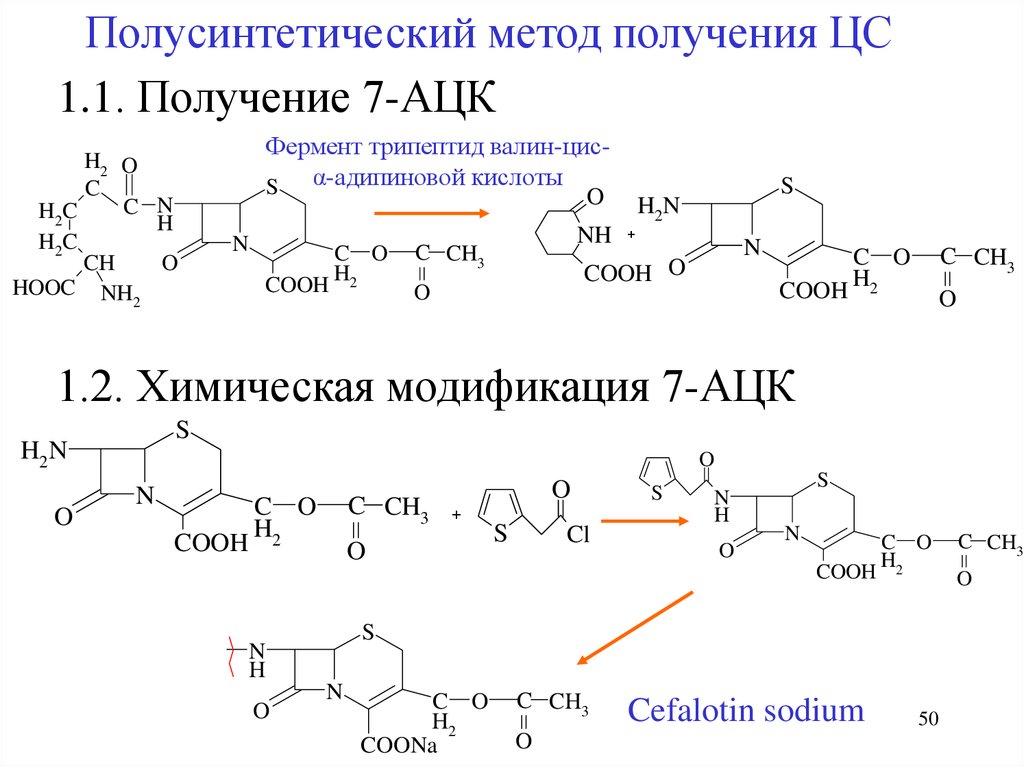
Полусинтетический метод получения ЦС1.1. Получение 7-АЦК
H2 O
C
C N
H2C
H
H2C
CH
O
HOOC NH
2
Фермент трипептид валин-цисS α-адипиновой кислоты
O
N
COOH
C O
H2
NH
C CH3
S
H2N
+
N
COOH O
O
COOH
C CH3
C O
H2
O
1.2. Химическая модификация 7-АЦК
S
H2N
O
O
N
COOH
C CH3
C O
H2
+
O
S
Cl
S
N
H
O
S
N
COOH
C O
H2
S
N
H
O
O
N
C O
H2
COONa
C CH3
O
Cefalotin sodium
50
C CH3
O
51.
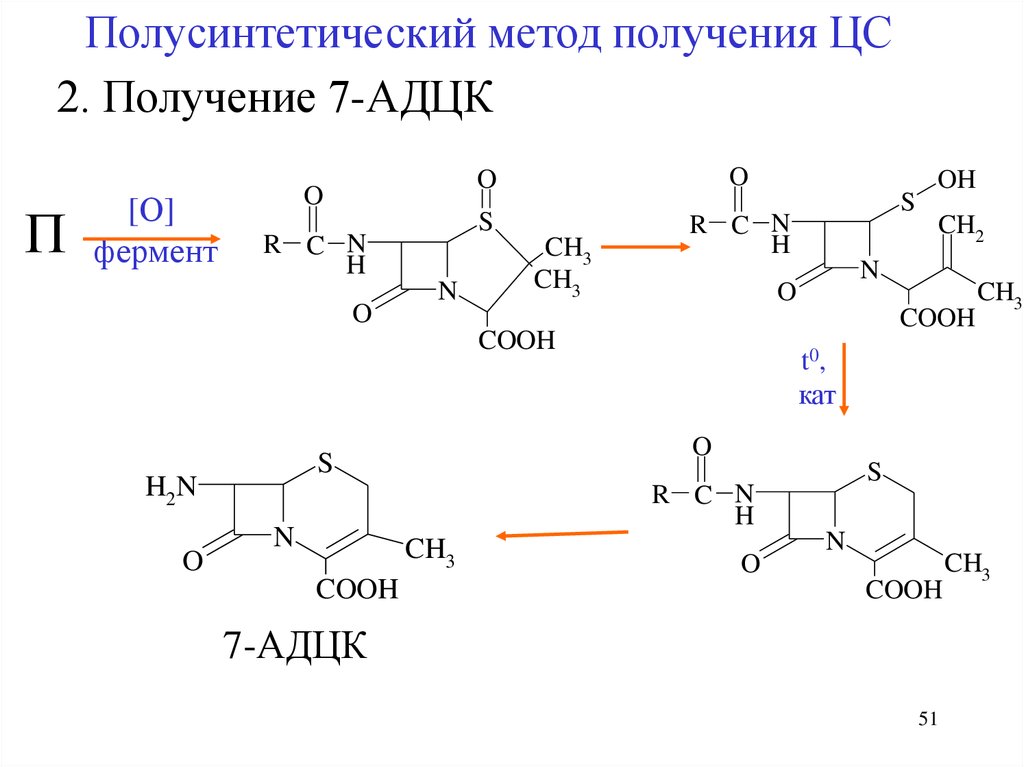
Полусинтетический метод получения ЦС2. Получение 7-АДЦК
П
[О]
фермент
O
R C N
H
O
N
O
O
S
R C N
H
CH3
CH3
COOH
O
t0,
кат
S
R C N
H
CH3
COOH
CH3
O
S
N
CH2
N
O
COOH
H2N
S
OH
O
N
COOH
7-АДЦК
51
CH3
52.
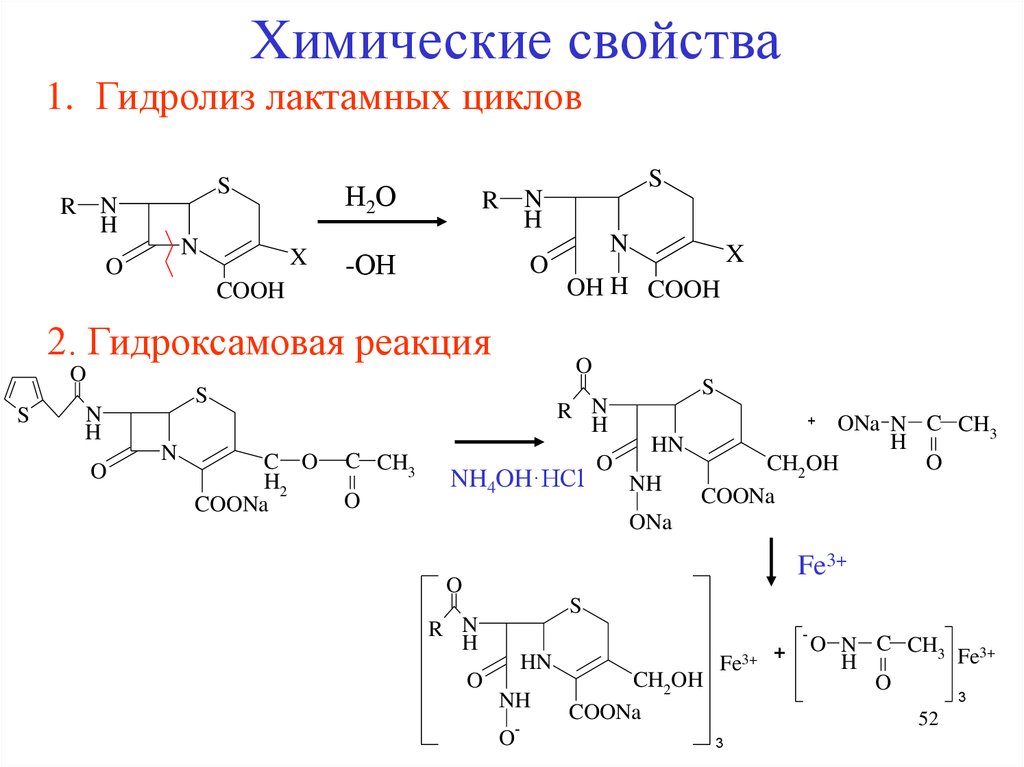
Химические свойства1. Гидролиз лактамных циклов
S
R N
H
N
O
Н2О
X
-ОН
O
COOH
2. Гидроксамовая реакция
N
H
O
S
N
C O
H2
COONa
N
OH H COOH
R N
H
C CH3
O
X
O
O
S
S
R N
H
S
ONa N C CH3
H
HN
O
CH2OH
O
NH4OH·HCl
NH
COONa
ONa
+
Fe3+
O
S
R N
H
-
HN
O
NH
O-
CH2OH
COONa
Fe3+ +
O N C CH3
Fe3+
H
O
3
52
3
53.
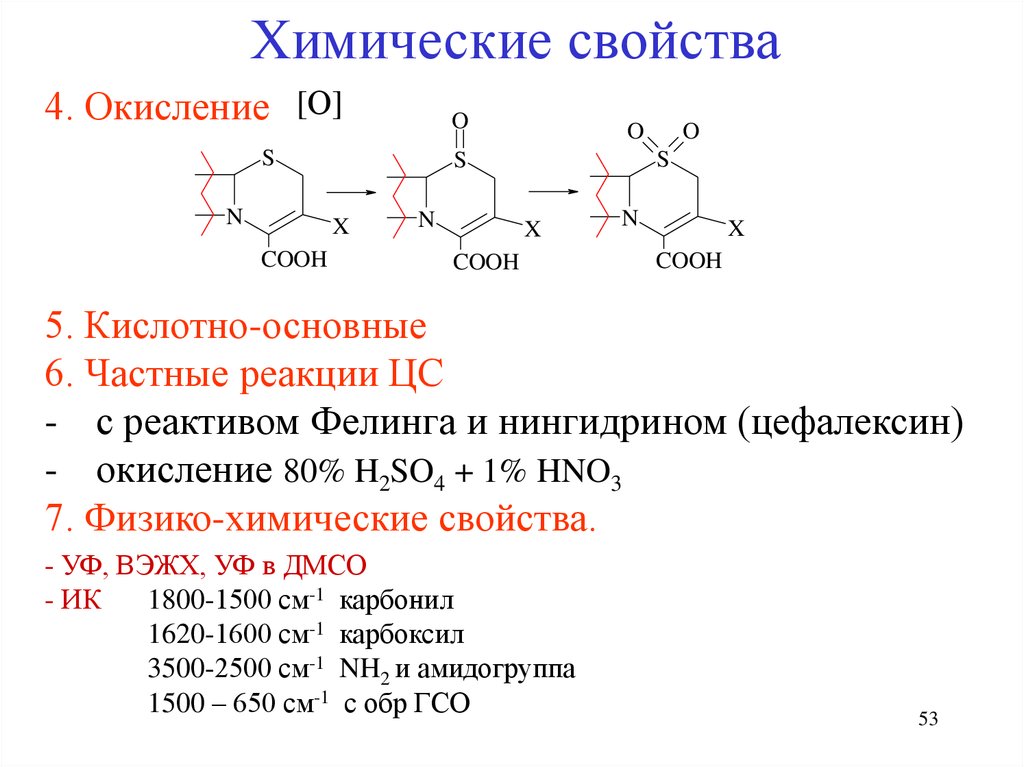
Химические свойства4. Окисление [О]
O
S
N
N
O
S
S
X
COOH
O
X
COOH
N
X
COOH
5. Кислотно-основные
6. Частные реакции ЦС
- с реактивом Фелинга и нингидрином (цефалексин)
- окисление 80% H2SO4 + 1% HNO3
7. Физико-химические свойства.
- УФ, ВЭЖХ, УФ в ДМСО
- ИК
1800-1500 см-1 карбонил
1620-1600 см-1 карбоксил
3500-2500 см-1 NH2 и амидогруппа
1500 – 650 см-1 с обр ГСО
53
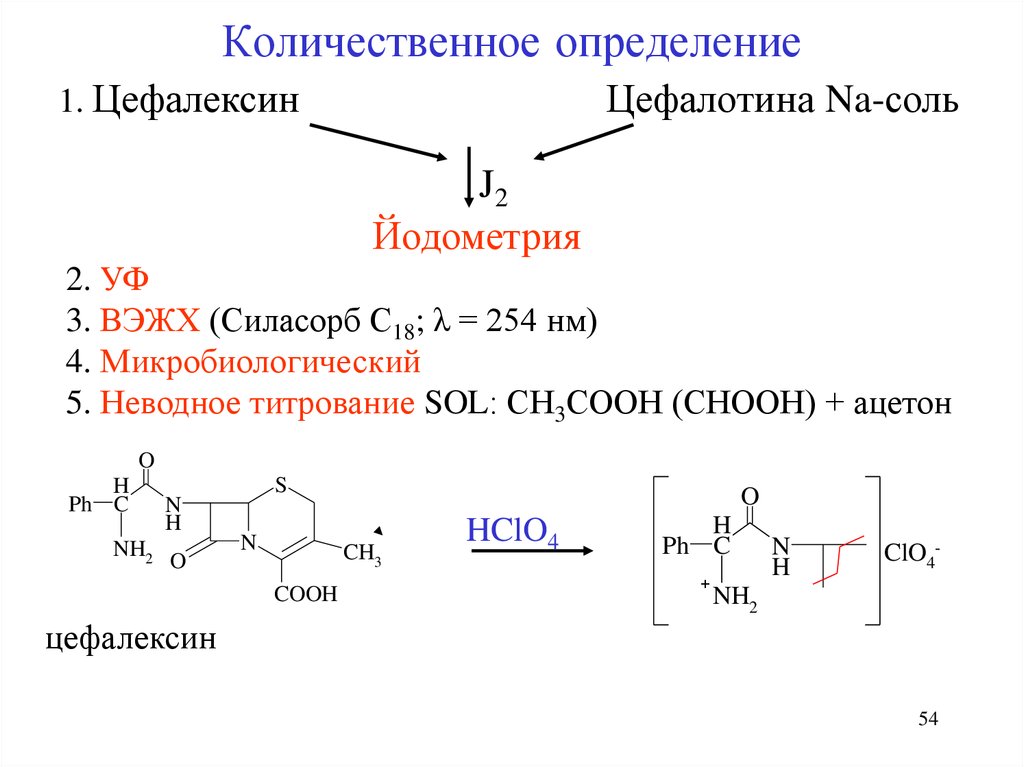
54. Количественное определение
1. ЦефалексинЦефалотина Na-соль
J2
Йодометрия
2. УФ
3. ВЭЖХ (Силасорб С18; λ = 254 нм)
4. Микробиологический
5. Неводное титрование SOL: СН3СООН (СНООН) + ацетон
O
H
Ph C
NH2
N
H
O
S
N
O
CH3
COOH
HClO4
H
Ph C
+
N
H
ClO4-
NH2
цефалексин
54
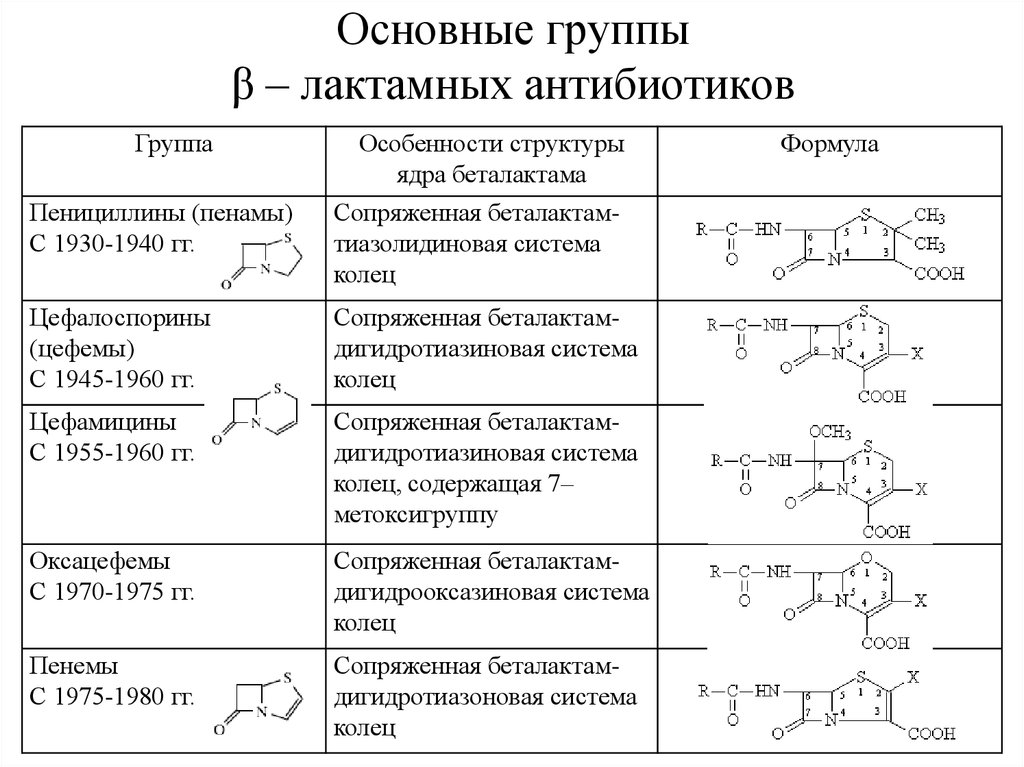
55. Основные группы β – лактамных антибиотиков
ГруппаОсобенности структуры
ядра беталактама
Пенициллины (пенамы)
С 1930-1940 гг.
Сопряженная беталактамтиазолидиновая система
колец
Цефалоспорины
(цефемы)
С 1945-1960 гг.
Сопряженная беталактамдигидротиазиновая система
колец
Цефамицины
С 1955-1960 гг.
Сопряженная беталактамдигидротиазиновая система
колец, содержащая 7–
метоксигруппу
Оксацефемы
С 1970-1975 гг.
Сопряженная беталактамдигидрооксазиновая система
колец
Пенемы
С 1975-1980 гг.
Сопряженная беталактамдигидротиазоновая система
колец
Формула
55
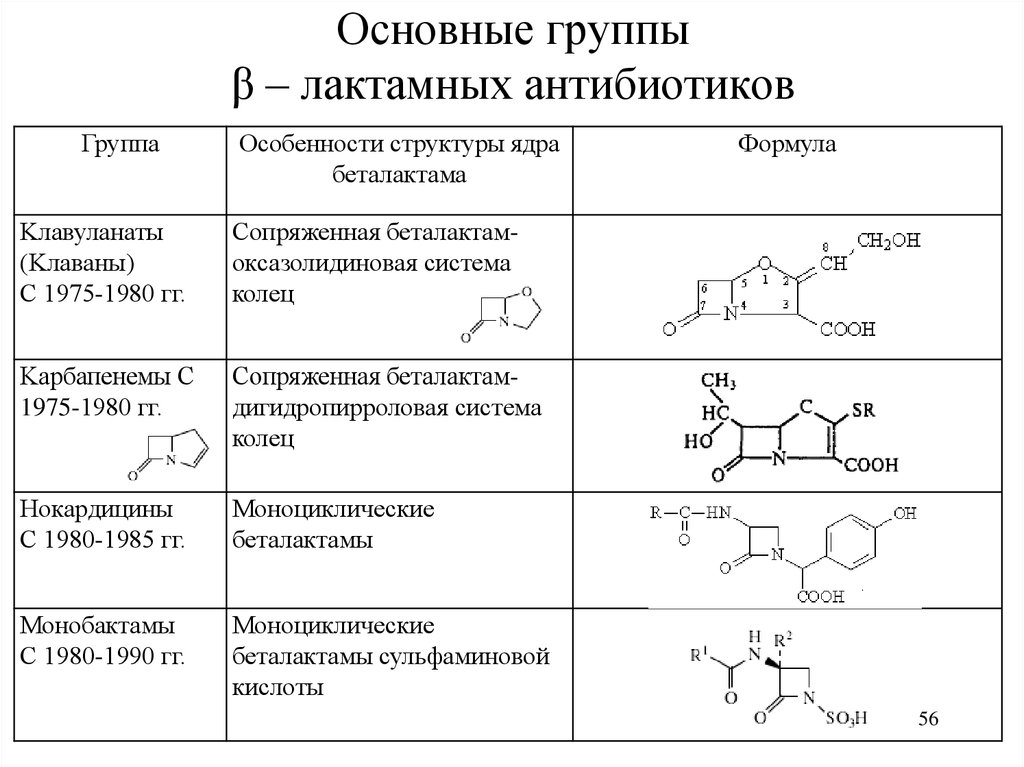
56. Основные группы β – лактамных антибиотиков
ГруппаОсобенности структуры ядра
беталактама
Kлавуланаты
(Kлаваны)
С 1975-1980 гг.
Сопряженная беталактамоксазолидиновая система
колец
Kарбапенемы С
1975-1980 гг.
Сопряженная беталактамдигидропирроловая система
колец
Нокардицины
С 1980-1985 гг.
Моноциклические
беталактамы
Монобактамы
С 1980-1990 гг.
Моноциклические
беталактамы сульфаминовой
кислоты
Формула
56
57. Антибиотики как ЛС Антибиотики-гликозиды
Государственное образовательное учреждение высшего профессионального образованияНИЖЕГОРОДСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
Федерального агентства по здравоохранению и социальному развитию
КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ И ФАРМАКОГНОЗИИ
Антибиотики как ЛС
Антибиотики-гликозиды
Доцент кафедры фармацевтической химии и
фармакогнозии, к.х.н.,
Жильцова Ольга Евгеньевна
58.
АМИНОГЛИКОЗИДНЫЕ АНТИБИОТИКИ (АА)1943 г. – выделен Актиномицет, образующий стрептомицин
1944 г. – публикация (А. Шатц, И. Буги и 3. Ваксманом)
«Стрептомицин» от Streptomyces, а организм, образующий этот
антибиотик, был определен как S. griseus.
Штаммы, вырабатывающие стрептомицин: S. bikiniensis, S.
raneus, S. humidus, S. reticuli, S. griseocarneus, S. mashuensis.
Классификация
1. Аминогликозиды I поколения:
Стрептомицин, неомицин, канамицин
2. Аминогликозиды II поколения:
Гентамицин, тобрамицин, сизомицин
3. Аминогликозиды III поколения:
Амикацин
58
59.
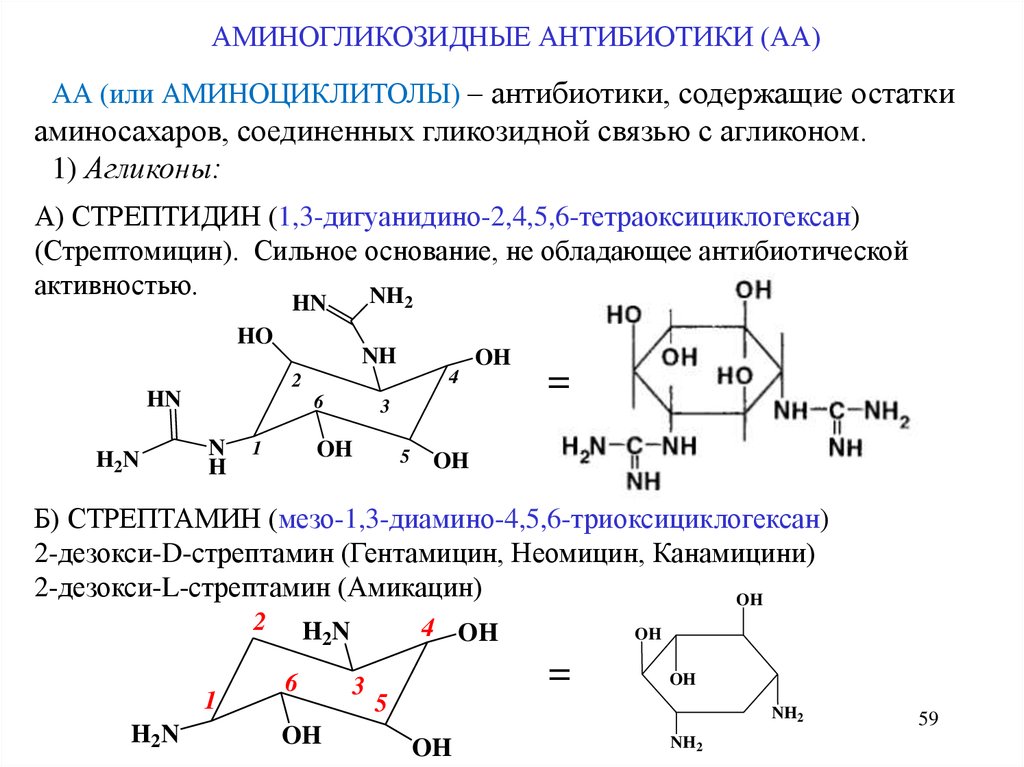
АМИНОГЛИКОЗИДНЫЕ АНТИБИОТИКИ (АА)АА (или АМИНОЦИКЛИТОЛЫ) – антибиотики, содержащие остатки
аминосахаров, соединенных гликозидной связью с агликоном.
1) Агликоны:
А) СТРЕПТИДИН (1,3-дигуанидино-2,4,5,6-тетраоксициклогексан)
(Стрептомицин). Сильное основание, не обладающее антибиотической
активностью.
NH2
HN
HO
OH
4
2
HN
H2N
NH
6
N
H
3
OH
1
5
=
OH
Б) СТРЕПТАМИН (мезо-1,3-диамино-4,5,6-триоксициклогексан)
2-дезокси-D-стрептамин (Гентамицин, Неомицин, Канамицини)
2-дезокси-L-стрептамин (Амикацин)
OH
2
1
H2 N
4 OH
H2 N
6
OH
3
OH
=
OH
5
NH2
OH
NH2
59
60.
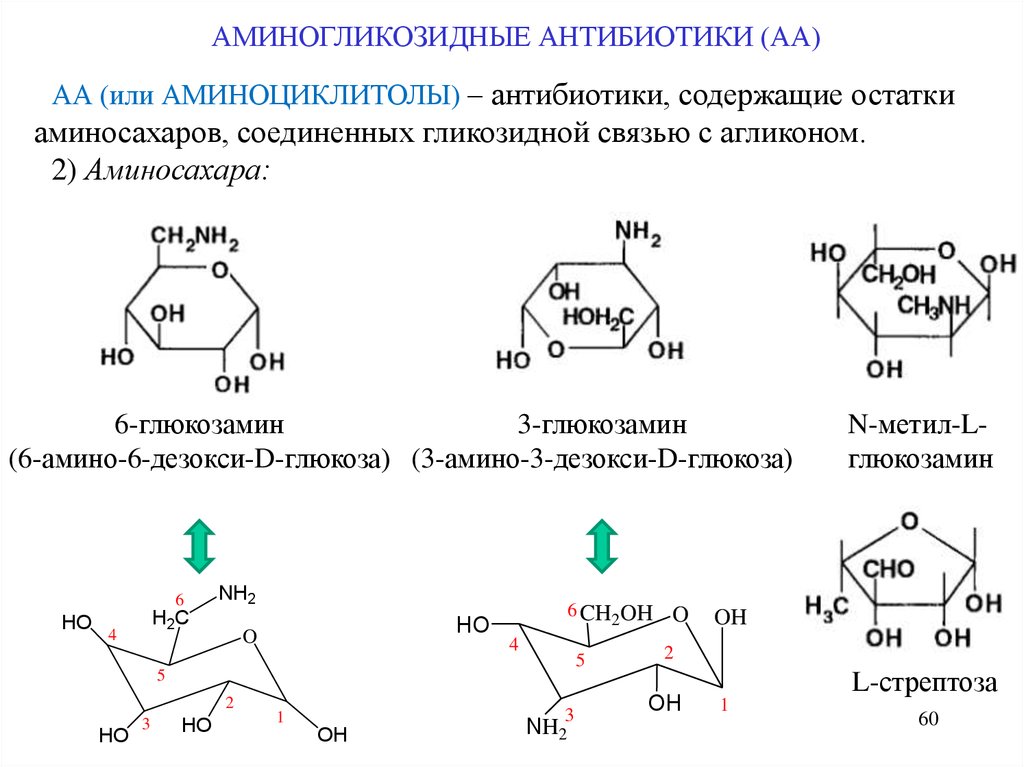
АМИНОГЛИКОЗИДНЫЕ АНТИБИОТИКИ (АА)АА (или АМИНОЦИКЛИТОЛЫ) – антибиотики, содержащие остатки
аминосахаров, соединенных гликозидной связью с агликоном.
2) Аминосахара:
6-глюкозамин
3-глюкозамин
(6-амино-6-дезокси-D-глюкоза) (3-амино-3-дезокси-D-глюкоза)
6
HO
NH2
H2C
4
6 CH2OH
HO
O
4
5
5
2
HO
3
HO
3
1
OH
NH2
O
N-метил-Lглюкозамин
OH
2
OH
L-стрептоза
1
60
61.
АМИНОГЛИКОЗИДНЫЕ АНТИБИОТИКИ (АА)Биосинтез стрептомицина
В 1946 г. Ваксман с сотрудниками сообщил, что стрептомицин
синтезируется при развитии S. griseus лишь в средах, содержащих в своем
составе мясной экстракт, и рекомендовал для образования антибиотика
следующую среду:
Компоненты
Количество в 1 л
водопроводной воды
Глюкоза
10
Пептон
5
Мясной экстракт*
5
Хлорид натрия
5
рН такой среды устанавливается в пределах 6,5-7,0.
* В настоящее время Мясной экстракт заменяют дрожжевым экстрактом,
соевой или кукурузной мукой и их гидролизатами, кроме того в состав
питательной среды входят: источники азота ( нитраты, соли аммония),
источники углерода (глюкоза), фосфор (K2HPO4), железо (FeSO4∙7H2O),61цинк,
медь, магний, кальций (CaCО ), NaCl.
62.
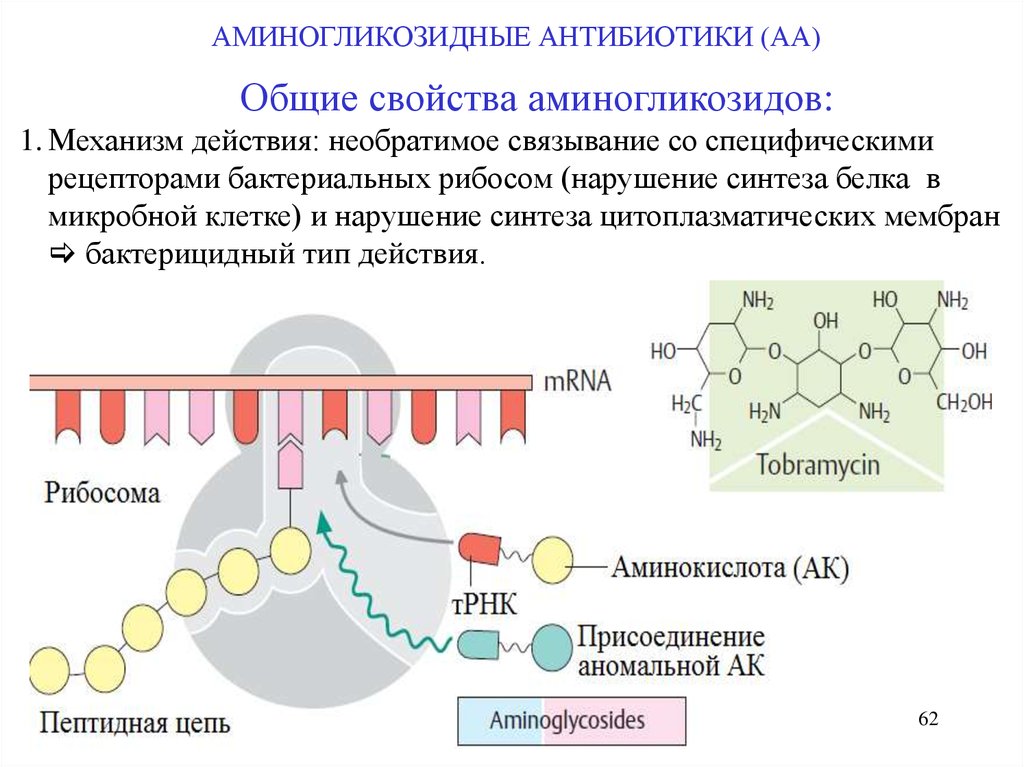
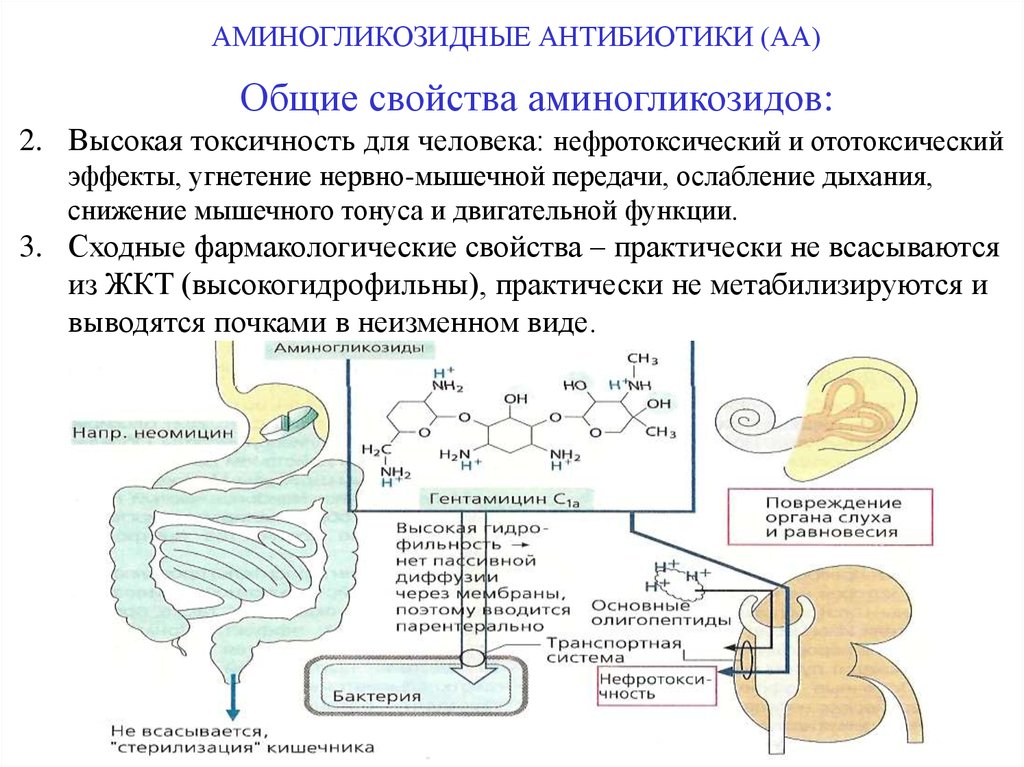
АМИНОГЛИКОЗИДНЫЕ АНТИБИОТИКИ (АА)Общие свойства аминогликозидов:
1. Механизм действия: необратимое связывание со специфическими
рецепторами бактериальных рибосом (нарушение синтеза белка в
микробной клетке) и нарушение синтеза цитоплазматических мембран
бактерицидный тип действия.
62
63.
АМИНОГЛИКОЗИДНЫЕ АНТИБИОТИКИ (АА)Общие свойства аминогликозидов:
2. Высокая токсичность для человека: нефротоксический и ототоксический
эффекты, угнетение нервно-мышечной передачи, ослабление дыхания,
снижение мышечного тонуса и двигательной функции.
3. Сходные фармакологические свойства – практически не всасываются
из ЖКТ (высокогидрофильны), практически не метабилизируются и
выводятся почками в неизменном виде.
63
64.
АМИНОГЛИКОЗИДНЫЕ АНТИБИОТИКИ (АА)Общие свойства аминогликозидов:
4. Потенциирование антибактериального действия пенициллинов и
цефалоспоринов.
5. Широкий спектр антибактериального действия с
преимущественным влиянием на Гр «–» флору, не влияют на
анаэробы, наиболее активны в отношении микобактерий.
64
65.
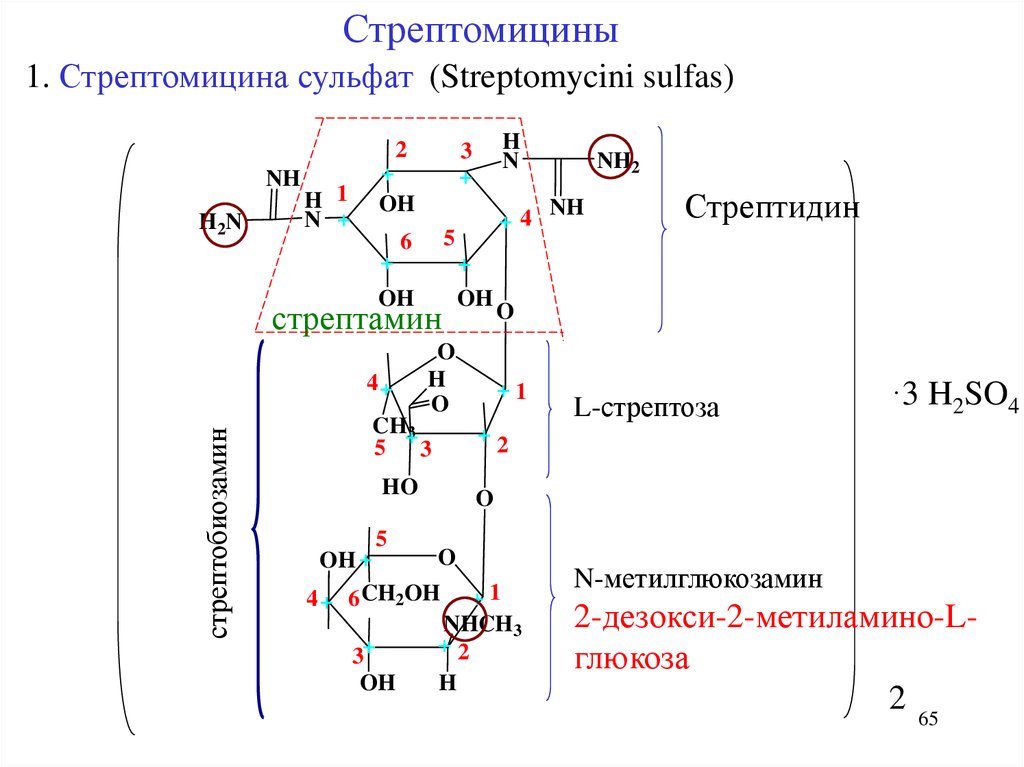
Стрептомицины1. Стрептомицина сульфат (Streptomycini sulfas)
2
NH
H2 N
H 1
N +
+
OH
+
стрептамин
стрептобиозамин
Стрептидин
+
OH
OH
O
H
O
CH+3
5 3
HO
NH2
NH
+4
5
6
4+
H
N
3
+
O
+1
L-стрептоза
·3 H2SO4
+2
O
5
O
OH +
4 + 6 CH2OH + 1
NHCH3
+2
3+
OH
H
N-метилглюкозамин
2-дезокси-2-метиламино-Lглюкоза
2 65
66.
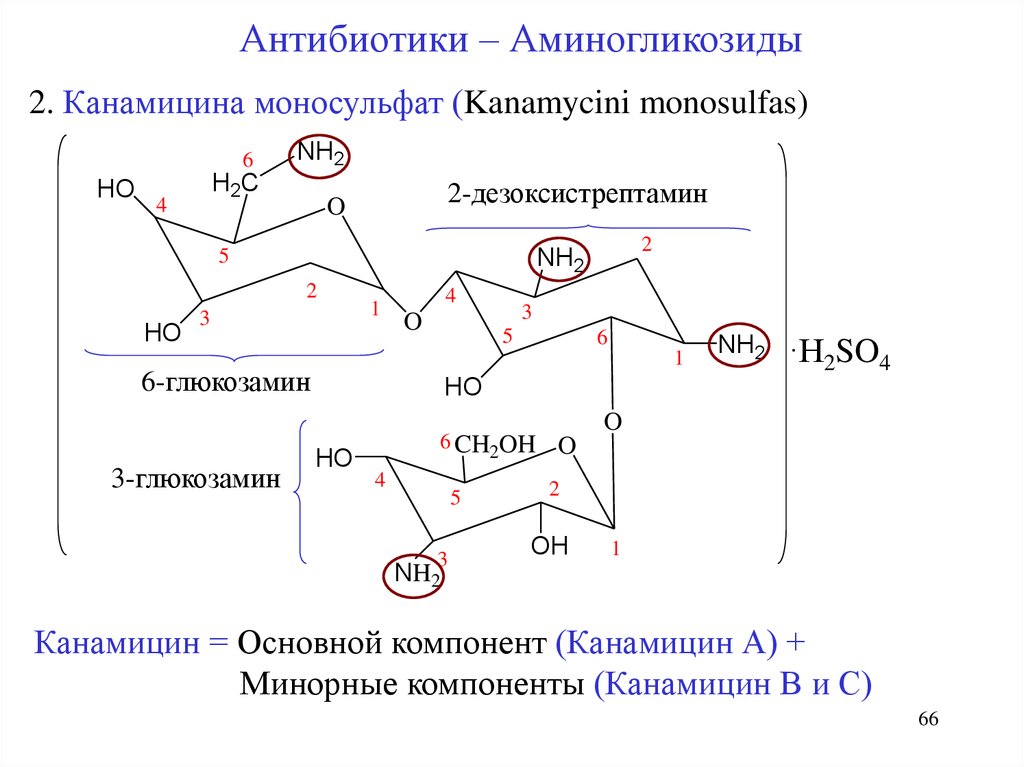
Антибиотики – Аминогликозиды2. Канамицина моносульфат (Kanamycini monosulfas)
6
HO
NH2
H2C
4
2-дезоксистрептамин
O
2
HO
2
NH2
5
3
1
4
O
3
5
6
1
6-глюкозамин
3-глюкозамин
NH2
·H2SO4
HO
6 CH2OH
HO
4
5
3
O
O
2
OH
1
NH2
Канамицин = Основной компонент (Канамицин А) +
Минорные компоненты (Канамицин В и С)
66
67.
Антибиотики – Аминогликозиды3. Амикацина сульфат (Amikacini sulfas)
HO
4
6 CH NH
2
2
5
HO
3
4-амино-2-гидрокси бутирил
O
2
1
OH
6-глюкозамин
2
NH2
4
3
O
HO
6
O OH
CH CH2CH2NH2
NH
1
5
O
5
1
O
2
CH2OH
6
·2H2SO4
3
NH2
4
OH
OH
3-глюкозамин
67
68.
Антибиотики – Аминогликозиды4. Гентамицина сульфат (Gentamycini sulfas)
H 2N
OH
2
O
4
4
5
CH3
2
1
3
NHCH3
O
OH
6
O
5
5
O
2
OH
1
H 2N
Гарозамин
1
4
3
R/
3
NHR//
NH2
Агликон
2-дезокси-D-стрептамин
пурпурозамин
68
69.
Антибиотики – Аминогликозиды5. Тобрамицин (Tobramycin)
Фармакологической действие – антибактериальное широкого
спектра, бактерицидное.
69
70.
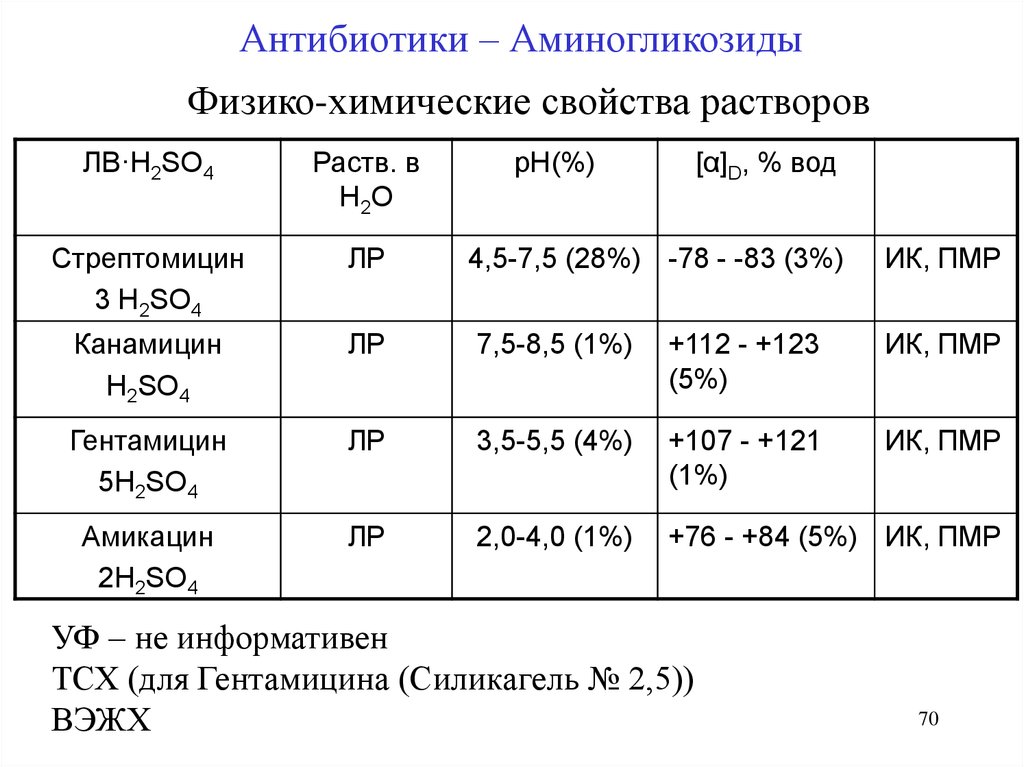
Антибиотики – АминогликозидыФизико-химические свойства растворов
ЛВ·H2SO4
Раств. в
Н 2О
рН(%)
[α]D, % вод
Стрептомицин
3 H2SO4
ЛР
4,5-7,5 (28%) -78 - -83 (3%)
ИК, ПМР
Канамицин
H2SO4
ЛР
7,5-8,5 (1%)
+112 - +123
(5%)
ИК, ПМР
Гентамицин
5H2SO4
ЛР
3,5-5,5 (4%)
+107 - +121
(1%)
ИК, ПМР
Амикацин
2H2SO4
ЛР
2,0-4,0 (1%)
+76 - +84 (5%) ИК, ПМР
УФ – не информативен
ТСХ (для Гентамицина (Силикагель № 2,5))
ВЭЖХ
70
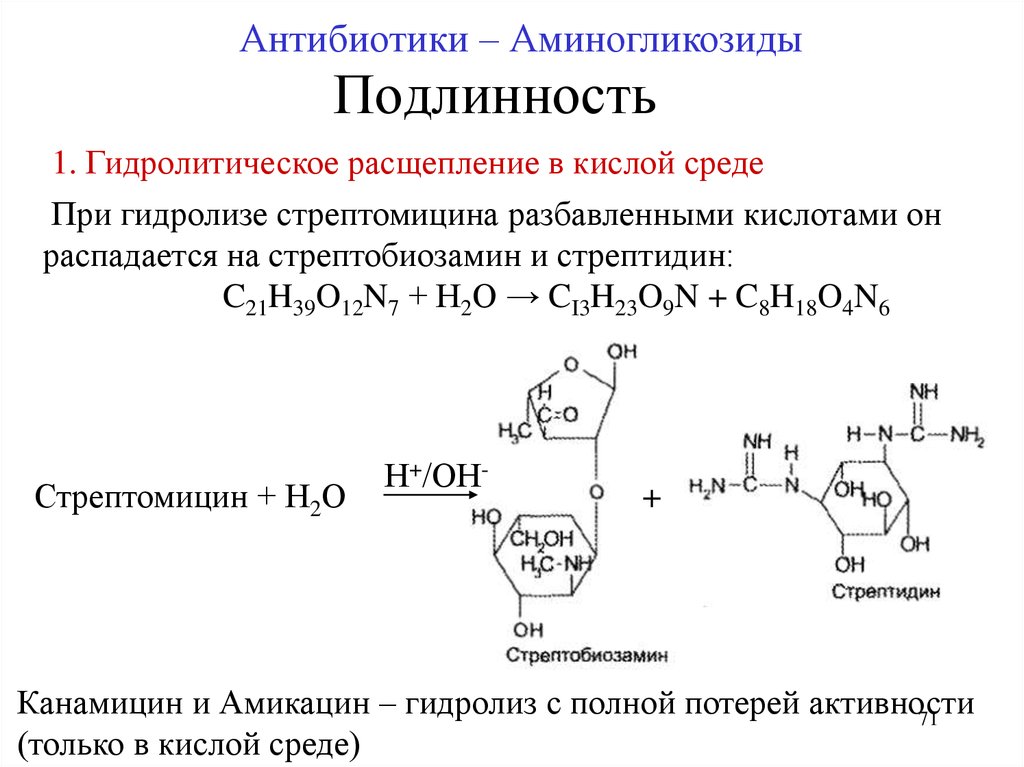
71. Подлинность
Антибиотики – АминогликозидыПодлинность
1. Гидролитическое расщепление в кислой среде
При гидролизе стрептомицина разбавленными кислотами он
распадается на стрептобиозамин и стрептидин:
C21H39O12N7 + Н2О → CI3H23O9N + C8H18O4N6
Стрептомицин + Н2О
Н+/ОН-
+
Канамицин и Амикацин – гидролиз с полной потерей активности
71
(только в кислой среде)
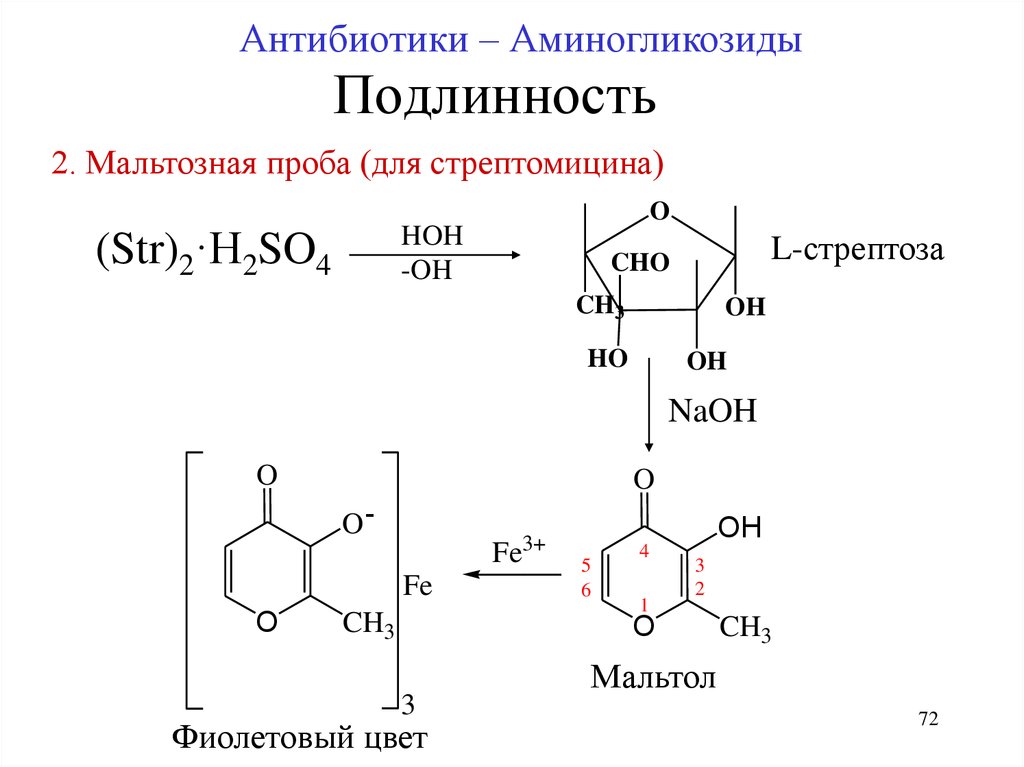
72. Подлинность
Антибиотики – АминогликозидыПодлинность
2. Мальтозная проба (для стрептомицина)
O
(Str)2·H2SO4
HOH
-OH
L-стрептоза
CHO
CH3
OH
HO
OH
NaOH
O
O
O-
Fe
Fe
O
OH
3+
CH3
5
6
4
1
3
2
O
3
Фиолетовый цвет
CH3
Мальтол
72
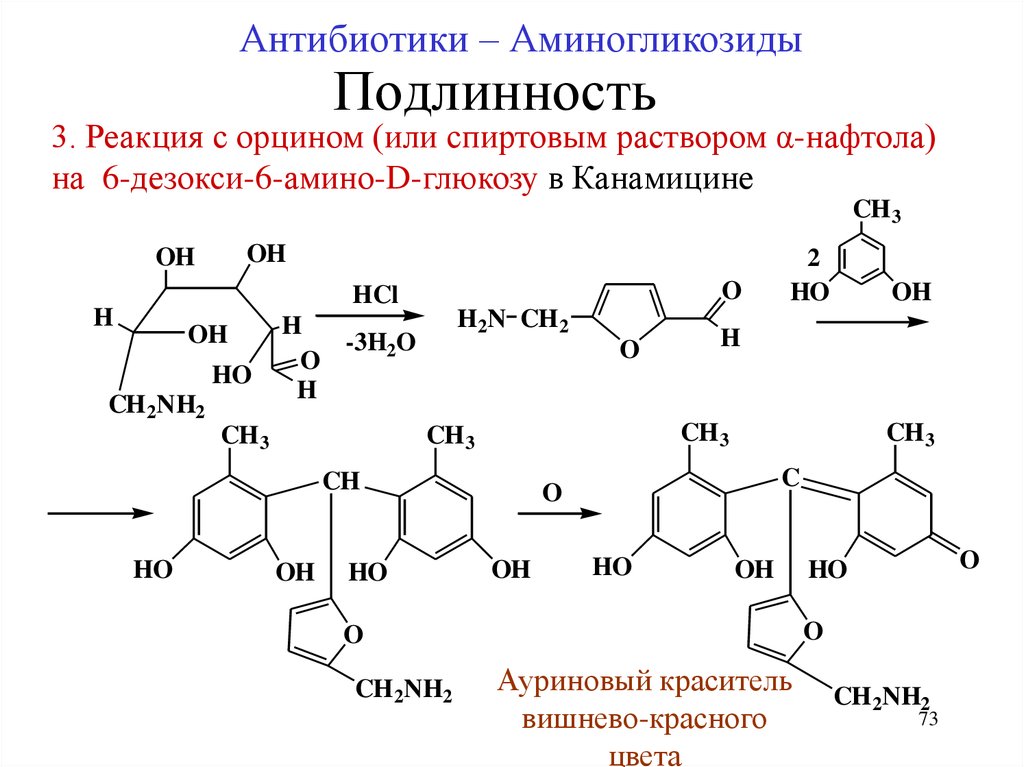
73.
Антибиотики – АминогликозидыПодлинность
3. Реакция с орцином (или спиртовым раствором α-нафтола)
на 6-дезокси-6-амино-D-глюкозу в Канамицине
CH 3
OH
OH
O
HCl
H
OH
HO
CH 2NH2
H2N CH 2
H
-3H2O
O
H
CH 3
O
OH
HO
H
CH 3
C
O
OH
HO
OH
O
HO
O
O
CH 2NH2
OH
CH 3
CH 3
CH
HO
2
HO
Ауриновый краситель
вишнево-красного
цвета
CH 2NH2
73
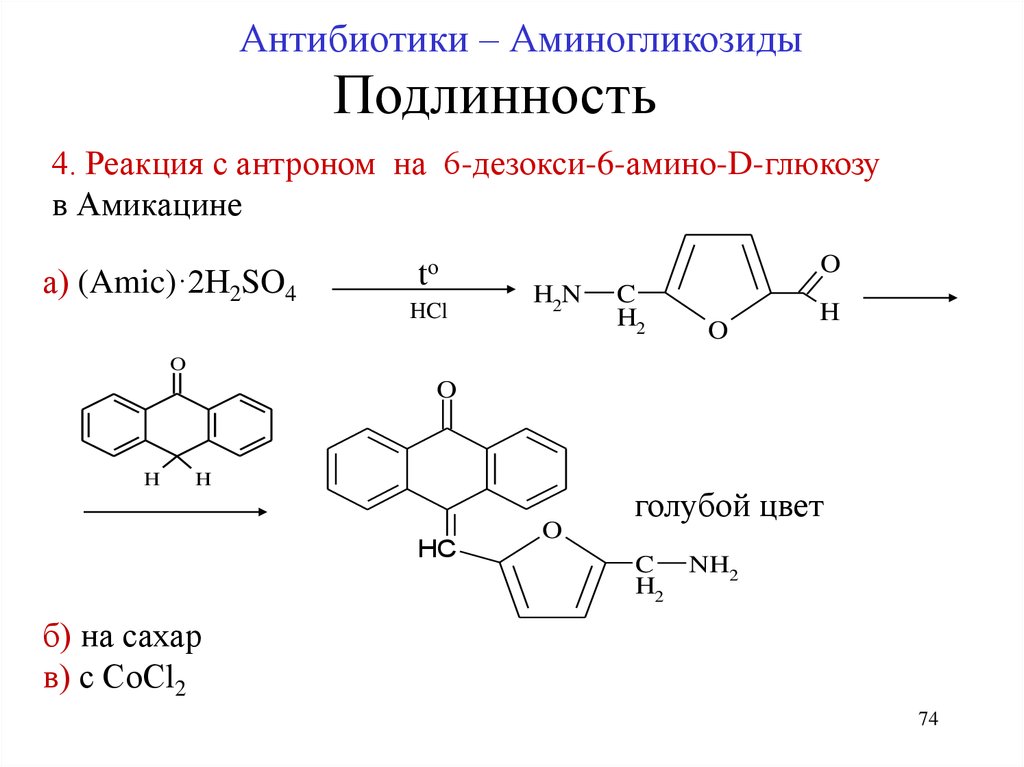
74.
Антибиотики – АминогликозидыПодлинность
4. Реакция с антроном на 6-дезокси-6-амино-D-глюкозу
в Амикацине
а) (Amic)·2H2SO4
tо
HCl
O
H2N
C
H2
O
H
O
O
H
H
HC
O
голубой цвет
C
H2
NH2
б) на сахар
в) с СоСl2
74
75.
Антибиотики – АминогликозидыПодлинность
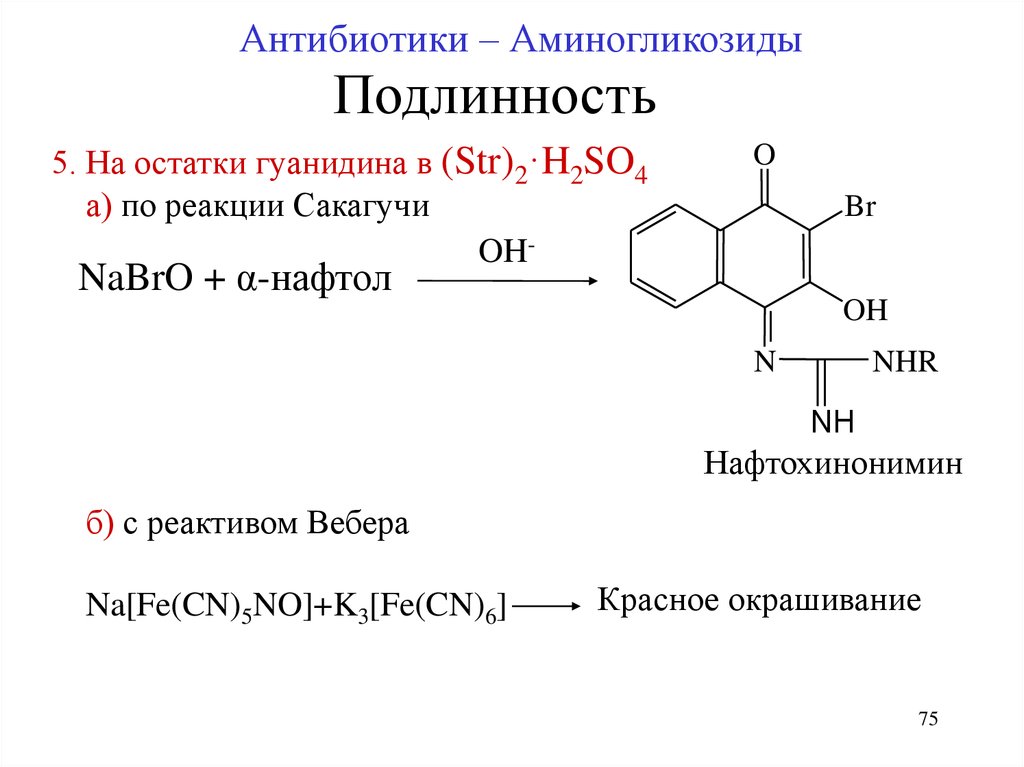
5. На остатки гуанидина в (Str)2·H2SO4
а) по реакции Сакагучи
OH-
O
Br
NaBrO + α-нафтол
OH
N
NHR
NH
Нафтохинонимин
б) с реактивом Вебера
Na[Fe(CN)5NO]+K3[Fe(CN)6]
Красное окрашивание
75
76.
Антибиотики – АминогликозидыПодлинность
6. По альдегидной группе после гидролиза
а) реакция серебряного зеркала
б) с реактивом Несслера
в) с реактивом Фелинга
г) с фенолами
Количественное определение
1. Микробиологический (дифузия в агар)
2. ВЭЖХ, ГЖХ
3. Спектрофотометрия (Стрептомицин сульфат, Канамицина
сульфат)
4. Полярография
76
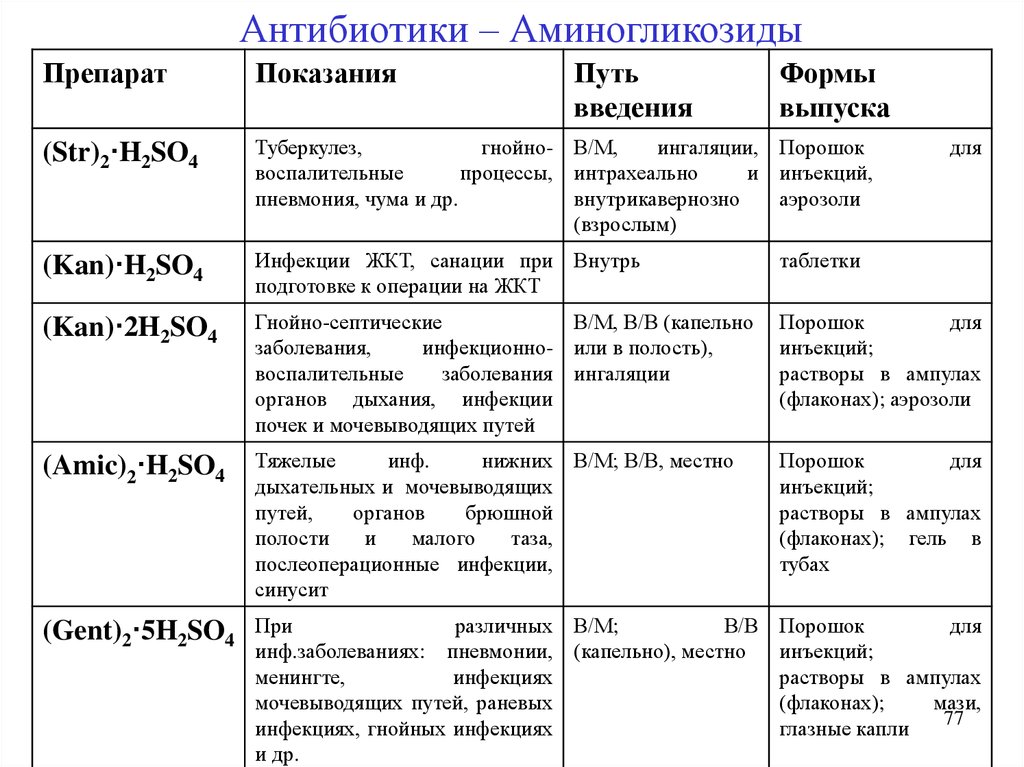
77.
Антибиотики – АминогликозидыПрепарат
Показания
Путь
введения
Формы
выпуска
(Str)2·H2SO4
Туберкулез,
гнойно- В/М,
ингаляции, Порошок
воспалительные
процессы, интрахеально
и инъекций,
пневмония, чума и др.
внутрикавернозно
аэрозоли
(взрослым)
(Kan)·H2SO4
Инфекции ЖКТ, санации при Внутрь
подготовке к операции на ЖКТ
таблетки
(Kan)·2H2SO4
Гнойно-септические
В/М, В/В (капельно
заболевания,
инфекционно- или в полость),
воспалительные
заболевания ингаляции
органов дыхания, инфекции
почек и мочевыводящих путей
Порошок
для
инъекций;
растворы в ампулах
(флаконах); аэрозоли
(Amic)2·H2SO4
Тяжелые
инф.
нижних В/М; В/В, местно
дыхательных и мочевыводящих
путей,
органов
брюшной
полости
и
малого
таза,
послеоперационные инфекции,
синусит
Порошок
для
инъекций;
растворы в ампулах
(флаконах); гель в
тубах
(Gent)2·5H2SO4
При
различных В/М;
В/В
инф.заболеваниях: пневмонии, (капельно), местно
менингте,
инфекциях
мочевыводящих путей, раневых
инфекциях, гнойных инфекциях
и др.
Порошок
для
инъекций;
растворы в ампулах
(флаконах);
мази,
77
глазные капли
для
78. Антибиотики как ЛС Макролиды, азалиды
Государственное образовательное учреждение высшего профессионального образованияНИЖЕГОРОДСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
Федерального агентства по здравоохранению и социальному развитию
КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ И ФАРМАКОГНОЗИИ
Антибиотики как ЛС
Макролиды, азалиды
Доцент кафедры фармацевтической химии и
фармакогнозии, к.х.н.,
Жильцова Ольга Евгеньевна
79.
Антибиотики – Макролиды, азалидыАнтибиотики-макролиды
–
антибиотики,
содержащие
макроциклическое лактонное кольцо, связанное с одним или
несколькими углеводными остатками – аминосахарами.
Лактонное кольцо состоит из 12, 14, 15, 16 и 17 членов и в общем
виде представлен:
Большинство макролидных антибиотиков образуют Streptomyces.
Розамицин, мегаломицин А выделены из Micromonospora,
эритромицин продуцируется представителем рода Saccharopolyspora,
метимицин Streptomyces и нокардиа, патулолиды — представителями
рода Penicillium.
79
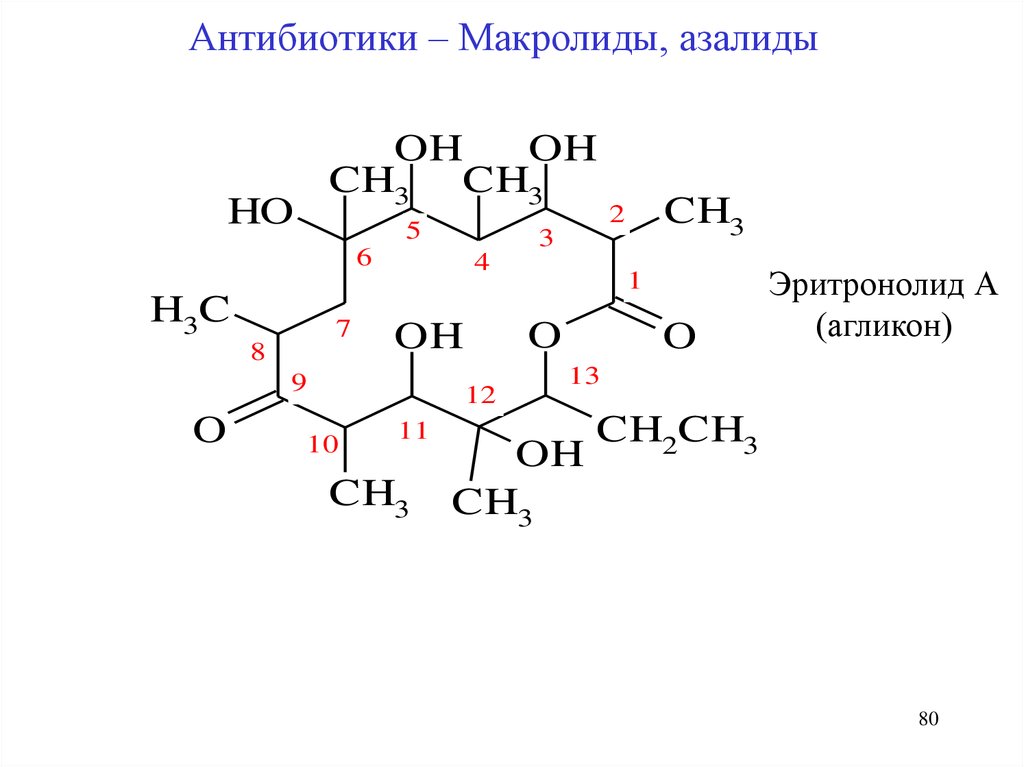
80.
Антибиотики – Макролиды, азалидыOH
OH
CH3 CH3
HO
5
3
6
H3C
7
8
4
O
12
10
11
CH3
1
O
OH
9
CH3
2
O
Эритронолид А
(агликон)
13
OH
CH3
CH2CH3
80
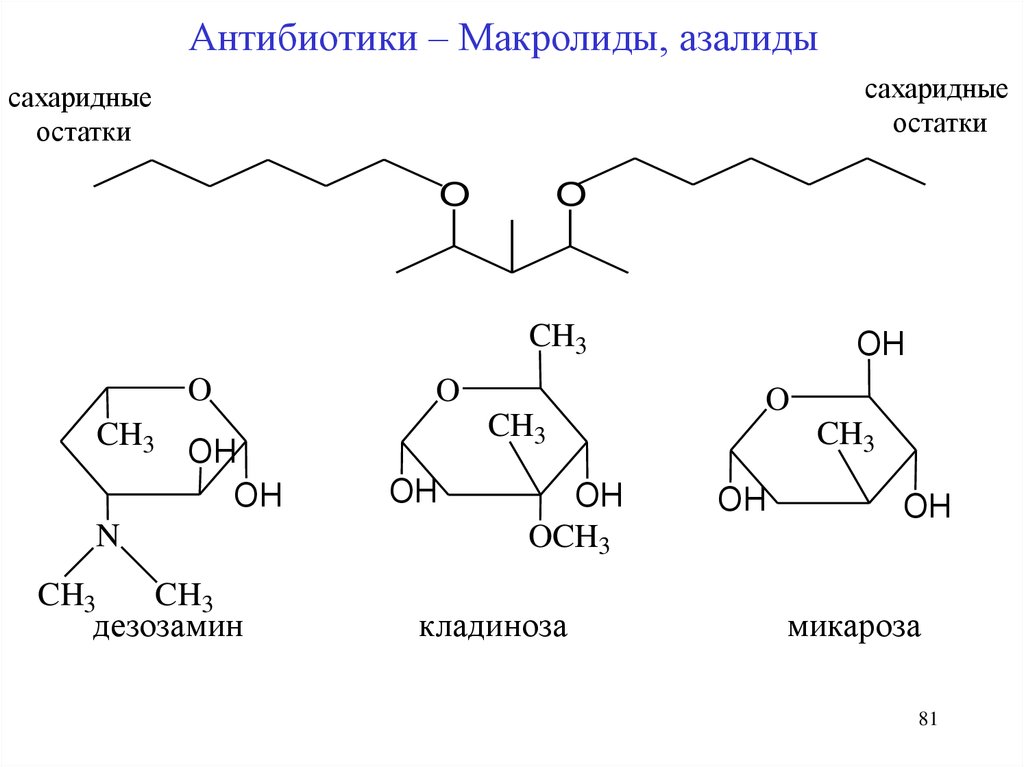
81.
Антибиотики – Макролиды, азалидысахаридные
остатки
сахаридные
остатки
O
O
CH3
O
CH3
OH
OH
N
CH3
CH3
дезозамин
O
CH3
OH
OH
OCH3
кладиноза
OH
O
CH3
OH
OH
микароза
81
82.
Антибиотики – Макролиды, азалиды1. Эритромицин (Erythromycinum) (1952)
! Эритромицин A: R = OH; R = L-кладинозил
1
Эритромицин В: R = H; R1 = L-кладинозил
Эритромицин С: R = ОН; R1 = L-микарозил
Эритромицин В – на 15-25% ниже а/бактериал. акт-ть,
в 2 раза более высокая токсичность
82
83.
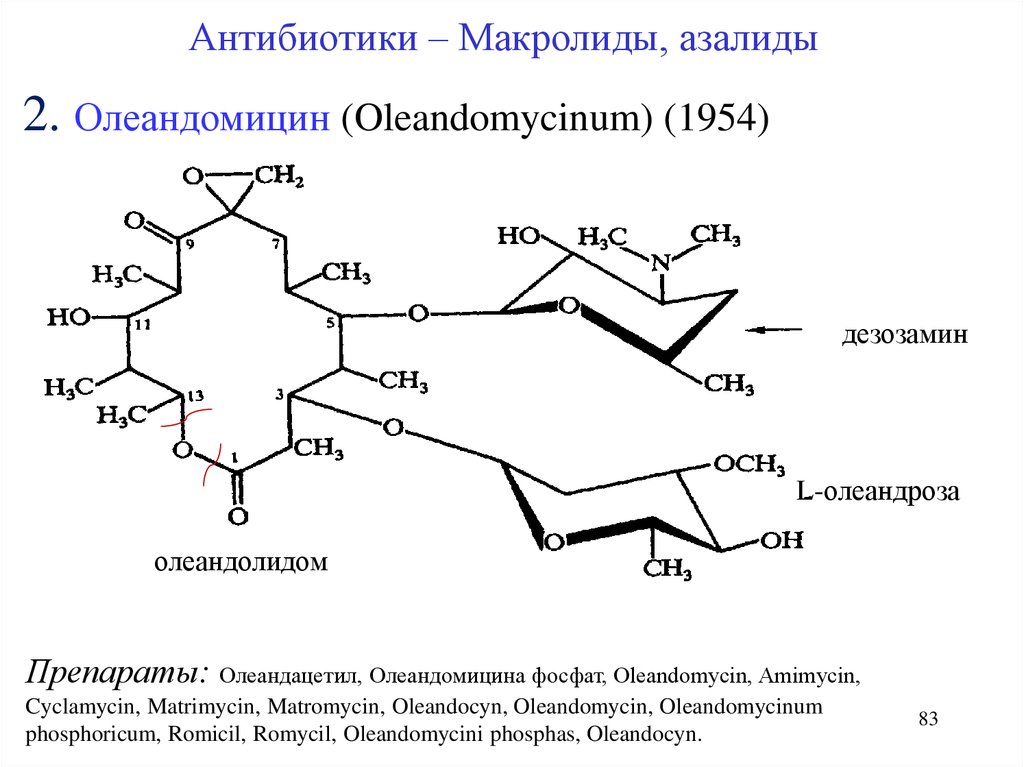
Антибиотики – Макролиды, азалиды2. Олеандомицин (Oleandomycinum) (1954)
дезозамин
L-олеандроза
олеандолидом
Препараты: Олеандацетил, Олеандомицина фосфат, Oleandomycin, Amimycin,
Cyclamycin, Matrimycin, Matromycin, Oleandocyn, Oleandomycin, Oleandomycinum
phosphoricum, Romicil, Romycil, Oleandomycini phosphas, Oleandocyn.
83
84.
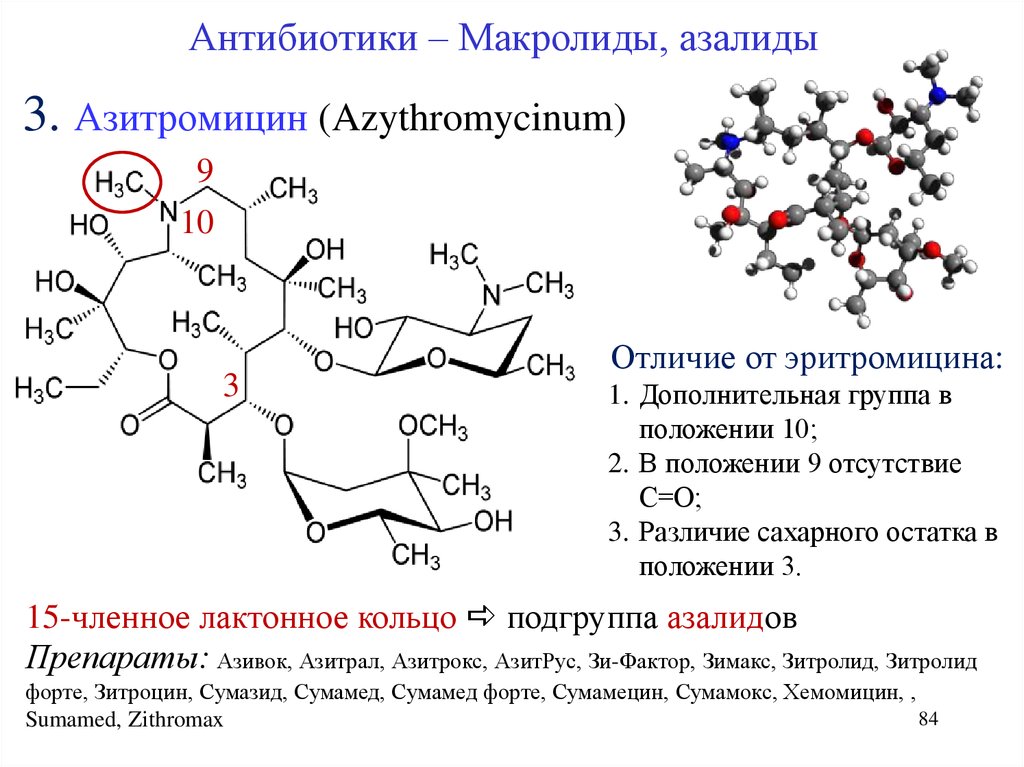
Антибиотики – Макролиды, азалиды3. Азитромицин (Azythromycinum)
9
10
3
Отличие от эритромицина:
1. Дополнительная группа в
положении 10;
2. В положении 9 отсутствие
С=О;
3. Различие сахарного остатка в
положении 3.
15-членное лактонное кольцо подгруппа азалидов
Препараты: Азивок, Азитрал, Азитрокс, АзитРус, Зи-Фактор, Зимакс, Зитролид, Зитролид
форте, Зитроцин, Сумазид, Сумамед, Сумамед форте, Сумамецин, Сумамокс, Хемомицин, ,
84
Sumamed, Zithromax
85.
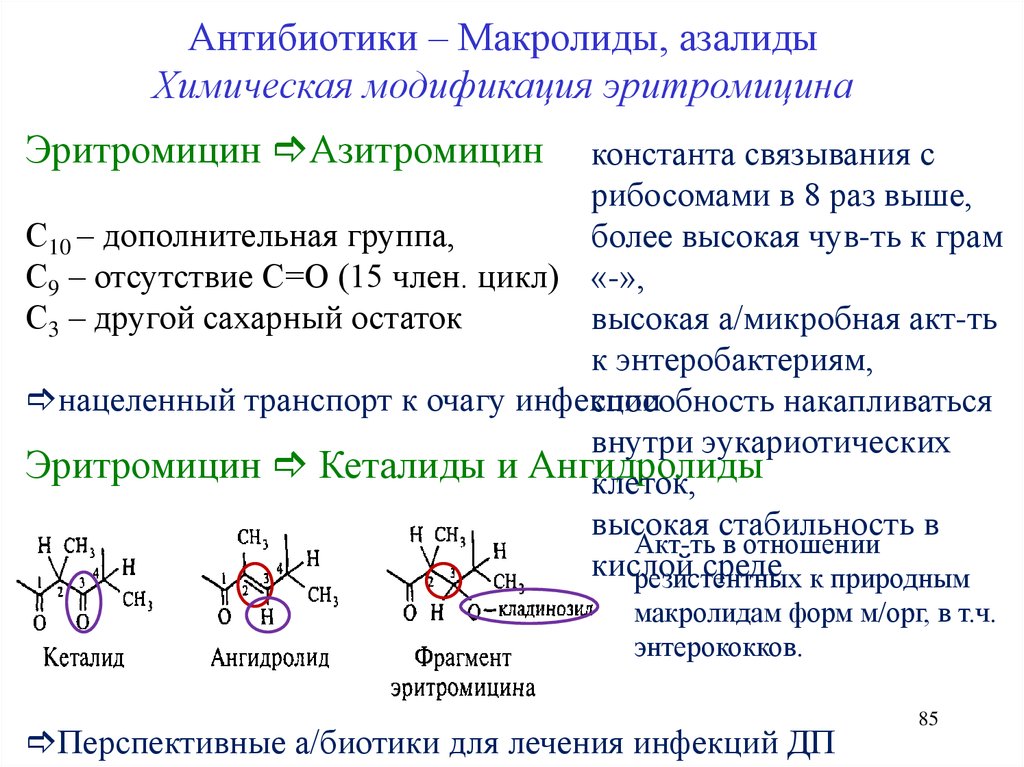
Антибиотики – Макролиды, азалидыХимическая модификация эритромицина
Эритромицин Азитромицин
константа связывания с
рибосомами в 8 раз выше,
С10 – дополнительная группа,
более высокая чув-ть к грам
С9 – отсутствие С=О (15 член. цикл) «-»,
С3 – другой сахарный остаток
высокая а/микробная акт-ть
к энтеробактериям,
нацеленный транспорт к очагу инфекции
способность накапливаться
внутри эукариотических
Эритромицин Кеталиды и Ангидролиды
клеток,
высокая стабильность в
Акт-ть в отношении
кислой
среде к природным
резистентных
макролидам форм м/орг, в т.ч.
энтерококков.
Перспективные а/биотики для лечения инфекций ДП
85
86.
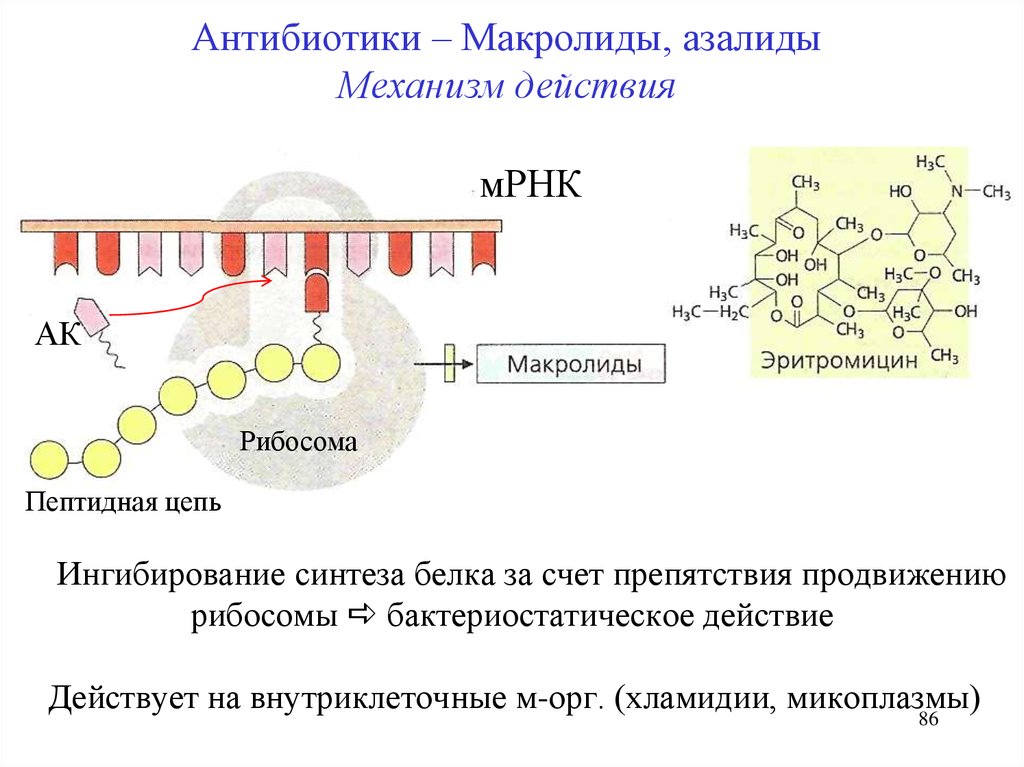
Антибиотики – Макролиды, азалидыМеханизм действия
мРНК
АК
Рибосома
Пептидная цепь
Ингибирование синтеза белка за счет препятствия продвижению
рибосомы бактериостатическое действие
Действует на внутриклеточные м-орг. (хламидии, микоплазмы)
86
87.
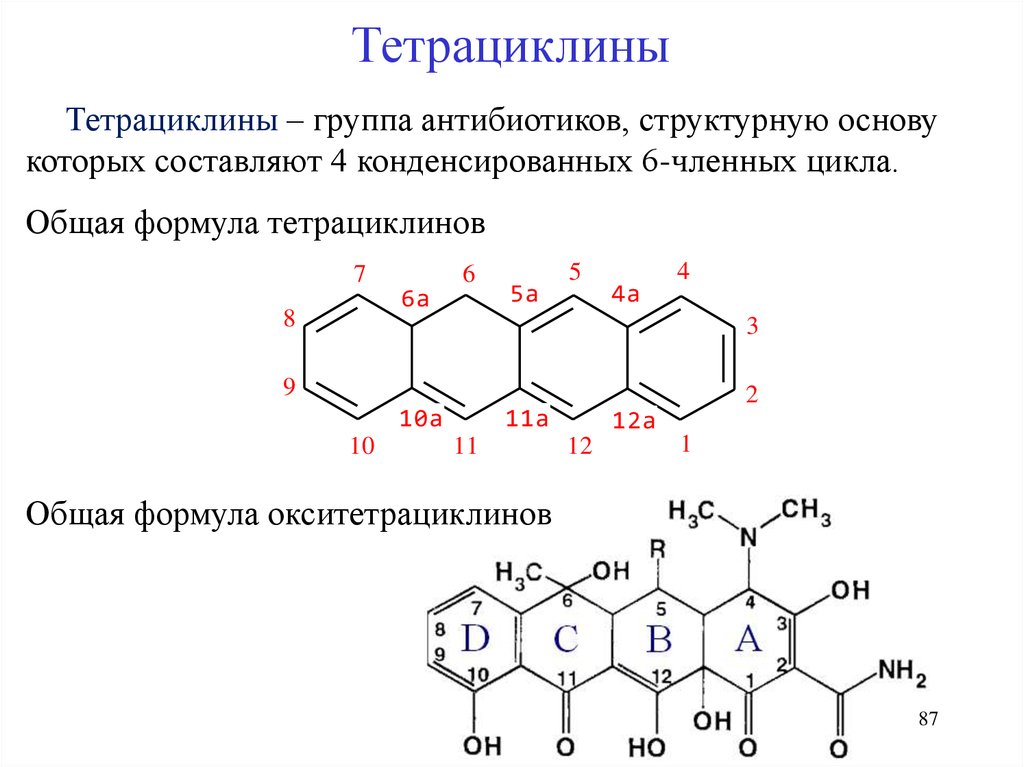
ТетрациклиныТетрациклины – группа антибиотиков, структурную основу
которых составляют 4 конденсированных 6-членных цикла.
Общая формула тетрациклинов
7
6
6а
8
5а
5
4а
4
3
9
11а
10а
10
2
11
12а
12
1
Общая формула окситетрациклинов
87
88.
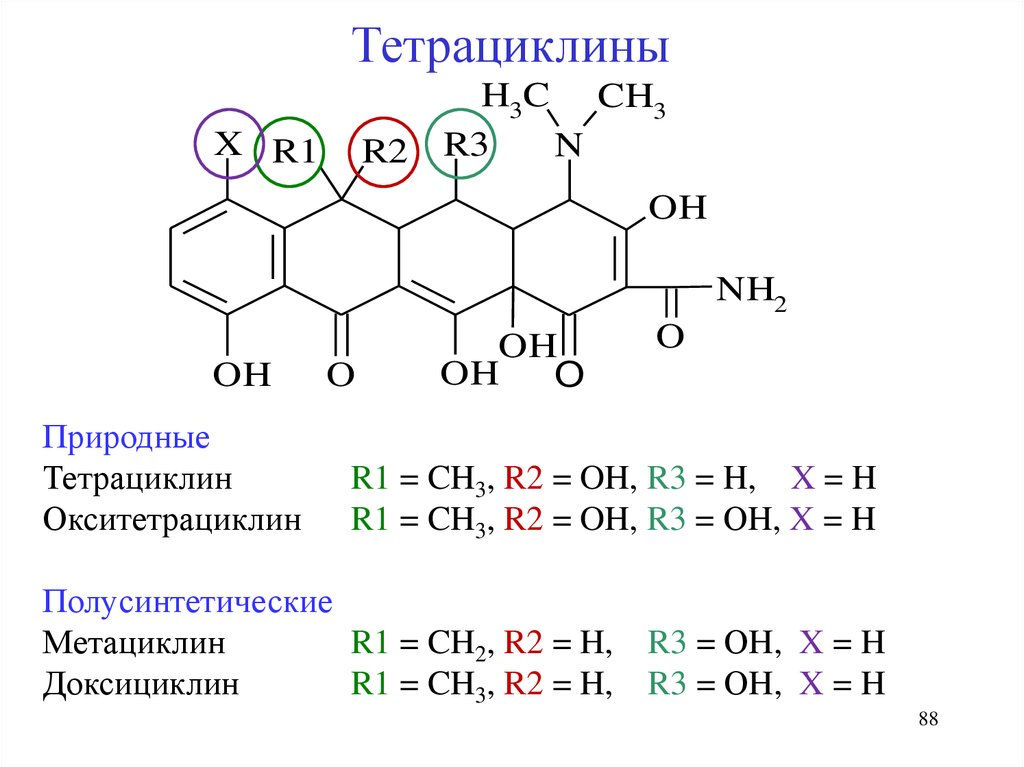
ТетрациклиныX R1
R2
H3C CH3
R3
N
OH
NH2
OH
Природные
Тетрациклин
Окситетрациклин
O
OH
OH
O
O
R1 = CH3, R2 = OH, R3 = H, X = H
R1 = CH3, R2 = OH, R3 = ОH, X = H
Полусинтетические
Метациклин
R1 = CH2, R2 = H,
Доксициклин
R1 = CH3, R2 = H,
R3 = ОH, X = H
R3 = ОH, X = H
88
89.
ТетрациклиныТетрациклин
Тетрациклин HCl
Ж, Кр, Кр-Кор
МР в Н2О
УФ: 0,1 М HCl,
[С]=0,01%
λ1=220,
λ2=265,
λ3=395
λ=380 нм
Ж, Кр,
ЛР в р-ре
10% H2SO4,
100 ч С2Н5ОН
Окситетрациклин
Ж, Кр,
λ1=353 (0,002% в
HCl
HCl)
под действ О2-кор
Р в Н2О
89
90.
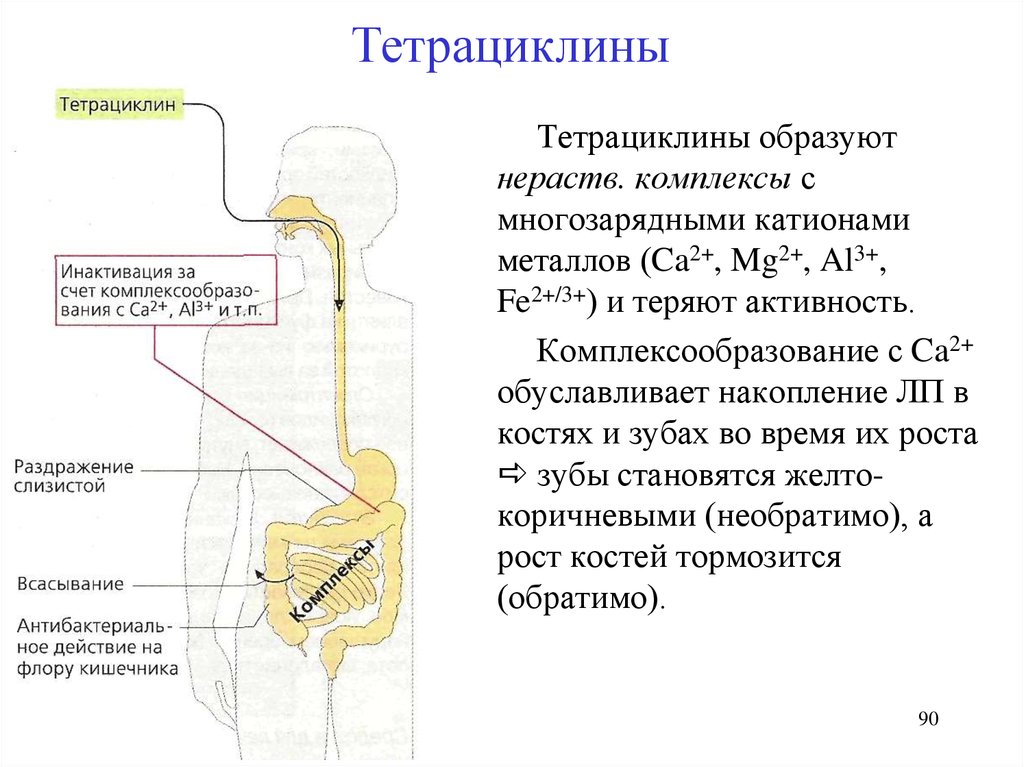
ТетрациклиныТетрациклины образуют
нераств. комплексы с
многозарядными катионами
металлов (Ca2+, Mg2+, Al3+,
Fe2+/3+) и теряют активность.
Комплексообразование с Ca2+
обуславливает накопление ЛП в
костях и зубах во время их роста
зубы становятся желтокоричневыми (необратимо), а
рост костей тормозится
(обратимо).
90
91.
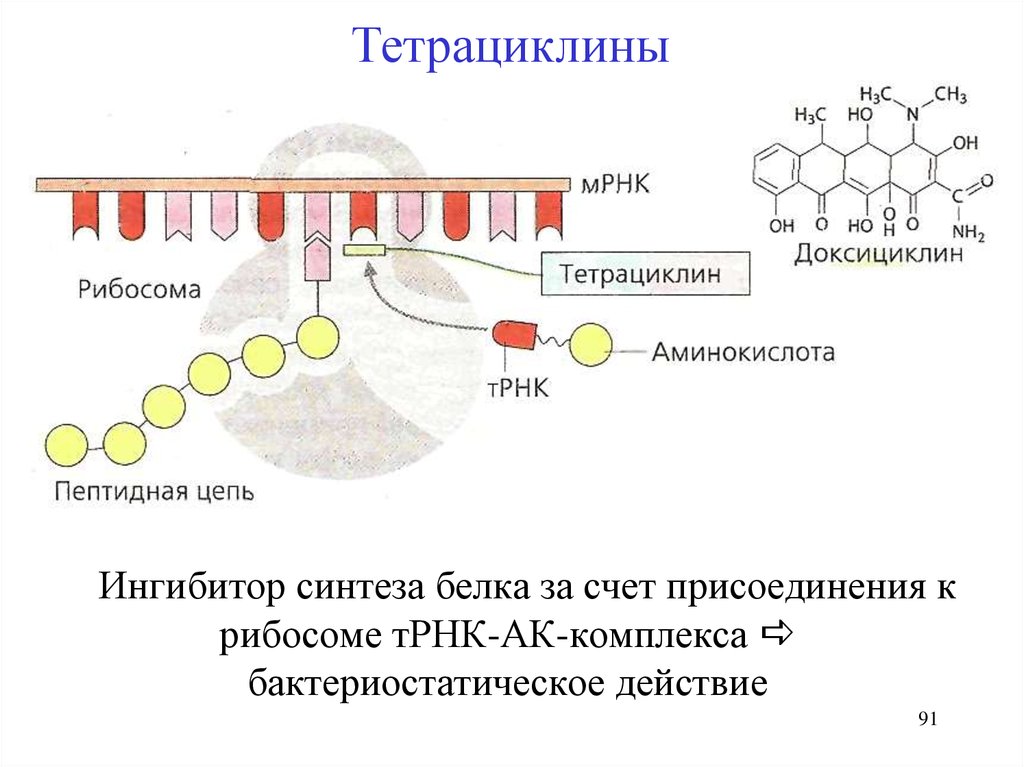
ТетрациклиныИнгибитор синтеза белка за счет присоединения к
рибосоме тРНК-АК-комплекса
бактериостатическое действие
91
92.
Противоопухолевые антибиотикиВ
лечении
онкозаболеваний
применяются
антибиотики
следующих групп:
Актиномицины — дактиномицин
Антрациклины — рубомицин, доксорубицин, карминомицин
Флеомицины — блеомицин, блеомицетин
Производные ауреоловой кислоты — оливомицин, митрамицин
Разного химического строения — брунеомицин, митомицин
Особенность данных антибиотиков заключается в механизме
действия – ингибирование синтеза белка.
92
93.
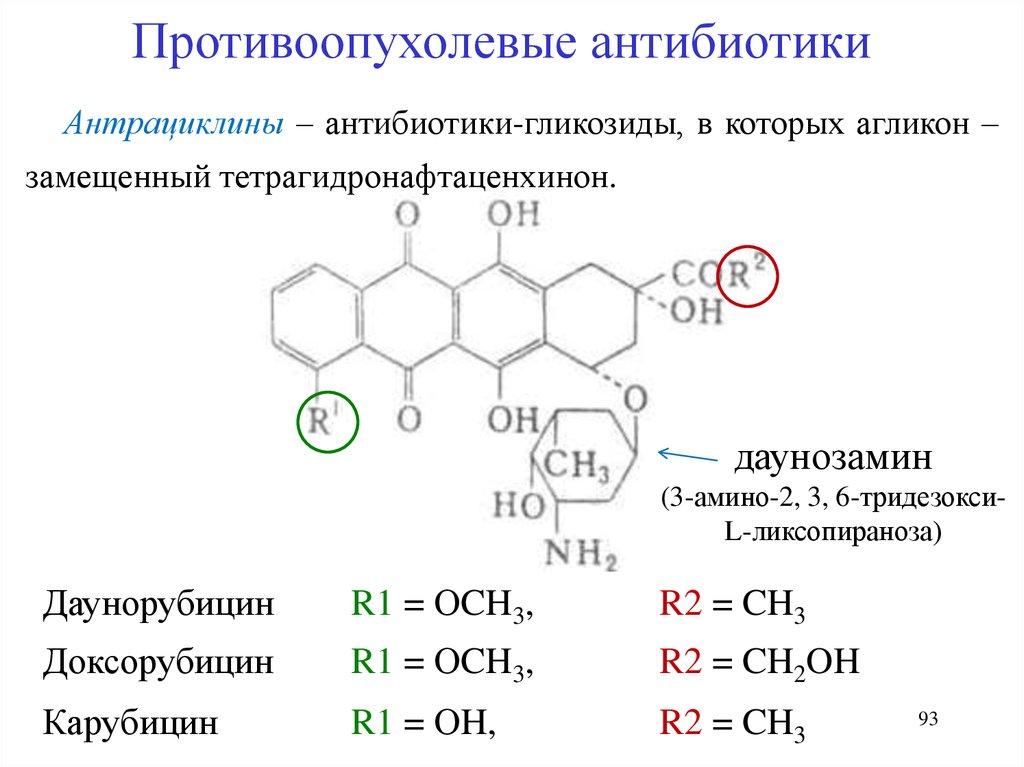
Противоопухолевые антибиотикиАнтрациклины – антибиотики-гликозиды, в которых агликон –
замещенный тетрагидронафтаценхинон.
даунозамин
(3-амино-2, 3, 6-тридезоксиL-ликсопираноза)
Даунорубицин
R1 = ОCH3,
R2 = CH3
Доксорубицин
R1 = ОCH3,
R2 = CH2OH
Карубицин
R1 = ОH,
R2 = CH3
93
94.
Противоопухолевые антибиотики1. Даунорубицин (Daunorubicin) или
Дауномицин (Daunomycin)
Первый антрациклин
(начало 60-х годов) из
Streptomyces coeruleorubidus
Препараты: Даунозом, Церубидин,
Даунорубицин-ЛЭНС, Рубомицина г/хл
с церулоплазмином
(Cu)
А
0,5
10
480
500 520
560
λ, нм
94
95.
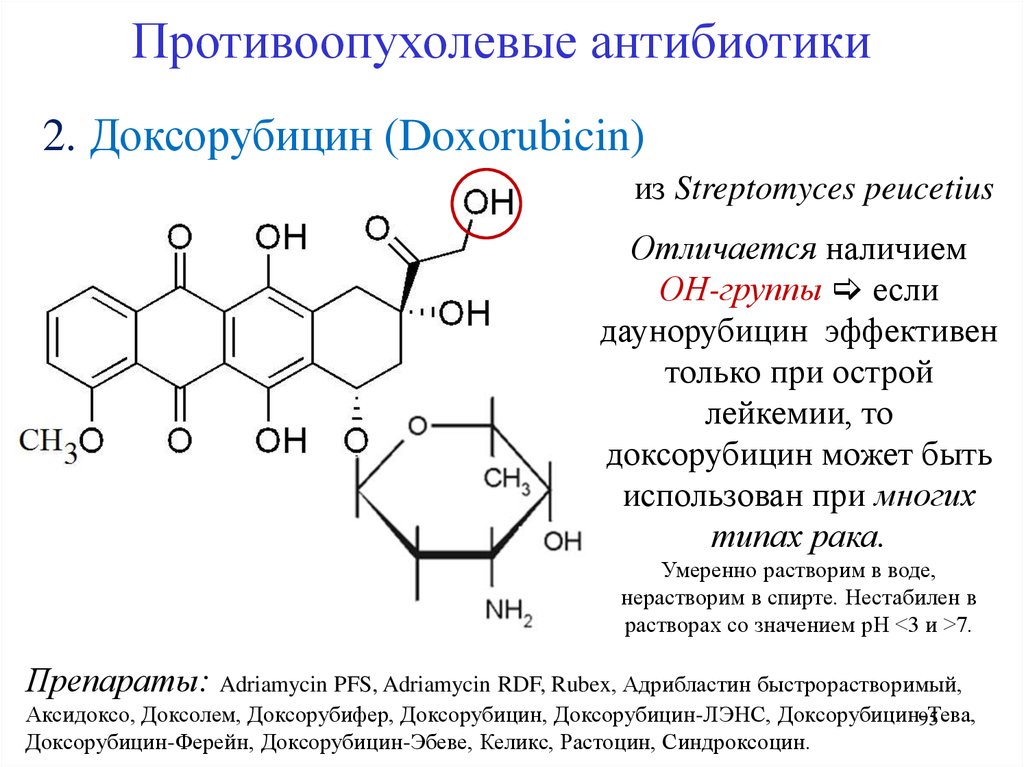
Противоопухолевые антибиотики2. Доксорубицин (Doxorubicin)
из Streptomyces peucetius
Отличается наличием
ОН-группы если
даунорубицин эффективен
только при острой
лейкемии, то
доксорубицин может быть
использован при многих
типах рака.
Умеренно растворим в воде,
нерастворим в спирте. Нестабилен в
растворах со значением рН <3 и >7.
Препараты: Adriamycin PFS, Adriamycin RDF, Rubex, Адрибластин быстрорастворимый,
Аксидоксо, Доксолем, Доксорубифер, Доксорубицин, Доксорубицин-ЛЭНС, Доксорубицин-Тева,
95
Доксорубицин-Ферейн, Доксорубицин-Эбеве, Келикс, Растоцин, Синдроксоцин.
96.
Противоопухолевые антибиотики3. Карубицин (Carubicin)
из Actionomadura carminata
Отличается отсутствием
CH3-группы карубицин
подавляет рост первичной
опухоли и метастазов,
высоко эффективен при
злокачественных опухолях
у детей; хорошо проникает
в различные ткани, не
проходит через ГЭБ.
Препараты: Карминомицина гидрохлорид
Растворим в воде.
96
97.
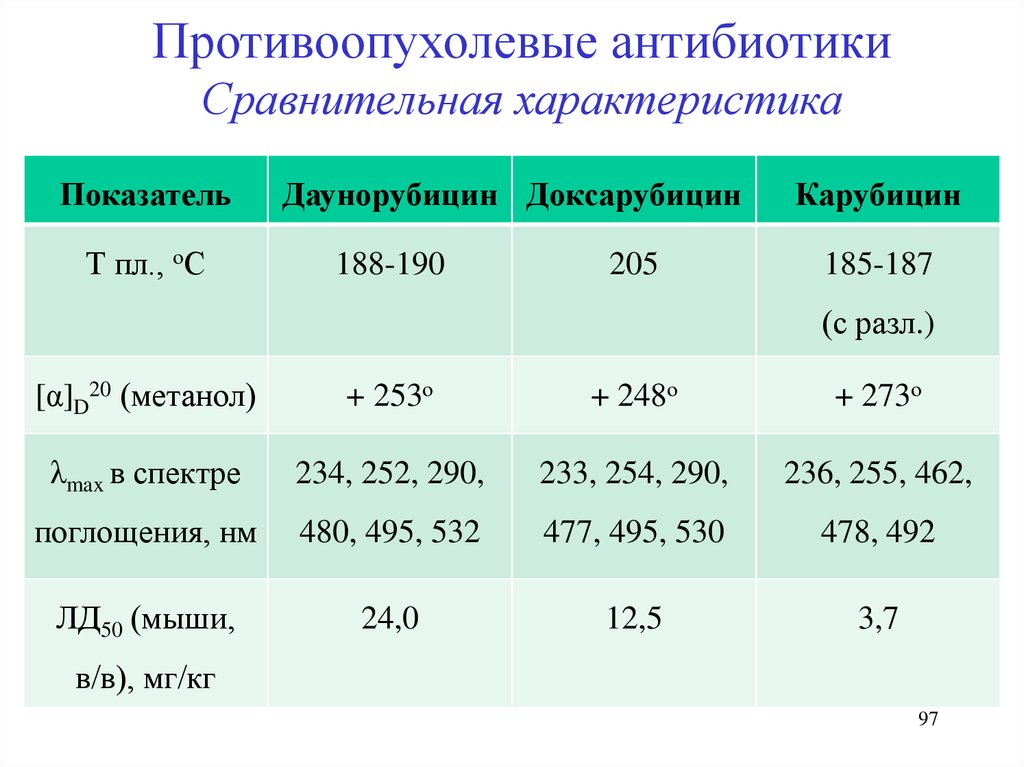
Противоопухолевые антибиотикиСравнительная характеристика
Показатель
Т пл., оС
Даунорубицин Доксарубицин
188-190
205
Карубицин
185-187
(с разл.)
[α]D20 (метанол)
+ 253о
+ 248о
+ 273о
λmax в спектре
234, 252, 290,
233, 254, 290,
236, 255, 462,
поглощения, нм
480, 495, 532
477, 495, 530
478, 492
ЛД50 (мыши,
24,0
12,5
3,7
в/в), мг/кг
97
98.
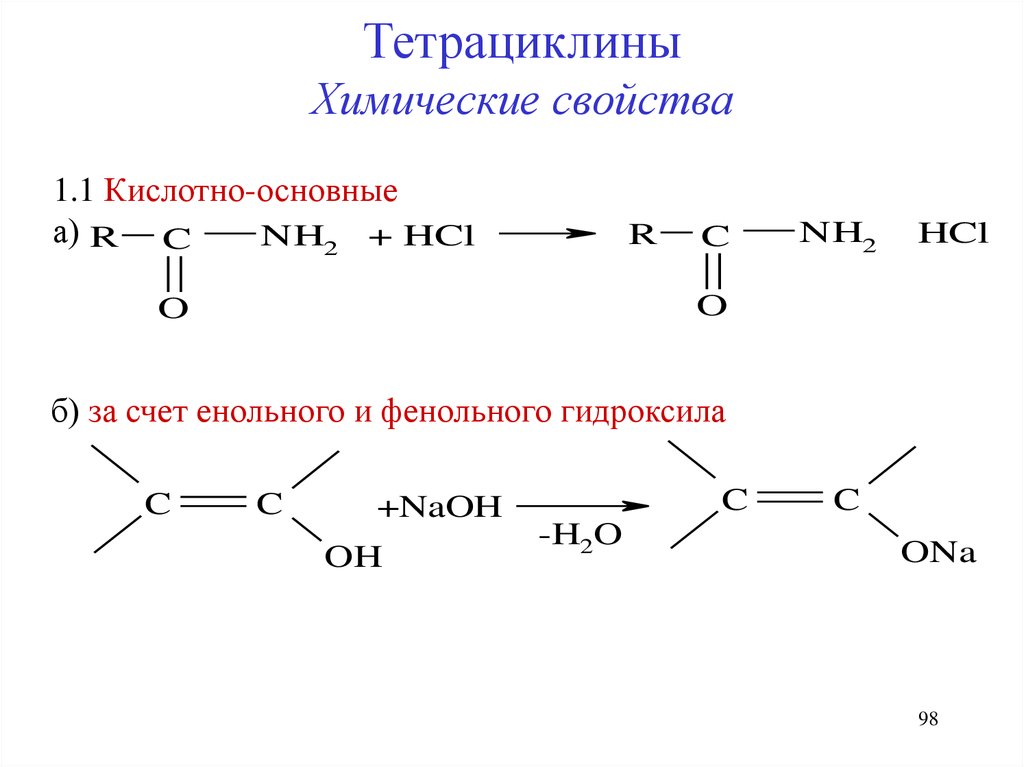
ТетрациклиныХимические свойства
1.1 Кислотно-основные
а) R C
NH2 + HCl
R
C
NH2
HCl
O
O
б) за счет енольного и фенольного гидроксила
C
C
+NaOH
OH
C
-H2O
C
ONa
98
99.
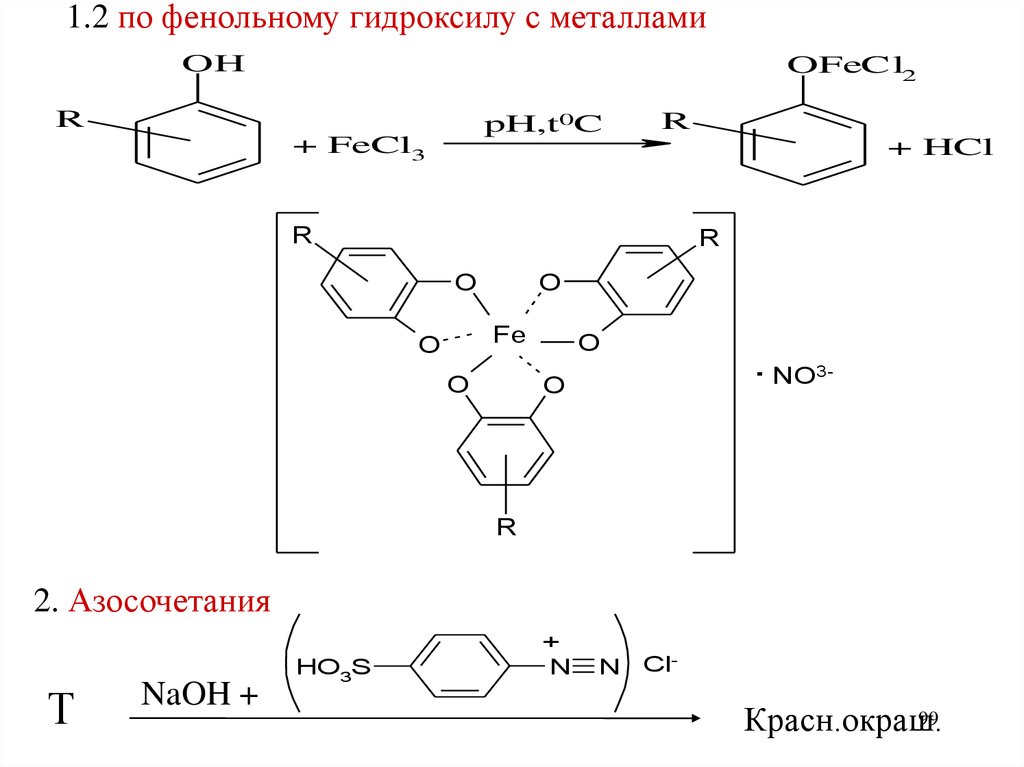
1.2 по фенольному гидроксилу с металламиOH
OFeCl2
R
pH,t0C
+ FeCl3
R
+ HCl
R
R
O
O
Fe
O
O
O
. NO
O
3-
R
2. Азосочетания
Т
NaOH +
HO3S
+
N
N
Cl99
Красн.окраш.
100.
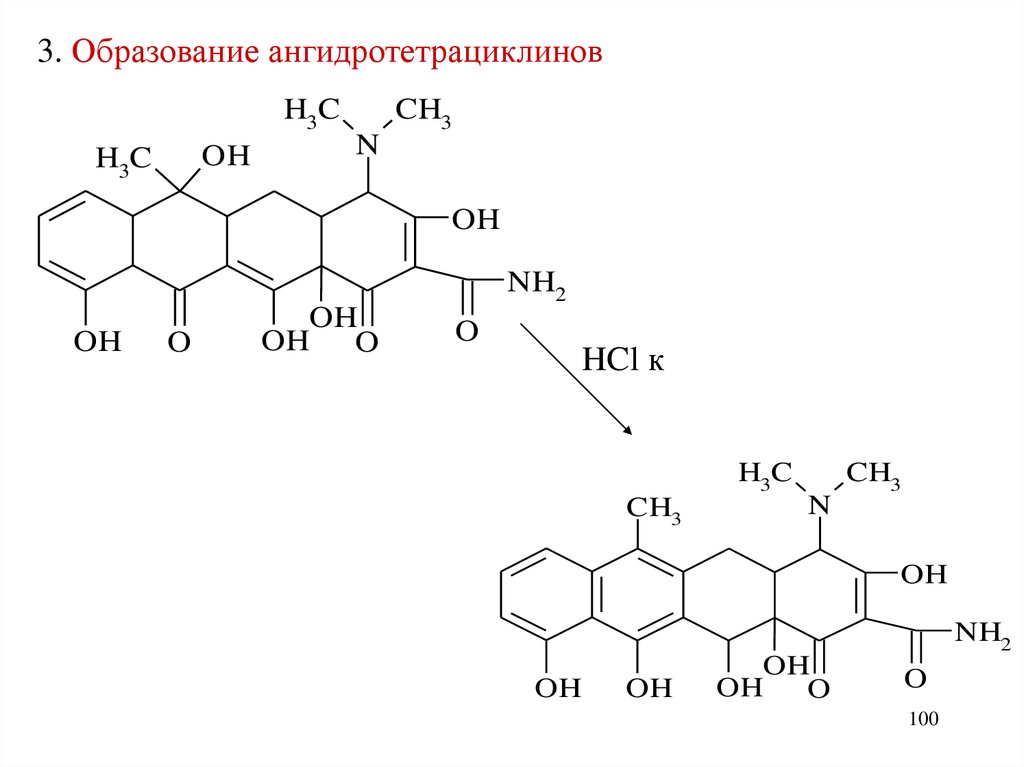
3. Образование ангидротетрациклиновH3C
OH
H3C
CH3
N
OH
NH2
OH
O
OH
OH O
O
HCl к
H3C
CH3
CH3
N
OH
NH2
OH
OH
OH
OH
O
O
100
101.
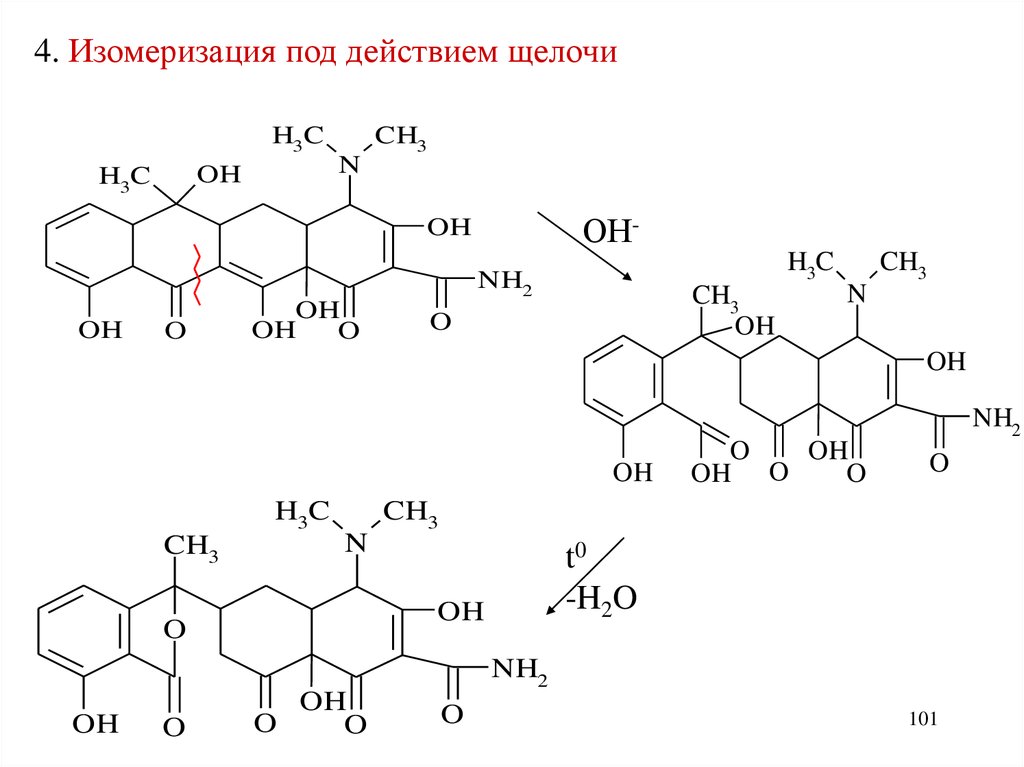
4. Изомеризация под действием щелочиH3C
N
OH
H3C
CH3
ОН-
OH
H3C
NH2
OH
O
OH
OH
O
CH3
OH
O
CH3
N
OH
NH2
OH
H3C
CH3
O
OH
OH O
O
O
CH3
N
t0
-H2O
OH
O
NH2
OH
O
OH
O
O
O
101
102.
Государственное образовательное учреждение высшего профессионального образованияНИЖЕГОРОДСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
Федерального агентства по здравоохранению и социальному развитию
КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ И ФАРМАКОГНОЗИИ
Антибиотики ароматического ряда
Доцент кафедры фармацевтической химии и
фармакогнозии, к.х.н.,
Жильцова Ольга Евгеньевна
103.
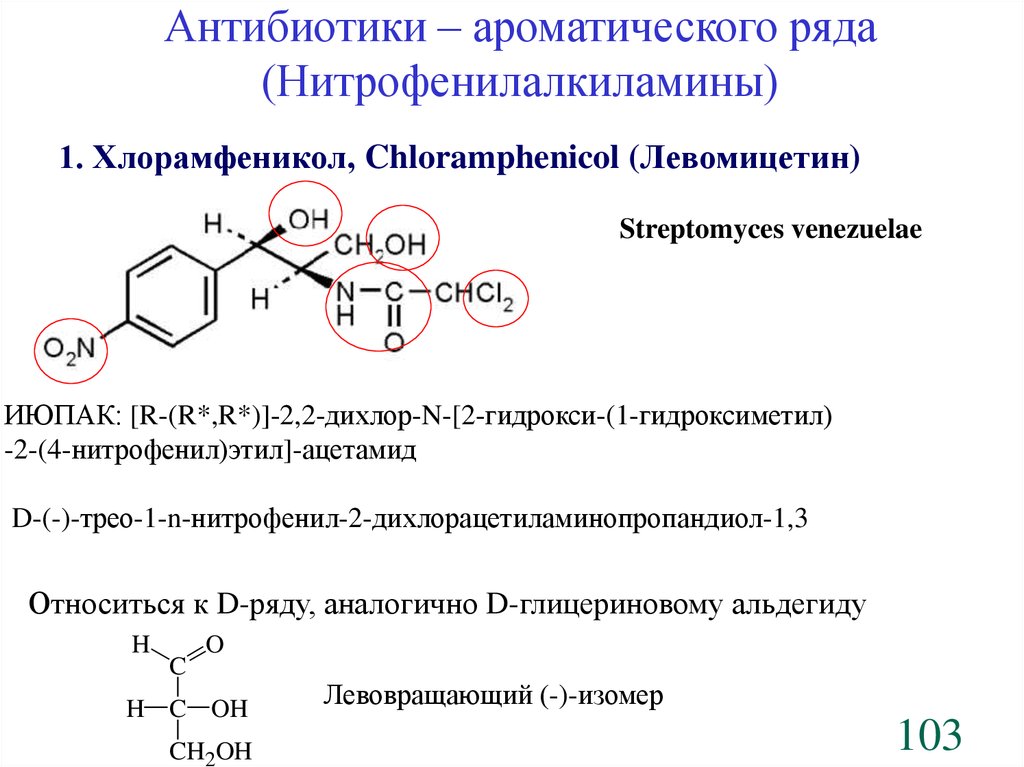
Антибиотики – ароматического ряда(Нитрофенилалкиламины)
1. Хлорамфеникол, Chloramphenicol (Левомицетин)
Streptomyces venezuelae
ИЮПАК: [R-(R*,R*)]-2,2-дихлор-N-[2-гидрокси-(1-гидроксиметил)
-2-(4-нитрофенил)этил]-ацетамид
D-(-)-трео-1-n-нитрофенил-2-дихлорацетиламинопропандиол-1,3
Относиться к D-ряду, аналогично D-глицериновому альдегиду
H
C
O
H C OH
CH2OH
Левовращающий (-)-изомер
103
104.
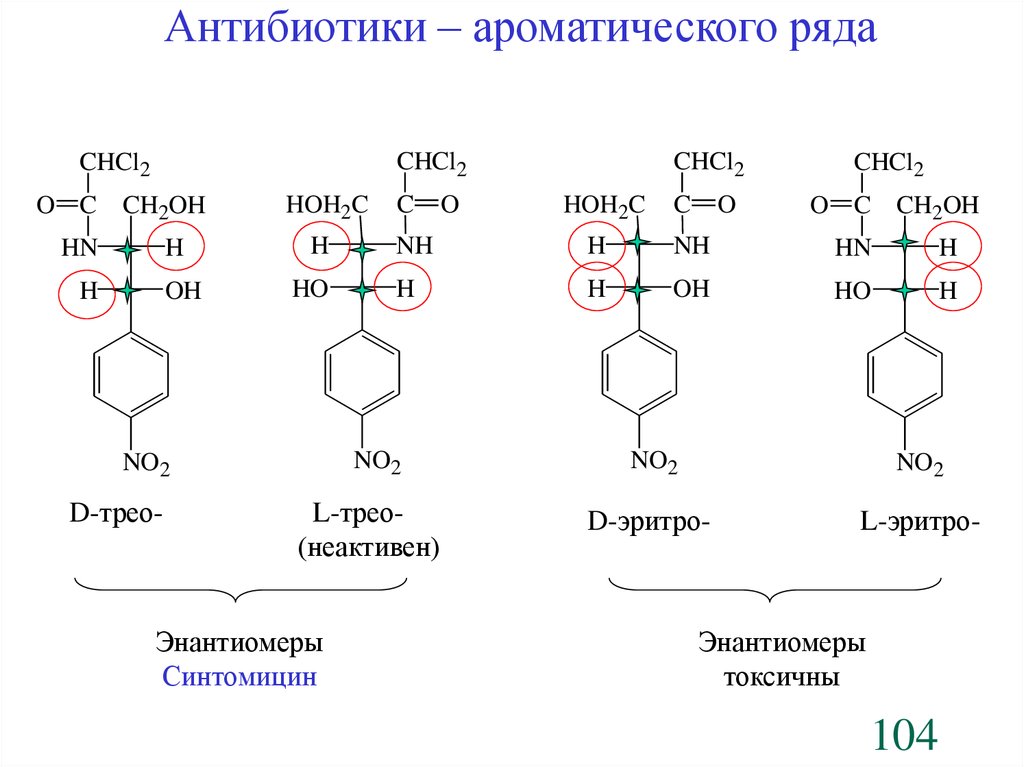
Антибиотики – ароматического рядаCHCl2
CHCl2
O C CH2OH
HN
H
H
OH
HOH2C
H
HO
HOH2C
C
O
O C
CH2OH
H
NH
HN
H
H
H
OH
HO
H
L-трео(неактивен)
Энантиомеры
Синтомицин
O
CHCl2
NH
NO2
NO2
D-трео-
C
CHCl2
NO2
NO2
D-эритро-
L-эритро-
Энантиомеры
токсичны
104
105.
Антибиотики – ароматического ряда2. Хлорамфеникола стеарат, Chloramphenicol stearate
(Левомицетина стеарат, Laevomycetini stearas)
O
HN C CHCl2
H2
C O C
OH H
O
H
O2N
(CH2)16
CH3
3. Хлорамфеникола натрия сукцинат, Chloramphenicol sodium
succinate (Левомицетина сукцинат растворимый, Laevomycetini
sucinas solubile)
O
O2N
HN C CHCl2
H
H2
C O C
OH H
O
(CH2)2
COONa
105
106.
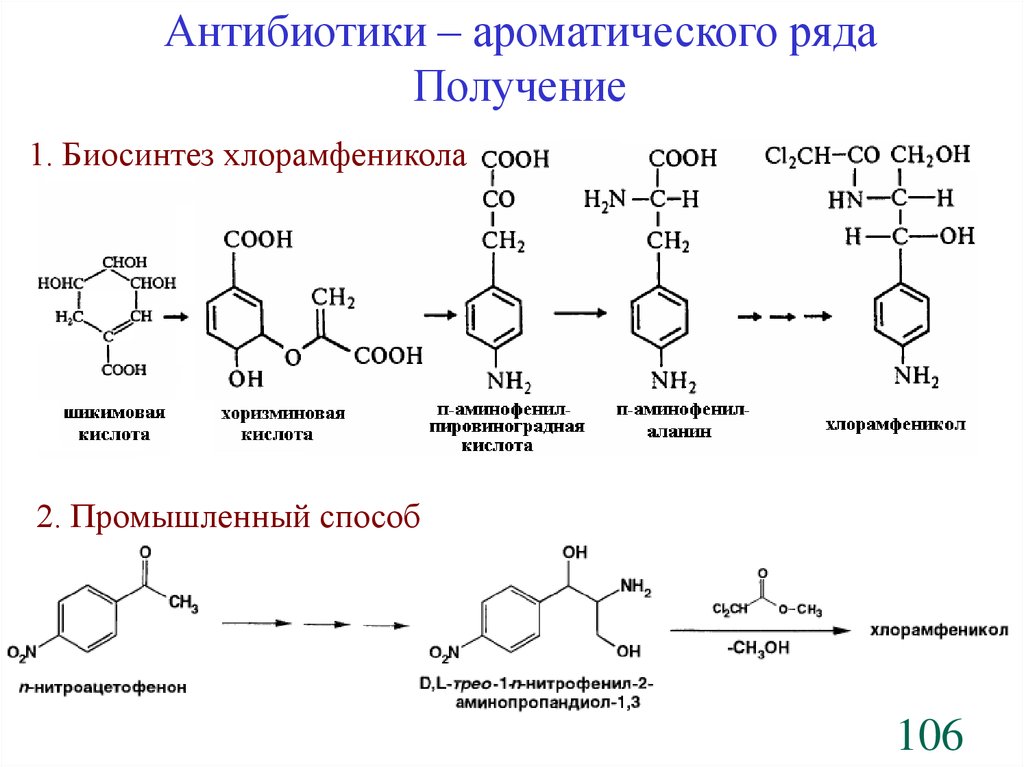
Антибиотики – ароматического рядаПолучение
1. Биосинтез хлорамфеникола
2. Промышленный способ
106
107.
Физико-химические свойства1. Поглощение в УФ-свете
λ max =278 нм (Е1%1 см = 290-305 ), λ min =237 нм;
2. Оптическая активность (направление вращения зависит от растворителя)
[α]20D от +180 до + 210 (5% р-р левомицетина в EtOH)
[α]20D от +150 до + 200 (5% р-р левомицетина стеарата в EtOH)
[α]20D от +50 до + 80 (5% р-р левомицетина сукцината в H2О)
3. ИК по сравнению с ГСО
107
108.
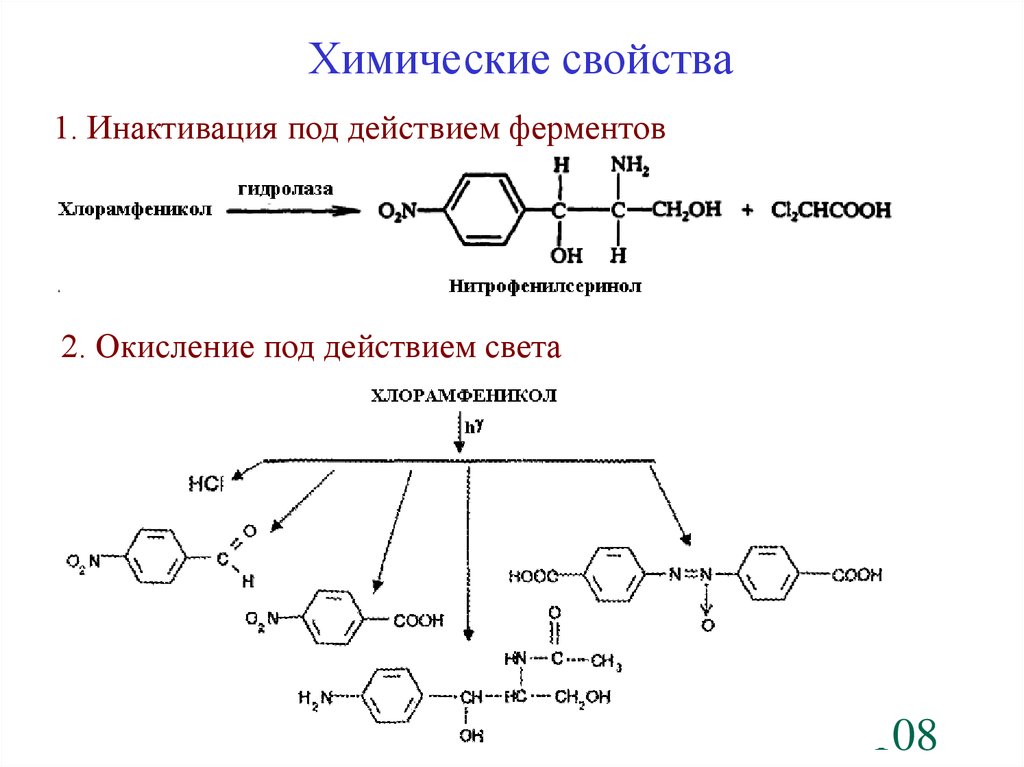
Химические свойства1. Инактивация под действием ферментов
2. Окисление под действием света
108
109.
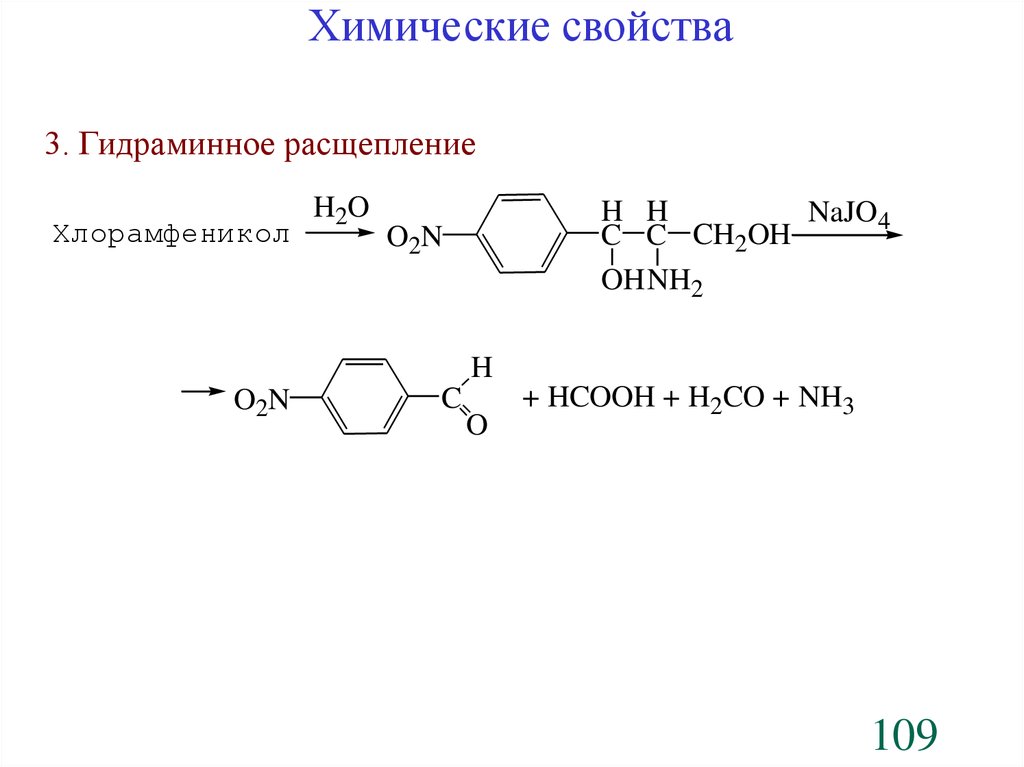
Химические свойства3. Гидраминное расщепление
Хлорамфеникол
H2 O
H H
NaJO4
C C CH2OH
OH NH2
O 2N
H
O 2N
C
O
+ HCOOH + H2CO + NH3
109
110.
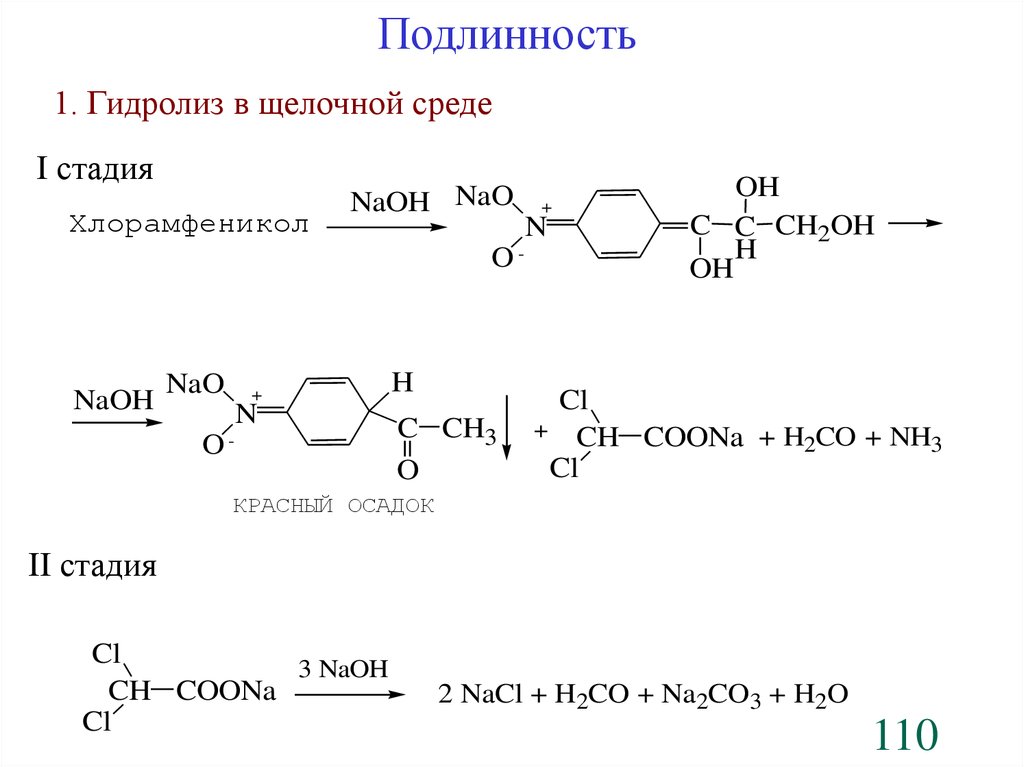
Подлинность1. Гидролиз в щелочной среде
I стадия
Хлорамфеникол
NaOH NaO
O-
NaOH
NaO
+
N
O-
H
C CH3
O
+
N
OH
C C CH2OH
H
OH
Cl
+ CH COONa + H CO + NH
2
3
Cl
КРАСНЫЙ ОСАДОК
II стадия
Cl
3 NaOH
CH COONa
Cl
2 NaCl + H2CO + Na2CO3 + H2O
110
111.
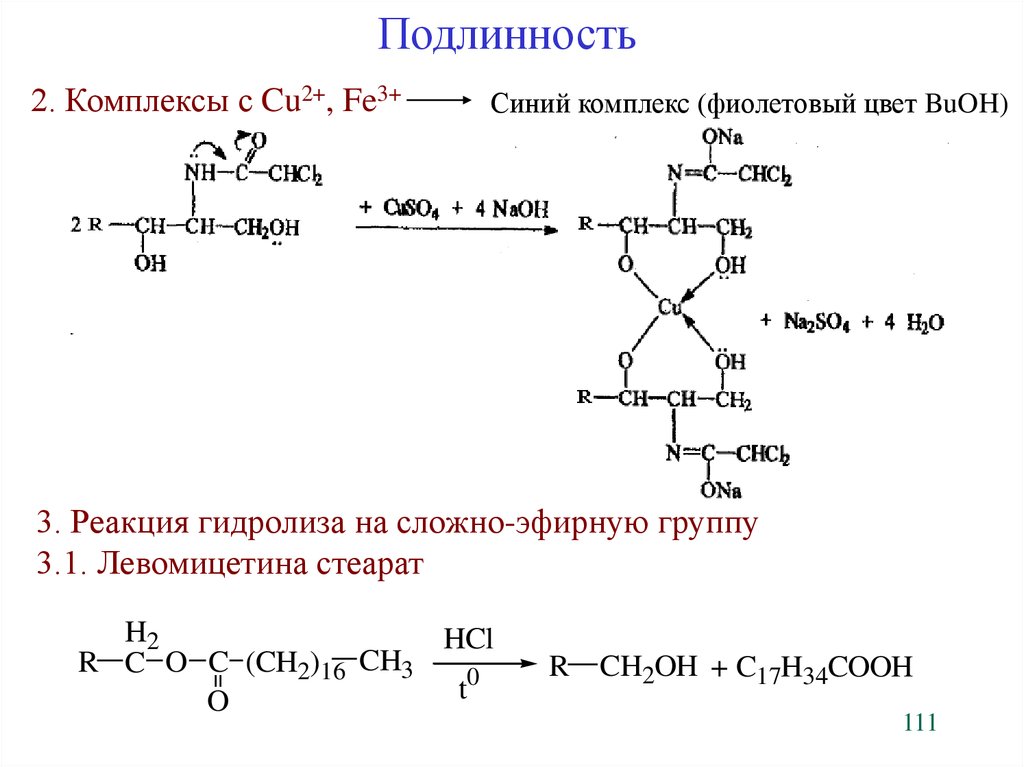
Подлинность2. Комплексы с Cu2+, Fe3+
Синий комплекс (фиолетовый цвет BuOH)
3. Реакция гидролиза на сложно-эфирную группу
3.1. Левомицетина стеарат
H2
HCl
R C O C (CH2)16 CH3
0
t
O
R
CH2OH + C17H34COOH
111
112.
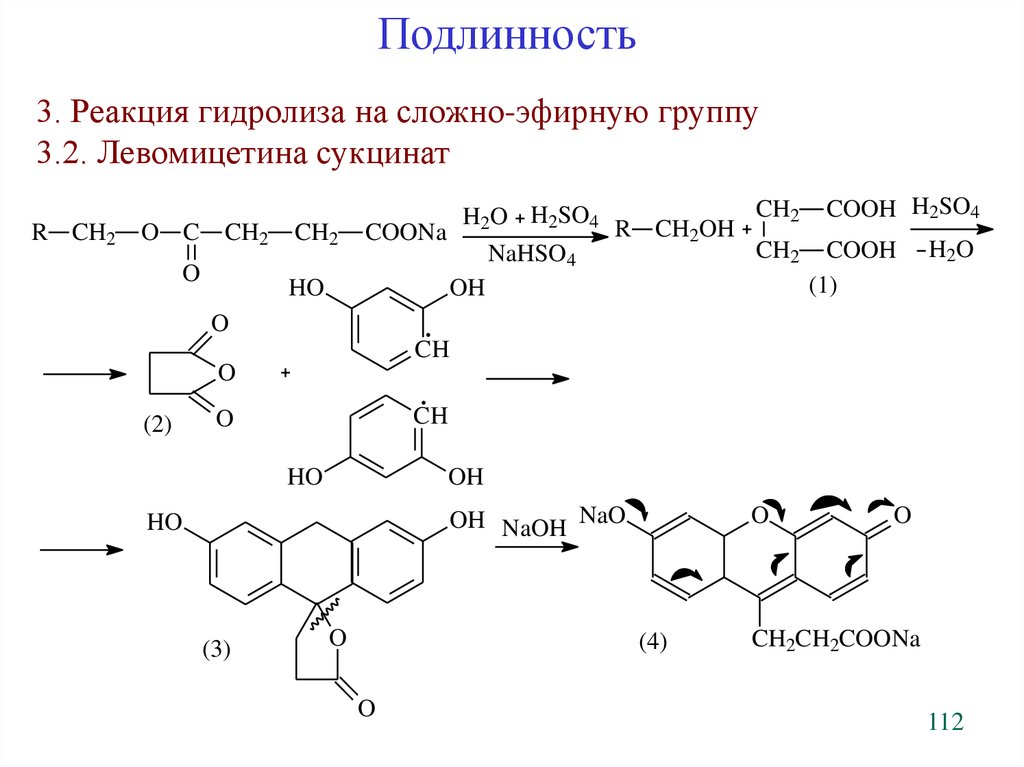
Подлинность3. Реакция гидролиза на сложно-эфирную группу
3.2. Левомицетина сукцинат
R CH2
O C
CH2
O
CH2
H2O H2SO4
COONa
NaHSO4
HO
R CH2OH
CH2
CH2
OH
COOH H2SO4
COOH
(1)
H 2O
O
CH
O
(2)
CH
O
HO
OH
OH NaOH NaO
HO
(3)
O
O
(4)
O
O
CH2CH2COONa
112
113.
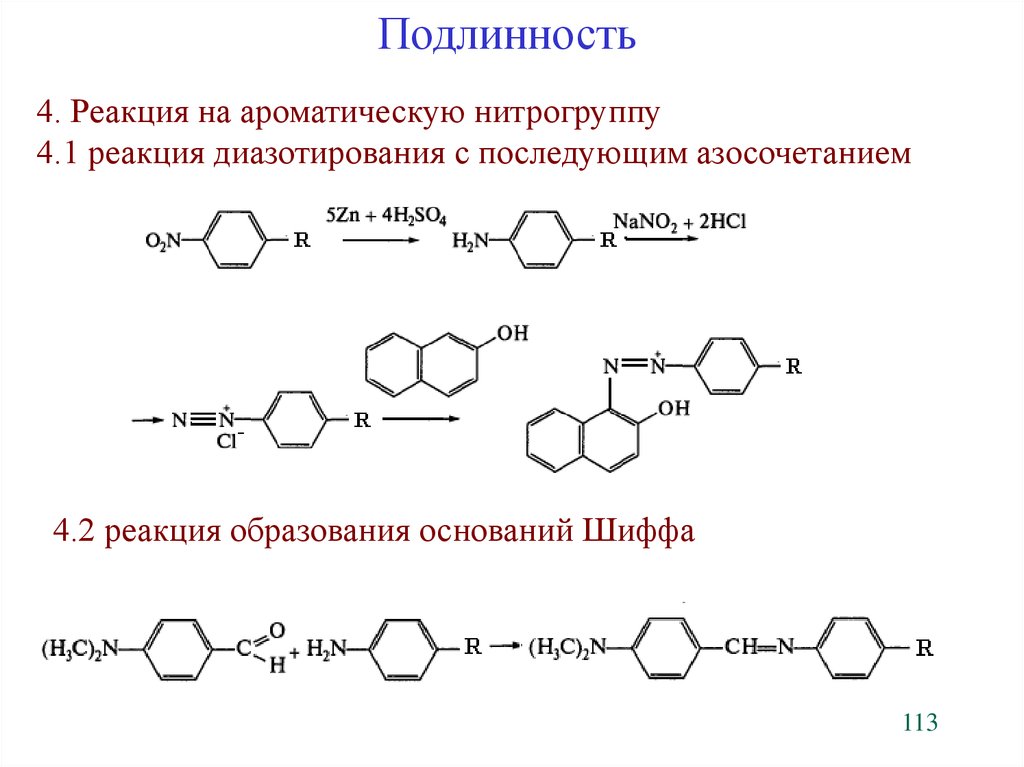
Подлинность4. Реакция на ароматическую нитрогруппу
4.1 реакция диазотирования с последующим азосочетанием
4.2 реакция образования оснований Шиффа
113
114.
Количественное определение1. Нитритометрия (после восстановления ароматической нитрогруппы)
O2N
R
Zn
N N
2 KI + 2 NaNO2 + 4 HCI
2 HCI
H2N
R CI
NaNO3 2 HCI
R
NaCI
H2O
-
I2 + 2 NaCI + 2 KCI + 2 NO + 2 H2O
2. УФ-спектроскопия (λ max =272 нм)
3. Куприметрический метод – комплекс [Лев]2Cu
3.1 Прямое титрование: тирант 0,1М р-р CuSO4 Jnd- мурексид.
Сравнивают с холостым опытом. fэкв.=2
114
115.
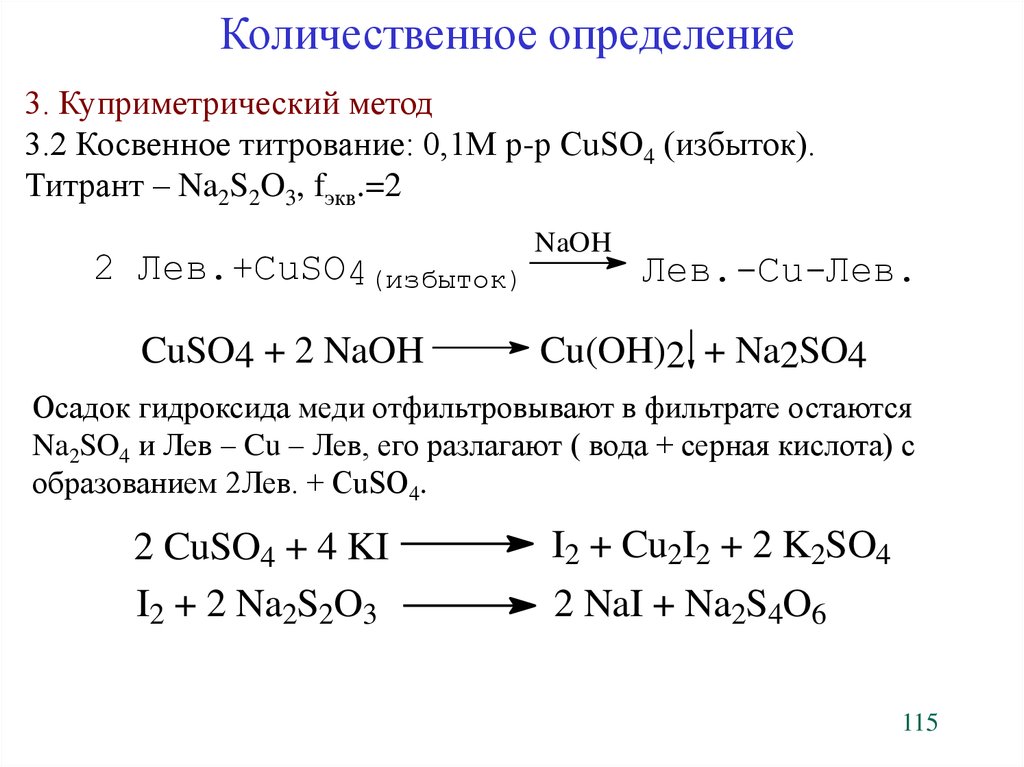
Количественное определение3. Куприметрический метод
3.2 Косвенное титрование: 0,1М р-р CuSO4 (избыток).
Титрант – Na2S2O3, fэкв.=2
2 Лев.+CuSO4(избыток)
CuSO4 + 2 NaOH
NaOH
Лев.-Cu-Лев.
Cu(OH)2 + Na2SO4
Осадок гидроксида меди отфильтровывают в фильтрате остаются
Na2SO4 и Лев – Cu – Лев, его разлагают ( вода + серная кислота) с
образованием 2Лев. + CuSO4.
2 CuSO4 + 4 KI
I2 + 2 Na2S2O3
Fýêâ.=2
I2 + Cu2I2 + 2 K2SO4
2 NaI + Na2S4O6
115











































 Химия
Химия