Похожие презентации:
Антибиотики как лекарственные вещества. Источники получения. Классификация
1.
Министерство здравоохранения УкраиныЗапорожский государственный медицинский университет
Кафедра фармацевтической химии
Антибиотики как лекарственные вещества.
Источники получения. Классификация. Общие
методы качественного и количественного
определения.
Антибиотики алициклического и
ароматического строения.
1
2.
Антибиотики – вещества продуцируемые микроорганизмами, высшимирастениями, животными тканями в процессе их жизнедеятельности и продукты
модификации этих веществ, избирательно подавляющие рост патогенных
микроорганизмов,
низших
грибов,
некоторых
вирусов
и
клетки
злокачественных образований, при этом не оказывая токсического действия на
организм человека.
Биохимические механизмы устойчивости бактерий к антибиотикам:
• Модификация мишени действия.
• Инактивация антибиотика.
• Активное выведение антибиотика из микробной клетки.
• Нарушение проницаемости внешних структур микробной клетки.
• Формирование метаболического "шунта"(ответвление).
2
3.
СПОСОБЫ ПОЛУЧЕНИЯ АНТИБИОТИКОВ:1). Микробиологический синтез на основе плесневых (Penicillum) или лучистых
(Streptomyces) грибов. Включает такие основные этапы:
•подбор высокопродуктивных штаммов продуцентов;
•подбор питательной среды;
•процесс биосинтеза (ферментации) при соблюдении специальных условий:
температурного режима, аэрации, продолжительности;
•выделение и очистка антибиотика.
2). Химический синтез.
3). Сочетание микробиологического и химического синтеза.
Единица антибиотической активности (ЕД) - минимальное количество
антибиотика, способное подавлять развитие или задерживать рост
стандартного штамма тест-организма (различные штаммы золотистого
стафилококка: Staphylococcus aureus) в определенном объеме питательной
среды. Условные единицы действия выражаются в ЕД/мл или ЕД/мг, то есть
количество ЕД содержащихся в 1 мл раствора или в 1 мг препарата.
3
4.
КЛАССИФИКАЦИЯ АНТИБИОТИКОВ1. По молекулярному механизму действия:
•нарушение синтеза клеточной оболочки (пенициллины, цциклосерин);
•мембраноактивные антибиотики (полиены, новобиоцин);
•нарушение внутриклеточного синтеза белка и функций рибосом (тетрациклины,
макролиды, хлорамфеникол, аминогликозиды и др.);
•нарушение синтеза РНК (актиномицины, антрациклины) и ДНК (брунеомицин,
рубомицин, фторхинолоны и др.).
2. По спектру действия
•влияющие
преимущественно
на
грамположительные
бактерии
(макролиды,
линкомицин, фузидин);
•влияющие преимущественно на грамотрицательные бактерии (полимиксины и др.);
•обладающие широким спектром действия (тетрациклины, хлорамфеникол,
аминогликозиды и др.);
•противогрибковые (нистатин, леворин, гризеофульвин и др.);
•активные по отношению к простейшим (трихомицин и др.);
•противоопухолевые (актиномицин, антрациклины и др.).
•противотуберкулезные (стрептомицин, рифампицин, циклосерин, канамицин и др.);
4
5.
3. Химическая классификация атибиотиков:1). Антибиотики алициклического строения
(группа
тетрациклинов
полусинтетические аналоги);
2). Антибиотики ароматического ряда (левомицетин и его эфиры);
3). Антибиотики гетероциклической структуры (β-лактамные
пенициллины, цефалоспорины и их синтетические аналоги;
4).
и
их
антибиотики:
˃ Антибиотики-гликозиды (стрептомицины);
˃ Антибиотики-аминогликозиды (канамицин, неомицин, гентамицин, мономицин);
˃ Антибиотики-макролиды (эритромицин, олеандомицин);
˃ Антибиотики-анзамицины (рифампицины и их полусинтетические аналоги);
˃ Полиеновые антибиотики с гликозидоподобной структурой (нистатин,
амфотерицин, микогептин);
5). Антибиотики противоопухолевого действия (производные ауреоловой кислоты,
производные хинолин-5,8-диона, актиномицины);
6). Антибиотики группы циклических полипептидов (грамицидины, полимиксины и
др.);
7). Антибиотики различных групп (фузафунжин).
5
6.
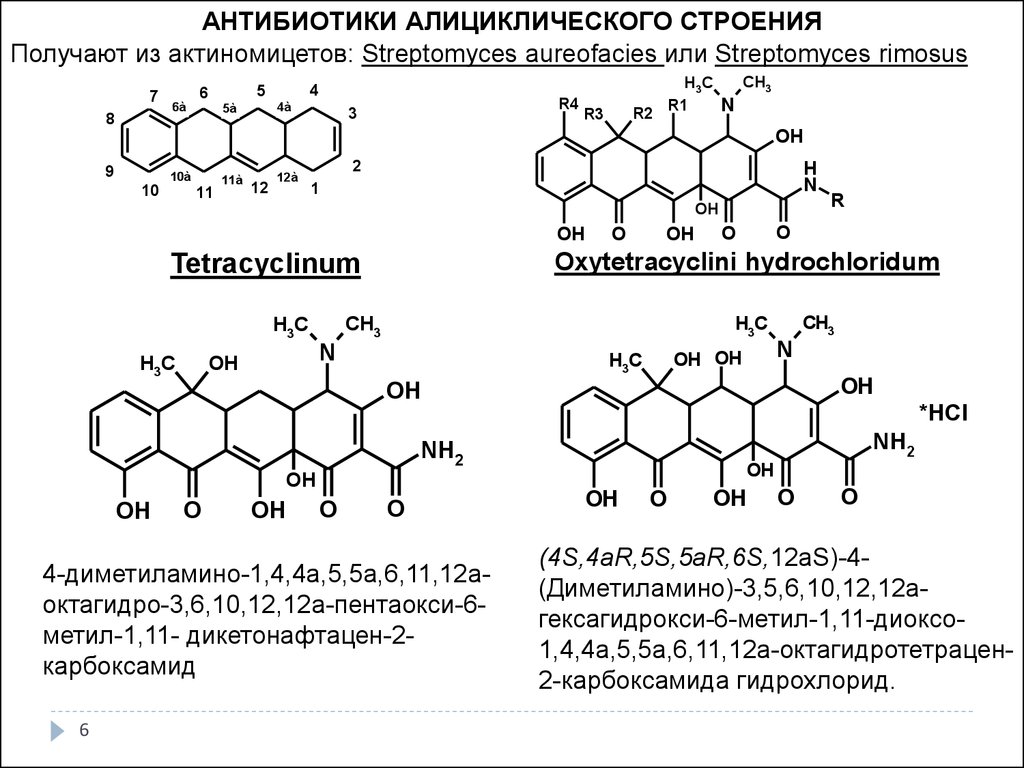
АНТИБИОТИКИ АЛИЦИКЛИЧЕСКОГО СТРОЕНИЯПолучают из актиномицетов: Streptomyces aureofacies или Streptomyces rimosus
7
8
6à
4
5
6
4à
5à
R4
3
R2
R3
CH3
H3C
R1
N
OH
9
10à
10
11
11à
12
12à
2
H
N
1
OH
OH
O
O
H3C
CH3
H3C
N
OH
OH
Oxytetracyclini hydrochloridum
Tetracyclinum
H3C
O
OH OH
H3C
N
*HCl
NH2
OH
O
OH
O
O
4-диметиламино-1,4,4а,5,5а,6,11,12аоктагидро-3,6,10,12,12а-пентаокси-6метил-1,11- дикетонафтацен-2карбоксамид
6
CH3
OH
OH
OH
R
NH2
OH
OH
O
OH
O
O
(4S,4aR,5S,5aR,6S,12аS)-4(Диметиламино)-3,5,6,10,12,12агексагидрокси-6-метил-1,11-диоксо1,4,4а,5,5а,6,11,12а-октагидротетрацен2-карбоксамида гидрохлорид.
7.
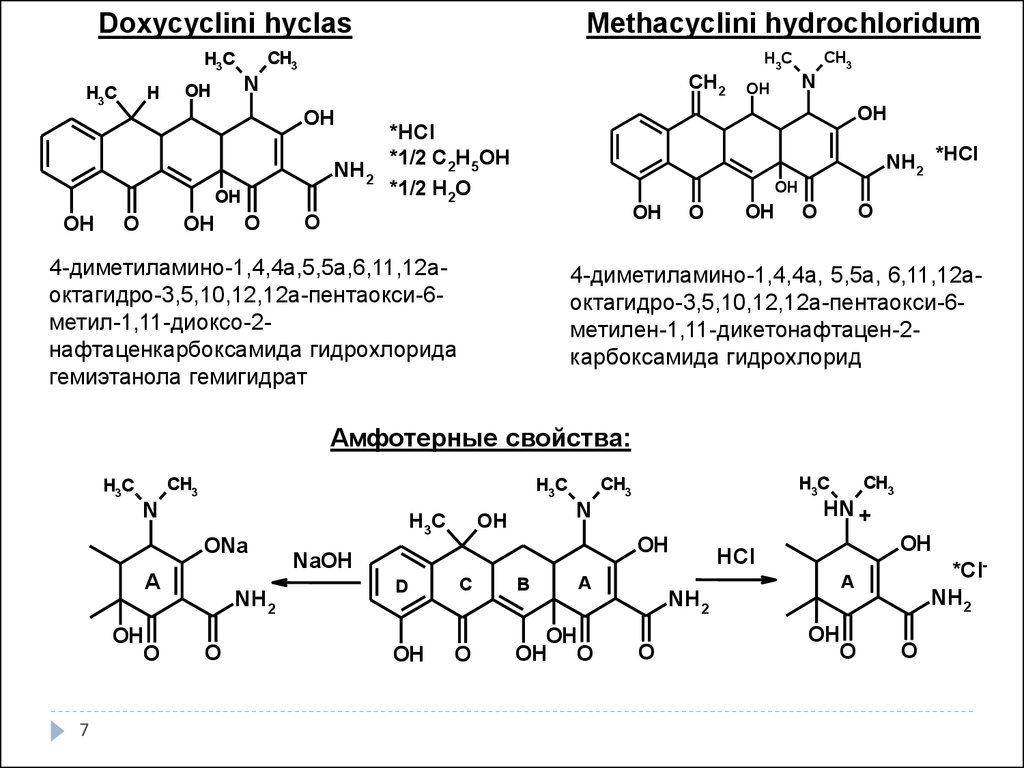
Doxycyclini hyclasH3C
H
H3C
N
OH
CH3
H3C
CH 2
OH
NH 2
OH
OH
OH
O
Methacyclini hydrochloridum
O
OH
N
CH3
OH
*HCl
*1/2 C2H5OH
*1/2 H2O
NH 2 *HCl
OH
O
OH
O
4-диметиламино-1,4,4а,5,5а,6,11,12аоктагидро-3,5,10,12,12а-пентаокси-6метил-1,11-диоксо-2нафтаценкарбоксамида гидрохлорида
гемиэтанола гемигидрат
OH
O
O
4-диметиламино-1,4,4а, 5,5а, 6,11,12аоктагидро-3,5,10,12,12а-пентаокси-6метилен-1,11-дикетонафтацен-2карбоксамида гидрохлорид
Амфотерные свойства:
H3C
N
CH3
H3C
ONa
A
OH
O
7
NH 2
O
OH
H3C
N
D
OH
HN +
OH
NaOH
A
C
B
O
OH
OH O
CH3
H3C
CH3
NH2
O
OH
HCl
*ClNH 2
A
OH
O
O
8.
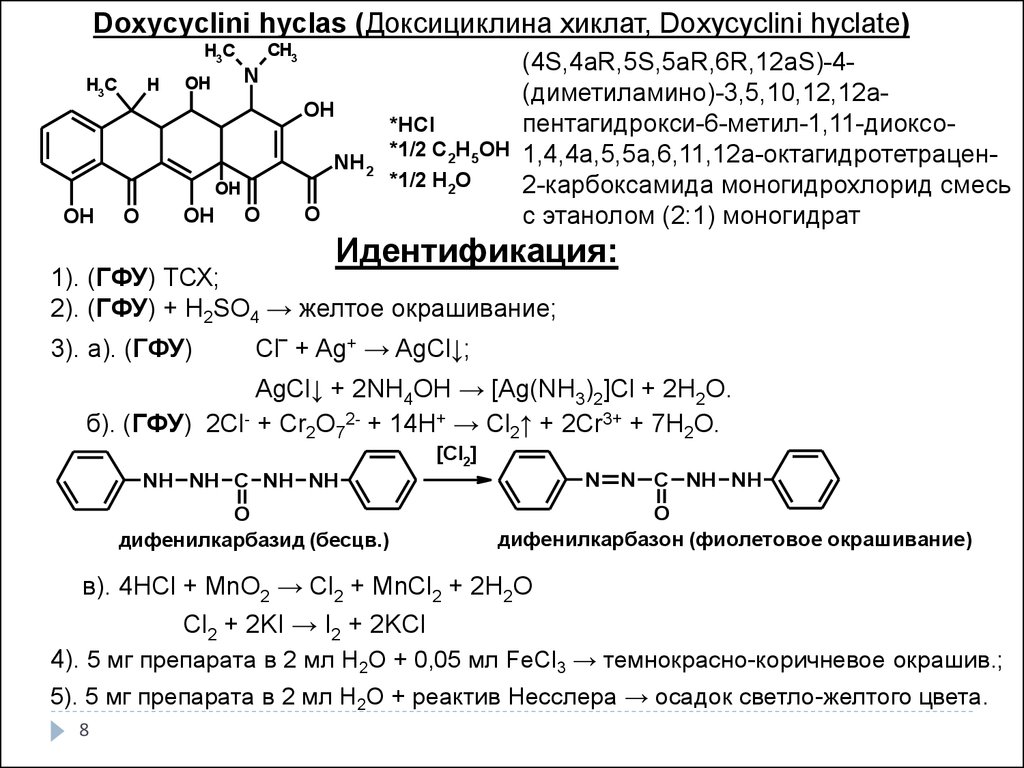
Doxycyclini hyclas (Доксициклина хиклат, Doxycyclini hyclate)H3C
H
H3C
OH
N
OH
OH
O
OH
O
CH3
(4S,4aR,5S,5aR,6R,12aS)-4(диметиламино)-3,5,10,12,12аOH
пентагидрокси-6-метил-1,11-диоксо*HCl
*1/2 C2H5OH 1,4,4а,5,5а,6,11,12а-октагидротетраценNH 2
*1/2 H2O
2-карбоксамида моногидрохлорид смесь
O
с этанолом (2:1) моногидрат
Идентификация:
1). (ГФУ) ТСХ;
2). (ГФУ) + H2SO4 → желтое окрашивание;
3). а). (ГФУ)
Cl‾ + Ag+ → AgCl↓;
AgCl↓ + 2NH4OH → [Ag(NH3)2]Cl + 2H2O.
б). (ГФУ) 2Cl- + Cr2O72- + 14H+ → Cl2↑ + 2Cr3+ + 7H2O.
[Cl2]
N
NH NH C NH NH
O
дифенилкарбазид (бесцв.)
N C NH NH
O
дифенилкарбазон (фиолетовое окрашивание)
в). 4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
Cl2 + 2KI → I2 + 2KCl
4). 5 мг препарата в 2 мл H2O + 0,05 мл FeCl3 → темнокрасно-коричневое окрашив.;
5). 5 мг препарата в 2 мл H2O + реактив Несслера → осадок светло-желтого цвета.
8
9.
Окситетрациклина гидрохлорид (Oxytetracyclini hydrochloridum)H3C
OH OH
H3C
N
CH3
OH
*HCl
NH2
OH
OH
O
OH
O
(4S,4aR,5S,5aR,6S,12аS)-4(Диметиламино)-3,5,6,10,12,12агексагидрокси-6-метил-1,11-диоксо1,4,4а,5,5а,6,11,12а-октагидротетрацен2-карбоксамида гидрохлорид.
O
Идентификация:
1). (ГФУ) ТСХ;
2). (ГФУ) + H2SO4 → красное окрашивание → желтое окрашивание при
растворении водой;
3). (ГФУ) Реакции на Cl-;
4). + FeCl3 → коричневое окрашивание.
9
10.
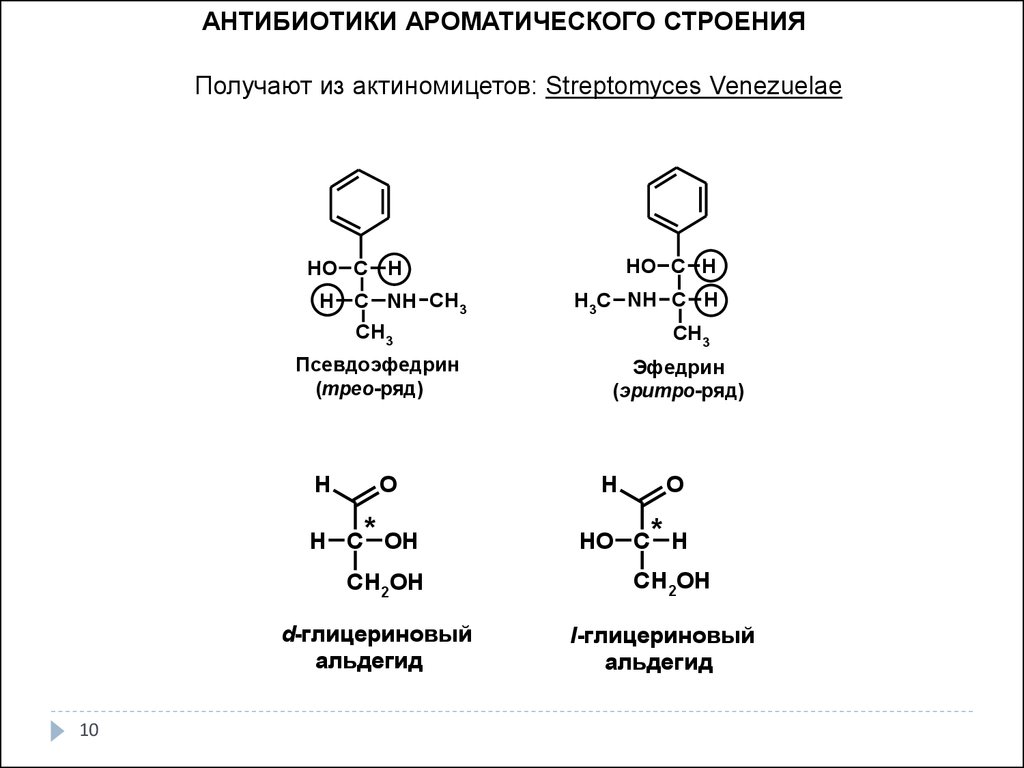
АНТИБИОТИКИ АРОМАТИЧЕСКОГО СТРОЕНИЯПолучают из актиномицетов: Streptomyces Venezuelae
HO C H
HO C H
H
C NH CH 3
H 3C NH C H
CH 3
Псевдоэфедрин
(трео-ряд)
H
O
H C * OH
CH 2OH
d-глицериновый
альдегид
10
CH 3
Эфедрин
(эритро-ряд)
H
O
HO C * H
CH 2OH
l-глицериновый
альдегид
11.
NO2NO2
HO C H
O
H C NH C CHCl2
D-трео-изомер
H C
OH
N
H
H
C
CH 2OH
L-трео-изомер
11
H C
NH
C CHCl2
D-эритро-изомер
NO2
NO2
CHCl2 C
OH O
CH 2OH
CH 2OH
O
H C
O HO C H
CHCl2 C HN C
H
CH 2OH
L-эритро-изомер
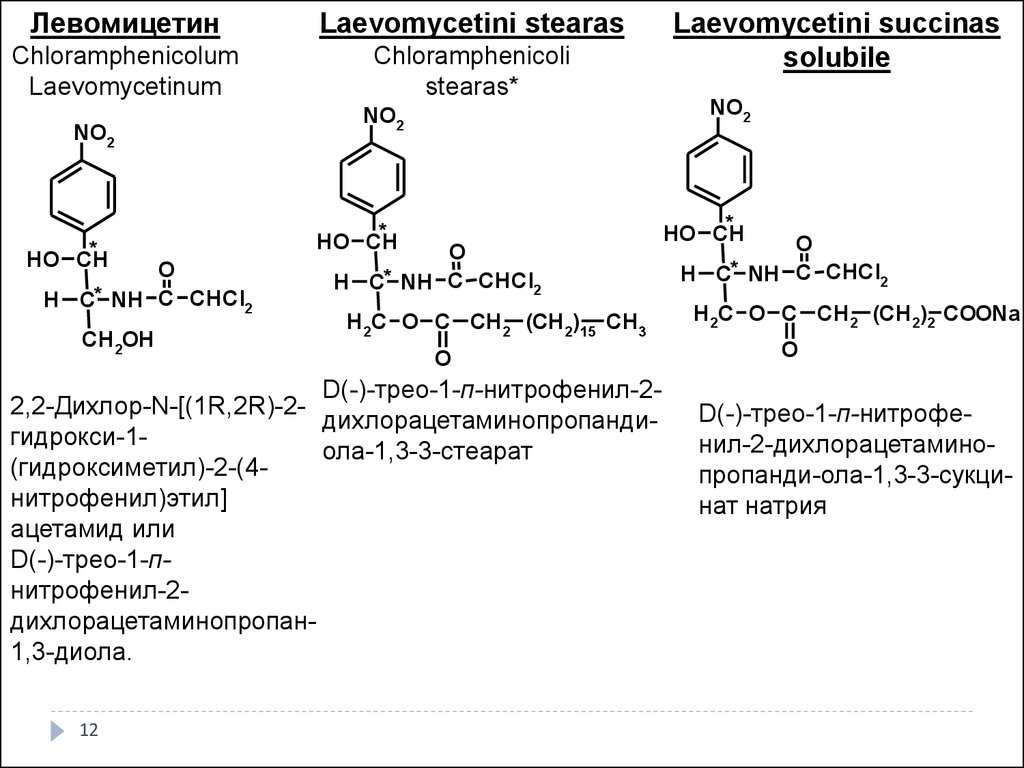
12.
ЛевомицетинLaevomycetini stearas
Сhloramphenicolum
Laevomycetinum
Сhloramphenicoli
stearas*
NO2
*
HO CH
O
H C* NH C CHCl2
CH 2OH
NO2
NO2
*
HO CH
*
HO CH
O
H C* NH C CHCl2
H 2C O C CH 2 (CH 2)15 CH 3
O
D(-)-трео-1-п-нитрофенил-22,2-Дихлор-N-[(1R,2R)-2дихлорацетаминопропандигидрокси-1ола-1,3-3-стеарат
(гидроксиметил)-2-(4нитрофенил)этил]
ацетамид или
D(-)-трео-1-пнитрофенил-2дихлорацетаминопропан1,3-диола.
12
Laevomycetini succinas
solubile
O
H C* NH C CHCl2
H 2C O C CH 2 (CH 2)2 COONa
O
D(-)-трео-1-п-нитрофенил-2-дихлорацетаминопропанди-ола-1,3-3-сукцинат натрия
13.
Сhloramphenicoli palmitas*NO2
*
H O CH
O
H C* NH C CHCl2
H 2C O C (CH 2)14 CH 3
O
13
D(-)-трео-2,2-дихлор-N-[(3-гидрокси-α(гидроксиметил)-п-нитрофенил] ацетамида αпальмитат
или
D(-)-трео-1-п-нитрофенил-2дихлорацетаминопропандиола-1,3-3-пальмитат.
14.
Левомицетин (Laevomycetinum, Хлорамфеникол, Сhloramphenicolum, )NO2
*
HO CH
O
H C* NH C CHCl2
CH 2OH
14
2,2-Дихлор-N-[(1R,2R)-2-гидрокси-1-(гидроксиметил)-2-(4нитрофенил)этил] ацетамид
или
D(-)-трео-1-п-нитрофенил-2-дихлорацетаминопропан-1,3диола.
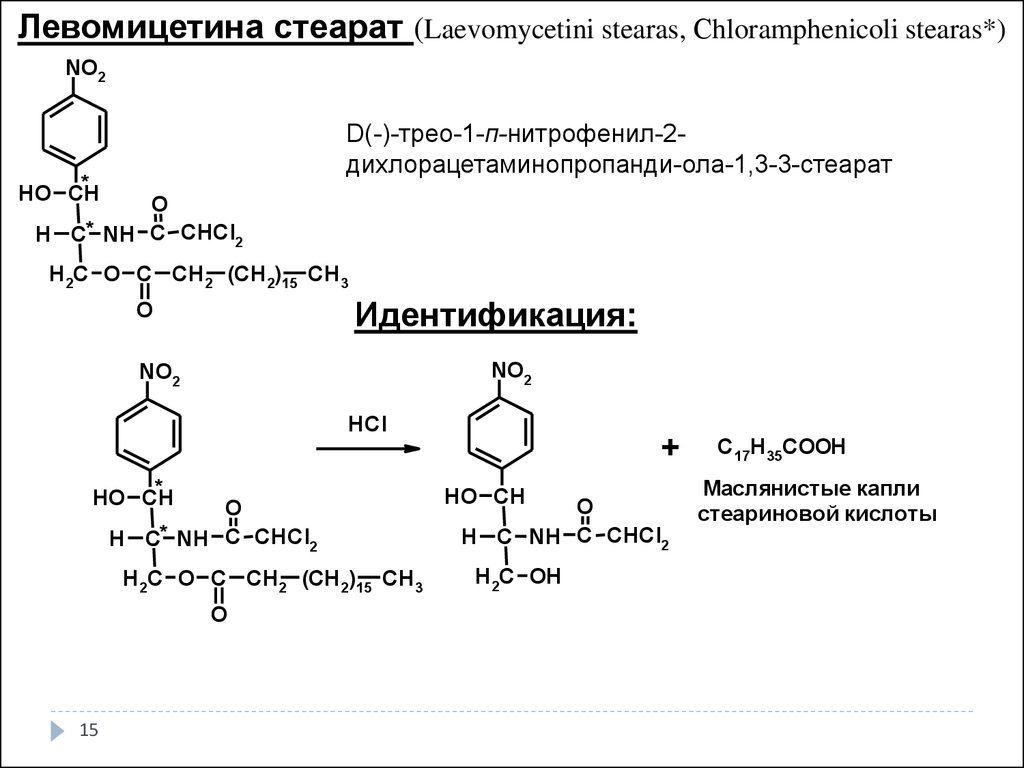
15.
Левомицетина стеарат (Laevomycetini stearas, Сhloramphenicoli stearas*)NO2
D(-)-трео-1-п-нитрофенил-2дихлорацетаминопропанди-ола-1,3-3-стеарат
*
HO CH
O
H C* NH C CHCl2
H 2C O C CH 2 (CH 2)15 CH 3
Идентификация:
O
NO2
NO2
HCl
*
HO CH
O
H C* NH C CHCl2
H 2C O C CH 2 (CH 2)15 CH 3
O
15
+
HO CH
O
H C NH C CHCl2
H 2C OH
C17H35COOH
Маслянистые капли
стеариновой кислоты
16.
Левомицетина пальмитат (Сhloramphenicoli palmitas*)NO2
D(-)-трео-2,2-дихлор-N-[(3-гидрокси-α-(гидроксиметил)п-нитрофенил] ацетамида α-пальмитат
или
*
H O CH
O
H C* NH C CHCl2
H 2C O C (CH 2)14 CH 3
O
16
D(-)-трео-1-п-нитрофенил-2дихлорацетаминопропандиола-1,3-3-пальмитат.
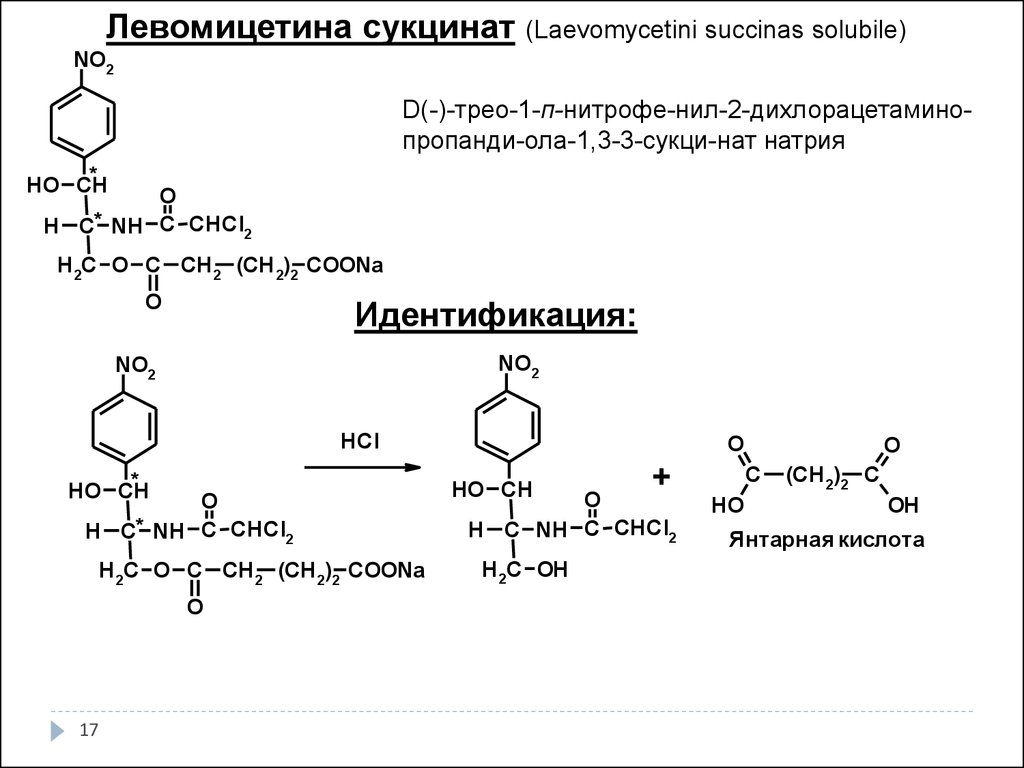
17.
Левомицетина сукцинат (Laevomycetini succinas solubile)NO2
D(-)-трео-1-п-нитрофе-нил-2-дихлорацетаминопропанди-ола-1,3-3-сукци-нат натрия
*
HO CH
O
H C* NH C CHCl2
H 2C O C CH 2 (CH 2)2 COONa
O
Идентификация:
NO2
NO2
HCl
*
HO CH
O
H C* NH C CHCl2
H 2C O C CH 2 (CH 2)2 COONa
O
17
O
HO CH
+
O
H C NH C CHCl2
H 2C OH
O
C
HO
(CH 2)2 C
OH
Янтарная кислота










 Химия
Химия