Похожие презентации:
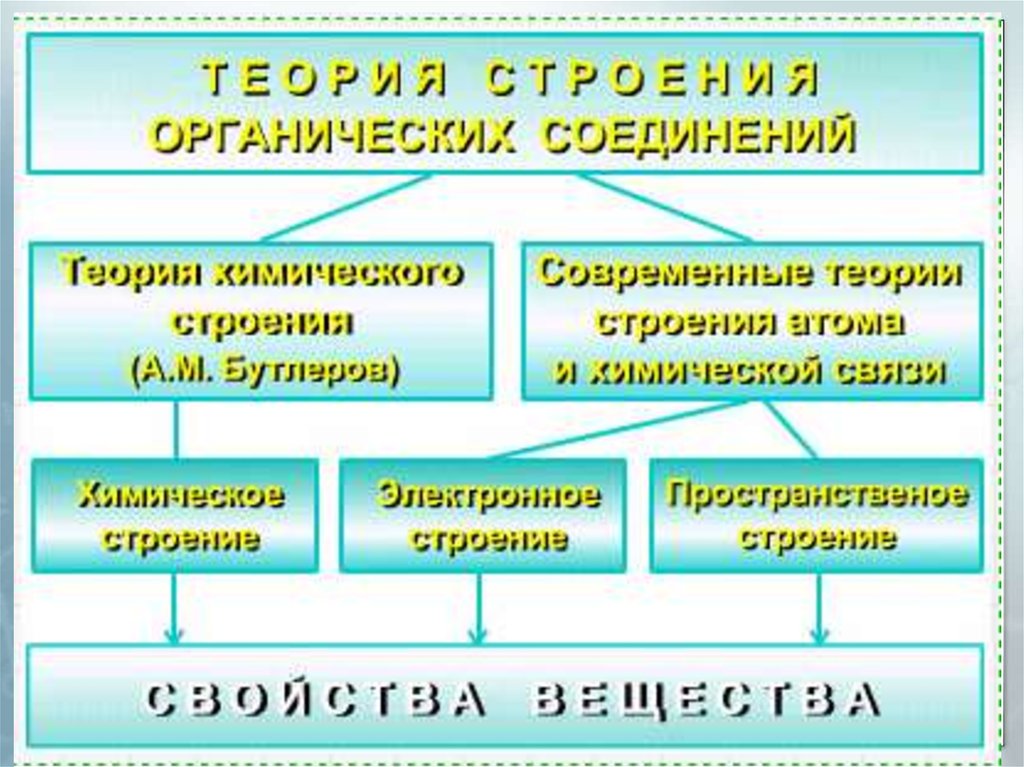
Теория строения органических соединений
1. Основы органической химии
E-mail: irkrav66@gmail.comОсновы
органической
химии
Семинар-3. Теория
строения органических
соединений
лектор:
проф. Рохин Александр
Валерьевич
2.
227.07.2017
3. Строение атома
Свойства химических соединений зависят отприроды и строения атомов, входящих в их состав
3
27.07.2017
4. Свойства электрона
Часть пространства, в котором вероятностьнахождения максимальна, называют орбиталью
или электронным облаком
27.07.2017
4
5.
Атомная орбиталь (АО) – областьнаиболее вероятного пребывания
электрона в электрическом поле ядра
атома
5
27.07.2017
6. Форма и энергия АО
Первый уровень – 1s,второй – 2s
6
27.07.2017
7. Форма и энергия АО
Второй уровень – 2s,2px,2py, 2pz
7
27.07.2017
8. Заполнение атомных орбиталей электронами
Принцип устойчивости.АО заполняются электронами в
порядке повышения их
энергетических уровней:
1s < 2s < 2p < 3s < 3p < 4s < 3d …
9. Принцип устойчивости
927.07.2017
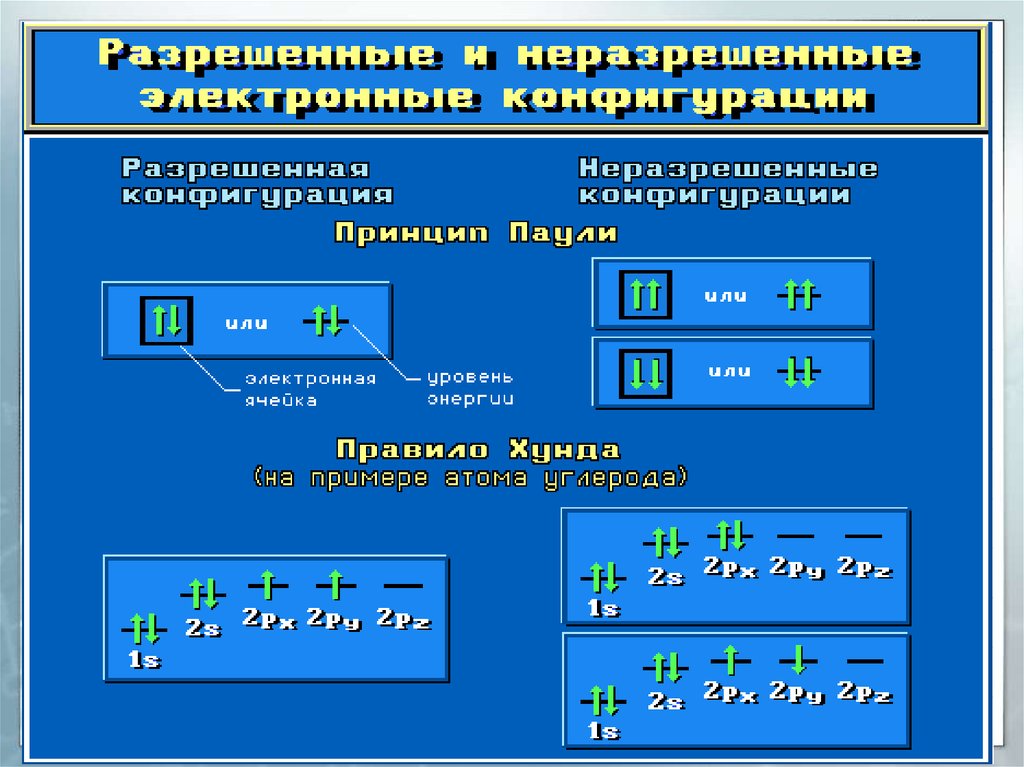
10. Заполнение атомных орбиталей электронами
Принцип Паули.На одной АО могут находиться
не более двух электронов с
противоположными спинами.
11. Заполнение атомных орбиталей электронами
Правило Хунда.На АО с одинаковой энергией,
так
называемых
вырожденных
орбиталях, электроны стремятся
расположиться
по
одному
с
параллельными спинами.
12.
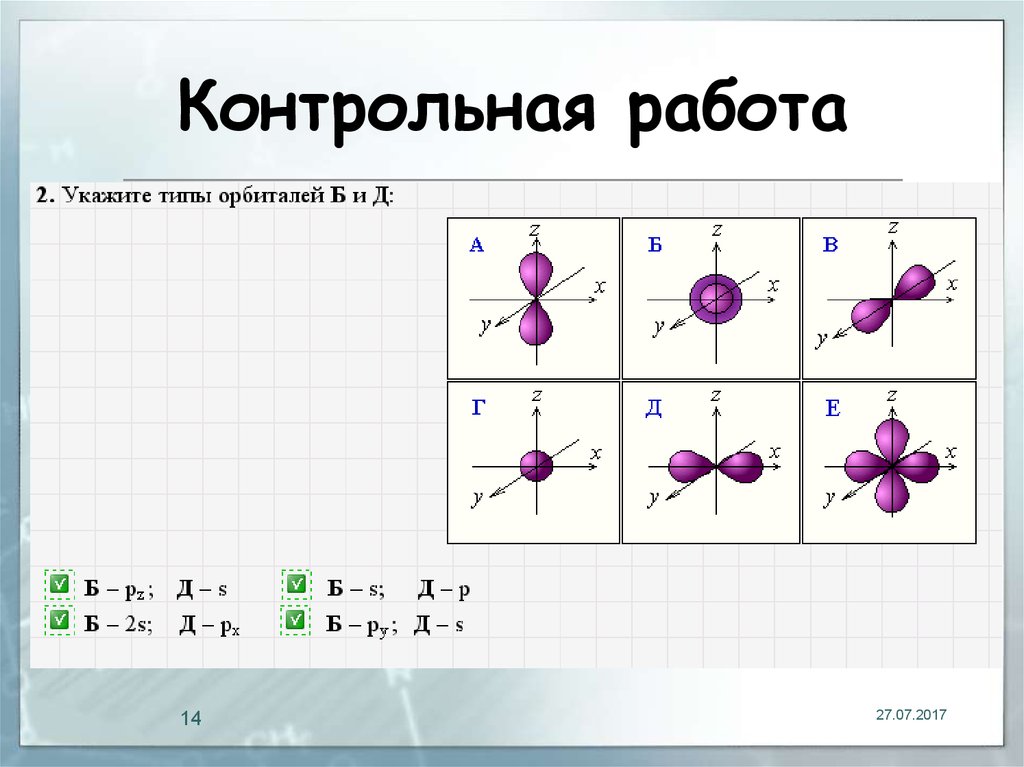
13. Контрольная работа
1327.07.2017
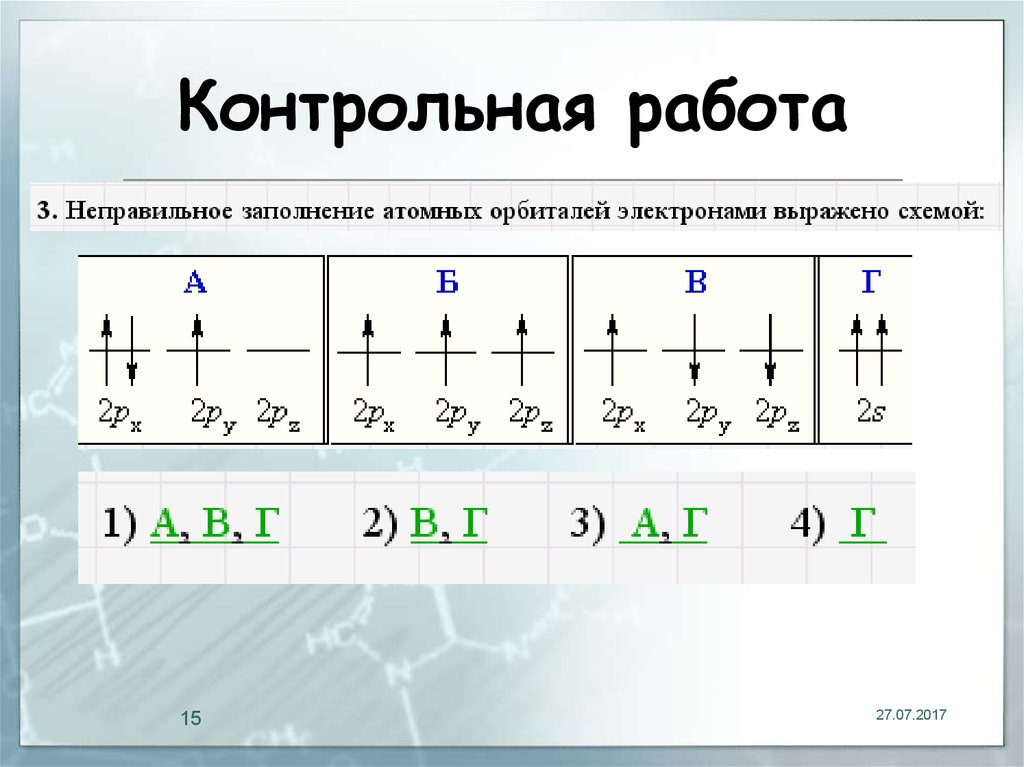
14. Контрольная работа
1427.07.2017
15. Контрольная работа
1527.07.2017
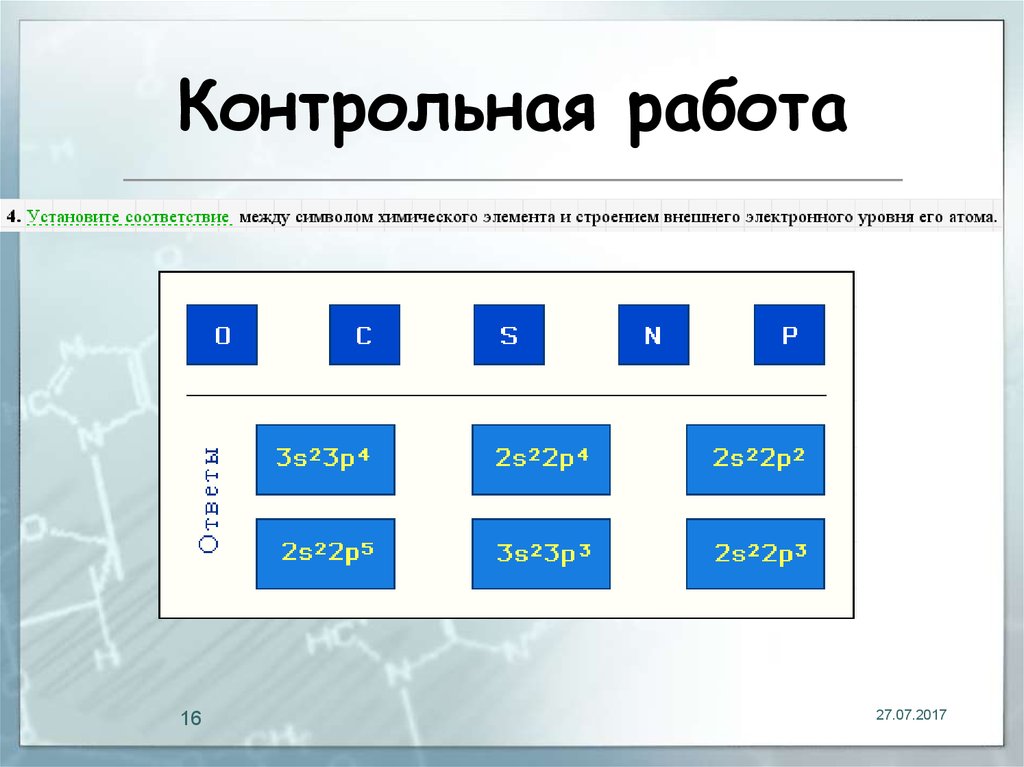
16. Контрольная работа
1627.07.2017
17. Контрольная работа
1727.07.2017
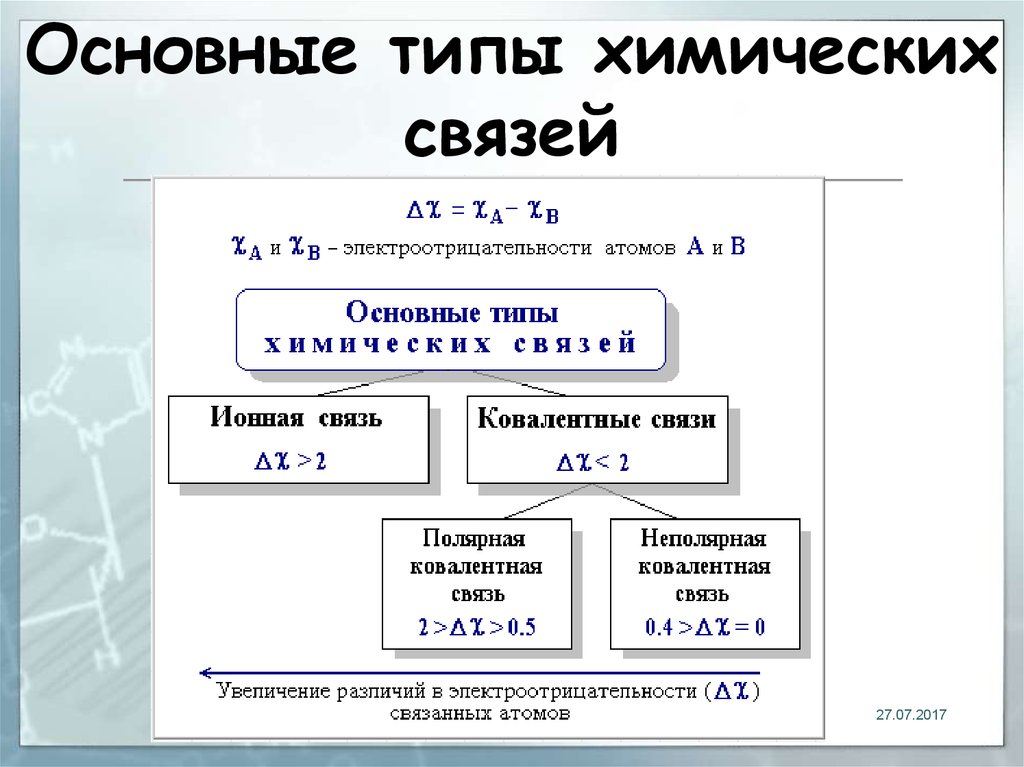
18. Основные типы химических связей
1827.07.2017
19. Ионная связь
химическая связь, основаннаяна электростатическом
притяжении ионов
В органических соединениях встречается
редко, например, в органических солях:
RCOO-Na+
19
27.07.2017
20. Электроотрицательность
Способность атома удерживатьвнешние валентные электроны
Подчиняется периодическому закону:
растет слева направо в периодах и
снизу вверх в главных подгруппах в
таблице Д.И. Менделеева
20
27.07.2017
21. Ковалентная связь
Связь, образованная путёмобобществления пары
электронов связываемых атомов
21
27.07.2017
22. Свойства ковалентной связи
Направленность
Насыщаемость
Полярность
Поляризуемость
22
27.07.2017
23. Направленность
Молекулярное строениеорганических молекул имеет
геометрическую форму.
Количественной мерой
направленности является угол
между двумя связями
(валентный угол)
23
27.07.2017
24. Насыщаемость
Способность атомовобразовывать ограниченное
число ковалентных связей.
Количество связей
определяется числом внешних
атомных орбиталей атома.
24
27.07.2017
25. Полярность
Обусловлена неравномернымраспределением электронной
плотности вследствии
различной электроотрицательности атомов по
шкале Л.Полинга:
25
27.07.2017
26. Полярность
Ковалентные связи делятся наполярные и неполярные.
Неполярные связи между двумя
одинаковыми атомами:
Н—Н, С—С.
26
27.07.2017
27. Полярность
Полярные связи между двумяатомами с разной
электроотрицательностью:
Н—F, С—Сl.
27
27.07.2017
28. Поляризуемость
Смещение электронов подвоздействием внешнего
электрического поля другой
частицы.
28
27.07.2017
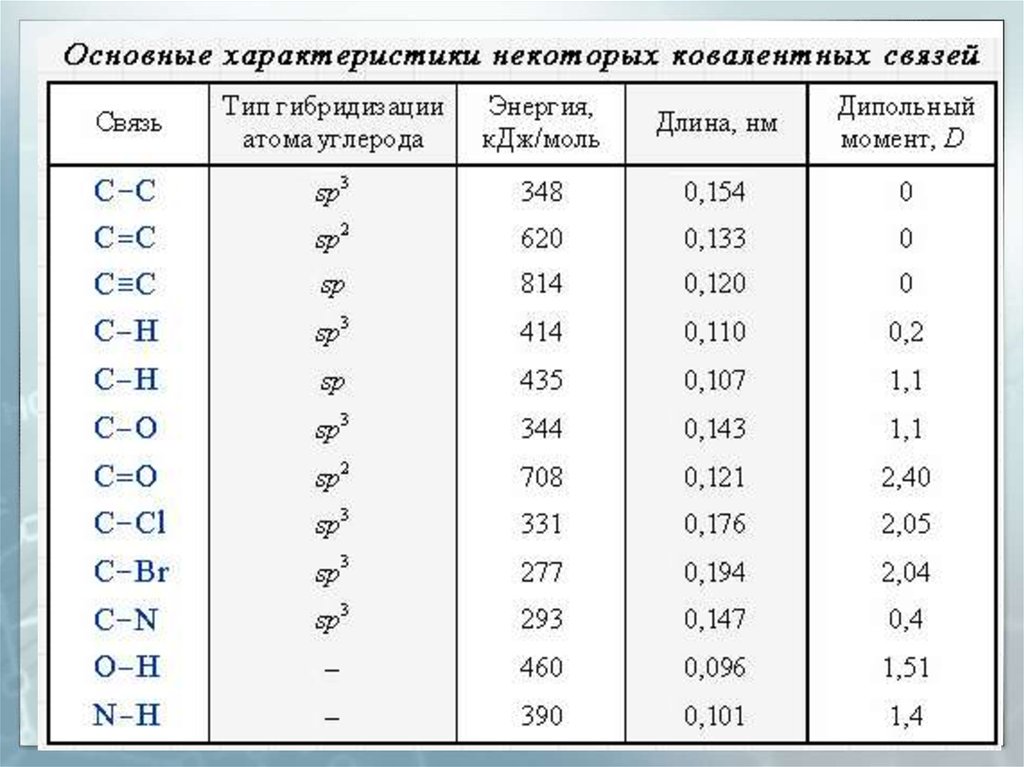
29. Длина связи
Расстояние между центрамидвух связанных атомов.
На характеристики связей
влияет их кратность
29
27.07.2017
30. Энергия связи
Энергия, выделяемая приобразовании связи или
необходимая для разъединения
двух связанных атомов
30
27.07.2017
31. Дипольный момент (μ или D)
Величина, характеризующаяполярность связи:
l – длина связи
q – эффективный заряд
31
27.07.2017
32.
3227.07.2017
33. Контрольная работа
3327.07.2017
34. Контрольная работа
3427.07.2017
35. Контрольная работа
3527.07.2017
36. Контрольная работа
3627.07.2017
37. Контрольная работа
3727.07.2017
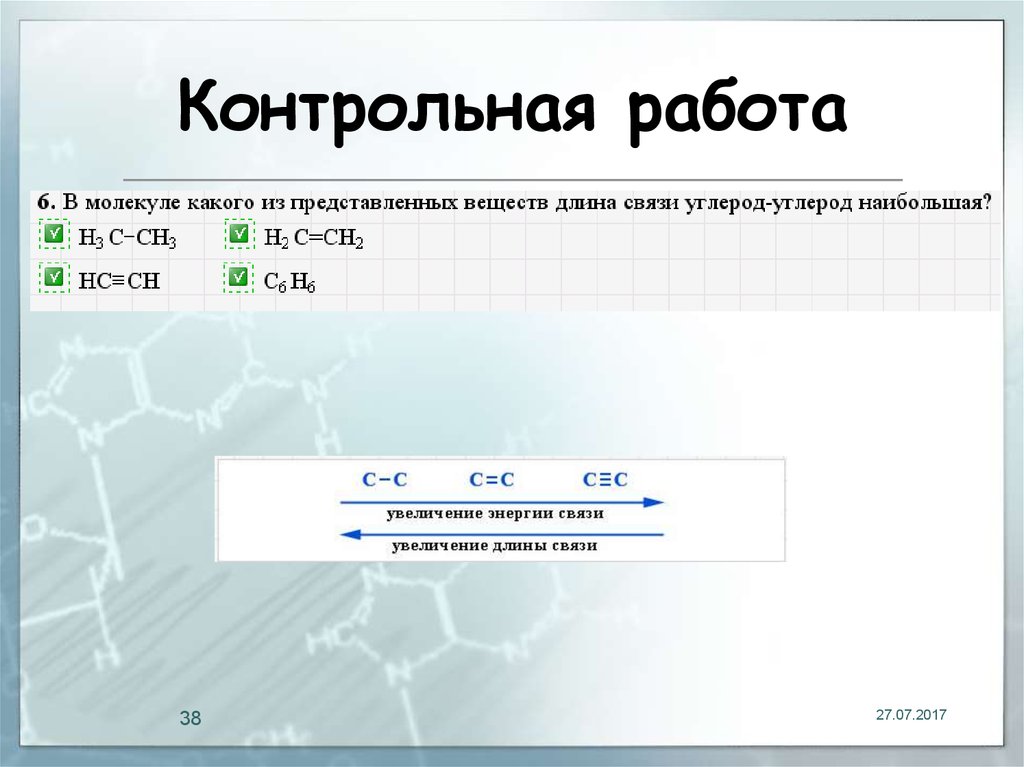
38. Контрольная работа
3827.07.2017






























 Химия
Химия








