Похожие презентации:
Взаимное влияние атомов в молекулах
1.
Кафедра биологической химии с курсами медицинской,фармакологической и токсикологической химии
Тема: Взаимное влияние
атомов в молекулах
Лекция №5 для студентов 1 курса,
обучающихся по специальности
060101-Лечебное дело
Лектор: к.б.н. доцент
Оловянникова Раиса Яковлевна
Красноярск, 2011
1
2.
Кафедра биологической химии с курсами медицинской,фармакологической и токсикологической химии
Тема: Взаимное влияние
атомов в молекулах
Лекция №5 для студентов 1 курса,
обучающихся по специальности
060103-Педиатрия
Лектор: к.б.н. доцент
Оловянникова Раиса Яковлевна
Красноярск, 2011
2
3. Цель лекции
• На основе строения атомов и химическихсвязей сформировать знания о их
взаимном влиянии, направленном на
термодинамическую устойчивость систем
или наоборот, на появление реакционных
центров в молекулах и ионах.
• Рассмотреть все другие факторы,
определяющие реакционную способность
3
4. План лекции
1. Актуальность темы2. Сопряжение и ароматичность как основа
для понимания термодинамически
устойчивости систем
3. Электронные эффекты заместителей в
углеродных цепях
4. Факторы, определяющие реакционную
способность органических соединений
5. Выводы
4
5. Актуальность темы
• Взаимное влияние атомов в молекулахвыражается в эффектах сопряжения и
электронных эффектах.
• Сопряженные системы с открытой и
замкнутой цепью сопряжения широко
распространены в природе и среди
фармакологически активных веществ
5
6. Актуальность темы
• Свои функции они выполняютнепосредственно через реакционные центры
либо самих заместителей и гетероатомов в
циклах, либо под их влиянием.
• Поэтому знание понятий «сопряжение»,
«ароматичность», «электронные эффекты
заместителей» будет использоваться для
нахождения реакционных центров молекул и
прогнозирования их химического поведения.
6
7. Сопряженные системы с открытой цепью.
• Если две двойные связи разделены одинарнойили рядом с двойной связью находится атом с
несвязывающей р-АО (занятой одним
электроном, двумя или вакантной), то между
двумя р-АО , не вступившими в
локализованную π-связь, возникает
дополнительное взаимодействие, которое и
называется сопряжением.
7
8.
∙∙
∙
Образуется единая
четырехцентровая π-МО
с делокализованной электронной
плотностью.
Делокализация электронной
плотности приводит к снижению
энергии системы.
∙
π-π-сопряжение
бутадиен
∙∙
N
виниламин
∙
N
∙
∙∙
N
π-р-сопряжение
Образуется единая трёххцентровая
π-МО с делокализованной
электронной плотностью.
Причем, четыре π-электрона
приходится на три атома.
При этом на атомах углерода
электронная плотность повышается,
а на атоме азота –понижается, что
отражается на свойствах
соответствующих реакционных
центров.
Принцип образования сопряженной системы π-π и р-π - типов.
8
9.
1515ꞌ
β-каротин
СН2ОН
Ретинол
9
10. Сопряженные системы с замкнутой цепью.
• Среди таких систем наиболее важноезначение имеют ароматические системы.
• Ароматичность – это частный случай
сопряжения.
• Ароматичность возникает тогда, когда цепь
сопряжения замкнута и число электронов,
участвующих в сопряжении, подчиняется
правилу Хюккеля: оно равно 4n + 2 , где n –
любое целое число, в том числе и нуль.
10
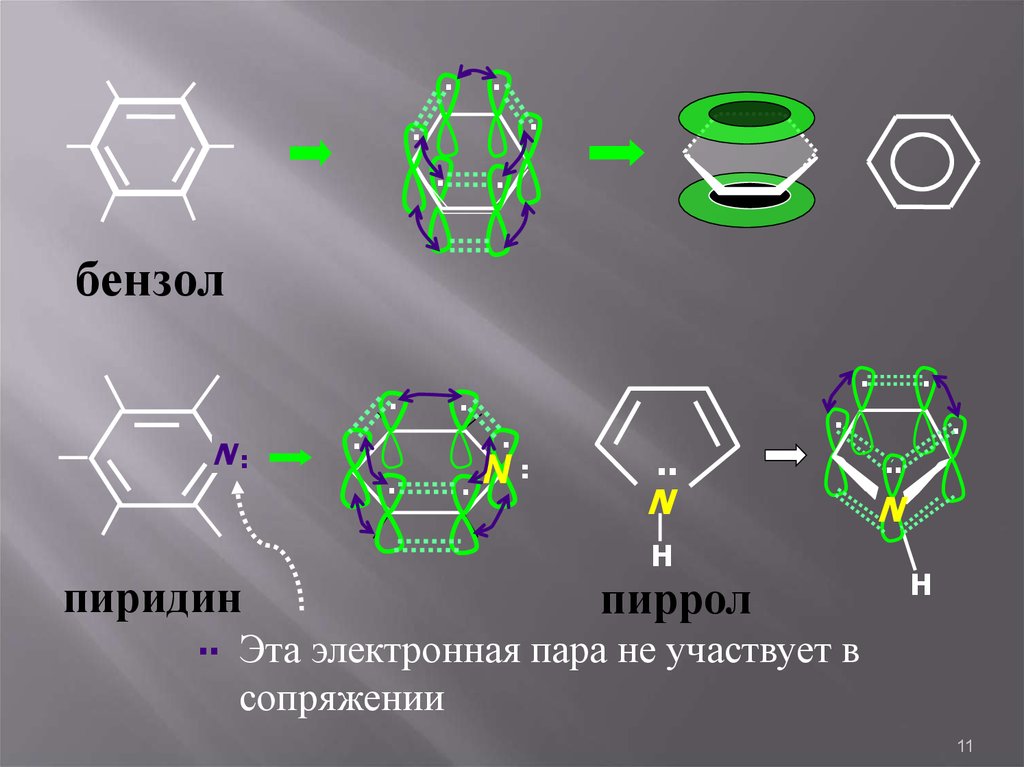
11.
∙∙
∙
∙
∙
∙
бензол
∙
∙
∙
∙
пиридин
∙
N
∙
∙∙
∙∙
N
∙
∙
∙
∙∙
N
Н
пиррол
∙
∙∙
N
Н
Эта электронная пара не участвует в
сопряжении
11
∙∙
12.
∙∙
∙
∙∙
тиофен
S
∙∙
∙∙
S
∙∙
∙
∙∙
О
∙∙
Циклопентадиен
фуран ильный анион
Все эти пятичленные гетероциклы имеют
замкнутую пятицентровую π -МО, на
которой содержится 6 электронов.
Другими словами, их структура
удовлетворяет критериям ароматичности
12
13. Электронные эффекты
• В зависимости от того, какпередается полярное влияние
заместителя по цепи ковалентно
связанных атомов,
различают индуктивный (I ) и
мезомерный (М ) эффекты.
13
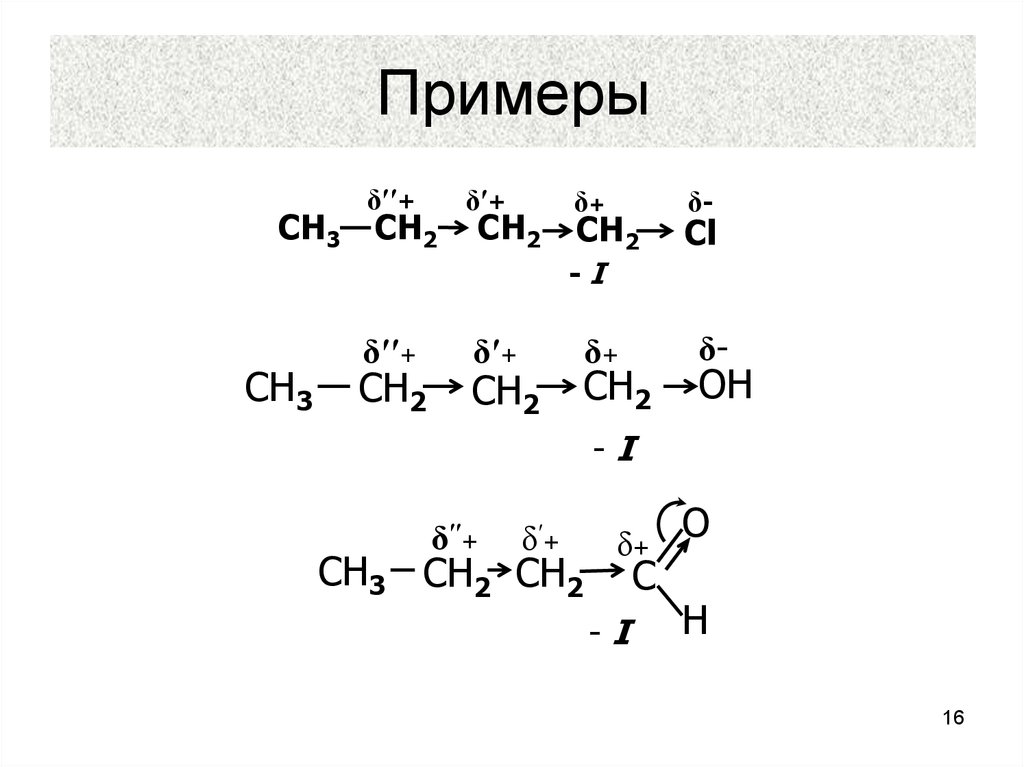
14. Индуктивный эффект
– это передача полярного влияниязаместителя по σ-связям в любой
цепи. Например, в молекуле
бутилхлорида
δ′′+
СН3 СН2
δ′+
СН2
δ+
СН2
δ-
Сl
-I
δ′′+
<
δ′+
<
δ+
14
15. Отрицательный индуктивный эффект (-I)
• -I эффект вызывают любыезаместители, содержащие атомы с
большей электроотрицательностью,
чем у атома углерода:
галогены (F, Cl, Br, I), OH- и ОRгруппы, NH2-, NHR- и NR2-группы,
оксо-группа, карбоксильная группа,
нитрогруппа и многие другие.
15
16. Примеры
δ′′+СН3 СН2
δ′+
СН2
δ+
СН2
δ-
Сl
-I
СН3
δ′′+
СН2
δ′+
СН2
δ+
СН2
δ-
ОН
-I
δ′′+
δ′+
СН3 СН2 СН2
δ+
С
-I
О
Н
16
17. Положительный индуктивный эффект (+I)
• +I эффектом обладают: алкильные R-группы,связанные с sp2 и sp-гибридизованными атомами
углерода, алкоксид-анион, оксид-анионные
центры, атомы металлов.
δ+
δCH2 = CH ← CH3
СН3
+I
δ′′-
δ′-
δ-
δ′′-
СН2
δ′-
СН2
δ-
СН2
−
О
+I
δ+
CH3 – CH2 ← CH2 ← CH2 ← MgBr
+I
17
18. Мезомерный эффект
• – это передача полярноговлияния атома или группы атомов
по π -связям в сопряженной
системе. Причем, атом,
передающий эффект должен сам
участвовать в сопряжении.
18
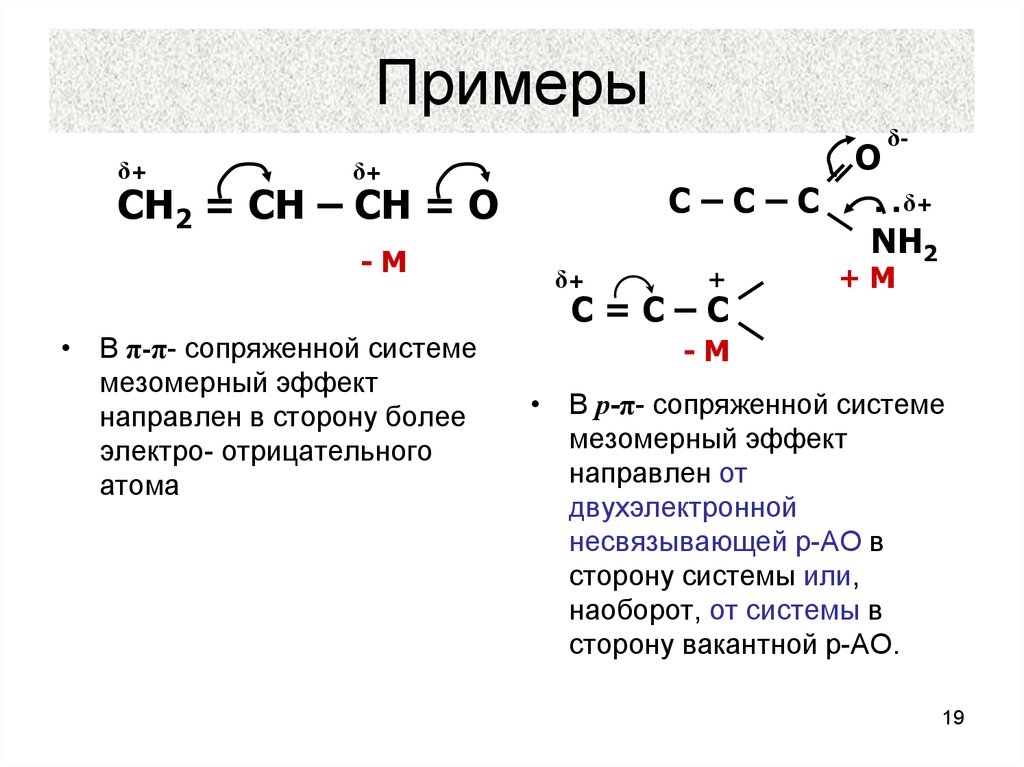
19. Примеры
δ+O
δ+
C–C–C
CH2 = CH – CH = O
-M
δ+
+
C=C–C
• В π-π- сопряженной системе
мезомерный эффект
направлен в сторону более
электро- отрицательного
атома
δ-
‥δ+
NH2
+M
-M
• В р-π- сопряженной системе
мезомерный эффект
направлен от
двухэлектронной
несвязывающей р-АО в
сторону системы или,
наоборот, от системы в
сторону вакантной р-АО.
19
20. Электронодоноры и электроноакцепторы
• Заместители, обладающие -I и -М-эффектами,называются электроноакцепторами.
• Заместители, обладающие +I и +М-эффектами,
называются электронодонорами.
• Если электронные эффекты заместителя
разнонаправлены, например -I и +М, то
преобладающим, как правило, будет +Мэффект. Такой заместитель является
δэлектронодонором.
..δ+
δ-
NH2
δ-
-I < +M
ЭД
20
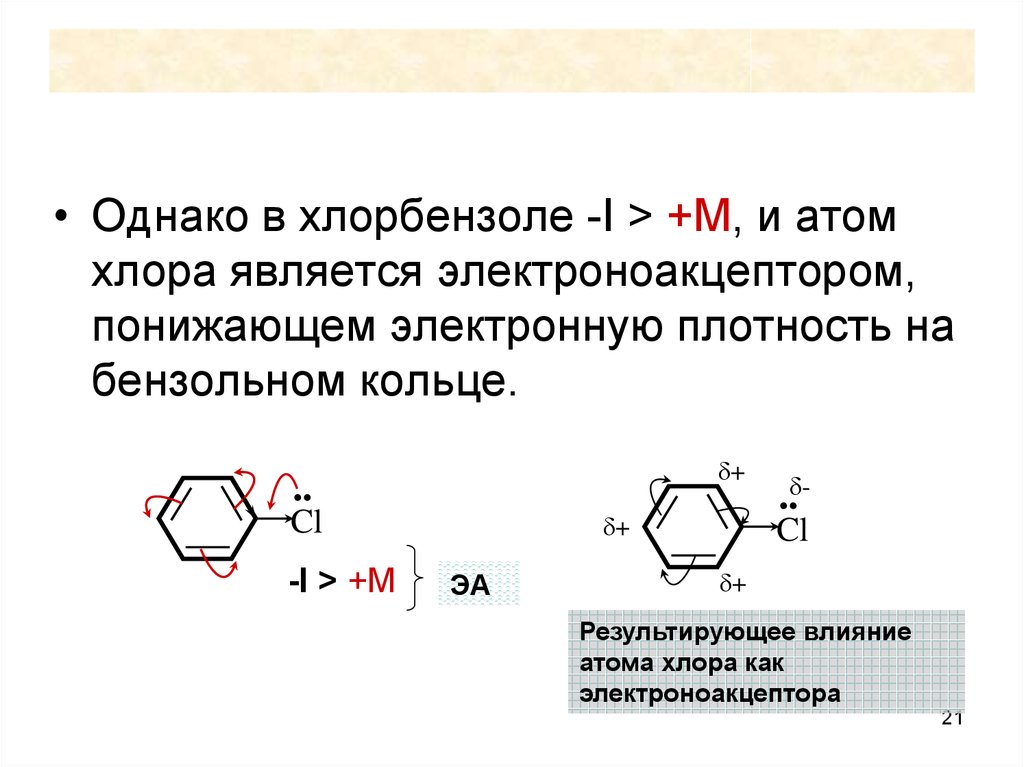
21.
• Однако в хлорбензоле -I > +M, и атомхлора является электроноакцептором,
понижающем электронную плотность на
бензольном кольце.
δ+
..
Cl
-I > +M
δ+
ЭА
..δCl
δ+
Результирующее влияние
атома хлора как
электроноакцептора
21
22. Факторы, определяющие реакционную способность
• Типы разрыва ковалентной связи• Промежуточные частицы реакции
• Энергетический барьер реакции
(энергия активаци)
• Температура, рН среды, соотношение
реагентов, наличие кофакторов и
катализаторов.
22
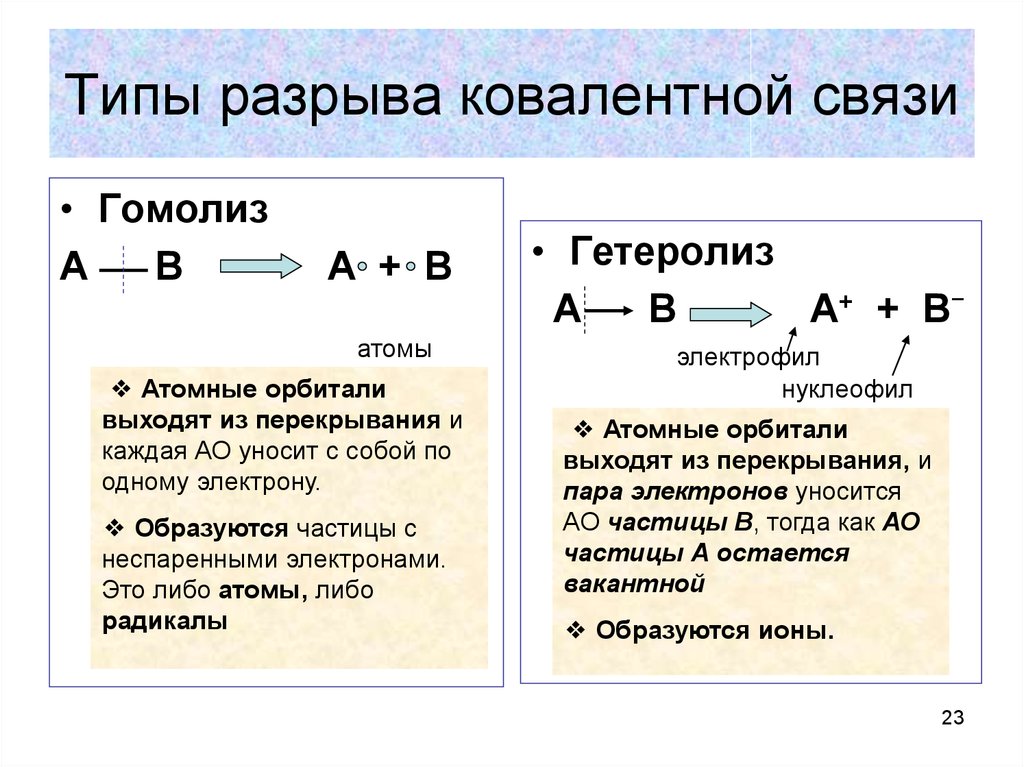
23. Типы разрыва ковалентной связи
• ГомолизА
В
А + В
атомы
❖ Атомные орбитали
выходят из перекрывания и
каждая АО уносит с собой по
одному электрону.
❖ Образуются частицы с
неспаренными электронами.
Это либо атомы, либо
радикалы
• Гетеролиз
А
В
А+ + В
электрофил
нуклеофил
❖ Атомные орбитали
выходят из перекрывания, и
пара электронов уносится
АО частицы В, тогда как АО
частицы А остается
вакантной
❖ Образуются ионы.
23
24. Гомолиз
• Гомолиз характерен для неполярных имало полярных ковалентных связей и
протекает
– В присутствии неполярных растворителей
– Под действием света или высокой температуры
– Под действием высоко реакционноспособных
частиц – радикалов
24
25. Гетеролиз
• Характерен для полярныхковалентных связей и протекает
– В присутствии полярных
сольватирующих растворителей
– Под действием электрофилов и
нуклеофилов
25
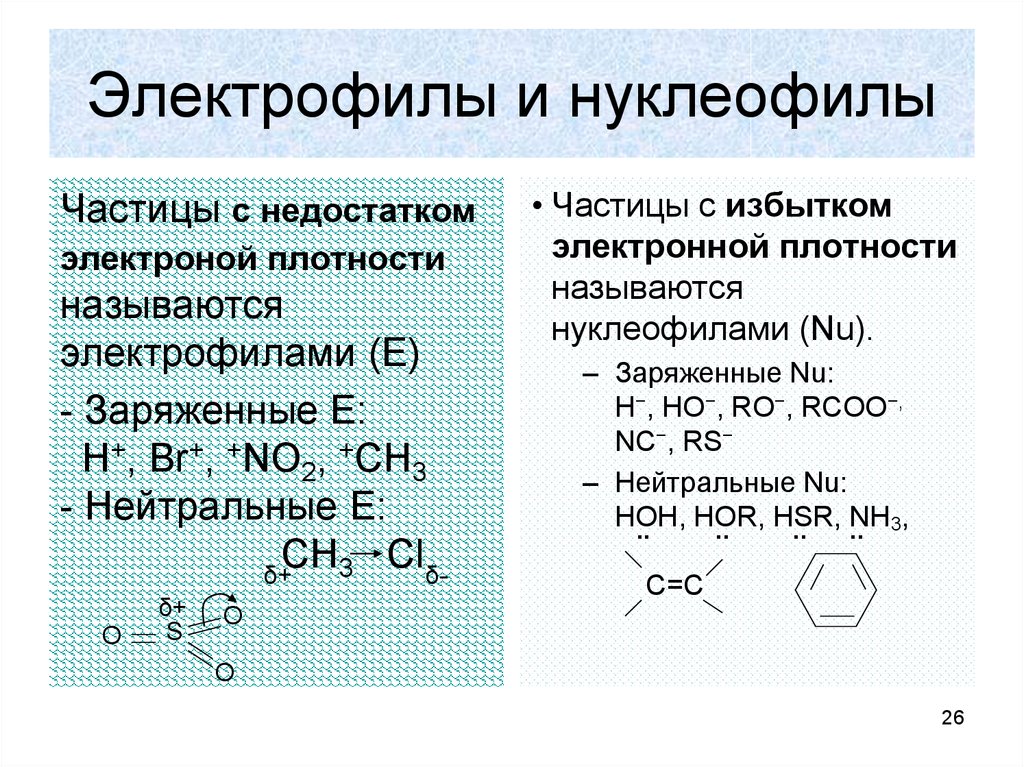
26. Электрофилы и нуклеофилы
Частицы с недостаткомэлектроной плотности
называются
электрофилами (Е)
- Заряженные Е:
Н+, Br+, +NO2, +CH3
- Нейтральные Е:
CH3 Clδδ+
O
δ+
S
• Частицы с избытком
электронной плотности
называются
нуклеофилами (Nu).
– Заряженные Nu:
Н−, НО−, RO−, RCOO−,
NC−, RS−
– Нейтральные Nu:
НОН,
НОR,
HSR,
NH3,
..
..
..
..
C=C
O
O
26
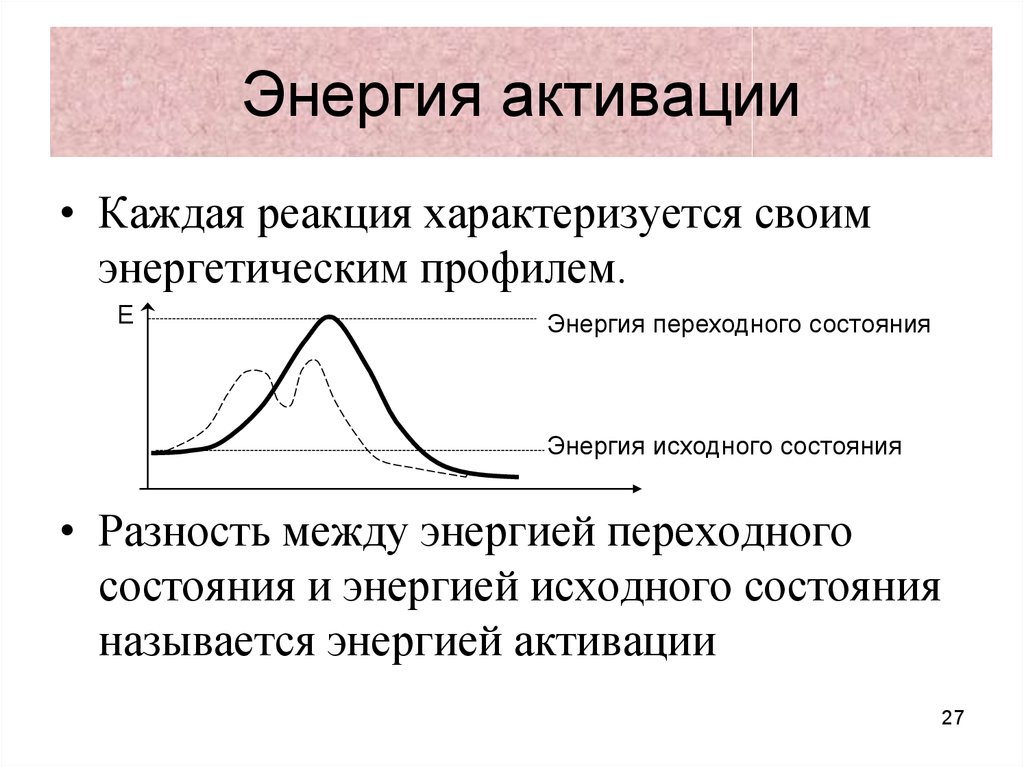
27. Энергия активации
• Каждая реакция характеризуется своимэнергетическим профилем.
Е
Энергия переходного состояния
Энергия исходного состояния
• Разность между энергией переходного
состояния и энергией исходного состояния
называется энергией активации
27
28.
• Чем меньше энергия активации, тем вышескорость реакции.
• Катализаторы снижают энергию активации
и тем самым ускоряют реакцию
• Уменьшение энергетического барьера
достигается как за счет снижения энергии
переходного состояния, так и за счет
повышения энергии исходного состояния.
28
29.
• Реакции с катализаторами происходит внесколько стадий:
– На первой стадии катализатор
взаимодействует с субстратом и
активирует реакционный центр
– На последующих стадиях идут
превращения субстрата в продукт реакции
прямо на активированном субстраткатализаторном комплексе, после чего
катализатор высвобождается из комплекса
29
30. Типы органических реакций
• По типу разрыва • По направлениюковалентной связи
– Замещения (S)
–Гомолитические
–Гетеролитические
– Присоединения (А)
– Элиминирования
(E)
– Перегруппировки
– Изомерии
30
31. По реагенту:
• Электрофильные (с учетомнаправления обозначаются: АE, SE)
• Нуклеофильные (с учетом направления
обозначаются: АN, SN)
• Радикальные (с учетом направления
обозначаются: АR, S R)
• Кислотно-основные
• Окислительно-восстановительные
31
32. Основные выводы
1. Атомы в молекулах связаны между собой спомощью как локализованных, так и
делокализованных ковалентных связей.
2. Сопряжение – это делокализованная π-связь,
которая возникает при определенном
взаимодействии между атомами.
3. Заместителеи в углеводородной цепи и
гетероатомы в циклах бывают
электродонорами или электроакцепторами
32
33. Основные выводы
4. Вид заместителя определяется с помощьюконцепции электронных эффектов
5. Наличие заместителя приводит к
перераспределению электронной
плотности и появлению реакционных
центров.
6. Тип реакционного центра определяет тип
атакующего реагента и способ разрыва
связи.
33
34. Заключение
• Электронодонорные илиэлектроноакцепторные заместители
будут влиять на устойчивость
промежуточных частиц реакции.
• От устойчивости промежуточных частиц
будет зависеть направление реакции
(присоединение, замещение,
перегруппировки) и место входа
реагента.
34
35. Литература
основная:• Слесарев В.И. – Химия: Основы химии
живого: Учебник для вузов. – 3-е изд., испр.
– СПб: Химиздат. – 2007. – 784с.
• Тюкавкина Н. А., Бауков Ю.И. –
Биоорганическая химия : Учебник. – М.:
ДРОФА. – 2006. – С. 36 – 46
35
36. Литература
дополнительная:• Грандберг И.И. – Органическая химия:
Учеб. Для студ. вузов, обучающихся по
агроном. спец. – 5-е изд. – М.: Дрофа, 2002.
– 672 с.
• Пузаков С.А. – Химия: Учебник, 2-е изд.
испр. и доп. М.: ГЭОТАР-Медиа Медицина,
- 2006. – 630 с.
36
37. Литература
электронные ресурсы:• Электронная библиотека Т.12.
Органическая химия. /гл. ред.М.А.
Пальцев.-М.: Русский врач, 2005
• Электронная библиотека Colibris
• Электронный каталог Крас ГМУ
• Ресурсы Интернет
37
38. Приготовиться к вопросу!
СН3СН2
СН2
ОН
Пропанол
СН3
СН
СН2
СН
СН2
NН2
Аллиламин
СН
Пропен-1-ол-1
ОН
СН2
СН
NН2
Виниламин
38
39. Внимание вопрос !!
• Какимиэлектронными
эффектами
обладает ОН-группа
в спиртах.
• Какими
электронными
эффектами
обладает NН2группа в аминах.
• Показать эти
эффекты графически,
обозначить
символически и
указать направление
• Показать эти
эффекты графически,
обозначить
символически и
указать направление
39
































 Химия
Химия








