Похожие презентации:
Взаимное влияние атомов в органических молекулах и способы его передачи
1.
Мы учим и лечимс 1888 года
Взаимное влияние атомов в
органических молекулах и способы
его передачи
Чешкова Т.В.
Доцент кафедры химии,
к.х.н.
2.
Взаимное влияниеатомов в молекулах
проявляется двумя
эффектами:
1)индуктивный (+I, -I)
2)мезомерный (+М, -М)
2
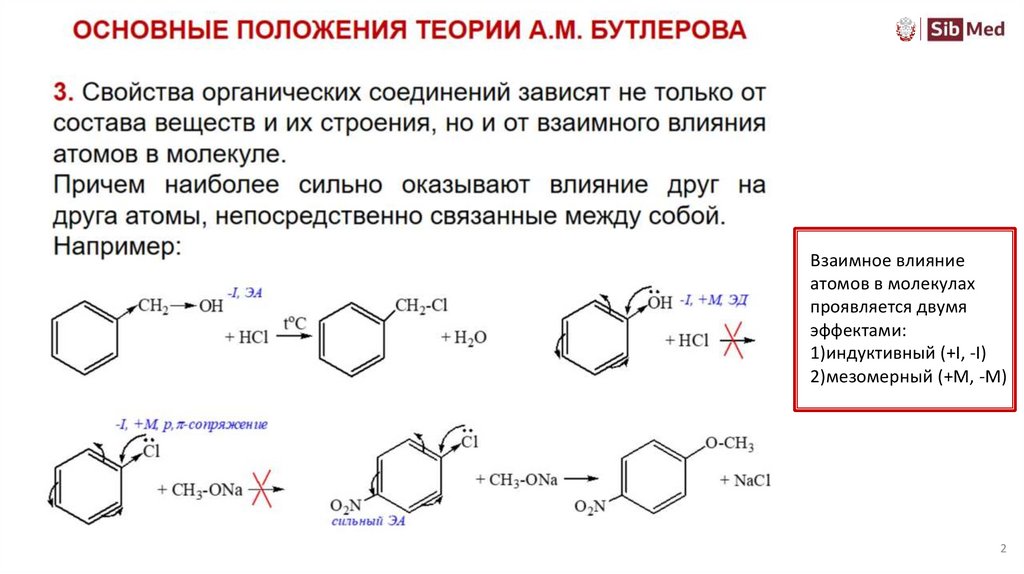
3.
34.
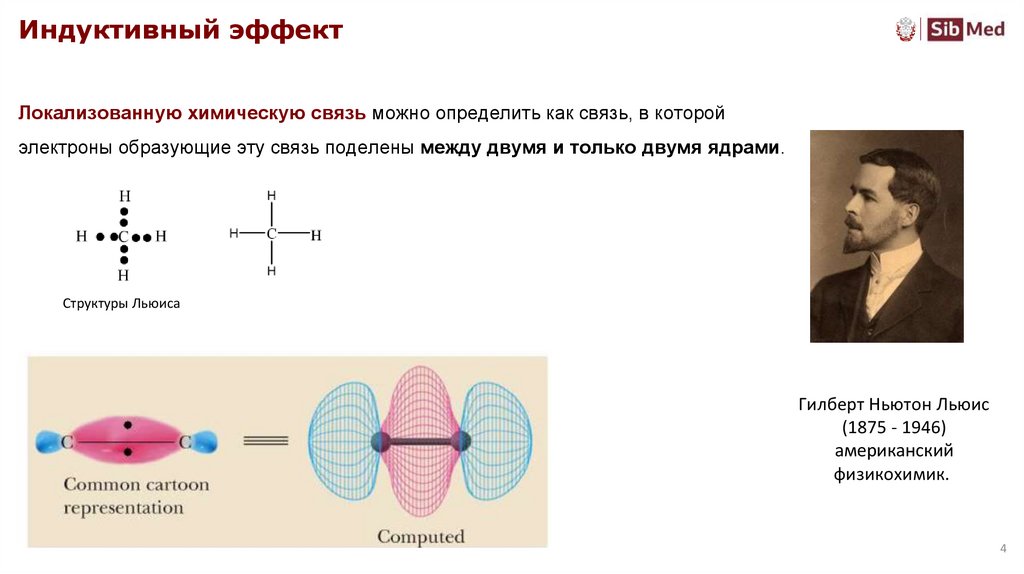
Индуктивный эффектЛокализованную химическую связь можно определить как связь, в которой
электроны образующие эту связь поделены между двумя и только двумя ядрами.
Структуры Льюиса
Гилберт Ньютон Льюис
(1875 - 1946)
американский
физикохимик.
4
5.
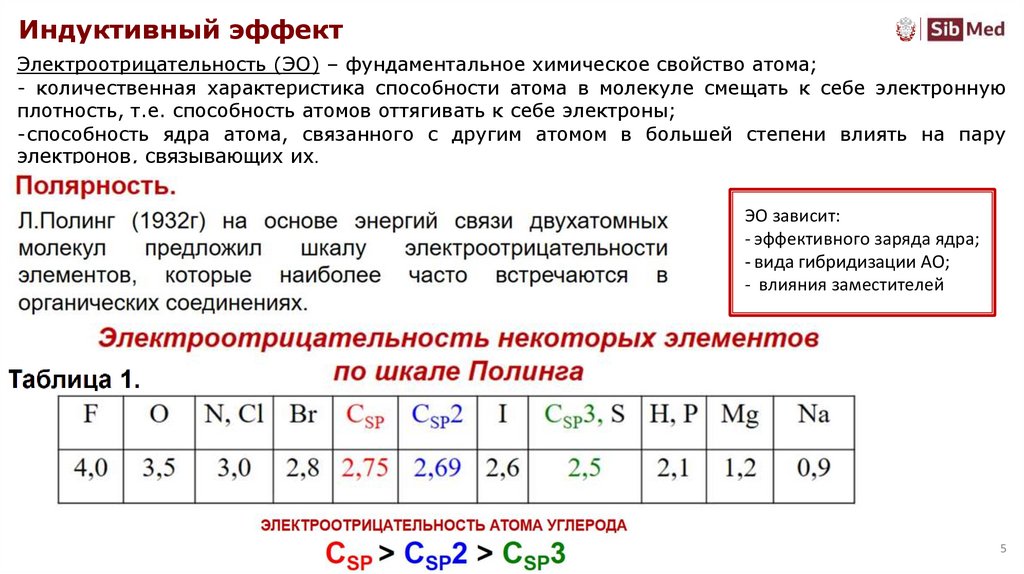
Индуктивный эффектЭлектроотрицательность (ЭО) – фундаментальное химическое свойство атома;
- количественная характеристика способности атома в молекуле смещать к себе электронную
плотность, т.е. способность атомов оттягивать к себе электроны;
-способность ядра атома, связанного с другим атомом в большей степени влиять на пару
электронов, связывающих их.
ЭО зависит:
- эффективного заряда ядра;
- вида гибридизации АО;
- влияния заместителей
5
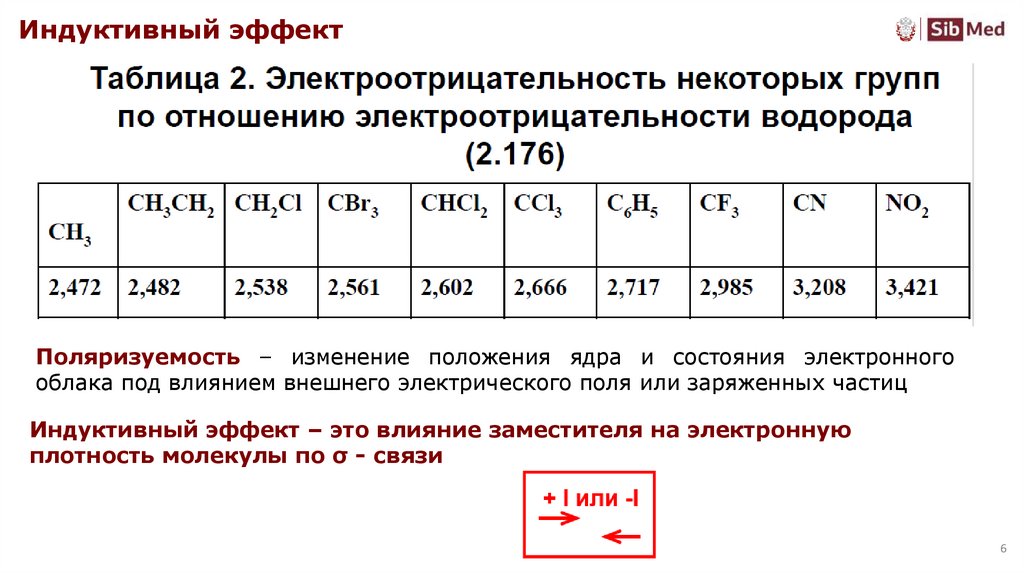
6.
Индуктивный эффектПоляризуемость – изменение положения ядра и состояния электронного
облака под влиянием внешнего электрического поля или заряженных частиц
Индуктивный эффект – это влияние заместителя на электронную
плотность молекулы по σ - связи
6
7.
78.
89.
10.
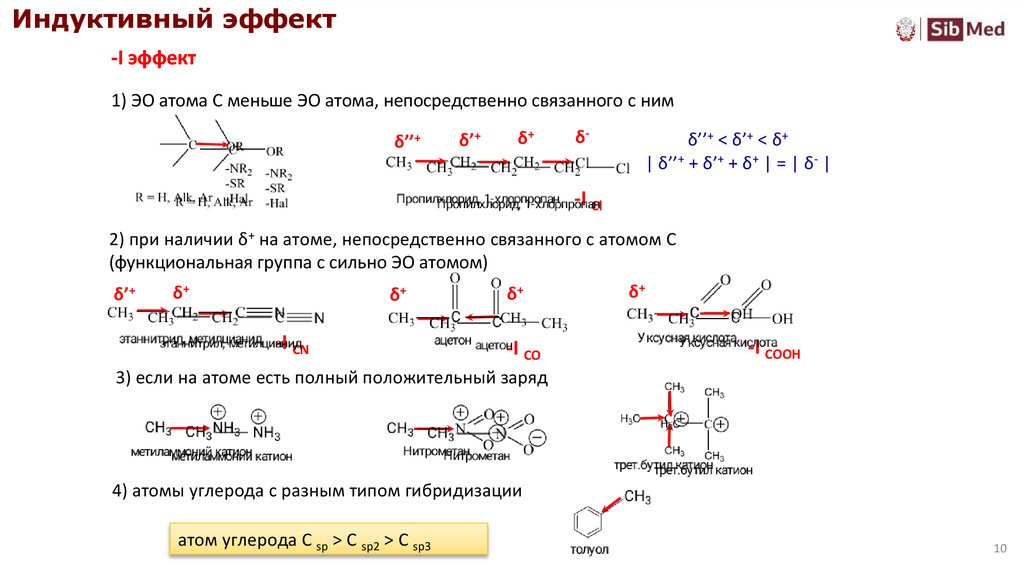
Индуктивный эффект-I эффект
1) ЭО атома С меньше ЭО атома, непосредственно связанного с ним
δ’’+
δ’+
δ+
δ-
δ’’+ < δ’+ < δ+
| δ’’+ + δ’+ + δ+ | = | δ- |
-I Cl
2) при наличии δ+ на атоме, непосредственно связанного с атомом С
(функциональная группа с сильно ЭО атомом)
δ’+
δ+
δ+
-I CN
δ+
-I CO
δ+
-I COOH
3) если на атоме есть полный положительный заряд
4) атомы углерода с разным типом гибридизации
атом углерода С sp > C sp2 > C sp3
10
11.
1112.
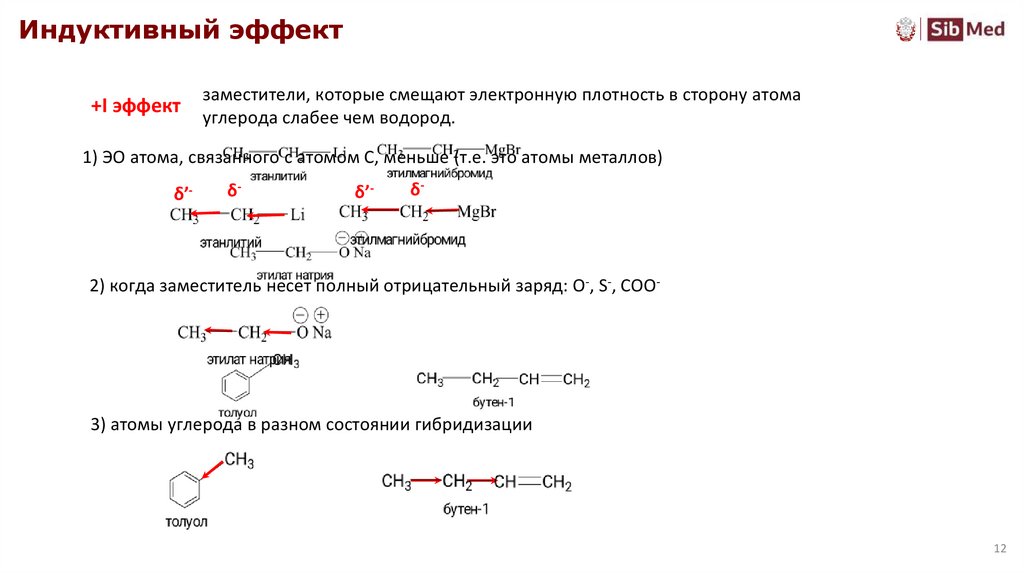
Индуктивный эффект+I эффект
заместители, которые смещают электронную плотность в сторону атома
углерода слабее чем водород.
1) ЭО атома, связанного с атомом С, меньше (т.е. это атомы металлов)
δ’-
δ-
δ’-
δ-
2) когда заместитель несет полный отрицательный заряд: O-, S-, COO-
3) атомы углерода в разном состоянии гибридизации
12
13.
Индуктивный эффект13
14.
1415.
1516.
1617.
1718.
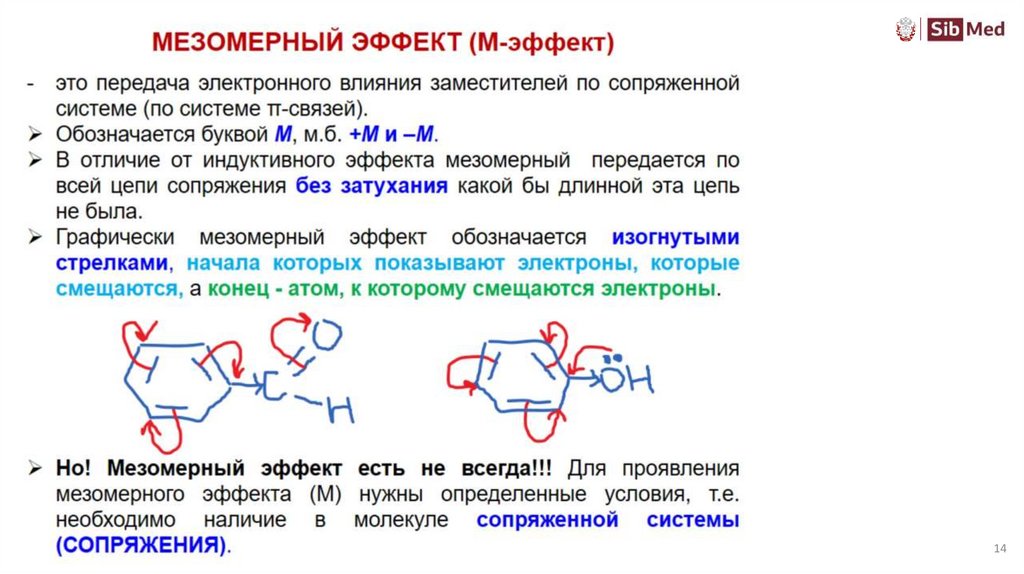
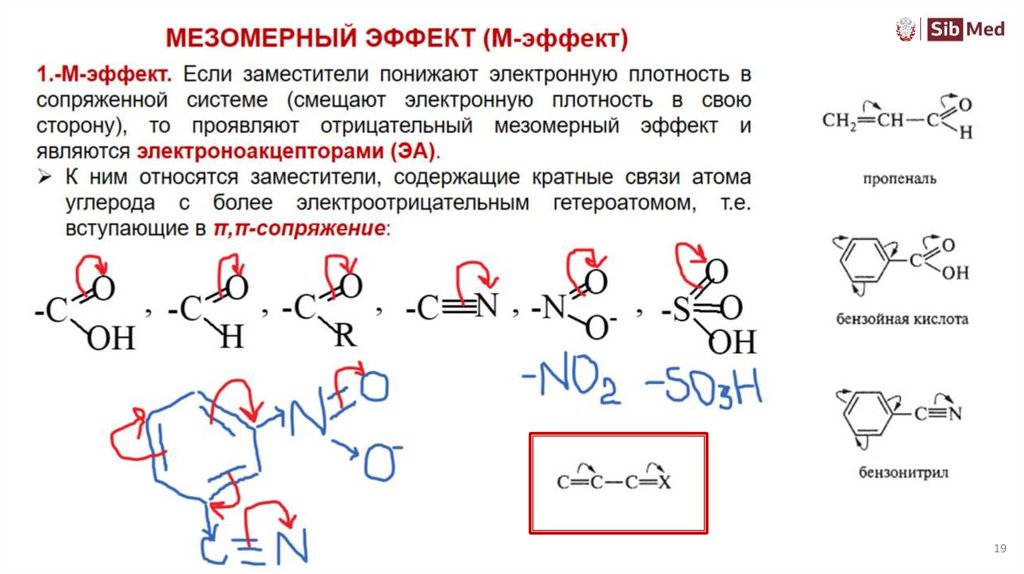
Мезомерный эффект+ М или - М
Мезомерный эффект (эффект сопряжения) – это
влияние заместителя на смещение электронной
плотности по сопряженной системе
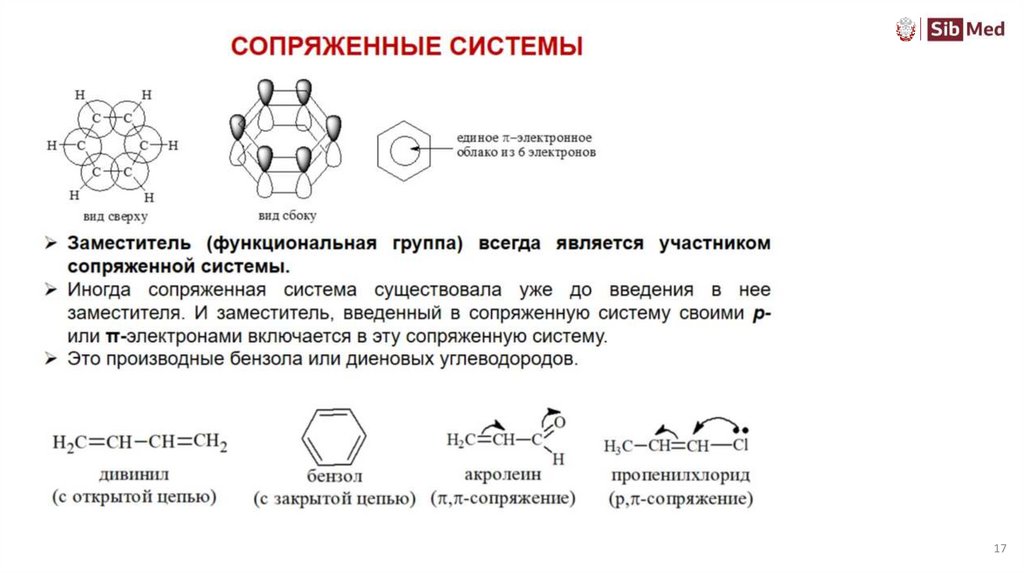
!!! НЕТ СОПРЯЖЕНИЯ – НЕТ МЕЗОМЕРНОГО ЭФФЕКТА !!!
Передается без затухания по всей сопряженной системе
18
19.
1920.
2021.
2122.
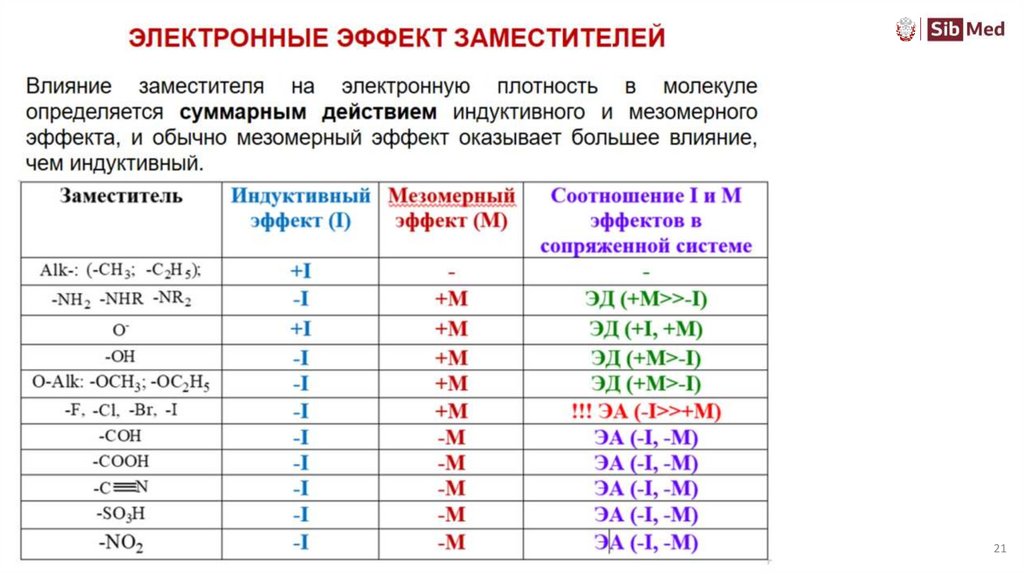
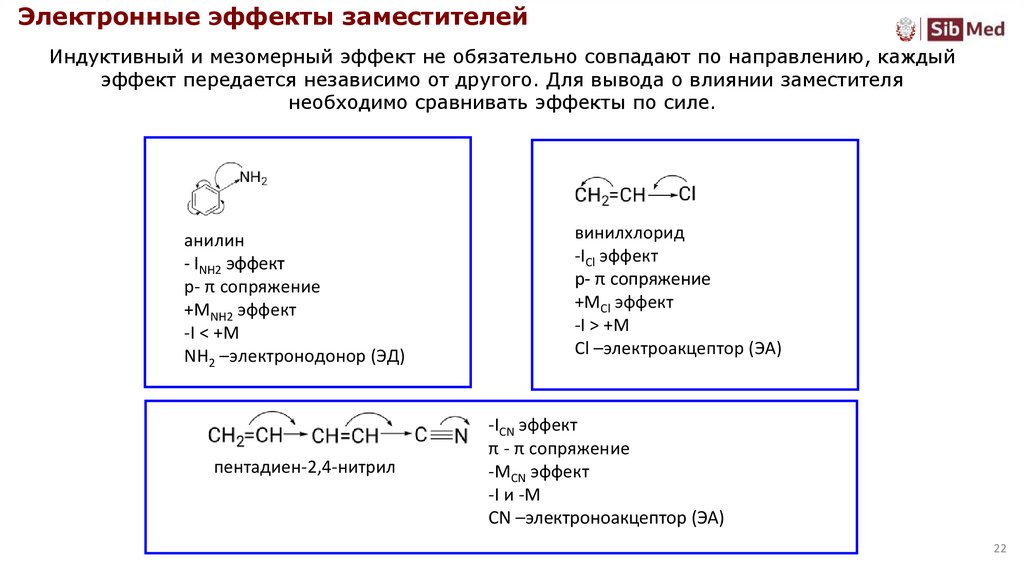
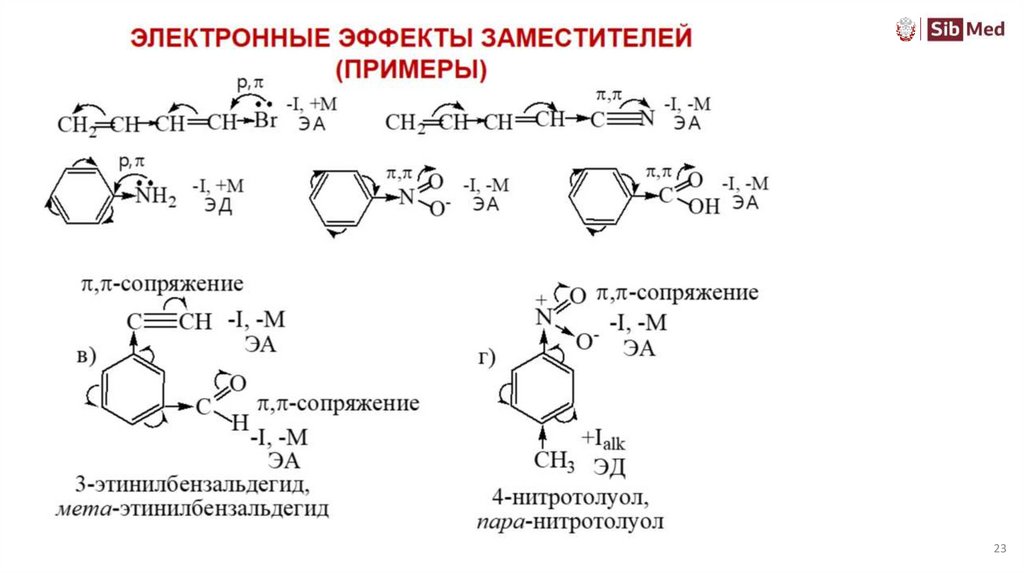
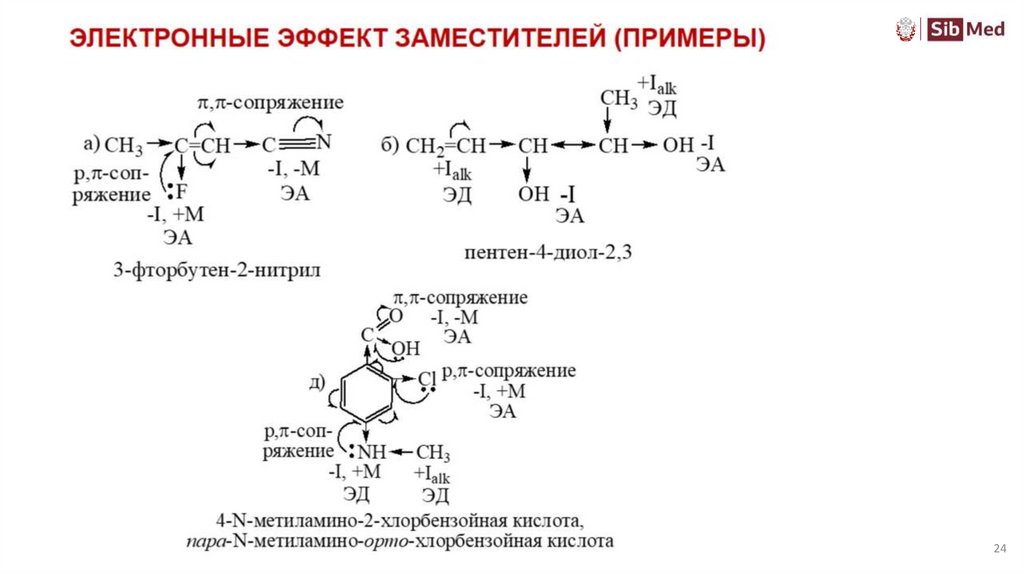
Электронные эффекты заместителейИндуктивный и мезомерный эффект не обязательно совпадают по направлению, каждый
эффект передается независимо от другого. Для вывода о влиянии заместителя
необходимо сравнивать эффекты по силе.
анилин
- INH2 эффект
р- π сопряжение
+MNH2 эффект
-I < +M
NH2 –электронодонор (ЭД)
пентадиен-2,4-нитрил
винилхлорид
-ICl эффект
р- π сопряжение
+MCl эффект
-I > +M
Cl –электроакцептор (ЭА)
-ICN эффект
π - π сопряжение
-MCN эффект
-I и -M
CN –электроноакцептор (ЭА)
22
23.
2324.
2425.
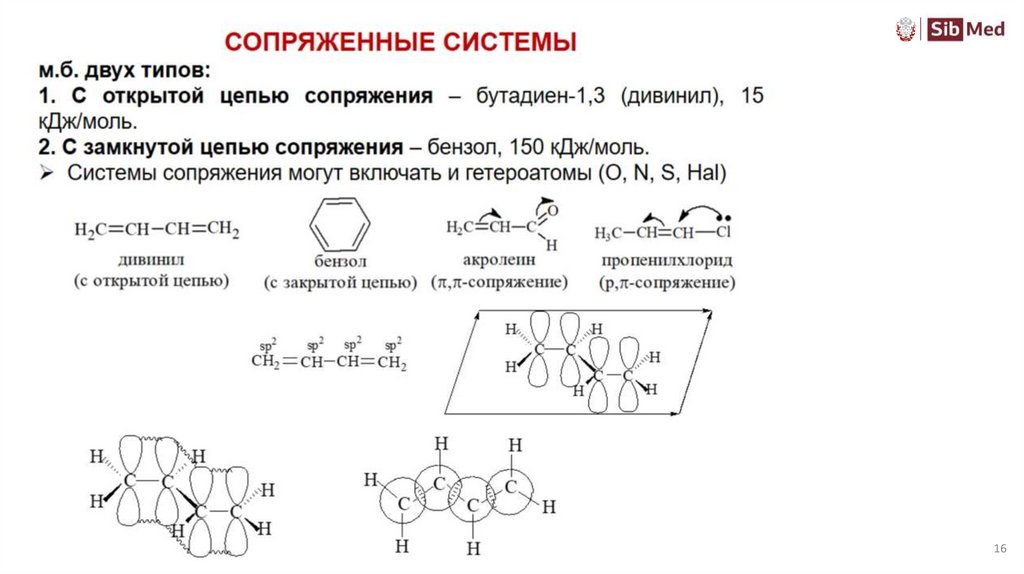
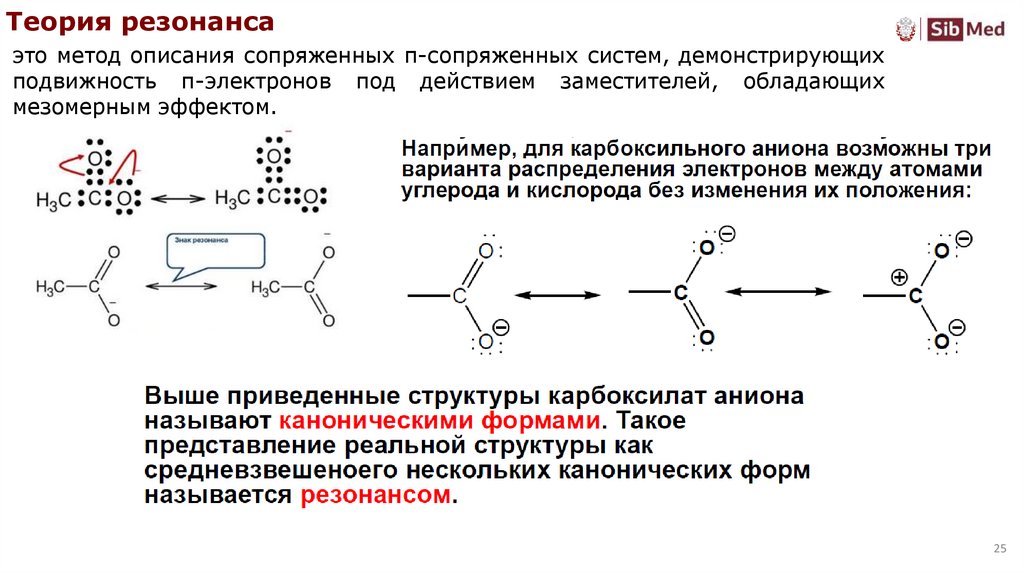
Теория резонансаэто метод описания сопряженных π-сопряженных систем, демонстрирующих
подвижность π-электронов под действием заместителей, обладающих
мезомерным эффектом.
25
26.
2627.
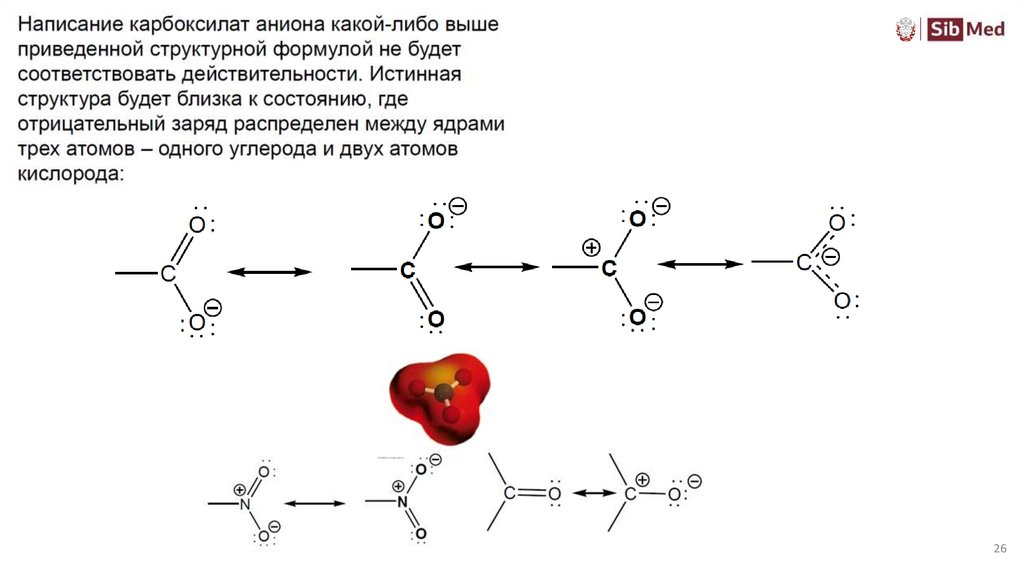
Теория резонанса• Все канонические формы должны быть структурами Льюиса
• Во всех структурах положение ядер должно быть одинаковым
• Все канонические формы должны иметь одинаковое число неспаренных электронов
• Энергия истинной молекулы меньше энергии любой из канонических структур,
поэтому делокализацию следует рассматривать как стабилизирующий фактор
• Способность молекулы к резонансу тем больше, чем большее число возможных
канонических структур.
27











 Химия
Химия








