Похожие презентации:
Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері
1. АЛКАНДАР
Метан молекуласының құрылысыМетан және оның
гомологтарының қасиеттері
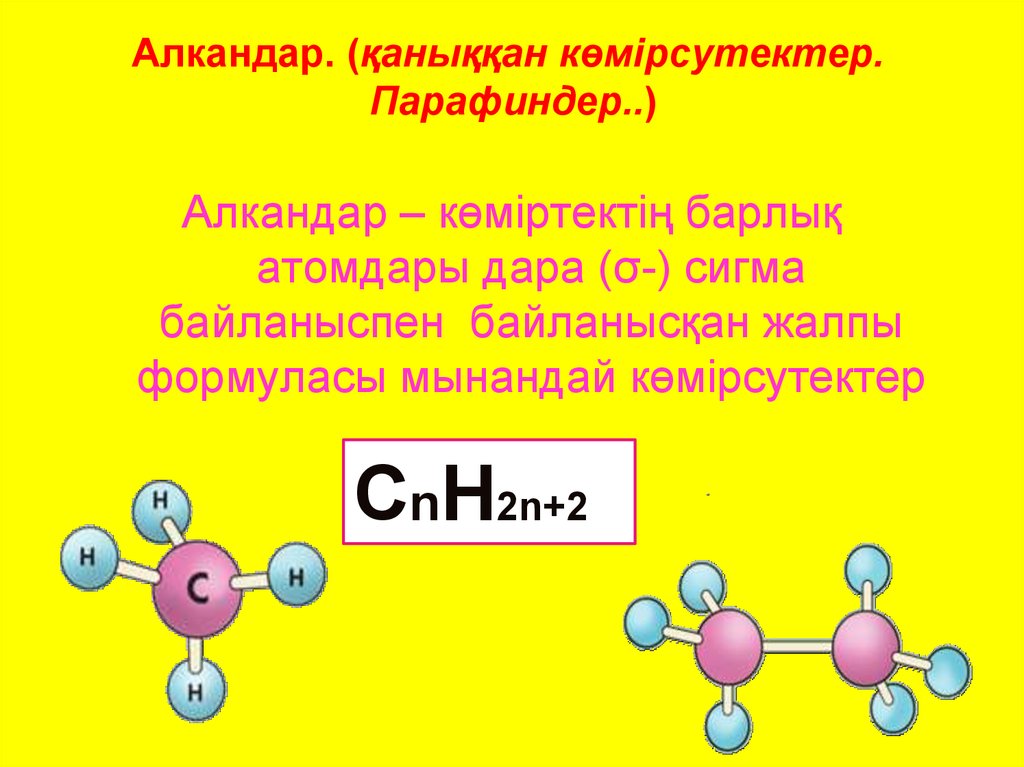
2. Алкандар. (қаныққан көмірсутектер. Парафиндер..)
Алкандар – көміртектің барлықатомдары дара (σ-) сигма
байланыспен байланысқан жалпы
формуласы мынандай көмірсутектер
CnH2n+2
3.
АЛКАНДАРқаныққан көмірсутектердің
халықаралық номенклатура
(ИЮПАК) бойынша атауы.
ПАРАФИНДЕР
қаныққан көмірсутектердің тарихи
атауы ( лат. parrum affinis – аз
белсенді малоактивный).
4.
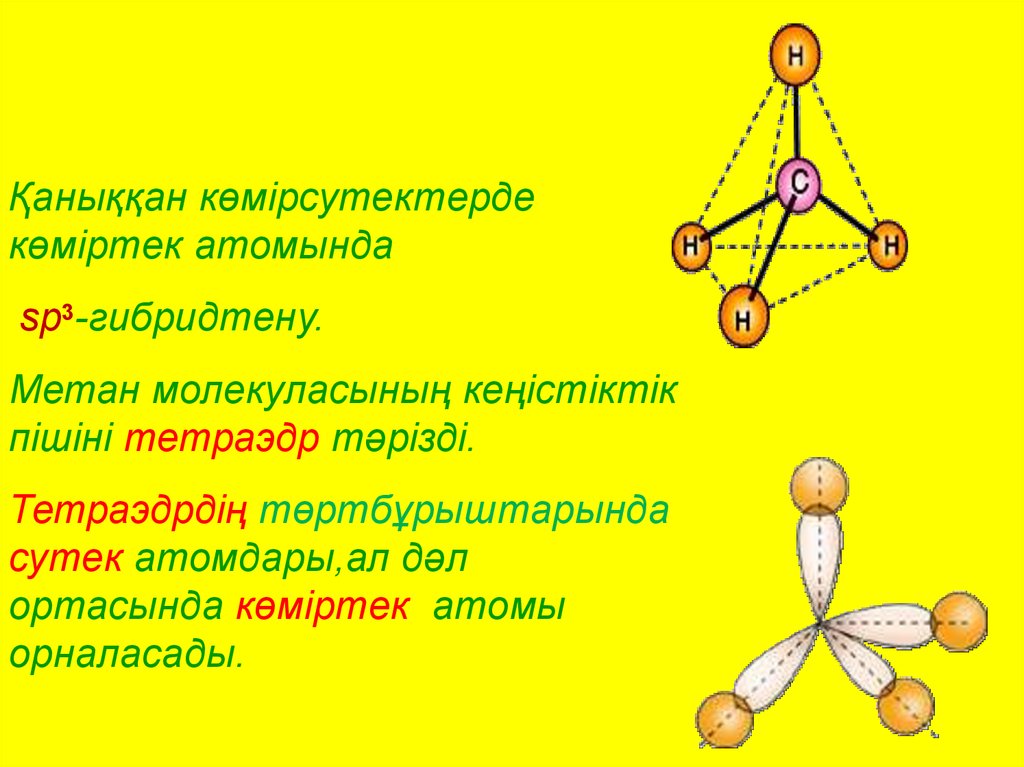
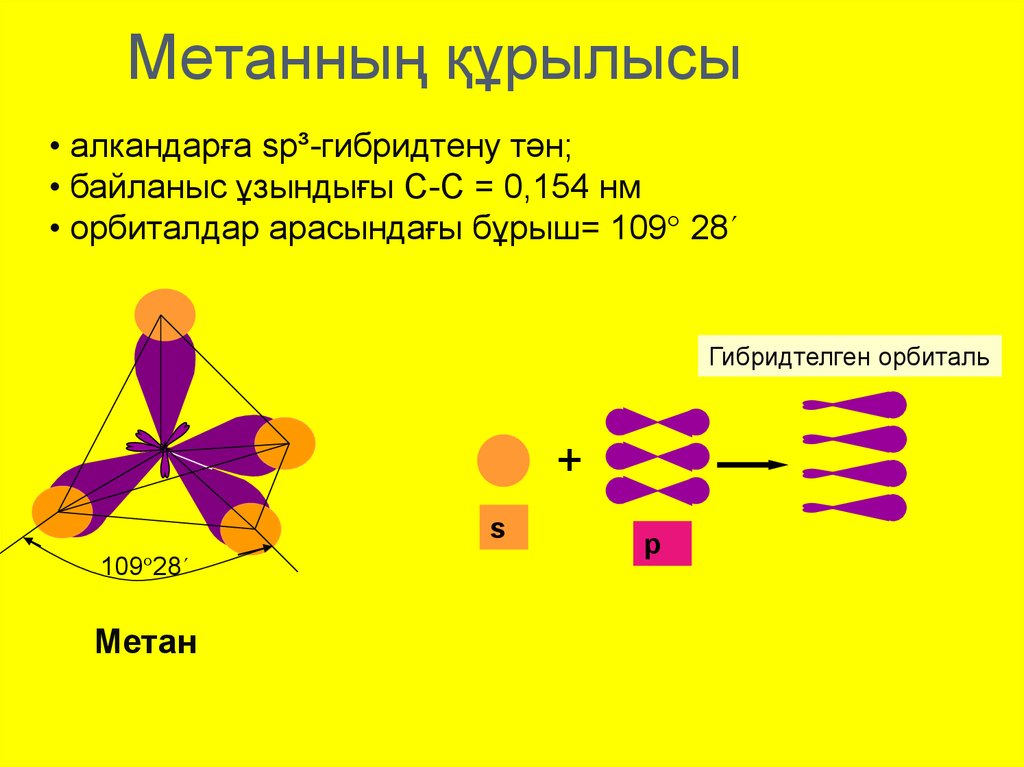
Қаныққан көмірсутектердекөміртек атомында
sp3-гибридтену.
Метан молекуласының кеңістіктік
пішіні тетраэдр тәрізді.
Тетраэдрдің төртбұрыштарында
сутек атомдары,ал дәл
ортасында көміртек атомы
орналасады.
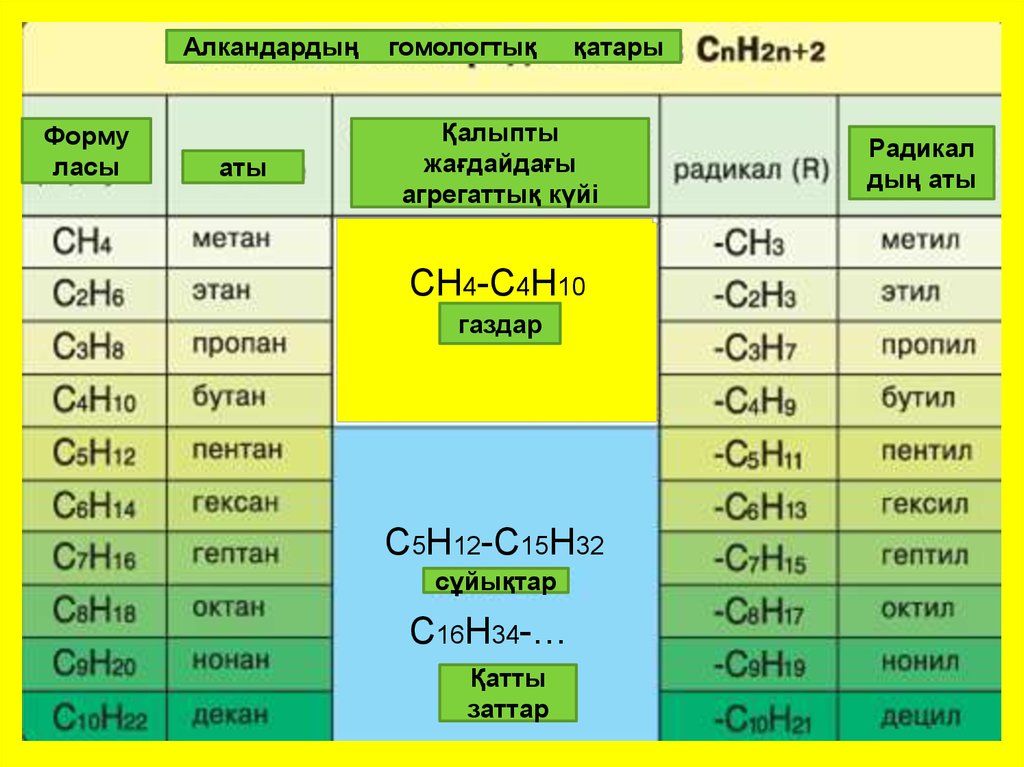
5. Метанның гомологтық қатары
Гомологтар – құрылысы мен қасиеті ұқсас ,бір немесебірнеше СH2. тобына айырмасы бар жалпы формуласы
бірдей заттар
СН4
С2H6
C3H8
C4H10
C5H12
метан
этан
пропан
бутан
пентан
C6H14
C7H16
C8H18
C9H20
C10H22
гексан
гептан
октан
нонан
декан
6.
АлкандардыңФорму
ласы
аты
гомологтық
қатары
Қалыпты
жағдайдағы
агрегаттық күйі
СН4-С4Н10
газдар
С5Н12-С15Н32
сұйықтар
С16Н34-…
Қатты
твердые
заттар
Радикал
дың аты
7.
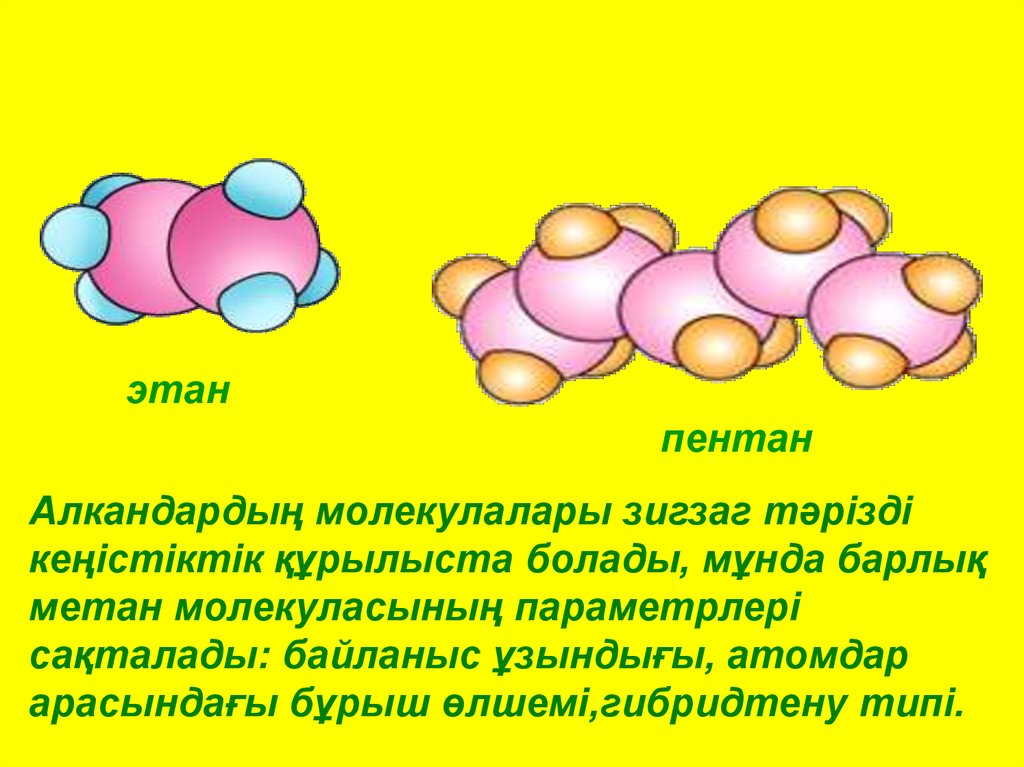
этанпентан
Алкандардың молекулалары зигзаг тәрізді
кеңістіктік құрылыста болады, мұнда барлық
метан молекуласының параметрлері
сақталады: байланыс ұзындығы, атомдар
арасындағы бұрыш өлшемі,гибридтену типі.
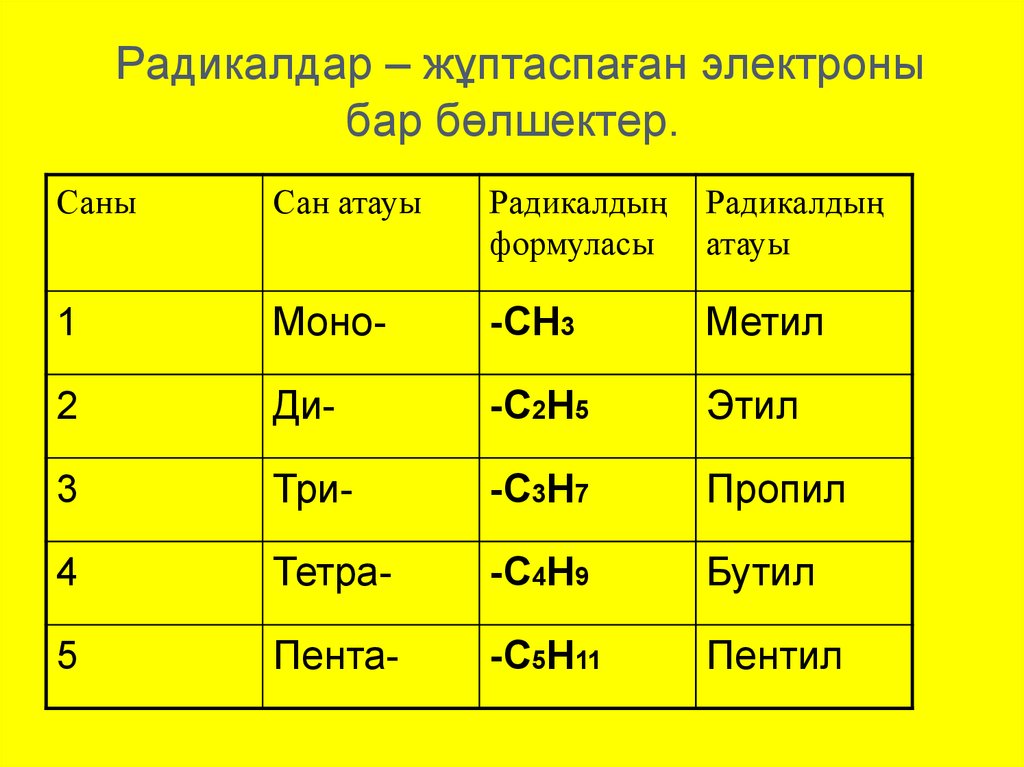
8. Радикалдар – жұптаспаған электроны бар бөлшектер.
СаныСан атауы
Радикалдың
формуласы
Радикалдың
атауы
1
Моно-
-СН3
Метил
2
Ди-
-С2Н5
Этил
3
Три-
-С3Н7
Пропил
4
Тетра-
-С4Н9
Бутил
5
Пента-
-С5Н11
Пентил
9. Метанның құрылысы
• алкандарға sp³-гибридтену тән;• байланыс ұзындығы С-С = 0,154 нм
• орбиталдар арасындағы бұрыш= 109° 28´
Гибридтелген орбиталь
+
s
109°28´
Метан
р
10. Физикалық қасиеттері
СН4…C4Н10 –газдар
Tқайнау:
-161,6…-0,5 °C
T балқу:
-182,5…-138,3
°C
С5Н12…C15Н32
–сұйықтар
T қайнау:
36,1…270,5 °C
Tбалқу:
-129,8…10 °C
С16Н34…ары
қарай қатты
заттар
T қайнау:
287,5 °C
T балқу:
20 °C
Салыстырмалы молекулалық массаларының
өсу ретіне қарай қайнау, балқу
температуралары артады
11.
АЛКАНДАРДЫҢ ФИЗИКАЛЫҚ ҚАСИЕТТЕРІ.ТАБИҒАТТА КЕЗДЕСУІ.
МЕТАН – газ, түссіз, иіссіз ,ауадан 2
есеге дерлік жеңіл,суда аз ериді. Ол
табиғатта ауа өтпейтін жерде
өсімдіктер мен жануарлардың
қалдықтарының ыдырауы
нәтижесінде түзіледі.Сондықтан
батпақталған су қоймаларында
кездеседі, онда газ көпіршіктері
түрінде көрінеді , немесе таскөмір
шахталарында жиналады, көмір
пластарынан бөлінген .Негізінен (8097%) метан табиғи газда және
мұнайға серік газдарда болады.
12.
ЭТАН, ПРОПАН МЕН БУТАНтабиғи газдың және мұнайға
серік газдардың құрамына
кіреді. АЛКАНДАР мұнайда
болады. Салыстырмалы
молекулалық массалары
өскен сайын сандық
қатынастарының сапаға өтуі
байқалады: агрегаттық күйі
өзгереді,қайнау және балқу
температуралары,тығыздық
тары біртіндеп артады.
13. Алынуы
1) Өнеркәсіптеа) мұнай өнімдерін
крекингілеу :
C16H34 → C8H18 + C8H16
2) Зертханада: а) карбидті гидролиздеу:
Al4C3 +12 H2O = 3 CH4 + 4 Al(OH)3↓
б) Вюрц реакциясы:
C2H5Cl + 2Na → C4H10 + 2NaCl
в) карбон қышқылының натрий тұздарын
декарбоксилдеу
СН3СООNa + 2NaОН → СН4 ↑ + Nа2СО3
14.
СН3СН2
СН2
СН2
t, катализатор
СН3
СН3
СН
СН2
СН3
СН3
СН4 + Н2О
800°С
СО + 3Н2
синтез-газ
1500°С
2СН4
СН3
Н
СН3
С≡С
Н + 3Н2 + Q
Н2С=СН2 + Н2 + Q
Қаныққан көмірсутектер оттегі жеткілікті болғанда
көмірленбей жанады)
С3Н8 + 5О2
3СО2 + 4Н2О + Q
Катализаторт қатысында тотығады:
СН4 + О2
500°С, катализатор
Н
2СН3(СН2)34СН3 + 5О2 4СН3
О
С + Н2О + Q
Н
(СН2)16СООН +2Н2О + Q
15. Алкандардың қолданылуы
Отын ретінде кеңінен қолданылады,іштен жанатын двигательдердің
отыны









 Химия
Химия








