Похожие презентации:
Багатоядерні ароматичні сполуки
1. БАГАТОЯДЕРНІ АРОМАТИЧНІ СПОЛУКИ
• Багатоядерні ароматичні сполуки (поліциклічні арени)умовно розділяють на сполуки з неконденсованими
бензеновими ядрами і з конденсованими.
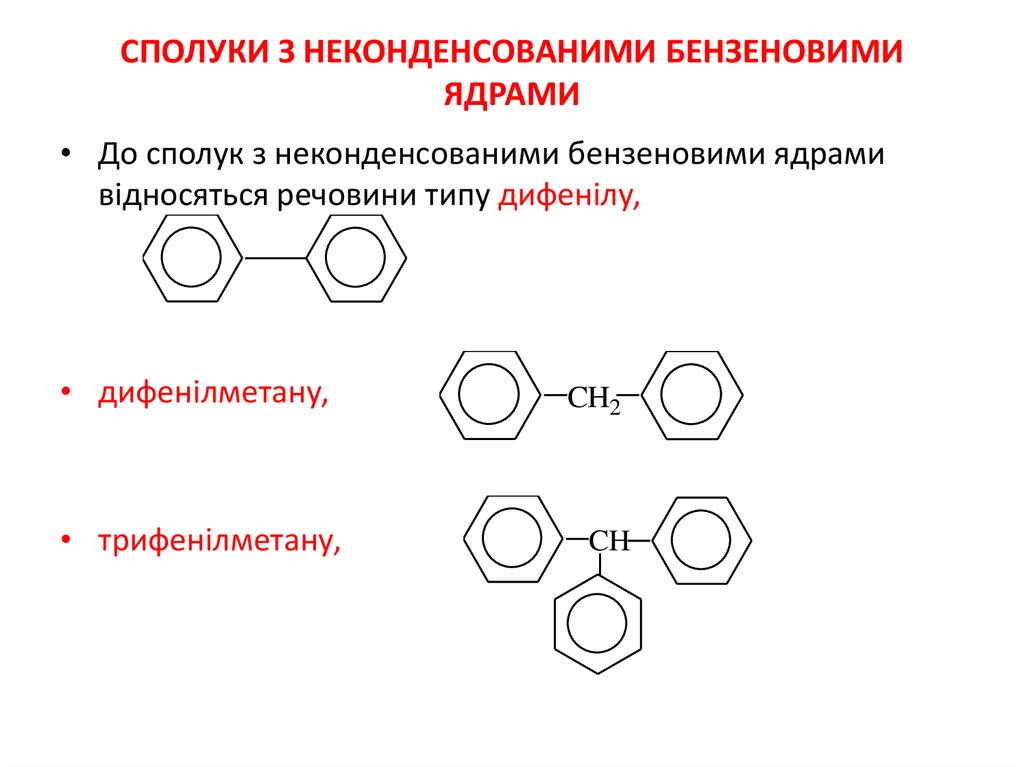
2. СПОЛУКИ З НЕКОНДЕНСОВАНИМИ БЕНЗеновиМИ ЯДРАМИ
СПОЛУКИ З НЕКОНДЕНСОВАНИМИ БЕНЗЕНОВИМИЯДРАМИ
• До сполук з неконденсованими бензеновими ядрами
відносяться речовини типу дифенілу,
• дифенілметану,
• трифенілметану,
CH2
CH
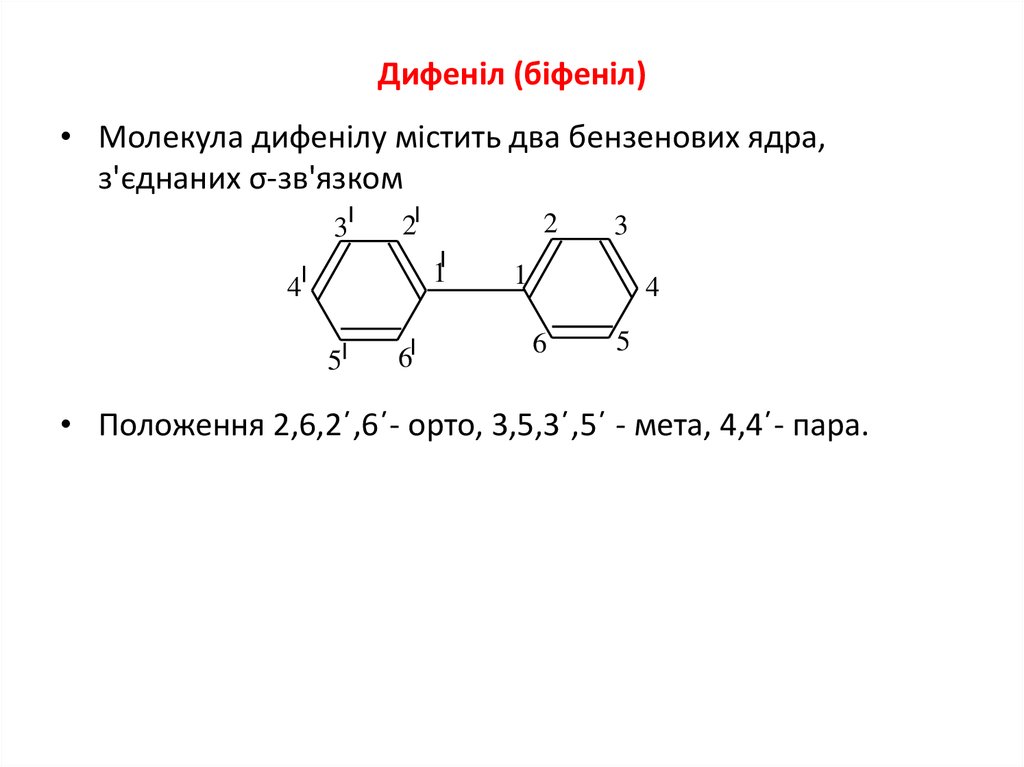
3. Дифеніл (біфеніл)
• Молекула дифенілу містить два бензенових ядра,з'єднаних σ-зв'язком
3
2
2
1
4
5
6
3
1
4
6
5
• Положення 2,6,2΄,6΄- орто, 3,5,3΄,5΄ - мета, 4,4΄- пара.
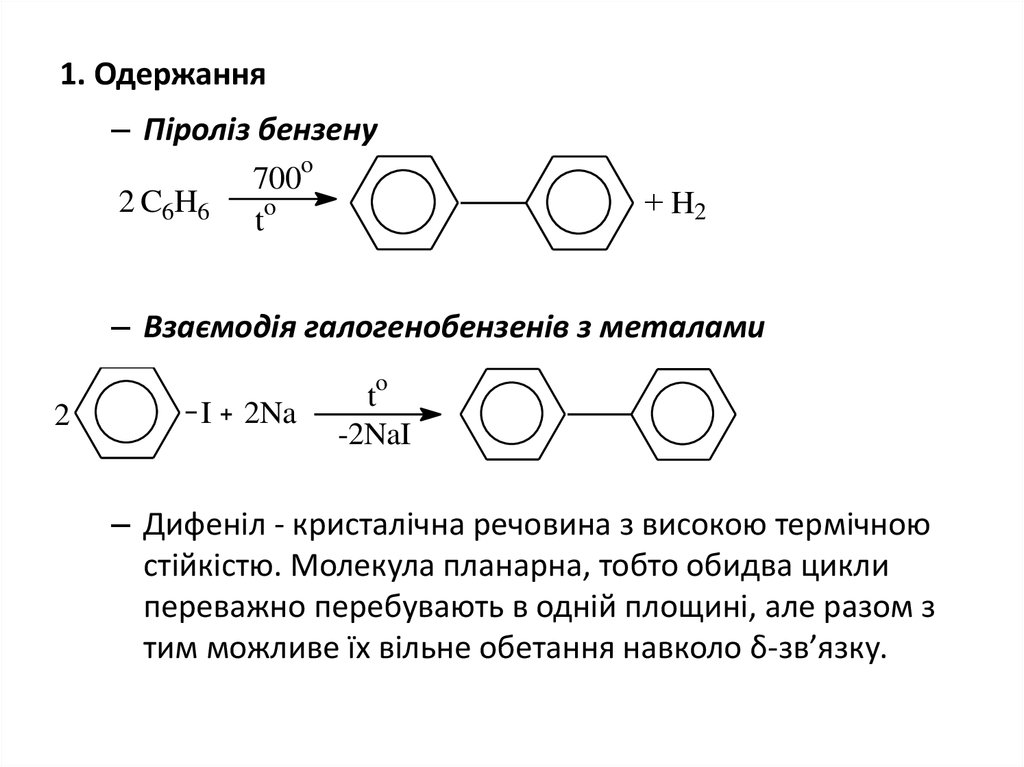
4. 1. Одержання
– Піроліз бензенуo
2 C6H6
700
o
t
+ H2
– Взаємодія галогенобензенів з металами
o
2
I
2Na
t
-2NaI
– Дифеніл - кристалічна речовина з високою термічною
стійкістю. Молекула планарна, тобто обидва цикли
переважно перебувають в одній площині, але разом з
тим можливе їх вільне обетання навколо δ-зв’язку.
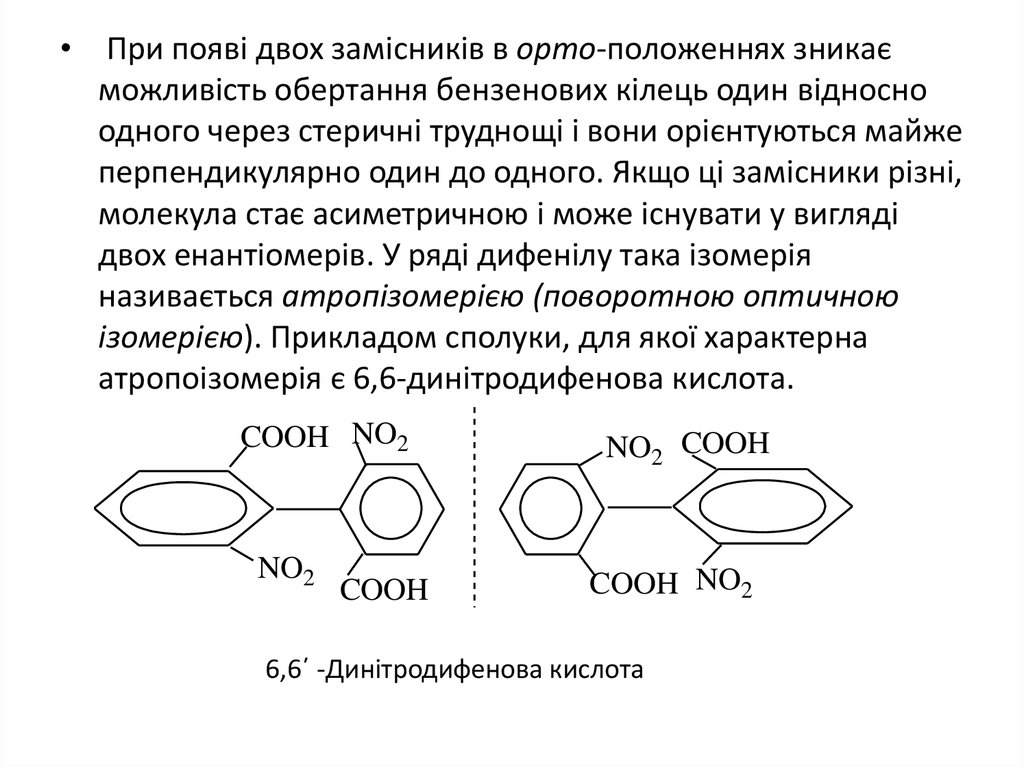
5.
• При появі двох замісників в орто-положеннях зникаєможливість обертання бензенових кілець один відносно
одного через стеричні труднощі і вони орієнтуються майже
перпендикулярно один до одного. Якщо ці замісники різні,
молекула стає асиметричною і може існувати у вигляді
двох енантіомерів. У ряді дифенілу така ізомерія
називається атропізомерією (поворотною оптичною
ізомерією). Прикладом сполуки, для якої характерна
атропоізомерія є 6,6-динітродифенова кислота.
COOH NO2
NO2
COOH
NO2 COOH
COOH NO2
6,6΄ -Динітродифенова кислота
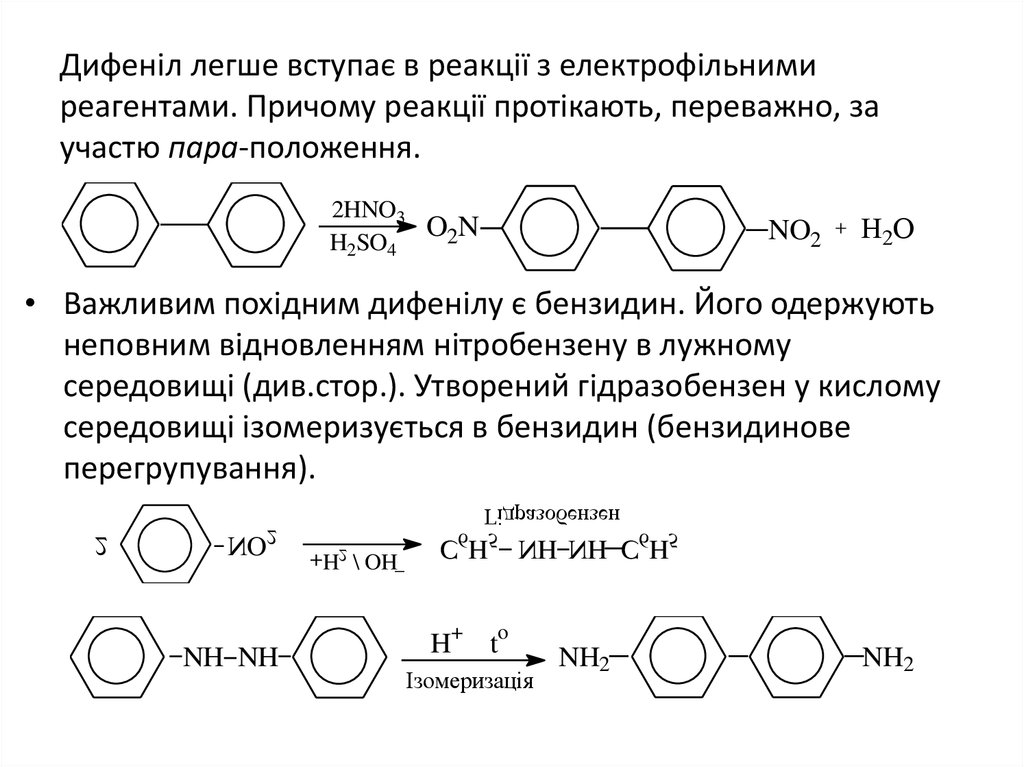
6. Дифеніл легше вступає в реакції з електрофільними реагентами. Причому реакції протікають, переважно, за участю пара-положення.
2HNO3H2SO4
O2N
NO2
H2O
• Важливим похідним дифенілу є бензидин. Його одержують
неповним відновленням нітробензену в лужному
середовищі (див.стор.). Утворений гідразобензен у кислому
середовищі ізомеризується в бензидин (бензидинове
перегрупування).
2
Гідразобензен
NO2
+H2
/ OH
C6H5 NH NH C6H5
+
NH NH
H
o
t
Ізомеризація
NH2
NH2
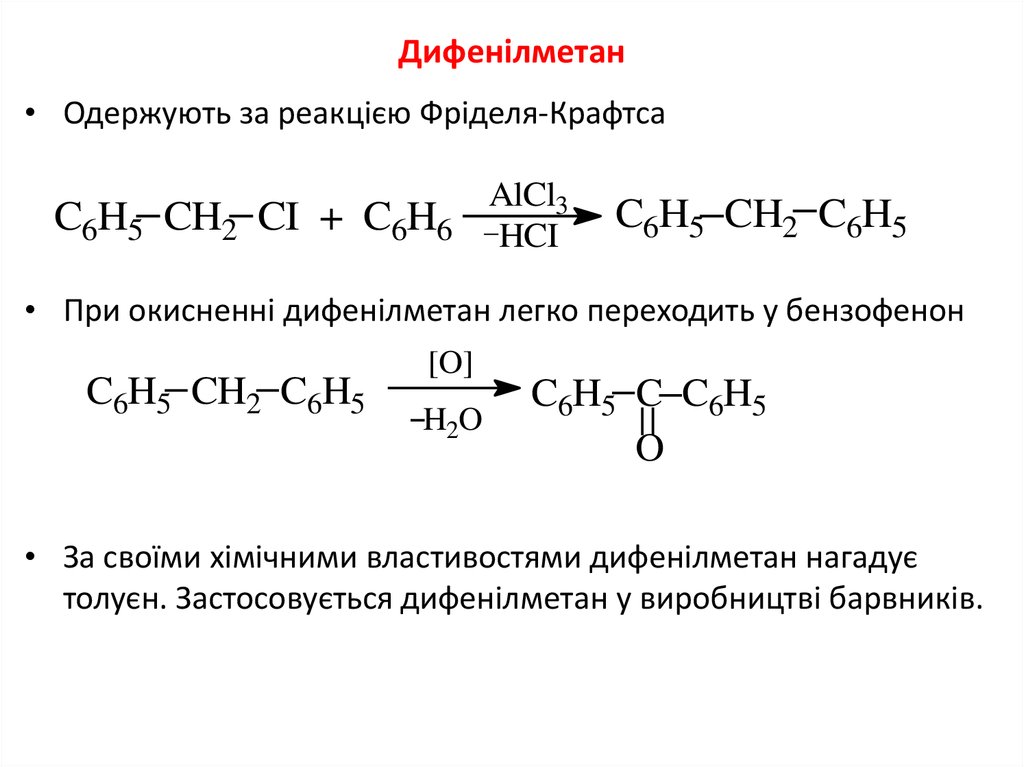
7. Дифенілметан
• Одержують за реакцією Фріделя-КрафтсаC6H5 CH2 CI + C6H6
AlCl3
HCI
C6H5 CH2 C6H5
• При окисненні дифенілметан легко переходить у бензофенон
C6H5 CH2 C6H5
[O]
H2O
C6H5 C C6H5
O
• За своїми хімічними властивостями дифенілметан нагадує
толуєн. Застосовується дифенілметан у виробництві барвників.
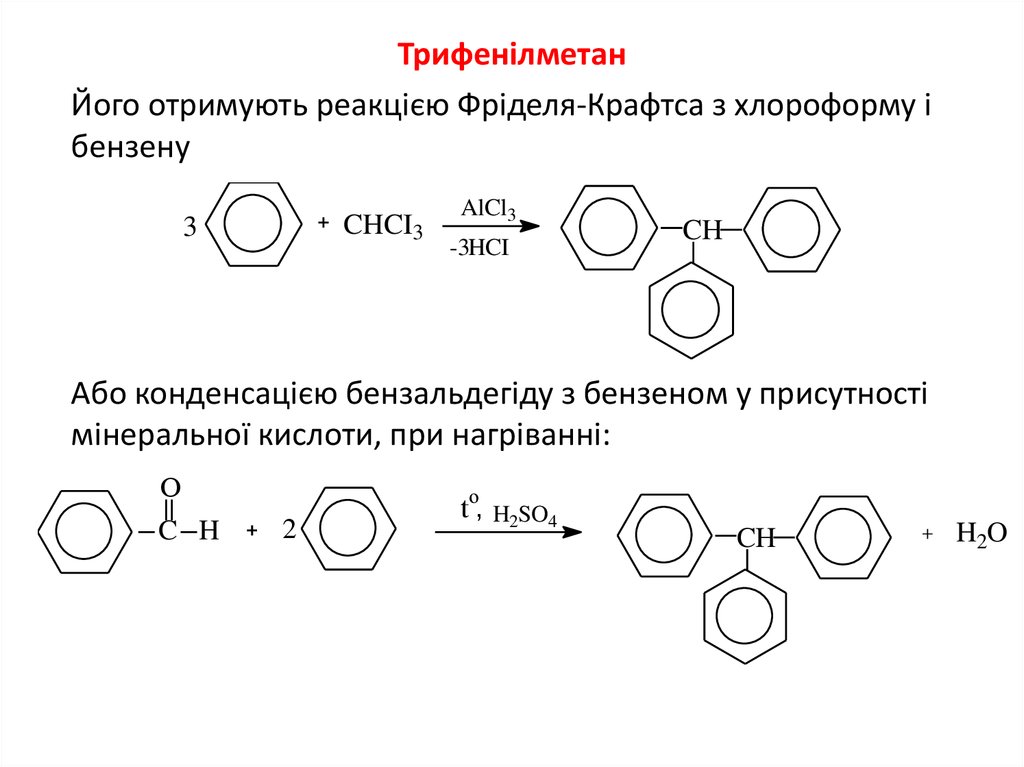
8. Трифенілметан
ТрифенілметанЙого отримують реакцією Фріделя-Крафтса з хлороформу і
бензену
CHCI3
3
AlCl3
-3HCI
CH
Або конденсацією бензальдегіду з бензеном у присутності
мінеральної кислоти, при нагріванні:
О
C H
o
2
t , H2SO4
CH
H2O
9.
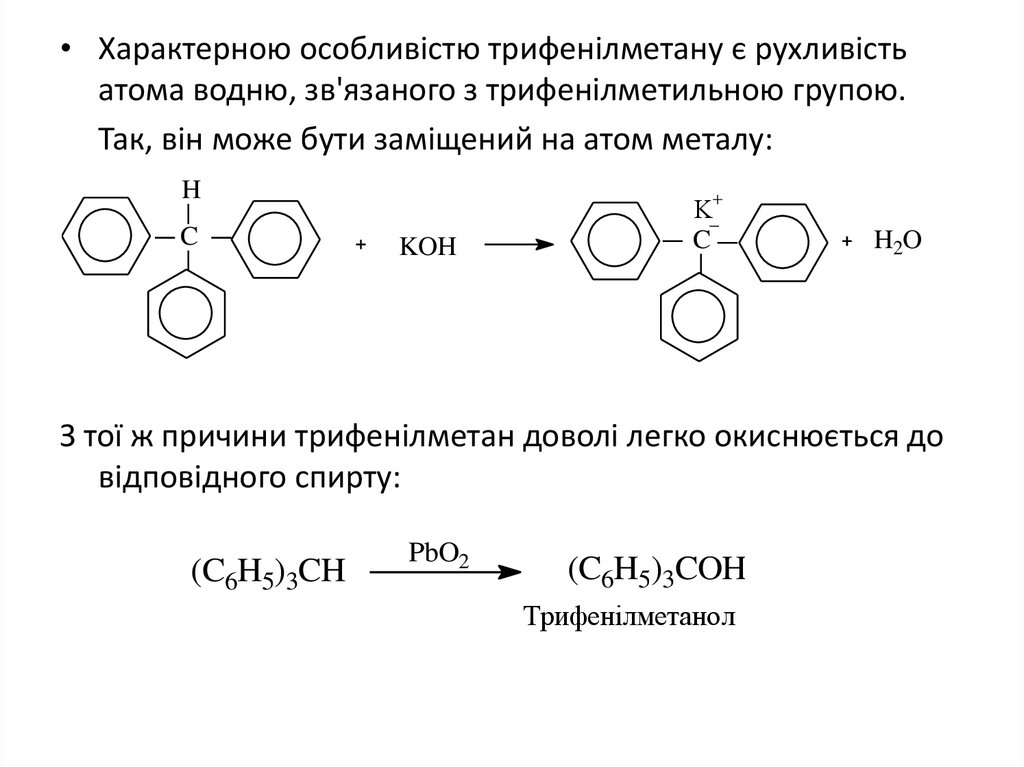
• Характерною особливістю трифенілметану є рухливістьатома водню, зв'язаного з трифенілметильною групою.
Так, він може бути заміщений на атом металу:
H
C
KOH
K
C
H2O
З тої ж причини трифенілметан доволі легко окиснюється до
відповідного спирту:
(C6H5)3CH
PbO2
(C6H5)3COH
Трифенілметанол
10.
• Сполуки трифенілметрильного ряду типу (С6Н5)С—Х легкодисоціюють за рахунок розриву зв’язку С—Х. В залежності
від способу розриву цього зв’язку можуть утворюватись
трифенілметильний радикал (1), трифенілметильний
карбокатіон (2), або трифенілметильний карбаніон (3):
• Легкість такої дисоціації зумовлена високою стабільністю
всіх трьох інтермедіатів (1), (2), (3). Кожен з них має рорбіталь на центральному вуглецевому атомі, яка вступає
у спряження з π-електронними системами трьох
бензенових ядер.
11.
ХC
C
Х
Х
C
Х
1
3
C
2
12.
• Очевидно, що стабілізації вільного радикалу (1) такарбокатіону (2) буде сприяти наявність в о- або пположеннях електронодонорних груп (—NH2, —NR2, —OH),
а стабілізації аніону (3) – наявність електроноакцекпторів
(—NO2, —C≡N, —COOR).
• Трифенілметан - безбарвна сполука. Він легко окиснюється
до спирту, який при взаємодії з кислотами дає забарвлені
солі:
(C6H5)3CH
Трифенілметан
(без кольору)
[O]
(C6H5)3C OH
Трифенілметанол
(без кольору)
HCI
H2O
(C6H5)3C CI
Трифенілхлорометан
сіль (забарвлена
в жовтий колір )
13. Виникнення забарвлення зумовлене утворенням спряженого трифенілметильного карбокатіону.
• Таке явище, коли безбарвна сполука утворює придисоціації забарвлений йон, називається галохромією.
• Ще інтенсивніше забарвлення мають похідні
трифенілметану з електронодонорними замісниками в
бензенових ядрах. Наявність таких замісників поляризує
систему, що підвищує інтенсивність поглинання світла.
Тому деякі похідні трифенілметану використовуються як
органічні барвники.
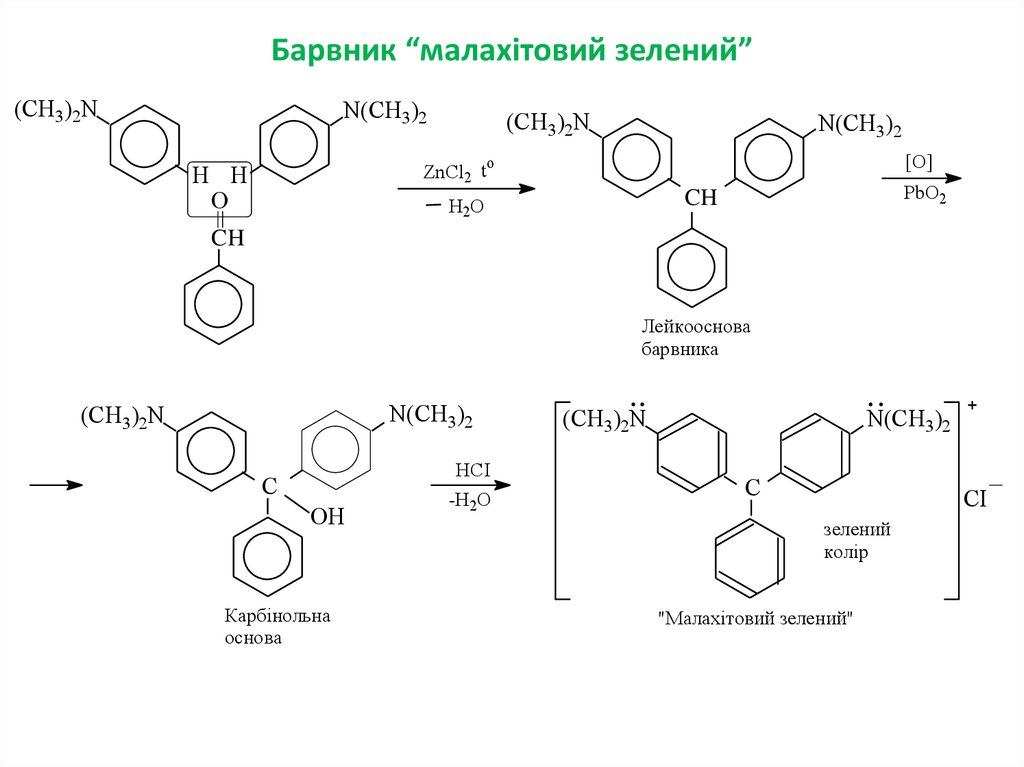
14. Барвник “малахітовий зелений”
(CH3)2NN(CH3)2
(CH3)2N
N(CH3)2
[O]
o
ZnCl2 t
H H
O
PbO2
CH
H2O
CH
Лейкооснова
барвника
N(CH3)2
(CH3)2N
HCI
C
OH
Карбінольна
основа
-H2O
(CH3)2N
N(CH3)2
C
СІ
зелений
колір
"Малахітовий зелений"
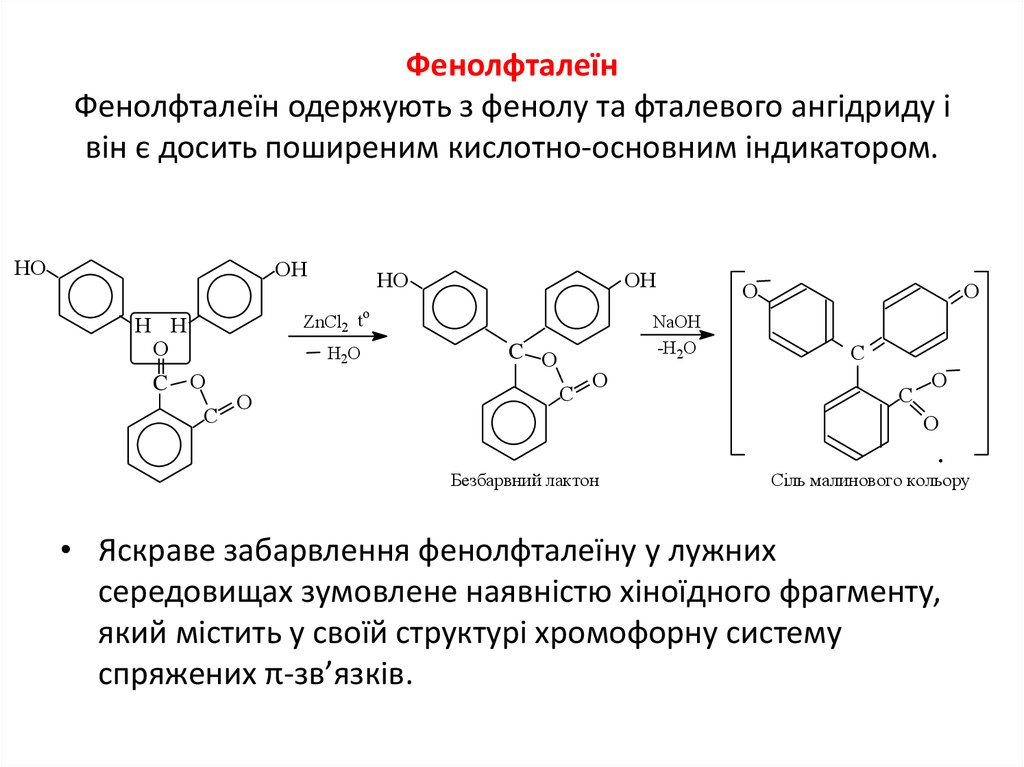
15. Фенолфталеїн Фенолфталеїн одержують з фенолу та фталевого ангідриду і він є досить поширеним кислотно-основним індикатором.
HOOH
OH
o
ZnCl2 t
H H
O
C
HO
H2O
O
C
O
NaOH
-H2O
C O
C
O
O
O
C
C
O
O
Безбарвний лактон
Сіль малинового кольору
• Яскраве забарвлення фенолфталеїну у лужних
середовищах зумовлене наявністю хіноїдного фрагменту,
який містить у своїй структурі хромофорну систему
спряжених π-зв’язків.
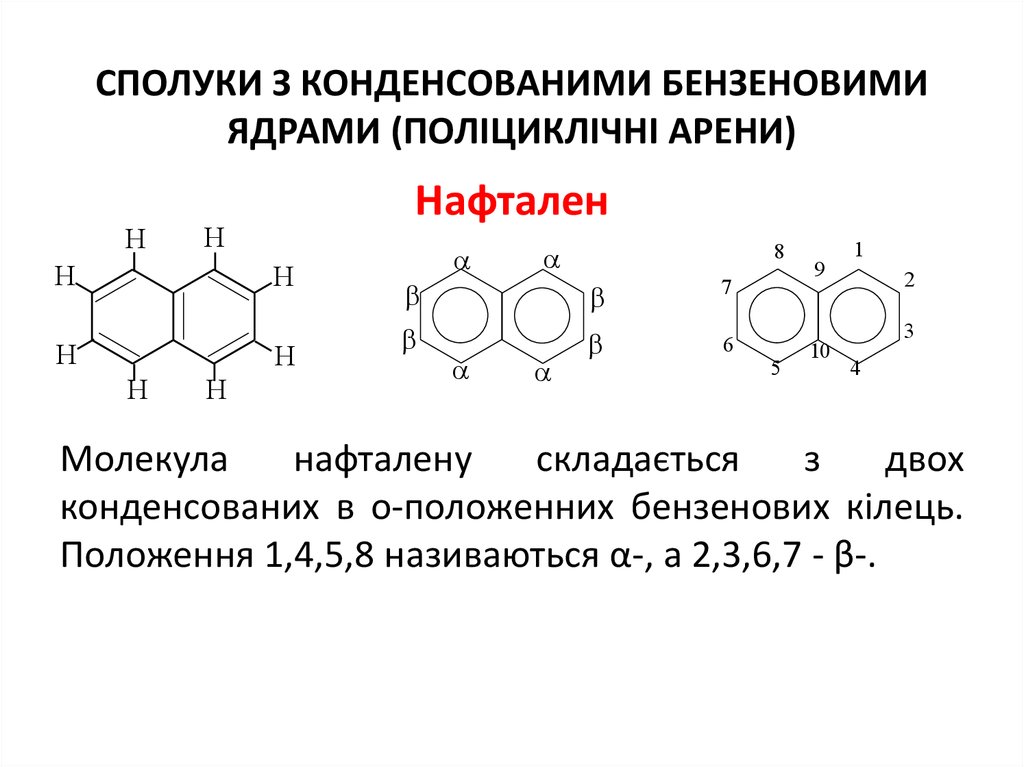
16. СПОЛУКИ З КОНДЕНСОВАНИМИ БЕНЗеновими ЯДРАМИ (ПОЛІЦИКЛІЧНІ АРЕНИ)
СПОЛУКИ З КОНДЕНСОВАНИМИ БЕНЗЕНОВИМИЯДРАМИ (ПОЛІЦИКЛІЧНІ АРЕНИ)
H
Нафтален
H
H
H
H
H
H
H
8
7
6
5
9
10
1
2
3
4
Молекула
нафталену
складається
з
двох
конденсованих в о-положенних бензенових кілець.
Положення 1,4,5,8 називаються α-, а 2,3,6,7 - β-.
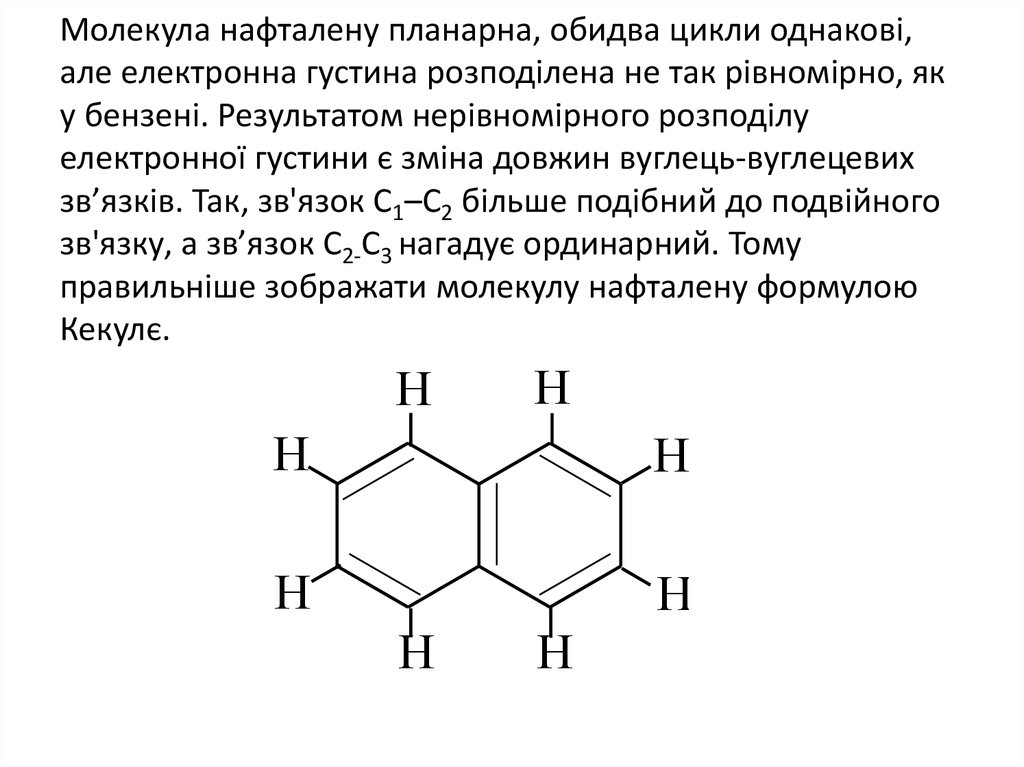
17. Молекула нафталену планарна, обидва цикли однакові, але електронна густина розподілена не так рівномірно, як у бензені.
Результатом нерівномірного розподілуелектронної густини є зміна довжин вуглець-вуглецевих
зв’язків. Так, зв'язок С1–С2 більше подібний до подвійного
зв'язку, а зв’язок С2-С3 нагадує ординарний. Тому
правильніше зображати молекулу нафталену формулою
Кекулє.
H
H
H
H
H
H
H
H
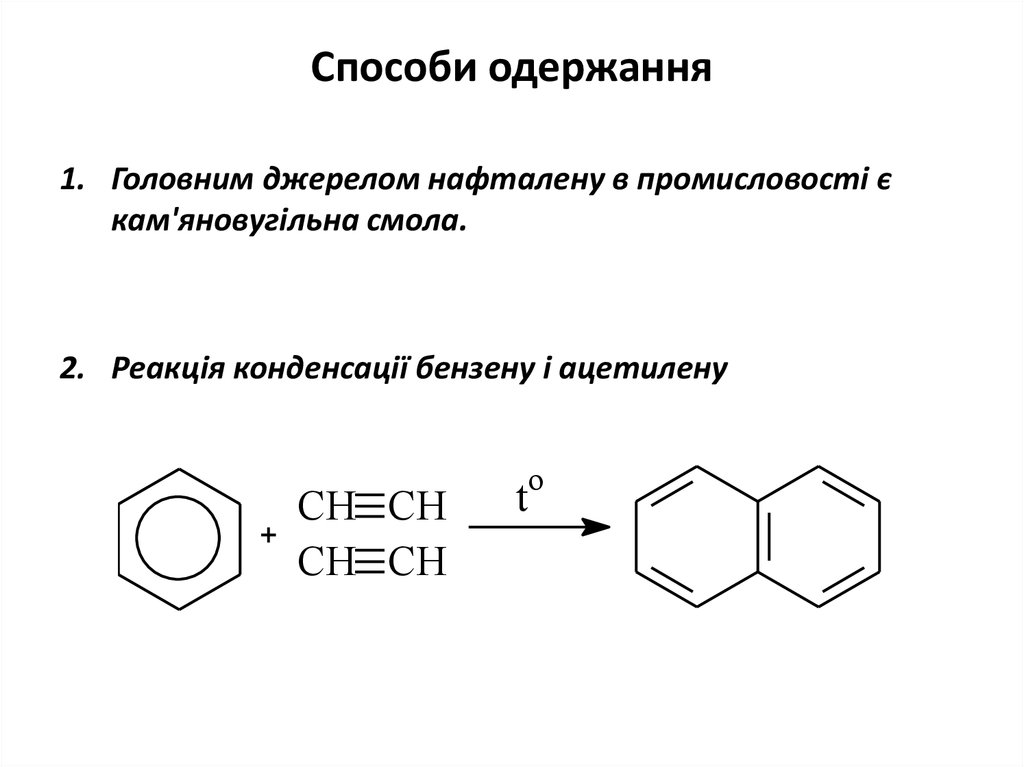
18. Способи одержання
1. Головним джерелом нафталену в промисловості єкам'яновугільна смола.
2. Реакція конденсації бензену і ацетилену
CH CH
CH CH
o
t
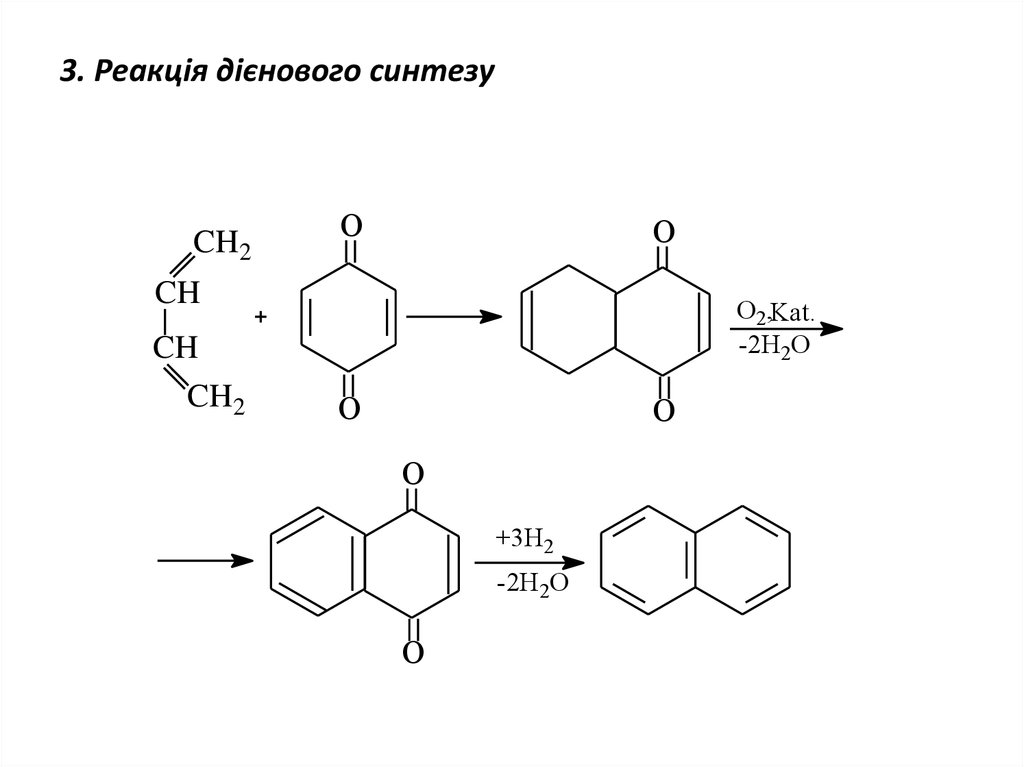
19. 3. Реакція дієнового синтезу
CH2O
O
CH
О2,Kat.
-2H2O
CH
CH2
O
O
O
+3H2
-2H2O
O
20. Хімічні властивості
Для нафталену характерні реакції SE, а такожреакції приєднання, які проходять легше, ніж для
бензену.
Реакції заміщення протікають, переважно за
участю α-вуглецевого атома. Це зв'язано з тим,
що у випадку утворення α-похідного проміжний
σ-комплекс стійкіший, ніж σ-комплекс за участю
β-вуглецю. σ-Комплекс при α-заміщенні має
ароматичну структуру, яка стабілізує позитивний
заряд краще, ніж хіноїдна структура σ-комплексу
у випадку β-заміщення.
21.
НН
Е
Е
-Комплекс
Е
Е
-Комплекс
H
Е
-Комплекс
H
Е
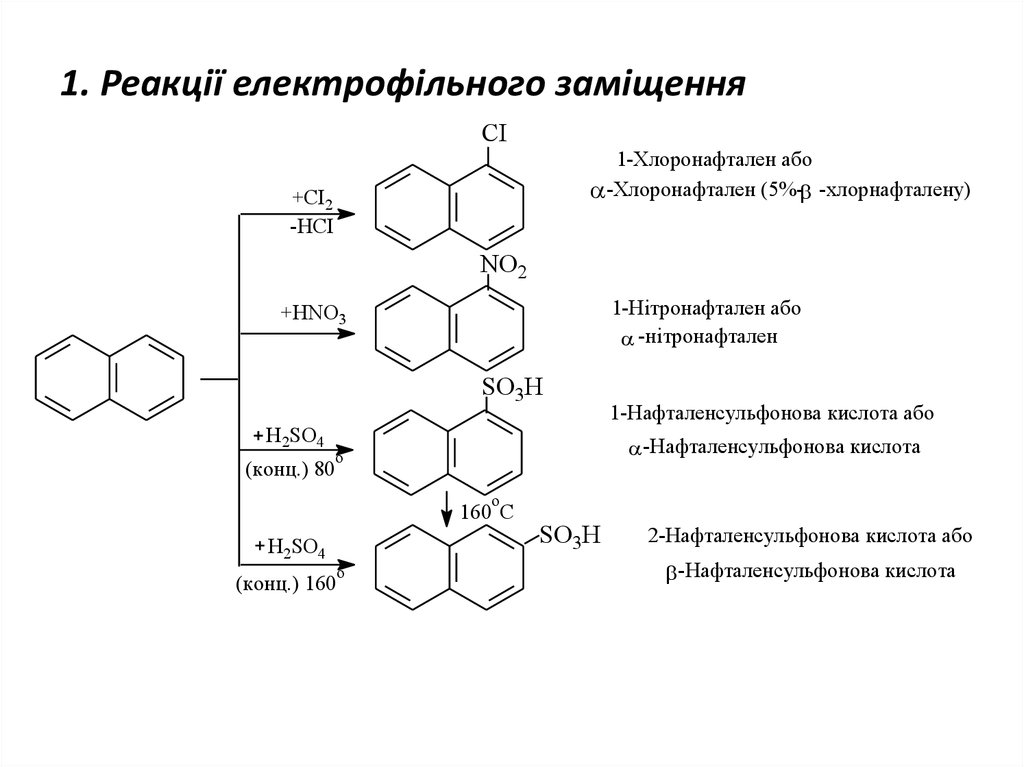
22. 1. Реакції електрофільного заміщення
CI1-Хлоронафтален або
-Хлоронафтален (5%- -хлорнафталену)
+CI2
-HCI
NO2
1-Нітронафтален або
-нітронафтален
+HNO3
SO3H
H2SO4
(конц.) 80
1-Нафталенсульфонова кислота або
-Нафталенсульфонова кислота
о
o
160 C
H2SO4
(конц.) 160
о
SO3H
2-Нафталенсульфонова кислота або
-Нафталенсульфонова кислота
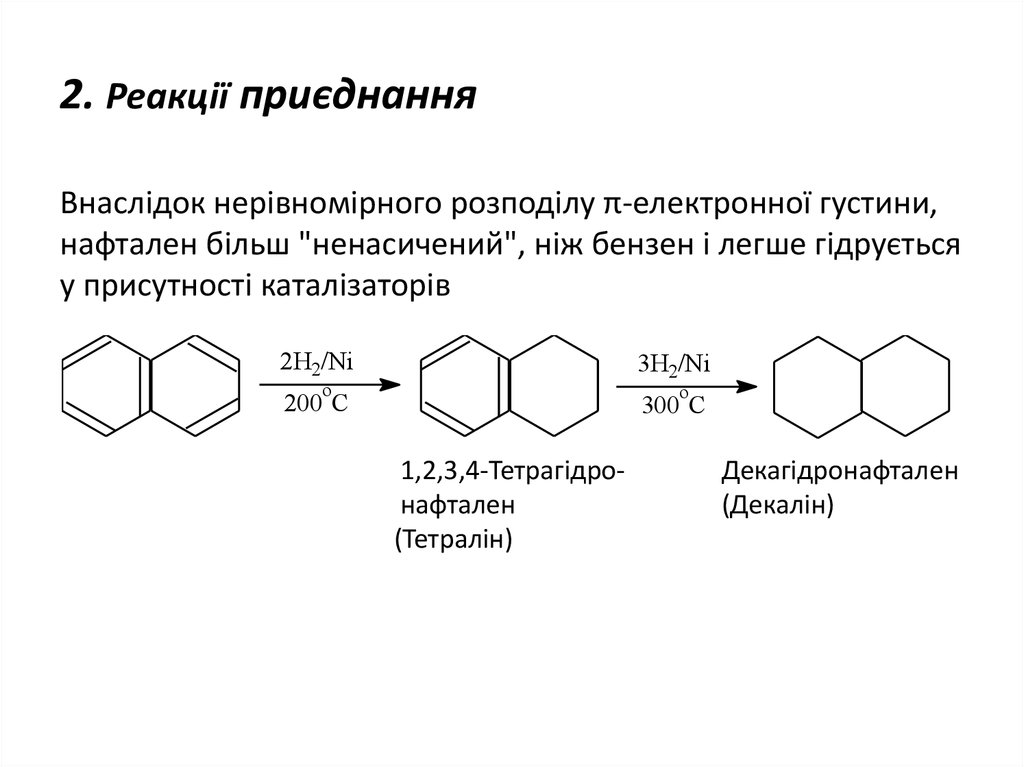
23. 2. Реакції приєднання
Внаслідок нерівномірного розподілу π-електронної густини,нафтален більш "ненасичений", ніж бензен і легше гідрується
у присутності каталізаторів
2H2/Ni
3H2/Ni
200 C
300 C
o
o
1,2,3,4-Тетрагідронафтален
(Тетралін)
Декагідронафтален
(Декалін)
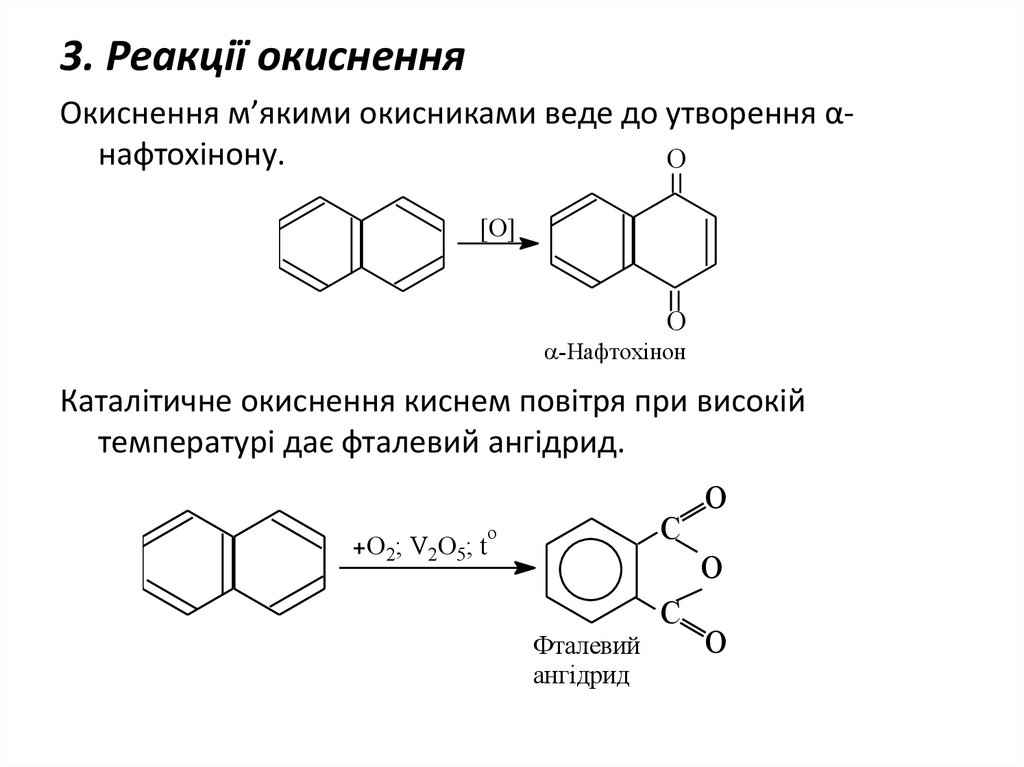
24. 3. Реакції окиснення
Окиснення м’якими окисниками веде до утворення αнафтохінону.O
[O]
O
-Нафтохінон
Каталітичне окиснення киснем повітря при високій
температурі дає фталевий ангідрид.
C
o
O2; V2O5; t
O
O
C
Фталевий
ангідрид
O
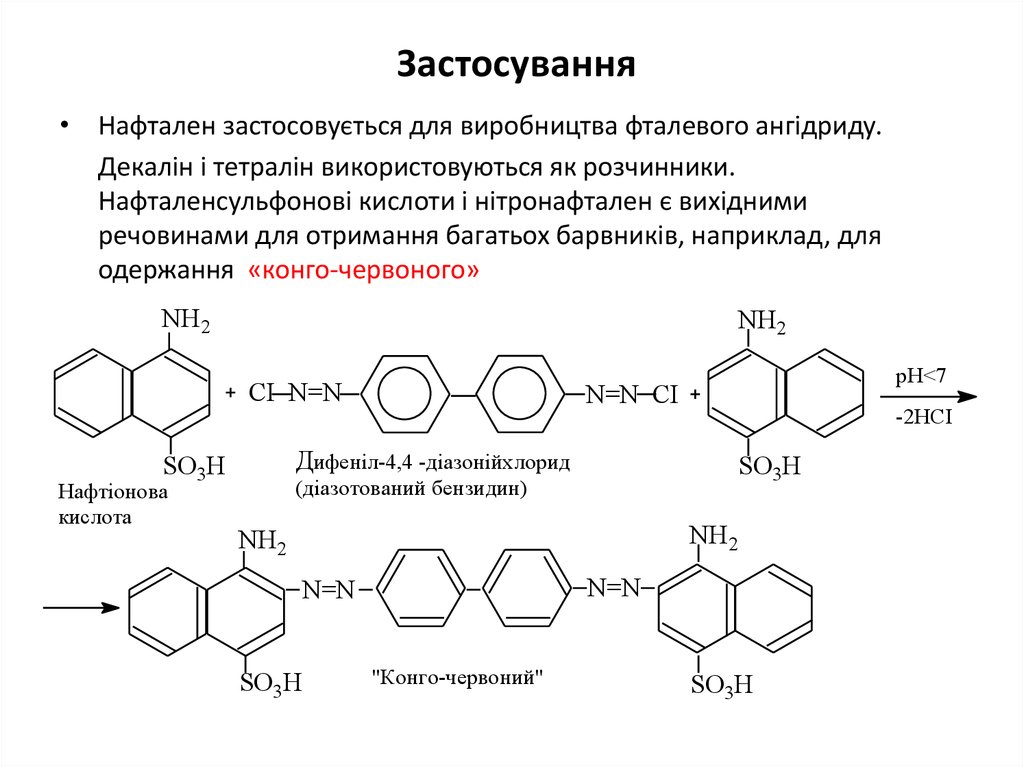
25. Застосування
• Нафтален застосовується для виробництва фталевого ангідриду.Декалін і тетралін використовуються як розчинники.
Нафталенсульфонові кислоти і нітронафтален є вихідними
речовинами для отримання багатьох барвників, наприклад, для
одержання «конго-червоного»
NH2
NH2
CI N=N
-2HCI
Дифеніл-4,4 -діазонійхлорид
SO3H
Нафтіонова
кислота
pH<7
N=N CI
SO3H
(діазотований бензидин)
NH2
NH2
N=N
N=N
SO3H
"Конго-червоний"
SO3H
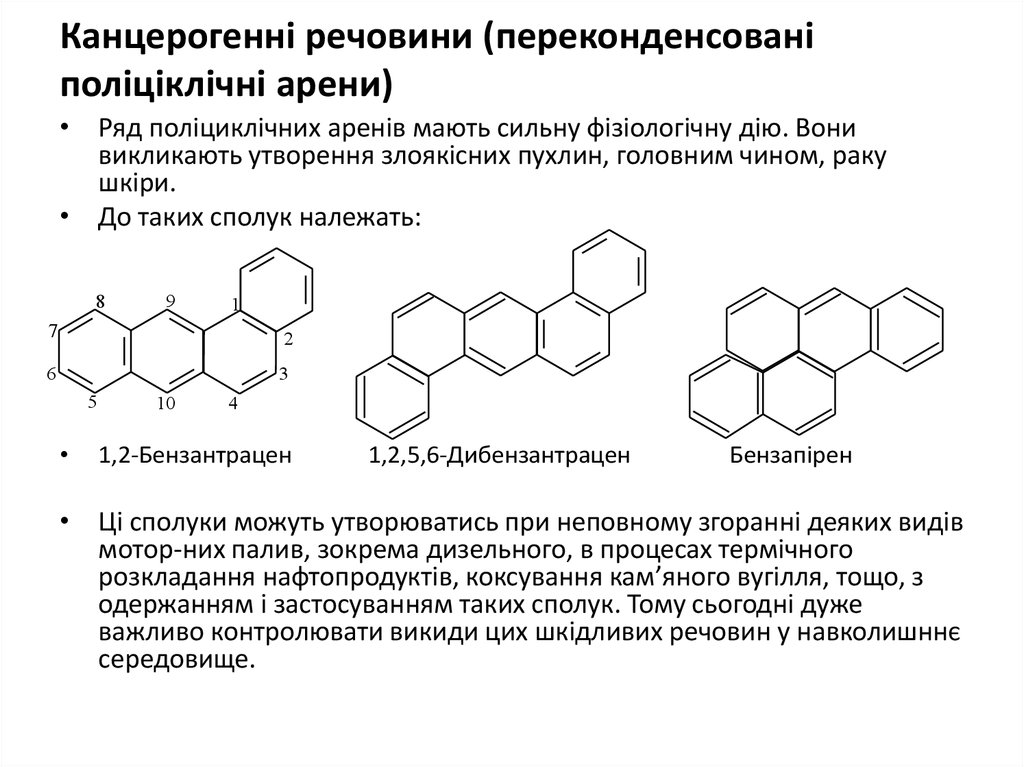
26. Канцерогенні речовини (переконденсовані поліціклічні арени)
• Ряд поліциклічних аренів мають сильну фізіологічну дію. Вонивикликають утворення злоякісних пухлин, головним чином, раку
шкіри.
• До таких сполук належать:
8
9
1
7
2
6
3
5
10
4
1,2-Бензантрацен
1,2,5,6-Дибензантрацен
Бензапірен
• Ці сполуки можуть утворюватись при неповному згоранні деяких видів
мотор-них палив, зокрема дизельного, в процесах термічного
розкладання нафтопродуктів, коксування кам’яного вугілля, тощо, з
одержанням і застосуванням таких сполук. Тому сьогодні дуже
важливо контролювати викиди цих шкідливих речовин у навколишннє
середовище.







 Химия
Химия








