Похожие презентации:
Методи добування у промисловості
1. МЕТОДИ ДОБУВАННЯ У ПРОМИСЛОВОСТІ 1. Головними джерелами алканів є природний газ і нафта.
МЕТОДИ ДОБУВАННЯ УПРОМИСЛОВОСТІ
1. Головними джерелами алканів
є природний газ і нафта.
2. 2. Гідрування вугілля (метод Ф.Бергіуса, 1925).
450 o Cn C + (n +1) H2
CnH2n+2
• 3. Метод Фішера-Тропша (із синтез-газу).
CH4 + H2O
CO
CH4 + CO2
2 CO
2 CH4 + O2
+
3 H2
+
2H2
2CO + 4 H2
o
n CO
+
(2n + 1)H2
Fe-Co,300 C
CnH2n+2
+
n H2O
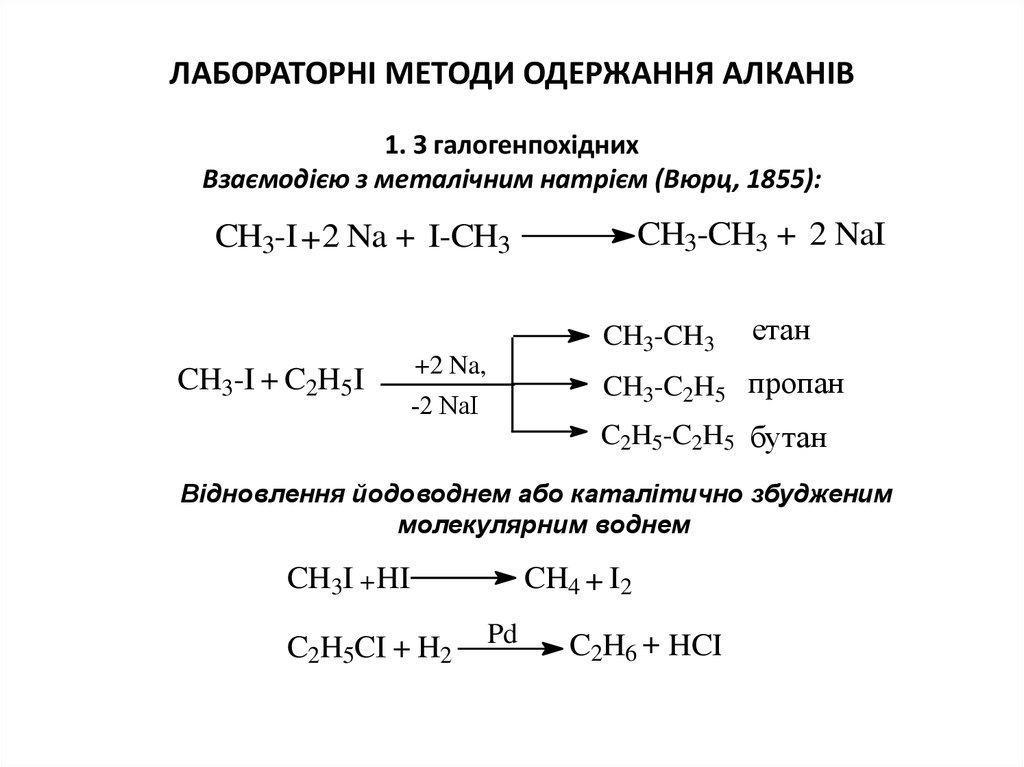
3. ЛАБОРАТОРНІ МЕТОДИ ОДЕРЖАННЯ АЛКАНІВ 1. З галогенпохідних Взаємодією з металічним натрієм (Вюрц, 1855):
ЛАБОРАТОРНІ МЕТОДИ ОДЕРЖАННЯ АЛКАНІВ1. З галогенпохідних
Взаємодією з металічним натрієм (Вюрц, 1855):
CH3-CH3 + 2 NaI
CH3-I +2 Na + I-CH3
CH3-CH3
CH3-I + C2H5 I
+2 Na,
етан
CH3-C2H5 пропан
-2 NaI
C2H5-C2H5 бутан
Відновлення йодоводнем або каталітично збудженим
молекулярним воднем
CH3I + HI
C2H5CI + H2
CH4 + I2
Pd
C2H6 + HCI
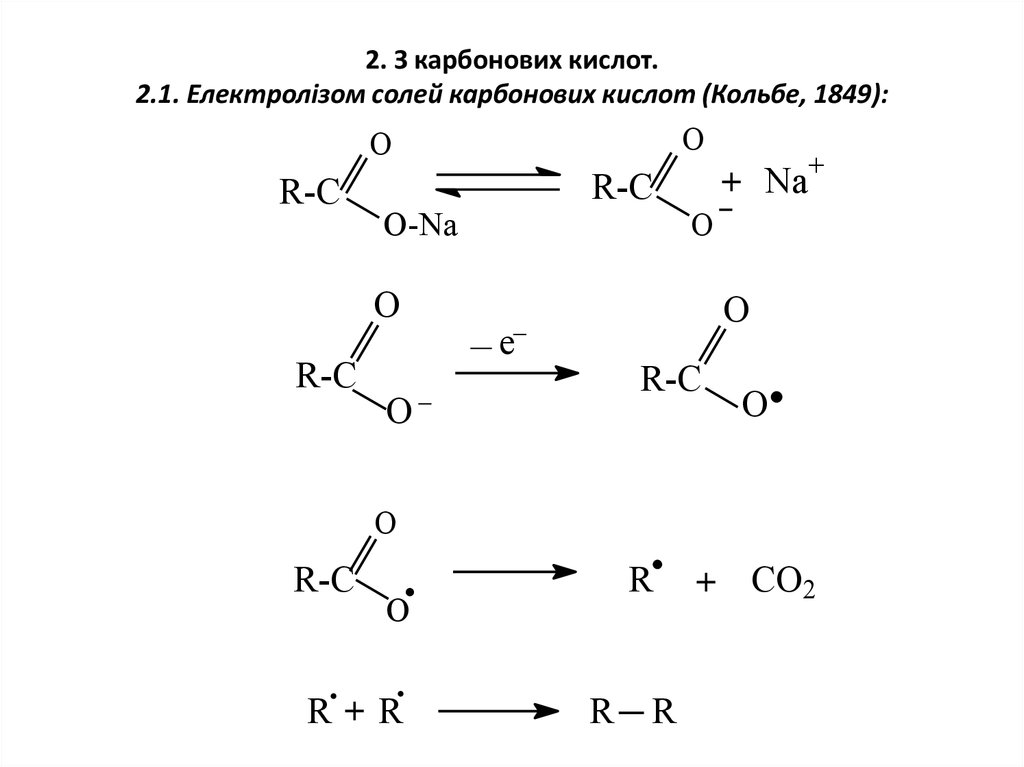
4. 2. З карбонових кислот. 2.1. Електролізом солей карбонових кислот (Кольбе, 1849):
OO
R-C
O-Na
O
R-C
R-C
+ Na+
O
O
e
R-C
O
O
O
R-C
R
O
R+R
R
R
+ CO2
5. 2.2. Піроліз солей карбонових кислот у присутності твердого лугу:
OCH3 C
+ Na OH
ONa
0
300 C
Na2CO3 + CH4
• 3. Каталітичне гідрування ненасичених вуглеводнів.
CH2 CH2 + H2
CH CH + 2 H2
Pt, Ni
Pt, Ni
CH3-CH3
CH3-CH3
6. ХІМІЧНІ ВЛАСТИВОСТІ
• Атоми вуглецю в алканах перебувають в sp3-гібридномустані та зв`язані між собою тільки σ-зв`язками. Крім σ (CC)-зв`язків існують і σ (C-H)-зв`язки, утворені за рахунок
sp3-гібридних орбіталей атома вуглецю та s-орбіталі
атома водню. Отже, за своєю природою алкани повністю
насичені сполуки і не вступають у реакції приєднання.
Що стосується їх реакційної здатності, то вони досить
інертні і не взаємодіють за нормальних умов з
кислотами, лугами, окиснювачами, активними металами.
7. Таким чином, насичений характер алканів зумовлює можливість протікання наступних типів реакцій:
• 1) реакцій заміщення водню (S);• 2) реакцій розщеплення молекули (за зв’язками
С—С або С—Н);
• 3) реакцій ізомеризації.
• В окрему групу можна виділити реакції
окиснення.
Оскільки як С—С, так і С—Н-зв’язки
характеризуються незначною полярністю, алкани
неохоче вступають в йонні реакції. Найбільш
характерними для них є радикальні реакції.
8.
• Величина енергії σ-зв‘язку С—С складає 314-368кДж/моль, а σ-зв’язку С—Н 375-425 кДж/моль. Однак,
частіше розриваються більш стійкі С—Н-зв‘язки, тому що
вони доступніші для атаки реагентів. Реакційна здатність
С—Н-зв‘язку зменшується при переході від третинних до
первинних атомів вуглецю.
CH
CH3
CH3
H
425
кДж/моль
CH3 CH2 H
406
CH3 CH H
395
3
CH3 C
H
CH3
375
• Наочно видно, що вільнорадикальні реакції протікають
переважно з розривом С―Н-звязку біля третинного атому
вуглецю (цей зв’язок характеризується найменшою
енергією), далі – біля вторинного і, в останню чергу, — біля
первинного.
9. Реакції заміщення (S).
Реакції заміщення (S).
1. Галогенування.
Швидкість взаємодії з галогенами знижується в ряді:
F > Cl > Br > I.
Взаємодія з фтором протікає з вибухом, хлор реагує при температурі
250-400oС або при опромінюванні УФ-світлом, бромування протікає в
250.000 разів повільніше від хлорування, і також потребує нагріву, а з
йодом алкани практично не реагують
• 1.1. Фторування
CH4 + 2 F2
C + 4HF
Реакція фторування сильно екзотермічна, тому її важко
Контролювати і вона часто закінчується вибухом. У промисловості для
уникнення вибуху фтор розбавляють азотом і проводять реакцію в
розчиннику — фторованому алкані. Але і в цьому випадку реакція
завершується вичерпним фторуванням:
CH4 + 4 F2
N2, фтороалкан
CF4 + 4HF
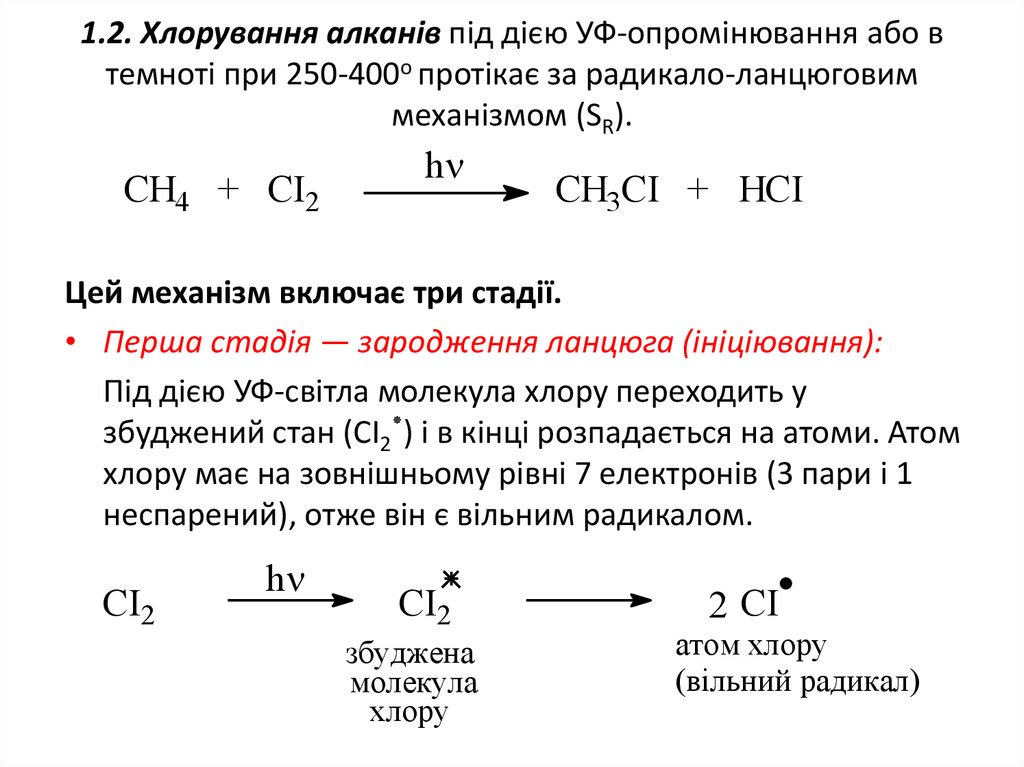
10. 1.2. Хлорування алканів під дією УФ-опромінювання або в темноті при 250-400о протікає за радикало-ланцюговим механізмом (SR).
CH4 + CI2h
CH3CI + HCI
Цей механізм включає три стадії.
• Перша стадія — зародження ланцюга (ініціювання):
Під дією УФ-світла молекула хлору переходить у
збуджений стан (СІ2 )٭і в кінці розпадається на атоми. Атом
хлору має на зовнішньому рівні 7 електронів (3 пари і 1
неспарений), отже він є вільним радикалом.
СI2
h
СI2
збуджена
молекула
хлору
2 СI
атом хлору
(вільний радикал)
11. Друга стадія — ріст ланцюга полягає у взаємодії атомарного хлору з метаном. Ця стадія є найповільнішою і тому визначає
швидкість процесу вцілому. Утворенийметильний вільний радикал далі взаємодіє з молекулою
хлору, даючи хлорометан і новий атом хлору, що продовжує
процес.
CH3 H + CI
CH3 + СI2
CH3 + HCI
CH3CI + CI
і так далі
Трея стадія — обрив ланцюга здійснюється при рекомбінації
(сполученні) двох будь-яких вільних радикалів.
CI + CI
СI2
CH3 + CH3
CH3-CH3
CI
CH3Cl
+ CH3
12.
CH4СI2
CH3 CI
HCI
СI2
HCI
СI2
CH2CI2
HCI
CHCI3
СI2
HCI
CCI4
Найлегше галогеном заміщається водень біля третинного атому
вуглецю, полім – біля вторинного і, найважче, — біля
первинного. Тобто, реакція протікає регіоселективно.
2-Метилпропан
CH3
CH3
CH3
CH
CH3
2-Метил-1-хлоропропан
2-Метил-2-хлоропропан
+
CI2
HCl
CH3 C CH3
CH3
+
CH3 CH CH2 Cl
Cl
Співвідношення швидкостей заміщення водню біля первинного,
вторинного і третинного атомів вуглецю можна оцінити як 1:4:5
— при хлоруванні і як 1:200:2000 — при бромуванні. Отже,
бромування протікає хоча і повільніше, але з більшою
регіоселективністю.
13. 2. Нітрування. Процес нітрування полягає у введенні в сполуку нітрогрупи (―NO2). Для цього найчастіше використовують нітратну
кислоту (HNO3).Концентрована нітратна киcлота, діє на алкани тільки при
високій температурі і, виключно, як окиснювач. У 1888 р
М.Коновалов запропонував застосовувати для нітрування
алканів розведену (10-14 %) нітратну кислоту при
температурі її кипіння.
10-14% HNO3 , 140 C
0
CH3 CH2 CH2 CH3 + HO NO2
CH3-CH CH2-CH3 + H2O
NO2
2-Нітробутан
14. При нітруванні інших алканів легкість заміщення водню у вуглецевих атомів, як і при галогенуванні зростає в ряді: первинний
< вторинний < третиннийЧасто процес супроводжується розривом зв‘язків
С—С, що видно з аналізу складу продуктів нітрування
пропану:
CH3 CH2 CH3
NO2
400
0
CH3 CH CH3 + CH3 CH2 CH2 NO2 +
32%
NO
2
33%
1-Нітропропан
2-Нітропропан
+ CH3 CH2 NO2 + CH3 NO2
25%
9%
Нітроетан
Нітрометан
15. 3. Реакції сульфохлорування та сульфоокиснення.
• Алкани за звичайних умов стійкі до дії сульфатної кислоти.При нагріванні сульфатна кислота виступає як окиснювач.
Тому перспективними методоми одержання
сульфопохідних є сульфохлорування і сульфоокиснення.
• Сульфохлорування.
CH3 CH2 CH3 + SO2 + CI2
hv
CH3 CH 2 CH2 SO2CI + HCl
Пропансульфохлорид
16.
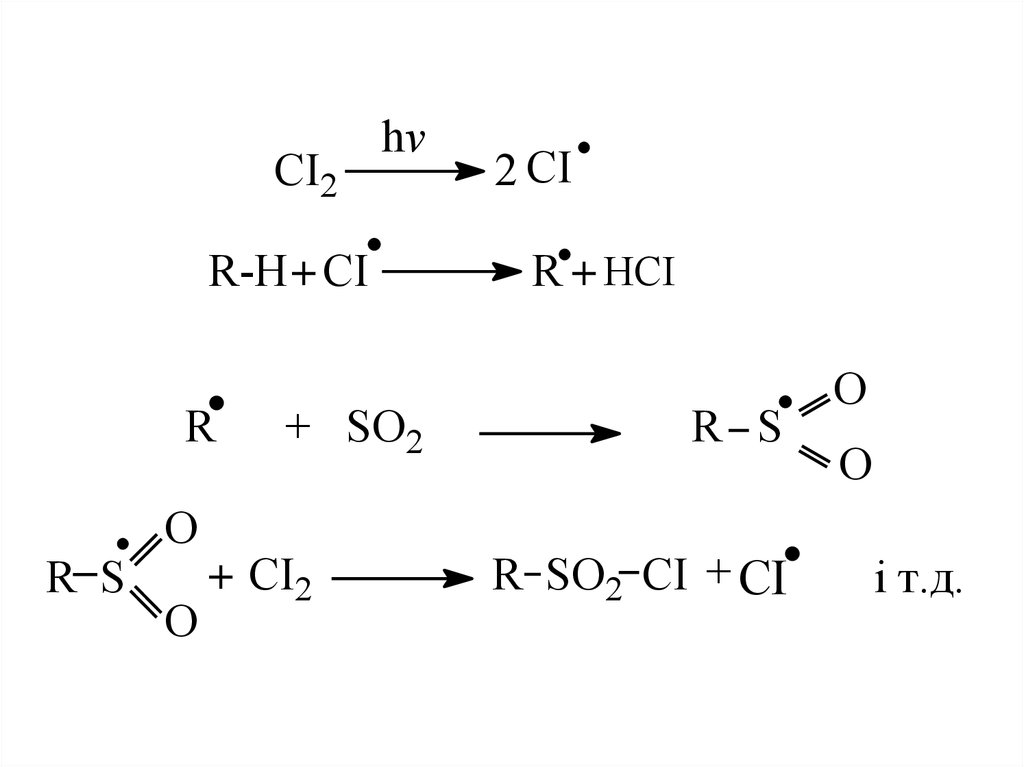
СI2hv
R-H + CI
R
R S
O
O
+ SO2
+ СI2
2 CI
R + HCI
R S
R SO2 CI + CI
O
O
і т.д.
17.
• У реакцію фотохімічного сульфохлорування вступають всівуглеводні, починаючи з метану, при кімнатній
температурі.
• Атоми водню, що зв’язані з вторинними вуглецевими
атомами заміщуються легше ніж ті, що зв’язані з
первинними. Водні біля третинного вуглецю на
сульфохлоридну групу не заміщуються, мабуть внаслідок
просторових труднощів.
• Алкансульфохлориди при взаємодії з лугами утворюють
солі сульфокислот, які застосовують, як миючі засоби і
поверхнево-активні речовини (ПАР).
R SO2CI
2 Na OH
R SO2 O Na
Натрій алкілсульфонат
NaCI
H2O
18. Сульфоокиснення застосовується для одержання алкансульфокислот.
2R H2 SO2 O2
2 R SO2OH
Алкансульфокислота
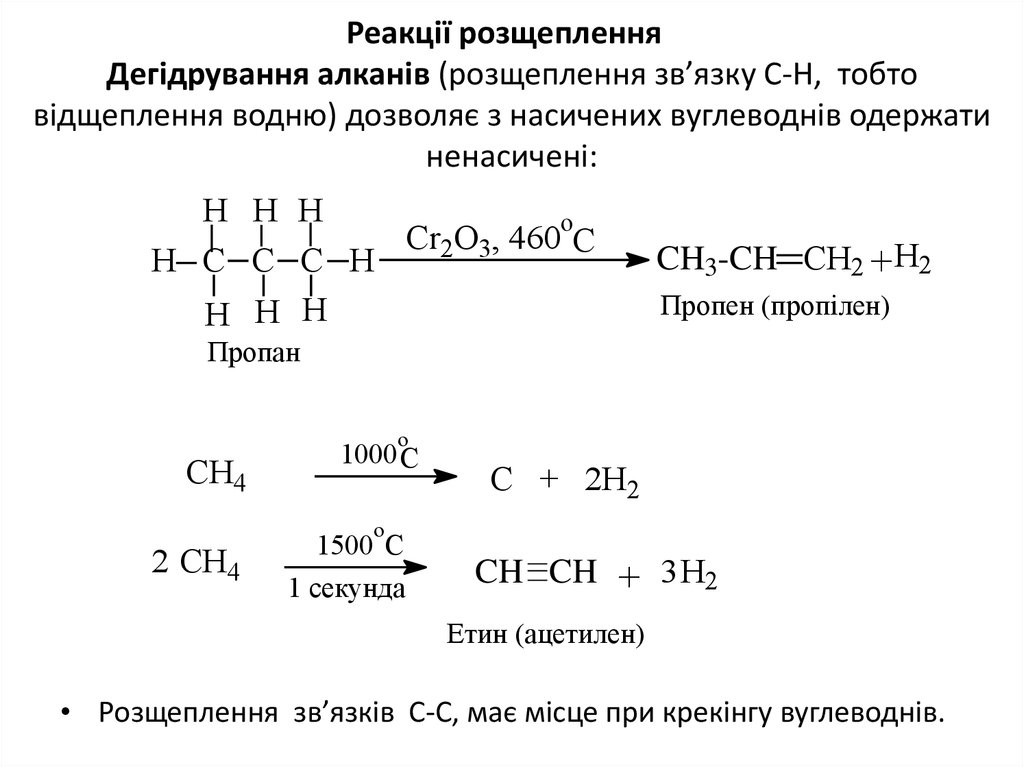
19. Реакції розщеплення Дегідрування алканів (розщеплення зв’язку С-Н, тобто відщеплення водню) дозволяє з насичених вуглеводнів
Реакції розщепленняДегідрування алканів (розщеплення зв’язку С-Н, тобто
відщеплення водню) дозволяє з насичених вуглеводнів одержати
ненасичені:
H H H
o
Cr2O3, 460 C
H C C C H
H H H
CH3-CH CH2 +H2
Пропен (пропілен)
Пропан
o
СН4
2 СН4
1000 C
С + 2Н2
o
1500 С
1 секунда
CH CH + 3 H2
Етин (ацетилен)
• Розщеплення зв’язків С-С, має місце при крекінгу вуглеводнів.
20. Крекінг алканів Крекінгом називається термічне перетворення алканів при температурі 470-540оС. Розрізняють термічний і
каталітичний крекінг.• 2.1. Термічний крекінг. Буває рідкофазний та газофазний. Це
вільнорадикальний процес, в результаті якого утворюються, як
правило суміш насичених і ненасичених вуглеводнів.
• При температурі 470-550o алкани розкладаються на вільні радикали,
які, в свою чергу, здатні піддаватись подальшим перетворенням.
o
СН3 СН2 СН2 СH2 CH2 CH2 CH3
СН3 СН2 СН2 СH2 CH2
t
СН3 СН2 СН2 СH2 CH2
CH3 CH2 CH2
СН2 CH3
[CH2 CH2]
Нестійкий
бірадикал
СН2 СН2
21. Реакція диспропорціонування — це реакція β-розпаду за С—Н-зв’язком. Але атомарний водень, що утворився би в результаті цієї
реакції має дужевисоку енергію і тому його відщеплення може протікати тільки при
взаємодії з іншим вільним радикалом, який приєднує цей атом водню. В
результаті утворюється ненасичений і насичений вуглеводні
СН3
H
СH CH2
СН2 СН2 СН3
СН3 СH CH2
CH3 CH2 CH3
Пропен
Пропан
• Каталітичний крекінг застосовують, головним чином, з метою
одержання розгалужених алканів та алкенів. Процес проходить у
присутності алюмосилікатних каталізаторів або AlCl3 при 450-530оС.
• Одержані за допомогою каталітичного крекінгу розгалужені
вуглеводні є цінними високооктановими бензинами.
22. Окиснення алканів Такі традиційні окисники, як KMnO4, K2Cr2O7 тощо на алкани, переважно, не діють Алкани окиснюються киснем
ОКИСНЕННЯ АЛКАНІВТакі традиційні окисники, як KMnO4, K2Cr2O7 тощо на алкани,
переважно, не діють Алкани окиснюються киснем повітря
при 110-190о в присутності кобальтового каталізатора. Це так
зване аутоокиснення алканів. Механізм реакції
вільнорадикальний.
• При окисненні алканів утворюються, в основному,
карбонові кислоти з домішками кетонів та спиртів.
• Промислове значення має процес окиснення бутану в
оцтову кислоту
о
CH3 СН2 СН2 СН3 + 2,5 О2
130
кат.
O
2 CH3 C OH
Н2О
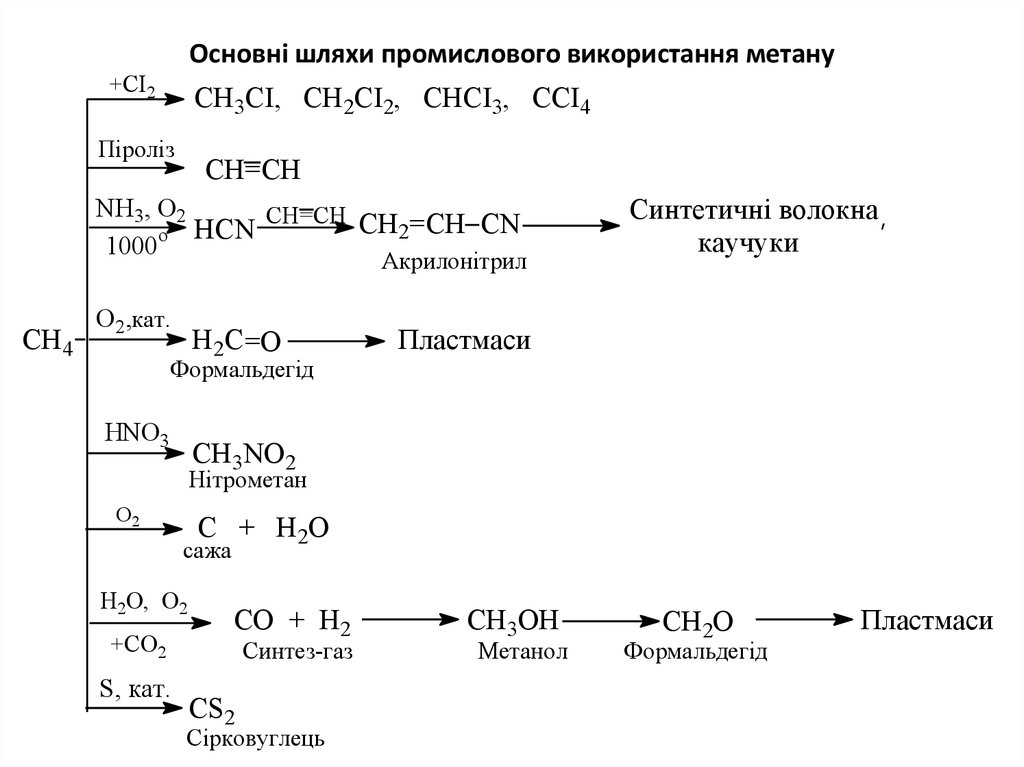
23. Основні шляхи промислового використання метану
+CI2CH3CI, CH2CI2, CHCI3, CCI4
Піроліз
CH=CH
NH3, O2
CH=CH CH =CH CN
2
o HCN
1000
Акрилонітрил
CH4
O2,кат.
Н2С =О
Синтетичні волокна ,
каучуки
Пластмаси
Формальдегід
HNO3
CH3NO2
Нітрометан
O2
C + H2O
сажа
H2O, O2
+CO2
S, кат.
CO + H2
Синтез-газ
CS2
Сірковуглець
CH3OH
Метанол
CH2O
Формальдегід
Пластмаси

















 Химия
Химия








