Похожие презентации:
Азотовмисні та елементоорганічні сполуки
1.
ЛекціяАЗОТОВМИСНІ ТА ЕЛЕМЕНТООРГАНІЧНІ
СПОЛУКИ
План.
1.Нітросполуки. Їх властивості та застосування.
2.Аміни. Фізичні та хімічні властивості аліфатичних
амінів.
3.Амінокислоти як мономери білків.
4.Елементоорганічні сполуки та їх
пожежобезпечність.
2.
Нітросполуки - це сполуки, що містять усвоєму складі, одну або кілька нітрогруп
NO2 (беруть участь у побудові біополімерів –
білків та нуклеїнових кислот, без яких неможливе
існування живої матерії).
Назву нітросполук за систематичною номенклатурою
утворюють з назви відповідного насиченого
вуглеводню, додаючи до неї префікс нітро-.
Місцеположення нітрогрупи в молекулі зазначають
цифрою.
3
2
1
2
1
Н3С – СН2 – СН2 – NO2 – 1– Нітропропан,
3
4
Н3С – СН – СН2 – СН3 – 2 – Нітробутан і т.д.
NO2
3.
Нітросполуки аліфатичного ряду добуваютьнітруванням алканів, а також взаємодією йод – і
бромалканів з нітритом аргентума:
Тo, Р
СН3 – СН3 + HNO3(розч.)
СН3 – СН2 – NO2 +H2O
СН3 – СН2 – J + AgNO2 СН3 – СН2 – NO2 + AgJ
Нітросполуки класифікують залежно від
гібридизації атома вуглецю, з яким сполучена
нітрогрупа, на первинні R – CH2 – NO2,
R1 – CH – NO2
R2
вторинні,
R2
R1 – C – NO2
R3
третинні
4.
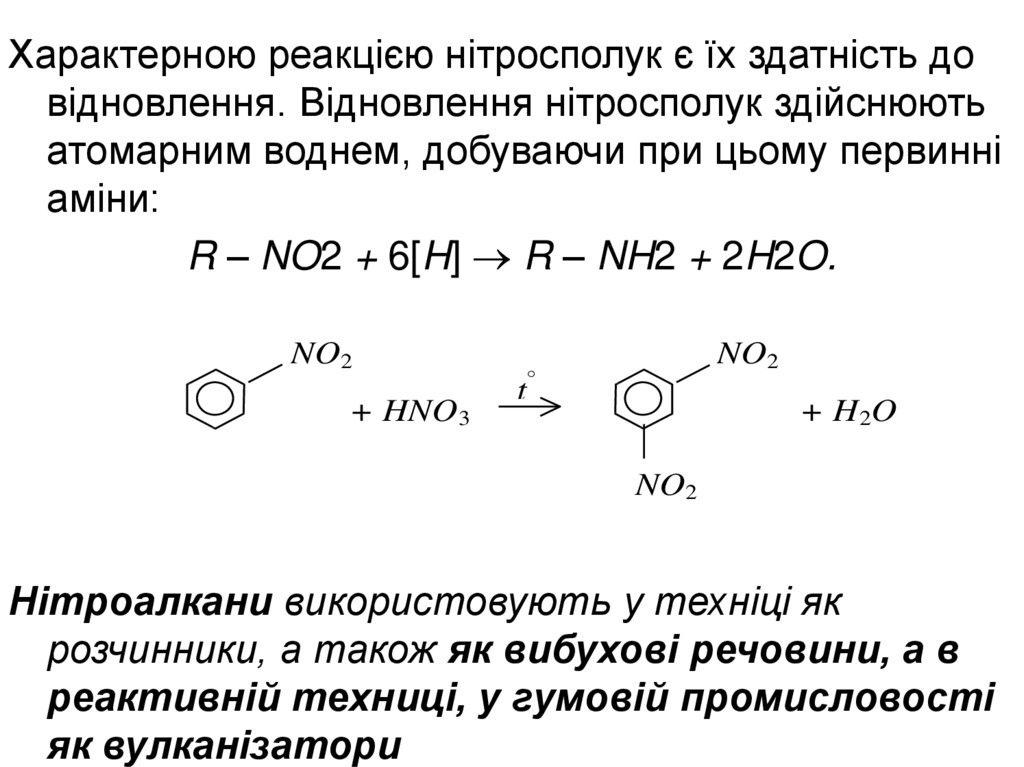
Характерною реакцією нітросполук є їх здатність довідновлення. Відновлення нітросполук здійснюють
атомарним воднем, добуваючи при цьому первинні
аміни:
R – NO2 + 6[H] R – NH2 + 2H2O.
NO2
+ HNO3
NO2
t
+ H 2O
NO2
Нітроалкани використовують у техніці як
розчинники, а також як вибухові речовини, а в
реактивній техниці, у гумовій промисловості
як вулканізатори
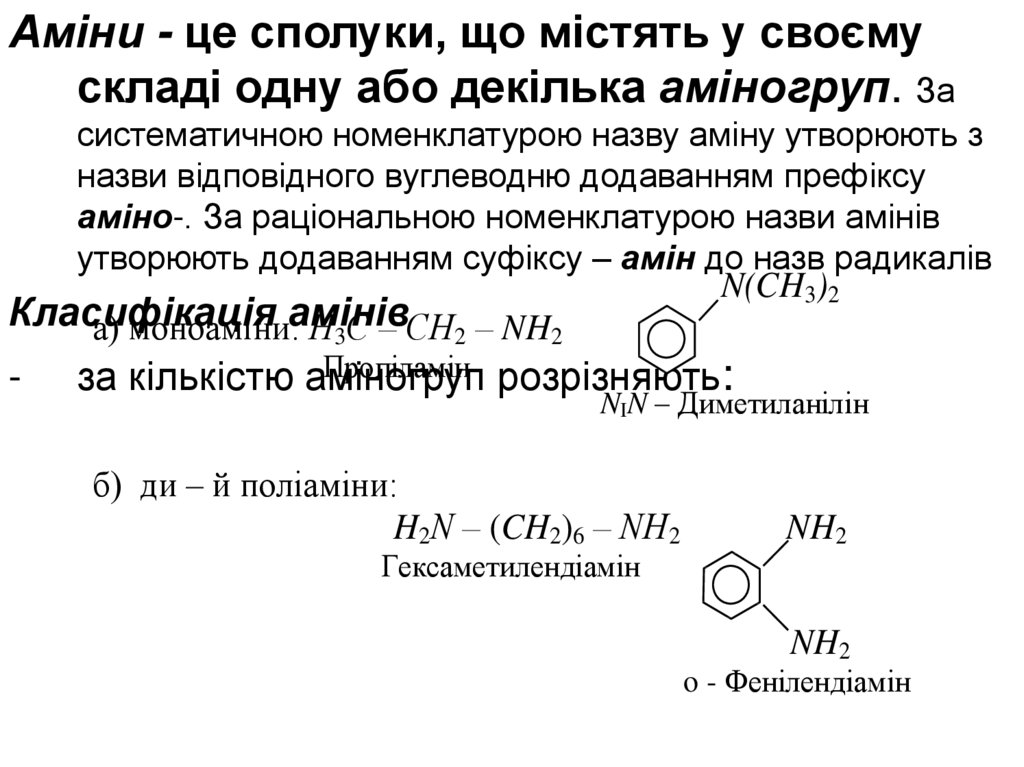
5.
Аміни - це сполуки, що містять у своємускладі одну або декілька аміногруп. За
систематичною номенклатурою назву аміну утворюють з
назви відповідного вуглеводню додаванням префіксу
аміно-. За раціональною номенклатурою назви амінів
утворюють додаванням суфіксу – амін до назв радикалів
N(CH3)2
Класифікація
а) моноаміни:амінів
Н3С – СН2 – NH2
-
Пропіламін розрізняють:
за кількістю аміногруп
NIN – Диметиланілін
б) ди – й поліаміни:
H2N – (CH2)6 – NH2
Гексаметилендіамін
NH2
NH2
o - Фенілендіамін
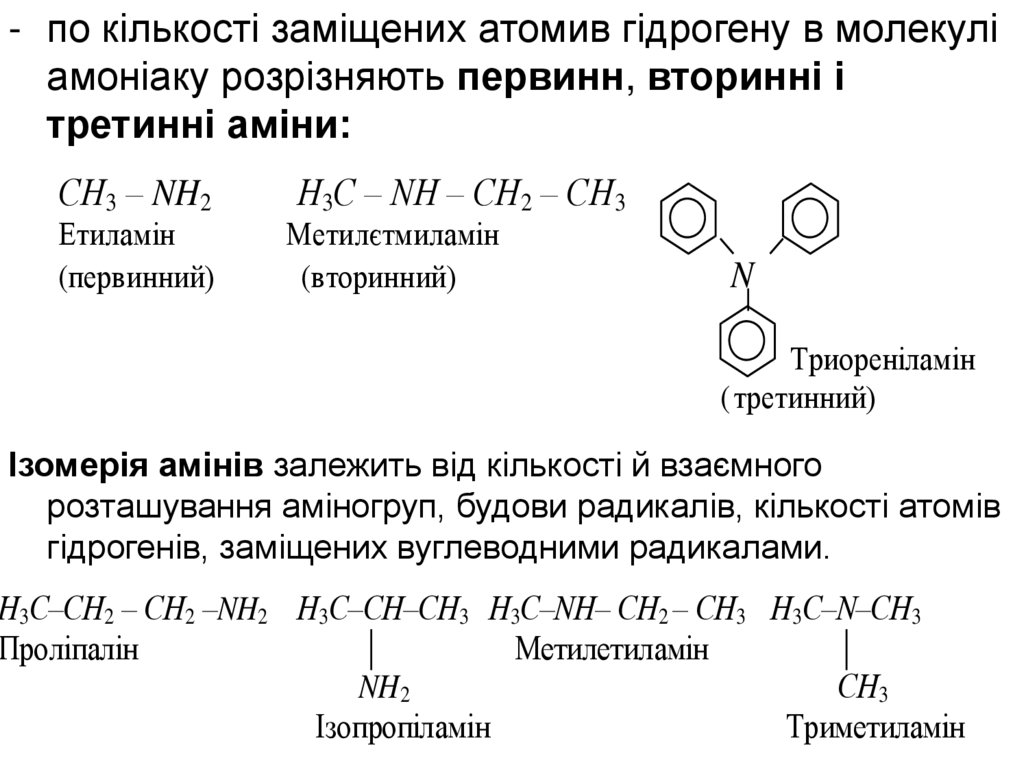
6.
- по кількості заміщених атомив гідрогену в молекуліамоніаку розрізняють первинн, вторинні і
третинні аміни:
СН3 – NH2
Етиламін
(первинний)
Н3С – NH – CH2 – CH3
Метилєтмиламін
(вторинний)
N
Триореніламін
( третинний)
Ізомерія амінів залежить від кількості й взаємного
розташування аміногруп, будови радикалів, кількості атомів
гідрогенів, заміщених вуглеводними радикалами.
Н3С–СН2 – СН2 –NH2 Н3С–СН–СН3 Н3С–NH– СН2 – СН3 Н3С–N–СН3
Проліпалін
Метилетиламін
NH2
СН3
Ізопропіламін
Триметиламін
7.
Майже всі аліфатичні аміни відрізняютьсяхарактерним запахом зіпсованої риби, а діаміни
мають трупний запах. Всі аміни дуже отруйні.
Хімічні властивості аліфатичних амінів:
1. При горінні амінів можуть утворюватися
токсичні речовини: оксиди нітрогену та
синильна кислота. Аміни схильні до
самозаймання при контакті з азотно–
кислотними окисниками (HNO3, NO2, N2O4).
Суміш таких речовин горить з виділенням
великої кількості тепла, що дозволяє
використовувати їх в якості компонентів
ракетних палив.
8.
2. Утворює донорно-акцепторний зв’язок з протоном:R – NH2 + H+ R – NH3+.
3. У водних розчинах аміни приєднують протон води
з утворенням гідроксидів амонійних сполук:
+
R – NH3 + OH -.
R – NH2 + HOH
4. Реагують з кислотами:
(СН3)3 N: +Н+Сl– (СН3)3 NH+ Cl–
Триметиламоній хлорид
9.
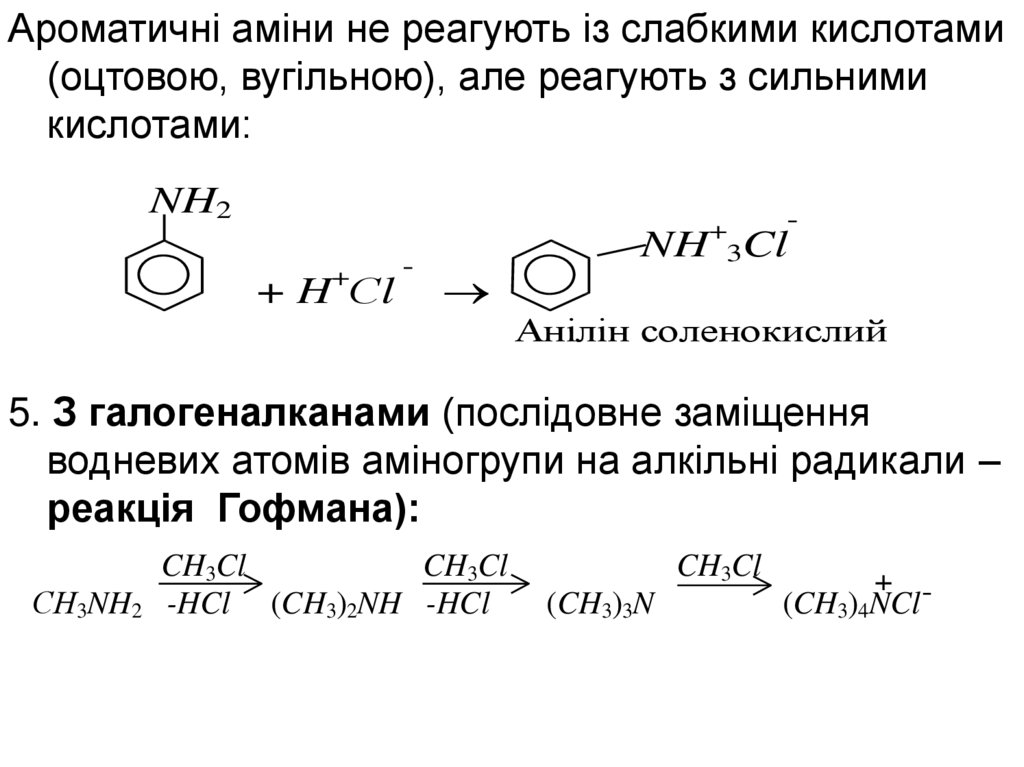
Ароматичні аміни не реагують із слабкими кислотами(оцтовою, вугільною), але реагують з сильними
кислотами:
NH2
+
+ H Сl
-
+
NH 3Cl
Анілін соленокислий
5. З галогеналканами (послідовне заміщення
водневих атомів аміногрупи на алкільні радикали –
реакція Гофмана):
CH3Cl
CH3Cl
СН3NH2 -HCl (CH3)2NH -HCl
CH3Cl
(CH3)3N
+ (CH3)4NCl
10.
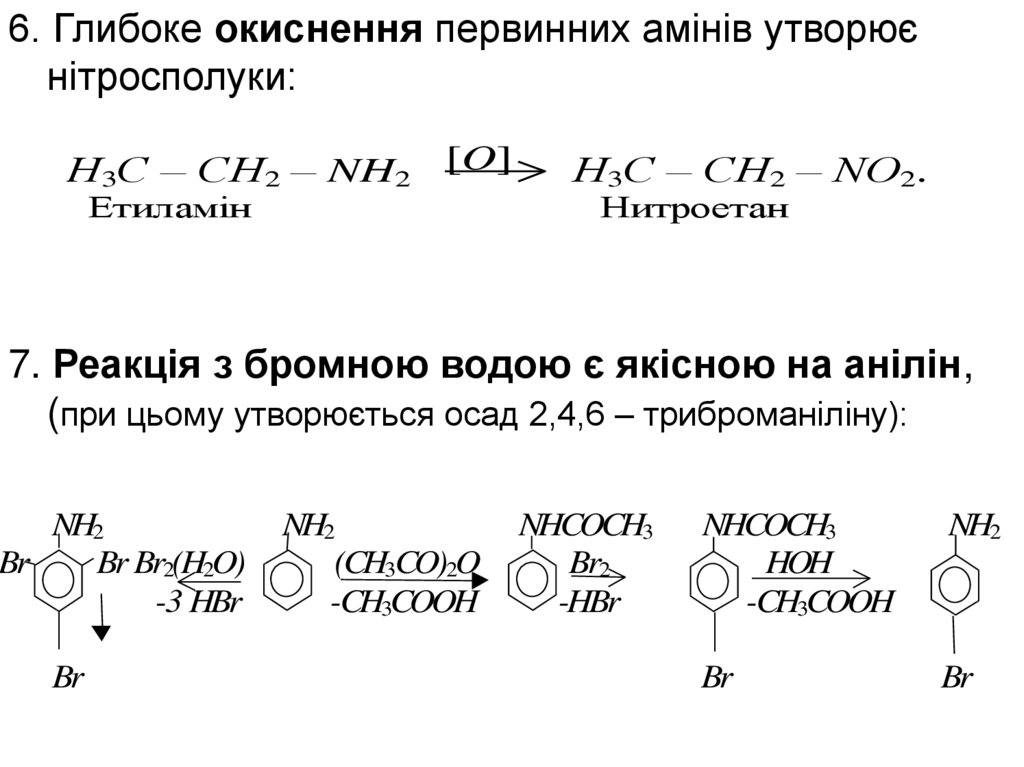
6. Глибоке окиснення первинних амінів утворюєнітросполуки:
Н3С – СН2 – NH2
[O]
Етиламін
Н3С – СН2 – NO2.
Нитроетан
7. Реакція з бромною водою є якісною на анілін,
(при цьому утворюється осад 2,4,6 – триброманіліну):
NH2
Br
Br Br2(H2O)
-3 HBr
Br
NH2
(CH3CO)2O
-CH3COOH
NHCOCH3
Br2
-HBr
NHCOCH3
HOH
-CH3COOH
NH2
Br
Br
11.
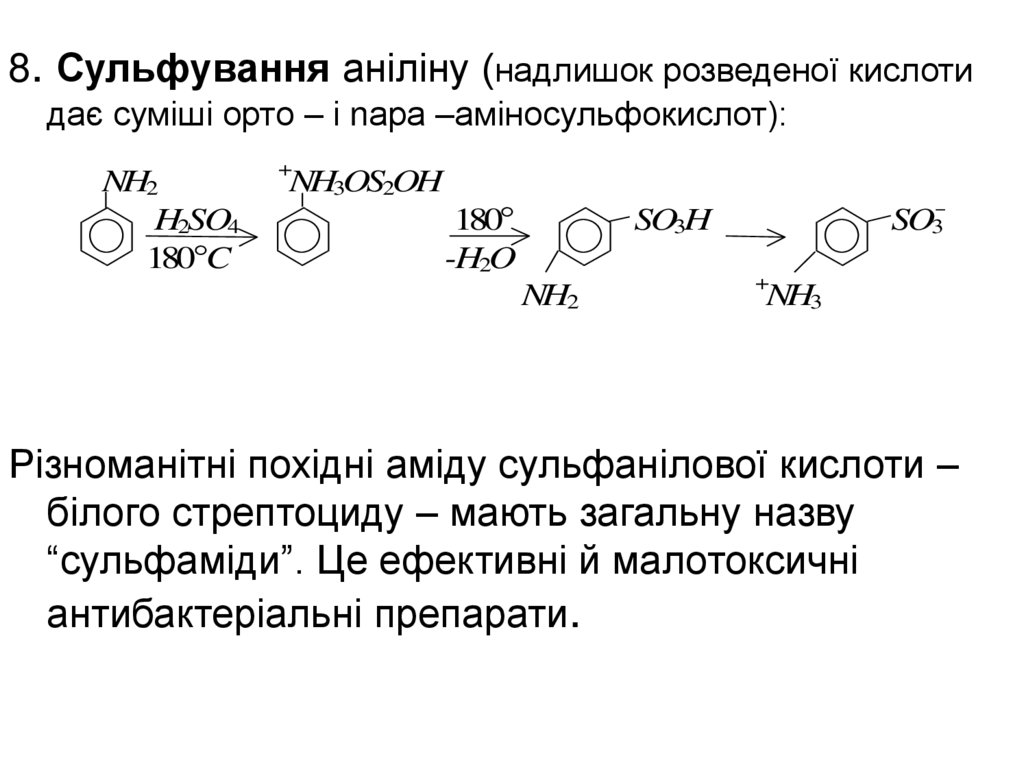
8. Сульфування аніліну (надлишок розведеної кислотидає суміші орто – і nара –аміносульфокислот):
NH2
H2SO4
180 C
+
NH3OS2OH
180
-H2O
SO3-
SO3H
NH2
+
NH3
Різноманітні похідні аміду сульфанілової кислоти –
білого стрептоциду – мають загальну назву
“сульфаміди”. Це ефективні й малотоксичні
антибактеріальні препарати.
12.
Амінокислоти – це карбонові кислоти, молекулияких містять одну або декілька аміногруп.
Амінокислоти – це мономери білків, які ковалентно
сполучені між собою пептидними зв’язками між
карбоксильною групою однієї кислоти та аміногрупою іншої :
O
O
O
O
…N – CH – C – N – CH – C – N – CH – C – NH – CH – C…
Н R1
H R2
H R3
R4
Пептидний
зв’язок
Амінокислотний
залишок
Залежно від довжини утвореного ланцюга, всі
поліпептиди умовно можна розділити на пептиди
(які містять від 2 до 10 амінокислот), поліпептиди
(від 10 до 40 амінокислот) і білки (більше 40
13.
Білки – це високомолекулярні природніполімери, що побудовані із залишків
амінокислот, які сполучені між собою амідними
(пептидними) зв’язками.
Кожному білку притаманна властива йому
амінокислотна послідовність і вони мають складну
просторову структуру, що визначає їх фізико-хімічні
та біологічні властивості.
Білки наявні у вигляді головних компонентів у будьякій формі живої матерії – мікроорганізмах,
тваринах або рослинах.
14.
Елементоорганічні сполуки:Метали з органічними сполуками утворюють
металоорганічні сполуки (нелеткі й нерозчинні в
органічних розчинниках). Металоорганічні сполуки
відрізняються дуже великою реакційноздатністю,
деякі з них на повітрі самозаймаються. Їх
активність є наслідком високої полярності зв’язку
метал – вуглеводень.
Одержання:
СН3 – J + Mg
С2Н5Br + 2Li
етер
етер
СН3 – MgJ
С2Н5 – Li + LiBr.
15.
- Характерні реакції зі сполуками, які маютьактивний гідроген:
СН3MgJ + HA CH4 + J – Mg – A.
може бути: Н2О; С2Н5ОН;NH3; R – NH2;
Наприклад:
СН3MgJ + H2O CH4 + Mg(OH)J
СН3MgJ + H2N – R CH4 + R – NH – MgJ .
- Диоксид вуглецю легко приєднує металоорганічні
сполуки з утворенням карбонових кислот:
R – Mg X + CO2 R – COOMgX
+
HX
R – COOH + MgX2.
16.
Металоорганічні сполуки токсичні для людей татварин. Токсичність залежить від природи
елементу й будови сполуки. Найбільш токсичні
сполуки арсену, стибію, меркурію.
Найбільш активні, з хімічної точки зору,
елементоорганічні сполуки натрію, літію, калію.
Вони розкладаються без плавлення при
нагріванні, на повітрі самозаймаються.
Елементоорганічних сполук не можна гасити
водою, а також диоксидом карбону.










 Химия
Химия








