Похожие презентации:
Галогенопроизводные. Растворимость, общие закономерности
1.
ГАЛОГЕНОПРОИЗВОДНЫЕПроизводные углеводородов, в молекулах которых
один или несколько атомов водорода замещены
галогеном.
R–X
где R – углеводородный радикал; X = F, Cl, Br или I.
Если R = СnН2n+1, т. е. является алкильным
радикалом, то галогенопроизводные называются
алкилгалогенидами или галогеналканами.
2.
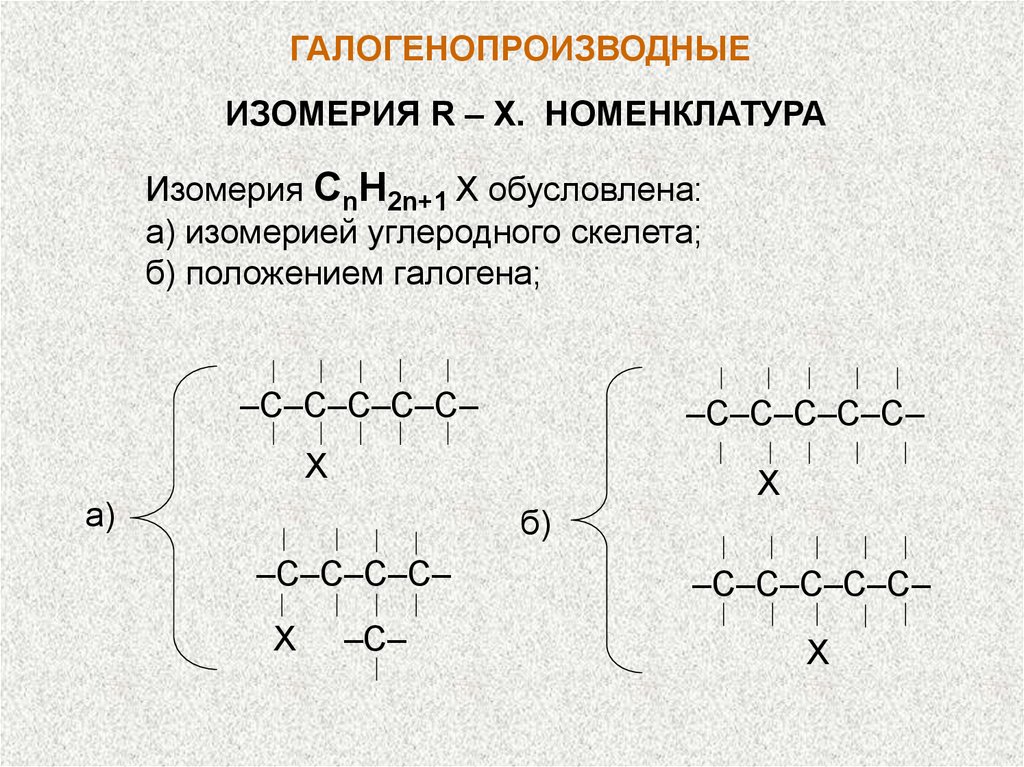
ГАЛОГЕНОПРОИЗВОДНЫЕИЗОМЕРИЯ R – X. НОМЕНКЛАТУРА
Изомерия CnH2n+1 X обусловлена:
а) изомерией углеродного скелета;
б) положением галогена;
–С–С–С–С–С–
–С–С–С–С–С–
Х
Х
а)
б)
–С–С–С–С–
Х
–С–
–С–С–С–С–С–
Х
3.
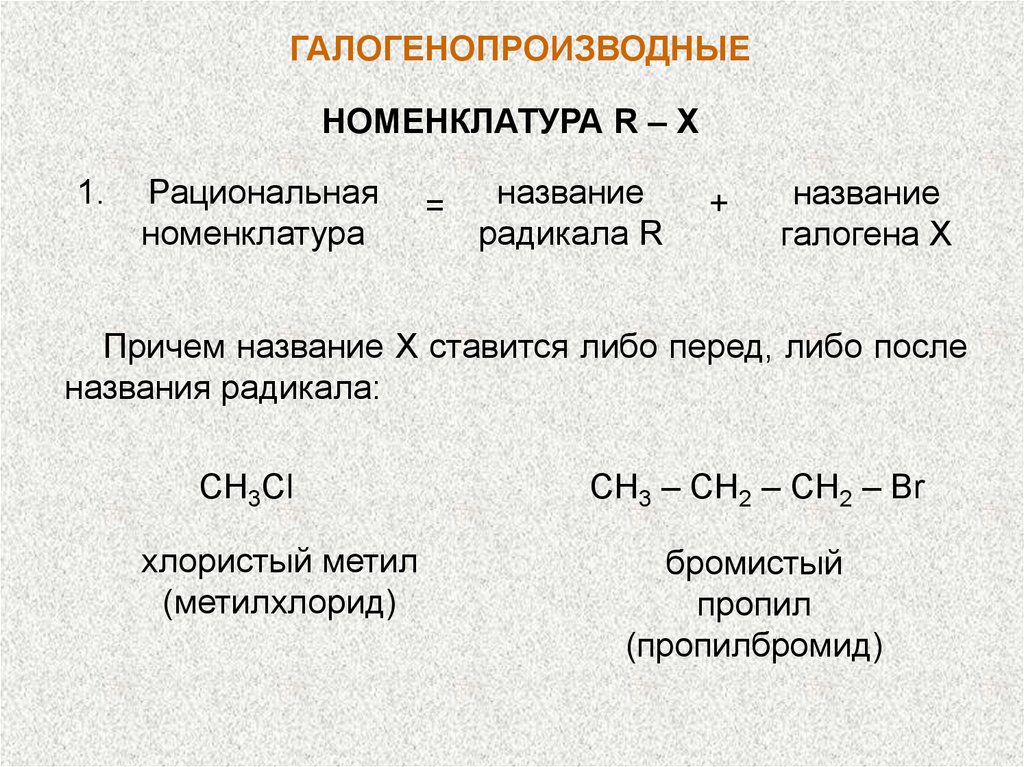
ГАЛОГЕНОПРОИЗВОДНЫЕНОМЕНКЛАТУРА R – X
1.
Рациональная
номенклатура
=
название
радикала R
+
название
галогена X
Причем название X ставится либо перед, либо после
названия радикала:
СН3Сl
хлористый метил
(метилхлорид)
СН3 – СН2 – СН2 – Br
бромистый
пропил
(пропилбромид)
4.
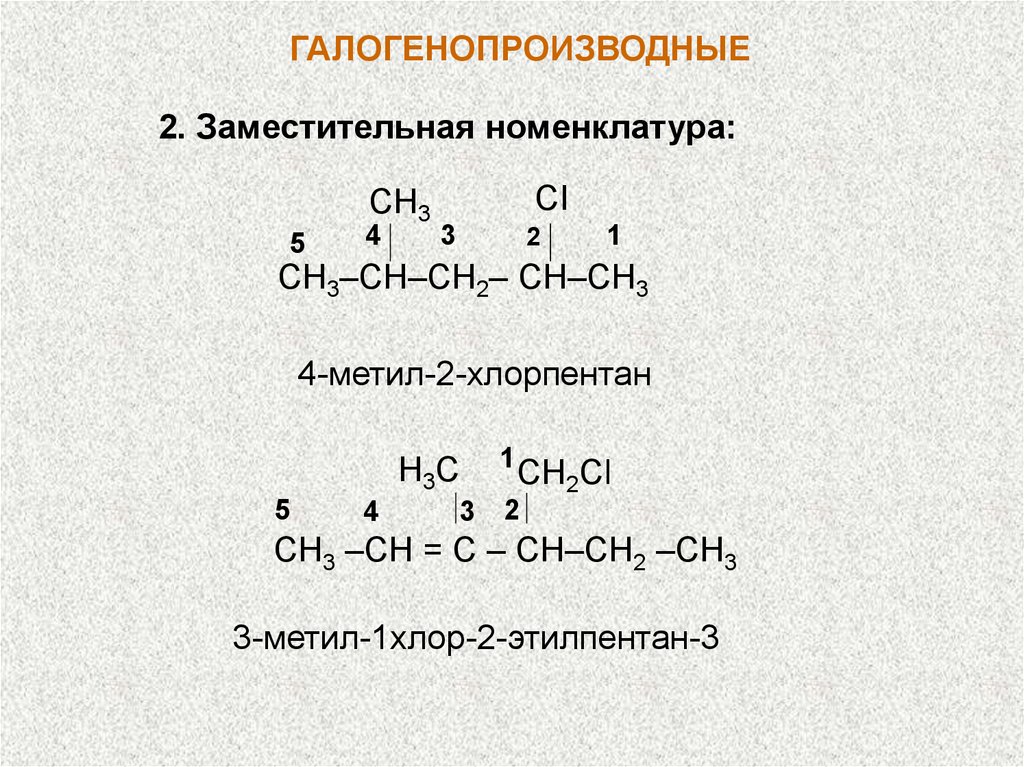
ГАЛОГЕНОПРОИЗВОДНЫЕ2. Заместительная номенклатура:
CH3
5
4
CI
3
2
1
СН3–СН–СН2– СН–СН3
4-метил-2-хлорпентан
H3C
5
4
3
1
СН2Cl
2
СН3 –СН = С – СН–СН2 –СН3
3-метил-1хлор-2-этилпентан-3
5.
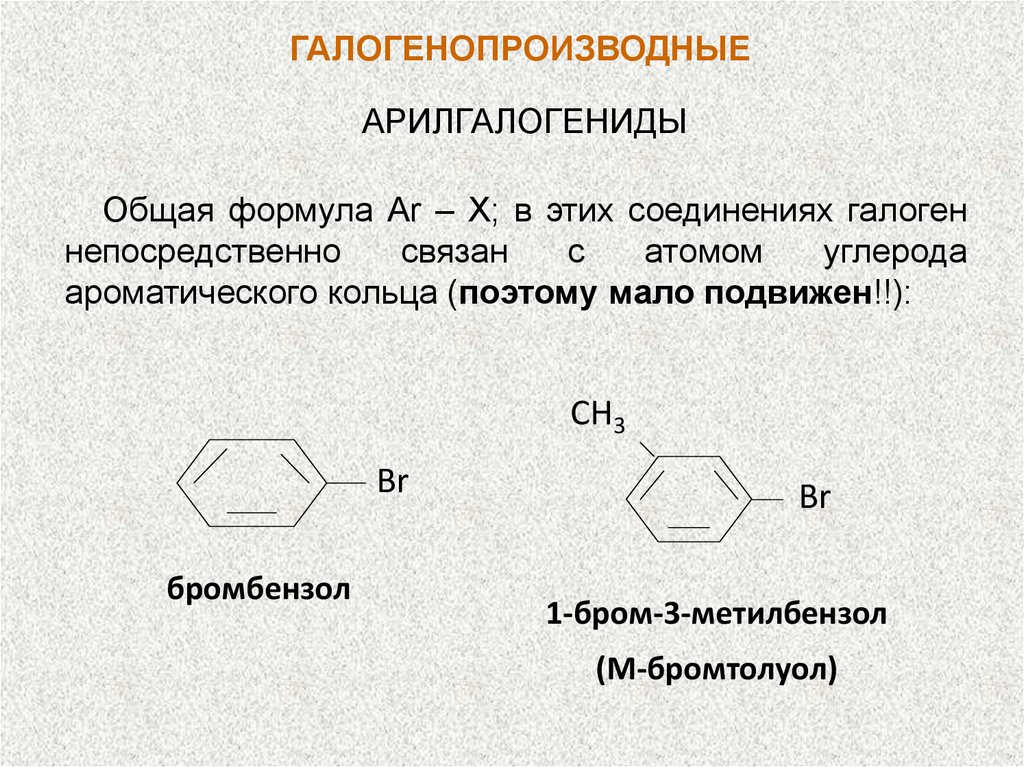
ГАЛОГЕНОПРОИЗВОДНЫЕАРИЛГАЛОГЕНИДЫ
Общая формула Ar – X; в этих соединениях галоген
непосредственно
связан
с
атомом
углерода
ароматического кольца (поэтому мало подвижен!!):
СH3
Br
бромбензол
Br
1-бром-3-метилбензол
(М-бромтолуол)
6.
ГАЛОГЕНОПРОИЗВОДНЫЕМЕТОДЫ СИНТЕЗА R – X
(звездочкой (*) отмечены методы, используемые
также в промышленности).
1. Из спиртов:
действием галогеноводородов (НХ) и галогенидов
фосфора (РХ):
Общая схема:
НХ или
R – OH РХ ,PX
R–X
3
5
алкилгалогенид
спирт
7.
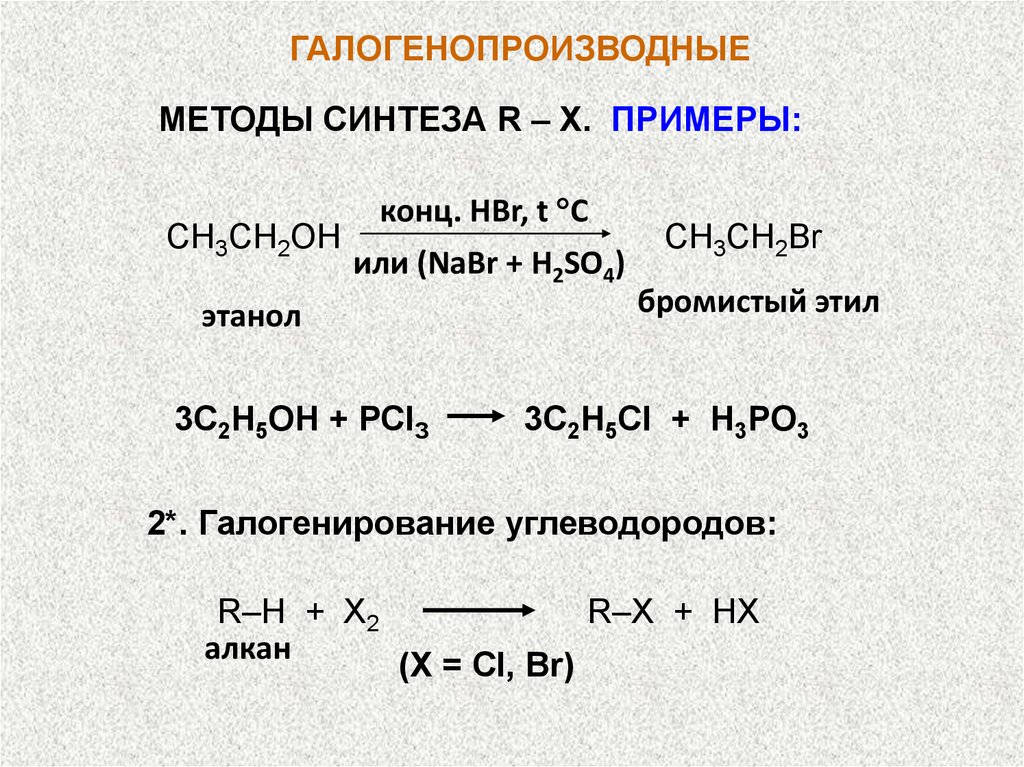
ГАЛОГЕНОПРОИЗВОДНЫЕМЕТОДЫ СИНТЕЗА R – X. ПРИМЕРЫ:
СН3СН2OН
конц. НBr, t C
или (NaBr + H2SO4)
этанол
3С2Н5ОН + РСlЗ
СН3СН2Br
бромистый этил
3C2H5Cl + Н3PО3
2*. Галогенирование углеводородов:
R–H + X2
алкан
R–X + HX
(X = Cl, Br)
8.
ГАЛОГЕНОПРОИЗВОДНЫЕ3*. Присоединение галогеноводородов к алкенам:
–С=С–
HX
–С–С–
H
алкен
Х
4*. Присоединение галогенов к алкенам и алкинам:
–С=С–
Х2
–С–С–
Х
Н– С ≡ С –Н
Х2
Х
Н– СХ2 – СХ2–Н
9.
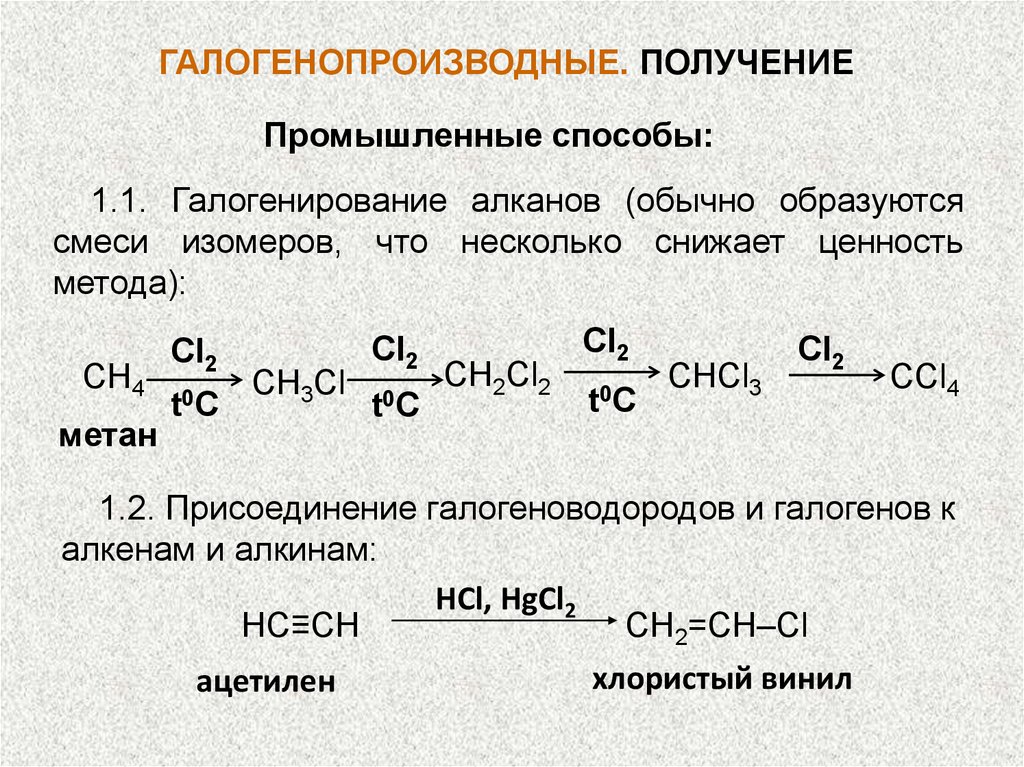
ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕПромышленные способы:
1.1. Галогенирование алканов (обычно образуются
смеси изомеров, что несколько снижает ценность
метода):
CH4
метан
CI2
t 0C
CH3Cl
CI2
t 0C
CH2Cl2
CI2
t 0C
CHCl3
CI2
CCl4
1.2. Присоединение галогеноводородов и галогенов к
алкенам и алкинам:
HCl, HgCl2
НС≡СН
СН2=СН–Сl
ацетилен
хлористый винил
10.
ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕСН2 = СН2
этилен
Cl2
СН2 – СН2
Сl
Сl
500 C
СН2=СН–Сl
хлористый винил
11.
ГАЛОГЕНОПРОИЗВОДНЫЕФИЗИЧЕСКИЕ СВОЙСТВА R – X
1.
Температура
плавления и
кипения R – X
>
Температура
плавления и
кипения R – H
?
2. При данном R температура кипения повышается в
ряду:
R–F R–Cl R–Br R–I
?
3. Растворимость R – X: хотя R – X – полярные
соединения, они нерастворимы в воде (почему ?), но
хорошо растворимы в обычных органических
растворителях.
12.
ГАЛОГЕНОПРОИЗВОДНЫЕРАСТВОРИМОСТЬ: ОБЩИЕ ЗАКОНОМЕРНОСТИ
Старинное правило:
«ПОДОБНОЕ РАСТВОРЯЕТСЯ
В ПОДОБНОМ»
(Растворяемое вещество)
(Растворитель)
Компонент А
Компонент В
13.
ГАЛОГЕНОПРОИЗВОДНЫЕХИМИЧЕСКИЕ СВОЙСТВА R – X
Характерной чертой RX является наличие группировки:
δ+ .. δ-
– C – ..
X:
Анализ строения позволяет отметить следующее:
1. функциональная группа не имеет кратных связей,
поэтому не склонна к реакциям присоединения;
2. галогены как элементы более электроотрицательные, чем углерод, создают на связанном с ними
атоме углерода частичный положительный заряд ( +).
14.
ГАЛОГЕНОПРОИЗВОДНЫЕХИМИЧЕСКИЕ СВОЙСТВА R – X
Отмеченные обстоятельства заставляют предположить:
Наиболее
характерными
реакциями
галогенпроизводных будут реакции нуклеофильного замещения (SN – реакции).
«S» - от слова «substitution» - замещение;
«N» - от слова «nucleophilic».
В SN – реакциях происходит атака нуклеофила :Nu
(т.е. реагента, предоставляющего электронную пару) на
атом углерода с вытеснением галогена в виде :X–
Nu: + R :X
R:Nu
+
:X–
15.
ПРИМЕРЫ НУКЛЕОФИЛОВ:а) Анионы:
НО–
RO–
RCOO–
СN–
(гидроксил-анион)
(алкоголят-ионы)
(ионы органических кислот)
(цианид-ион)
.. ..
б) Нейтральные молекулы: Н2О,
NH3 и их производные
..
..
..
..
..
ROR, NH2R, NHR2, NR3 – нуклеофильные свойства
нейтральных
молекул
обусловлены
свободной
электронной парой.
16.
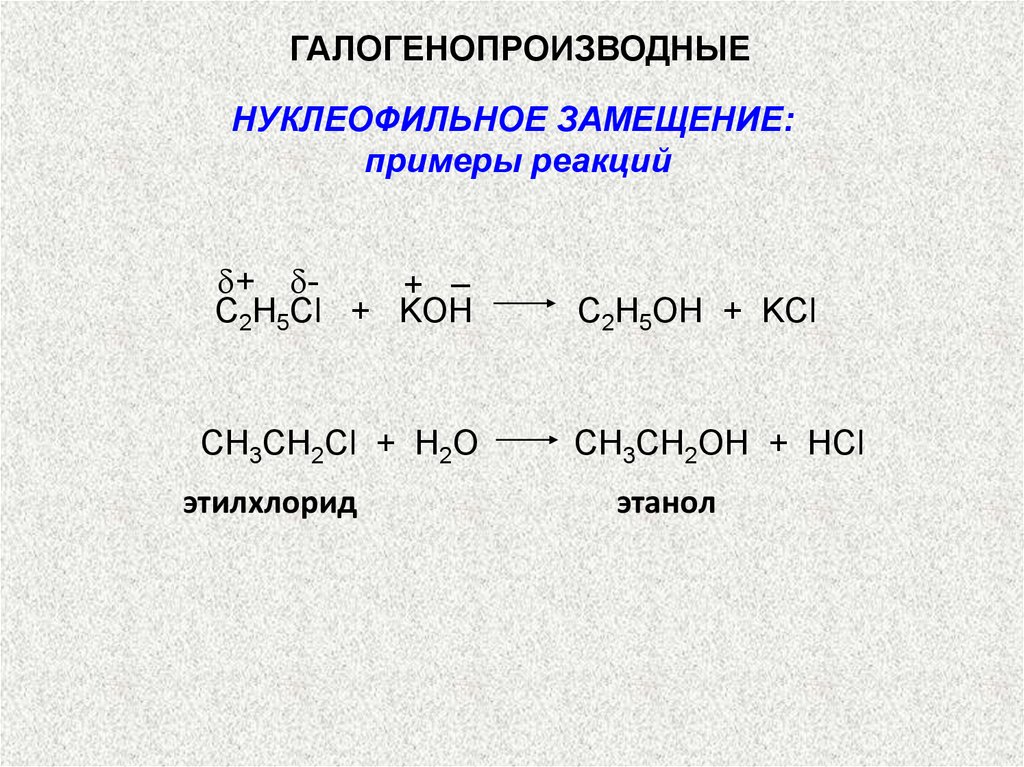
ГАЛОГЕНОПРОИЗВОДНЫЕНУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ:
примеры реакций
+ + –
С2H5Cl + KOH
CH3CH2Cl + H2O
этилхлорид
C2H5OH + KCl
CH3CH2OH + HCl
этанол
17.
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ:ОБШАЯ СХЕМА:
R:X
+ :Nu
R:Nu +
:X–
ПРИМЕРЫ РЕАКЦИЙ
1. R:X
+ :ОН–
R:OH + :X–
спирт
2. R:X
+ Н2О:
R:OH + H:X
3. R:X
+
-:OR′
R:OR′ + :X–
спирт
простой эфир
18.
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ:ПРИМЕРЫ РЕАКЦИЙ
4. R:X + –:С ≡ СR′
R:C ≡ CR′ + :X–
алкин
5. R:X + Na:R′
R:R′
+ :X–
алкан
6. R:X + :I–
R:I
+
:X–
иодистый алкил
7. R:X + :CN–
R:CN
+ :X–
нитрил
8. R:X + R′COO:–
R′COO:R + :X–
сложный эфир
19.
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ:ПРИМЕРЫ РЕАКЦИЙ
R:NH3
9. R:X+ :NH3
:NH3
+
–
:X
амин
R:NH2R′ +X–
10. R:X + :NH2R′
R–NH2
RNHR′ + НX
вторичный амин
реакция Фриделя – Крафтса:
11. R:X + ArH
арен
12. и др. …
AlCl3
Ar – R
алкилбензол
20.
ДРУГИЕ РЕАКЦИИ ГАЛОГЕНОПРОИЗВОДНЫХ2) Дегидрогалогенирование: отщепление
–С–С–
H Х
КОН
(спирт)
– С = С – + НХ
3) Синтез реактива Гриньяра:
RX + Mg
эфир
RMgX
21.
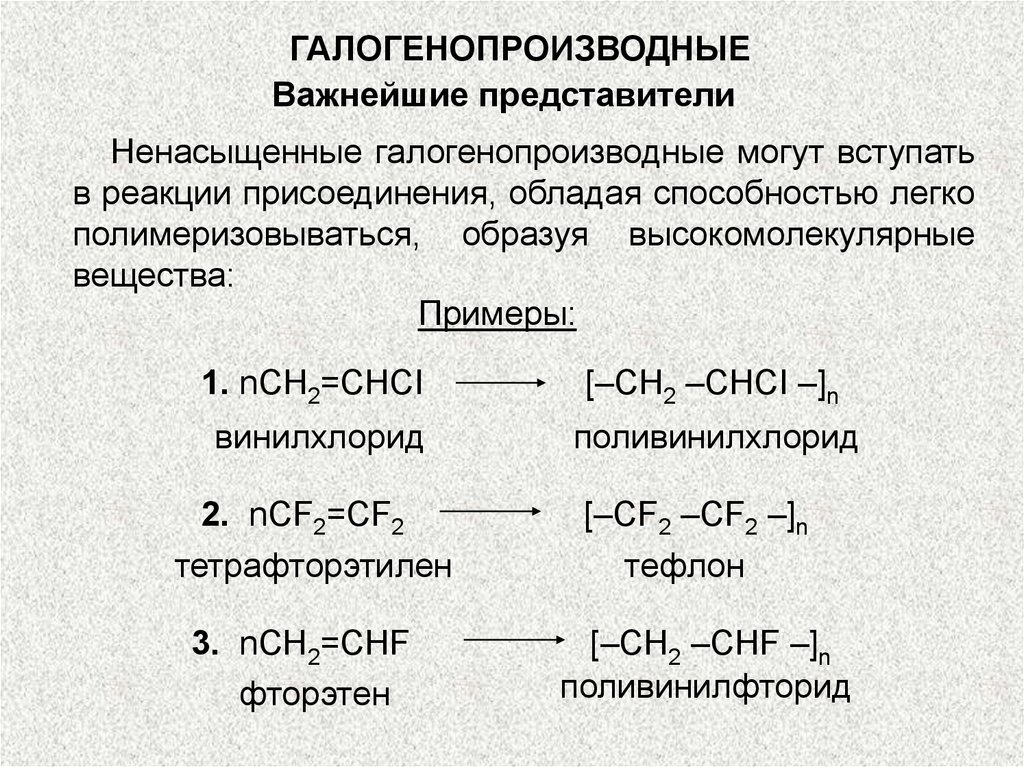
ГАЛОГЕНОПРОИЗВОДНЫЕВажнейшие представители
Ненасыщенные галогенопроизводные могут вступать
в реакции присоединения, обладая способностью легко
полимеризовываться, образуя высокомолекулярные
вещества:
Примеры:
1. nCH2=CHCI
[–CH2 –CHCI –]n
винилхлорид
поливинилхлорид
2. nCF2=CF2
тетрафторэтилен
3. nCH2=CHF
фторэтен
[–CF2 –CF2 –]n
тефлон
[–CH2 –CHF –]n
поливинилфторид
22.
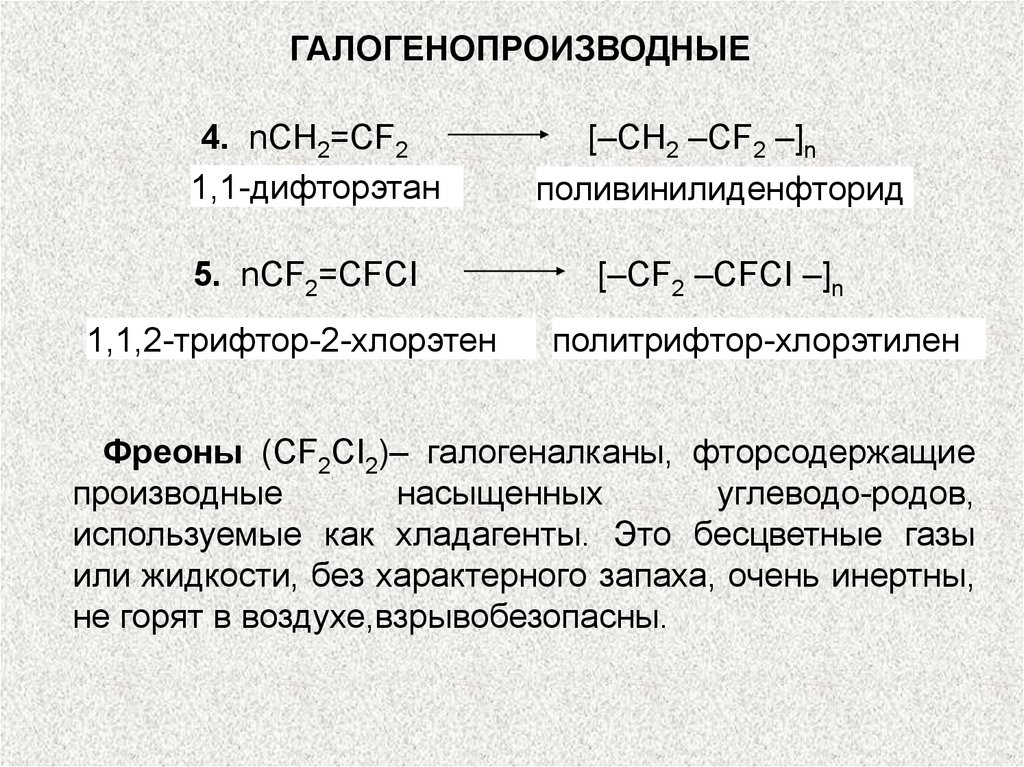
ГАЛОГЕНОПРОИЗВОДНЫЕ4. nCH2=CF2
1,1-дифторэтан
[–CH2 –CF2 –]n
поливинилиденфторид
5. nCF2=CFCI
[–CF2 –CFCI –]n
1,1,2-трифтор-2-хлорэтен
политрифтор-хлорэтилен
Фреоны (CF2CI2)– галогеналканы, фторсодержащие
производные
насыщенных
углеводо-родов,
используемые как хладагенты. Это бесцветные газы
или жидкости, без характерного запаха, очень инертны,
не горят в воздухе,взрывобезопасны.













 Химия
Химия








