Похожие презентации:
Галогенопроизводные углеводородов 1
1.
ГАЛОГЕНОПРОИЗВОДНЫЕПроизводные углеводородов, в молекулах которых
один или несколько атомов водорода замещены
галогеном.
Их общая формула:
R–X
где R – углеводородный радикал; X = F, Cl, Br или I.
Если R = СnН2n+1, т. е. является алкильным
радикалом, то галогенопроизводные называются
алкилгалогенидами или галогеналканами.
2.
ГАЛОГЕНОПРОИЗВОДНЫЕИЗОМЕРИЯ R – X. НОМЕНКЛАТУРА
Изомерия CnH2n+1 X обусловлена:
а) изомерией углеродного скелета;
б) положением галогена;
–С–С–С–С–С–
–С–С–С–С–С–
Х
а)
Х
б)
–С–С–С–С–
–С–С–С–С–С–
Х–С–
Х
3.
ГАЛОГЕНОПРОИЗВОДНЫЕНОМЕНКЛАТУРА R – X
1.
Рациональная
номенклатура
=
название
радикала R
+
название
галогена X
Причем название X ставится либо перед, либо после
названия радикала:
СН3Сl
хлористый метил
(метилхлорид)
СН3 – СН2 – СН2 – Br
бромистый
пропил
(пропилбромид)
4.
ГАЛОГЕНОПРОИЗВОДНЫЕ2. Заместительная номенклатура:
CH3
5
4
CI
3
2
1
СН3–СН–СН2– СН–СН3
4-метил-2-хлорпентан
H3C
5
4
3
1
СН2Cl
2
СН3 –СН = С – СН–СН2 –СН3
3-метил-1хлор-2-этилпентан-3
5.
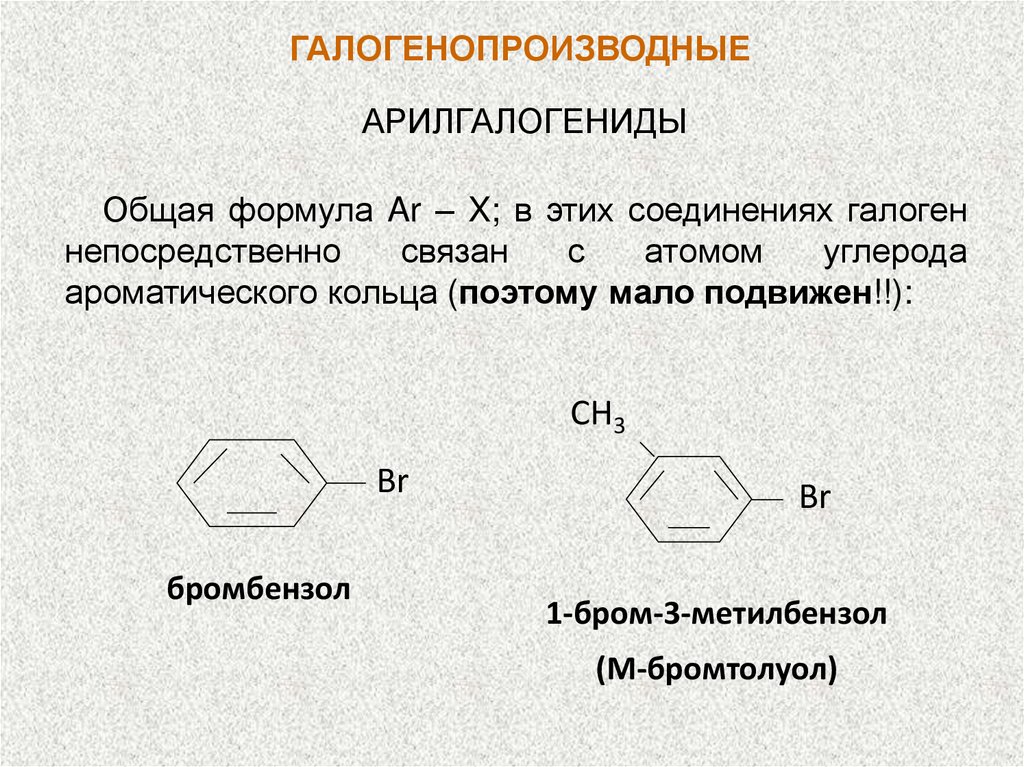
ГАЛОГЕНОПРОИЗВОДНЫЕАРИЛГАЛОГЕНИДЫ
Общая формула Ar – X; в этих соединениях галоген
непосредственно
связан
с
атомом
углерода
ароматического кольца (поэтому мало подвижен!!):
СH3
Br
бромбензол
Br
1-бром-3-метилбензол
(М-бромтолуол)
6.
ГАЛОГЕНОПРОИЗВОДНЫЕМЕТОДЫ СИНТЕЗА R – X
(звездочкой (*) отмечены методы, используемые
также в промышленности).
1. Из спиртов:
действием галогеноводородов (НХ) и галогенидов
фосфора (РХ):
Общая схема:
НХ или
R – OH РХ ,PX
R–X
3
5
алкилгалогенид
спирт
7.
ГАЛОГЕНОПРОИЗВОДНЫЕМЕТОДЫ СИНТЕЗА R – X. ПРИМЕРЫ:
СН3СН2OН
конц. НBr, t C
или (NaBr + H2SO4)
этанол
3С2Н5ОН + РСlЗ
СН3СН2Br
бромистый этил
3C2H5Cl + P(OH)3
2*. Галогенирование углеводородов:
R–H + X2
алкан
R–X + HX
(X = Cl, Br)
8.
ГАЛОГЕНОПРОИЗВОДНЫЕ3*. Присоединение галогеноводородов к алкенам:
–С=С–
HX
–С–С–
H
алкен
Х
4*. Присоединение галогенов к алкенам и алкинам:
–С=С–
Х2
–С–С–
Х
Н– С ≡ С –Н
Х2
Х
Н– СХ2 – СХ2–Н
9.
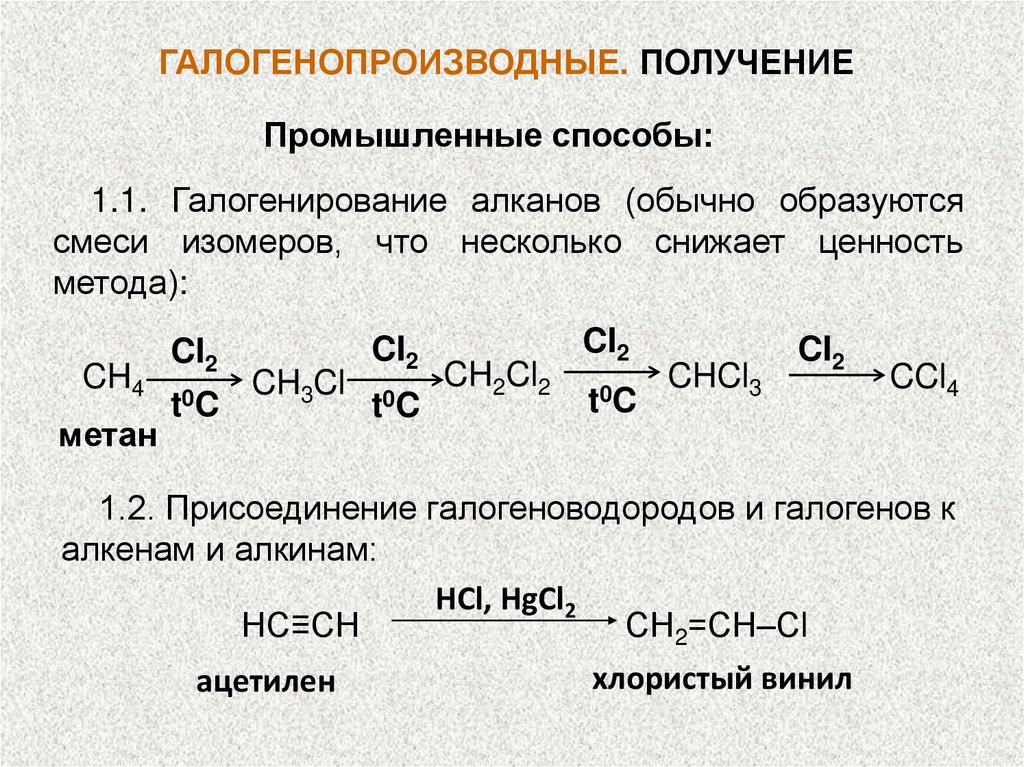
ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕПромышленные способы:
1.1. Галогенирование алканов (обычно образуются
смеси изомеров, что несколько снижает ценность
метода):
CH4
метан
CI2
t 0C
CH3Cl
CI2
t 0C
CH2Cl2
CI2
t 0C
CHCl3
CI2
CCl4
1.2. Присоединение галогеноводородов и галогенов к
алкенам и алкинам:
HCl, HgCl2
НС≡СН
СН2=СН–Сl
ацетилен
хлористый винил
10.
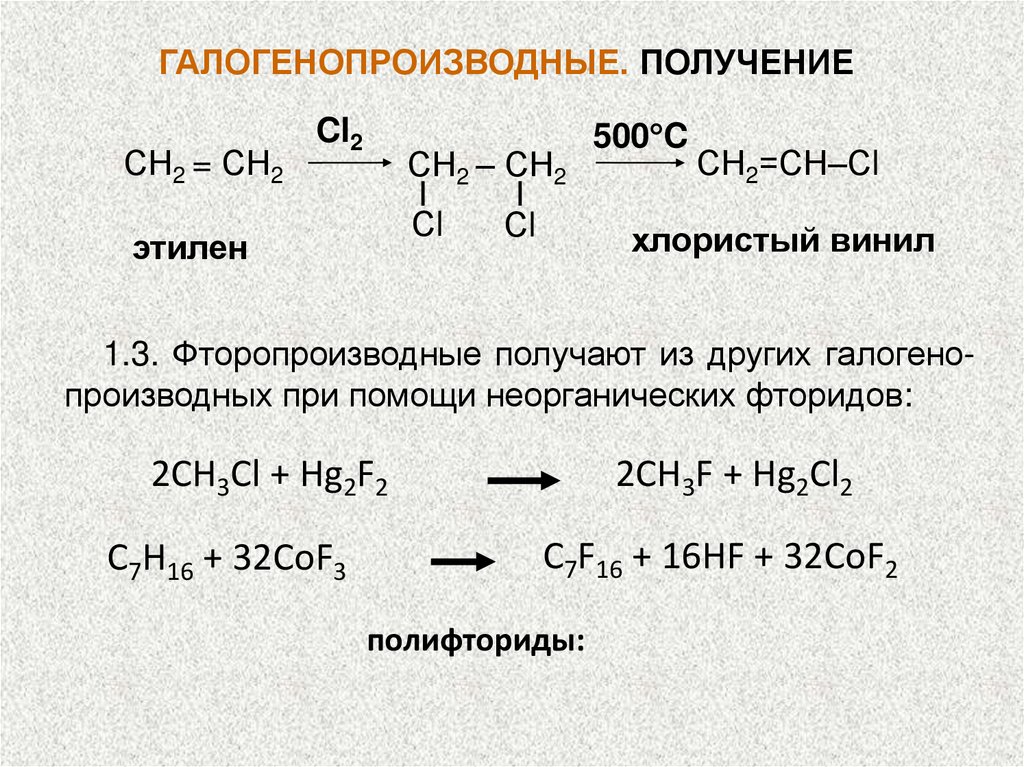
ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕСН2 = СН2
Cl2
СН2 – СН2
Сl
этилен
Сl
500 C
СН2=СН–Сl
хлористый винил
1.3. Фторопроизводные получают из других галогенопроизводных при помощи неорганических фторидов:
2СН3Cl + Hg2F2
C7H16 + 32CoF3
2CH3F + Hg2Cl2
C7F16 + 16HF + 32CoF2
полифториды:
11.
ГАЛОГЕНОПРОИЗВОДНЫЕФИЗИЧЕСКИЕ СВОЙСТВА R – X
1.
Температура
плавления и
кипения R – X
>
Температура
плавления и
кипения R – H
?
2. При данном R температура кипения повышается в
ряду:
R–F R–Cl R–Br R–I
?
3. Растворимость R – X: хотя R – X – полярные
соединения, они нерастворимы в воде (почему ?), но
хорошо растворимы в обычных органических
растворителях.
12.
ГАЛОГЕНОПРОИЗВОДНЫЕВажнейшие представители
Ненасыщенные галогенопроизводные могут вступать
в реакции присоединения, обладая способностью легко
полимеризовываться, образуя высокомолекулярные
вещества:
Примеры:
1. nCH2=CHCI
[–CH2 –CHCI –]n
винилхлорид
поливинилхлорид
2. nCF2=CF2
тетрафторэтилен
3. nCH2=CHF
фторэтен
[–CF2 –CF2 –]n
тефлон
[–CH2 –CHF –]n
поливинилфторид
13.
ГАЛОГЕНОПРОИЗВОДНЫЕ4. nCH2=CF2
1,1-дифторэтан
[–CH2 –CF2 –]n
поливинилиденфторид
5. nCF2=CFCI
[–CF2 –CFCI –]n
1,1,2-трифтор-2-хлорэтен
политрифтор-хлорэтилен
Фреоны (CF2CI2)– галогеналканы, фторсодержащие
производные
насыщенных
углеводо-родов,
используемые как хладагенты. Это бесцветные газы
или жидкости, без характерного запаха, очень инертны,
не горят в воздухе,взрывобезопасны.










 Химия
Химия








