Похожие презентации:
Галогенопроизводные углеводородов
1. Галогенопроизводные углеводородов
– функциональные производные, которыепредставляют собой результат замещения
одного (или нескольких) атомов Н на атомы
галогенов
R
Ar
X
алифатические
X
ароматические
X = F, Cl, Br, I
2.
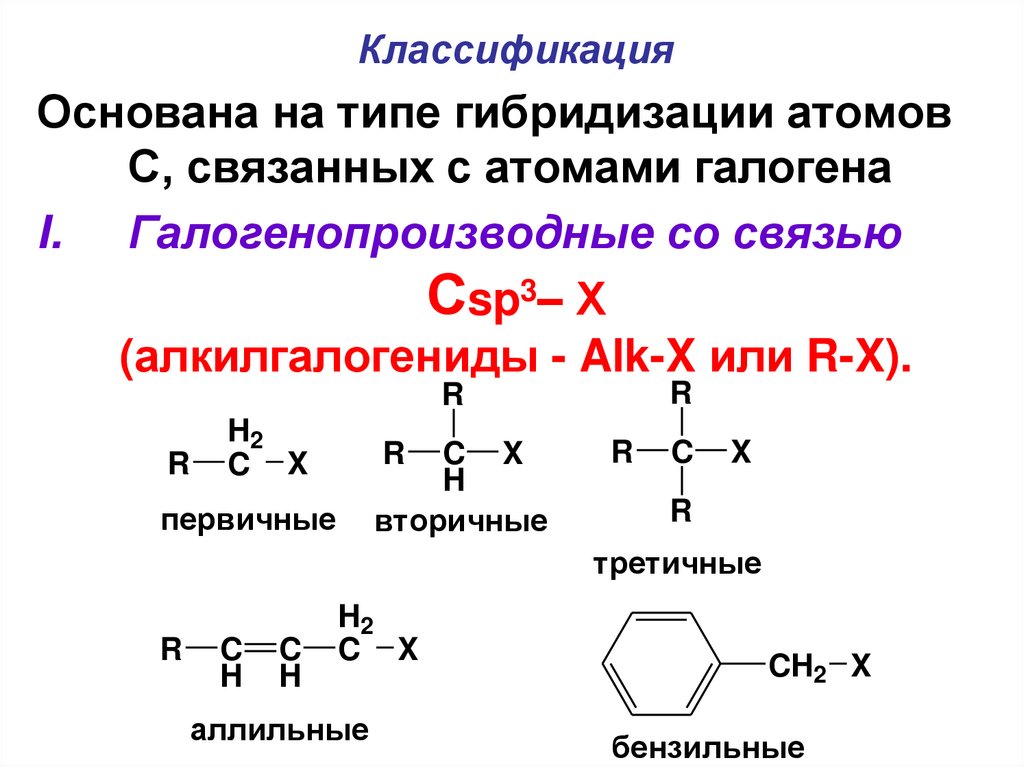
КлассификацияОснована на типе гибридизации атомов
С, связанных с атомами галогена
I. Галогенопроизводные со связью
Сsp3– Х
(алкилгалогениды - Alk-X или R-X).
R
R
R
H2
C X
R
C X
H
вторичные
первичные
R
C
X
R
третичные
R
C
H
C
H
H2
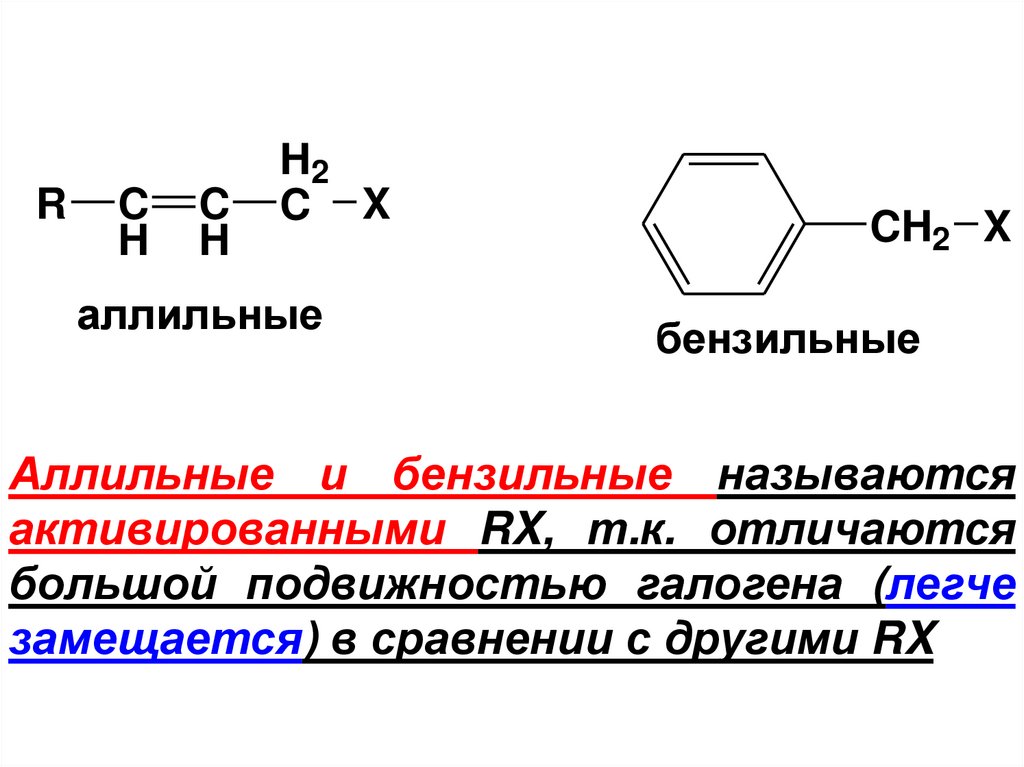
C X
аллильные
CH2 X
бензильные
3.
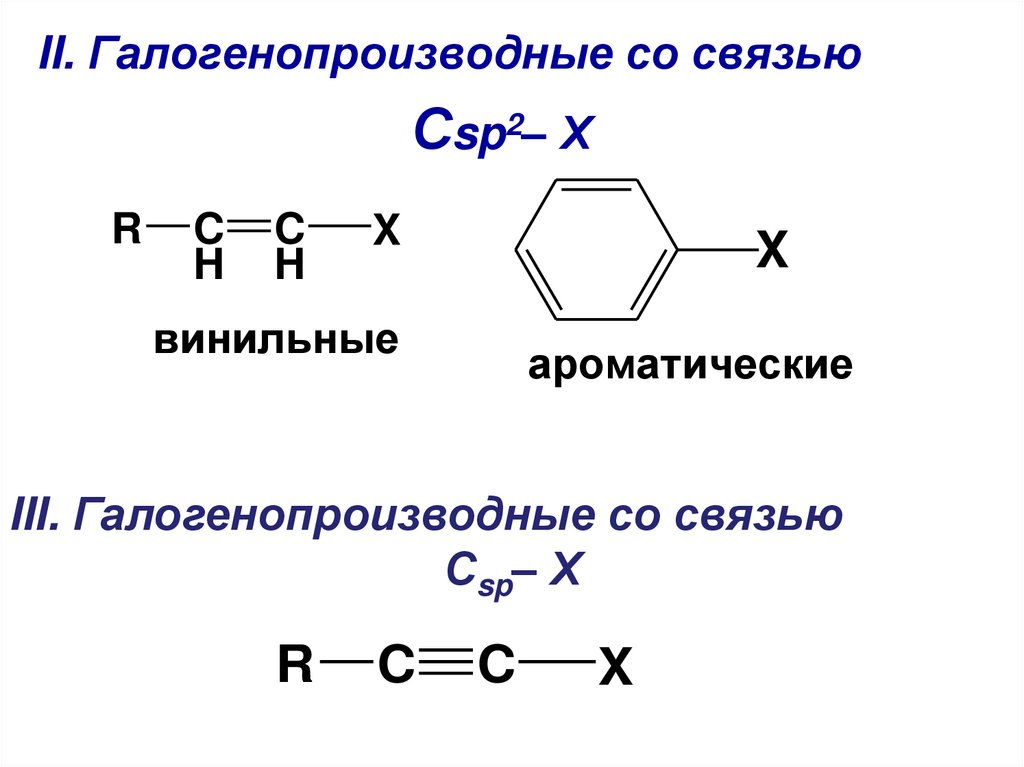
II. Галогенопроизводные со связьюСsp2– Х
R
C
H
C
H
X
X
винильные
ароматические
III. Галогенопроизводные со связью
Сsp– Х
R
C
C
X
4.
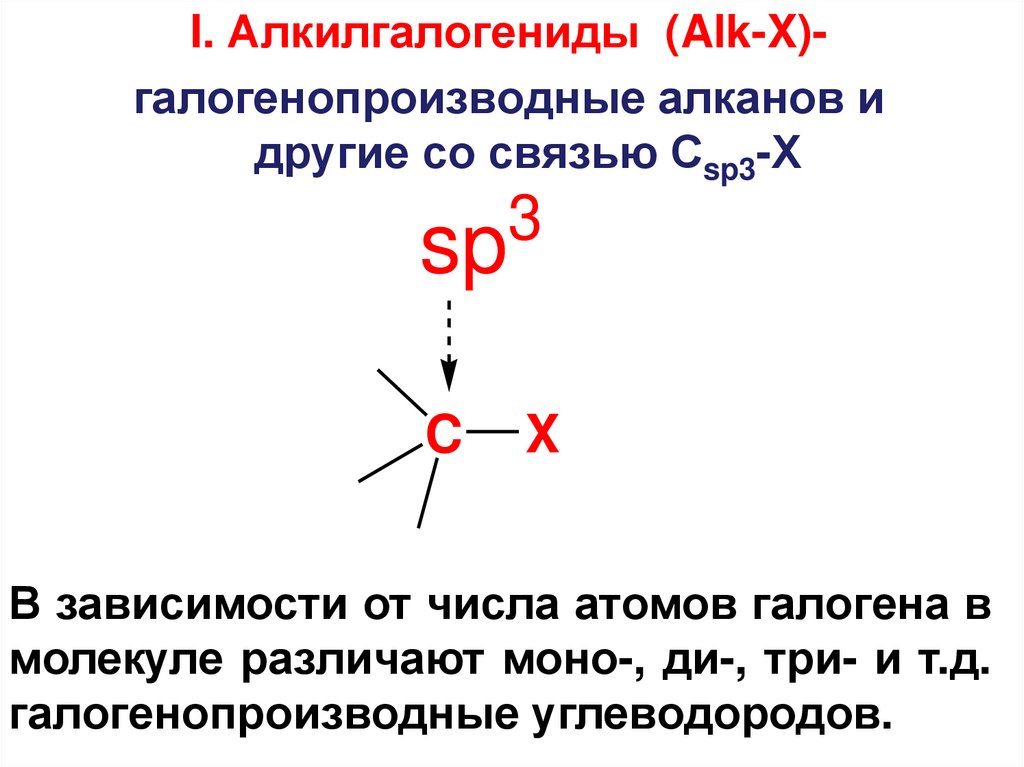
I. Алкилгалогениды (Alk-X)галогенопроизводные алканов идругие со связью Сsp3-Х
sp
3
C
X
В зависимости от числа атомов галогена в
молекуле различают моно-, ди-, три- и т.д.
галогенопроизводные углеводородов.
5.
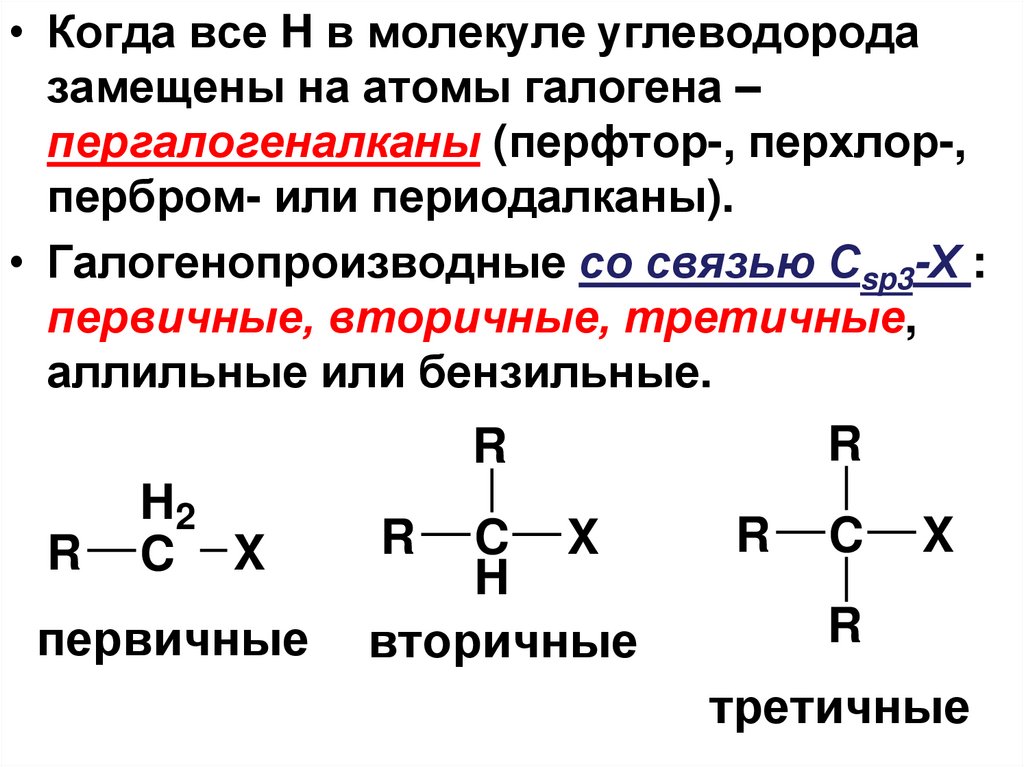
• Когда все H в молекуле углеводородазамещены на атомы галогена –
пергалогеналканы (перфтор-, перхлор-,
пербром- или периодалканы).
• Галогенопроизводные со связью Сsp3-Х :
первичные, вторичные, третичные,
аллильные или бензильные.
R
R
R
H2
C X
первичные
R
C X
H
вторичные
R
C
X
R
третичные
6.
RC
H
C
H
H2
C X
аллильные
CH2 X
бензильные
Аллильные и бензильные называются
активированными RX, т.к. отличаются
большой подвижностью галогена (легче
замещается) в сравнении с другими RX
7.
Физические свойства, строение• Бесцветные жидкости или газы (CH3Cl),
обладающие при глубоком вздохе
слабым вкусом. Нерастворимы в воде и
тяжелее воды (d420 > 1)
• Ткип. увеличивается с увеличением
содержания галогенов в молекуле (кроме
фтора).
При переходе от фторалканов к
иодалканам увеличивается
поляризуемость связи С–Х
8.
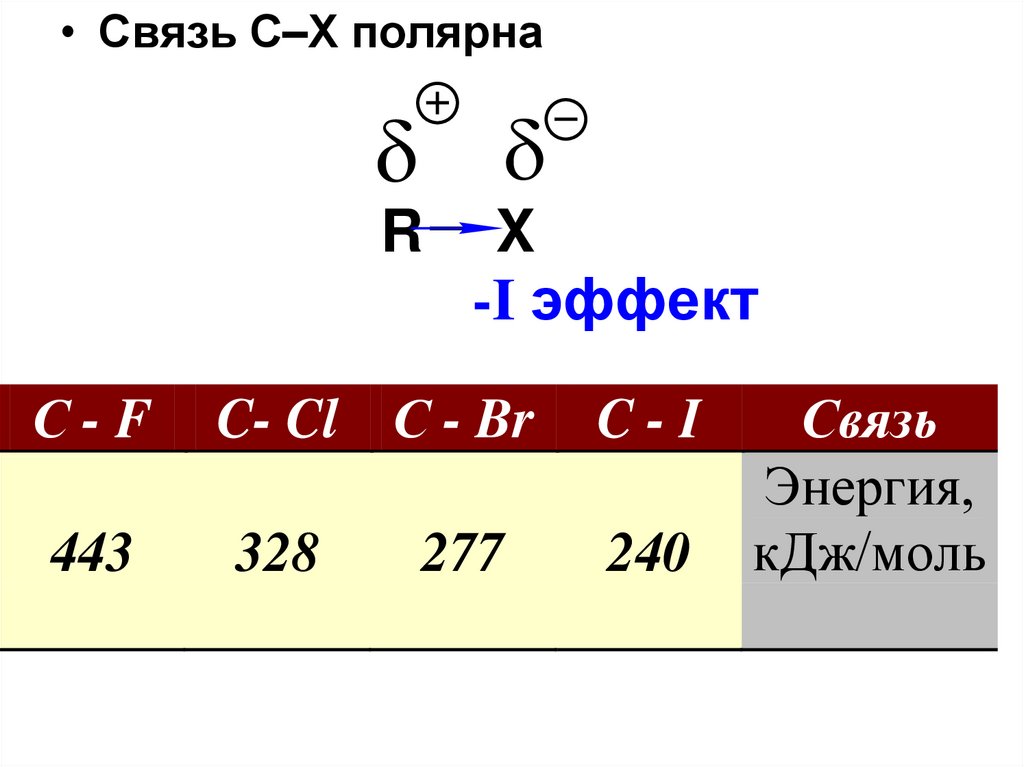
• Связь С–Х полярнаR
X
-I эффект
С-F
C- Cl С - Br
C-I
443
328
240
277
Связь
Энергия,
кДж/моль
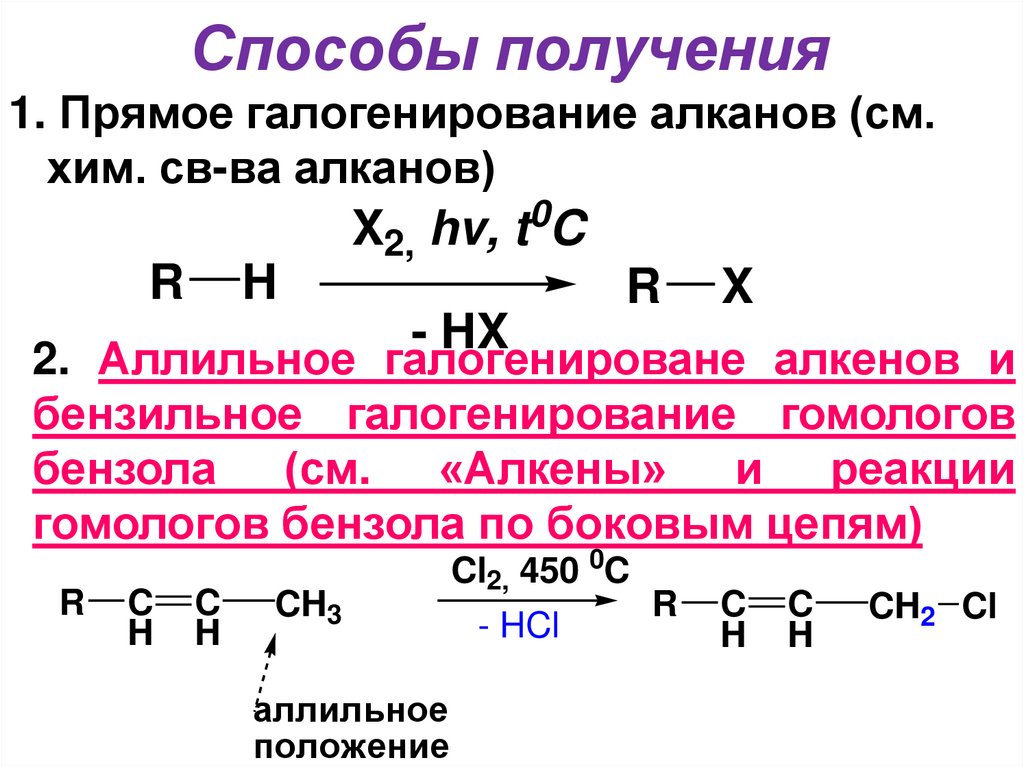
9. Способы получения
1. Прямое галогенирование алканов (см.хим. св-ва алканов)
0
X2, hv, t C
R
H
R
X
- HX
2. Аллильное галогенироване алкенов и
бензильное галогенирование гомологов
бензола (см. «Алкены» и реакции
гомологов бензола по боковым цепям)
R
C
H
C
H
CH3
аллильное
положение
Cl2, 450 0C
- HCl
R
C
H
C
H
CH2 Cl
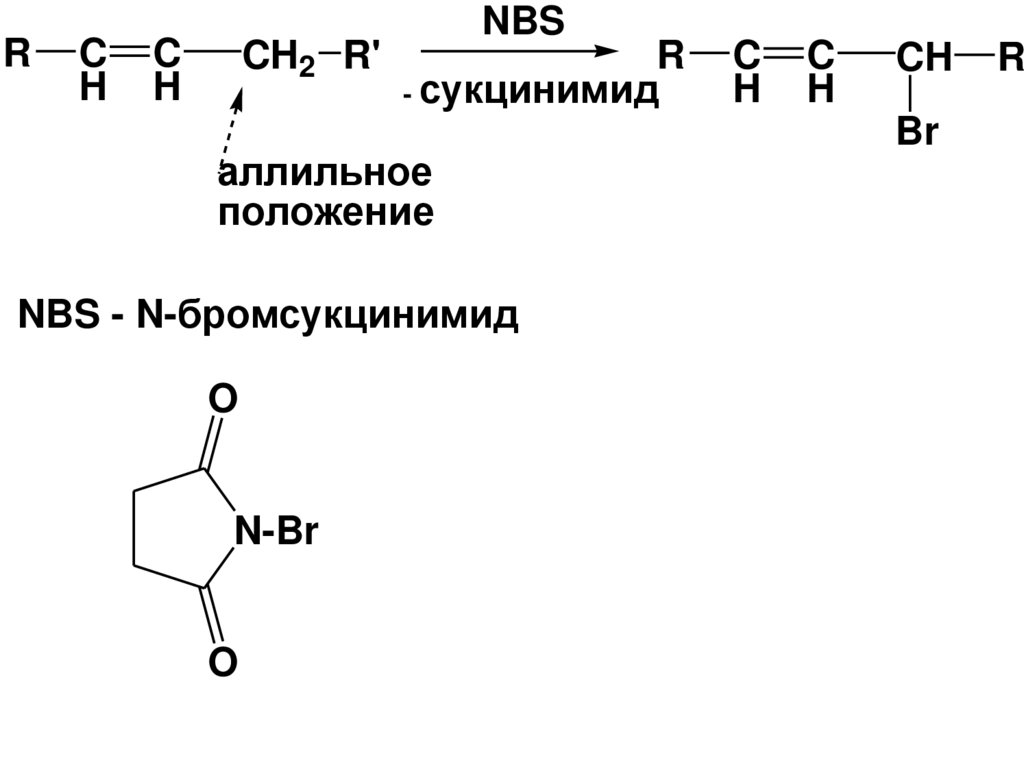
10.
RC
H
C
H
CH2 R'
NBS
R
- сукцинимид
аллильное
положение
NBS - N-бромсукцинимид
O
N-Br
O
C
H
C
H
CH
Br
R
11.
H2C R
Br2, hv, t 0C
бензильное
положение
- HBr
H
C
R
Br
12.
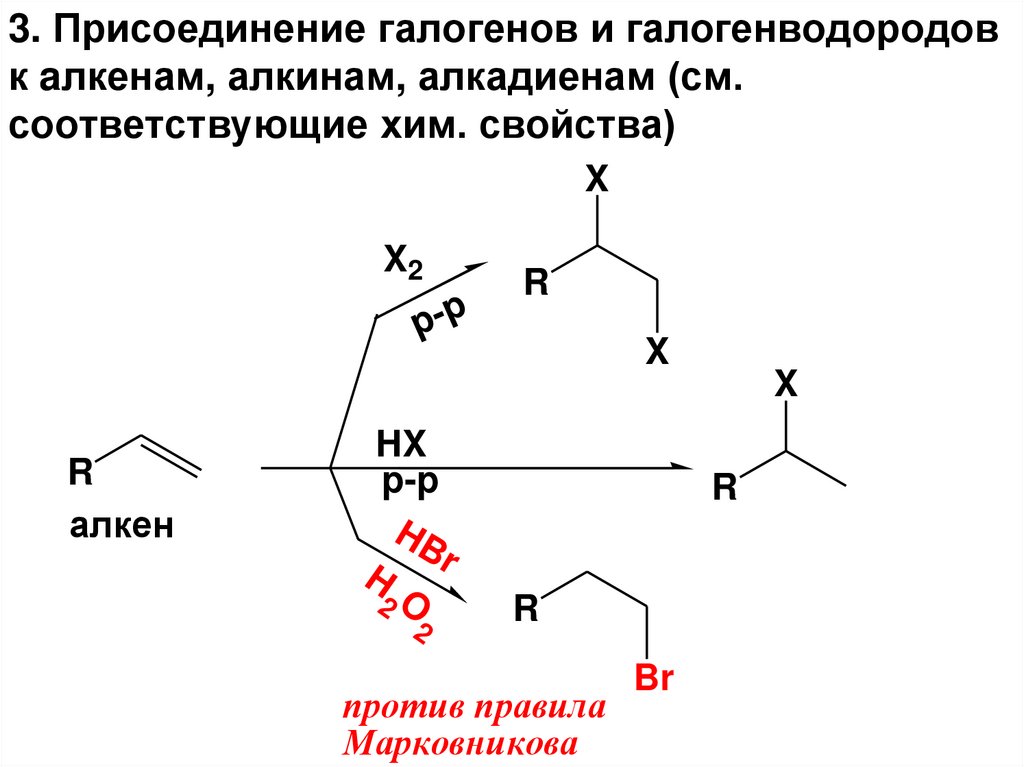
3. Присоединение галогенов и галогенводородовк aлкенам, алкинам, алкадиенам (см.
соответствующие хим. свойства)
X
X2
p-p
R
алкен
HX
p-p
HB
H r
2O
2
R
X
X
R
R
против правила
Марковникова
Br
13.
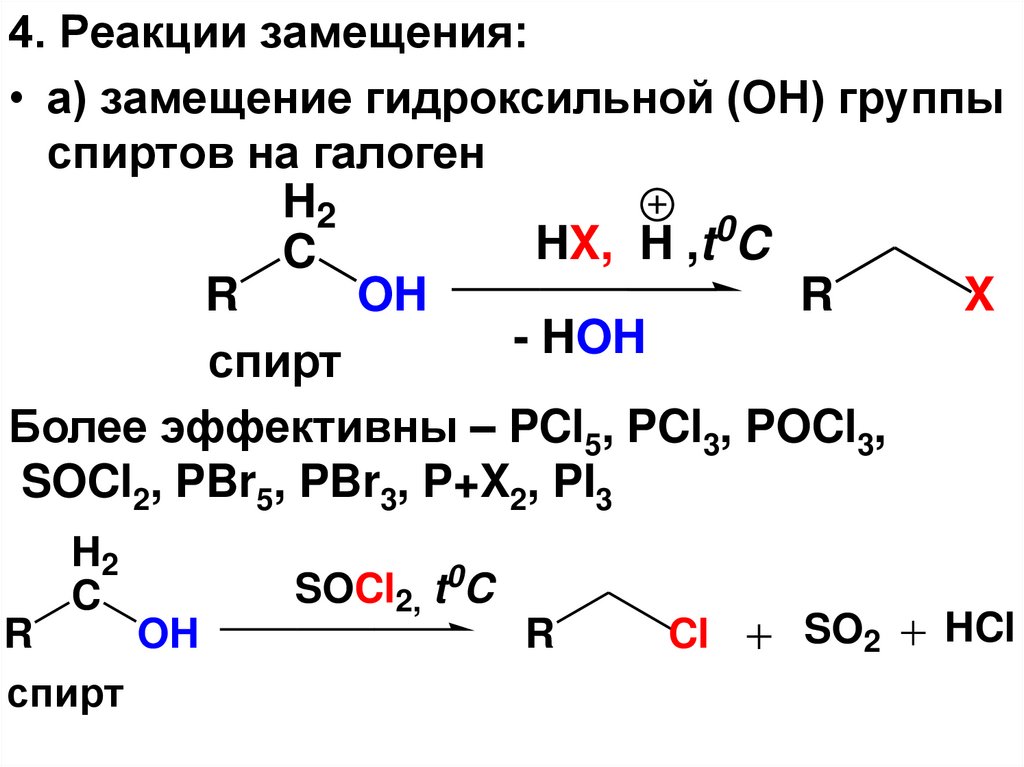
4. Реакции замещения:• а) замещение гидроксильной (ОН) группы
спиртов на галоген
H2
0
HX,
H
,t
C
C
R
OH
R
X
- HOH
спирт
Более эффективны – PCl5, PCl3, POCl3,
SOCl2, PBr5, PBr3, P+X2, PI3
H2
C
R
OH
спирт
SOCl2, t0C
R
Cl
SO2
HCl
14.
• Реагентом фторирования являетсяSF4.
2 R
H2
C
спирт
OH
SF4
2 R
F
SO2
2HF
15.
• б) замещение атома кислородакарбонильной группы ( >C=O) на 2 атома
галогена (получение геминальных
дигалогенопроизводных)
• Реагенты - PCl5, PBr5, SF4 при нагревании
16.
• в) замещение галогена на другой галогенR
H2
C
NaX'
X
R
ацетон
X'
NaX
17.
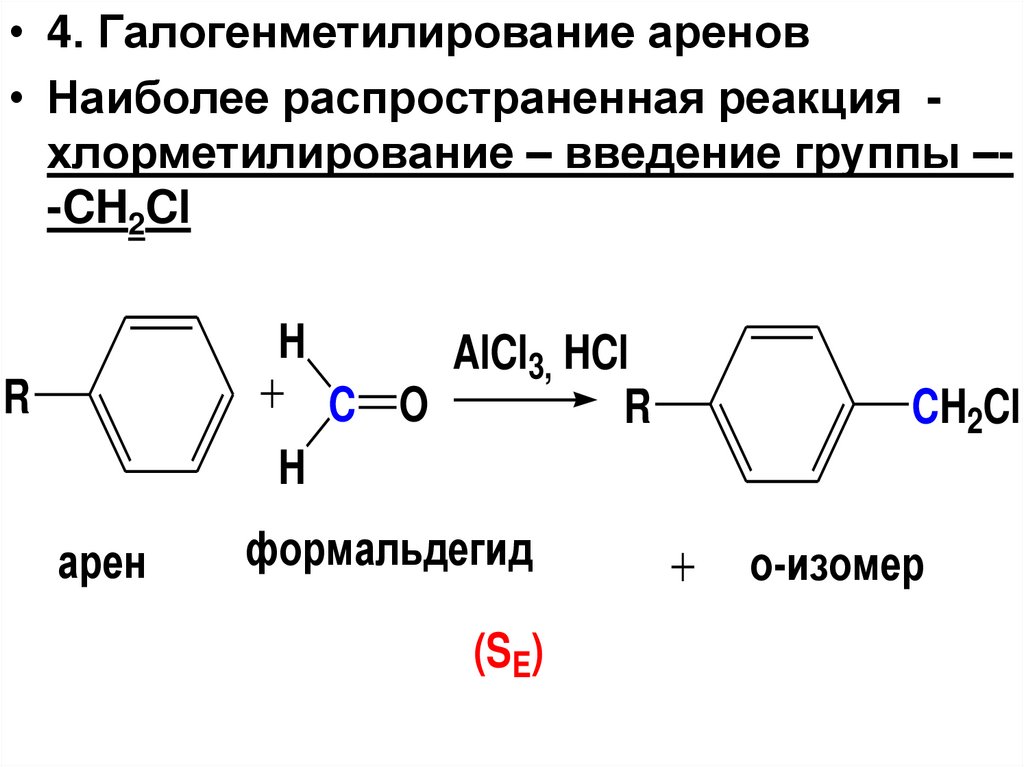
• 4. Галогенметилирование аренов• Наиболее распространенная реакция хлорметилирование – введение группы –-CH2Cl
H
R
AlCl3, HCl
C O
R
CH2Cl
H
арен
формальдегид
(SE)
o-изомер
18. ХИМИЧЕСКИЕ СВОЙСТВА
• Связь С–Х полярная - обладают высокойреакционной способностью
Alk-X проявляют высокую
склонность к реакция замещения при
взаимодействии с нуклеофильными
реагентами – SN -реакции
19.
• Галогеналкилы –алкилирующие средства.
Они отдают другим
молекулам свои алкильные
остатки (R-) вместо
подвижных атомов и групп
(H, металлы и др.) - реакция
алкилирования.
20.
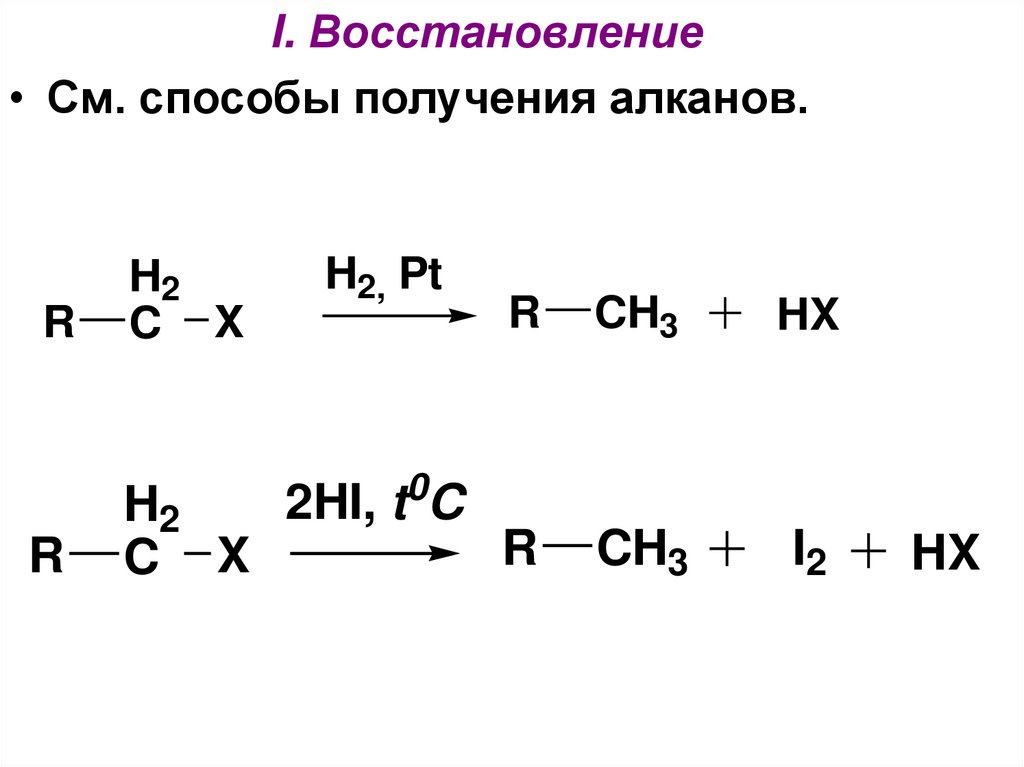
I. Восстановление• См. способы получения алканов.
R
H2
C X
H2, Pt
R
CH3
HX
2HI, t C
H2
R
C X
CH3
I2
0
R
HX
21.
II. Замещение галогена металлом• Осуществляется путем взаимодействия
R–Х со щелочными металлами и
приводит к образованию
металлоорганических соединений (через
образование анион-радикалов и
свободных радикалов)
R
H2
C X
2Na
NaX
R H2C Na
Na- органическое
соединение
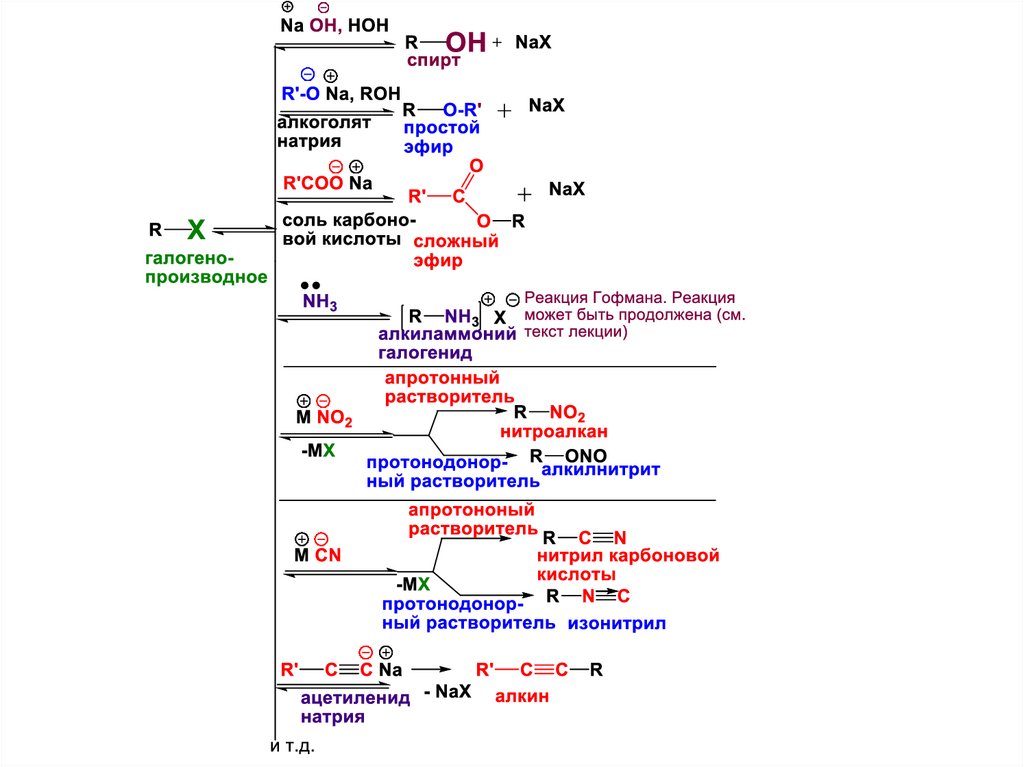
22. III. Замещение галогена нуклеофильными реагентами
SN -реакцииВ
общем
виде
уравнения
галогенопроизводного
а)с нуклеофилом-анионом (Nu- )
реакций
23.
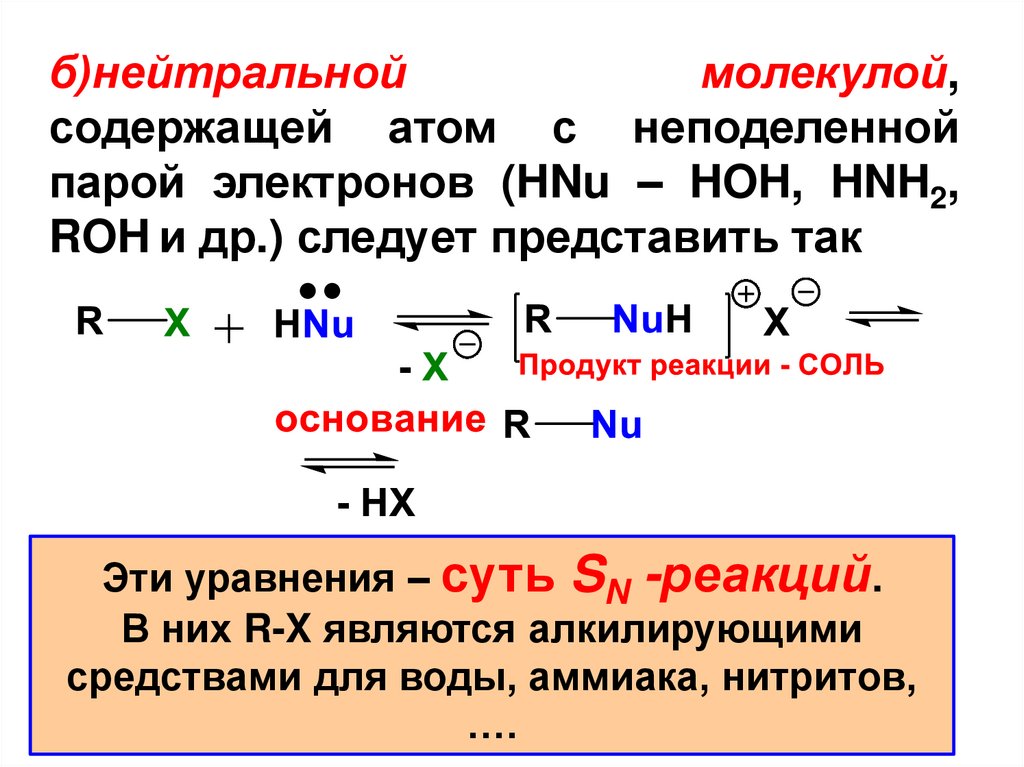
б)нейтральноймолекулой,
содержащей атом с неподеленной
парой электронов (HNu – HOH, HNH2,
ROH и др.) следует представить так
Эти уравнения – суть SN -реакций.
В них R-X являются алкилирующими
средствами для воды, аммиака, нитритов,
….
24.
25.
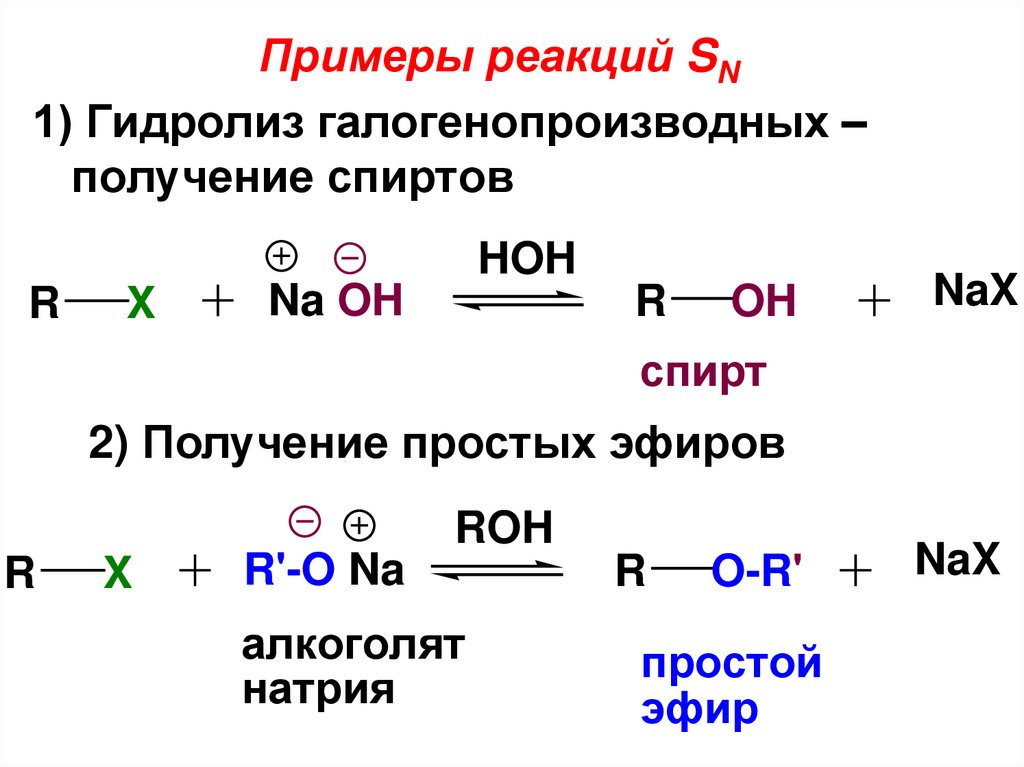
Примеры реакций SN1) Гидролиз галогенопроизводных –
получение спиртов
HOH
R
X
Na OH
R
OH
NaX
спирт
2) Получение простых эфиров
ROH
R
X
R'-O Na
R
алкоголят
натрия
простой
эфир
O-R'
NaX
26.
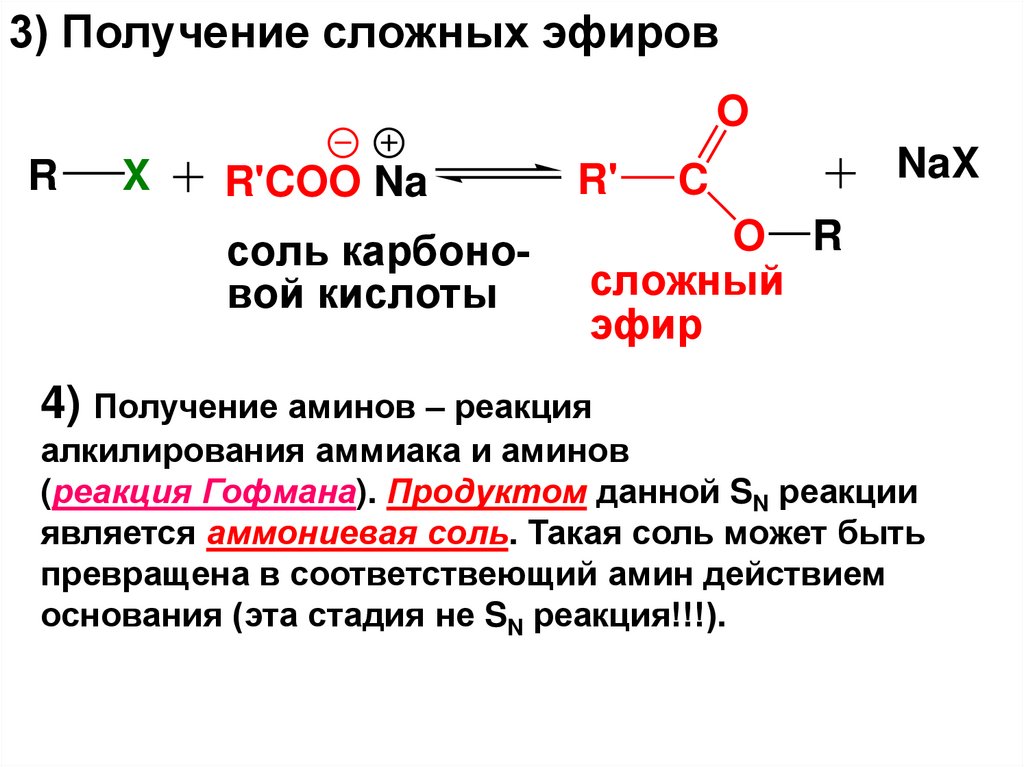
3) Получение сложных эфировO
R
X
R'COO Na
R'
C
соль карбоновой кислоты
O R
сложный
эфир
NaX
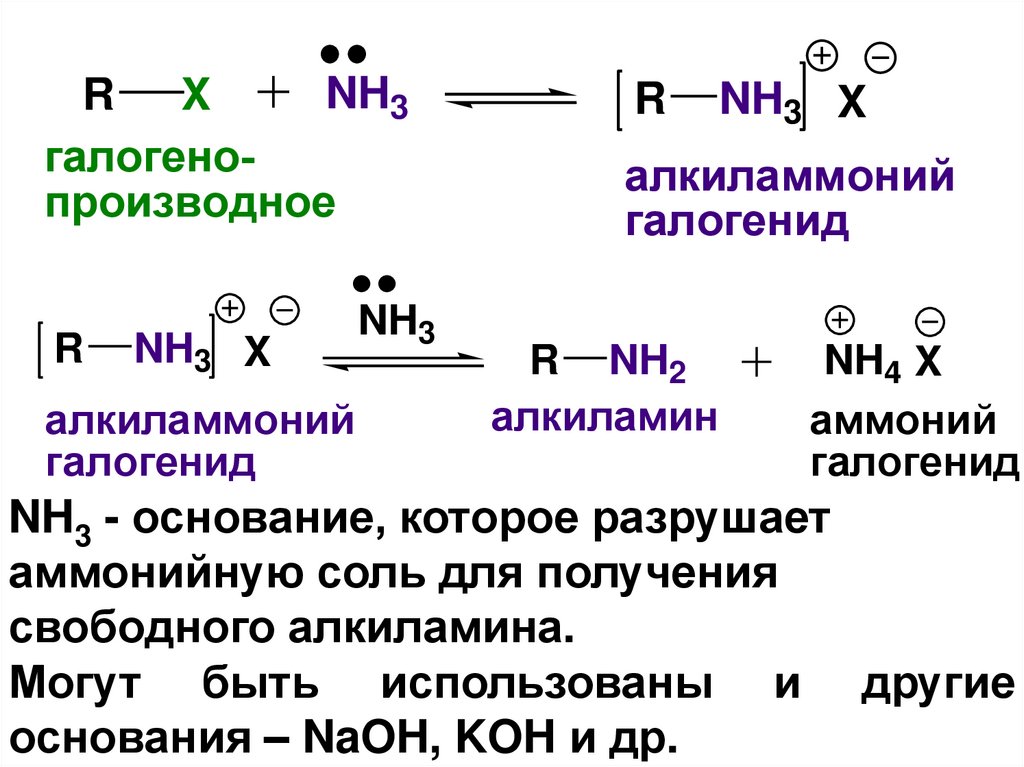
4) Получение аминов – реакция
алкилирования аммиака и аминов
(реакция Гофмана). Продуктом данной SN реакции
является аммониевая соль. Такая соль может быть
превращена в соответствеющий амин действием
основания (эта стадия не SN реакция!!!).
27.
NH3R X
галогенопроизводное
R
NH3 X
алкиламмоний
галогенид
NH3
R
NH3 X
алкиламмоний
галогенид
R NH2
алкиламин
NH4 X
аммоний
галогенид
NH3 - основание, которое разрушает
аммонийную соль для получения
свободного алкиламина.
Могут быть использованы и другие
основания – NaOH, KOH и др.
28.
Реакция может быть продолженаR'
R
R
X
R' NH2
галогеноалкиламин
производное
R'
R
NH2 X
NH3
диалкиламмоний
галогенид
NH2 X
диалкиламмоний
галогенид
R'
R
NH
диалкиламин
NH4 X
аммоний
галогенид
29.
R'R'
R
R
X
R NH
галогенодиалкиламин
производное
NH
X
R
триалкиламмоний
галогенид
R'
R
NH
R'
NH3
X
R
триалкиламмоний
галогенид
R
N
R
триалкиламин
NH4 X
аммоний
галогенид
30.
R'R'
R X
R N
галогеноR
производное
триалкиламин
R
N
R
X
R
тетраалкиламмоний
галогенид
31.
5) Получение нитросоединений (R-NO2) иалкилнитритов (R-ONO)
апротонный
растворитель
R NO2
нитроалкан
R X
M NO2
галогенопроизводное
-MX
R
протонодонорный растворитель
R
X
AgNO2
нитрит - AgX
серебра
ONO
алкилнитрит
R ONO
алкилнитрит
32.
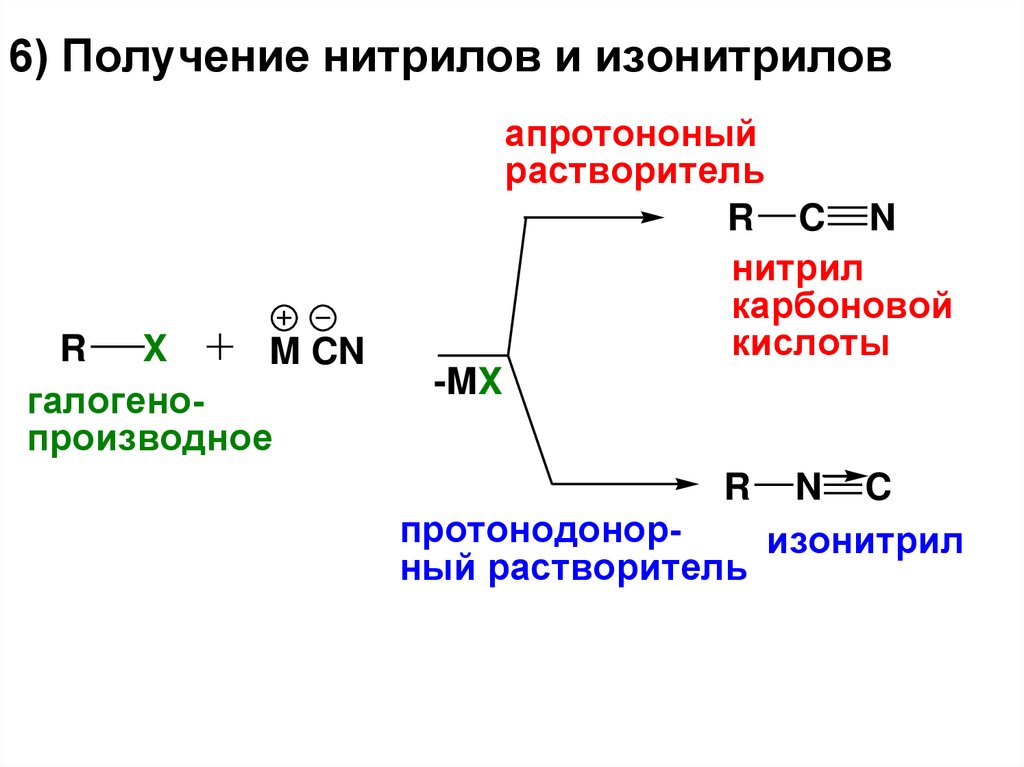
6) Получение нитрилов и изонитриловR
X
M CN
галогенопроизводное
апротононый
растворитель
R C N
нитрил
карбоновой
кислоты
-MX
R
протонодонорный растворитель
N C
изонитрил
33.
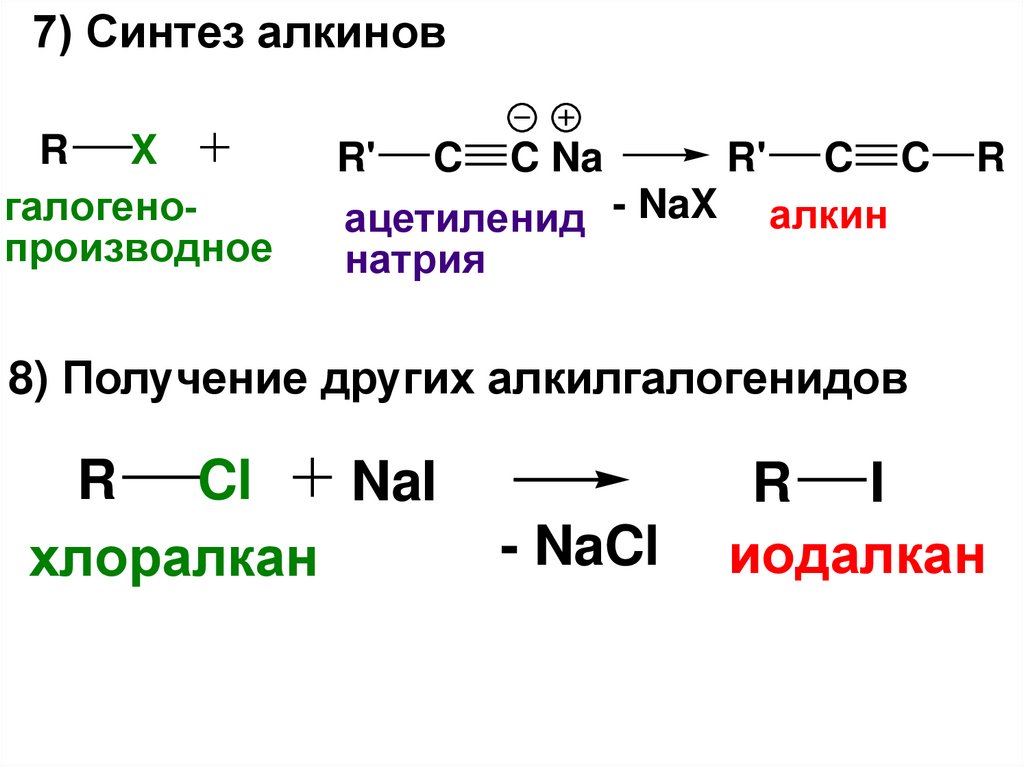
7) Синтез алкиновR
X
галогенопроизводное
R' C C Na
R' C C
ацетиленид - NaX алкин
натрия
R
8) Получение других алкилгалогенидов
R Cl
NaI
хлоралкан
- NaCl
R I
иодалкан
34.
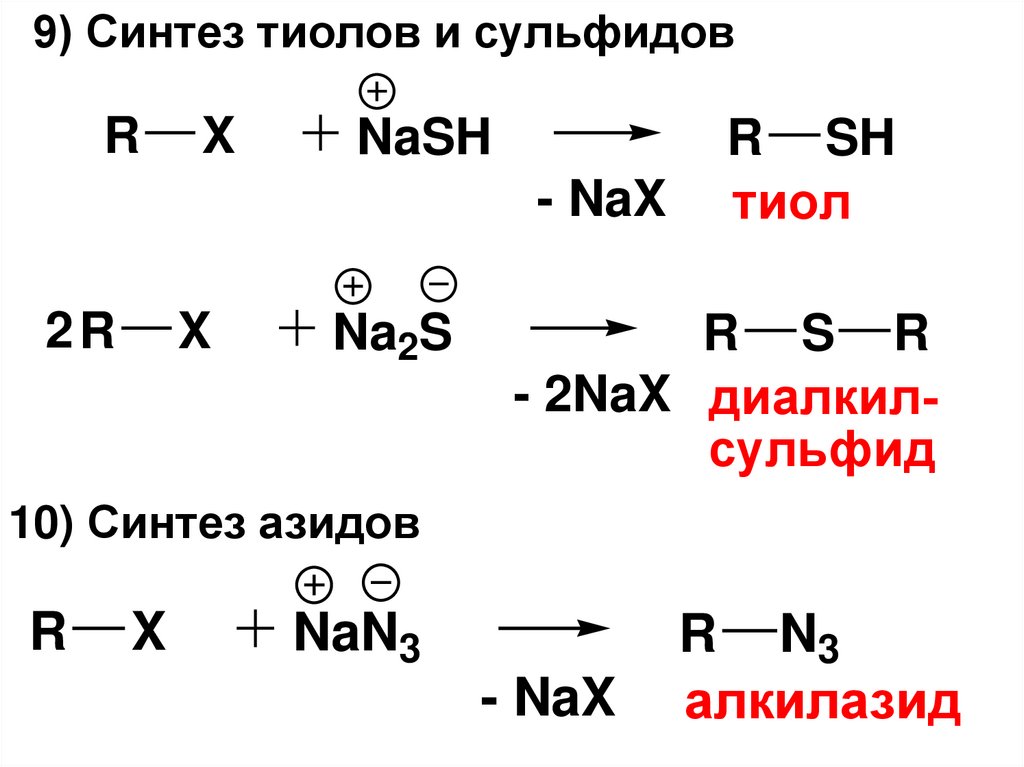
9) Синтез тиолов и сульфидовR
X
NaSH
- NaX
2R
X
Na2S
R SH
тиол
R S R
- 2NaX диалкилсульфид
10) Синтез азидов
R
X
NaN3
- NaX
R N3
алкилазид
35.
SN1 –реакции (мономолекулярные) – реакциинуклеофильного замещения, скорость
которых зависит только от
концентрации галегенопроизводного
(субстрата) и не зависит от
концентрации нуклеофильного
реагента. Такие реакции описываются
уравнением реакции 1-ого порядка.
36.
SN 2 реакции –скорость таких нуклеофильных реакций
зависит как от концентрации
галогенопроизводного (субстрата) так и
от концентрации нуклеофильного
реагента и описывается уравнением
реакции 2-ого порядка
(бимолекулярные реакции).
37.
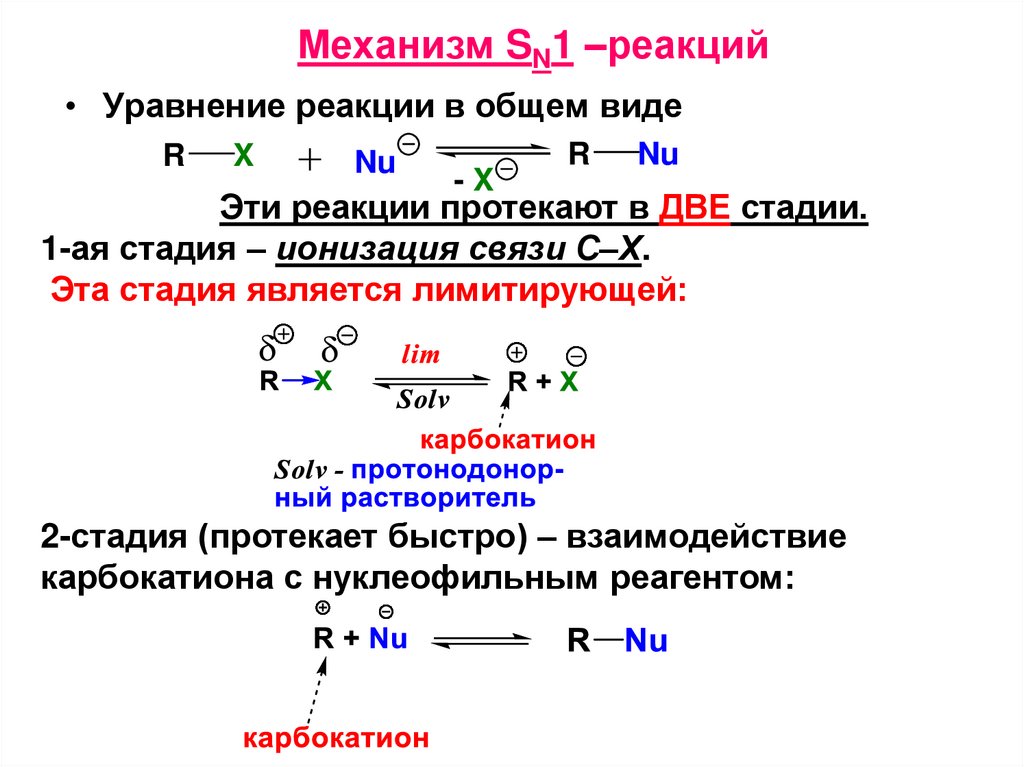
Механизм SN1 –реакций• Уравнение реакции в общем виде
R
X
Nu
-X
R
Nu
Эти реакции протекают в ДВЕ стадии.
1-ая стадия – ионизация связи С–Х.
Эта стадия является лимитирующей:
2-стадия (протекает быстро) – взаимодействие
карбокатиона с нуклеофильным реагентом:
38.
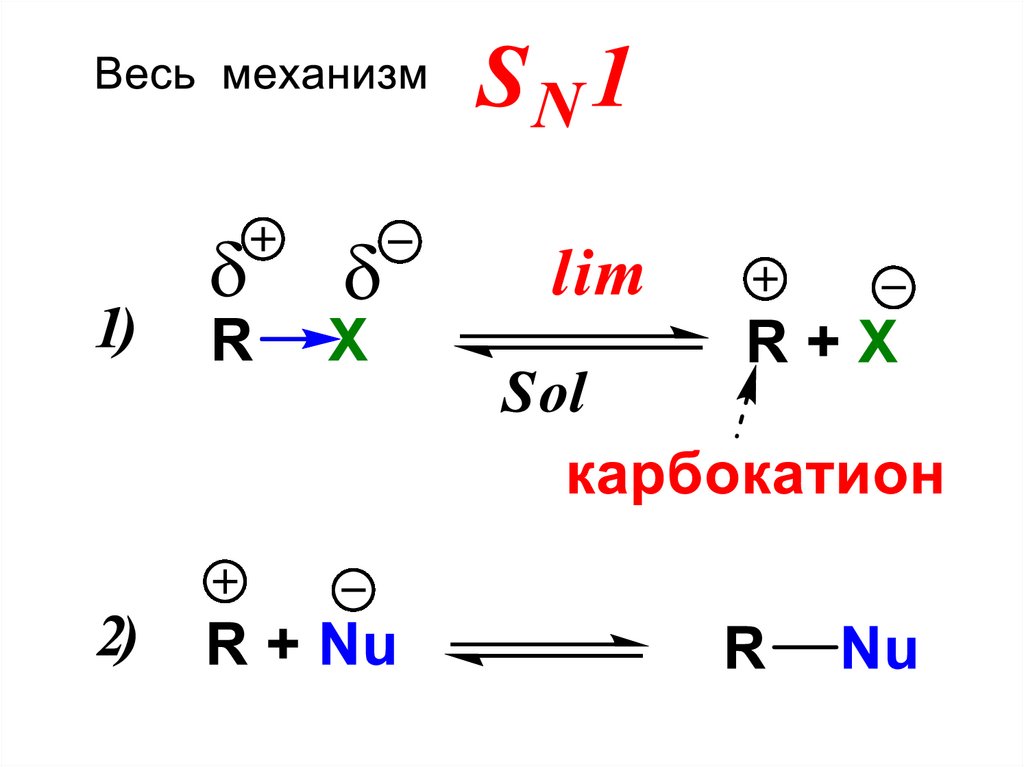
39.
Т.к. суммарная скорость реакцииопределяется скоростью самой
медленной стадии, то она становится
для SN1 реакции пропорциональна
только концентрации субстрата
VSN1 = k1[R-X] - мономолекулярная
реакция
40.
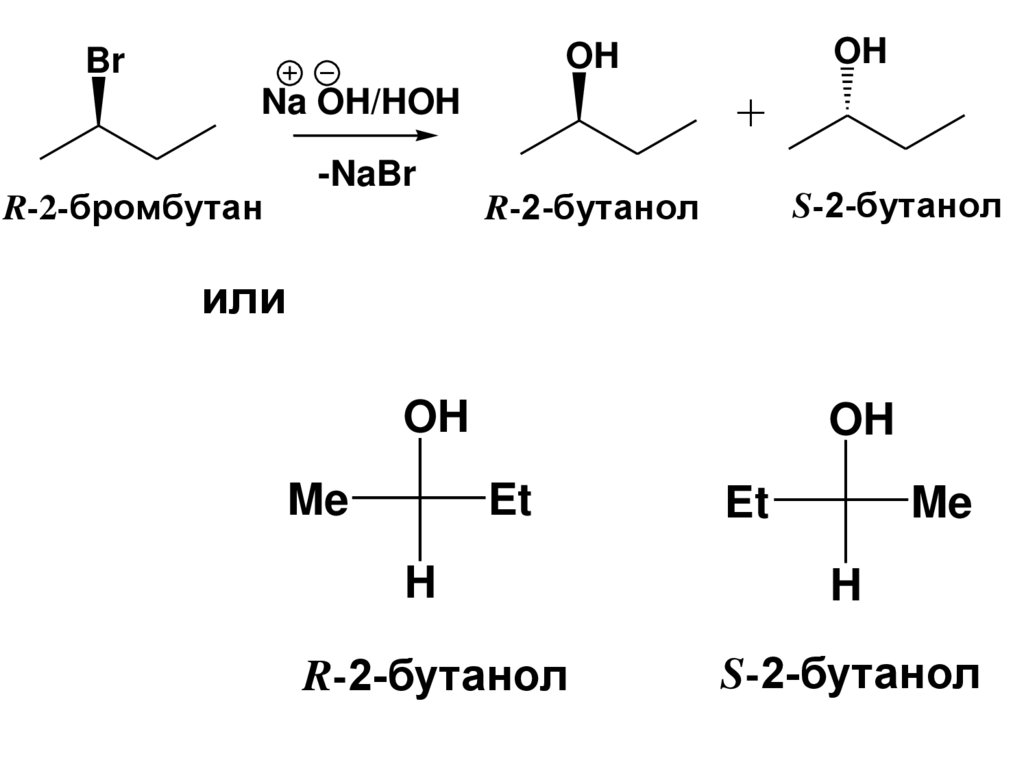
•Стереохимический результат реакции SN1– если в реакцию вступил оптически
активный субстрат произойдет
образование рацемической смеси
(оптическая активность в итоге
реакции исчезнет), т.к. на lim стадии
образуется плоский карбокатион. Атом С в
sp2 гибридном состоянии. Его атака
нуклеофилом осуществляется
равновероятно с обеих сторон плоскости,
в которой находится катионный атом
углерода и его σ-связи, что ведет к
образованию равных количеств обоих
энантиомеров
41.
OHOH
Br
Na OH/HOH
-NaBr
R-2-бромбутан
S-2-бутанол
R-2-бутанол
или
OH
Me
OH
Et
Et
Me
H
H
R-2-бутанол
S-2-бутанол
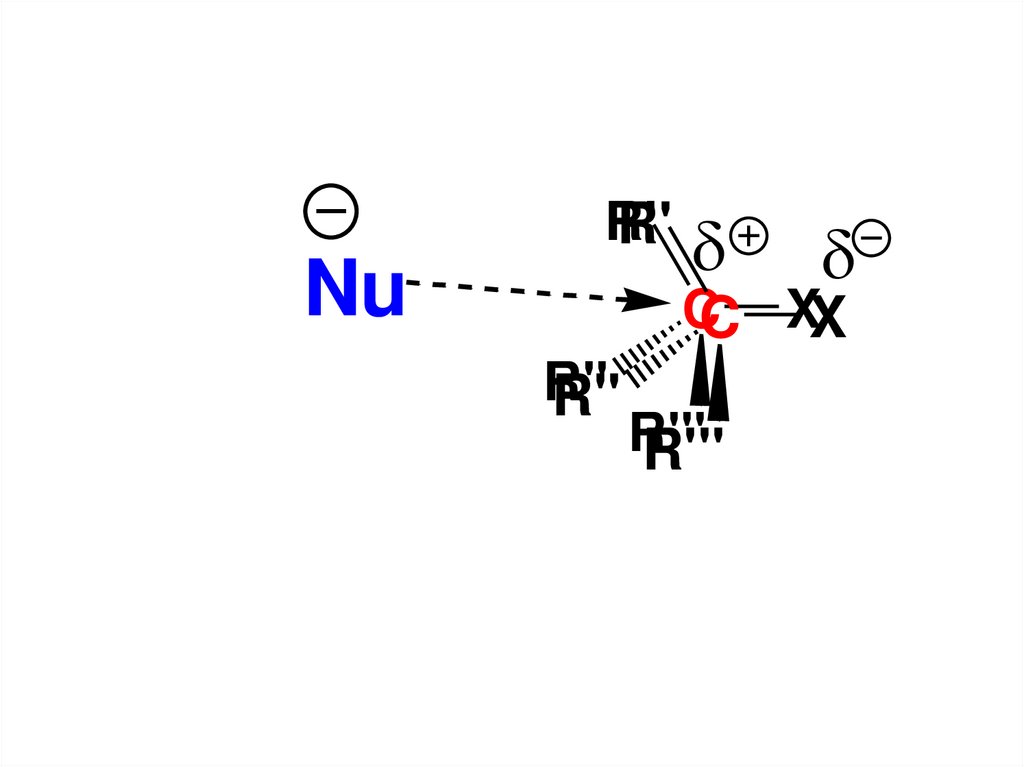
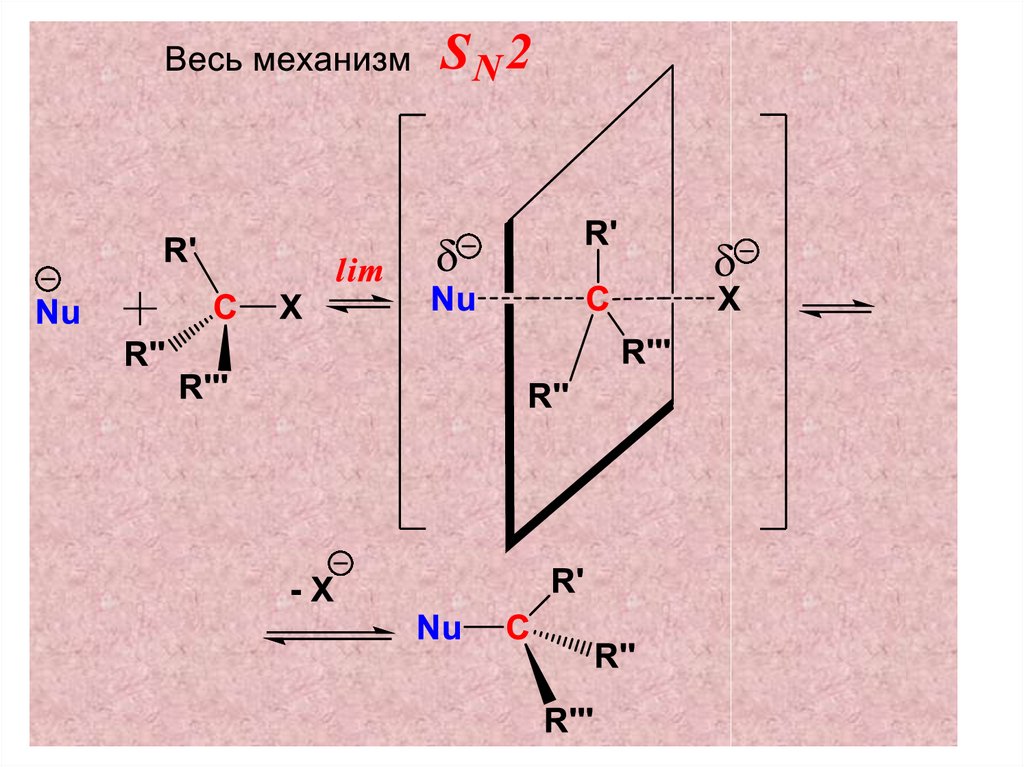
42. Механизм SN2 –реакций
Уравнение реакции в общем виде тоже, что и впредыдущем случае: R
R
X
Nu
-X
Механизм такой реакции и, в частности,
лимитирующая стадия, представляет собой
синхронное образование новой связи С–Nu и
разрыв связи С–Х.
Это такое переходное состояние в котором
старая связь ещё не полностью
разорвалась в то время как новая
связь ещё также не успела
полностью сформироваться.
Nu
43.
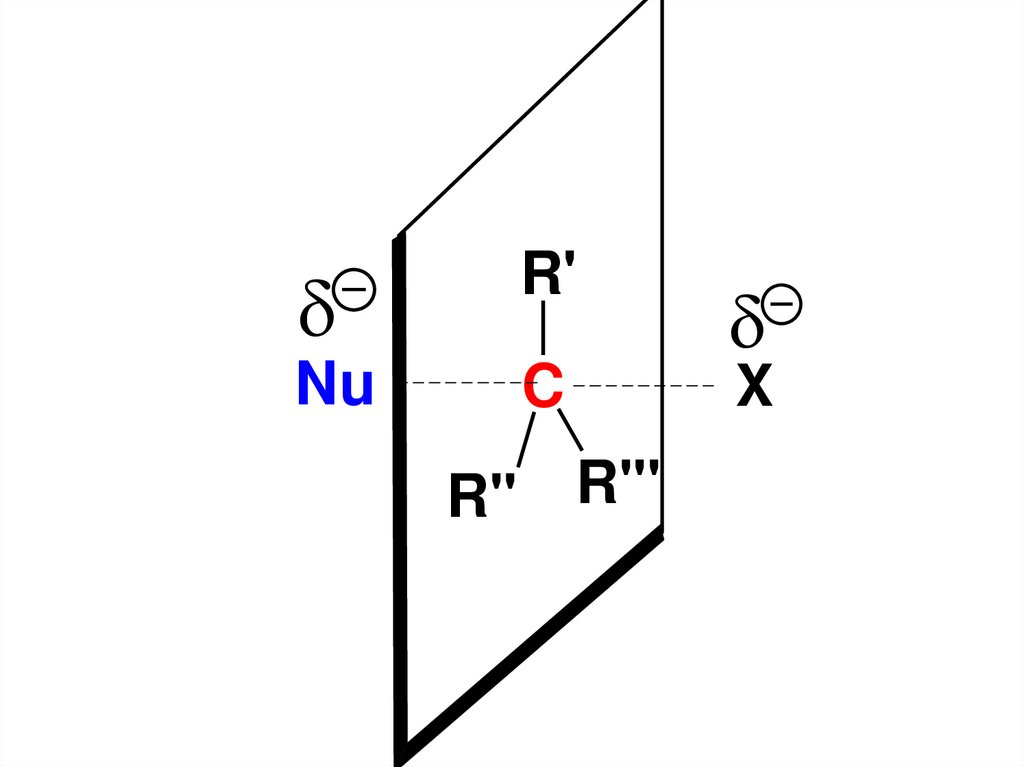
Энергетически такое переходноесостояние наиболее вероятно
образуется, если атака нуклеофила
будет происходить на атом С,
связанный с Х, со стороны
противоположной направлению связи
С–Х («атака с тыла»).
44.
R'R'
Nu
CC XX
R''
R''
R'''
R'''
45.
sp2 гибридноесостояние
lim
R'
Nu
C
X
R''
R'
-X
Nu
C
R''
R'''
R'''
46.
47.
R'Nu
C
R'' R'''
X
48.
Из механизма реакции следует, что влимитирующей стадии реакции
принимает участие как субстрат, так и
реагент. Поэтому выражение для
скорости SN2 реакции имеет вид
VSN2 = k2[R-X][Nu] - бимолекулярная
реакция
49.
•Из механизма реакции видно, что если вреакции SN2 принимает участие оптически
активный субстрат, то в результате SN2
реакции оптическая активность должна
сохраняться, т.к. происходит
целенаправленная атака реагентом «с
тыла», что приводит к образованию только
одного энантиомера. Очевидно, что в таком
случае может измениться знак оптического
вращения (с «-» на «+» и наоборот) –
обращение оптической активности. Такое
изменение знака оптической активности
впервые наблюдал П.Вальден (1896) –
вальденовское обращение.
50.
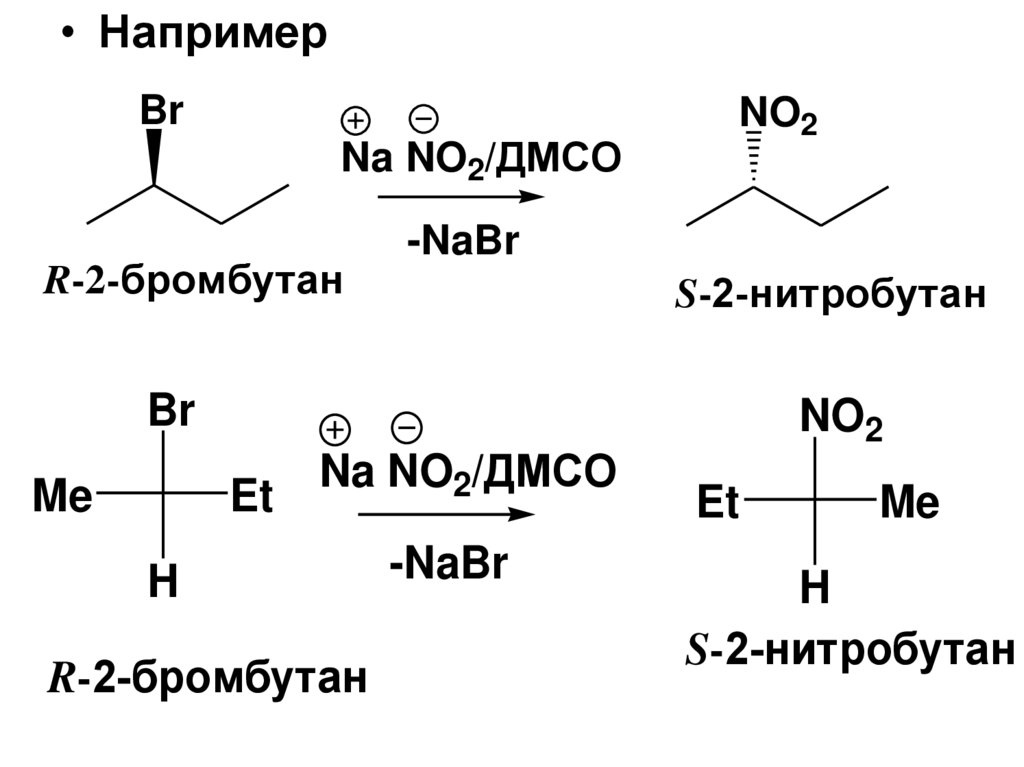
• НапримерBr
NO2
Na NO2/ДМСО
-NaBr
R-2-бромбутан
S-2-нитробутан
Br
NO2
Me
Et
Na NO2/ДМСО
H
R-2-бромбутан
-NaBr
Et
Me
H
S-2-нитробутан
51.
• Итак, стереохимический результатреакций –
• SN2 реакция – обращение
конфигурации;
• SN1 реакции – рацемизация
(исчезновение оптической
активности за счет образования
эквимолярных количеств обоих
энантиомеров)
52.
Влияние различных факторов напротекание реакции по SN1 или SN2
механизмам
В каждой конкретной реакции нуклеофильное замещение
осуществляется по обоим механизмам, однако их скорости могут
сильно различаться (вклад каждой реакции в суммарный процесс
различен). Поэтому суммарный порядок реакции часто бывает
дробным (между 1 и 2).
Скорость и механизм SN-реакций сильно зависит от
ряда факторов –
• 1) строения и концентрации алкилгалогенида
(субстрата),
• 2) полярности растворителя,
• 3) концентрации и природы нуклеофила,
• 4) природы нуклеофуга (уходящей группы),
• 5) температуры и др.
53.
• Как определить какой механизмреакции оказывается преобладающим
в каждой конкретной реакции?
• Следует рассмотреть факторы,
влияющие на механизм SN реакций
• А) Структура субстрата
• 1. В реакции, протекающей по SN1
механизму наиболее активными будут
субстраты, ионизация которых
позволяет получить достаточно
стабильные карбокатионы.
54.
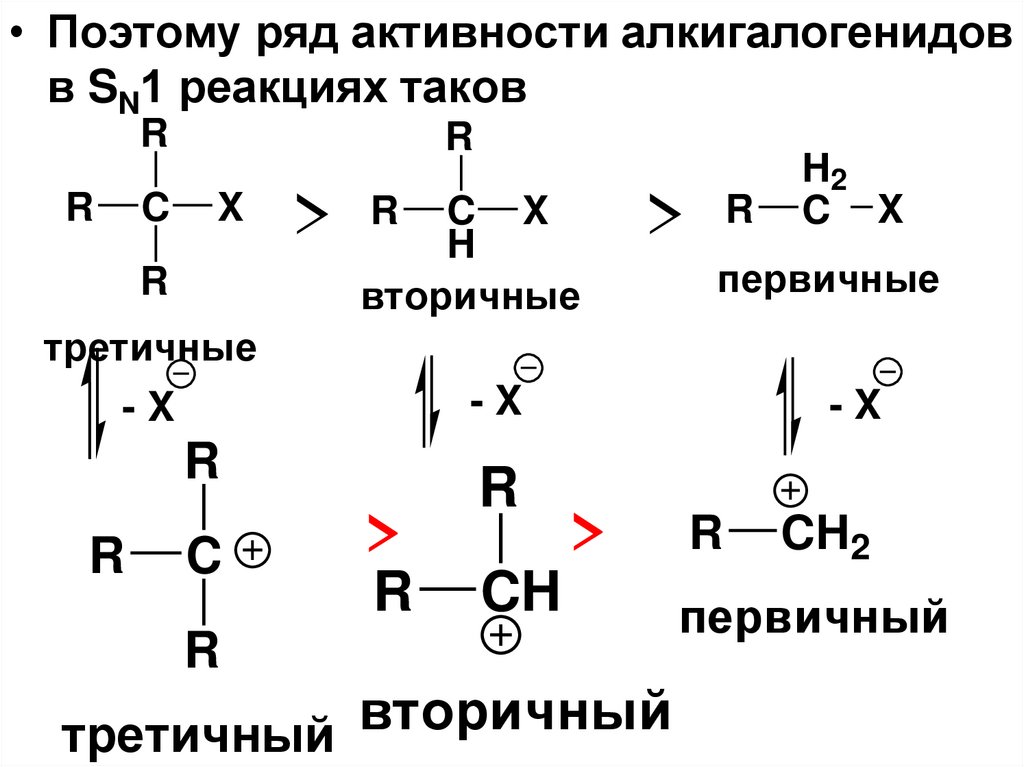
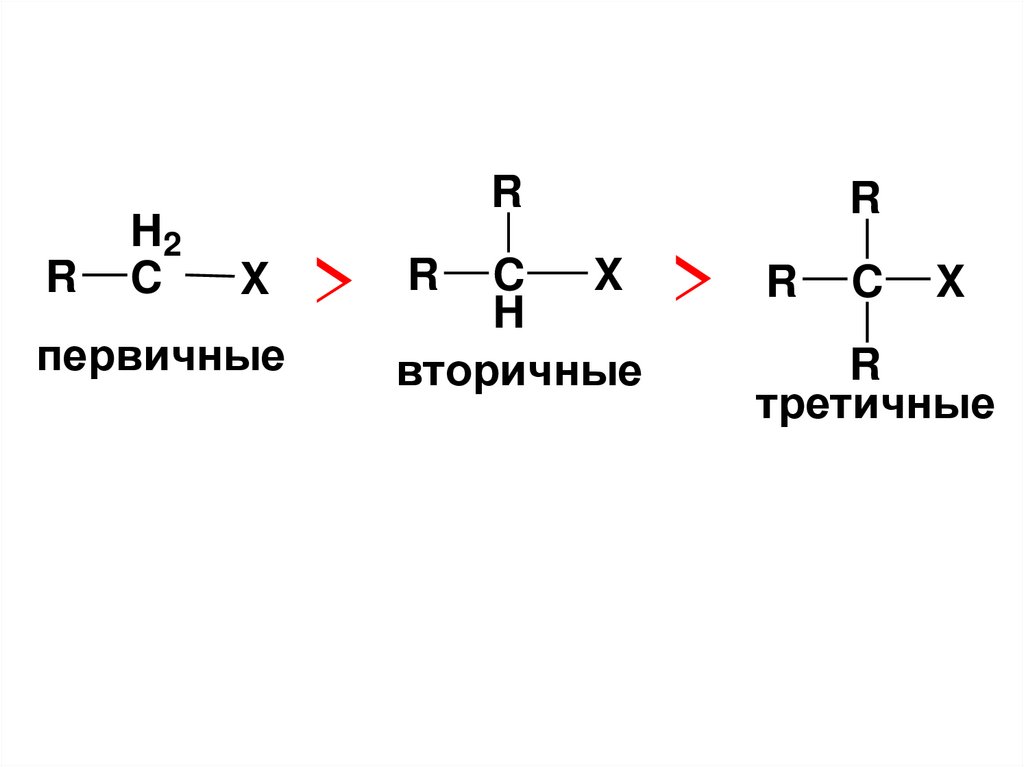
• Поэтому ряд активности алкигалогенидовв SN1 реакциях таков
R
R
C
R
X
R
> R CH X
> R
H2
C X
вторичные
первичные
-X
-X
третичные
-X
R
R
C
>
R
R
>
CH
R
вторичный
третичный
R
CH2
первичный
55.
Пространственные препятствиясущественно не влияют на ход SN1
реакции, т.к. скорость реакции не зависит
от концентрации нуклеофила и его
природы
56.
• 2. В реакции, протекающей по SN2механизму пространственные
факторы оказывают решающее
влияние, т.к. при «атаке с тыла»
большое значение имеет доступность
реакционного центра для атаки
нуклеофилом. При этом объёмные
заместители, очевидно, будут
препятствовать такой атаке. Поэтому
ряд активности алкигалогенидов в
реакции, протекающей по по SN2
механизму таков
57.
RH2
C
R
X
первичные
R
X
> R C X
вторичные
R
третичные
> R CH
58.
• Подтверждением такого фактаявляется то, что неопентилбромид
имеет низкую реакционную
способность в SN реакциях
CH3
H3C
C
H3C H
C
H
Br
59.
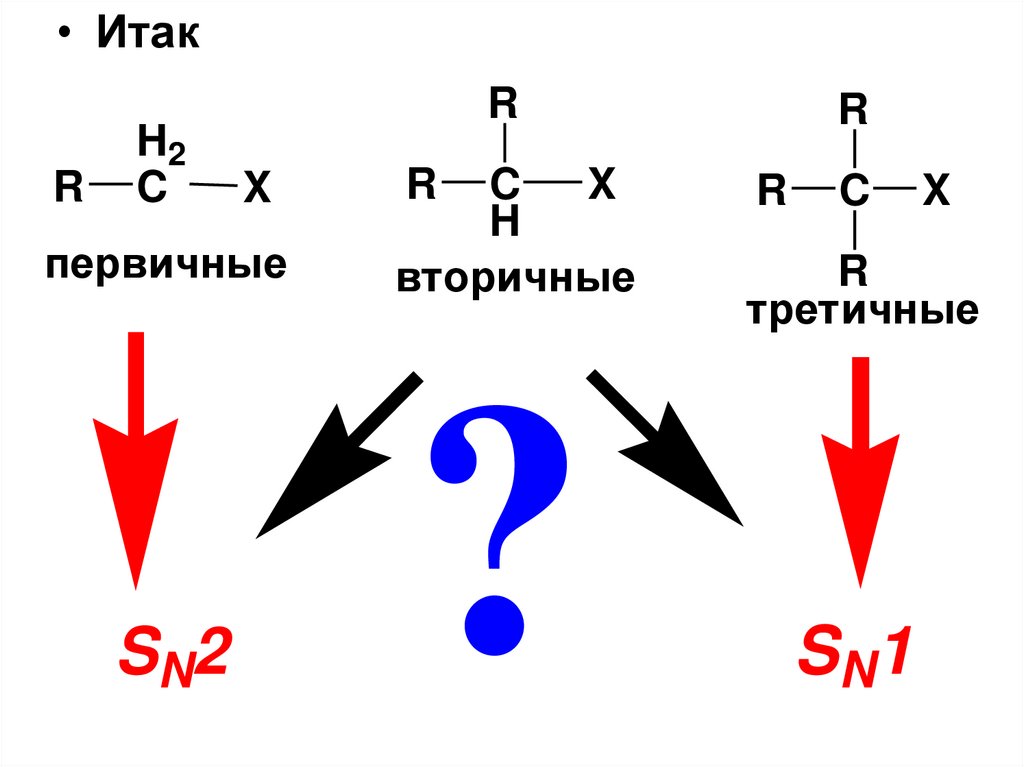
• ИтакR
H2
C
R
X
первичные
SN2
R
C
X
H
вторичные
?
R
R
C
X
R
третичные
S N1
60.
Б) Природа растворителяОсобенно чувствительны к полярности
(ионизирующей способноси) SN1 реакции.
В этом случае, чем лучше растворитель
способен сольватировать анионы и
катионы, тем легче будет происходить
ионизация связи R-X (лимитирующая
стадия SN1 реакций), тем больше будет
скорость этой реакции в целом.
SN1 процессу также способствует
увеличение диэлектрической
проницаемость растворителя.
61.
• Лучшим для SN1 реакции будетрастворитель, способный хорошо
сольватировать как катионы, так и
анионы. Таким растворителем
является HOH, а также растворители,
содержащие атомы с неподеленными
парами электронов и полярные связи
гетероатом-H :
NH3, ROH, RCOOH, и др.
• Они называются – протонодорными
растворителями. Такие растворители
способны образовывать водородные
связи с нуклеофугом.
62.
Для SN2 реакций влияние полярностирастворителя сводится к тому, как
такой растворитель способен
сольватировать переходное
состояние. Наиболее подходящими
растворителями в этом случае
являются апротонные растворители
такие как диметилсульфоксид
(ДМСО), диметилформамид (ДМФА),
ацетон, ацетонитрил, диоксан,
тетрагидрофуран (ТГФ).
63.
Влияние растворителя следует учитывать преждевсего в тех случаях, когда трудно сделать
окончательный вывод о преобладании либо SN1 либо
SN2 механизма только на основании структуры
субстрата. А именно:
R
H2
C
R
X
C
X
H
вторичные
?
C
X
R
третичные
й
SN2
R
ны
ор
он ль
о д те
он ри
от во
пр аст
р
а
ра пр
ст ото
во н
ри ны
те й
ль
первичные
R
R
S N1
64.
В) Нуклеофильность реагента• Нуклеофильность – главная
характеристика реагента в SN2
реакциях.
• Нуклеофильность – способность
реагента взаимодействовать с
электрофильным атомом С за счет
своей электронной пары.
• Основность – способность
связывать протон за счет своей
электронной пары
65.
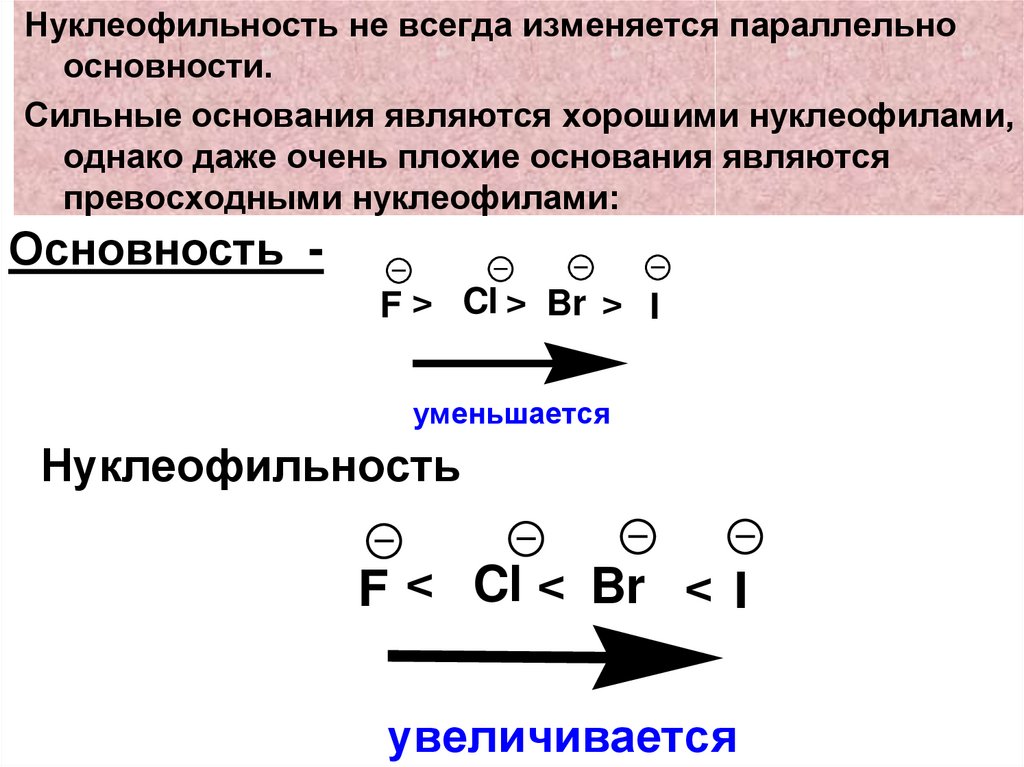
Нуклеофильность не всегда изменяется параллельноосновности.
Сильные основания являются хорошими нуклеофилами,
однако даже очень плохие основания являются
превосходными нуклеофилами:
Основность F > Cl > Br > I
уменьшается
Нуклеофильность
F < Cl < Br < I
увеличивается
66.
• Нуклеофильность зависит отполяризуемости, которая
возрастает при переходе от F к I, т.к.
растет радиус атомов.
• Чем > поляризуемость тем >
нуклеофильность
• Поэтому хорошими нуклеофилами
являются фенолят-анион (С6Н5O--),
сульфид-анион.
67.
• Различие в основности и нуклеофильностигалогенид-анионов может быть связано с
различием в Есольватации этих ионов.
Есольватации > для аниoнов небольших
размеров с высокой концентрацией
отрицательного заряда
(F->Cl-).
• У больших ионов заряд более диффузный.
•Поэтому ионы небольших размеров должны
преодолеть значительный энергетический
барьер для разрушения сольватных
оболочек прежде, чем приблизиться к
реакционному центру субстрата.
68.
Г) Природа нуклеофугаНуклеофуг – уходящая группа в SN реакциях
От природы нуклеофуга зависит реакционная
способность субстрата как в SN1 так и в SN2 реакциях
Существует корреляция между реакционной
способностью R-X и силой кислоты НХ, отщепляющейся
в результате реакции.
Также как сила галогенводородных кислот изменяется
ряду
HI > HBr > HCl > HF
Соответственно реакционная способность
галогеналкилов в SN уменьшается в ряду
R-I > R-Br > R-Cl > R-F
69.
• Хорошие нуклеофуги – анионыкислородсодержащих кислот –
серной, азотной, хлорной,
органических сульфокислот.
• Плохой нуклеофуг – гидроксильная
группа (ОН-группа) спиртов. Поэтому
реакцию замещения этой группы
проводят в кислой среде, когда она
превращается в НОН за счет
протонирования
70.
Амбидентностьнуклеофильных реагентов
Амбидентные нуклеофилы обладают
двумя реакционными центрами и
поэтому обладают двоякой
реакционной способностью.
К таким реагентам относятся анионы
NO2 , CN , N3 , OCN , SCN и др.
71.
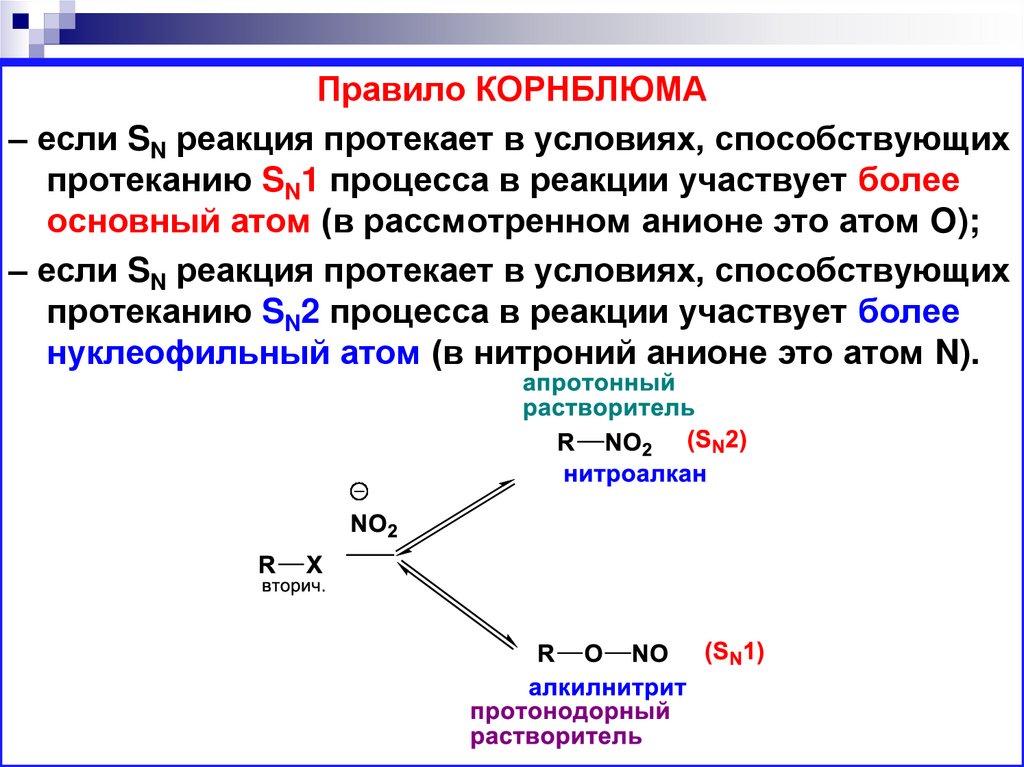
В зависимости от условий проведения реакции этианионы могут взаимодействовать с атомом С
субстрата с участием разных реакционных центров.
Например нитрит анион
• Обладает двумя реакционными центрами
– атом N и атом O
• Атом О - более электроотрицательный
(более основный),
• а атом N - более нуклеофильный (имеет
больший размер).
72.
Правило КОРНБЛЮМА– если SN реакция протекает в условиях, способствующих
протеканию SN1 процесса в реакции участвует более
основный атом (в рассмотренном анионе это атом O);
– если SN реакция протекает в условиях, способствующих
протеканию SN2 процесса в реакции участвует более
нуклеофильный атом (в нитроний анионе это атом N).
73.
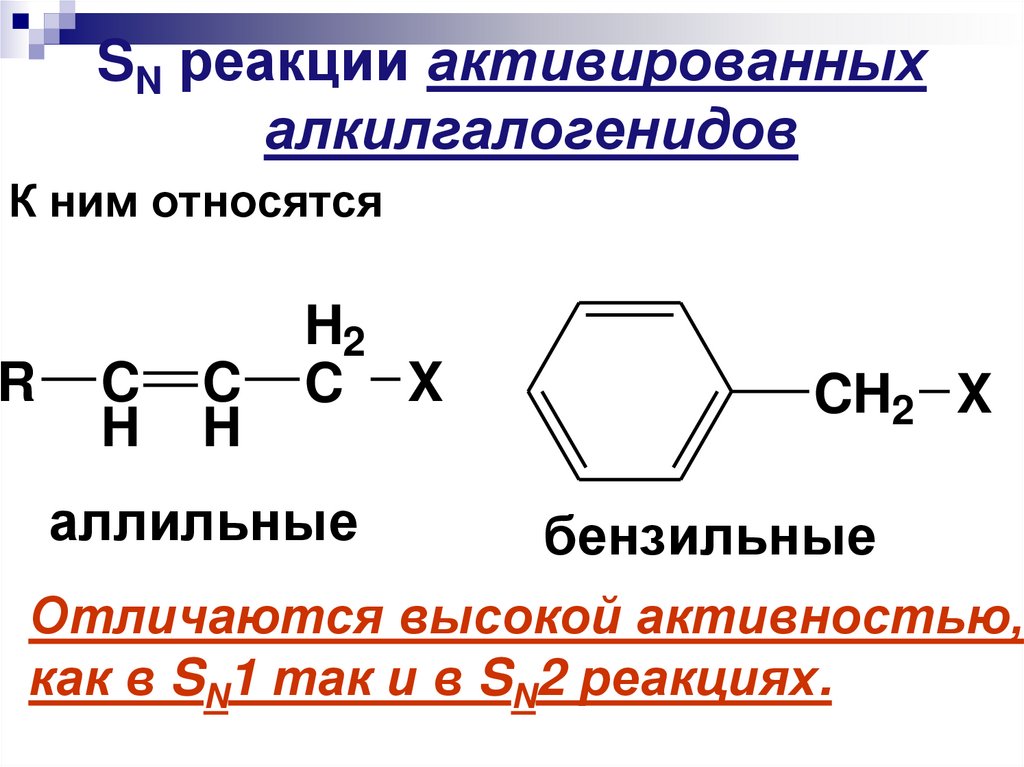
SN реакции активированныхалкилгалогенидов
К ним относятся
R
C
H
C
H
H2
C X
аллильные
CH2 X
бензильные
Отличаются высокой активностью,
как в SN1 так и в SN2 реакциях.
74.
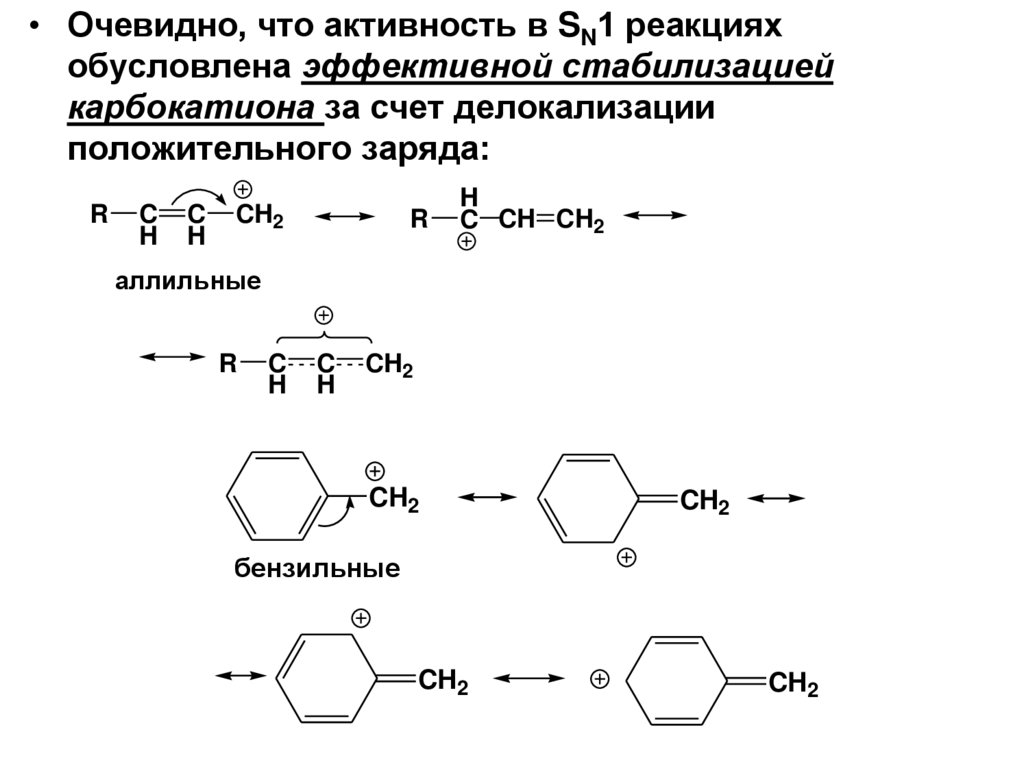
• Очевидно, что активность в SN1 реакцияхобусловлена эффективной стабилизацией
карбокатиона за счет делокализации
положительного заряда:
R
C
H
C
H
CH2
R
H
C CH CH2
аллильные
R
C
H
C
H
CH2
CH2
CH2
бензильные
CH2
CH2
75.
• Причина высокой активности этихсубстратов в SN2 реакциях не
получила окончательной оценки.
Одно из объяснений состоит в том,
что двойная связь или
ароматический цикл принимают
участие в стабилизации переходного
состояния, чем способствуют его
более легкому достижению.
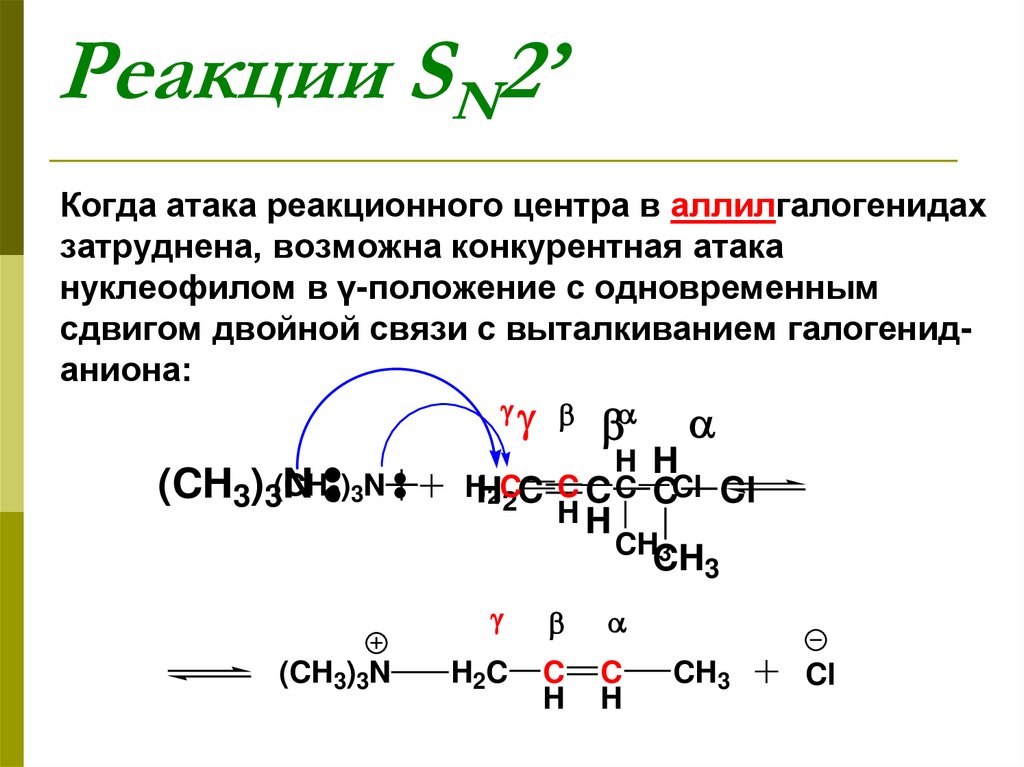
76. Реакции SN2’
Когда атака реакционного центра в аллилгалогенидахзатруднена, возможна конкурентная атака
нуклеофилом в γ-положение с одновременным
сдвигом двойной связи с выталкиванием галогениданиона:
(CH3)3(CH
N 3)3N
H H
HH2C
C C CCl Cl
2C C
HH
CH3
CH3
(CH3)3N
H2 C
C
H
C
H
CH3
Cl
77.
• Стереохимической особенностьюэтих реакций является то, что
нуклеофил подходит к молекуле с той
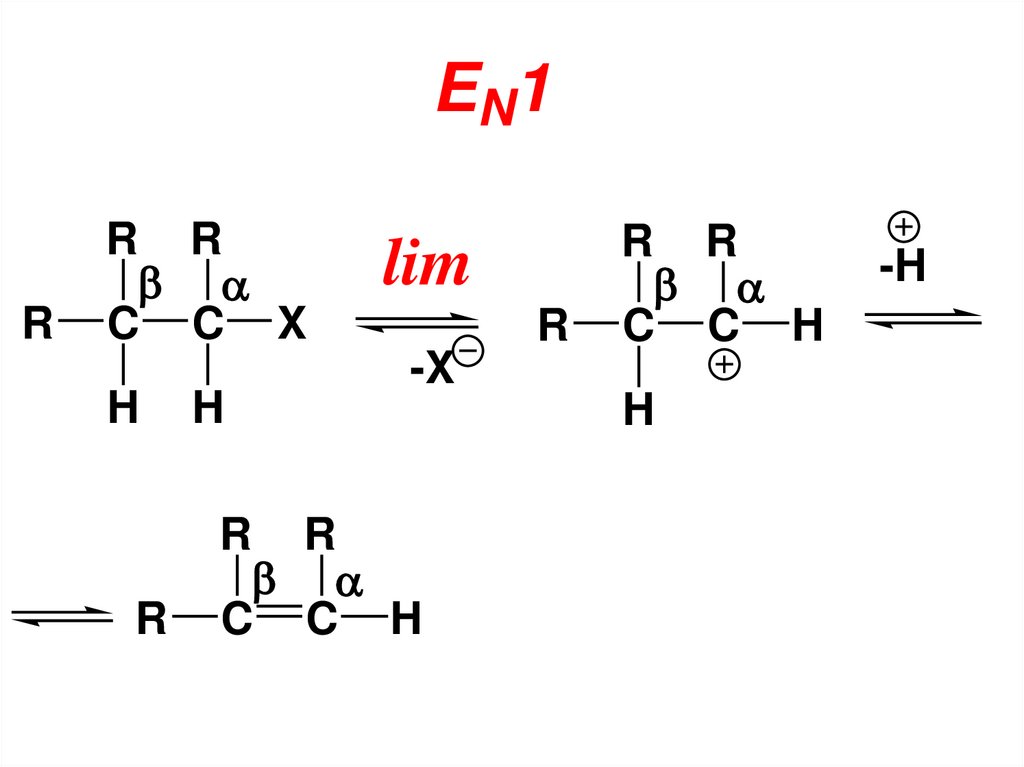
же стороны с которой уходит
нуклеофуг.
78. IV. Реакции элиминирования (отщепления)
• а) β-элиминирование(образование алкенов)
Символ EN
• Реакции отщепления представляют
собой процесс обратный
присоединению к алкенам.
Естественно, что в результате βэлиминирования образуются
алкены.
79.
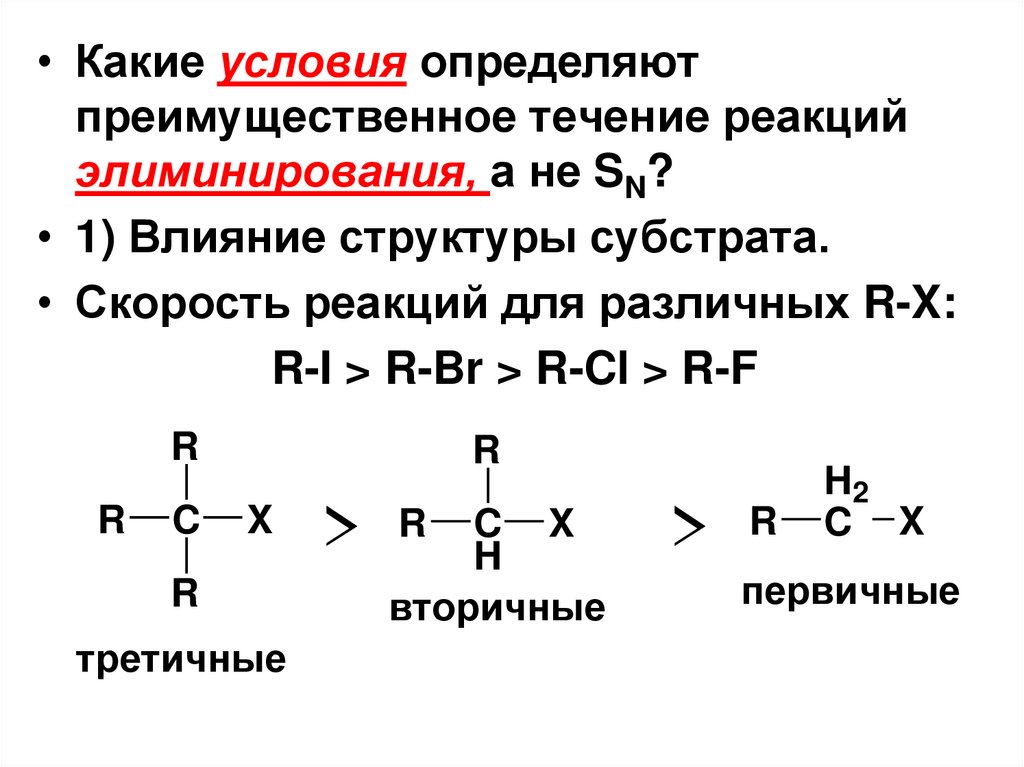
• Какие условия определяютпреимущественное течение реакций
элиминирования, а не SN?
• 1) Влияние структуры субстрата.
• Скорость реакций для различных R-X:
R-I > R-Br > R-Cl > R-F
R
R
C
R
X
R
третичные
> R CH X
вторичные
> R
H2
C X
первичные
80.
2) Сильные основания способствуютэлиминированию. По своей
эффективности в отношении
реакций отщепления основания
можно расположить в следующий
ряд:
NH2 > OC2H5 > OH > OCOCH3
3) Повышение температуры реакции
также способствует
преимущественному протеканию
отщепления (ЕN) в сравнении с
замещением (SN)
81.
ртпи
H
- HO
H
(EN)
-X,
OH
-X
H
t 0C
,с
R
H H
C C X
R C CH2
H
алкен
R
H H
C C OH
H
(SN)
H
Реакции SN и ЕN являются конкурирующими
82.
• Как и SN реакции и ЕN реакции бывают1-го и второго порядка (ЕN1 и ЕN2).
1.
ЕN1
• Лимитирующая стадия ЕN1 реакций ионизация галогеналкила с
образованием карбокатиона.
• Вторая стадия стабилизация
карбокатиона за счет выброса протона
• ( не присоединения нуклеофила, что
наблюдалось для SN1 реакций)
83.
EN1R
R R
C C X
lim
R
R R
C C H
-X
H
H
R
R R
C C H
H
-H
84.
• Часто ЕN1 реакции как и SN1 процессысопровождаются перегруппировкой
углеродного скелета молекулы,
связанной с тем, что промежуточно
образующийся карбокатион способен
изомеризоваться с образованием более
стабильного карбокатиона. Новый
карбокатион стабилизируется за счет
выброса протона и образуется алкен,
отличающийся положением кратной
связи и строением углеродного скелета
молекулы.
85.
RR
C
H2
C
0
X
КОН, спирт, t C
R
-KX, HOH
R
C
H
R
C C R
H H
продукт
перегруппировки
CH2
86.
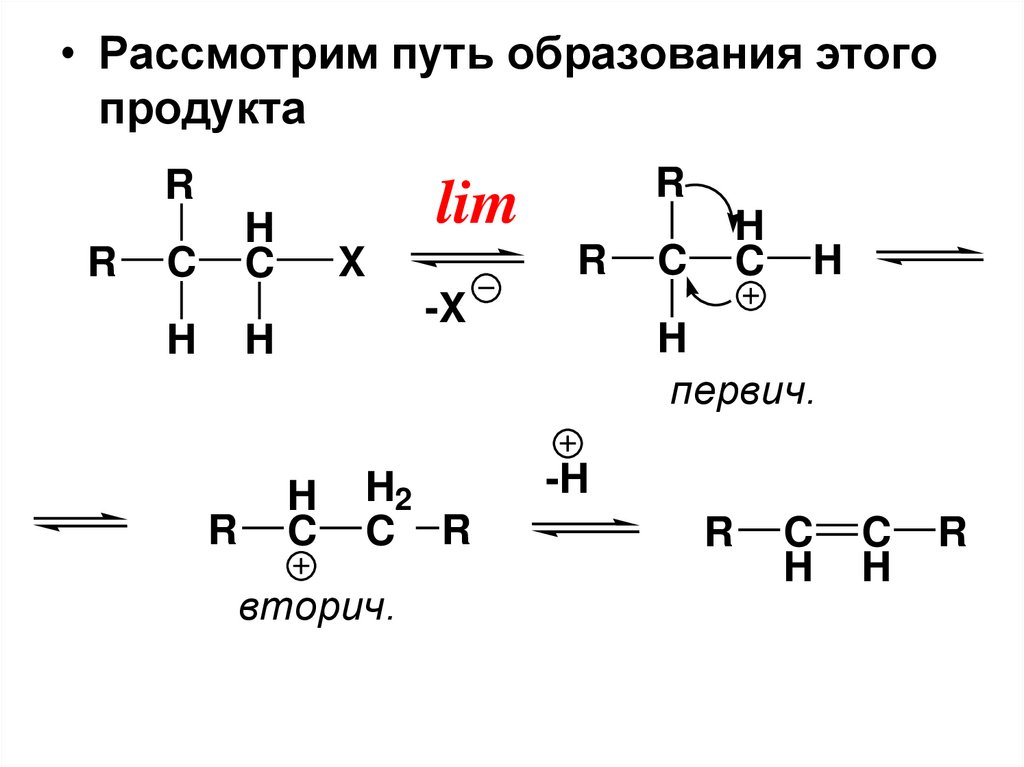
• Рассмотрим путь образования этогопродукта
R
R
lim
H
C
C
H
R
X
-X
H
R
R
H
C
H2
C R
вторич.
H
C
C
H
H
первич.
-H
R
C
H
C
H
R
87.
2.ЕN 2
• Механизм ЕN2 реакции включает атаку
основанием на протон в β-положении
по отношению к связи С-Х, в результате
чего протон отрывается с
одновременным уходом галогенидиона и образованием двойной связи
88.
RH R
C C
H
H
lim
X
R
OH
H R
C C
H
H
X
HO
H R
R
C
CH
HOH
X
89.
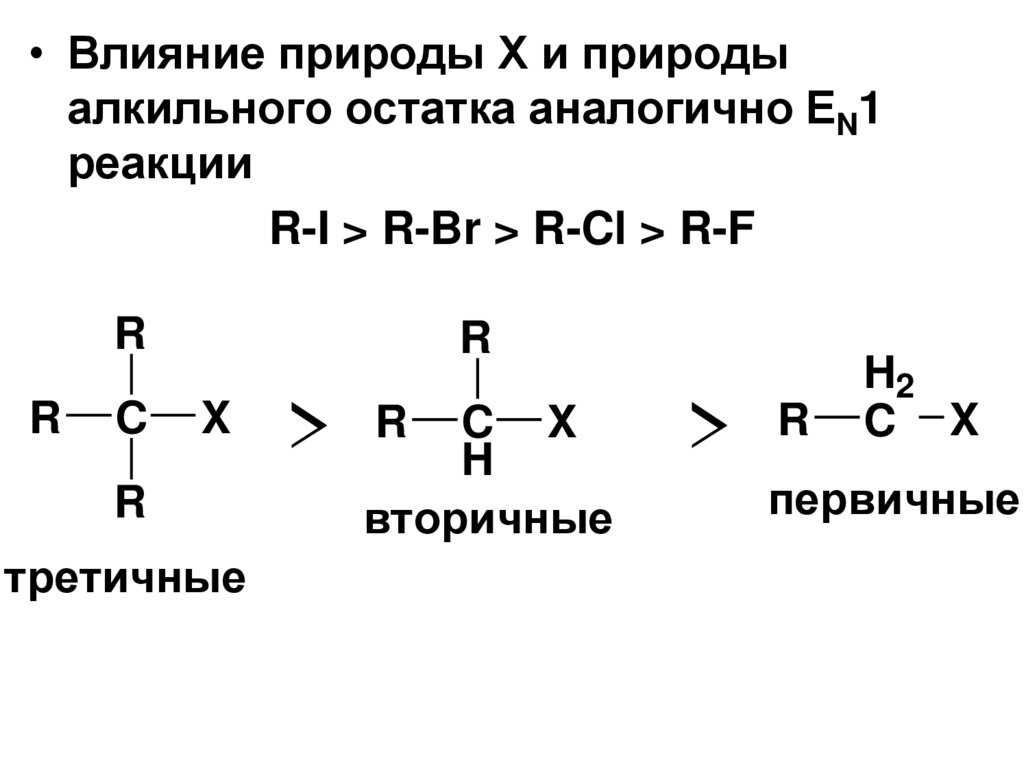
• Влияние природы Х и природыалкильного остатка аналогично ЕN1
реакции
R-I > R-Br > R-Cl > R-F
R
R
C
R
X
R
третичные
> R CH X
вторичные
> R
H2
C X
первичные
90.
• Пространственные препятствия атома С,связанного с галогеном, не имеют
решающего значения в этом случае, т.к.
атаке подвергается не С атом связи С-Х,
а атом Н в β-положении. Поэтому
отщепление идет легко для третичных
субстратов.
91.
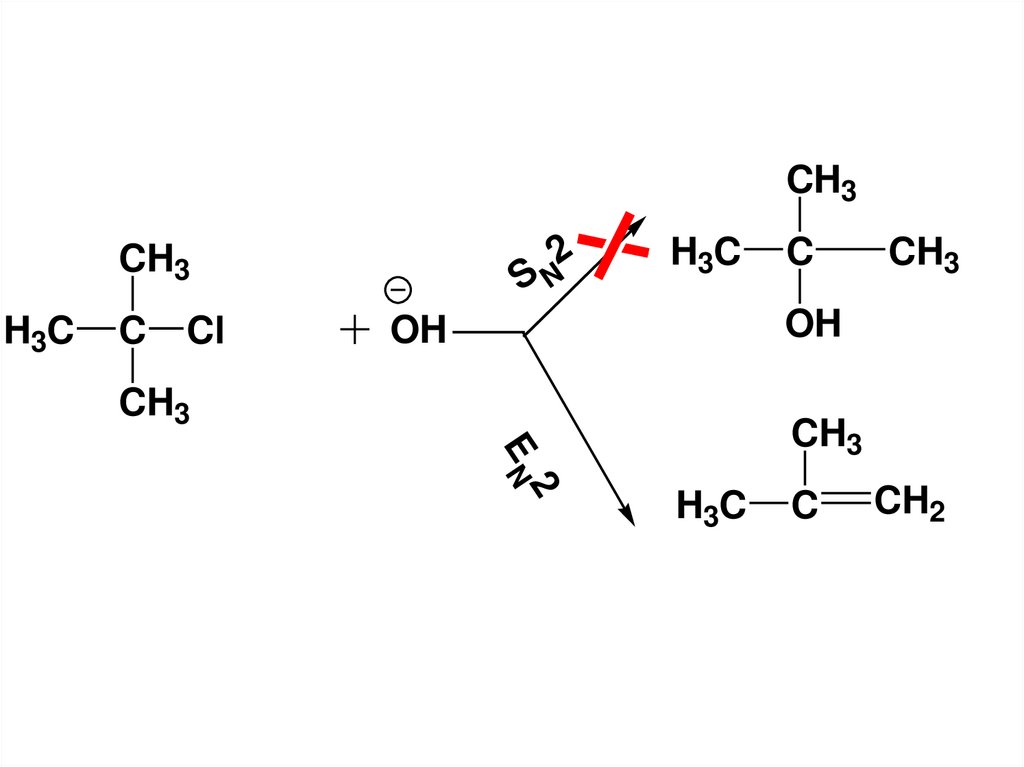
CH32
CH3
H3C
C
Cl
SN
H3C
C
CH3
OH
OH
CH3
2
EN
CH3
H3C
C
CH2
92.
б) α-элиминирование (образованиекарбенов
• От молекулы гем-тригалогенопроизводного возможно отщепление
α-водородного атома под действие
оснований, приводящее к
образованию карбаниона (анионный
С). В результате стабилизации
карбаниона путем выброса
галогенид-иона образуется карбен
93.
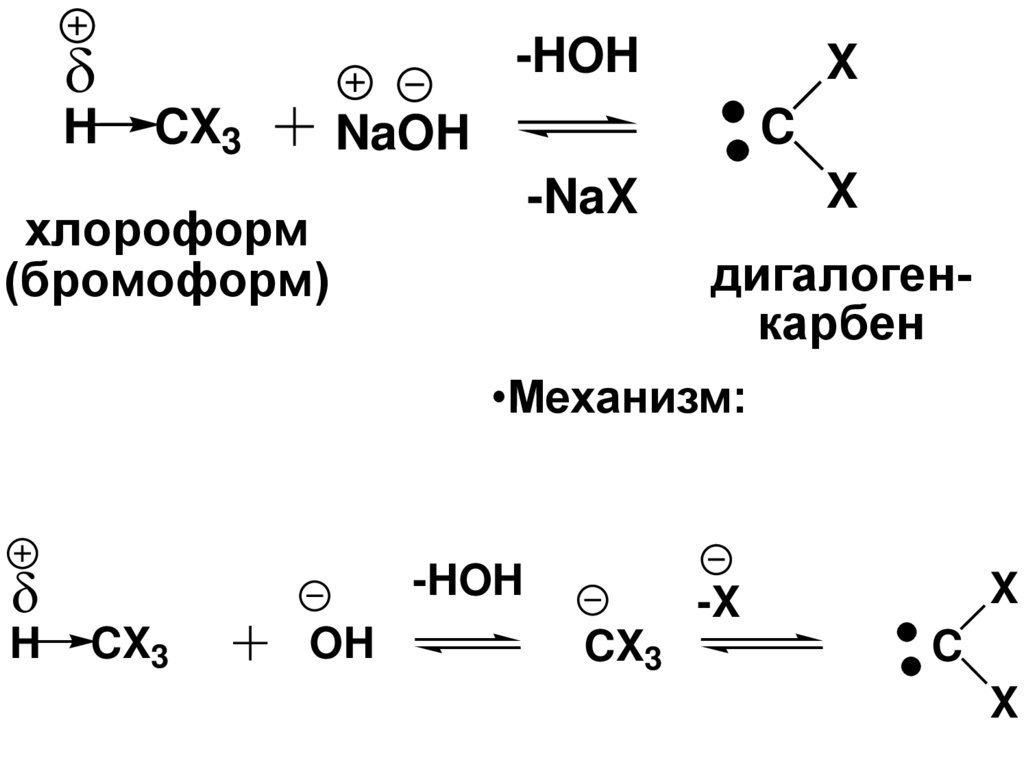
H-HOH
CX3
X
C
NaOH
X
-NaX
хлороформ
(бромоформ)
дигалогенкарбен
•Механизм:
H
-HOH
CX3
OH
X
-X
CX3
C
X
94.
Важнейшие представители• Метиленхлорид (CH2Cl2) – обладает
наркотическими свойствами, слабо
растворим в воде. Используется как
растворитель ПВХ, хлоркаучуков; смесь
с этанолом – растворитель
ацетилцеллюлозы. Используется в
производстве печатных плат и
микроэлектронике.
• Хлороформ (CHCl3) - обладает сильным
наркотическим и анестезирующим
действием. На воздухе, на свету
окисляется до COCl2.
95.
• Тертахлорметан (CCl4) – негорючая,тяжелая жидкость, используется как
растворитель синтеза фреонов,
теломеров. Ядовит.
• Дихлорэтан (ClCH2-CH2Cl) –
используется как расторитель, для
получения винилхлорида,
этилендиамина.
96.
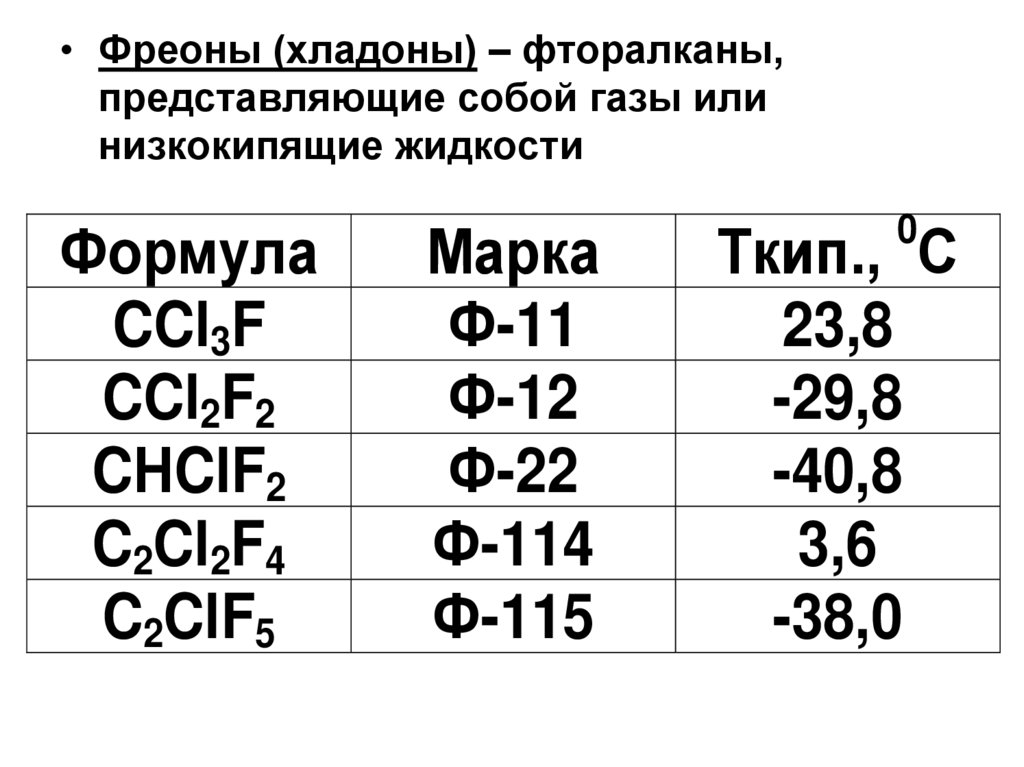
• Фреоны (хладоны) – фторалканы,представляющие собой газы или
низкокипящие жидкости
Формула
CCl3F
CCl2F2
CНClF2
C2Cl2F4
C2ClF5
Марка
Ф-11
Ф-12
Ф-22
Ф-114
Ф-115
0
Ткип., С
23,8
-29,8
-40,8
3,6
-38,0
97.
• Аллилхлорид – жидкость с резкимзапахом, лакриматор, используется для
получения эпихлоргидрина, глицерина,
аллиловых эфиров (простых и
сложных).
• Бензилхлорид – бесцветная жидкость,
лакриматор. Используется для для
получения бензилового спирта,
бензилцианида, бензиловых эфиров.
Влияние на окружающую среду
• Получение, хранение и применение
связано с серьезными экологическими
проблемами (Учебник, стр. 508-509).
98. Галогенопроизводные со связью Сsp2-X
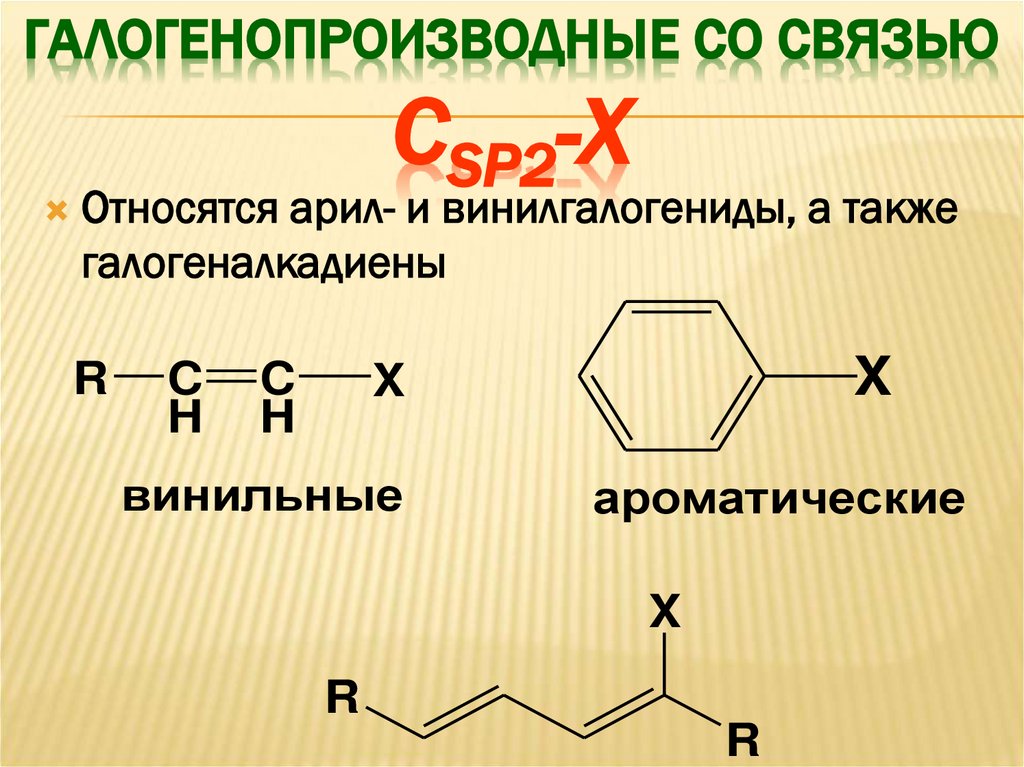
ГАЛОГЕНОПРОИЗВОДНЫЕ СО СВЯЗЬЮСSP2-X
Относятся арил- и винилгалогениды, а также
галогеналкадиены
R
C
H
C
H
X
X
винильные
ароматические
X
R
R
99.
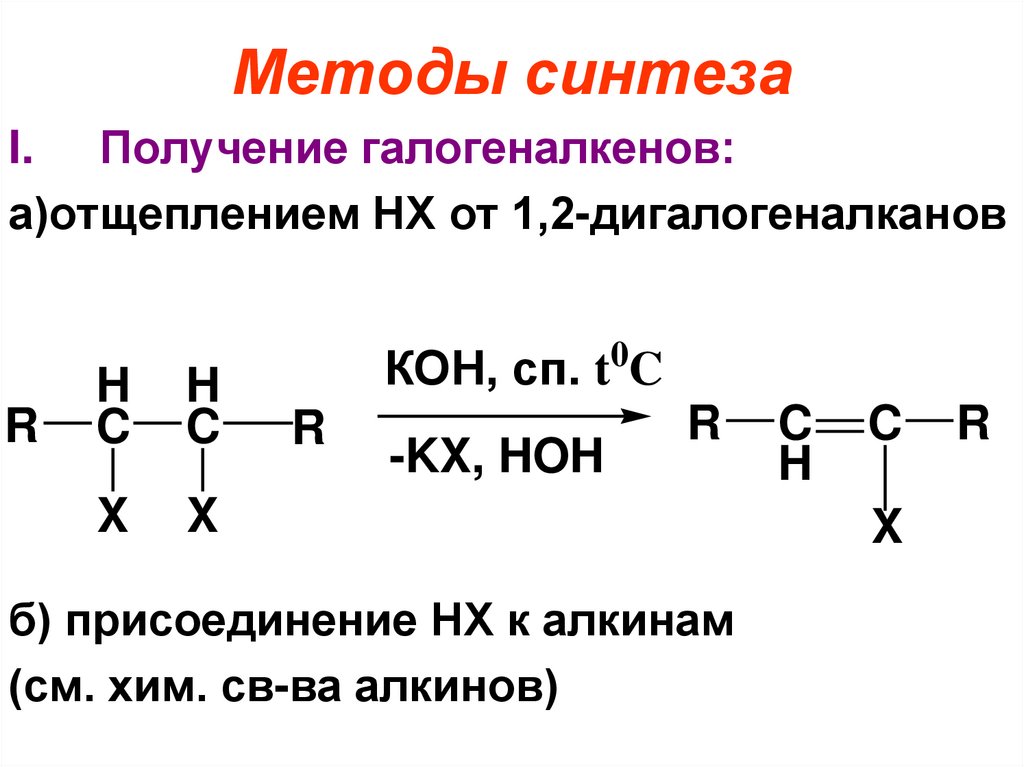
Методы синтезаI. Получение галогеналкенов:
а)отщеплением НХ от 1,2-дигалогеналканов
R
H
C
H
C
X
X
КОН, сп. t0C
R
-KX, HOH
R
б) присоединение НХ к алкинам
(см. хим. св-ва алкинов)
C
H
C
X
R
100.
2. Получение галогеналкадиенов• Присоединение НХ к винилацетилену
(см. хим. св-ва алкадиенов)
3. Получение галогенаренов (см. xим.
св-ва аренов).
101.
Физические свойства, строение.Природа связи
Являются бесцветными жидкостями, обладающими
запахом, нерастворимы в воде, тяжелее воды (d > 1).
Достаточно ядовиты.
Полярность связи Сsp2-X меньше, чем Сsp3-X, о чем
свидетельствует уменьшение дипольных моментов.
СН3СН2 –Х
СН2 =СН –Х
С6Н5 –Х
2,0 D
1,44 D
1,58 D
102.
• Причиной уменьшения полярности связиявляется
• 1.Увеличение электроотрицательности
атома Сsp2 и
• 2.Взаимодействие неподеленной пары
электронов атома галогена с электронами
π-связей двойных или ароматического
секстета.
H2 C
C
H
X
+М – эффект галогена
X
103.
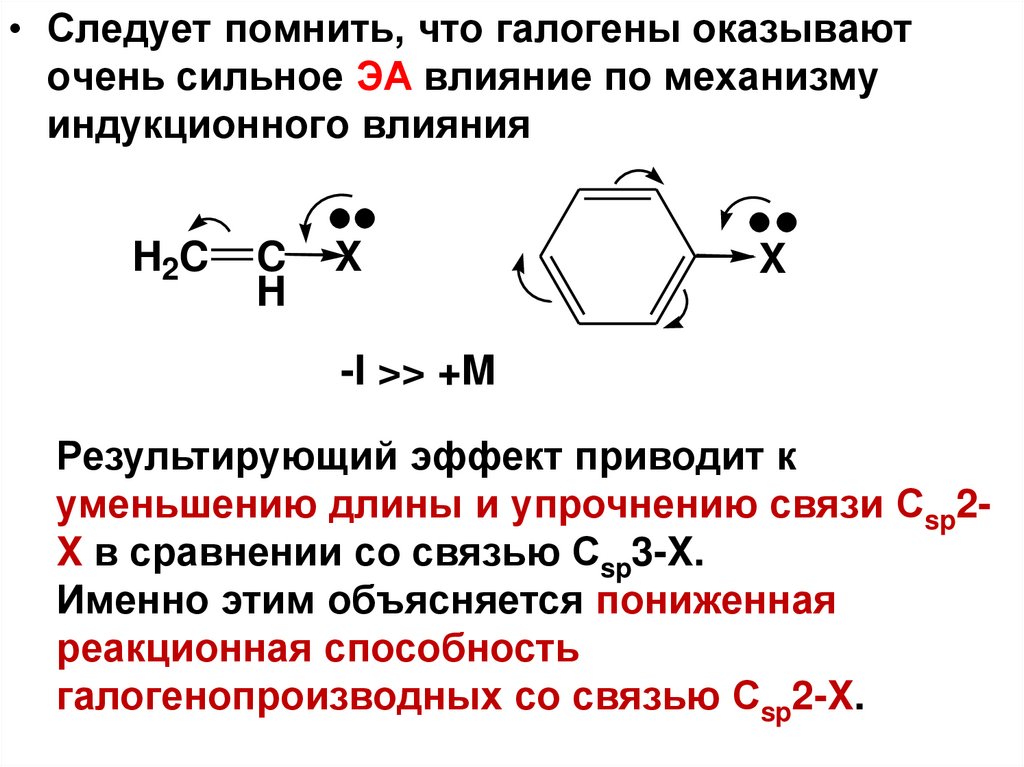
• Следует помнить, что галогены оказываюточень сильное ЭА влияние по механизму
индукционного влияния
H2C
C
H
X
X
-I >> +M
Результирующий эффект приводит к
уменьшению длины и упрочнению связи Сsp2X в сравнении со связью Сsp3-X.
Именно этим объясняется пониженная
реакционная способность
галогенопроизводных со связью Сsp2-X.
104.
•Таким образом, галогенопроизводные углеводородов бывают• А) с нормальной подвижностью
галогена (алкилгалогениды);
• Б) с повышенной подвижностью
галогена (аллил- и
бензилгалогениды);
• В)с пониженной подвижностью
галогена (винил- и аригалогениды)
105. Химические свойства
• Вступают в реакции двух типов:1) замещения галогена;
2) реакции в углеводородном радикале. –
реакции присоединения,
полимеризации, окисления,
отщепления, электрофильного
замещения (реакции алкенов и аренов).
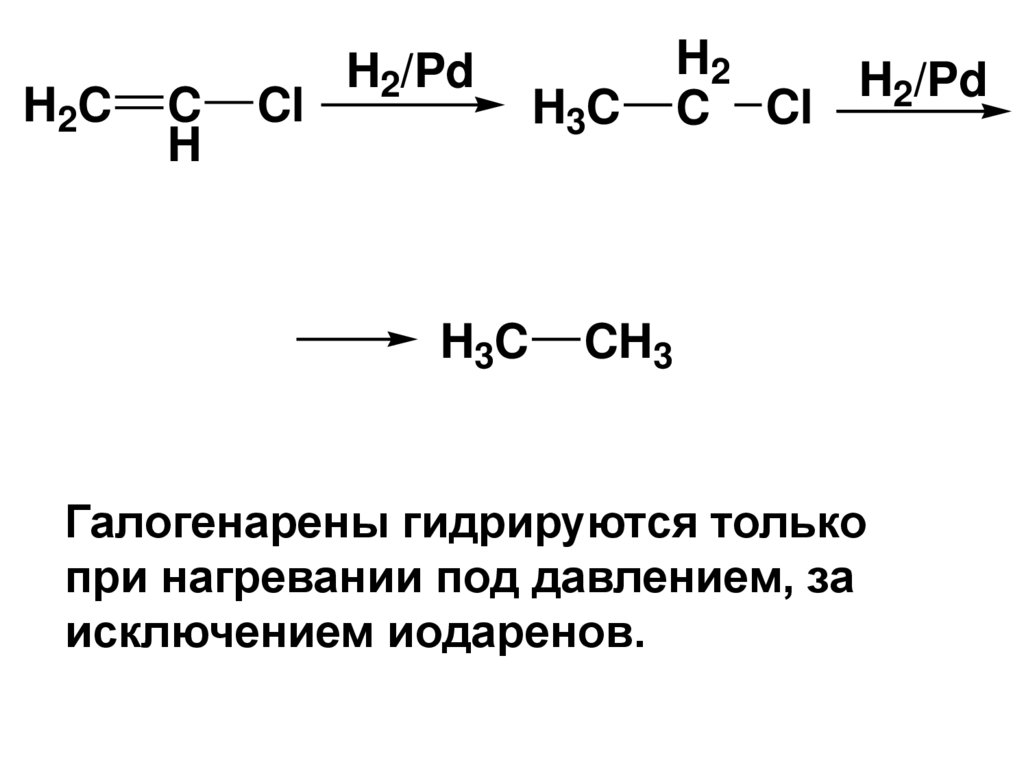
106. I. Реакции замещения галогенов
• Реакции протекают труднее – связьСsp2-X и прочнее и короче и менее
полярная.
• а) Восстановление водородом.
• При каталитическом гидрировании
винилгалогенидов Н2 сначала
присоединяется по двойной связи, а
затем происходит восстановление
связи С-Х
107.
H2CC
H
Cl
H2/Pd
H3C
H3C
H2
H2/Pd
C Cl
CH3
Галогенарены гидрируются только
при нагревании под давлением, за
исключением иодаренов.
108.
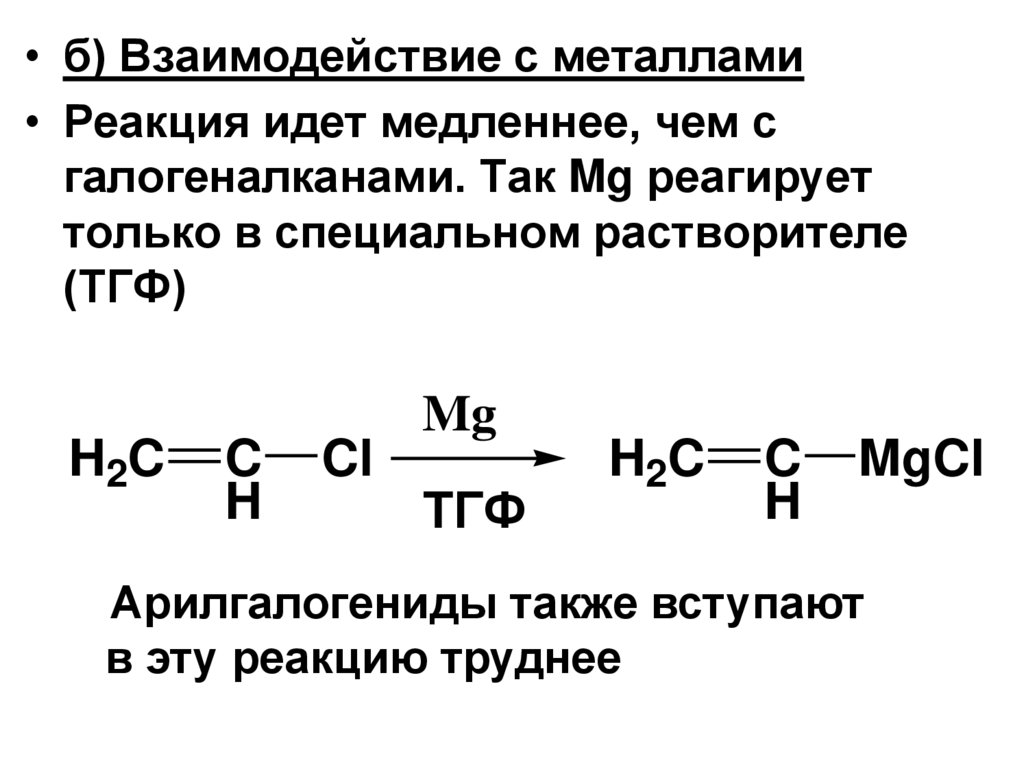
• б) Взаимодействие с металлами• Реакция идет медленнее, чем с
галогеналканами. Так Mg реагирует
только в специальном растворителе
(ТГФ)
H2C
C
H
Cl
Mg
ТГФ
H2C
C
H
MgCl
Арилгалогениды также вступают
в эту реакцию труднее
109.
•в) SN –реакции - взаимодействие снуклеофильными реагентами (NaOH,
NaOR, NH3, NH2R и др.).
•Галогеналкены при обычных условиях с
Nu— не реагируют. При повышенных
температурах (200-300 0С) образуются
смеси веществ в результате реакций
отщепления, присоединения,
полимеризации.
110.
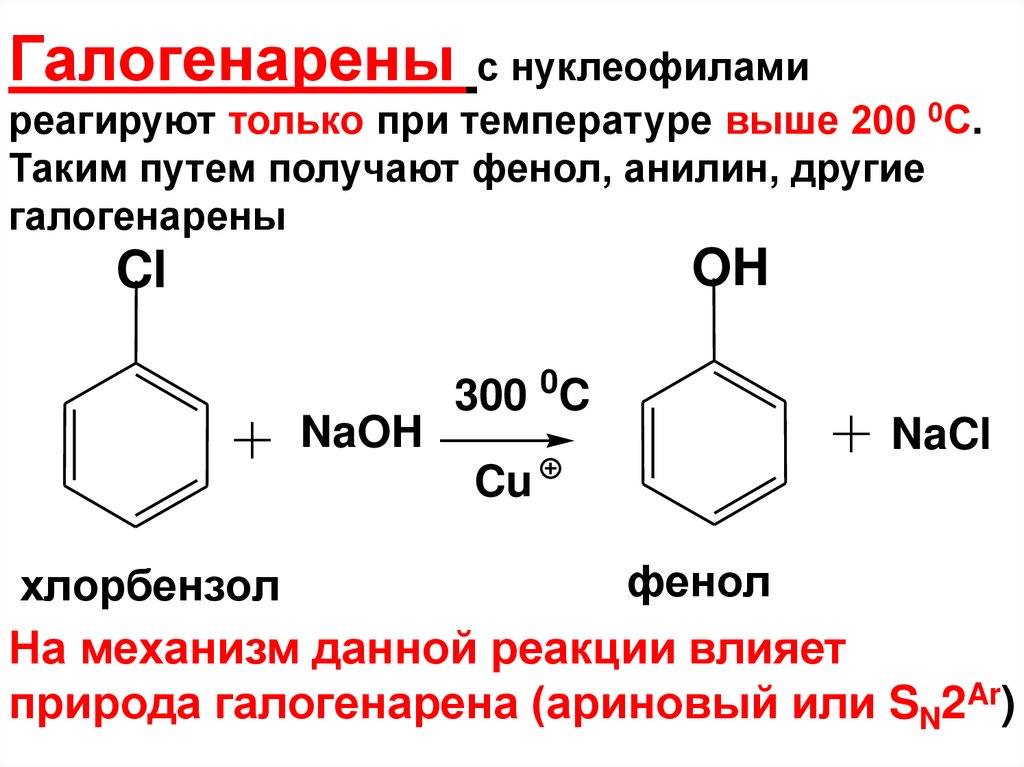
Галогенарены с нуклеофиламиреагируют только при температуре выше 200 0С.
Таким путем получают фенол, анилин, другие
галогенарены
OH
Cl
NaOH
300 0C
NaCl
Cu
фенол
хлорбензол
На механизм данной реакции влияет
природа галогенарена (ариновый или SN2Ar)
111.
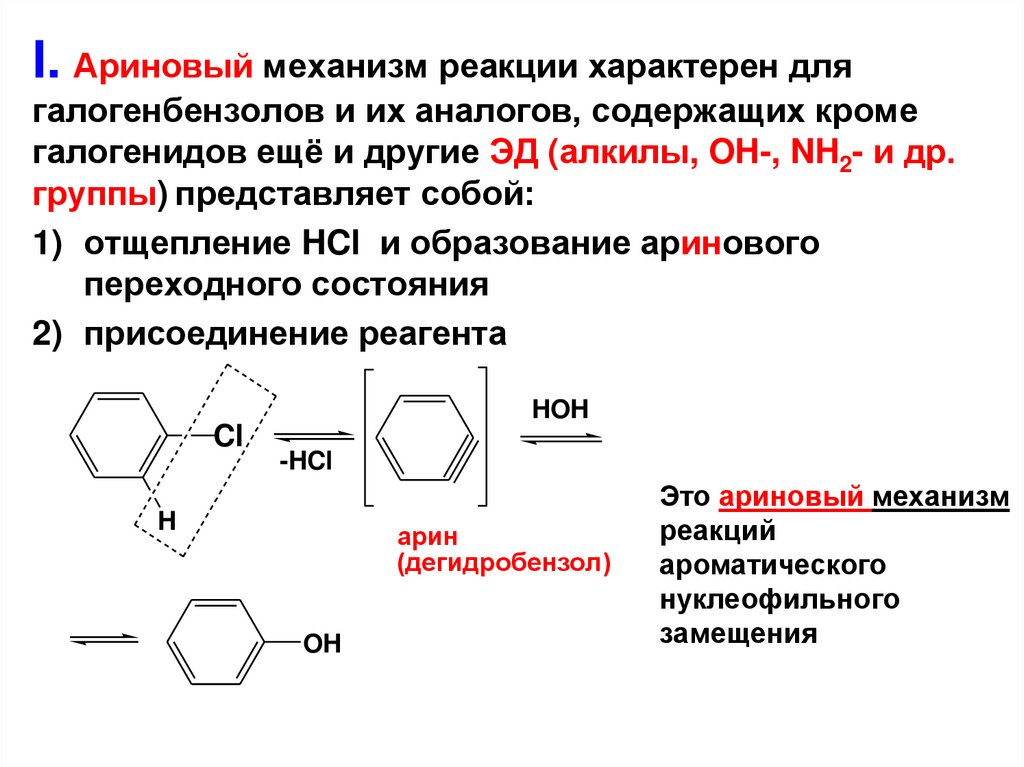
I. Ариновый механизм реакции характерен длягалогенбензолов и их аналогов, содержащих кроме
галогенидов ещё и другие ЭД (алкилы, OH-, NH2- и др.
группы) представляет собой:
1) отщепление HCl и образование аринового
переходного состояния
2) присоединение реагента
HOH
Cl
-HCl
H
арин
(дегидробензол)
OH
Это ариновый механизм
реакций
ароматического
нуклеофильного
замещения
112.
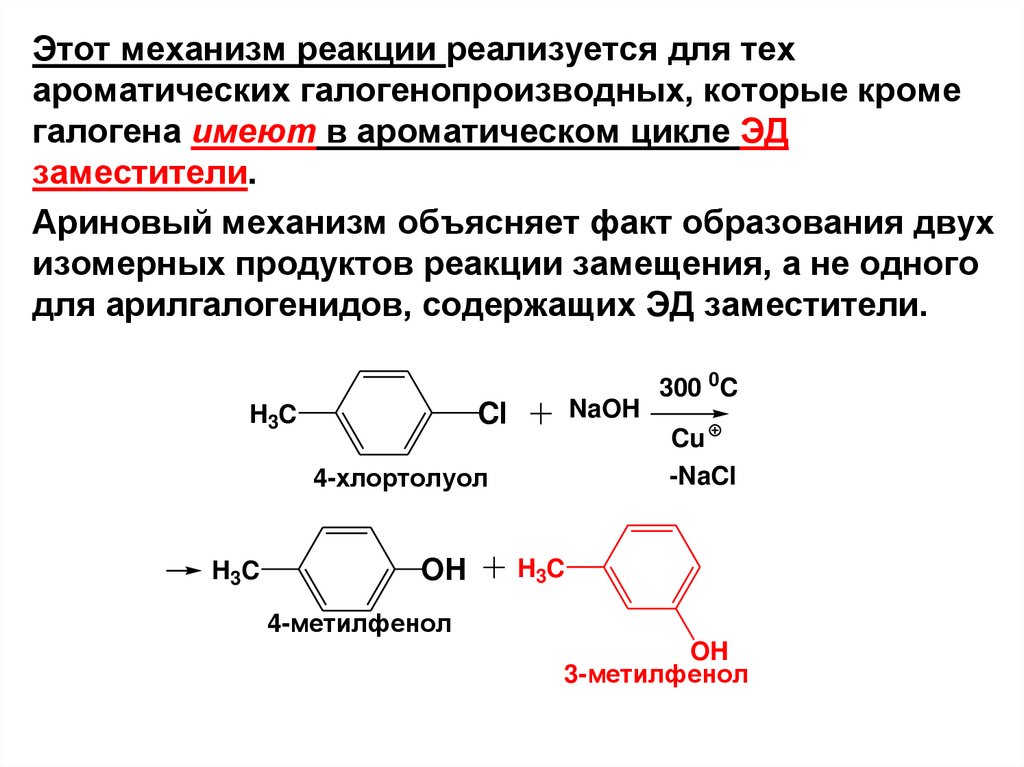
Этот механизм реакции реализуется для техароматических галогенопроизводных, которые кроме
галогена имеют в ароматическом цикле ЭД
заместители.
Ариновый механизм объясняет факт образования двух
изомерных продуктов реакции замещения, а не одного
для арилгалогенидов, содержащих ЭД заместители.
NaOH
Cl
H3C
Cu
-NaCl
4-хлортолуол
H3C
OH
300 0C
H3C
4-метилфенол
OH
3-метилфенол
113.
Такие ароматическиегалогенопроизводные,
содержащие ЭД
заместители в
ароматическом цикле,
называются
неактивированными
арилгалогенидами по
отношению к реакциям SN
(не путать с реакциями SE !).
114.
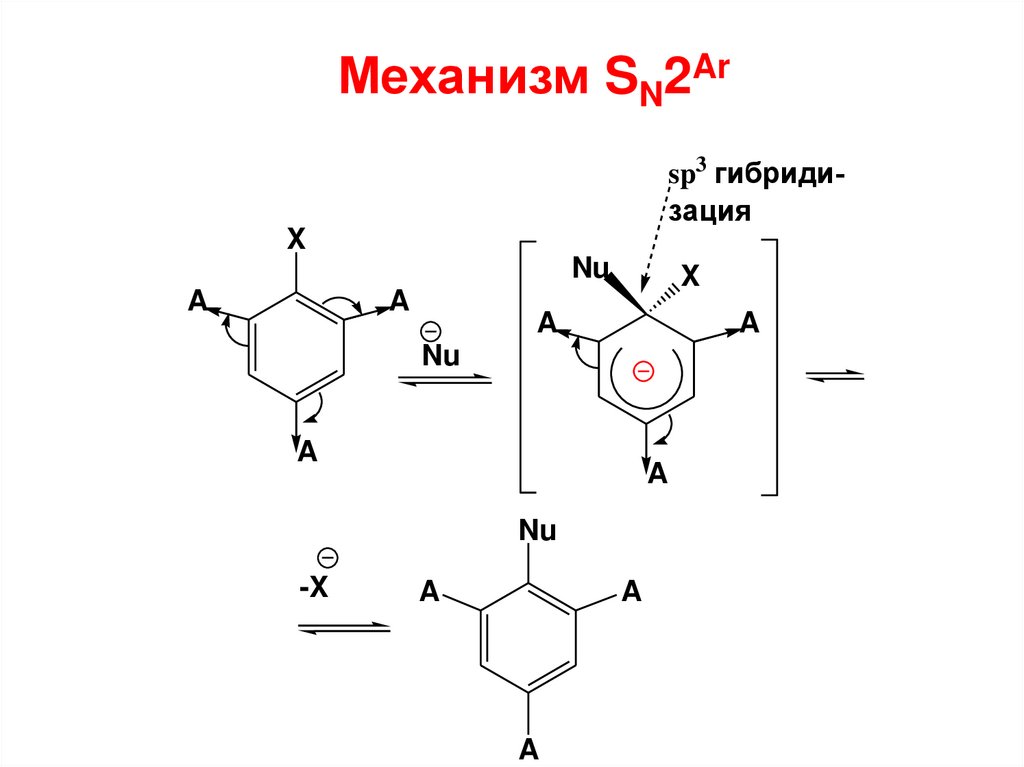
II. SNAr
2
Если в ароматическом цикле кроме галогена
присутствует ЭА заместитель то скорость SN реакции
возрастает (сравнить с SЕ!) – ЭА заместитель
активирует арилгалогенид к реакциям SN.
Такие арилгалогениды называются активированными
арилгалогенидами по отношению к реакциям SN.
Этот механизм (в отличие от аринового) включает
стадии:
1) присоединение нуклеофила;
2) отщепление НХ. Данный механизм называют SN2ароматическим.
Следует помнить, что ЭА заместители активируют
ароматическое галогенопроизводное к реакциям с
нуклеофильными реагентами только, если они
располагаются в о- или п-положениях по отношению к
ЭА заместителю.
115.
Механизм SN2Arsp3 гибридизация
X
Nu
A
A
X
A
A
Nu
A
A
Nu
-X
A
A
A
116.
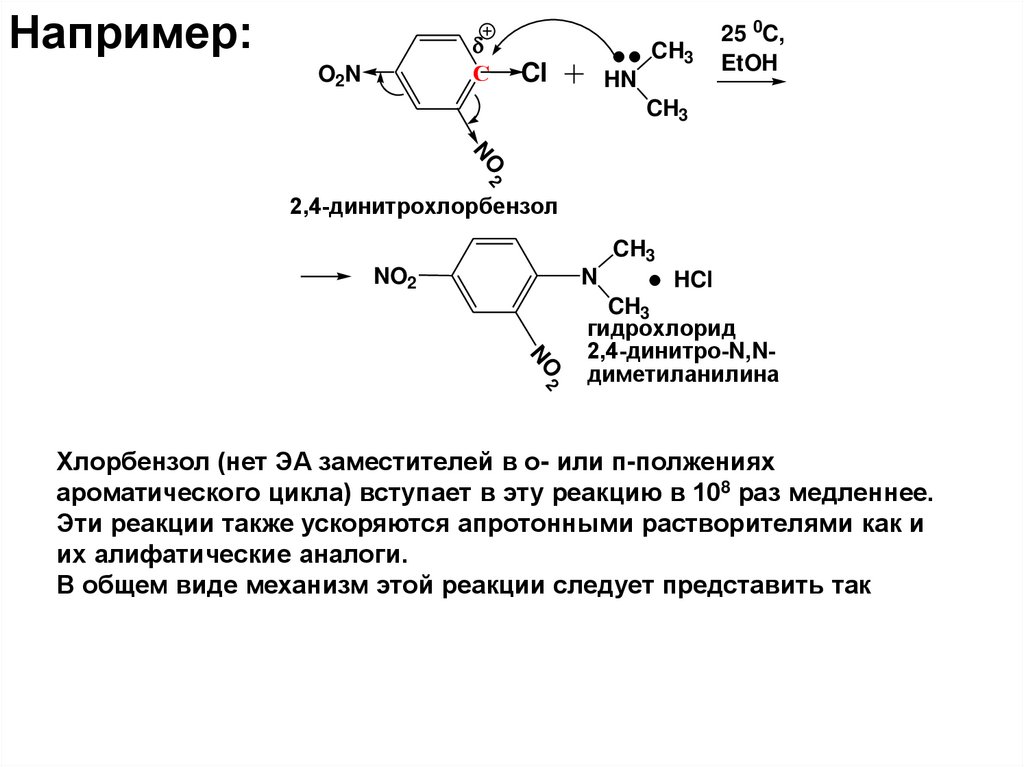
Например:С
O2N
CH3
Cl
HN
25 0C,
EtOH
CH3
2
NO
2,4-динитрохлорбензол
CH3
NO2
N
HCl
2
NO
CH3
гидрохлорид
2,4-динитро-N,Nдиметиланилина
Хлорбензол (нет ЭА заместителей в о- или п-полжениях
ароматического цикла) вступает в эту реакцию в 108 раз медленнее.
Эти реакции также ускоряются апротонными растворителями как и
их алифатические аналоги.
В общем виде механизм этой реакции следует представить так
117.
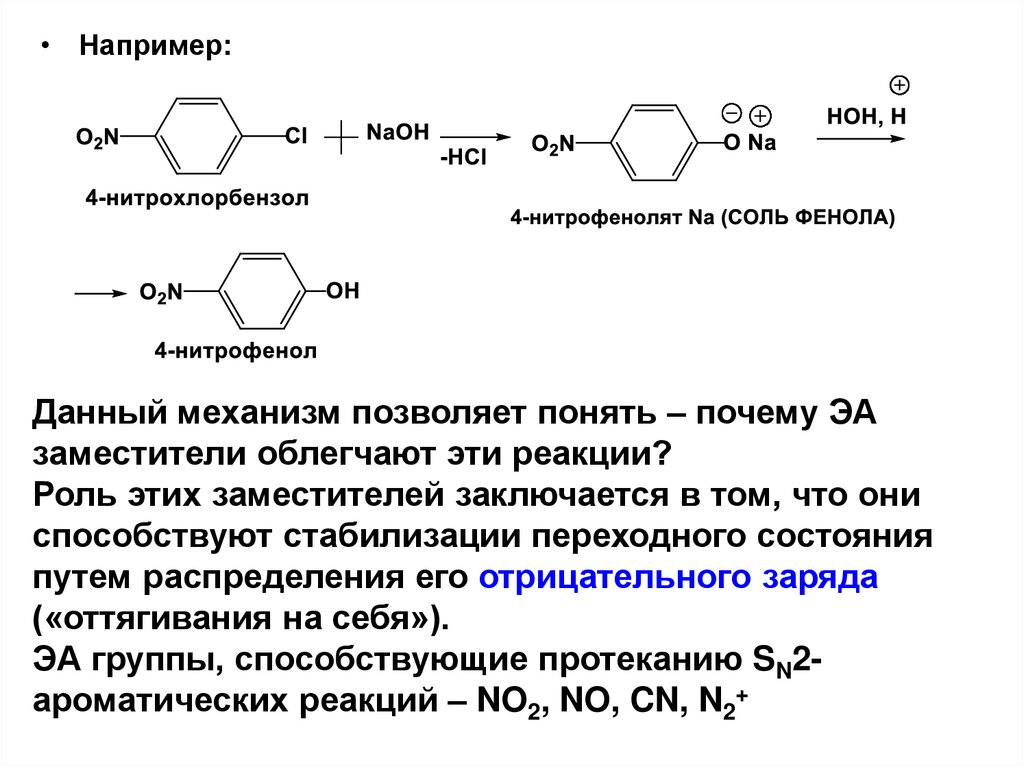
• Например:Данный механизм позволяет понять – почему ЭА
заместители облегчают эти реакции?
Роль этих заместителей заключается в том, что они
способствуют стабилизации переходного состояния
путем распределения его отрицательного заряда
(«оттягивания на себя»).
ЭА группы, способствующие протеканию SN2ароматических реакций – NO2, NO, CN, N2+
118.
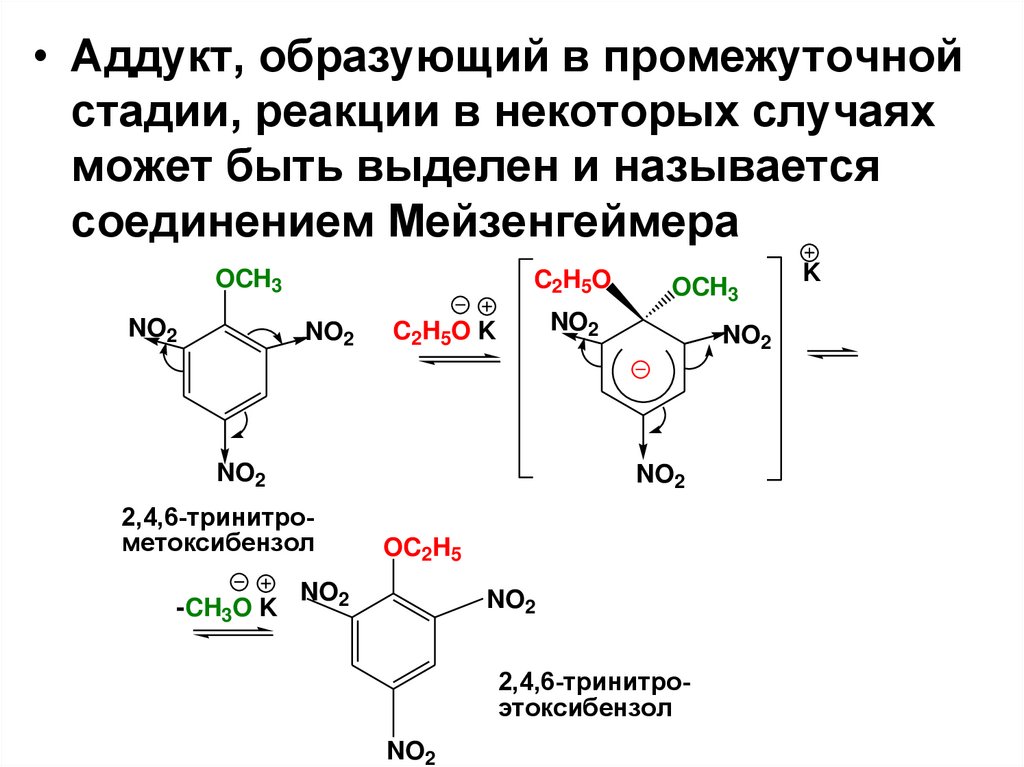
• Аддукт, образующий в промежуточнойстадии, реакции в некоторых случаях
может быть выделен и называется
соединением Мейзенгеймера
OCH3
NO2
C2H5O
NO2
NO2
C2H5O K
NO2
NO2
NO2
2,4,6-тринитрометоксибензол
-CH3O K
OCH3
OC2H5
NO2
NO2
2,4,6-тринитроэтоксибензол
NO2
K
119.
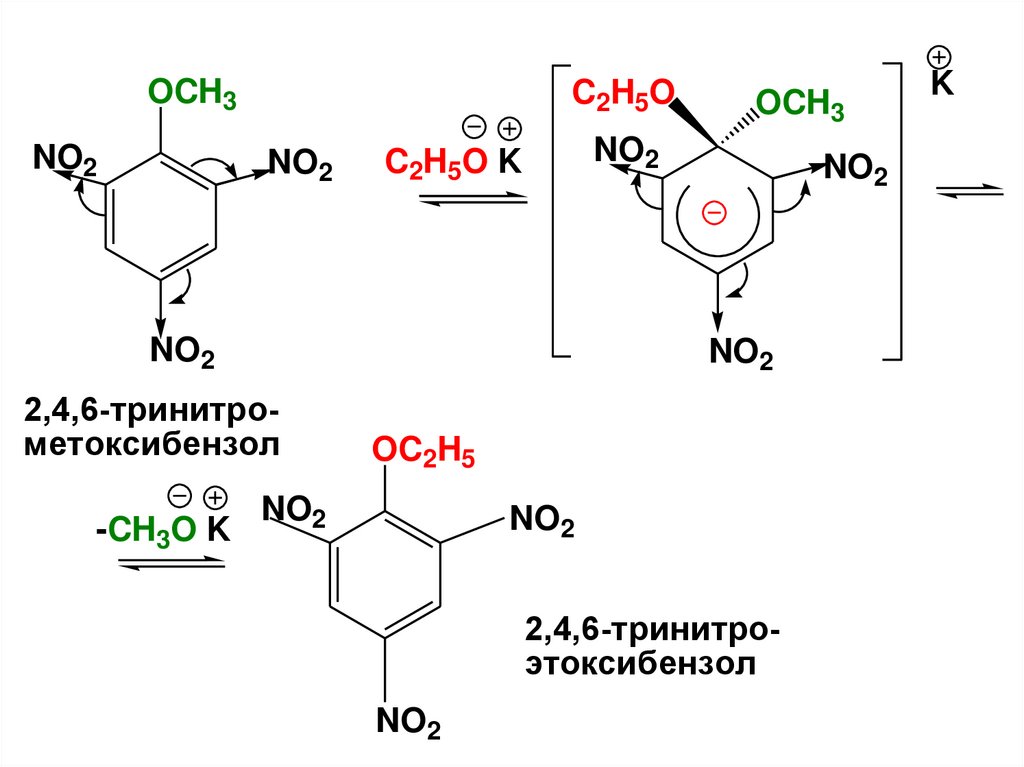
OCH3NO2
C2H5O
NO2
NO2
C2H5O K
NO2
NO2
NO2
2,4,6-тринитрометоксибензол
-CH3O K
OCH3
OC2H5
NO2
NO2
2,4,6-тринитроэтоксибензол
NO2
K
120.
• Рассмотрим резонансные структурыдля аниона Мейзенгеймера,
позволяющие понять его
стабилизацию с за счет сопряжения
с нитрогруппами
C2H5O
OCH3
NO2
NO2
NO2
C2H5O
O
OCH3
N
O
N
O
O
N
O
O
121.
122.
ОТЛИЧИЯ SN2 АРОМАТИЧЕСКИХ РЕАКЦИЙОТ SN2 АЛИФАТИЧЕСКИХ
1)В SN2-ароматических реакциях не может быть
реализовано переходное состояние, которое
осуществляется в ходе SN2-алифатических реакций,
когда происходит «атака с тыла» (новая связь еще не
вполне образовалась, а старая ещё не совсем
разорвалась);
2)SN2-ароматический процесс осуществляется в две
стадии – присоединение нуклеофила и отщепление HX;
3) Очевидно, что в SN2-ароматических реакциях легкость
замещения галогенов будет обратной тому, что имеет
место в SN2-алифатических.
Самой выгодной уходящей группой в данном случае
является
F > Cl > Br I
123.
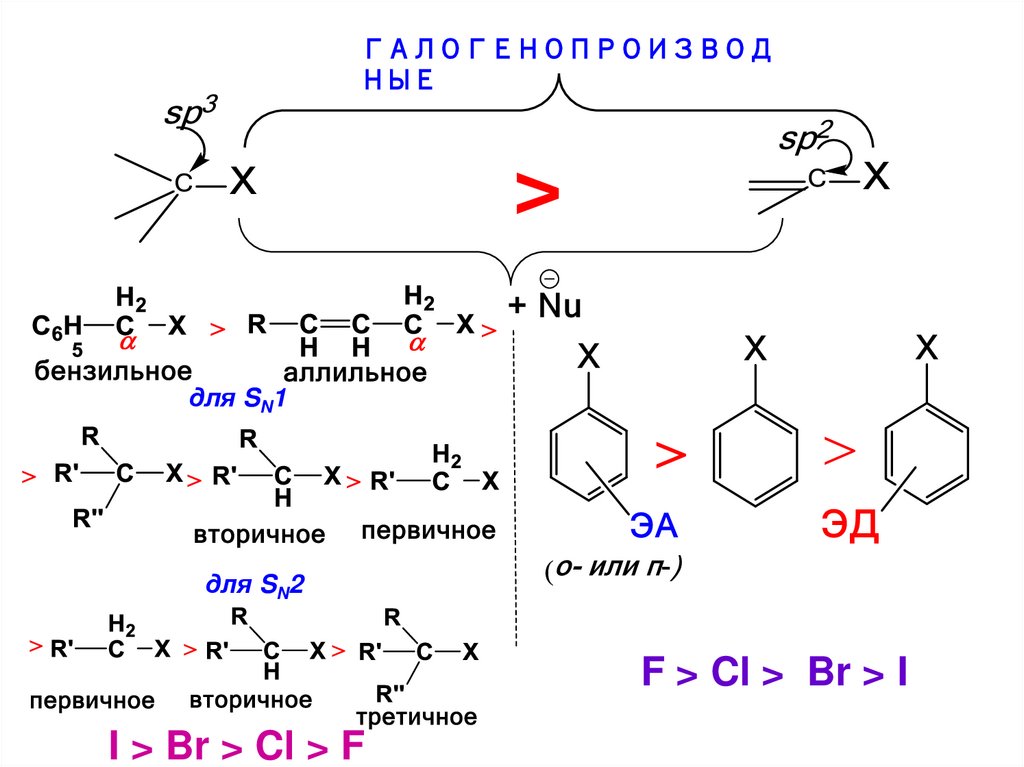
ГАЛОГЕНОПРОИЗВОДНЫЕ
>
для SN1
для SN2
F > Cl > Br > I
I > Br > Cl > F
124.
II. Реакции в углеводородномостатке
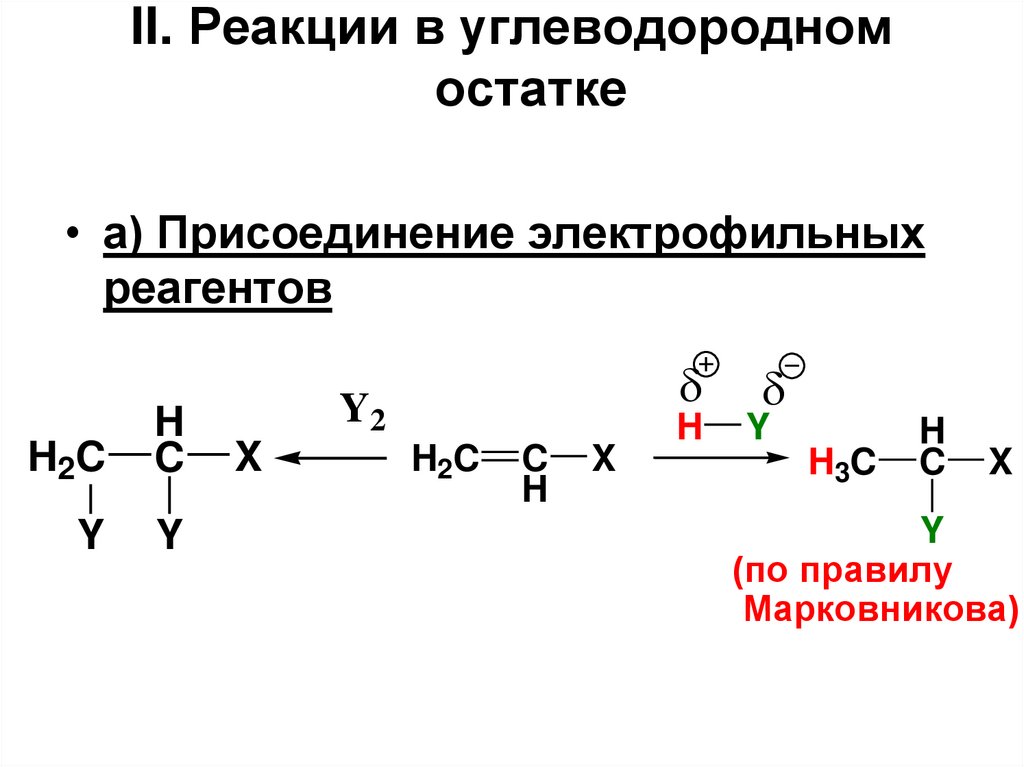
• а) Присоединение электрофильных
реагентов
H2C
H
C
Y
Y
Y2
X
H2C
C
H
X
H
Y
H3C
H
C
X
Y
(по правилу
Марковникова)
125. II. Реакции в углеводородном остатке
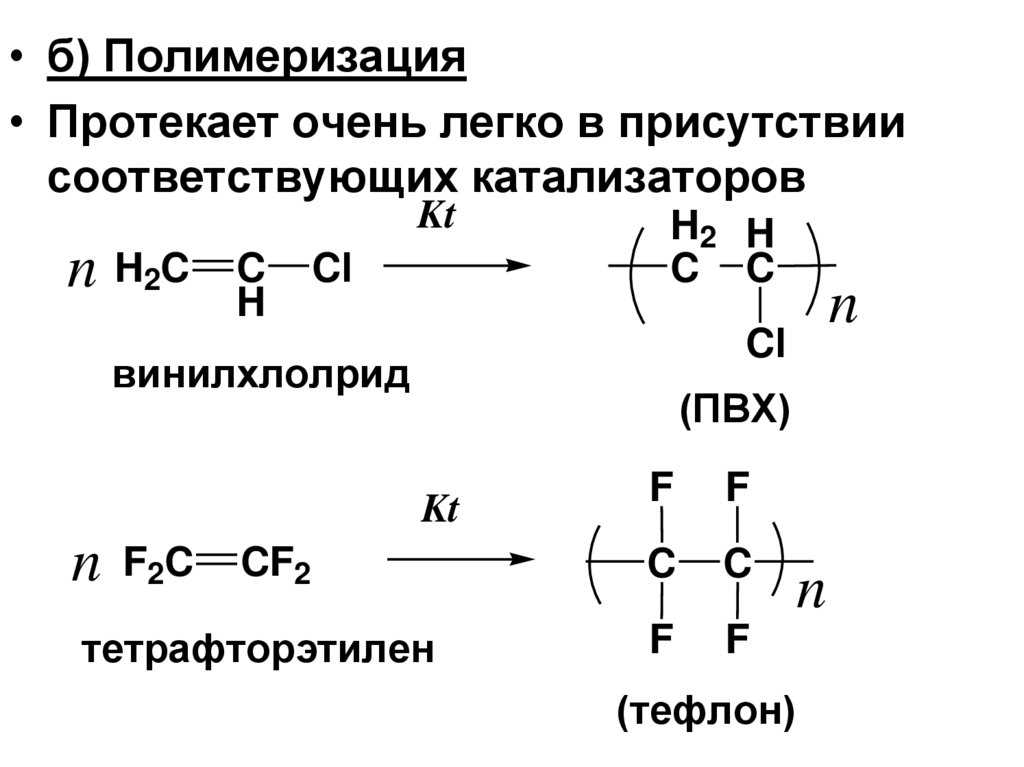
• б) Полимеризация• Протекает очень легко в присутствии
соответствующих катализаторов
Kt
n H2C
C
H
Cl
H2 H
C C
Cl
винилхлолрид
(ПВХ)
F
F
CF2
C
C
тетрафторэтилен
F
F
Kt
n F2C
n
(тефлон)
n
126.
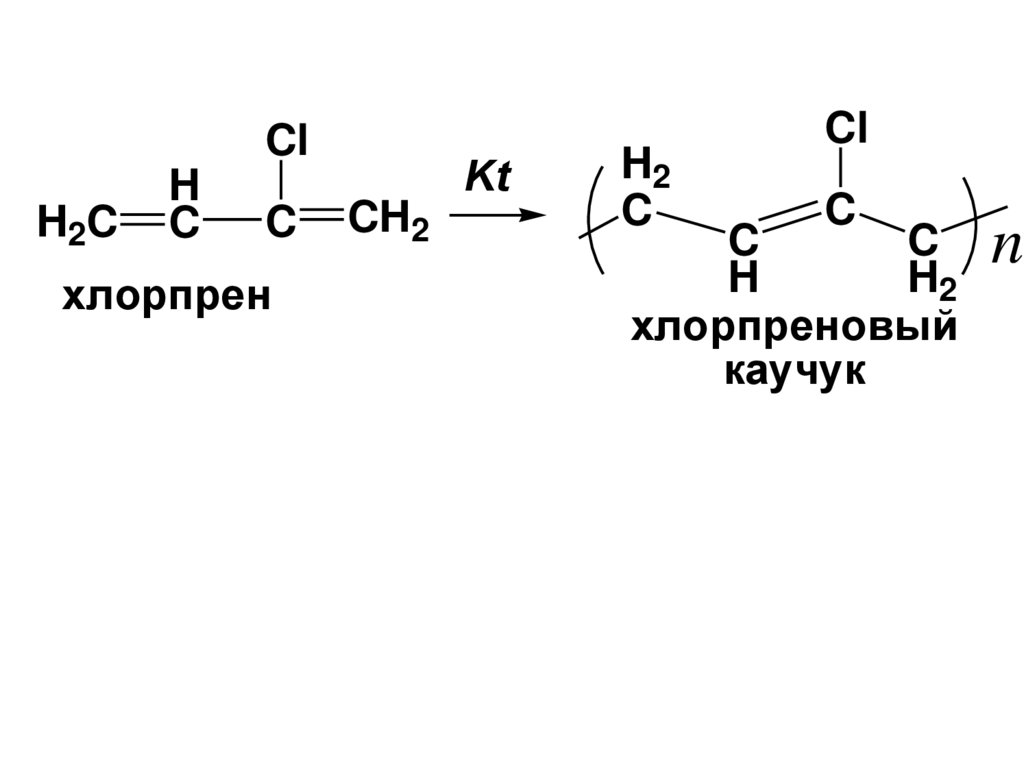
ClH2C
H
C
C
хлорпрен
Kt
CH2
H2
C
Cl
C
C
C
H
H2
хлорпреновый
каучук
n
127.
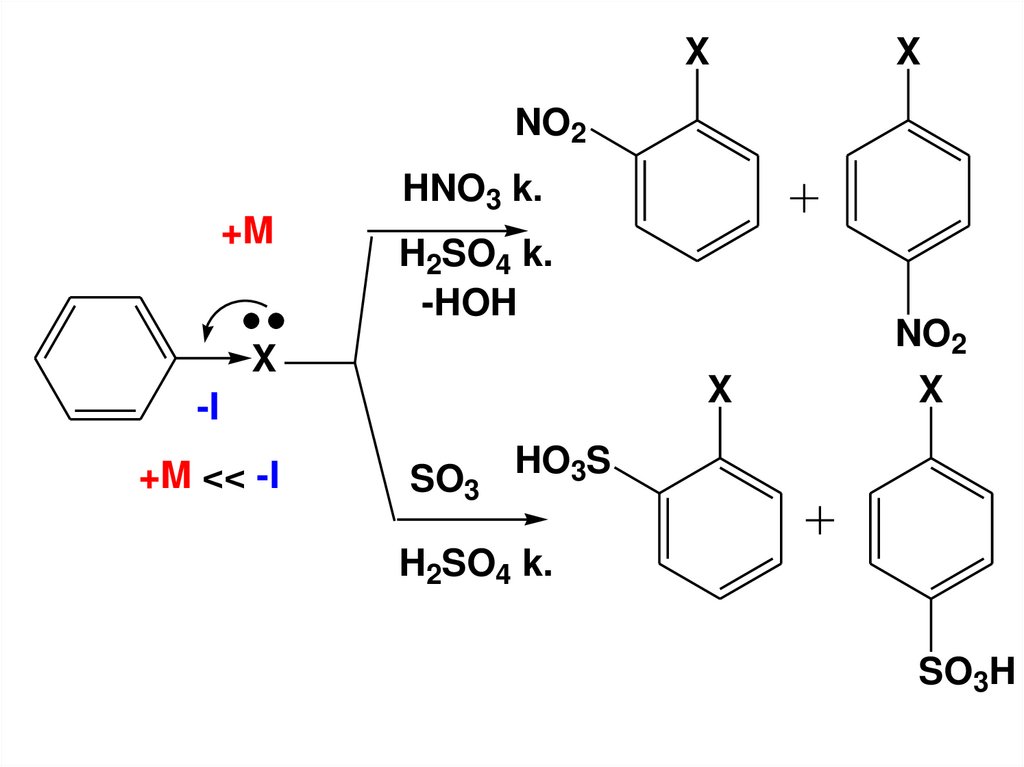
• в) Реакции SE в ароматическоекольцо галогенаренов
• Это – нитрование, сульфирование,
галогенирование.
• Атомы галогенов являются
дезактивирующими заместителями,
но о- и п-ориентантами
128.
XX
NO2
HNO3 k.
+M
H2SO4 k.
-HOH
X
X
-I
+M << -I
NO2
SO3
X
HO3S
H2SO4 k.
SO3H
129.
•При изучении галогенопроизводных углеводородовследует знать, что эти вещества с большим трудом
подвергаются в природе каким-либо превращениям, и
создают, поэтому, значительные экологические и
социальные проблемы. Большую опасность
представляет для человека группа токсических веществ
под общим названием диоксины, представляющие
собой галогенопроизводные различных
конденсированных карбо- и гетероциклических
соединений. Они образуются практически из любых
органических материалов под действием хлора,
который в больших количествах содержится в
полимерных материалах и используется для
обеззараживания воды. Многие из них в тысячи раз
токсичнее стрихнина и в десятки тысяч раз – натрийцианида





































































 Химия
Химия








