Похожие презентации:
Галогенопроизводные углеводородов
1. ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
26.11.20182.
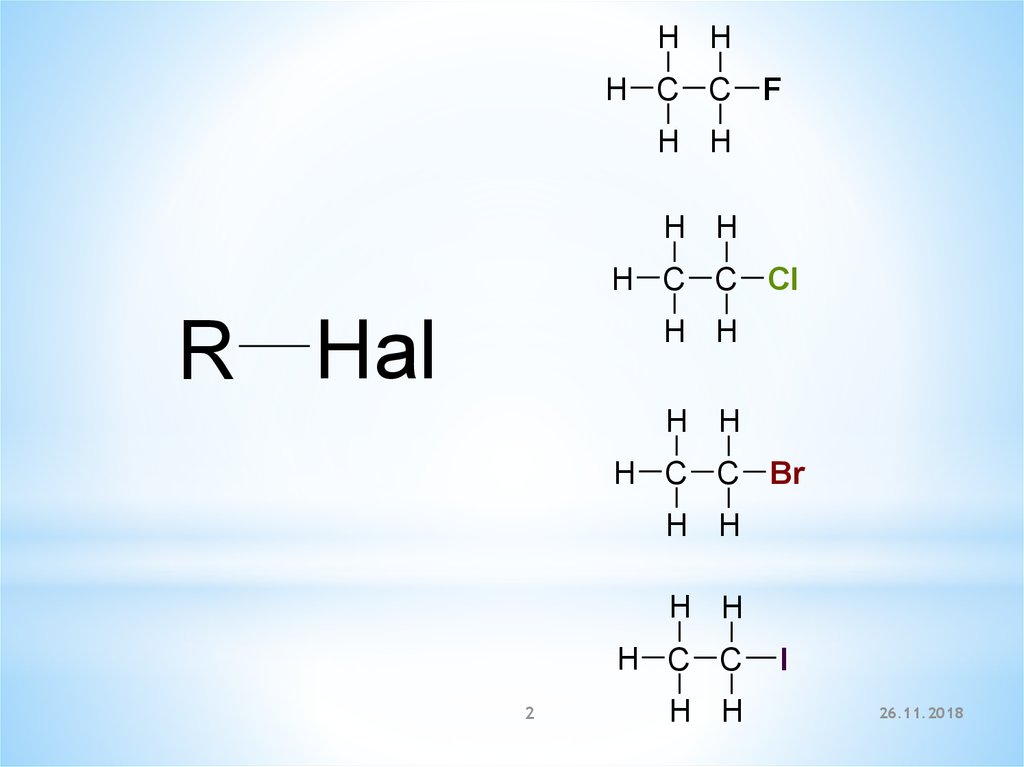
H HH C C
F
H H
H H
H C C Cl
H H
R Hal
H H
H C C Br
H H
H H
H C C
2
H H
I
26.11.2018
3.
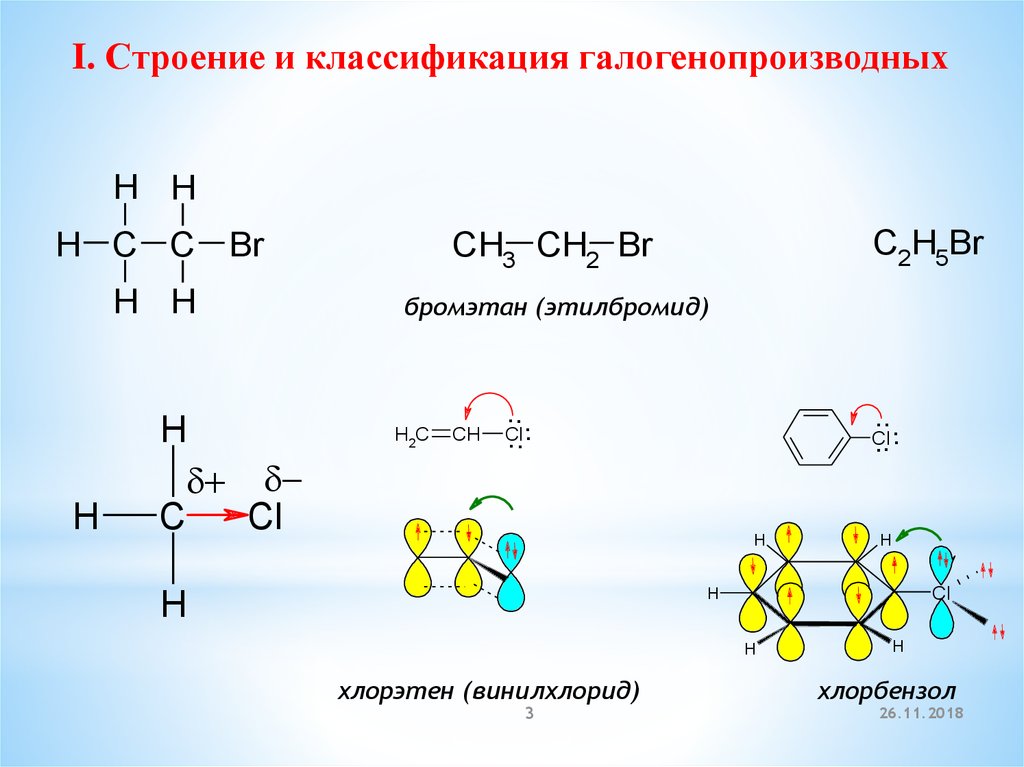
I. Строение и классификация галогенопроизводныхH H
C2H5Br
H C C Br
CH3 CH2 Br
H H
бромэтан (этилбромид)
H
H
C
Cl
H2C
CH
...
Cl
...
...
Cl
.. .
H
H
.
Cl
H
H
H
хлорэтен (винилхлорид)
3
H
хлорбензол
26.11.2018
4.
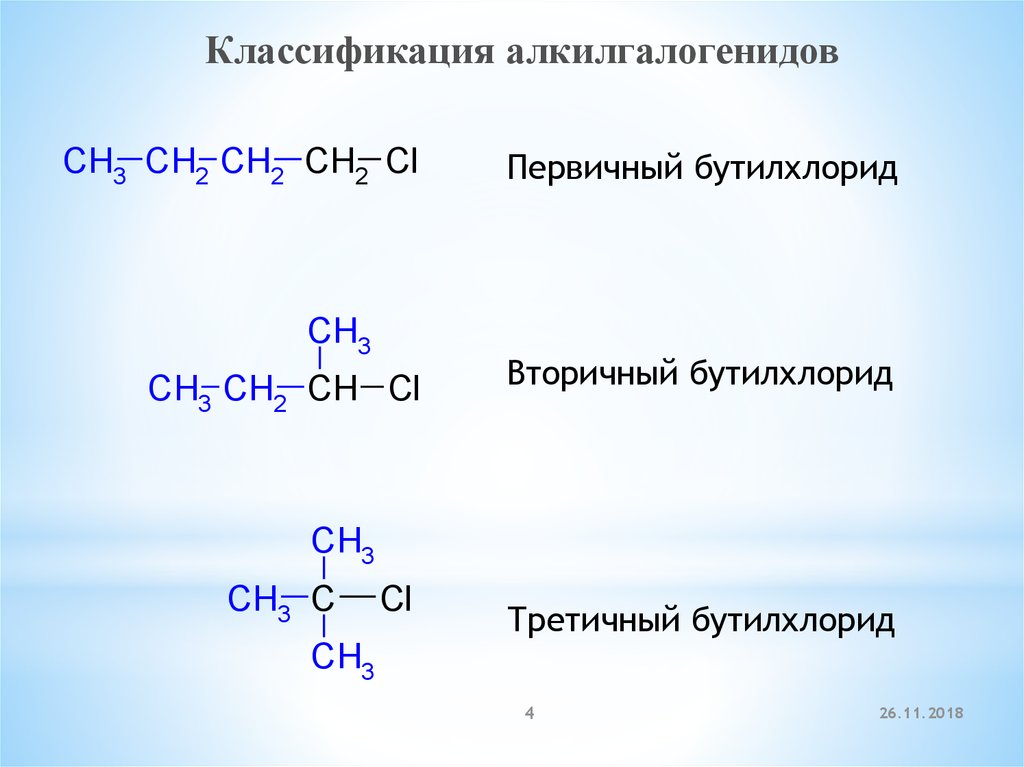
Классификация алкилгалогенидовCH3 CH2 CH2 CH2 Cl
CH3
CH3 CH2 CH Cl
Первичный бутилхлорид
Вторичный бутилхлорид
CH3
CH3 C
Cl
Третичный бутилхлорид
CH3
4
26.11.2018
5.
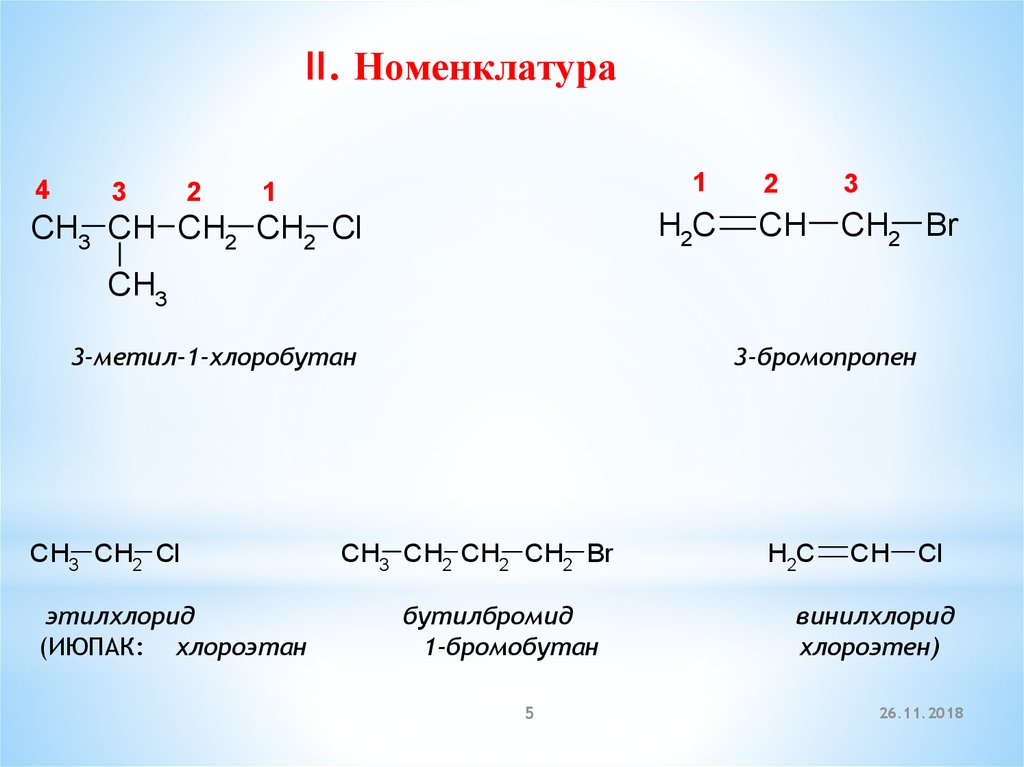
II. Номенклатура4
3
2
1
1
H2C
CH3 CH CH2 CH2 Cl
2
3
CH
CH2 Br
CH3
3-метил-1-хлоробутан
CH3 CH2 Cl
этилхлорид
(ИЮПАК: хлороэтан
3-бромопропен
CH3 CH2 CH2 CH2 Br
бутилбромид
1-бромобутан
5
H2C
CH
Cl
винилхлорид
хлороэтен)
26.11.2018
6.
Эмпирическая номенклатураCHCl3
CHBr3
хлороформ
бромоформ
6
CHI3
йодоформ
26.11.2018
7.
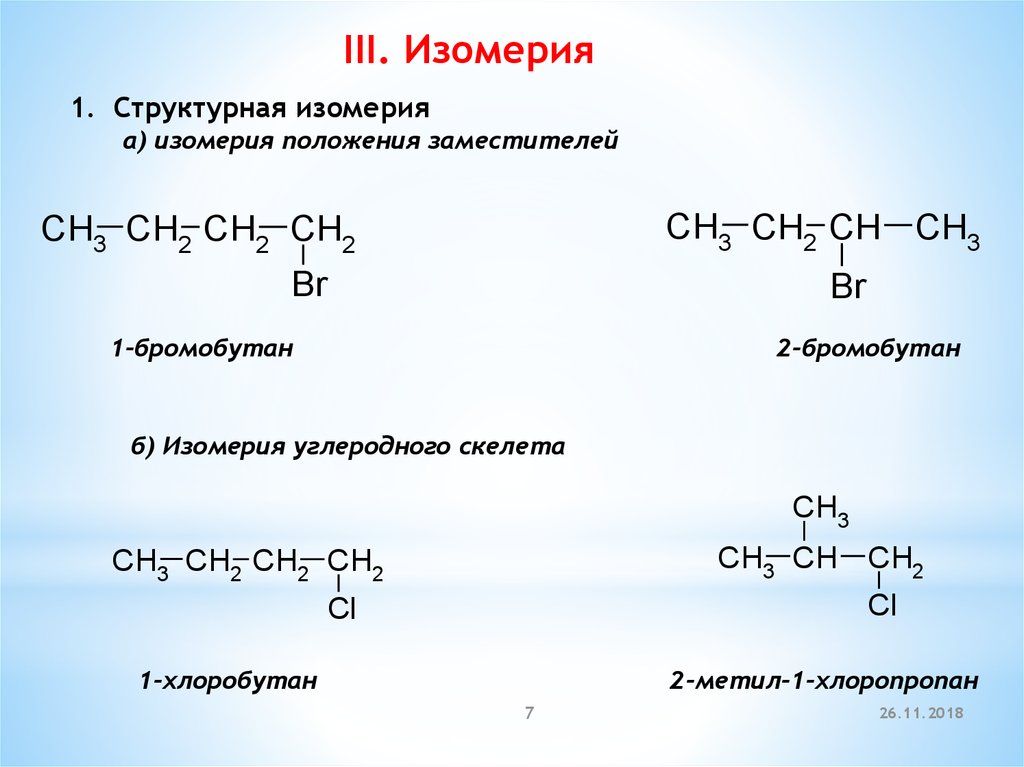
III. Изомерия1. Cтруктурная изомерия
а) изомерия положения заместителей
CH3 CH2 CH CH3
CH3 CH2 CH2 CH2
Br
Br
1-бромобутан
2-бромобутан
б) Изомерия углеродного скелета
CH3
CH3 CH CH2
CH3 CH2 CH2 CH2
Cl
Cl
1-хлоробутан
2-метил-1-хлоропропан
7
26.11.2018
8.
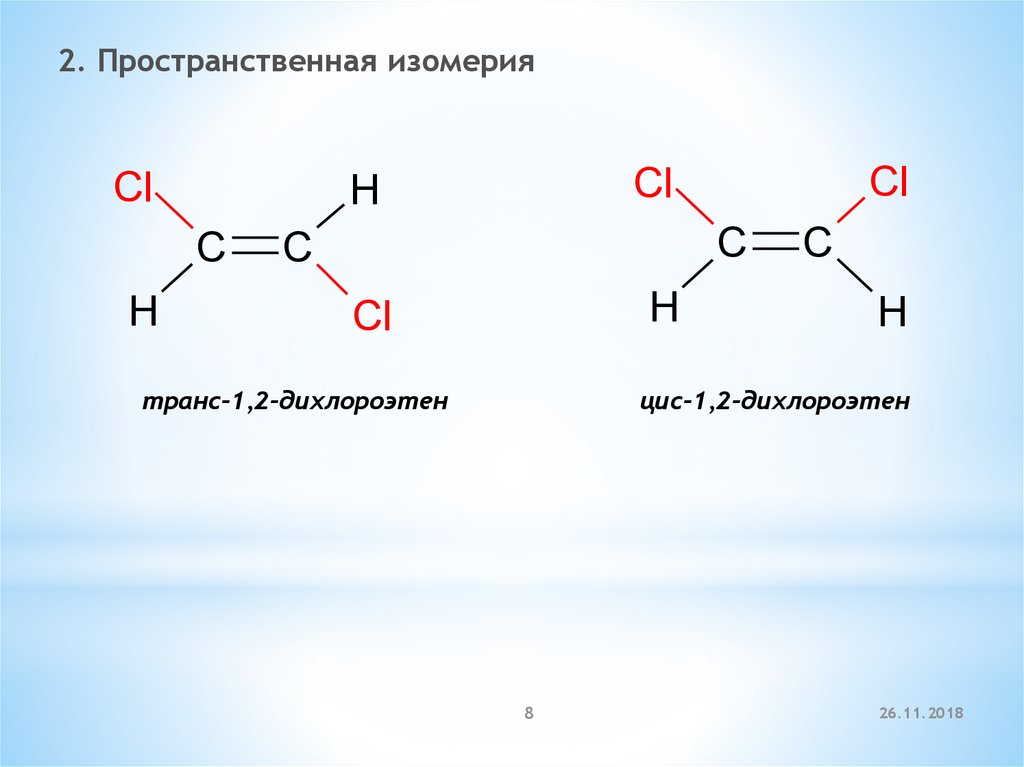
2. Пространственная изомерияCl
C
H
Cl
Cl
H
C
C
H
Cl
транс-1,2-дихлороэтен
C
H
цис-1,2-дихлороэтен
8
26.11.2018
9.
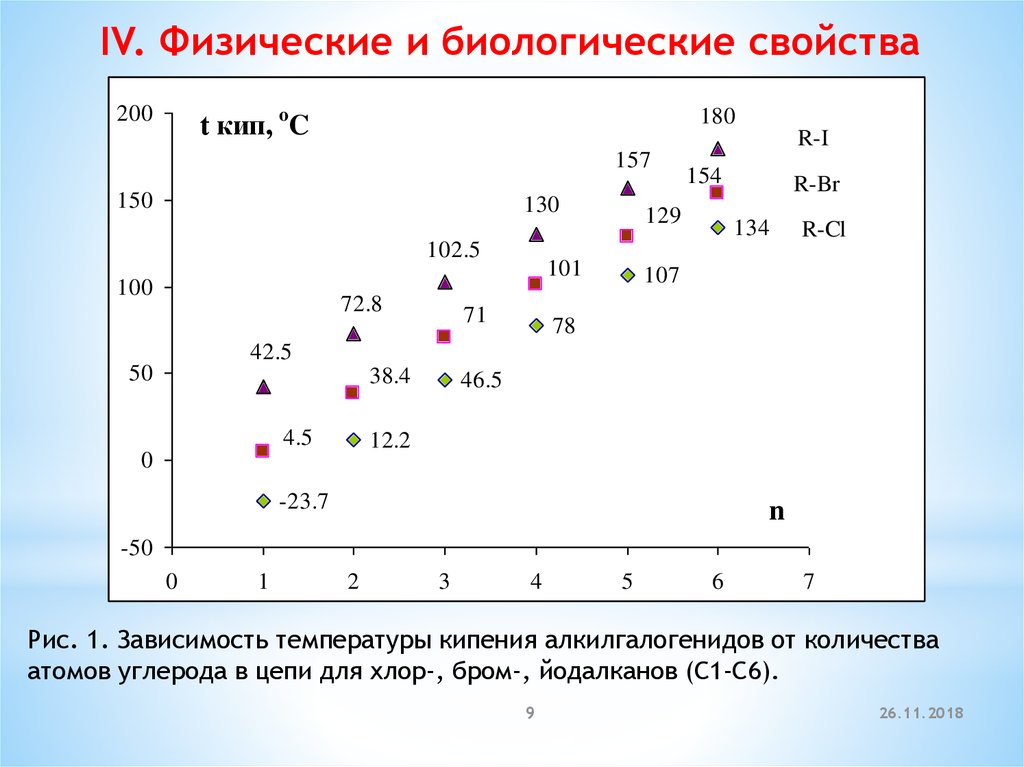
IV. Физические и биологические свойства200
180
t кип, oC
R-I
157
150
130
102.5
100
72.8
129
101
71
154
R-Br
134
R-Cl
107
78
42.5
50
38.4
4.5
46.5
12.2
0
-23.7
n
-50
0
1
2
3
4
5
6
7
Рис. 1. Зависимость температуры кипения алкилгалогенидов от количества
атомов углерода в цепи для хлор-, бром-, йодалканов (С1-С6).
9
26.11.2018
10.
CH3Clt кип. oC
-23,7
CHCl3
CHCl3
40
61,2
CCl4
76,8
Галогенопроизводные являются гидрофобными
веществами: они плохо растворяются в воде и хорошо
растворяются в неполярных гидрофобных растворителях.
Многие галогенопроизводные используются как хорошие
растворители: хлороформ, хлористый метилен,
четырёххлористый углерод используются для растворения
масел, жиров и эфирных масел.
10
26.11.2018
11.
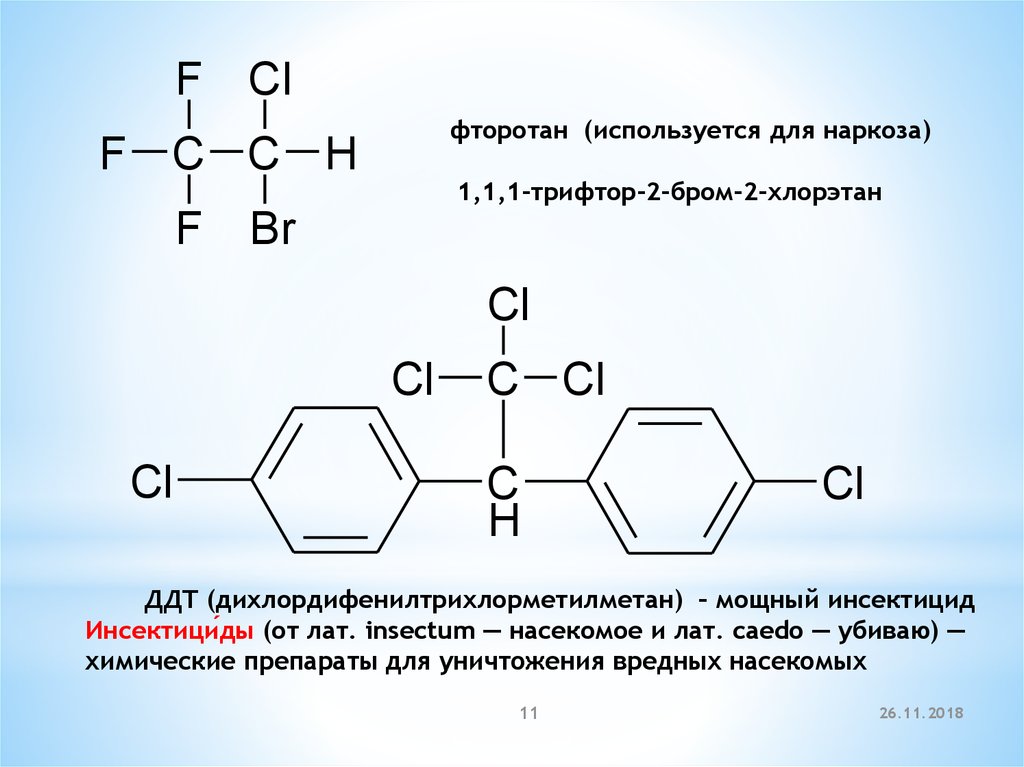
FCl
фторотан (используется для наркоза)
F C C H
F
1,1,1-трифтор-2-бром-2-хлорэтан
Br
Cl
Cl
Cl
C Cl
C
H
Cl
ДДТ (дихлордифенилтрихлорметилметан) – мощный инсектицид
Инсектици́ды (от лат. insectum — насекомое и лат. caedo — убиваю) —
химические препараты для уничтожения вредных насекомых
11
26.11.2018
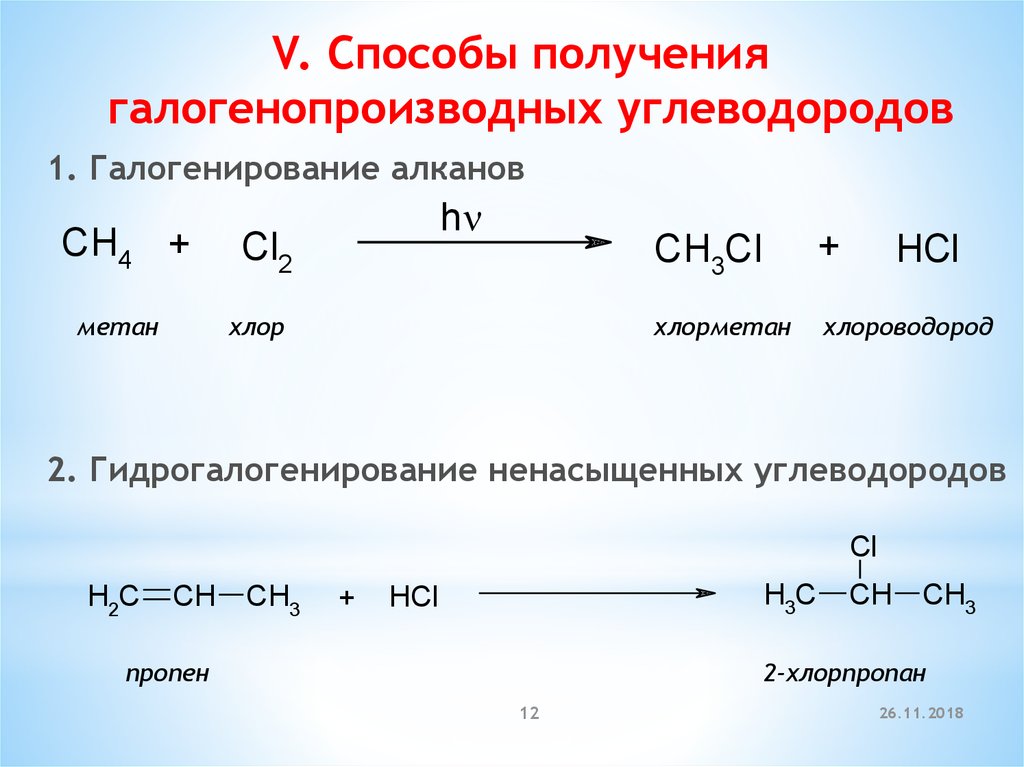
12.
V. Способы получениягалогенопроизводных углеводородов
1. Галогенирование алканов
CH4 +
метан
h
Cl2
хлор
CH3Cl
+
хлорметан
хлороводород
HCl
2. Гидрогалогенирование ненасыщенных углеводородов
Cl
H2C
CH
CH3
+
H3C
HCl
пропен
CH
CH3
2-хлорпропан
12
26.11.2018
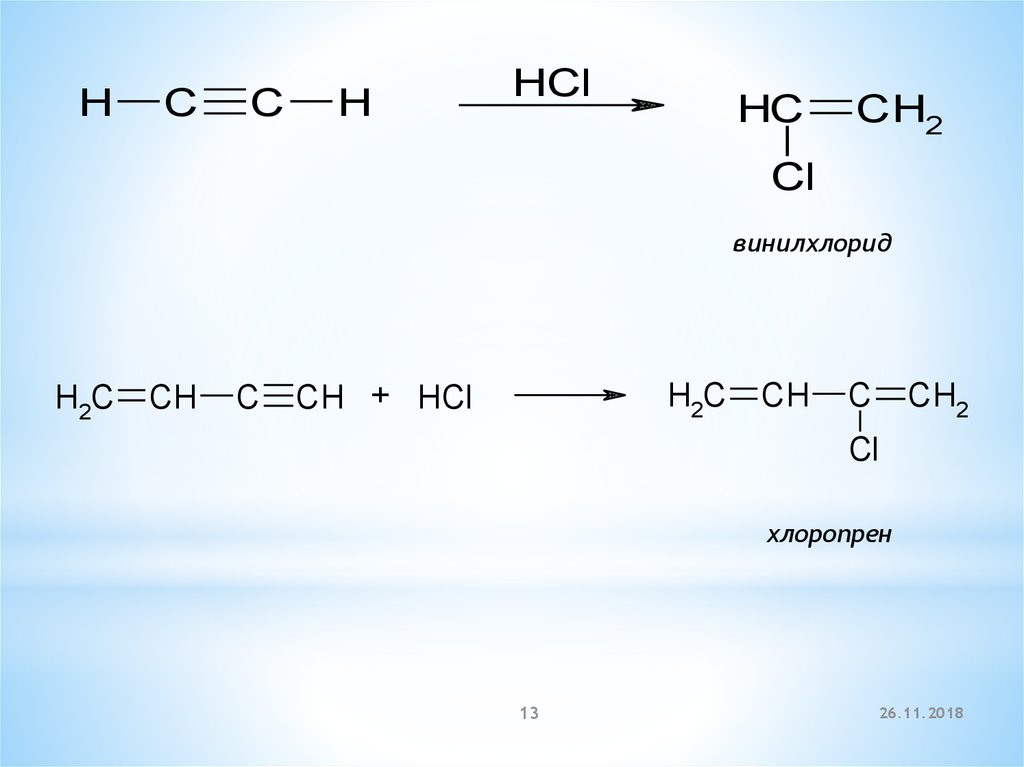
13.
HC
C
H
HCl
HC
CH2
Cl
винилхлорид
H2C
CH
C
CH + HCl
H2C
CH
C
CH2
Cl
хлоропрен
13
26.11.2018
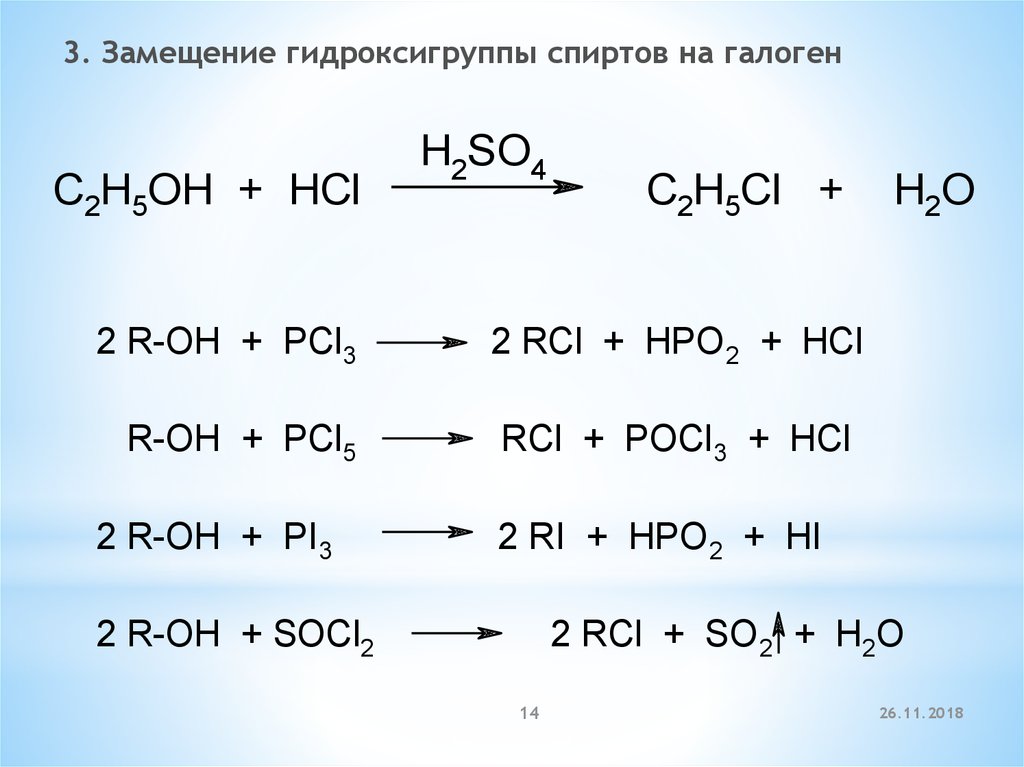
14.
3. Замещение гидроксигруппы спиртов на галогенC2H5OH + HCl
2 R-OH + PCl3
R-OH + PCl5
2 R-OH + PI3
H2SO4
C2H5Cl +
H2O
2 RCl + HPO 2 + HCl
RCl + POCl3 + HCl
2 RI + HPO 2 + HI
2 R-OH + SOCl2
2 RCl + SO 2 + H2O
14
26.11.2018
15.
4. Реакция Бородина-ХунсдиккераCH3 CH2 CH2 COOAg
+
CH3 CH2 CH2 Br
Br2
+ CO2 + AgBr
русский учёный-химик
(химик-органик) и композитор
Александр Бородин (31.10.1833 – 15.02.1887)
15
26.11.2018
16.
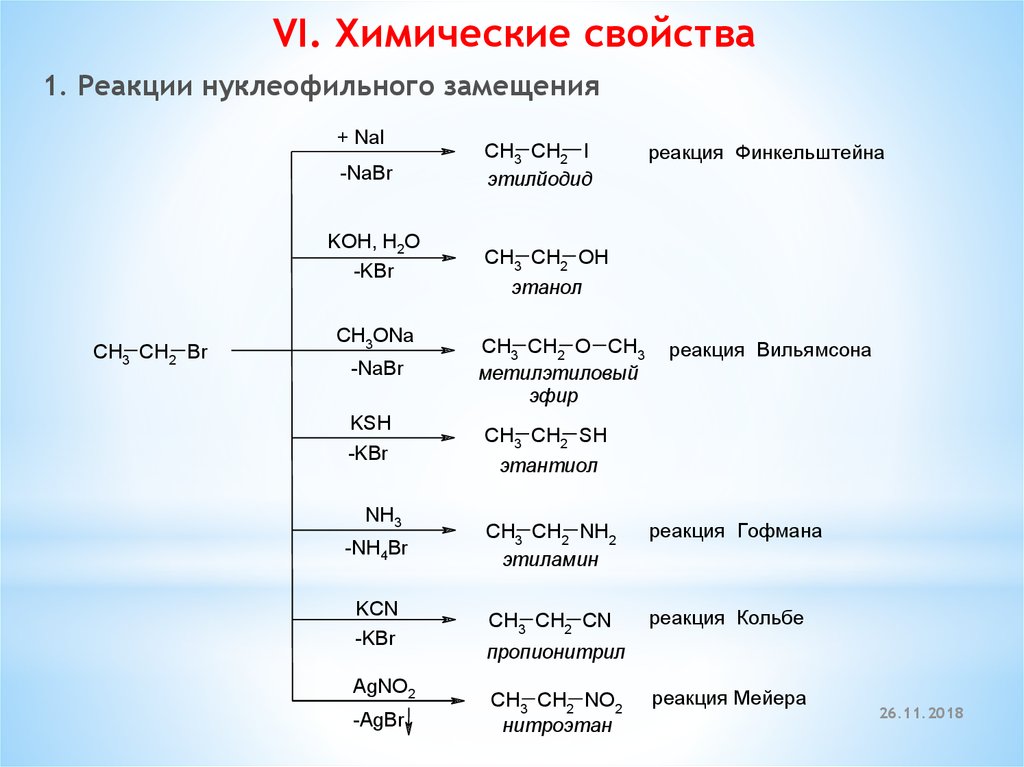
VI. Химические свойства1. Реакции нуклеофильного замещения
+ NaI
-NaBr
KOH, H2O
-KBr
CH3 CH2 Br
CH3ONa
-NaBr
KSH
-KBr
NH3
CH3 CH2 I
этилйодид
рeакция Финкeльштeйна
CH3 CH2 OH
этанол
CH3 CH2 O CH3
мeтилэтиловый
эфир
рeакция Вильямсона
CH3 CH2 SH
этантиол
-NH4Br
CH3 CH2 NH2
этиламин
рeакция Гофмана
KCN
-KBr
CH3 CH2 CN
рeакция Кольбe
AgNO2
-AgBr
пропионитрил
CH3 CH2 NO2
нитроэтан
рeакция Мeйeра
26.11.2018
17.
Органические галогенидыМеханизмы реакций нуклеофильного замещения и
элиминирования
Алкилгалогенид
ы
Органические
галогениды
Типичные реакции c
участием галогена:
Типичные реакции c
участием галогена:
SN
Арилгалогениды
SN
E
Механизмы
:
Механизмы
:
SN1, SN2
Ареновый
E1, E2
17
Ариновый
26.11.2018
18. Типовые реакции алифатического нуклеофильного замещения с участием алкилгалогенидов
НазваниеРеакция
Гидролиз алкилгалогенидов
Алкилирование
алкилгалогенидами
Алкилирование аминов
Реакции с участием
ацетиленовой группы
18
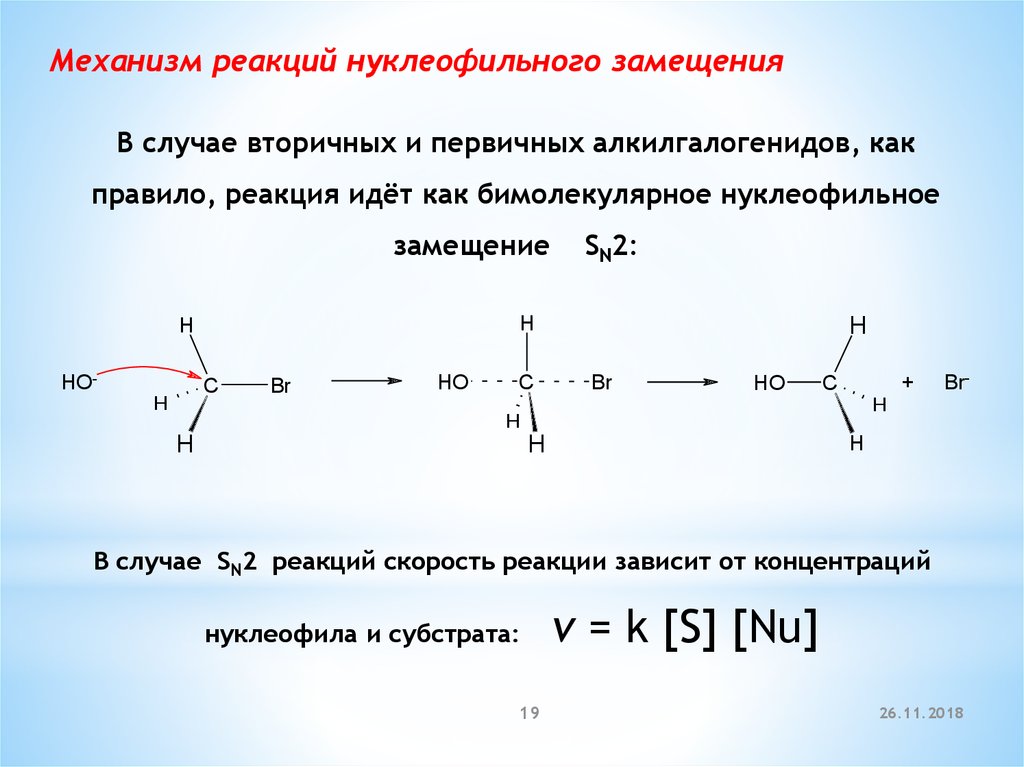
19.
Механизм реакций нуклеофильного замещенияВ случае вторичных и первичных алкилгалогенидов, как
правило, реакция идёт как бимолекулярное нуклеофильное
замещение
H
H
HO-
C
H
SN2:
Br
HO
C
H
Br
HO
+
C
H
H
H
Br-
H
H
В случае SN2 реакций скорость реакции зависит от концентраций
нуклеофила и субстрата:
19
v = k [S] [Nu]
26.11.2018
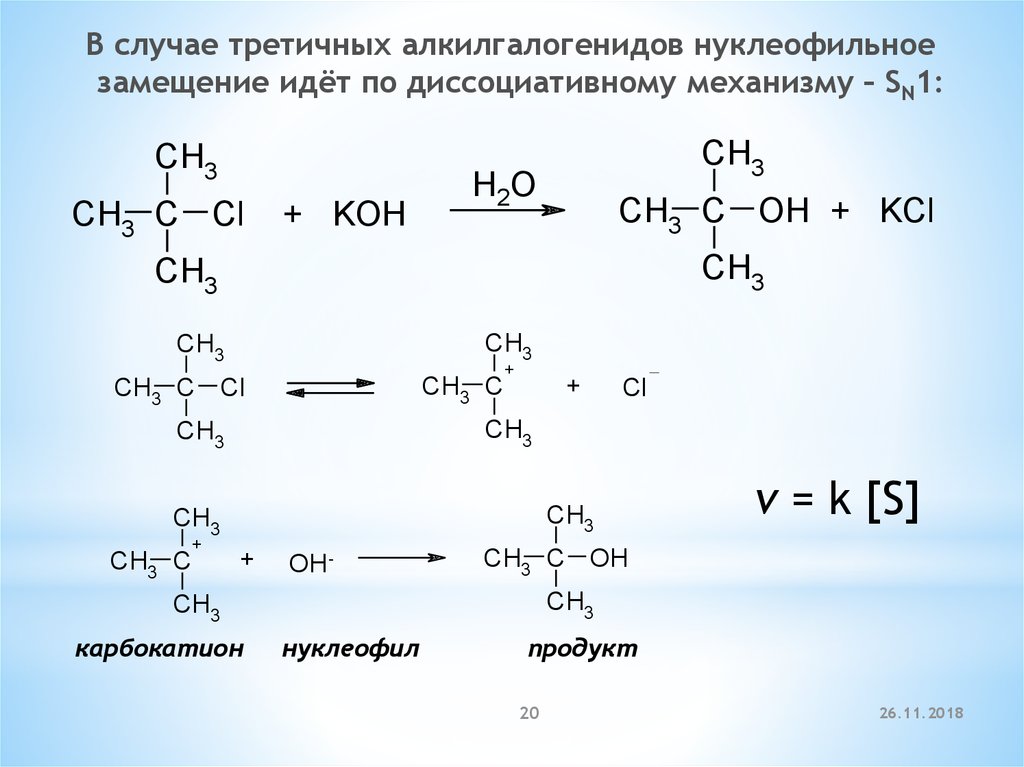
20.
В случае третичных алкилгалогенидов нуклеофильноезамещение идёт по диссоциативному механизму – SN1:
CH3
CH3 C Cl
+ KOH
CH3
H2O
CH3 C OH + KCl
CH3
CH3
CH3
CH3
CH3 C
CH3 C Cl
+
+
CH3
CH3
CH3
CH3
CH3 C
+
Cl
+
OH-
CH3 C OH
CH3
CH3
карбокатион
v = k [S]
нуклеофил
продукт
20
26.11.2018
21.
Реакционная способность алкилгалогенидов вреакциях нуклеофильного замещения:
Аллил, бензил > третичный > вторичный > первичный > CH3X
SN-1
SN-1 SN-2
21
SN-2
26.11.2018
22.
2. Реакции элиминирования (отщепления)1) дегидрогалогенирования
KOH, спирт, t
CH2 CH2
H
Cl
-HCl
H2C
CH2
Если проводить эту реакцию в воде, а не в спирте, то основным
продуктом будет спирт, а не алкен.
22
26.11.2018
23.
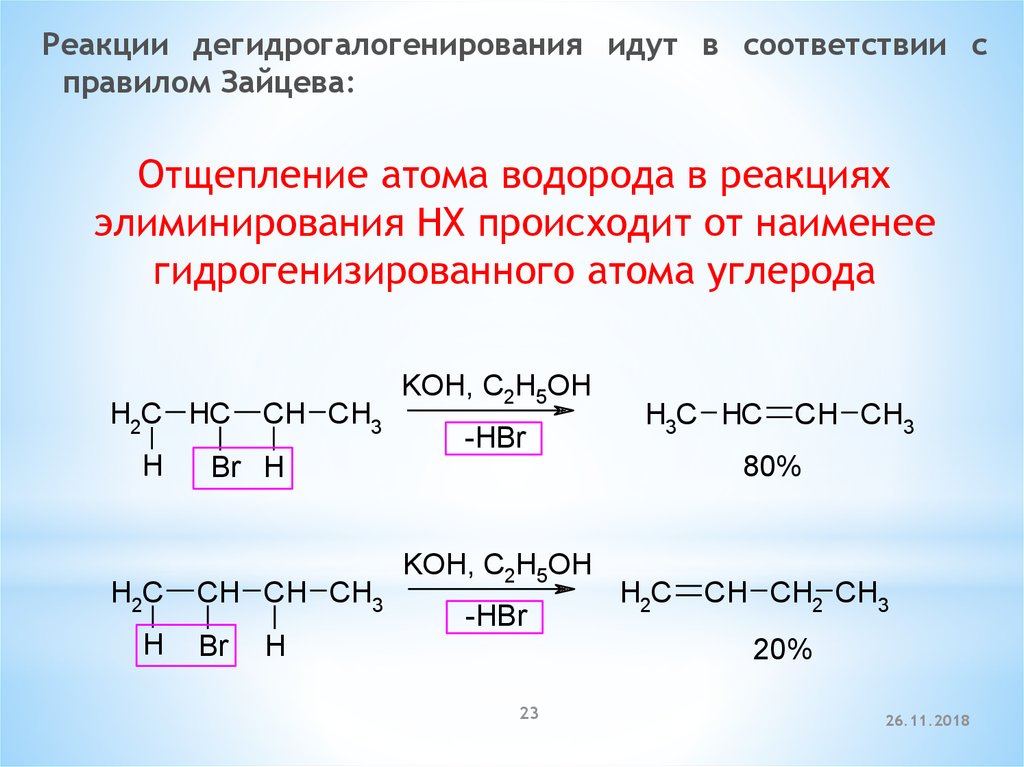
Реакции дегидрогалогенирования идут в соответствии справилом Зайцева:
Отщепление атома водорода в реакциях
элиминирования HX происходит от наименее
гидрогенизированного атома углерода
H2C HC
H
H2C
H
CH CH3
KOH, C2H5OH
-HBr
H3C HC
80%
Br H
CH CH CH3
Br
CH CH3
KOH, C2H5OH
-HBr
H
H2C
CH CH2 CH3
20%
23
26.11.2018
24.
Дата рождения: 2 июля 1841Место рождения: г. Казань
Дата смерти:
1 сентября 1910 (69 лет)
Место смерти: г. Казань
Страна: Российская империя
Научная сфера: химия
Место работы: Казанский университет
Научный руководитель: А. М. Бутлеров
Александр Михайлович Зайцев
Зайцев воспитал большую школу
химиков (Е. Е. Вагнер, А. Е. Арбузов,
С. Н. Реформатский, А. Н.
Реформатский, И. И. Канонников и
др.).
24
26.11.2018
25.
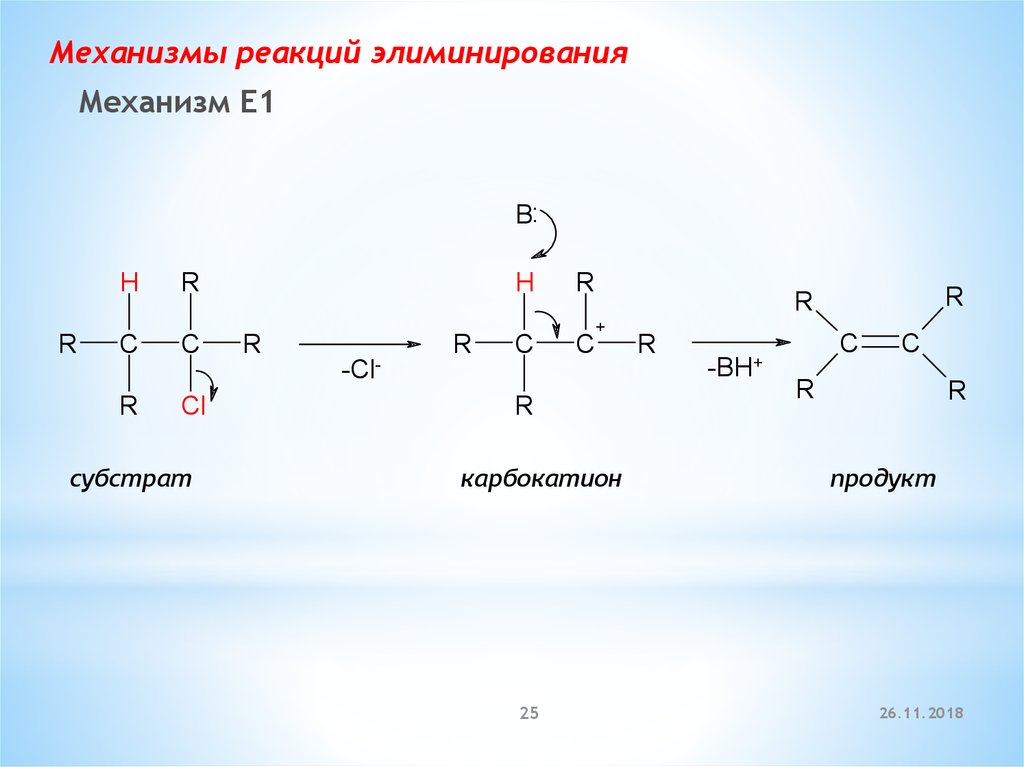
Механизмы реакций элиминированияМеханизм E1
B:
H
R
C
R
C
H
R
R
C
R
C
+
-ClR
Cl
субстрат
R
карбокатион
25
R
R
R
-BH+
C
C
R
R
продукт
26.11.2018
26.
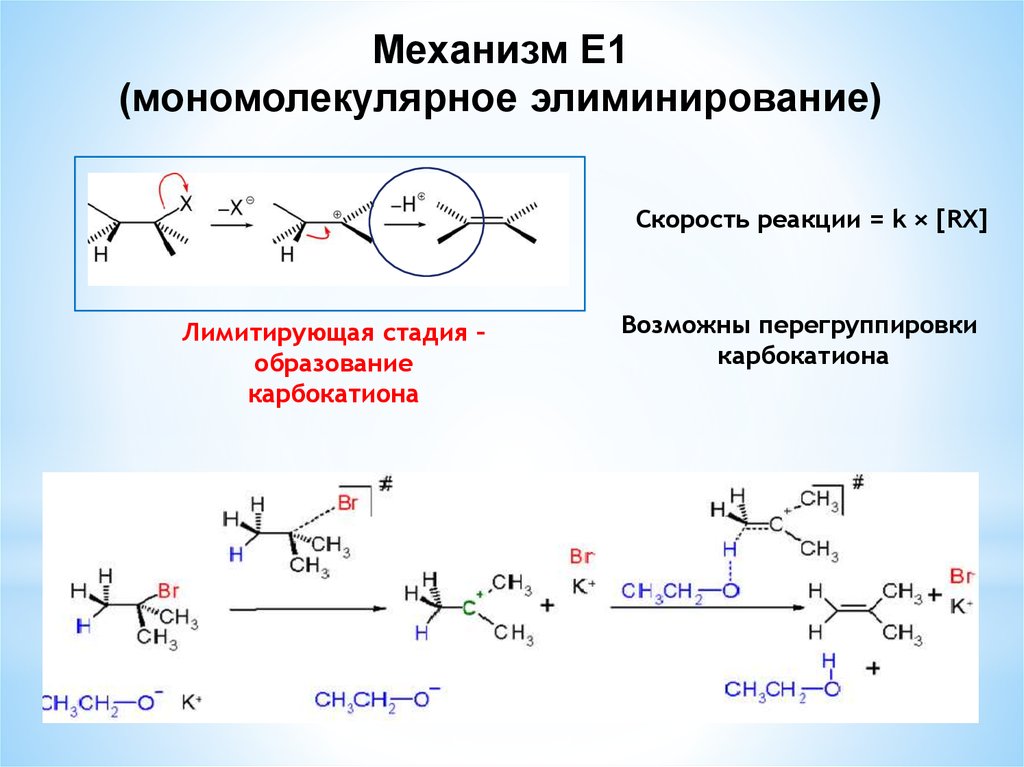
Механизм Е1(мономолекулярное элиминирование)
Скорость реакции = k × [RX]
Лимитирующая стадия –
образование
карбокатиона
Возможны перегруппировки
карбокатиона
27.
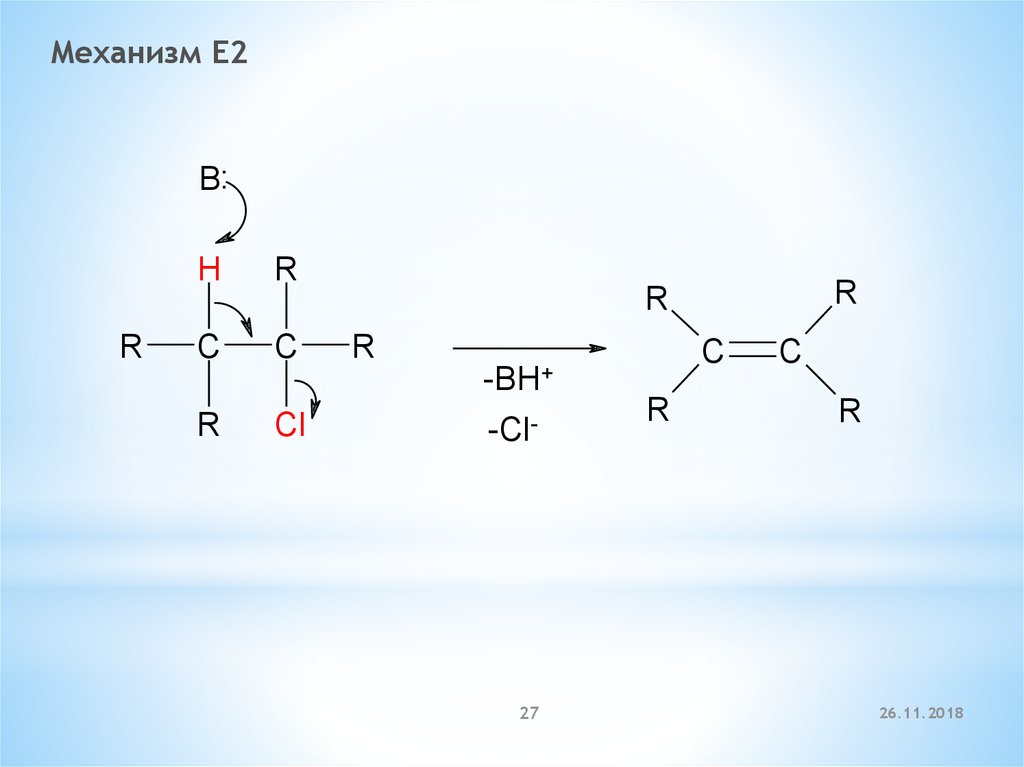
Механизм E2B:
R
H
R
C
C
R
-BH+
R
Cl
R
R
-Cl-
27
C
R
C
R
26.11.2018
28.
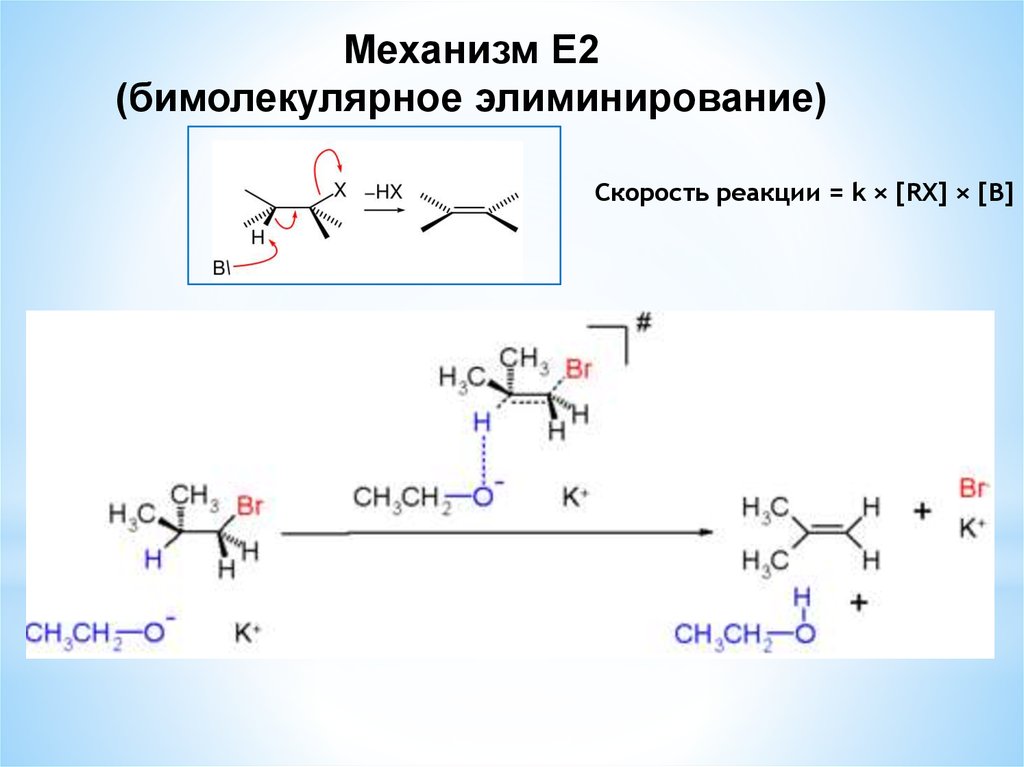
Механизм Е2(бимолекулярное элиминирование)
Скорость реакции = k × [RX] × [В]
29.
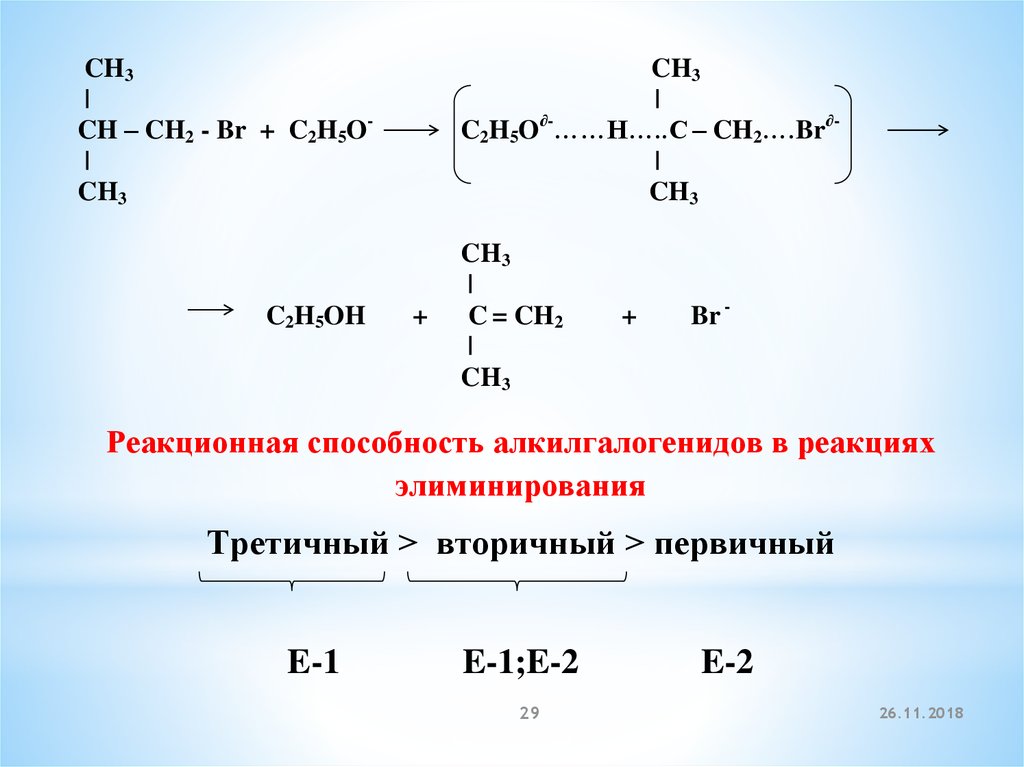
CH3|
CH – CH2 - Br + C2H5O|
CH3
C2H5OH
CH3
|
∂C2H5O ……H…..C – CH2….Br∂|
CH3
+
CH3
|
C = CH2
|
CH3
+
Br -
Реакционная способность алкилгалогенидов в реакциях
элиминирования
Третичный > вторичный > первичный
E-1
E-1;E-2
29
E-2
26.11.2018
30.
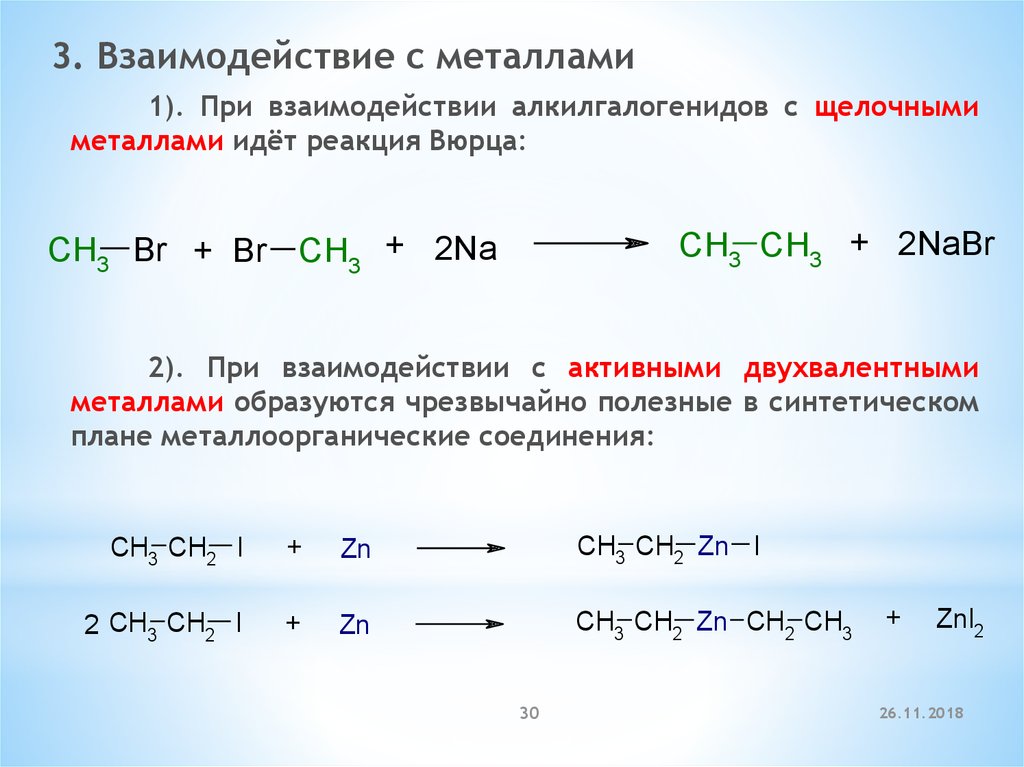
3. Взаимодействие с металлами1). При взаимодействии алкилгалогенидов с щелочными
металлами идёт реакция Вюрца:
CH3 CH3 + 2NaBr
CH3 Br + Br CH3 + 2Na
2). При взаимодействии с активными двухвалентными
металлами образуются чрезвычайно полезные в синтетическом
плане металлоорганические соединения:
CH3 CH2 I
+
Zn
CH3 CH2 Zn I
2 CH3 CH2 I
+
Zn
CH3 CH2 Zn CH2 CH3
30
+
ZnI2
26.11.2018
31.
CH3 CH2 Br+
Mg
эфир
этилбромид
CH3 CH2 Mg Br
этилмагнийбромид
Mg-органические соединения – реактивы Гриньяра
(Гриньяр, Нобелевская премия, 1912)
31
26.11.2018
32.
Гриньяр (Grignard) Франсуа ОгюстВиктор (06.05.1871, Шербур, —
13.12.1935, Лион), французский
химик-органик, член Парижской АН
(1926). Преподаватель, а затем
профессор университета в Нанси (с
1909). В 1900 совместно со своим
учителем Ф. Барбье получил раствор
эфиратов смешанных магнийгалогенорганических соединений и
применил эти соединения для синтеза
многих классов органических
соединений. Вскоре новый метод
широко вошёл в химическую практику
(см. Гриньяра реакция). Много
внимания Г. уделил разработке
номенклатуры органических
соединений. Нобелевская премия
(1912, совместно с П. Сабатье).
32
26.11.2018
33.
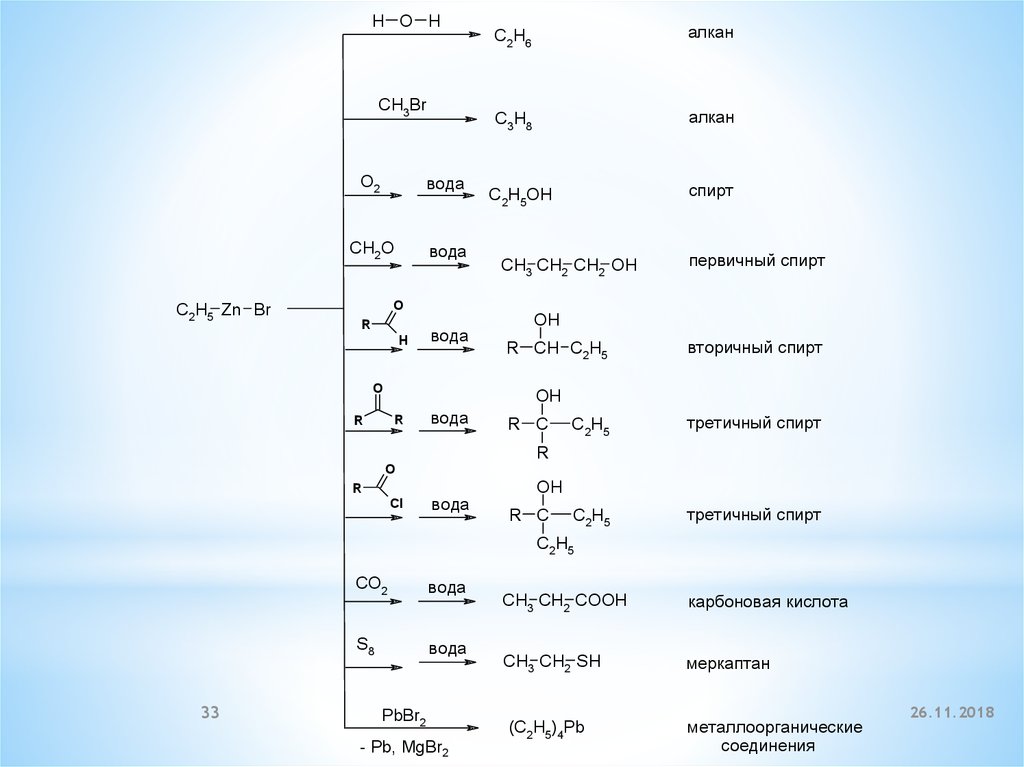
H O HCH3Br
C2H5 Zn Br
O2
вода
CH2O
вода
O
R
H
вода
O
C2H6
алкан
C3H8
алкан
спирт
C2H5OH
CH3 CH2 CH2 OH
пeрвичный спирт
OH
R CH C2H5
вторичный спирт
OH
R
R
вода
Cl
C2H5
трeтичный спирт
C2H5
трeтичный спирт
R
O
R
R C
вода
OH
R C
C2H5
33
CO2
вода
S8
вода
PbBr2
- Pb, MgBr2
CH3 CH2 COOH
карбоновая кислота
CH3 CH2 SH
мeркаптан
(C2H5)4Pb
мeталлоорганичeскиe
соeдинeния
26.11.2018
34.
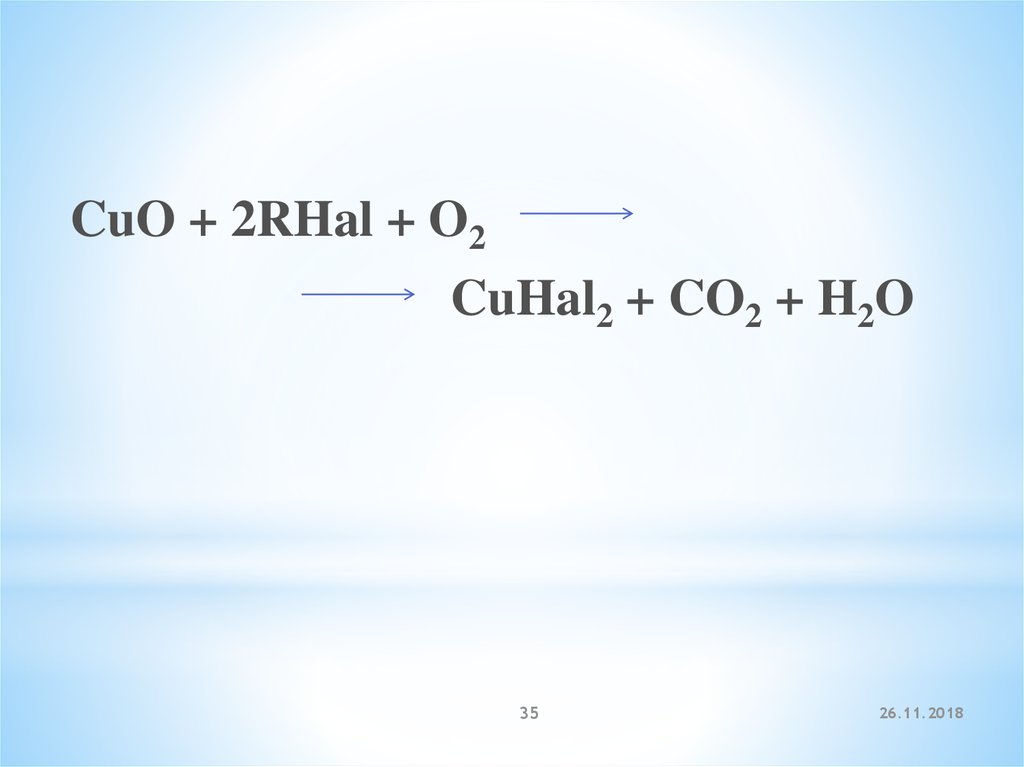
Качественная реакция на галогенопроизводныеназывается пробой Бейльштейна:
При нагревании галогенопроизводного с медью,
атомы галогена отщепляются с образованием
летучих хлоридов меди, окрашивающий пламя в
красивый зелёный или сине-зелёный цвет.
Метод предложен русским
учёным-химиком
Фёдором Фёдоровичем
Бейльштейном в 1872 г
Фёдор Фёдорович (Фридрих
Конрад) Бейльштейн
34
26.11.2018
35.
CuO + 2RHal + O2CuHal2 + CO2 + H2O
35
26.11.2018
36.
37. Спасибо за Ваше внимание!
3726.11.2018














 Химия
Химия








