Похожие презентации:
Классификация веществ в зависимости от типа химической связи
1.
2. Разделите вещества на группы
AlCl3, O2, Al, SO3,Na, HCl, Cl2, Na2S
3. Классификация веществ в зависимости от типа химической связи
• Ионная AlCl3, Na2S• Ковалентная полярная SO3, HCl
• Ковалентная неполярная O2, Cl2
• Металлическая Al, Na
4.
Ионная3+
Al Cl
,
3
+1
Na
2
2S
Ковалентная полярная
δ+
δδ+
δS O 3, H Cl
+6
-2
S O
,
3
+1
-1
H Cl
5. Степень окисления
это заряд,который может возникнуть у атома
в соединении,
если представить, что
связь в этом соединении
ионная
6. Правила определения cтепени окисления
7. 1. У свободных атомов и у атомов в составе простых веществ СО равна 0.
Na2O, H2, Ba, H2SO4, N2, S,H2O, Al, Cu, HNO3, F2, CaO
8. 2. Металлы во всех соединениях имеют положительную СО, её максимальное значение равно номеру группы: А) у металлов главной
подгруппы I группы +1Б) у металлов главной подгруппы II группы +2
В) у металлов главной подгруппы III группы +3
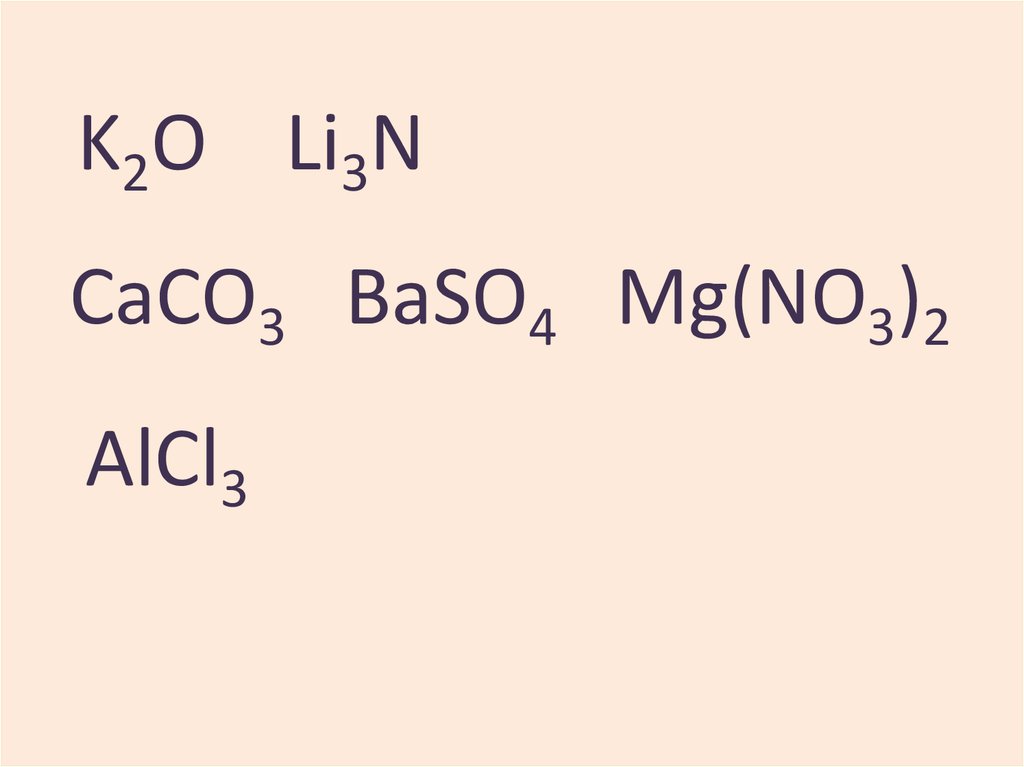
Na, K2O, Fe, CaCO3, CrO3,
AlCl3, Li3N, BaSO4, Zn,
Mg(NO3)2, Mn2O7
9.
K2O Li3NCaCO3 BaSO4 Mg(NO3)2
AlCl3
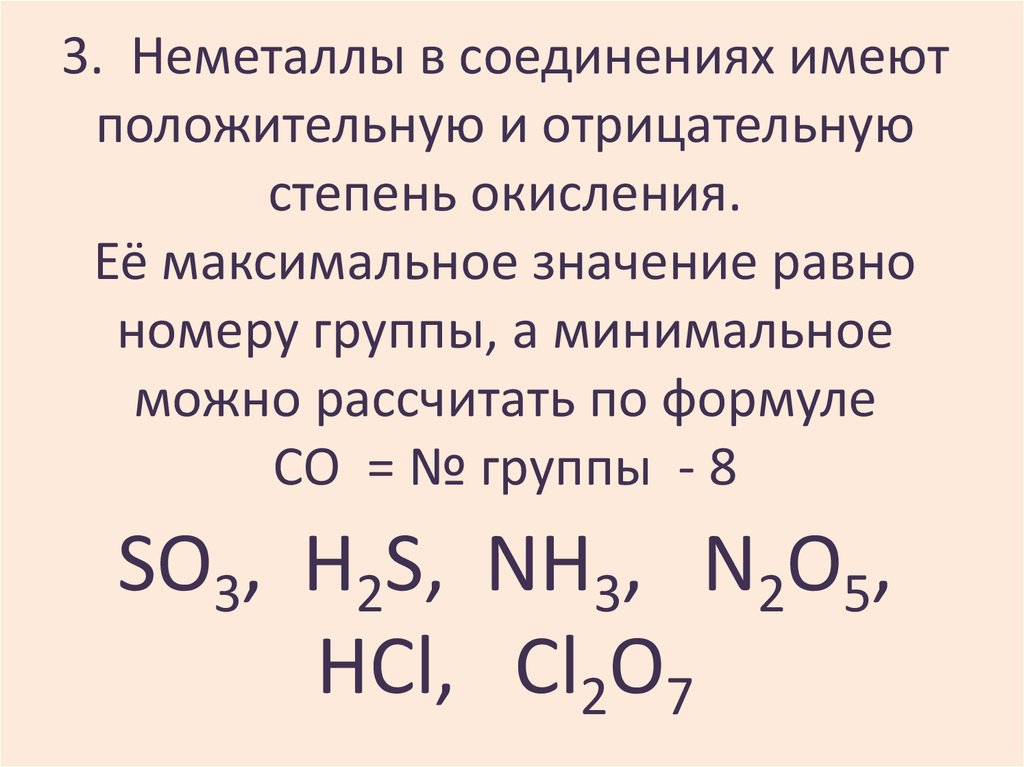
10. 3. Неметаллы в соединениях имеют положительную и отрицательную степень окисления. Её максимальное значение равно номеру группы,
а минимальноеможно рассчитать по формуле
СО = № группы - 8
SO3, H2S, NH3, N2O5,
HCl, Cl2O7
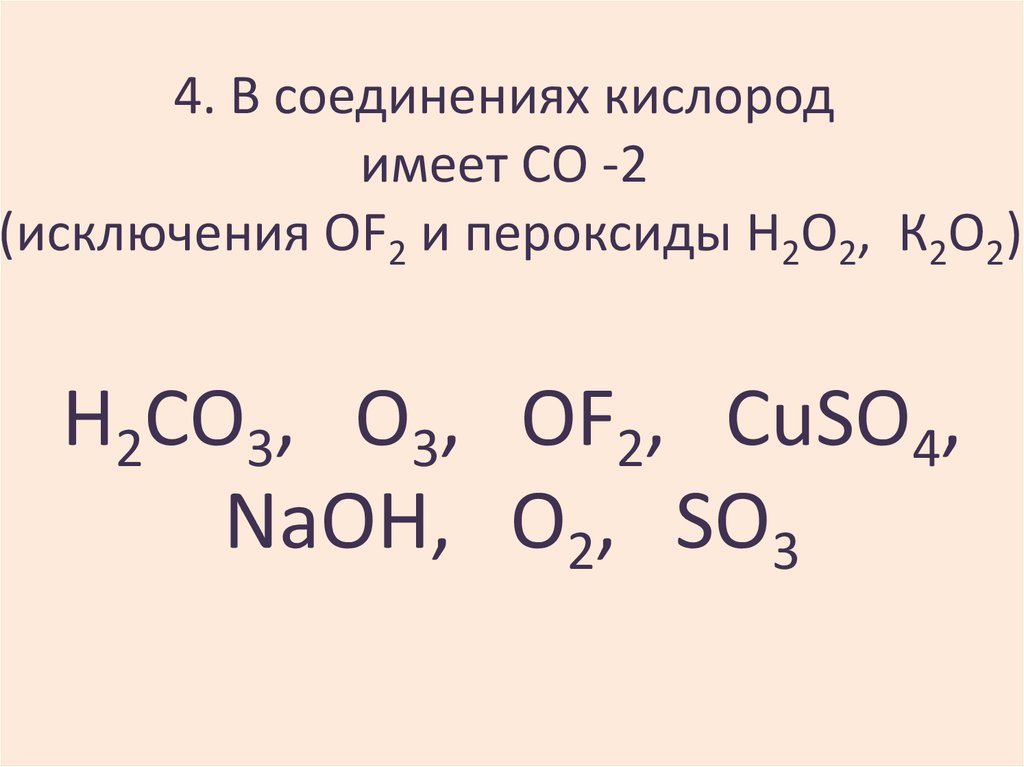
11. 4. В соединениях кислород имеет СО -2 (исключения OF2 и пероксиды Н2О2, К2О2)
H2CO3, O3, OF2, CuSO4,NaOH, O2, SO3
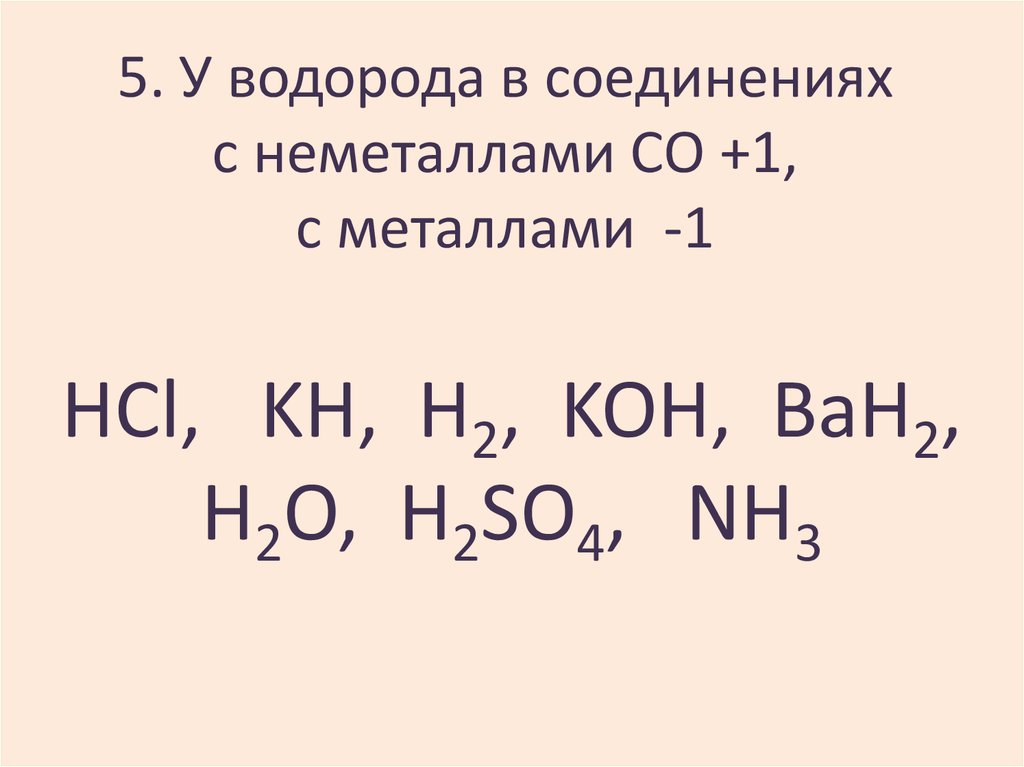
12. 5. У водорода в соединениях с неметаллами СО +1, с металлами -1
HCl, KH, H2, KOH, BaH2,H2O, H2SO4, NH3
13. 6. В соединениях сумма степеней окисления всех атомов равна 0.
14.
Группа 1+1
-2
-3
+1
N2 O , N H 3 ,
+5
-2
+3
-2
N2 O5 , Fe2 O3 ,
+3
-2
Al2 S3
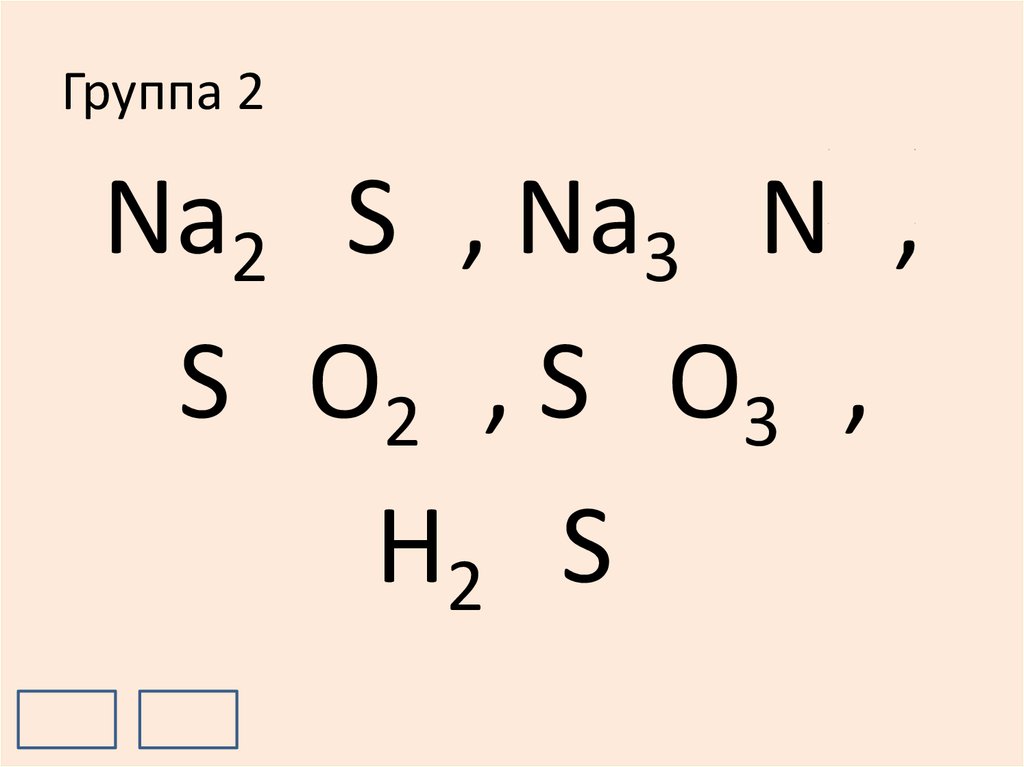
15. Группа 2
+1-2
+1
-3
Na2 S , Na3 N ,
+4
-2
+6
-2
S O2 , S O3 ,
+1
-2
H2 S
16. Группа 3
+2-2
Mg S ,
+2
-3
Mg3 N2 ,
+5
-2
-3
+1
P2 O 5 , P H 3 ,
+3
-2
P2 O 3
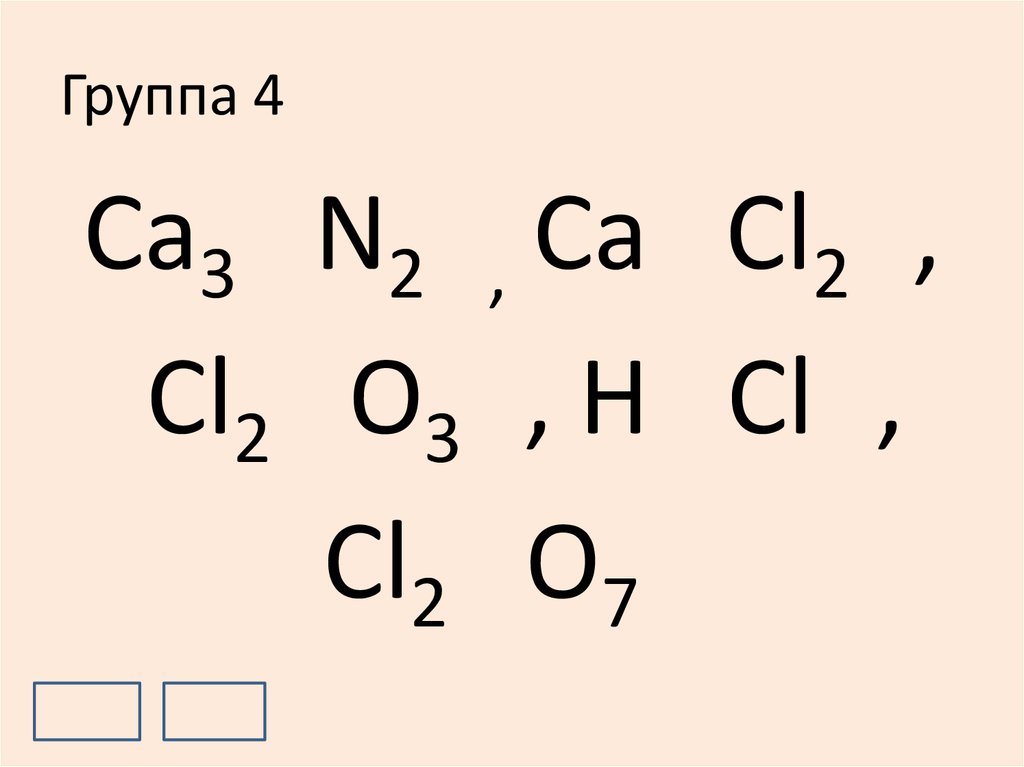
17. Группа 4
+2-3
+2
-1
Ca3 N2 , Ca Cl2 ,
+3
-2
+1
-1
Cl2 O3 , H Cl ,
+7
-2
Cl2 O7
18. Алгоритм определения cтепени окисления
1. Запишем значение постоянной степениокисления.
2. Умножим значение постоянной степени
окисления на число атомов элемента.
3. Полученное число разделим на число атомов
второго элемента.
4. Полученное число – значение степени
окисления второго элемента.
5. Необходимо помнить, что сумма степеней
окисления элементов в соединении равна 0.
19. Алгоритм определения cтепени окисления
Составим уравнение. Для этого1) определим значение постоянной степени
окисления и умножим его на число атомов
элемента;
2) неизвестную степень окисления обозначим Х
и умножим на число атомов элемента;
3) сложим полученные произведения;
4) их сумма равна 0, так как сумма степеней
окисления элементов в соединении равна 0.
20. Группа 6
K3P, K3PO4, KF,+4
-2
С S2 , SiH4
(+1) х 3 + Х + (-2) х 4 = 0
21.
На уроке я узнал ….
На уроке я научился …
Сегодня мне удалось…
При подготовке домашнего
задания мне надо обратить
внимание на ….
• Я хочу узнать …
22. Степень окисления. Определение степени окисления по формуле вещества.
23. Домашнее задание
1. Прочитайте текст §18 с. 100 – 1042. Выучите определение и правила.
3. Выполните задания 5, 7 на с. 106
















 Химия
Химия








