Похожие презентации:
Степень окисления. Тип химической связи для веществ
1. Степень окисления
2. Цель урока:
• Разобраться, что такое «степеньокисления»
• Научиться находить степень окисления
по формуле
• Научиться составлять формулы по
степени окисления
3. Определите тип химической связи для веществ:
• Na• NaCl
• Cl2
• HCl
металлическая
ионная
Ковалентная неполярная
Ковалентная полярная
4. У каких веществ будут наблюдаться заряды атомов в соединениях
Na 0атом электронейтрален
-
+
NaCl
молекула электронейтральна,
0
Cl2
+
заряды будут, связь ионная
связь ковалентная неполярная
-
HCl
заряды будут
связь ковалентная полярная
5. Степень окисления –
− это условный заряд атомовхимических элементов в
соединении, вычисленный на основе
предположения, что все соединения
состоят из ионов
6.
Элементы по степениокисления
постоянная с.о.
Металлы I, II, III группы
гл. подгруппы
переменная с.о.
7. Правила определения с.о.
1. с.о. атомов в простых веществах = 0 (Na0, Cl20)2. с.о. фтора = -1 (O+2F2-1)
3. с.о. кислорода = -2 (кроме Н2О2-1, O+2F2)
4.
5.
6.
7.
8.
-1)
с.о. водорода = +1 (кроме
МеН
=
с.о.Ме I, II, III групп = номеру группы
с.о неМе «+» = № группы
с.о. неМе «-» = 8 – № группы
с.о. неМе «+» = № группы
9. Суммарная с.о. всех атомов в веществе = 0
8. Возможные с.о.
• Положительная «+» с.о. равна числуотданных электронов. Максимальная
с.о. равна номеру группы
• Отрицательная «-» с.о. равна числу
принятых электронов. Минимальная с.о.
равна 8 – номер группы
• Нулевое значение с.о. имеют атомы в
молекулах с неполярной связью
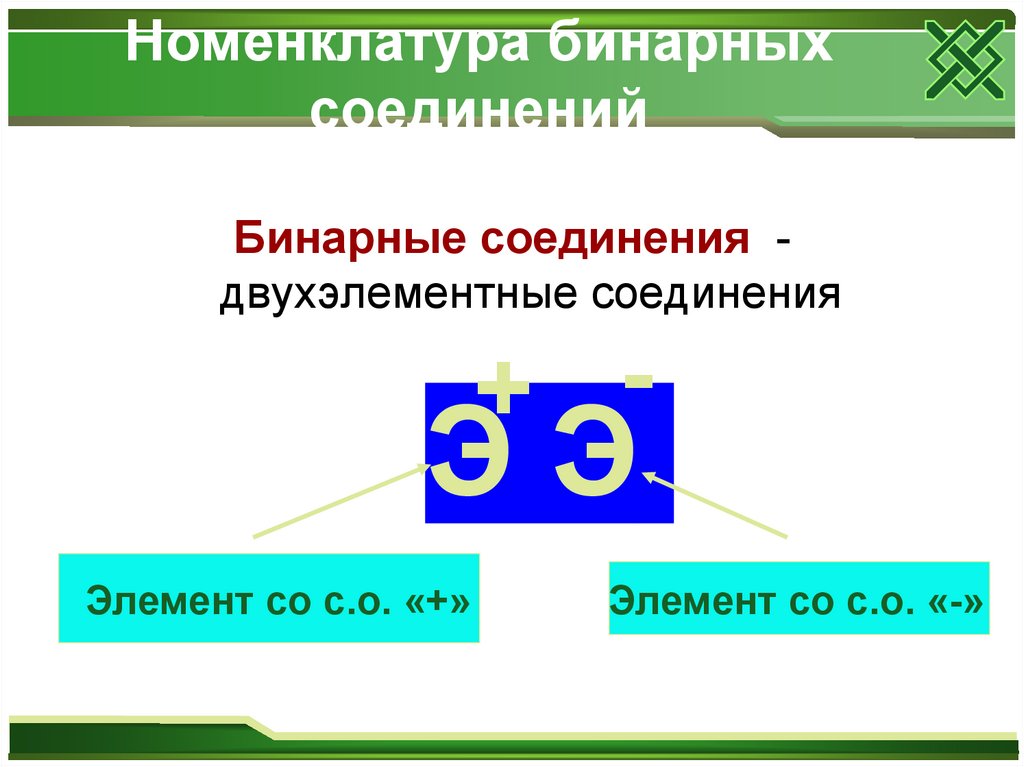
9. Номенклатура бинарных соединений
Бинарные соединения двухэлементные соединения+ -
ЭЭ
Элемент со с.о. «+»
Элемент со с.о. «-»
10. Название бинарных соедиенений– латинское с суффиксом «ид»
Хлорид – соединения хлораКарбид – соединения углерода
Сульфид – соединения серы
Оксид – соединения кислорода
Бромид – соединения брома
Фосфид – соединения фосфора
11. Определение степени окисления по формуле
12. Выполните задание
1 Определите с.о. у оксидов азота.NO N2O N2O3 NO2 N2O5
2 Определите с.о. и дайте названия
веществам.
Na2S Na3N NaBr MgCl2 MgS Mg3N2 Al2S3
Al2O3 N2O NH3 SO3 SO2 H2S Fe2O3
13. Составление формул по степени окисления
14. Составление формул по с.о.
1 если с.о. одинаковы, то индексы неставят.
2 если с.о. разные и их нельзя сократить,
то их ставят крест накрест
3 если с.о. разные и сокращаются, то их
сокращают и ставят крест накрест.
15. Выполните задание
1. Составьте формулы по степени окисленияА) Оксидов: марганца II, IV, VI, VII.
Б) Нитридов: натрия, кальция, алюминия.
В) гидрида бария,
хлорида фосфора,
сульфида алюминия,
хлорида сурьмы Sb (IV)
16. Промежуточные с.о.
Рассмотрим возможные с.о. серы – S
Максимальная +6 SO3
Минимальная -2 H2S
Сера может проявлять с.о. 0,+2,+4 – это
промежуточные с.о.
17. Определение с.о.
N2O3На первом месте стоит элемент с
«+» с.о., на втором с «-»
У кислорода постоянная с.о.=-2
У азота переменная с.о.
x -2
N2 O 3
Стр.67 прочитайте как найти x
18. Задание 1
• Определите С.О. по формулам• Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3,
Cu2O
19. Рефлексия
РОЗОВЫЙ – Узнал много нового! Было надчем подумать!
ОРАНЖЕВЫЙ – Я все хорошо понял, мне
было интересно! Цель достигнута!
ЖЕЛТЫЙ - Тему усвоил! Она мне пригодится
в жизни! Полезно!
СИНИЙ – Мне не все удалось, я могу лучше!
Мне надо больше стараться!
КРАСНЫЙ - Я не удовлетворен занятием!
Сложно! Я ничего не понял.



















 Химия
Химия








