Похожие презентации:
Простые эфиры
1. Простые эфиры
126.11.2018
2.
I Классификация1. В зависимости от строения углеводородного скелета:
1) ациклические
а)алифатические:
не смешанные (симметричные)
R–O–R
CH3 – O – CH3 ; CH3 – CH2 – O – CH2 – CH3
смешанные (несимметричные)
R – O – R1; CH3 – O – CH2 – CH3
б) ароматические:
R – О – Ar;
Ar – O – Ar1 ;
2
Ar – O – Ar
26.11.2018
3.
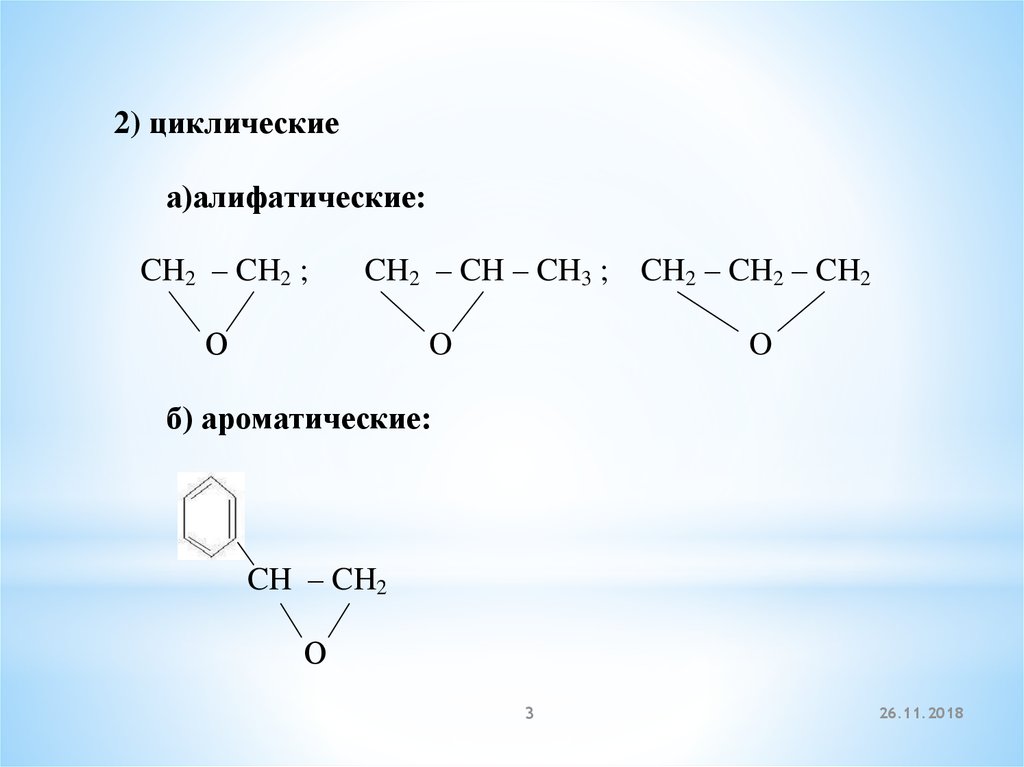
2) циклическиеа)алифатические:
CH2 – CH2 ;
CH2 – CH – CH3 ;
О
O
CH2 – CH2 – CH2
O
б) ароматические:
CH – CH2
О
3
26.11.2018
4.
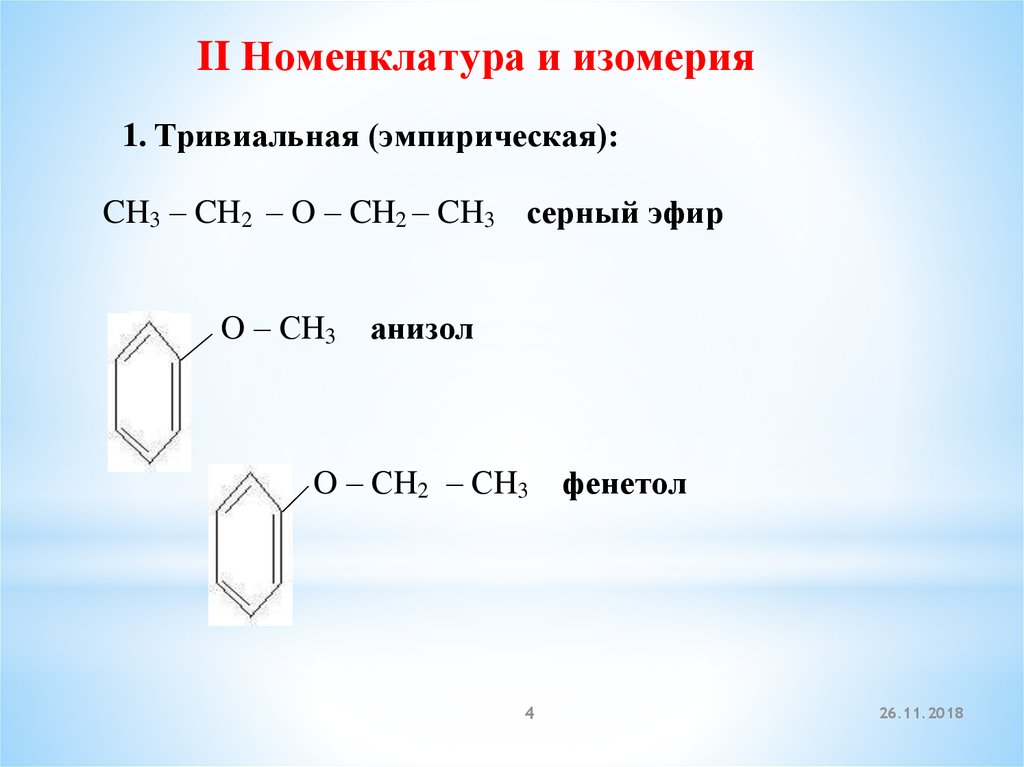
II Номенклатура и изомерия1. Тривиальная (эмпирическая):
CH3 – CH2 – O – CH2 – CH3 серный эфир
O – СH3
анизол
O – СH2 – СH3
4
фенетол
26.11.2018
5.
2. Рациональная:CH3 – O – CH3
диметиловый эфир
CH3 – O – CH2 – CH3
метилэтиловый эфир
CH3 – CH2 – O – CH – CH3
|
CH3 этилизопропиловый эфир
CH3 – CH2 – CH2 – O – CH – CH3
|
CH3
пропилизопропиловый эфир
5
26.11.2018
6.
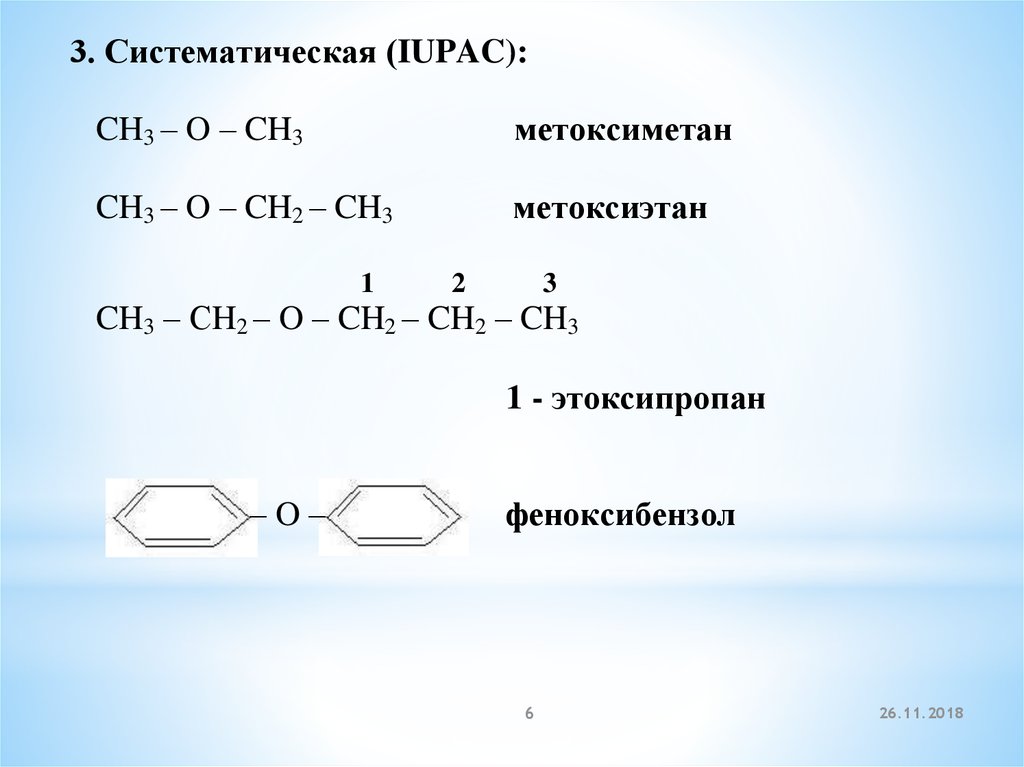
3. Систематическая (IUPAC):CH3 – O – CH3
метоксиметан
CH3 – O – CH2 – CH3
метоксиэтан
1
2
3
CH3 – СH2 – O – CH2 – CH2 – CH3
1 - этоксипропан
–O–
феноксибензол
6
26.11.2018
7.
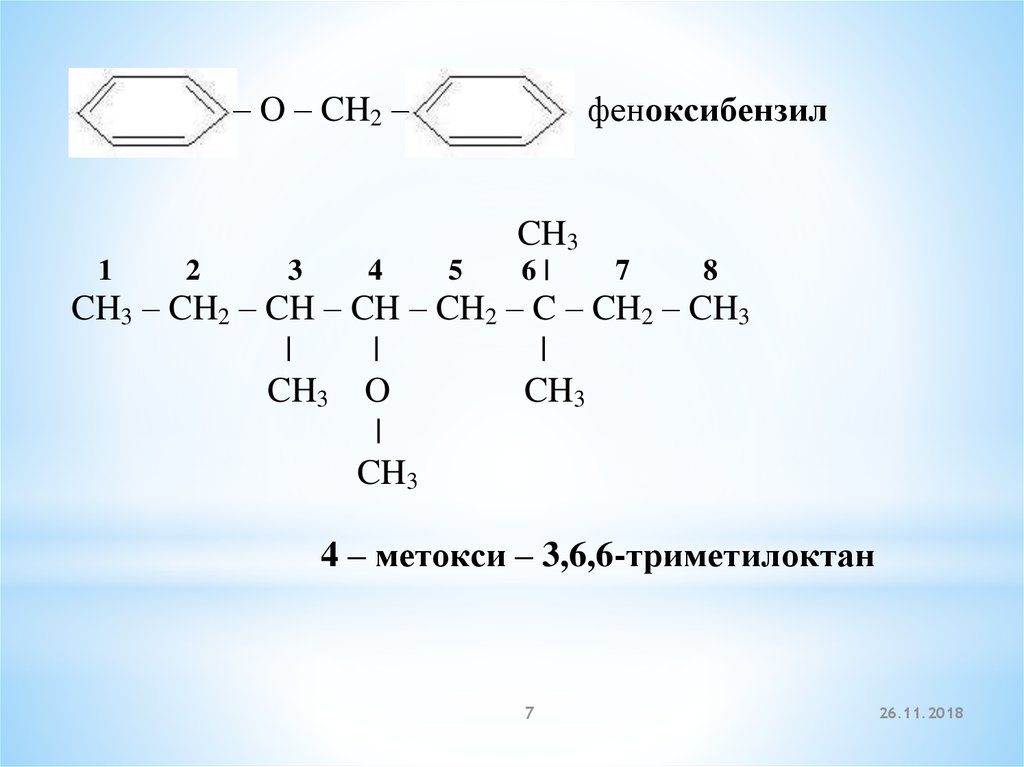
– O – CH2 –феноксибензил
CH3
1
2
3
4
5
6|
7
8
CH3 – CH2 – CH – CH – CH2 – C – CH2 – CH3
|
|
|
CH3 O
CH3
|
CH3
4 – метокси – 3,6,6-триметилоктан
7
26.11.2018
8.
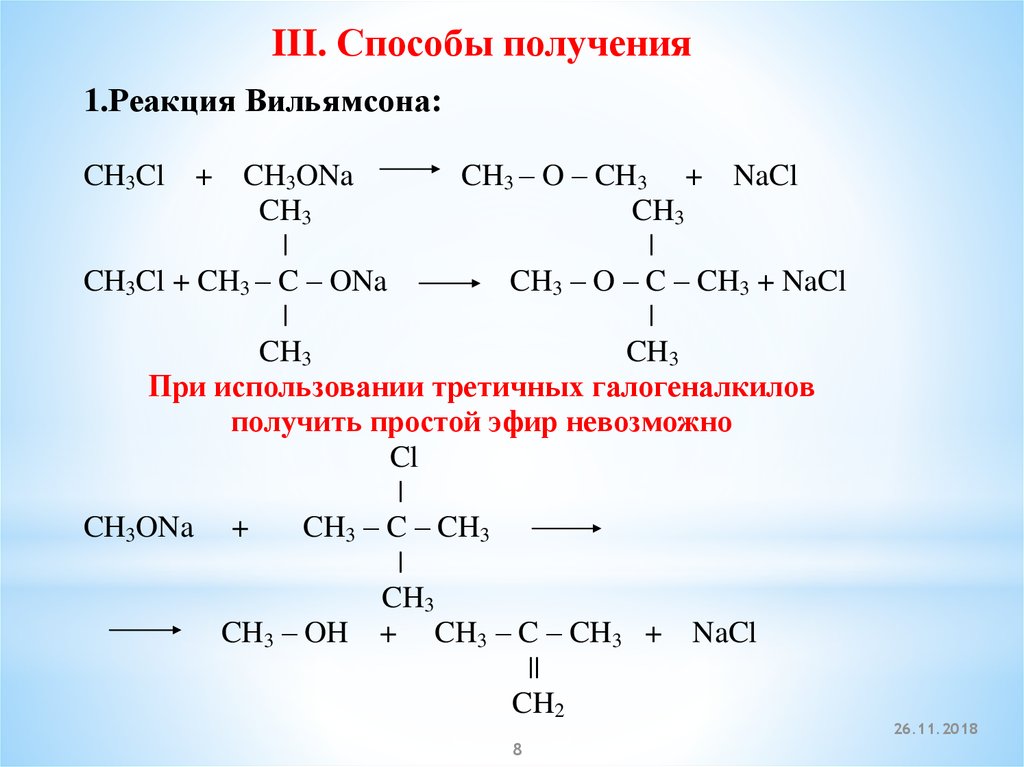
III. Способы получения1.Реакция Вильямсона:
+ CH3ONa
CH3 – O – CH3 + NaCl
CH3
CH3
|
|
CH3Cl + CH3 – C – ONa
CH3 – O – C – CH3 + NaCl
|
|
CH3
CH3
При использовании третичных галогеналкилов
получить простой эфир невозможно
Cl
|
CH3ONa +
CH3 – C – CH3
|
CH3
CH3 – OH + CH3 – C – CH3 + NaCl
||
CH2
CH3Cl
8
26.11.2018
9.
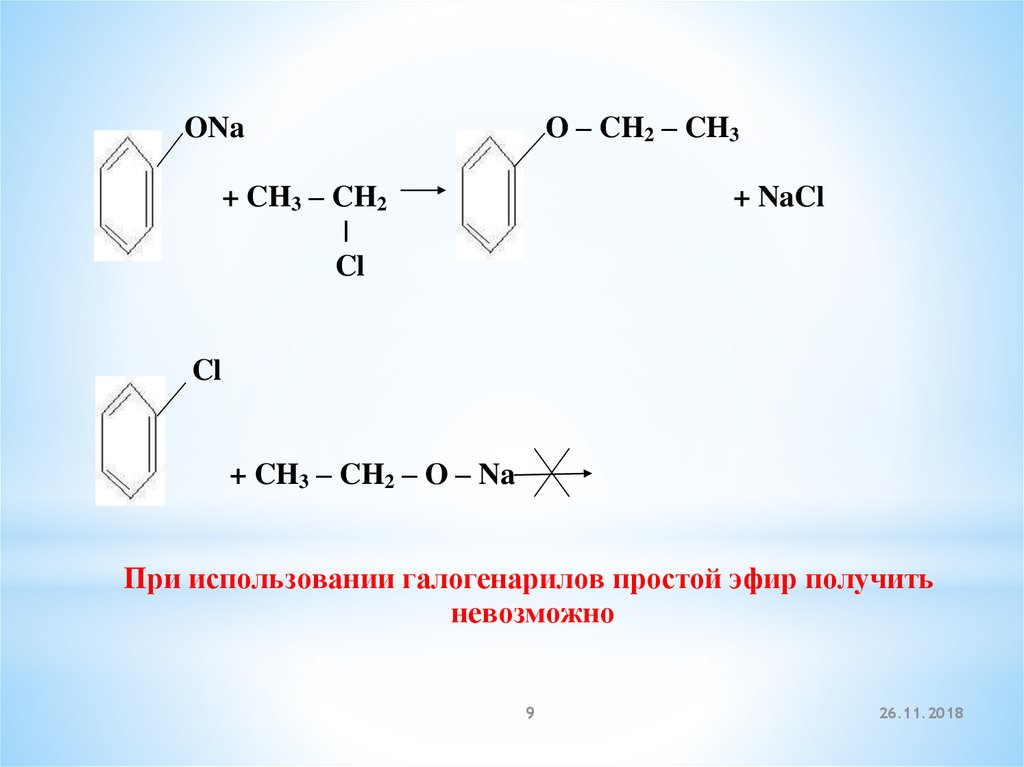
O – CH2 – CH3ONa
+ CH3 – CH2
|
Cl
+ NaCl
Cl
+ CH3 – CH2 – O – Na
При использовании галогенарилов простой эфир получить
невозможно
9
26.11.2018
10.
2. Взаимодействие спиртов (межмолекулярнаядегидратация):
H+
CH3OH + CH3OH
CH3 – O – CH3 + H2O
10
26.11.2018
11.
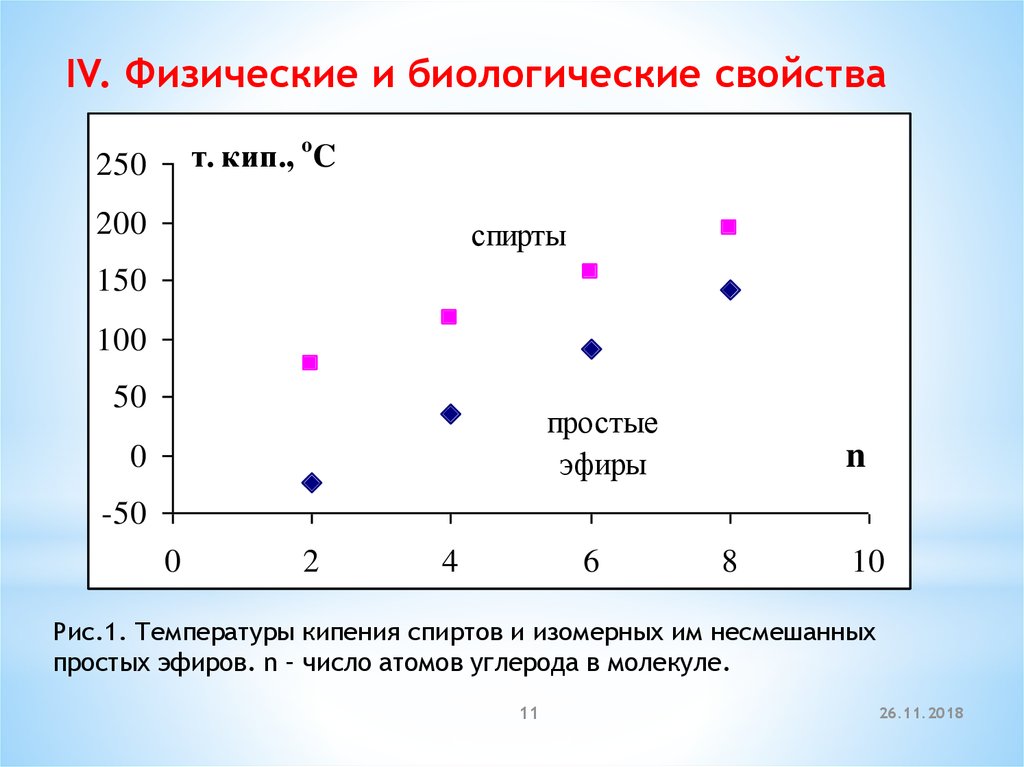
IV. Физические и биологические свойстват. кип., o C
250
200
спирты
150
100
50
простые
эфиры
0
n
-50
0
2
4
6
8
10
Рис.1. Температуры кипения спиртов и изомерных им несмешанных
простых эфиров. n – число атомов углерода в молекуле.
11
26.11.2018
12.
* Простыеэфиры
являются
довольно
инертными
соединениями, и значит относительно малотоксичными.
Простые
эфиры
проявляют
наркотические
свойства:
диэтиловый эфир широко использовался и используется для
наркоза.
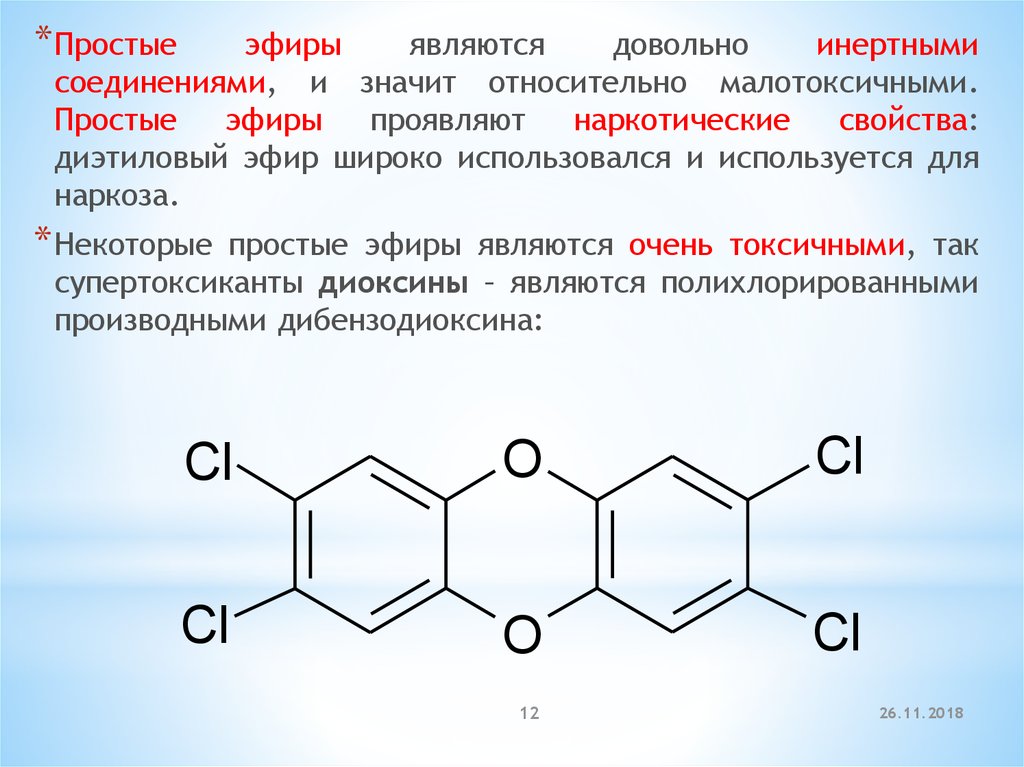
* Некоторые
простые эфиры являются очень токсичными, так
супертоксиканты диоксины – являются полихлорированными
производными дибензодиоксина:
Cl
O
Cl
Cl
O
Cl
12
26.11.2018
13.
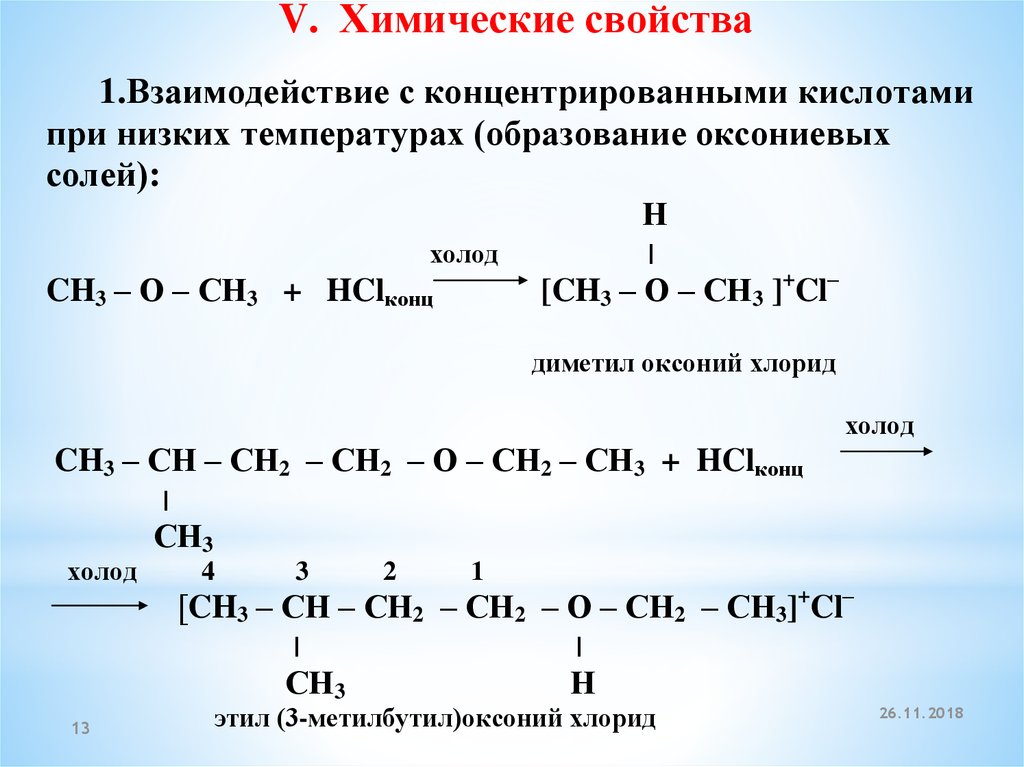
V. Химические свойства1.Взаимодействие с концентрированными кислотами
при низких температурах (образование оксониевых
солей):
Н
холод
CH3 – О – СН3 + HClконц
[CH3 – О – СН3 ]+Cl–
диметил оксоний хлорид
холод
CH3 – СН – СН2 – СН2 – О – СН2 – СН3 + HClконц
холод
СН3
4
3
1
[CH3 – СН – СН2 – СН2 – О – СН2 – СН3]+Cl–
СН3
13
2
Н
этил (3-метилбутил)оксоний хлорид
26.11.2018
14.
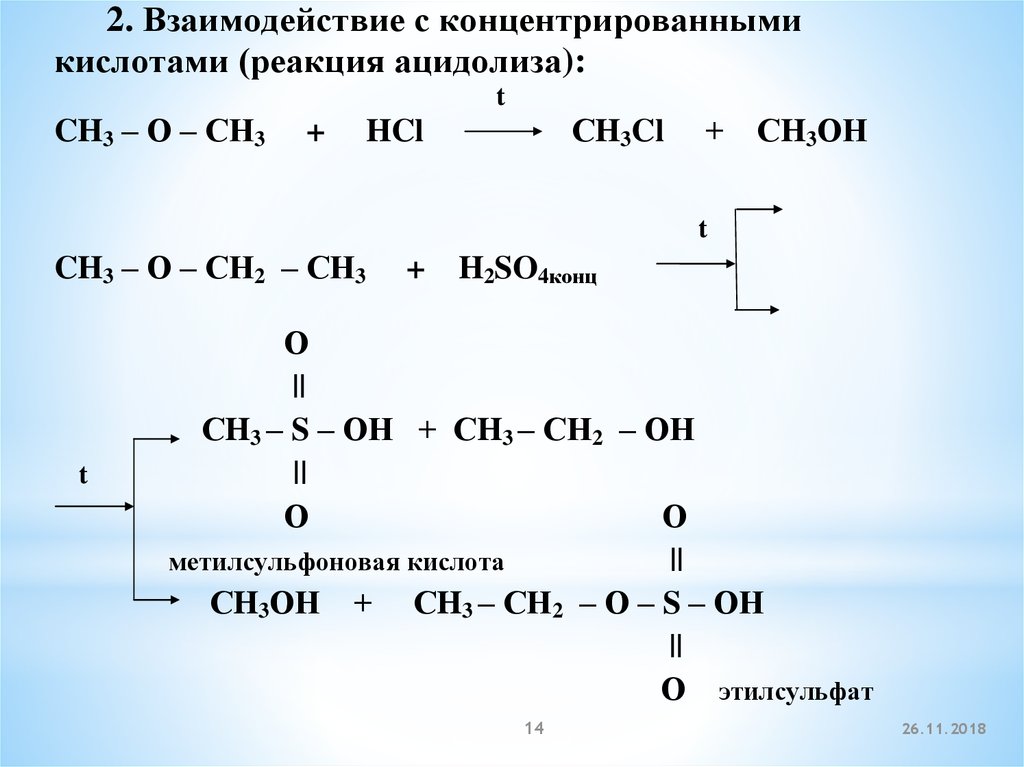
2. Взаимодействие с концентрированнымикислотами (реакция ацидолиза):
t
CH3 – О – СН3
+
СH3Cl
HCl
+
СH3ОН
t
CH3 – О – СН2 – СН3
t
+
H2SO4конц
О
||
СH3 – S – ОН + СH3 – СН2 – ОН
||
О
О
метилсульфоновая кислота
||
СH3ОН + СH3 – СН2 – О – S – ОН
||
О этилсульфат
14
26.11.2018
15.
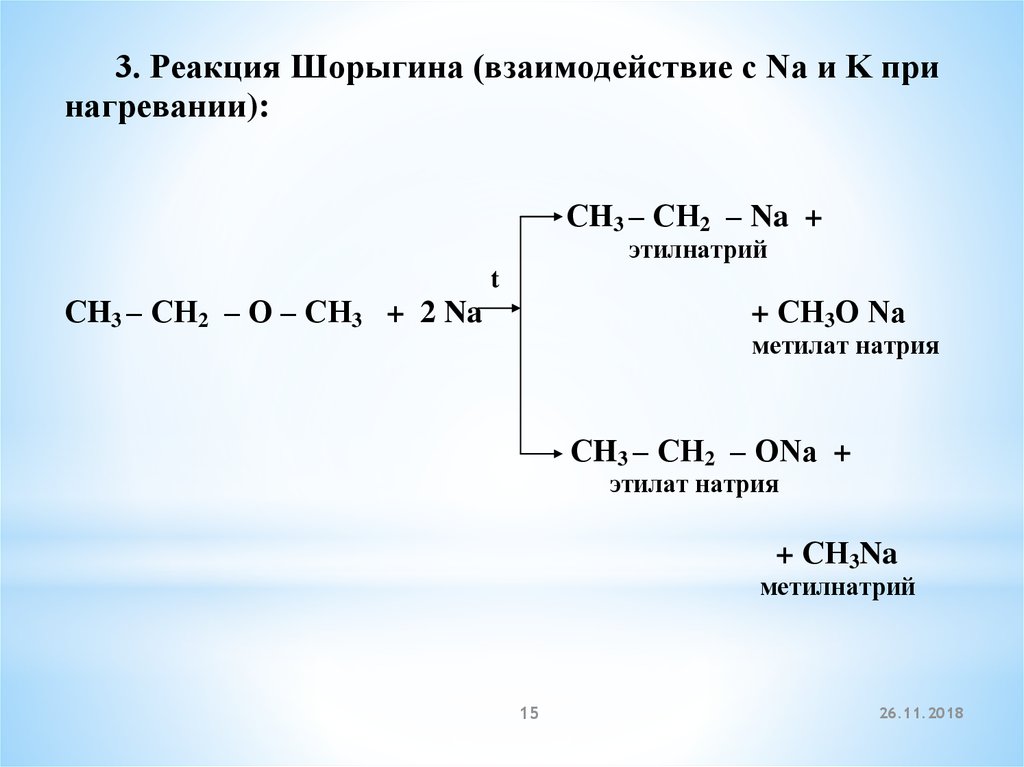
3. Реакция Шорыгина (взаимодействие с Na и K принагревании):
СH3 – СН2 – Na +
этилнатрий
t
СH3 – СН2 – О – СН3 + 2 Na
+ СН3О Na
метилат натрия
СH3 – СН2 – ОNa +
этилат натрия
+ СН3Na
метилнатрий
15
26.11.2018
16.
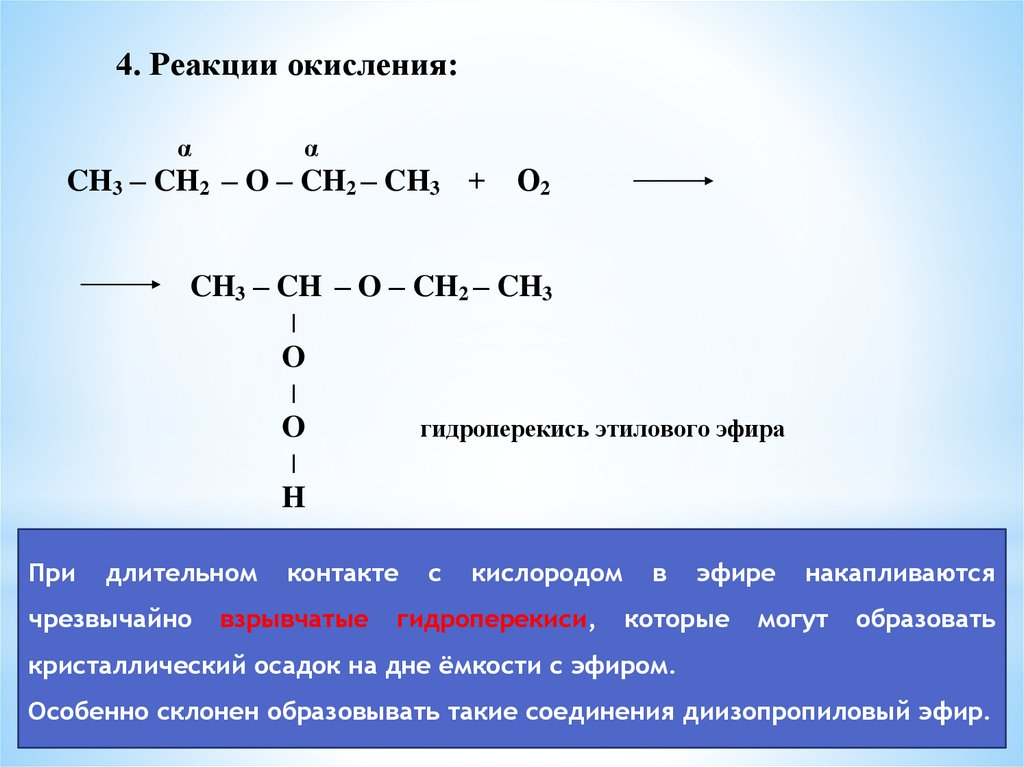
4. Реакции окисления:α
α
CH3 – CH2 – O – CH2 – CH3 +
О2
CH3 – CH – O – CH2 – CH3
O
гидроперекись этилового эфира
O
H
При
длительном
чрезвычайно
контакте
взрывчатые
с
кислородом
гидроперекиси,
в
эфире
которые
накапливаются
могут
образовать
кристаллический осадок на дне ёмкости с эфиром.
Особенно склонен образовывать такие соединения диизопропиловый эфир.
17.
CH3 – CH – O – CH2 – CH3+
KJ
O
O
H
CH3 – CH – O – CH2 – CH3 + КОН + J2
ОК
Качественная реакция на гидроперекись
17
26.11.2018
18. Спасибо за Ваше внимание!
1826.11.2018






 Химия
Химия








