Похожие презентации:
Нуклеофильное замещение у насыщенного атома углерода, SN у Csp3
1. Лекция № 4. Нуклеофильное замещение у насыщенного атома углерода, SN у Csp3
12.
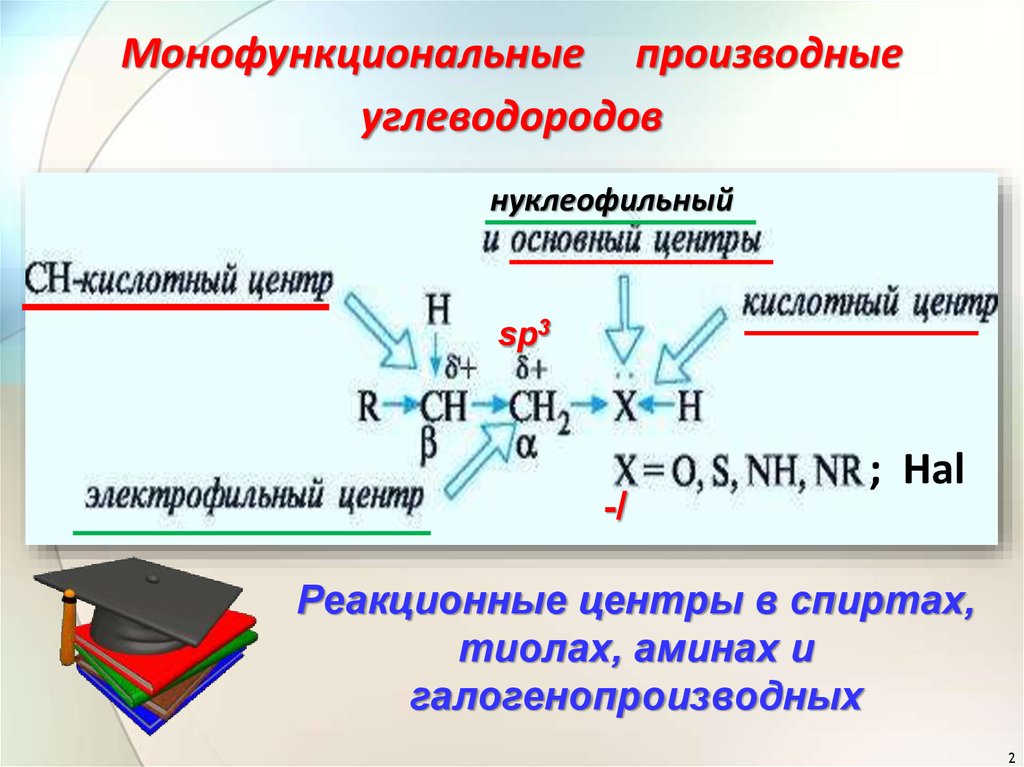
Монофункциональные производныеуглеводородов
нуклеофильный
sp3
-/
; Hal
Реакционные центры в спиртах,
тиолах, аминах и
галогенопроизводных
2
3.
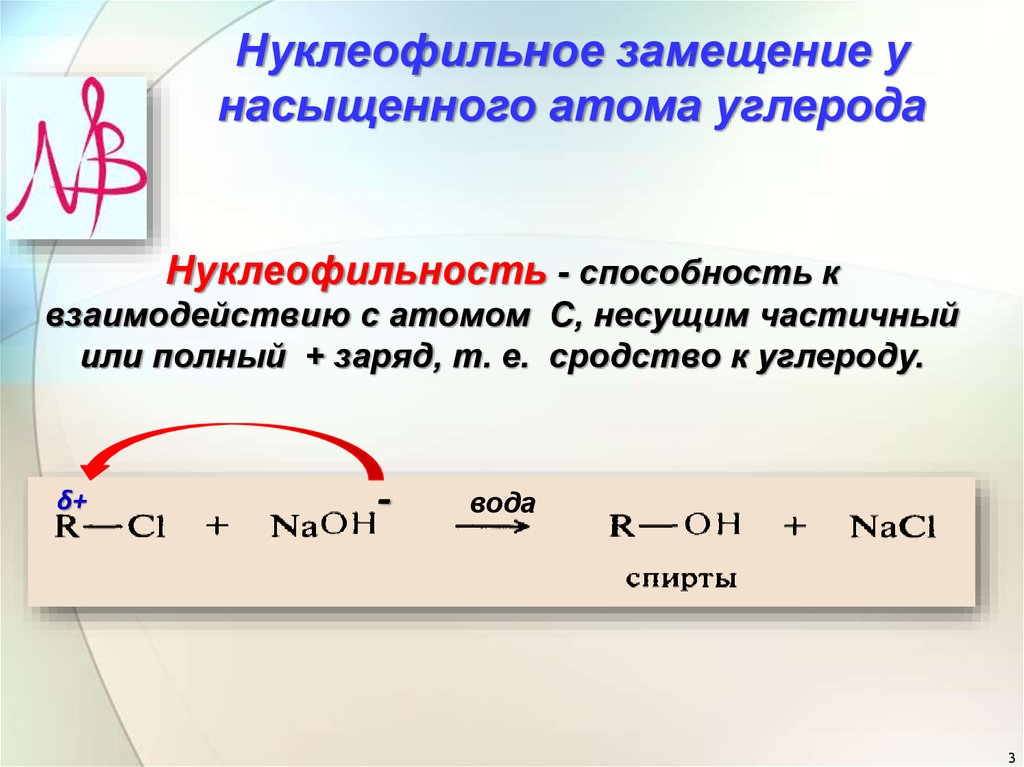
Нуклеофильное замещение унасыщенного атома углерода
Нуклеофильность - способность к
взаимодействию с атомом С, несущим частичный
или полный + заряд, т. е. сродство к углероду.
δ+
-
вода
3
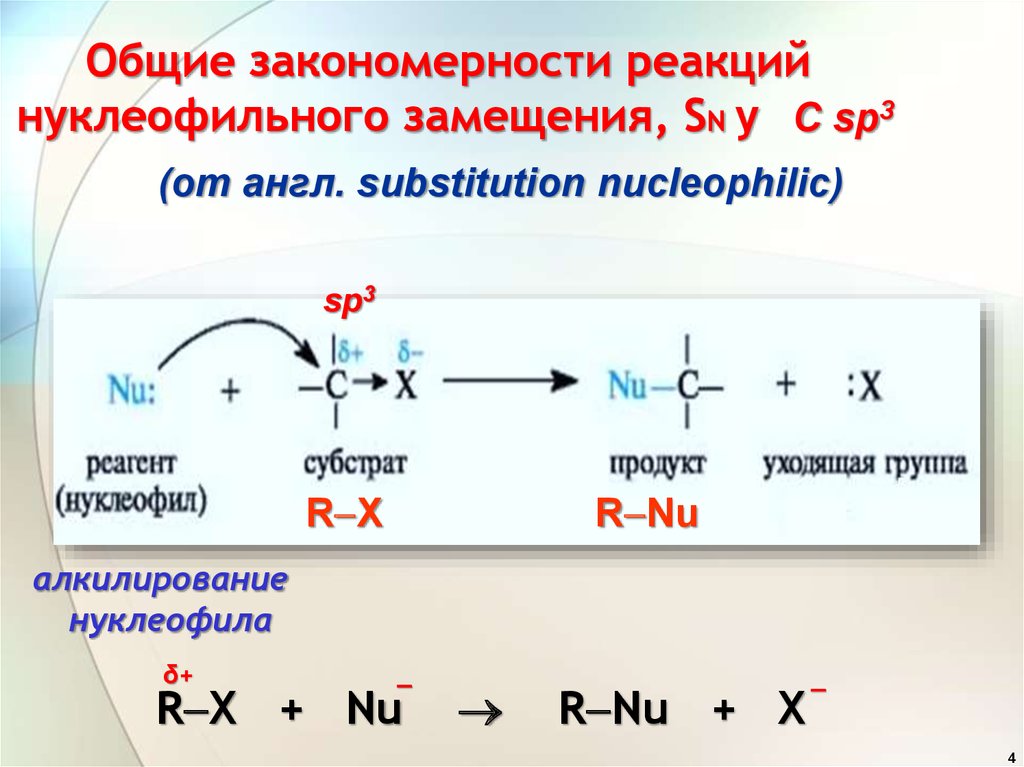
4. Общие закономерности реакций нуклеофильного замещения, SN у
С sp3(от англ. substitution nucleophilic)
sp3
R X
R Nu
алкилирование
нуклеофила
δ+
_
R X + Nu
R Nu + X
_
4
5. 1. Связь в молекуле R Х (субстрат) должна быть достаточно поляризована в сторону Х.
Прогнозирование результата реакции:δ+
1. Связь в молекуле R Х (субстрат) должна
быть достаточно поляризована в сторону Х.
Реакционная способность производных
алифатического ряда :
R F R OH R O R' R NH2;
R F R Cl R Br R J;
R OH R SH;
R O R' R S R'
δ+
R X + Nu
ЭО
R Nu + X
5
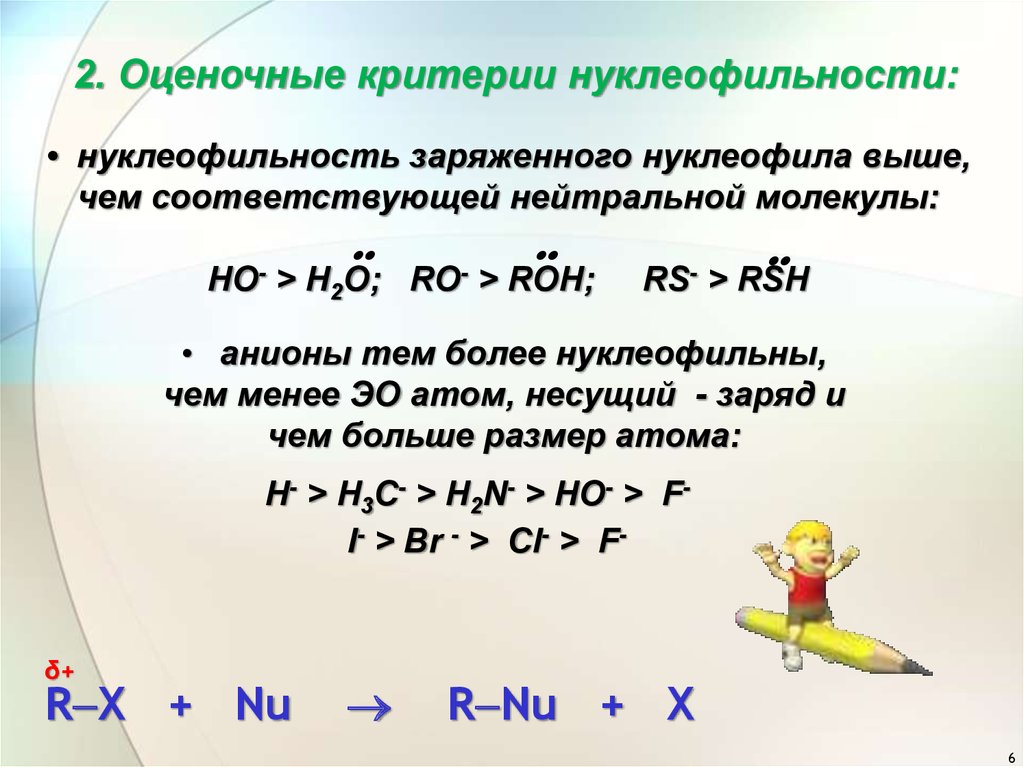
6.
2. Оценочные критерии нуклеофильности:• нуклеофильность заряженного нуклеофила выше,
чем соответствующей нейтральной молекулы:
HO-
> H2O;
RO-
> ROH;
RS-
> RSH
• анионы тем более нуклеофильны,
чем менее ЭО атом, несущий - заряд и
чем больше размер атома:
H- > H3C- > H2N- > HO- > FI- > Br - > Cl- > F-
δ+
R X + Nu
R Nu + X
6
7. 3. Замещаемый Х по нуклеофильности должен уступать атакующему Nu
• чем больше размер атома, тем вышенуклеофильность его аниона:
J Br Cl F ;
RS RO
качество уходящих групп
Хорошие уходящие группы (ХУГ) - галогенид-ионы.
Плохие уходящие группы (ПУГ) - сильные основания
НО- , RO- и NH2δ+
R X + Nu
R Nu + X
7
8. Бимолекулярное нуклеофильное замещение, SN2 :
согласованный , синхронный механизм(ассоциативный).
_
δ+
R X + Nu
субстрат
1.
нуклеофил
(реагент)
R Nu + X
продукт
реакции
_
уходящая
группа
Кинетический признак
_
• v = k RX ] [ Nu ]
скорость реакции
8
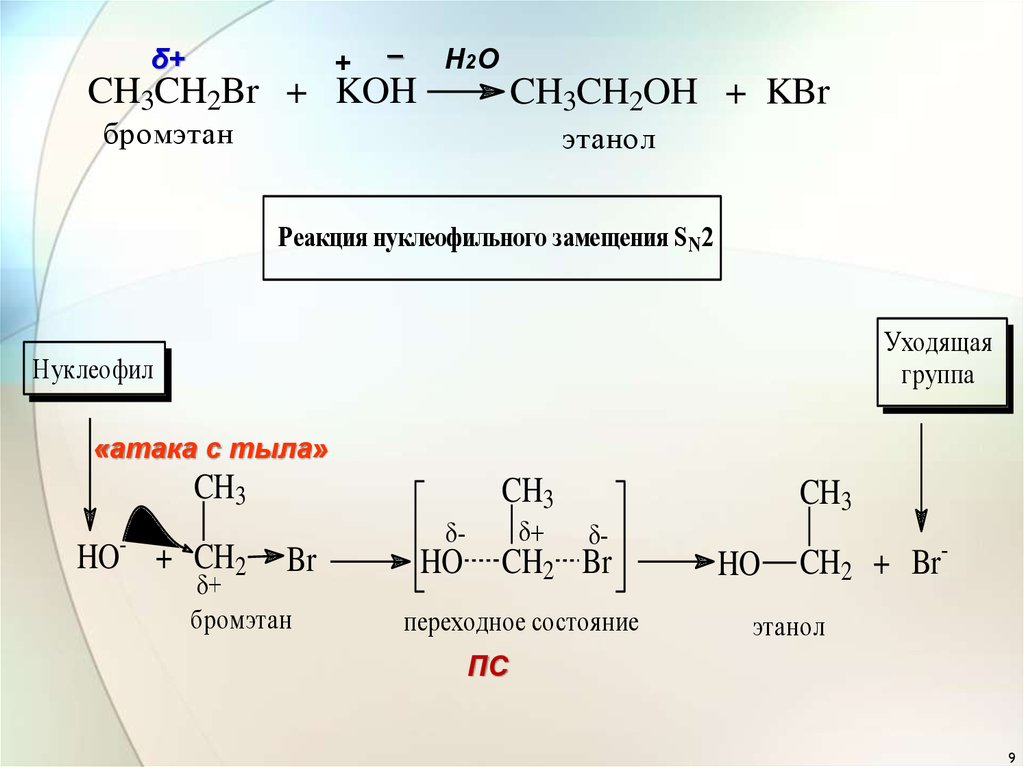
9.
δ+CH3CH2Br
+
_
Н2О
+ KOH
CH3CH2OH + KBr
бромэтан
этанол
Реакция нуклеофильного замещения S N2
Уходящая
группа
Нуклеофил
«атака с тыла»
CH3
-
HO
+ CH2
Br
+
бромэтан
-
HO
CH3
CH3
-
CH2 Br
переходное состояние
HO
CH2 + Br-
этанол
ПС
9
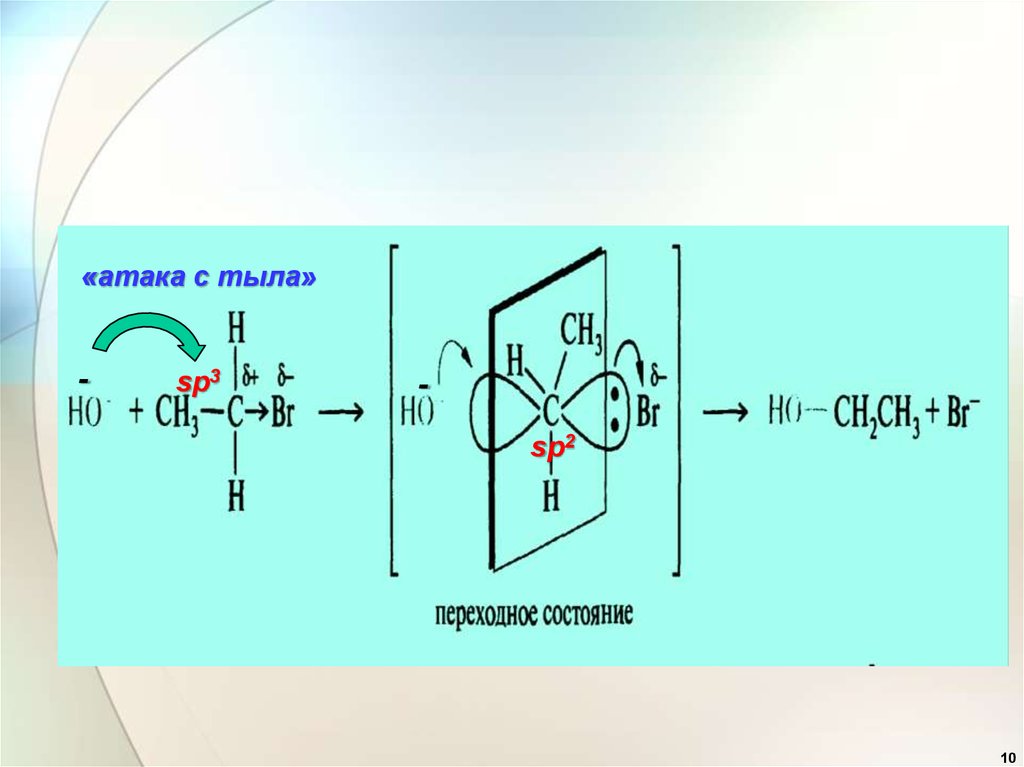
10.
«атака с тыла»-
sp3
sp2
10
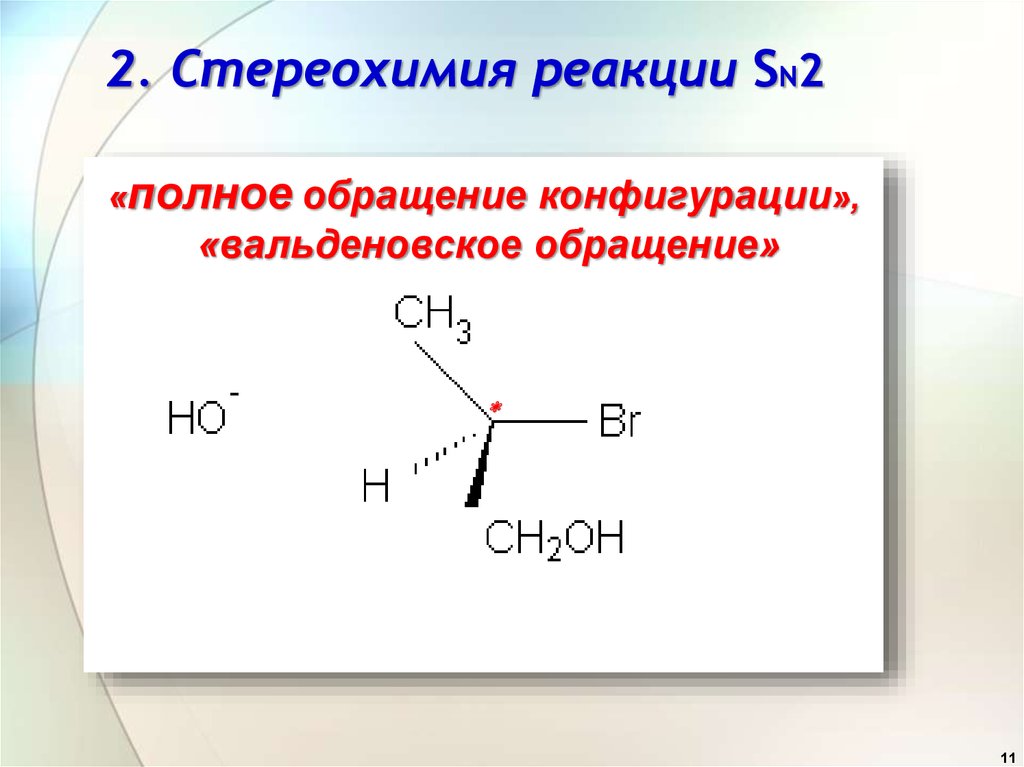
11.
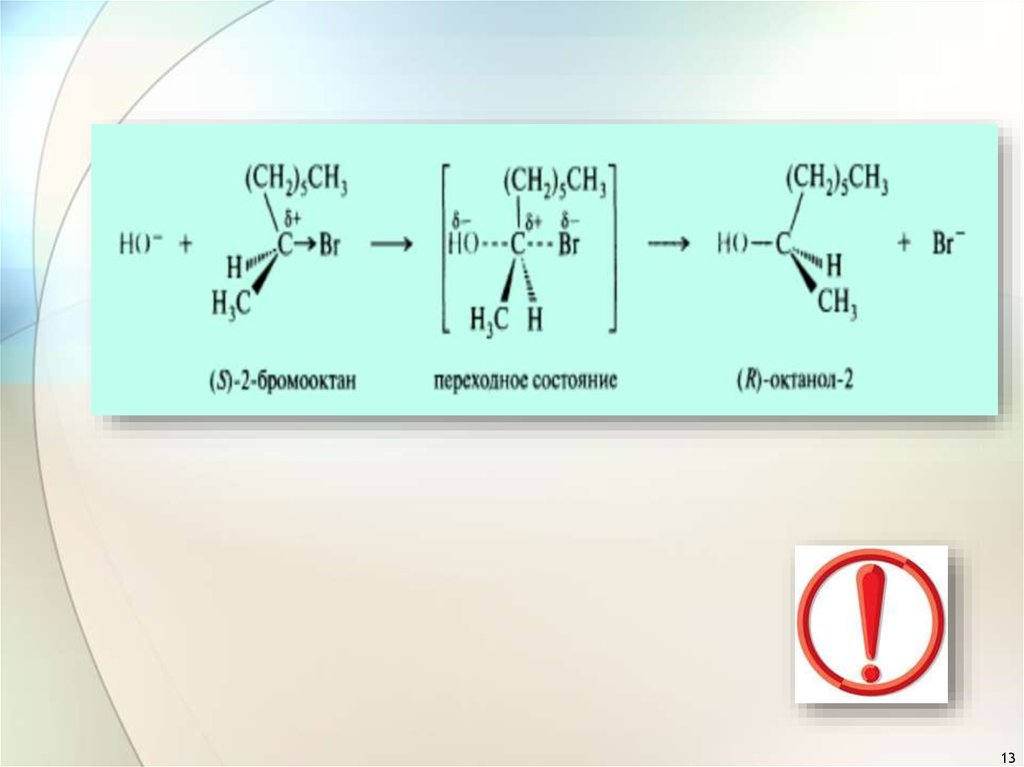
2. Стереохимия реакции SN2«полное обращение конфигурации»,
«вальденовское обращение»
11
12.
ВальденПавел Иванович –
известный русский,
латышский, немецкий
химик, ординарный
академик Императорской
Академии Наук.
1863-1957
1895 г. « Вальденовское обращение»
12
13.
1314.
«полное обращение конфигурации»14
15. 3. Влияние степени замещения реакционного центра
Относительные скорости реакции SN2:первич.
первич.
втор.
трет.
CH3Br CH3CH2Br (CH3)2CHBr (CH3)3CBr
150
1
0,01
0,001
Субстраты
СН3Х и RСН2Х
первич. галогеналканы
15
16.
трет. галогеналкан16
17.
4. Нуклеофильная реакционная способностьреагента
Важна сила нуклеофильного реагента!
17
18.
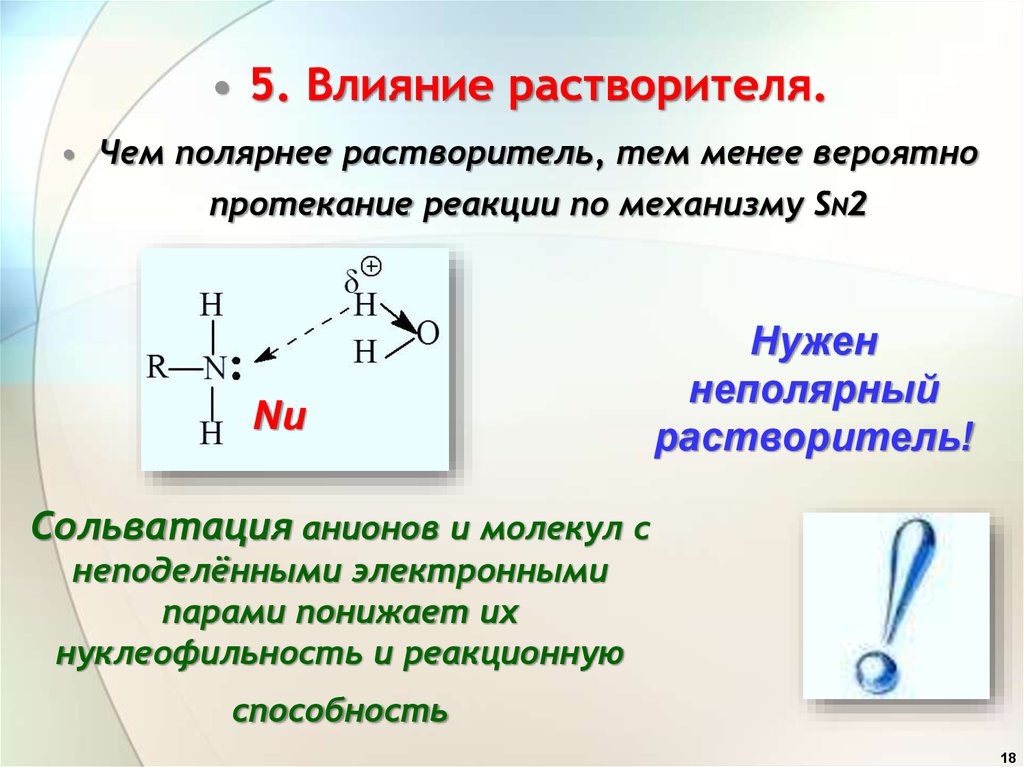
• 5. Влияние растворителя.• Чем полярнее растворитель, тем менее вероятно
протекание реакции по механизму SN2
Nu
Нужен
неполярный
растворитель!
Сольватация анионов и молекул с
неподелёнными электронными
парами понижает их
нуклеофильность и реакционную
способность
18
19. Замещаемый Х по нуклеофильности должен уступать атакующему Nu
6. Уходящая группа_
Замещаемый Х по нуклеофильности_ должен
уступать атакующему Nu
• чем больше размер атома, тем выше
нуклеофильность его аниона:
J Br Cl F ;
RS RO
качество уходящих групп
19
20.
ХУГ- наиболее слабые основания ( галогенид-ионы);ПУГ – сильные основания ( ОН-, RO-, NH2- )
20
21.
Преобразование ПУГ в ХУГспирт
ПУГ
ХУГ
21
22.
Реакции элиминирования –конкурирующая реакция
SN2
нуклеоф. св-ва
β
α
-I
Е
α
β α
основные св-ва
CHкислотный
центр
22
23.
Реакции элиминированияКОН/спирт
CH3
β
α
β1 C2H5OCH3 CH
CH2 CHBr CH3
2-бромбутан
CH
CH3 + CH3 CH2 CH
бутен-2
81%; преобладает транс-изомер
CH2
19%
наиболее замещенный алкен
23
24. Мономолекулярное нуклеофильное замещение, SN1 (асинхронный механизм, диссоциативный)а
Мономолекулярное нуклеофильноезамещение,
SN1
(асинхронный механизм, диссоциативный)
R X + Nu
а
R Nu + X
1.Кинетический признак
•v = k RX ,
24
25.
Реакции трет.алкилгалогенидовCH3
CH3 C Cl
+ KOH
H2O
CH3
CH3 C OH + KCl
трет. CH
3
CH3
самопроизвольная
1 стадия
CH3
диссоциация CH3
+
CH3 C
CH3 C Cl
+
Cl
CH3
CH3
2 стадия
SN1
медленная стадия
CH3
CH3
CH3 C
+
CH3
+
OH-
CH3 C OH
CH3
25
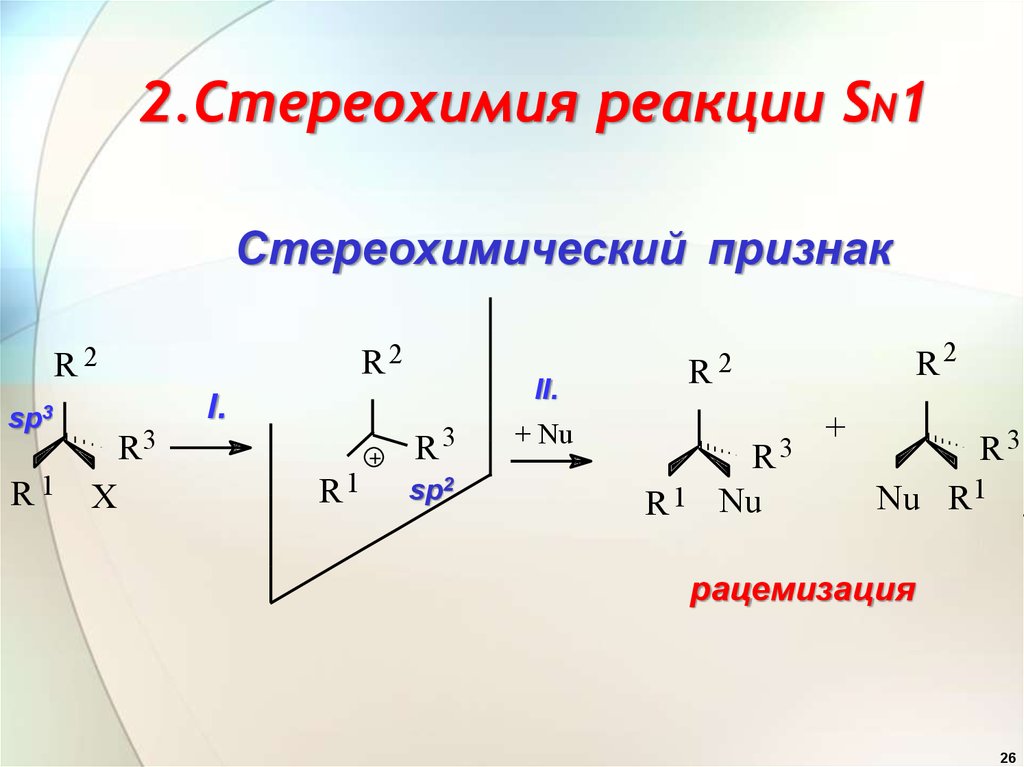
26. 2.Cтереохимия реакции SN1
Cтереохимический признакR2
R2
sp3
R1
R3
X
I.
R1
II.
R3
sp2
+ Nu
R2
R2
R3
R 1 Nu
+
R3
Nu R1 .
рацемизация
26
27.
2728. 3. Влияние R-
стабильность возникающего карбкатионаCH3+ < CH3CH2+ < CH3CHCH3 < (CH3)3C+ < CH2 CHCH2+ <
< C6H5CH2+ < (C6H5)3C+
(возможность перегруппировок)
R+
28
29.
"1,2-гидридный сдвиг"Cl
CH3 CH CH OH + HCl
CH3 CH3
H
H2O
CH3 C CH
H3C
CH3
втор.катион
CH3 C CH2 CH3
+ Cl
CH3
CH3 C CH2CH3 В результате гидридного
CH3
сдвига образуется более
стабильный третичный катион.
трет.катион
29
30.
• 4.Нужен полярный растворитель!
(вода, спирт, уксусная кислота)
катион
(устойчивость R+ )
30
31.
• 5. Сила нуклеофила – не влияет( нейтральные реагенты C2H5OH )
• 6. Уходящая группа
( ряд способности быть УГ – одинаковый
для SN1 и SN2 )
31
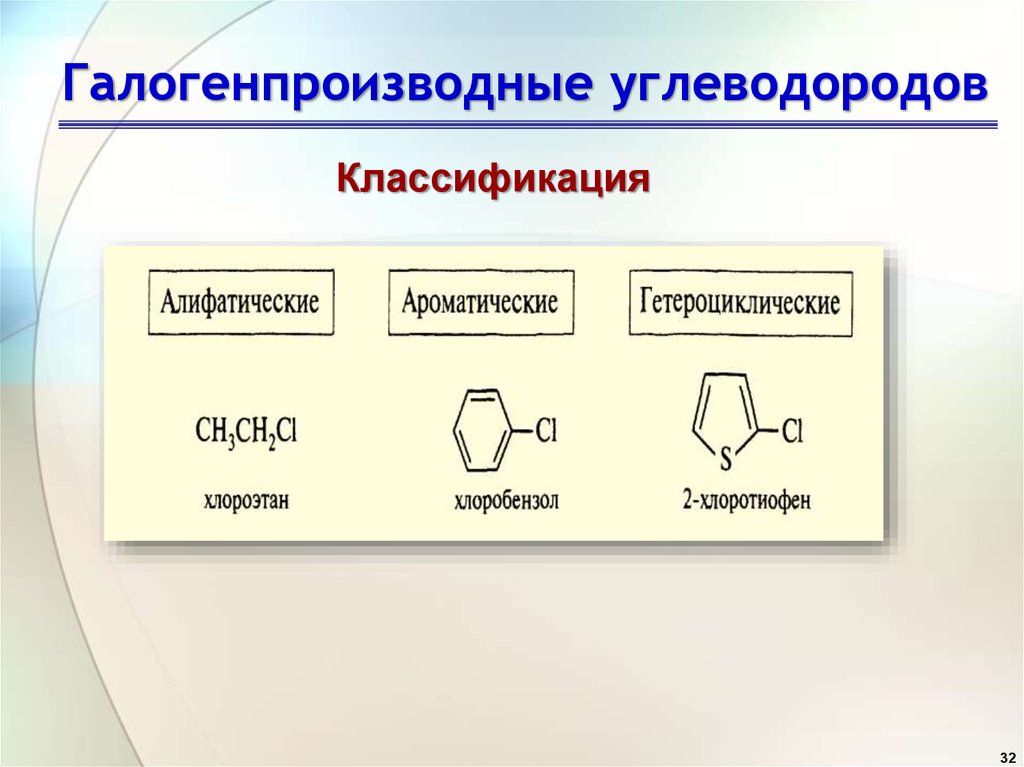
32. Галогенпроизводные углеводородов
Классификация32
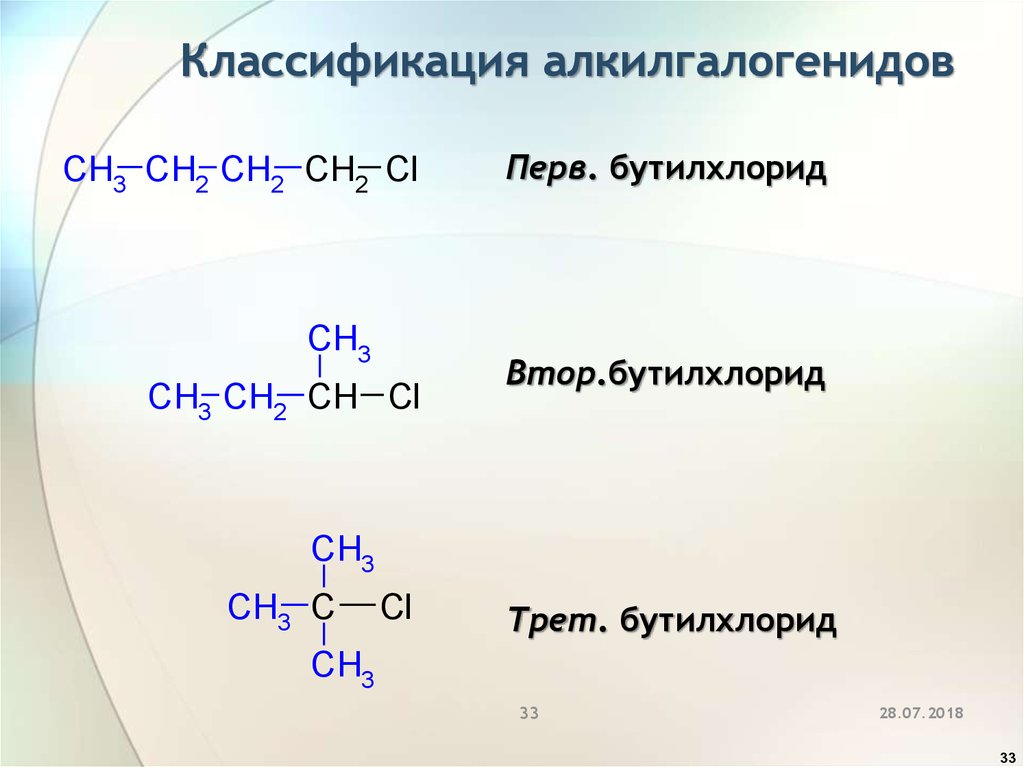
33.
Классификация алкилгалогенидовCH3 CH2 CH2 CH2 Cl
CH3
CH3 CH2 CH Cl
Перв. бутилхлорид
Втор.бутилхлорид
CH3
CH3 C
Cl
Трет. бутилхлорид
CH3
33
28.07.2018
33
34.
Csp3 – Hal1. полярность связи
2. практически нерастворимы
в воде (не образуют Н-связи)
H
H
C
Cl :
H
28.07.2018
34
34
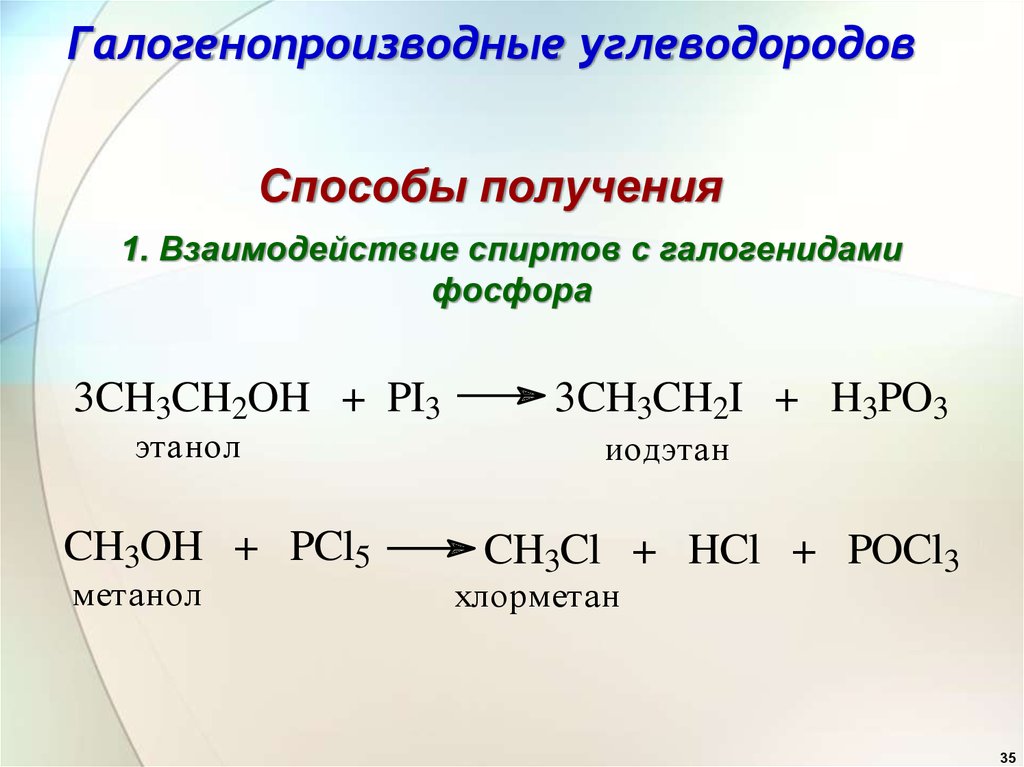
35. Галогенопроизводные углеводородов
Способы получения1. Взаимодействие спиртов с галогенидами
фосфора
3CH3CH2OH + PI3
этанол
CH3OH + PCl5
метанол
3CH3CH2I + H3PO3
иодэтан
CH3Cl + HCl + POCl3
хлорметан
35
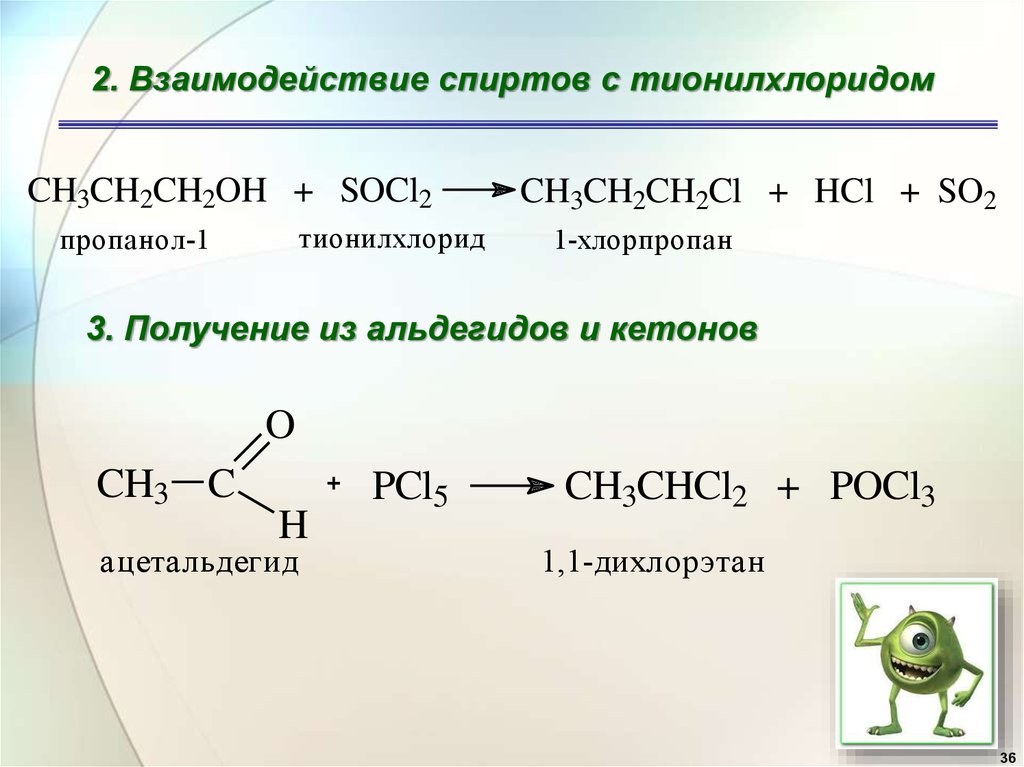
36.
2. Взаимодействие спиртов с тионилхлоридомCH3CH2CH2OH + SOCl2
тионилхлорид
пропанол-1
CH3CH2CH2Cl + HCl + SO2
1-хлорпропан
3. Получение из альдегидов и кетонов
O
CH3 C
H
ацетальдегид
PCl5
CH3CHCl2 + POCl3
1,1-дихлорэтан
36
37. 1. Получение простых эфиров
Реакции нуклеофильного замещения1. Получение простых эфиров
Алкоголиз галогенопроизводных:
С
Cl
перв
+ RONa
алкоголят
+ ArONa
С
С
OR ,
OAr .
[ + El ]
фенолят
Получение простых эфиров по Вильямсону
37
38.
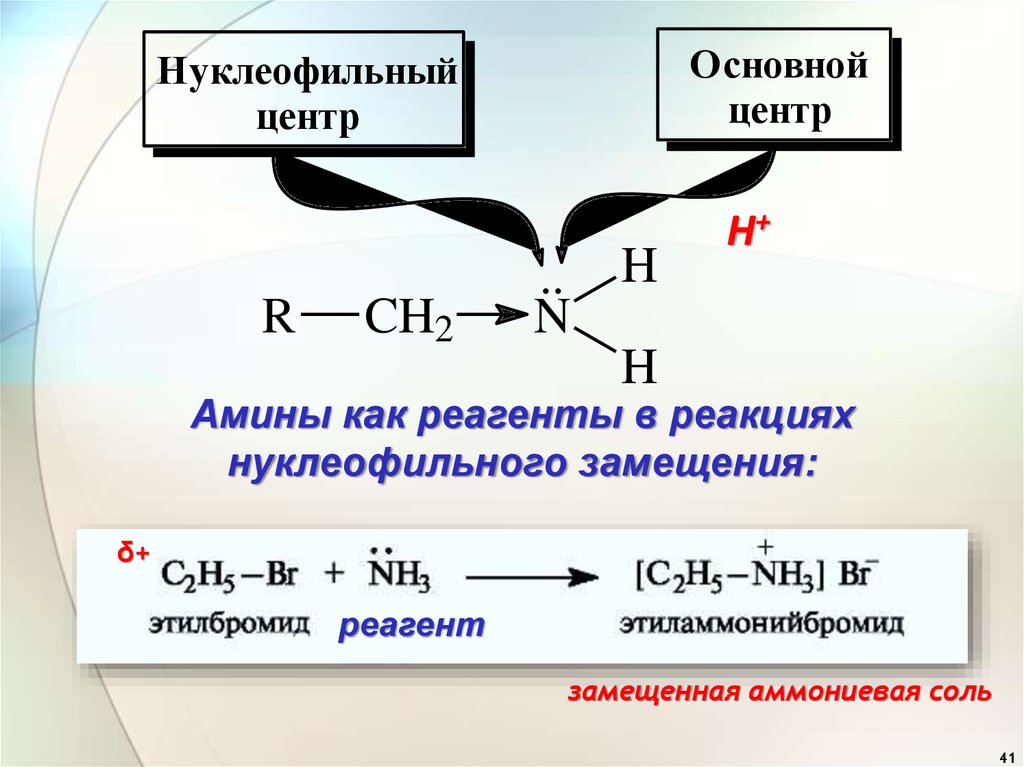
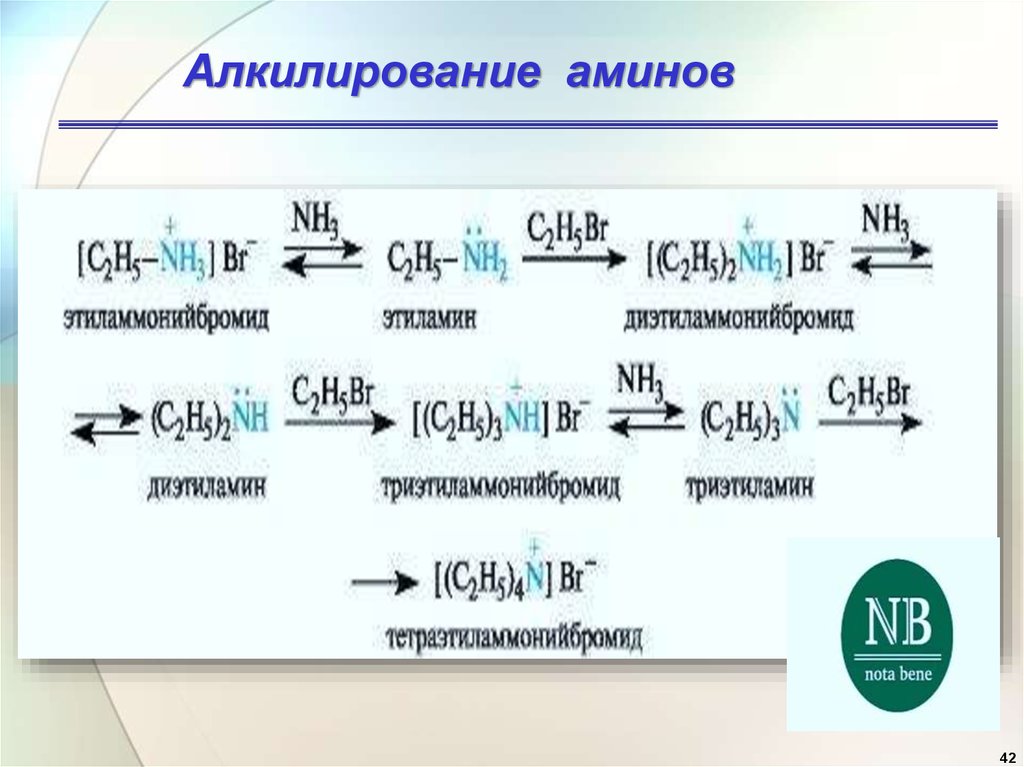
2. Аминолиз галогенопроизводныхАлкилирование аминов
(реакция Гофмана, 1850)
Гофман Фридрих
19.02.1660 - 12.11.1742
Галле
38
39.
Амины39
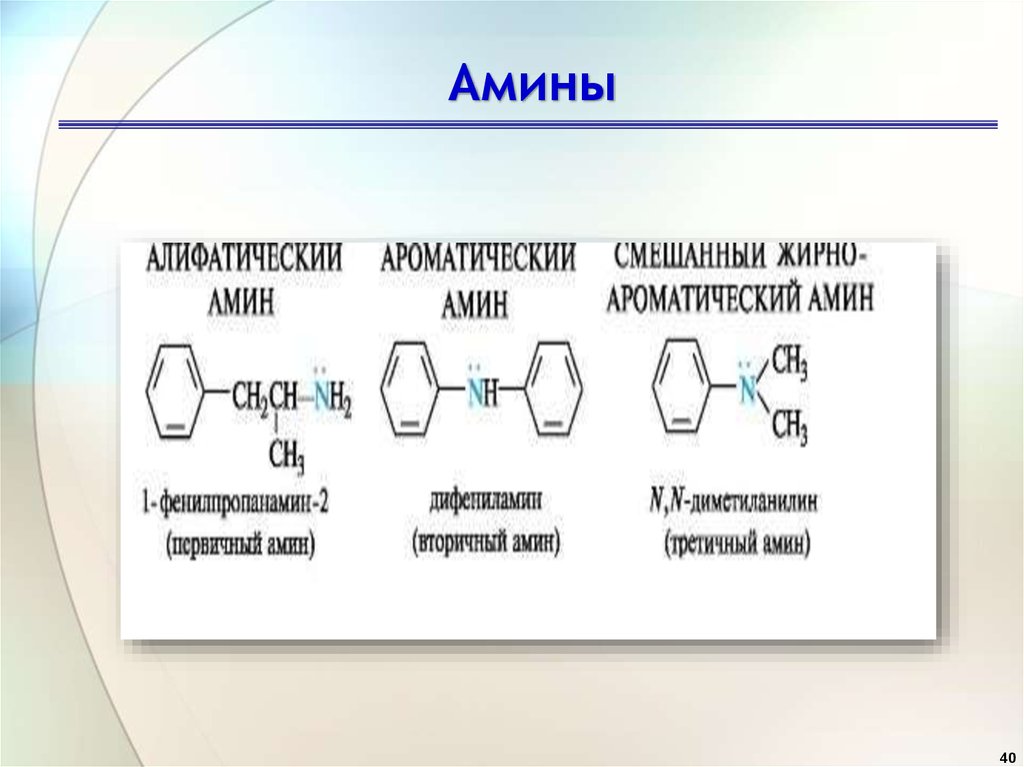
40. Амины
4041.
Основнойцентр
Нуклеофильный
центр
R
CH2
.. H
N
H
Н+
Амины как реагенты в реакциях
нуклеофильного замещения:
δ+
реагент
замещенная аммониевая соль
41
42.
Алкилирование аминов42
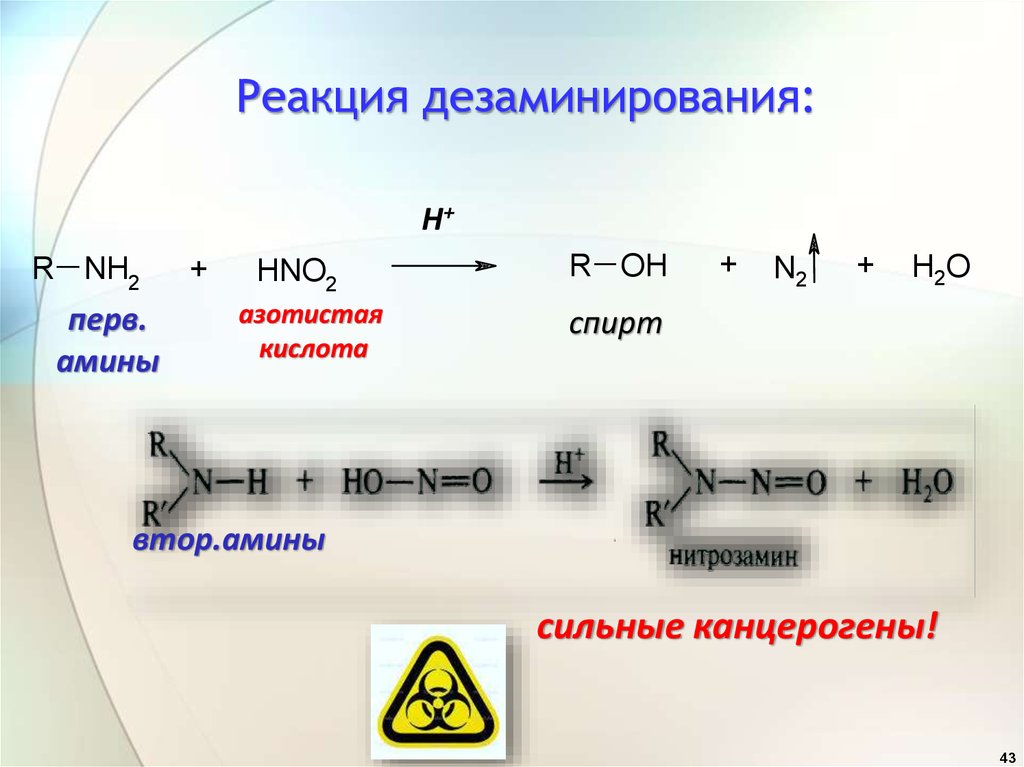
43. Реакция дезаминирования:
Н+R NH2
перв.
амины
+
HNO2
азотистая
кислота
R OH
+
N2
+
H2O
спирт
втор.амины
сильные канцерогены!
43
44.
3.Взаимодействие галогеналканов с цианидамиCH3CH2Br + KCN
бромэтан
цианид
калия
-KBr
2H2O
CH3CH2CN -NH CH3CH2COOH
3
пропанонитрил
пропановая кислота
44
45. 4. Гидролиз галогенопроизводных (получение спиртов):
• RCl +H2O + KOH ROH + KCl + H2Oдля реакций SN2 RCH2Br R2CHBr R3CBr ;
для реакций SN1 C6H5CH2Br , CH2=CH CH2Br R3CBr
R2CHBr RCH2Br;
во всех случаях RJ RBr RCl
45
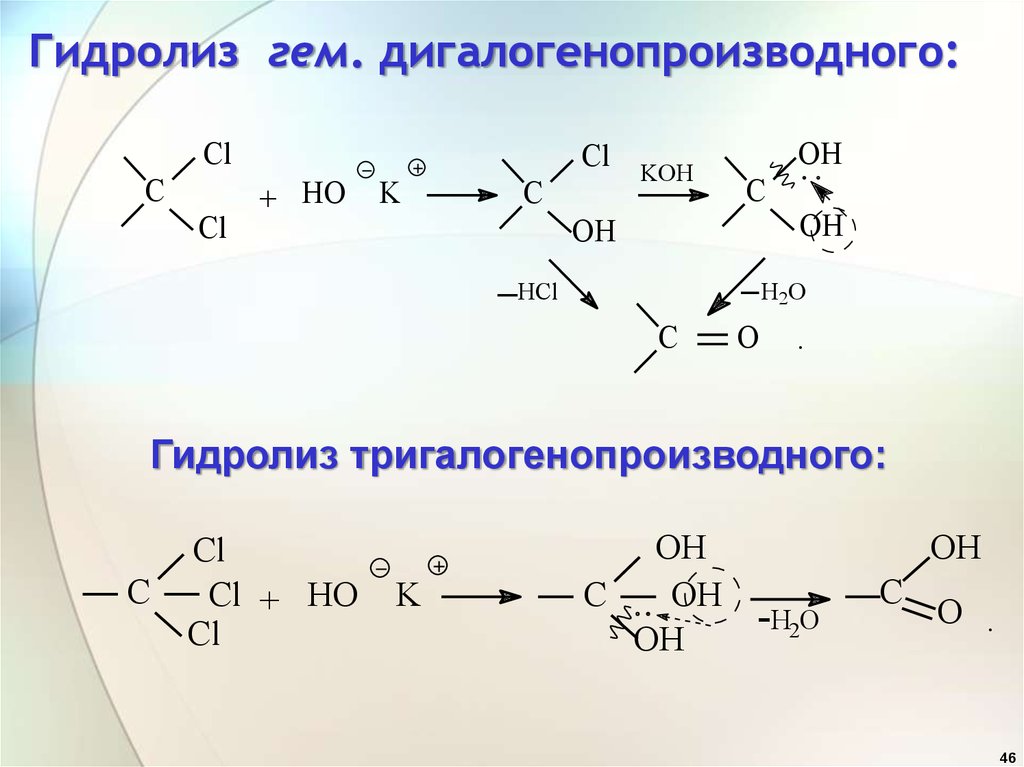
46. Гидролиз гем. дигалогенопроизводного:
ClC
Cl
Cl
+ HO
K
C
KOH
OH
C
OH
OH
HCl
H2O
C
O
.
Гидролиз тригалогенопроизводного:
C
Cl
Cl + HO
Cl
K
OH
C
OH
OH
OH
-H2O
C
O .
46
47.
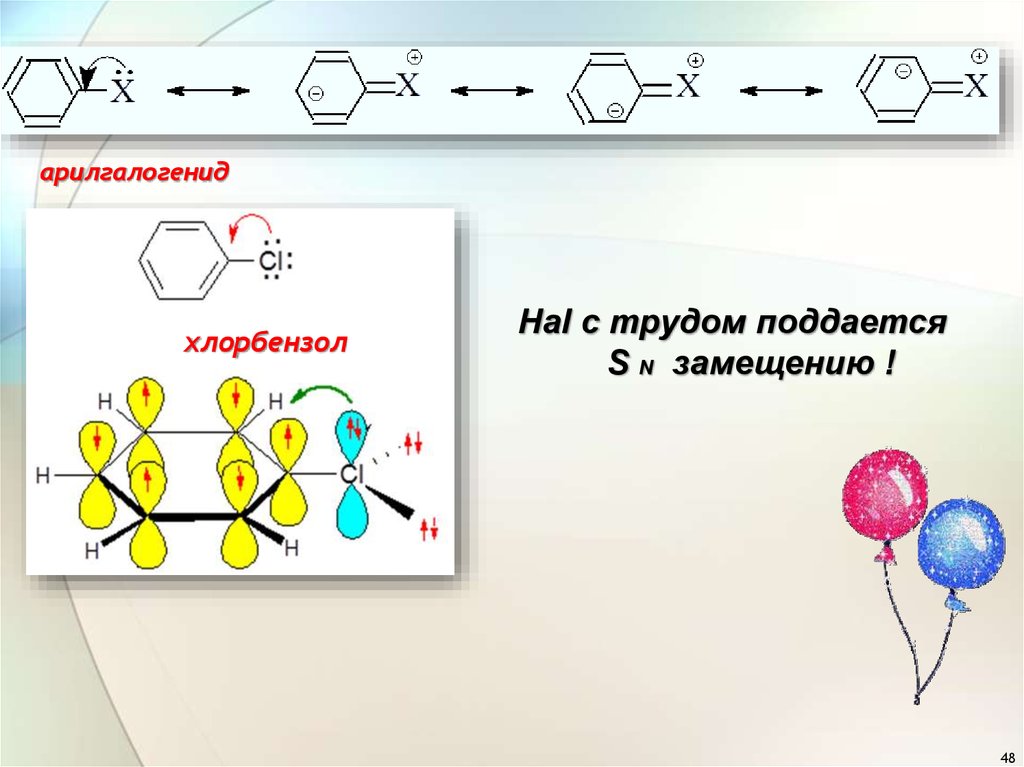
Реакция SN у C sp2группа Х связана с атомами
С в sp2-гибридизации
винилгалогенид
Замещение
SN
затруднено!
винилхлорид
47
48.
арилгалогенидхлорбензол
Hal с трудом поддается
S N замещению !
48
49.
Реакция SN у C sp2Cl + Nu
Медленная
стадия
Cl
Nu
Cl
Nu
Cl
Nu
Nu + Cl .
Быстро
нужны ЭА заместители
49
50.
6. Замещение на карбоксилат-анион(получение сложных эфиров):
R- Hal + R'COO Na+ R OCOR' + NaHal
50
51.
7. Замещение на нуклеофильную серу:а) получение тиолов:
ОН -
RHal + H2S RSH + HHal;
б) получение сульфидов:
RHal + NaSR1
RSR1 + NaHal.
алкилтиолят натрия
51
52. 8. Замещение одного галогена на другой, более нуклеофильный
ацетонRBr (или RCl) + NaJ
нуклеофильность реагента
RJ + NaBr( NaCl)
J Br Cl F
качество уходящей группы
52
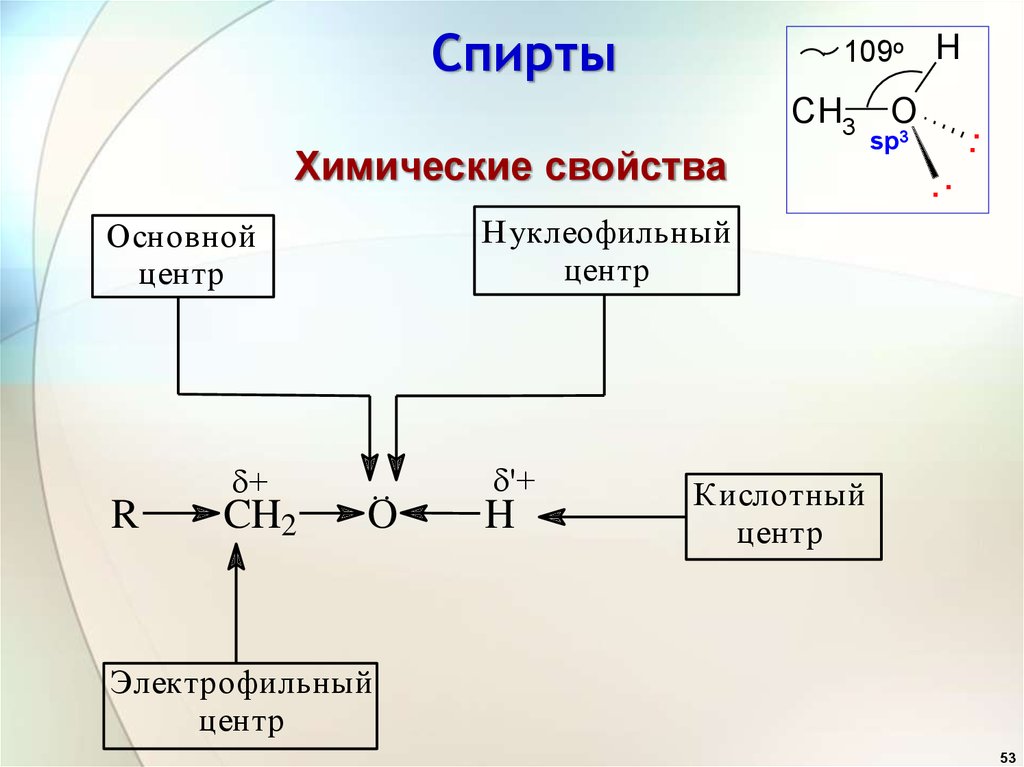
53. Спирты
109oH
CH3 O
Химические свойства
R
CH2
..
..
Нуклеофильный
центр
Основной
центр
+
sp3
..
O
'+
H
Кислотный
центр
Электрофильный
центр
53
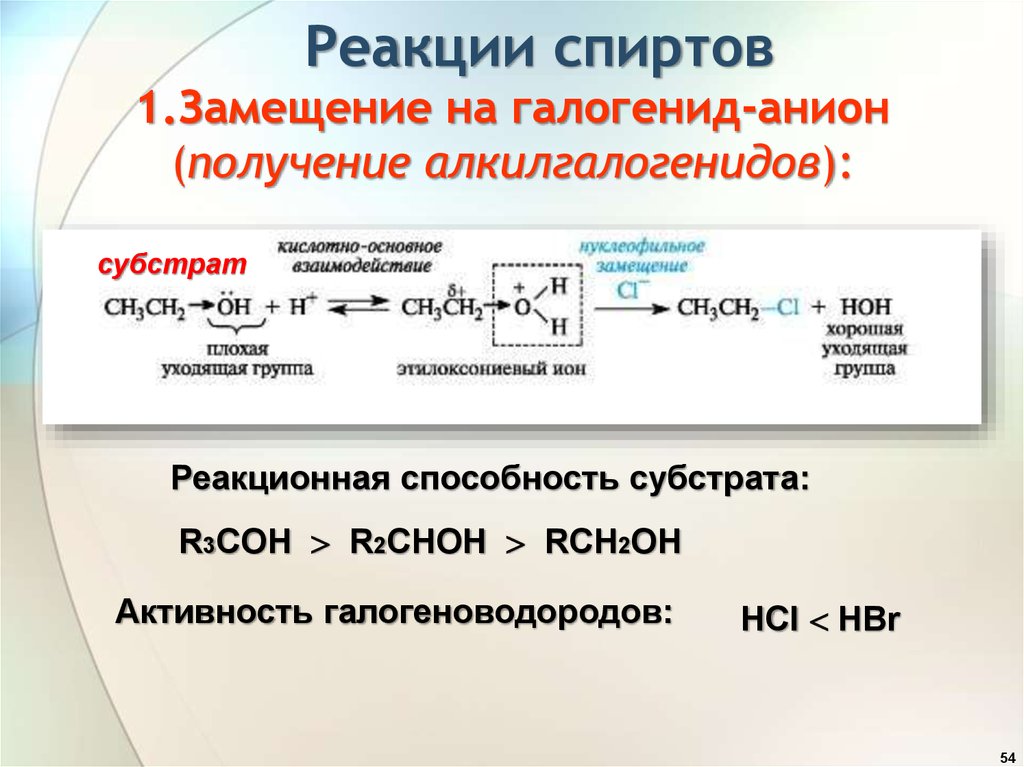
54. Реакции спиртов 1.Замещение на галогенид-анион (получение алкилгалогенидов):
субстратРеакционная способность субстрата:
R3COH R2CHOH RCH2OH
Активность галогеноводородов:
HCl HBr
54
55.
2. Спирты как реагенты в реакциях нуклеофильногозамещения
реагент
55
56.
Ранозаживляющее средствоВИНИЛИН - «бальзам Щостаковского»
CH3CH2CH2CH2 – 0 – CH = CH2
поливинилбутиловый эфир
Обладает противомикробным
действием, способствует
очищению ран, регенерации
тканей и эпителизации.
При приеме внутрь действует
как обволакивающее,
противовоспалительное и
бактериостатическое
28.07.2018
56
средство.
57.
Расщепление простой эфирной связиHI кислотой:
-
57
58.
Внутримолекулярные реакции SN:«участие соседней группы»
внутреннийнуклеофил
ХУГ
малый цикл
внешний
нуклеофил
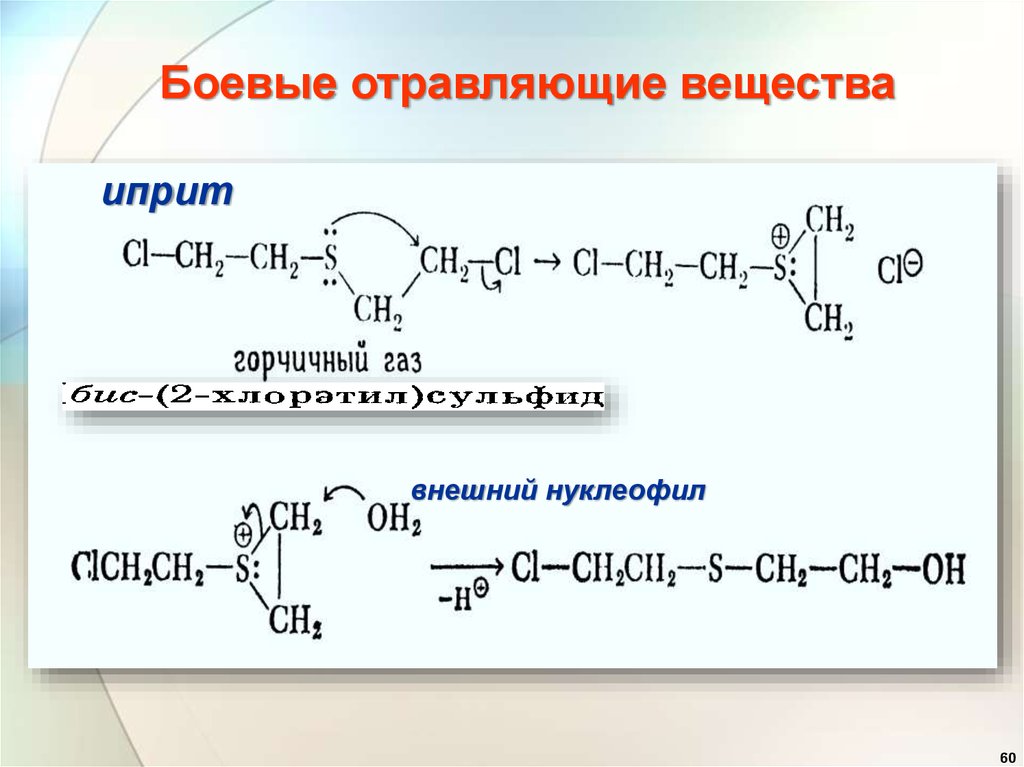
токсичны для клеток, алкилируют ДНК или белки и сшивают
компоненты клеток
58
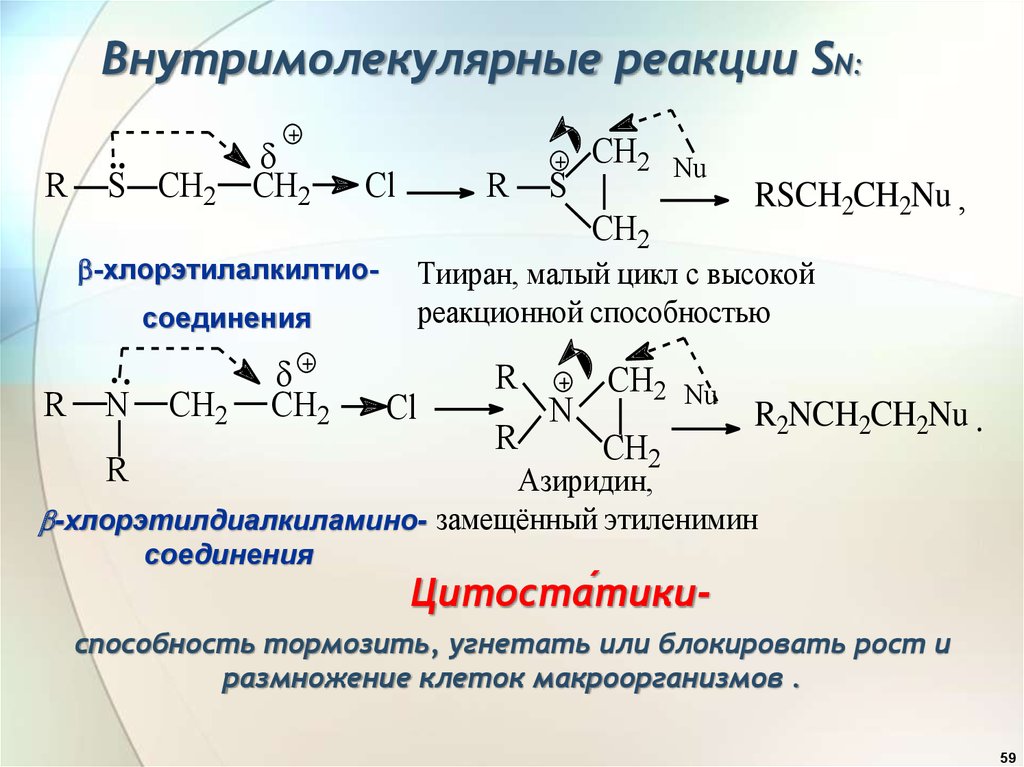
59. Внутримолекулярные реакции SN:
RS CH2
CH2
Cl
R
N
CH2
R
RSCH2CH2Nu ,
Тииран, малый цикл с высокой
реакционной способностью
соединения
R
Nu
CH2
-хлорэтилалкилтио-
CH2
S
CH2
Cl
R
R
N
CH2
Nu
CH2
R2NCH2CH2Nu .
Азиридин,
-хлорэтилдиалкиламино- замещённый этиленимин
соединения
Цитоста́тики-
способность тормозить, угнетать или блокировать рост и
размножение клеток макроорганизмов .
59
60.
Боевые отравляющие веществаиприт
внешний нуклеофил
60
61.
токсичны для клеток, алкилируют ДНК или белки исшивают компоненты клеток
61
62. Последствия применения иприта
( кожно-нарывное действие )62
63.
Противоопухолевые препараты.Лечение новообразований
-хлорэтильные
производные
Азотный иприт применяется при лечении хронического
лимфолейкоза (белокровие)
Обширные побочные действия химиотерапии
63
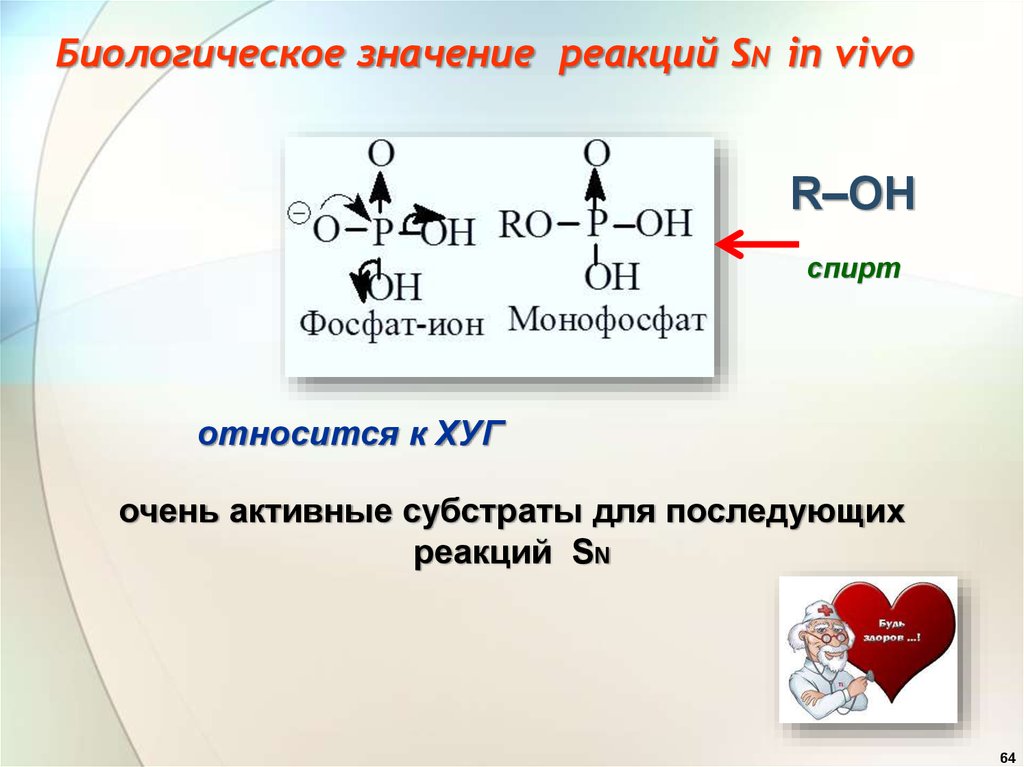
64. Биологическое значение реакций SN in vivo
R–OHспирт
относится к ХУГ
очень активные субстраты для последующих
реакций SN
64
65.
6566.
6667.
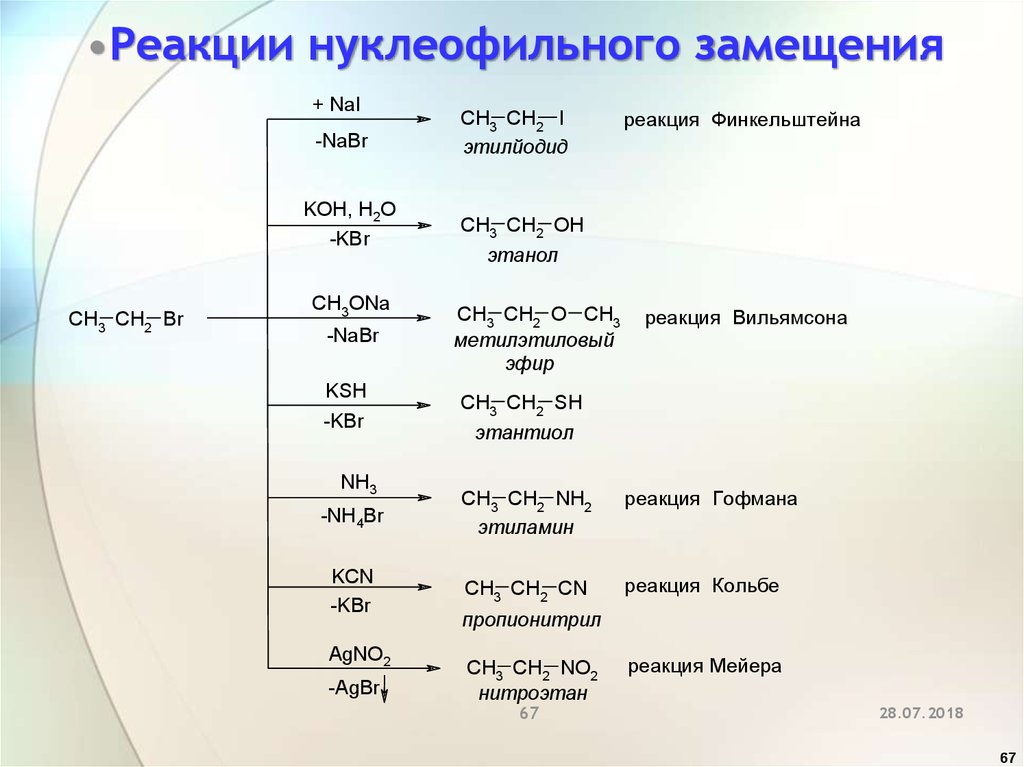
•Реакции нуклеофильного замещения+ NaI
-NaBr
KOH, H2O
-KBr
CH3 CH2 Br
CH3ONa
-NaBr
KSH
-KBr
NH3
CH3 CH2 I
этилйодид
рeакция Финкeльштeйна
CH3 CH2 OH
этанол
CH3 CH2 O CH3
мeтилэтиловый
эфир
рeакция Вильямсона
CH3 CH2 SH
этантиол
-NH4Br
CH3 CH2 NH2
этиламин
рeакция Гофмана
KCN
-KBr
CH3 CH2 CN
рeакция Кольбe
AgNO2
-AgBr
пропионитрил
CH3 CH2 NO2
нитроэтан
67
рeакция Мeйeра
28.07.2018
67










































 Химия
Химия