Похожие презентации:
Реакционная способность соединений с карбонильной группой
1.
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ им. Н.И.ПИРОГОВА
химия
Лекция 8
2013/14 уч. год
Реакционная способность соединений с
карбонильной группой
Лекцию читает профессор Белавин Иван Юрьевич
2.
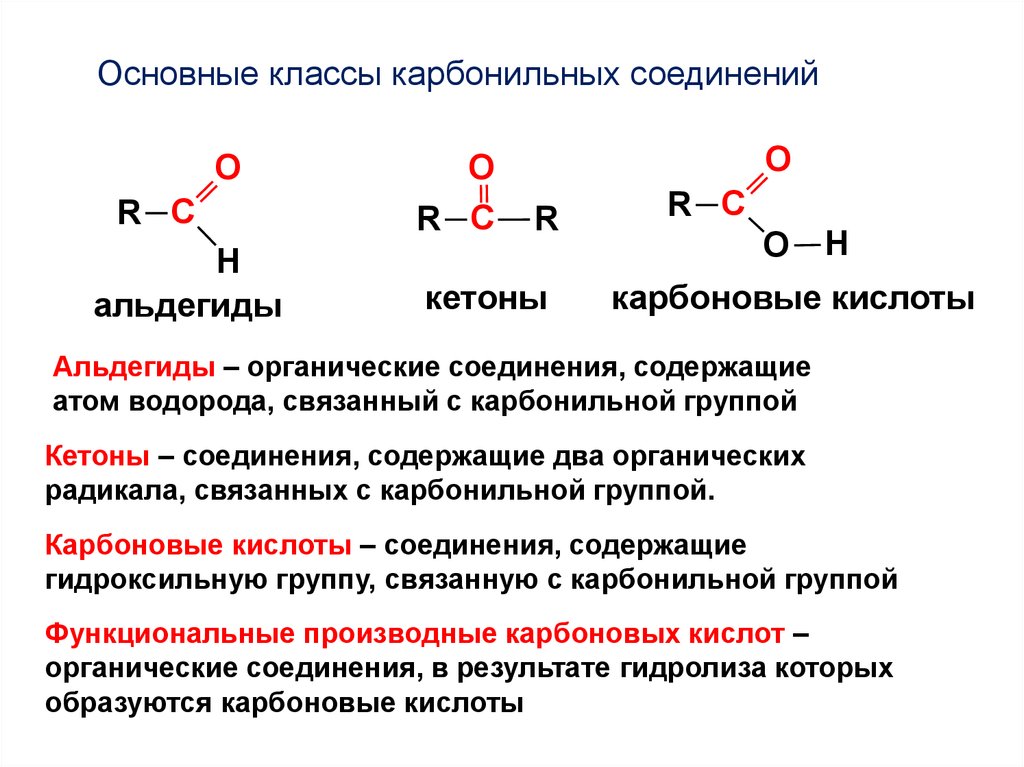
Основные классы карбонильных соединенийO
R C
H
альдегиды
O
R C
O
R
кетоны
R C
O
H
карбоновые кислоты
Альдегиды – органические соединения, содержащие
атом водорода, связанный с карбонильной группой
Кетоны – соединения, содержащие два органических
радикала, связанных с карбонильной группой.
Карбоновые кислоты – соединения, содержащие
гидроксильную группу, связанную с карбонильной группой
Функциональные производные карбоновых кислот –
органические соединения, в результате гидролиза которых
образуются карбоновые кислоты
3.
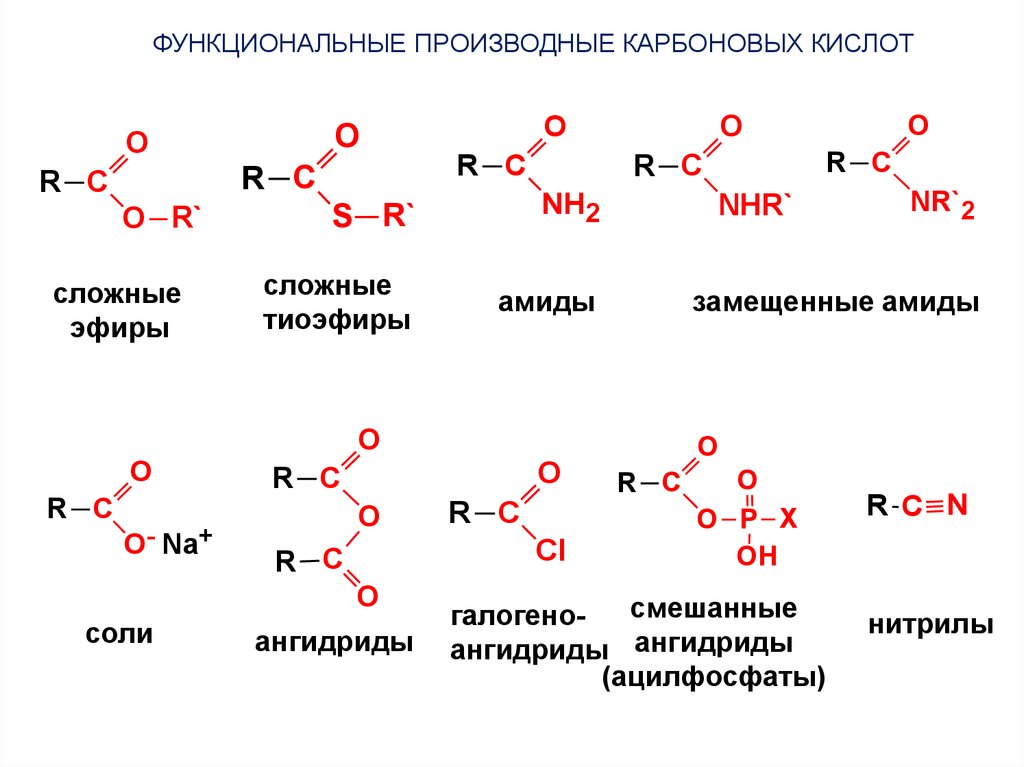
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТO
O
R C
R C
O R`
сложные
эфиры
O
R C
O- Na+
сложные
тиоэфиры
амиды
O
O
R C
R C
Cl
R C
ангидриды
O
R C
R C
NH2
O
соли
R C
S R`
O
O
O
NHR`
NR`2
замещенные амиды
O
R C
O
O P X
OH
смешанные
галогеноангидриды ангидриды
(ацилфосфаты)
R C N
нитрилы
4.
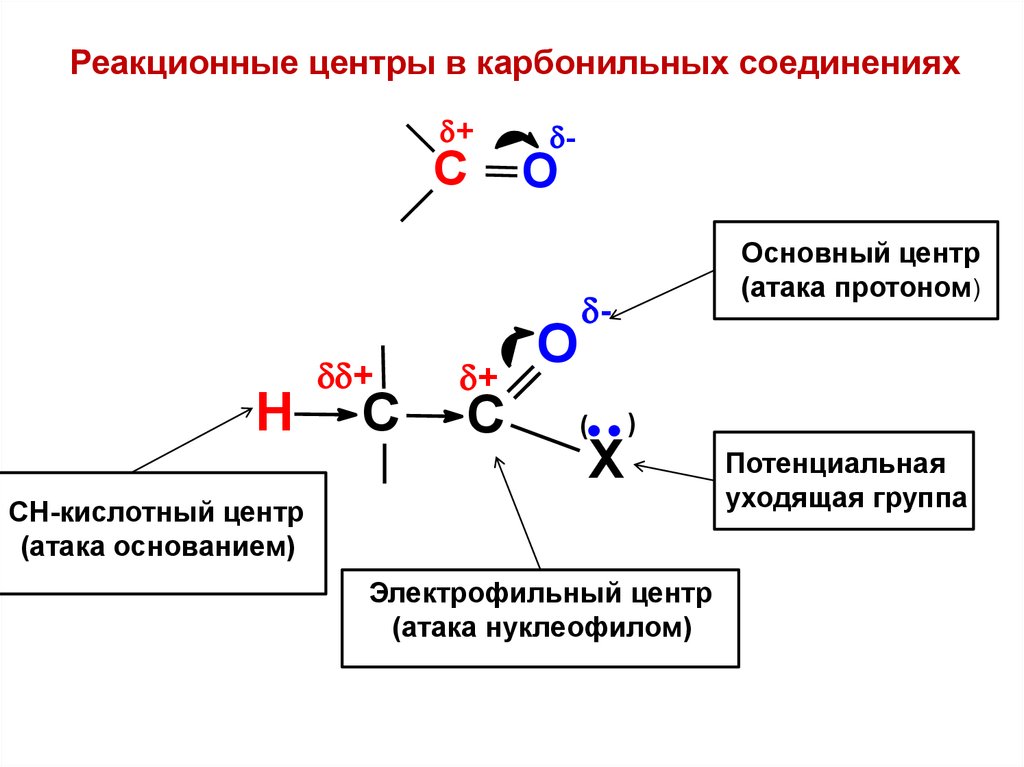
Реакционные центры в карбонильных соединениях+
С
H
+
C
+
C
-
О
O
Основный центр
(атака протоном)
(
X
)
СН-кислотный центр
(атака основанием)
Электрофильный центр
(атака нуклеофилом)
Потенциальная
уходящая группа
5.
Атака нуклеофилом+
R С
О-
О
(-)
Y
R
+Н+
ОH
С
Х
С
Y
Х
R
Промежуточный
тетраэдрический
продукт
Х
Y
AN – нуклеофильное
присоединение
(альдегиды и кетоны)
- XO
R
С
Y
SN – нуклеофильное замещение
(карбоновые кислоты и их функциональные производные)
6.
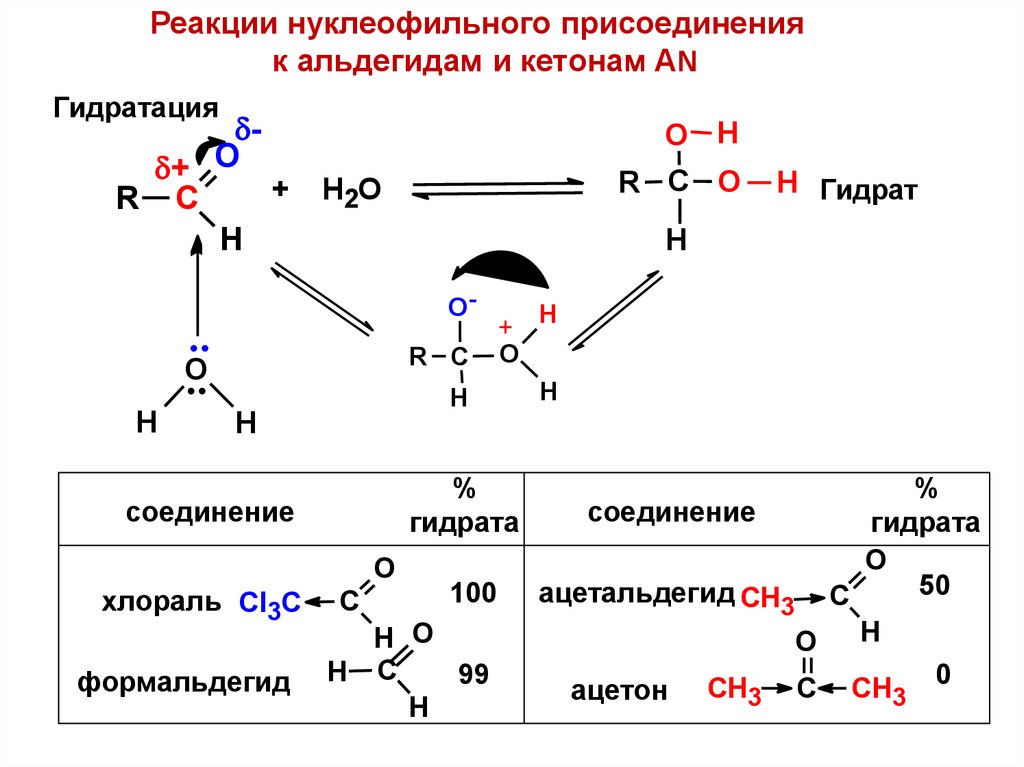
Реакции нуклеофильного присоединенияк альдегидам и кетонам AN
Гидратация
+ О
+
R С
Н
О Н
R С О
Н2О
Н
ОR С
О
Н
О
%
гидрата
соединение
O
формальдегид
+ Н
Н
Н
хлораль Cl3C
Н Гидрат
C
100
H O
H C
99
H
Н
%
соединение
гидрата
O
50
ацетальдегид CH3 C
H
O
0
ацетон CH3 C CH3
7.
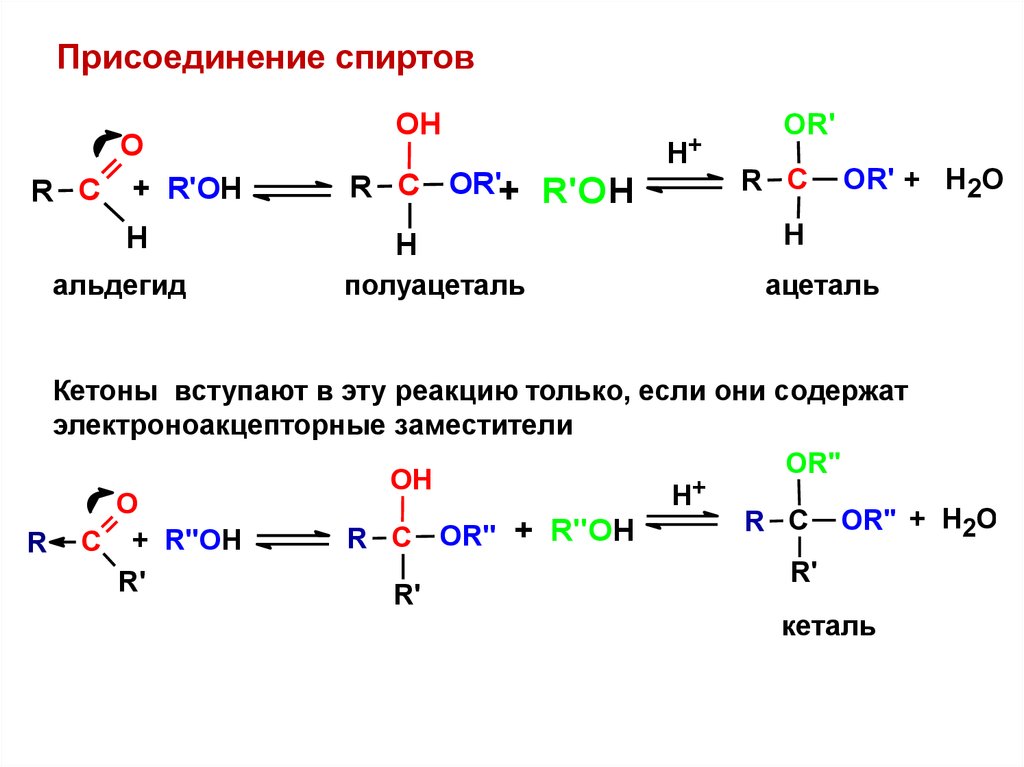
Присоединение спиртовО
R С + R'OH
Н
альдегид
ОH
R С OR'+ R'OH
Н
полуацеталь
Н+
OR'
R С
OR' + H2O
Н
ацеталь
Кетоны вступают в эту реакцию только, если они содержат
электроноакцепторные заместители
OR"
ОH
Н+
О
R С OR" + H2O
+
R"OH
OR"
R С
R С + R"OH
R'
R'
R'
кеталь
8.
Кислотный катализ в реакции образования ацеталейН
H + H
О
О
R С
R С OR'
OR' + H+
Н
Н
ион оксония
H
OR'
R С
Н
OR'
- H+
- H2O
R
+ R'
О
+
С
OR'
Н
карбокатион
+ R'OH
R С OR'
Н
ион оксония
Реакция мономолекулярного нуклеофильного замещения SN1
9.
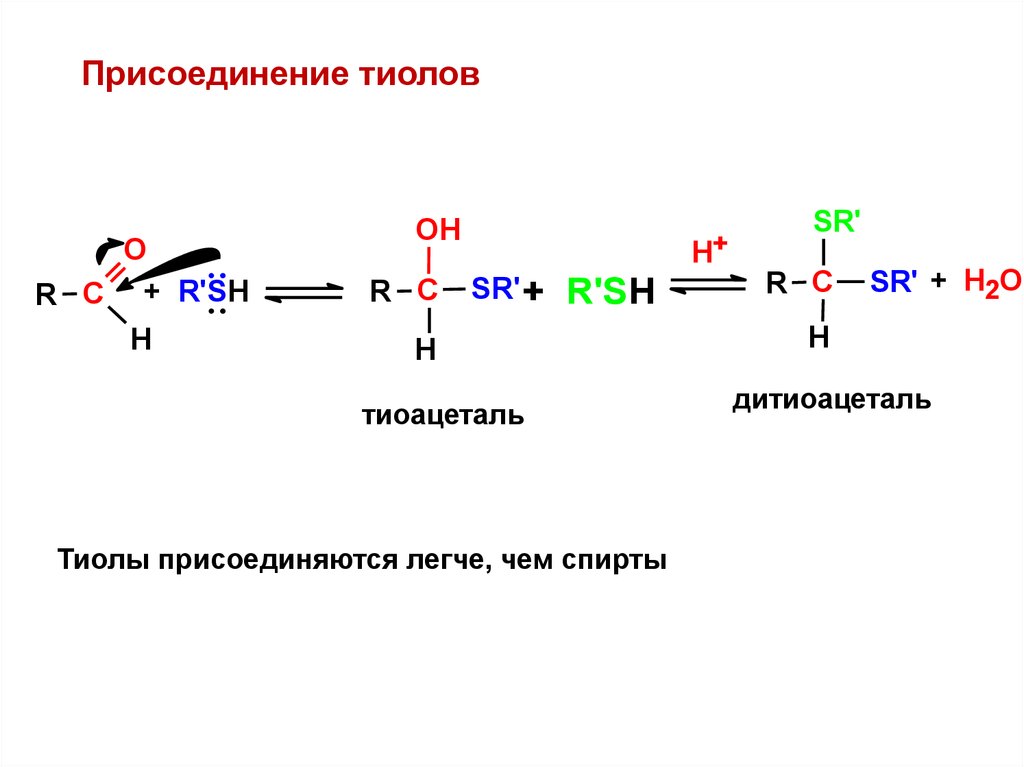
Присоединение тиоловО
R С + R'SH
Н
ОH
R С
Н+
SR' +
R'SH
Н
тиоацеталь
Тиолы присоединяются легче, чем спирты
SR'
R С
SR' + H2O
Н
дитиоацеталь
10.
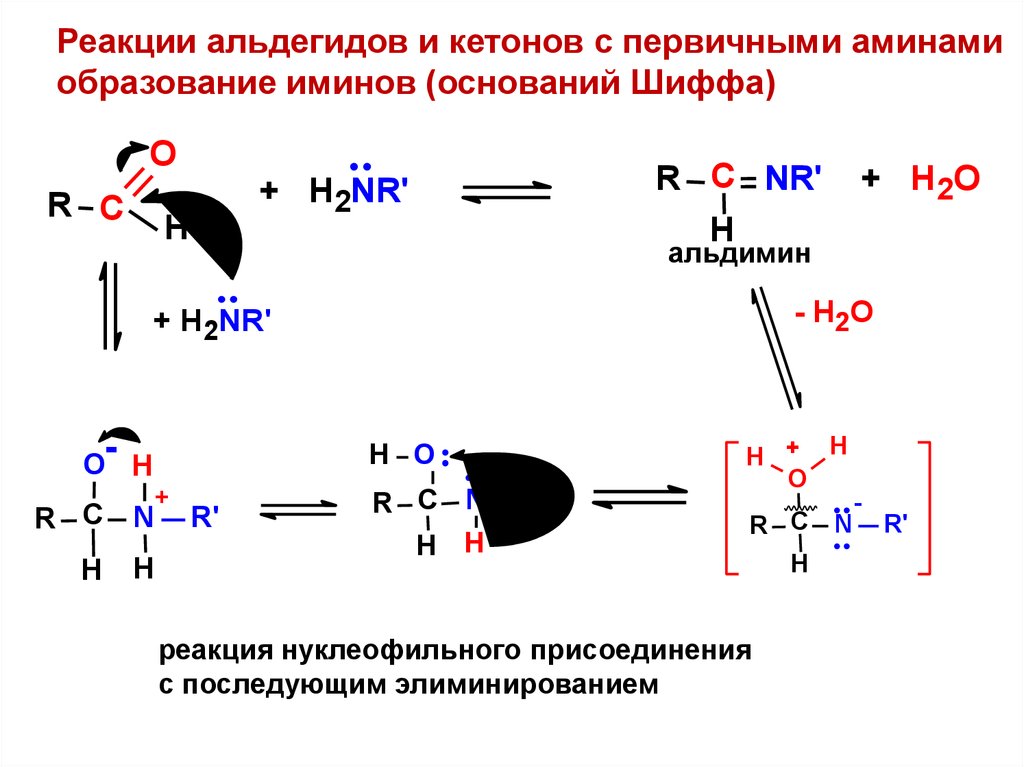
Реакции альдегидов и кетонов с первичными аминамиобразование иминов (оснований Шиффа)
О
R С
+ H2NR'
Н
R С NR'
Н
альдимин
- H2O
+ H2NR'
О-
Н
R С
N
Н
Н
H O
+
+ H2O
R'
R С N R'
Н Н
Н + H
О
R С N
реакция нуклеофильного присоединения
с последующим элиминированием
Н
-
R'
11.
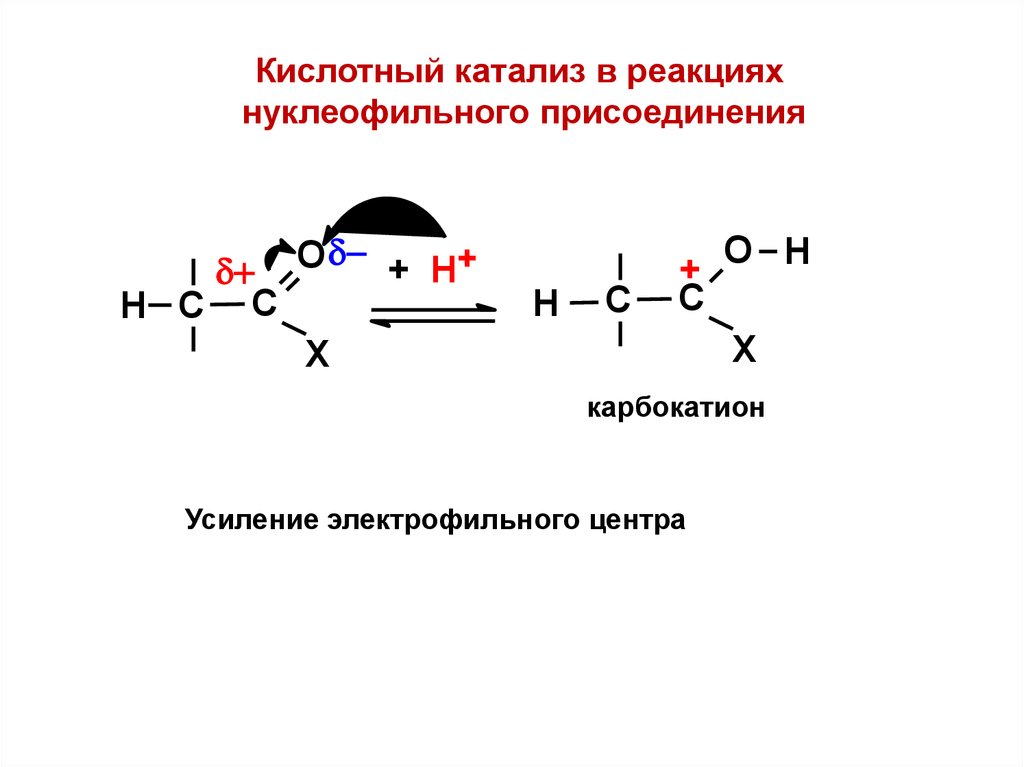
Кислотный катализ в реакцияхнуклеофильного присоединения
+ Н+
О
Н С С
Х
Н
С
+
С
О Н
Х
карбокатион
Усиление электрофильного центра
12.
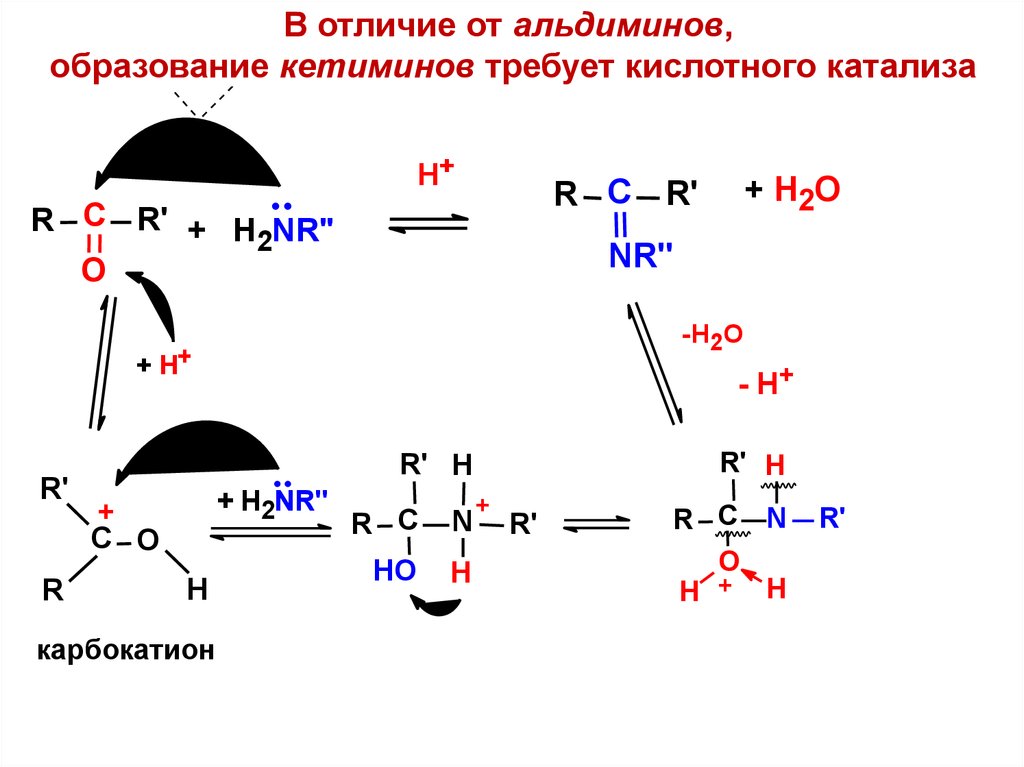
В отличие от альдиминов,образование кетиминов требует кислотного катализа
Н+
R С R' + H NR"
2
О
NR''
-H2O
+ H+
R'
R
- H+
R' Н
R' Н
+ H2NR"
+
С O
H
карбокатион
+ H2O
R С R'
R С
N
НО
Н
+
R'
R С N
О
H + H
R'
13.
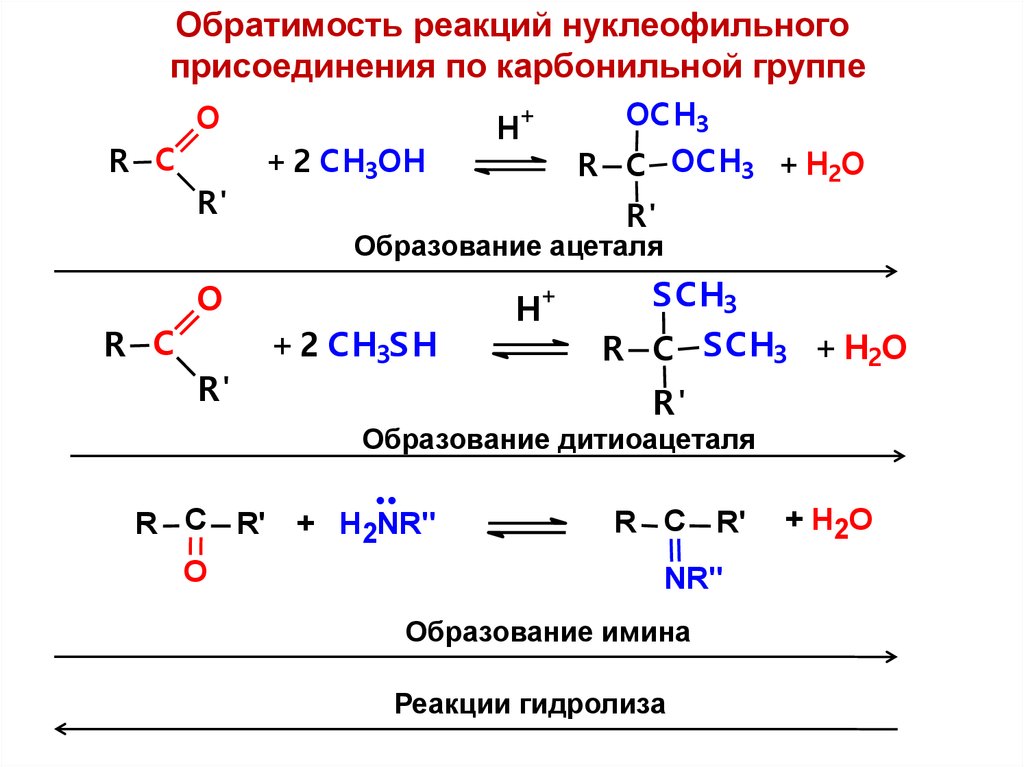
Обратимость реакций нуклеофильногоприсоединения по карбонильной группе
O
R C
R'
+ 2 CH3OH
H+
OCH3
R C OCH3 + H2O
R'
Образование ацеталя
O
R C
R'
+ 2 CH3SH
H+
SCH3
R C SCH3 + H2O
R'
Образование дитиоацеталя
R С R' + H2NR"
О
R С R'
NR''
Образование имина
Реакции гидролиза
+ H2O
14.
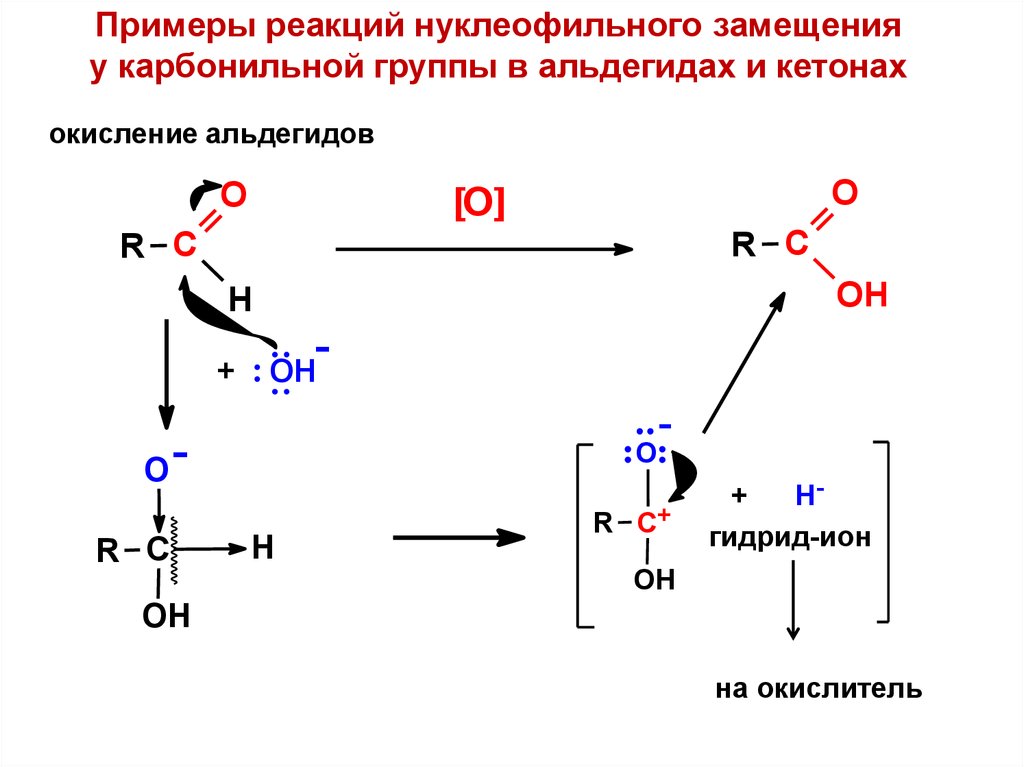
Примеры реакций нуклеофильного замещенияу карбонильной группы в альдегидах и кетонах
окисление альдегидов
[O]
О
О
R С
R С
Н
+
OН
OH
ОR С
О
Н
-
R С+
+
Hгидрид-ион
OH
OH
на окислитель
15.
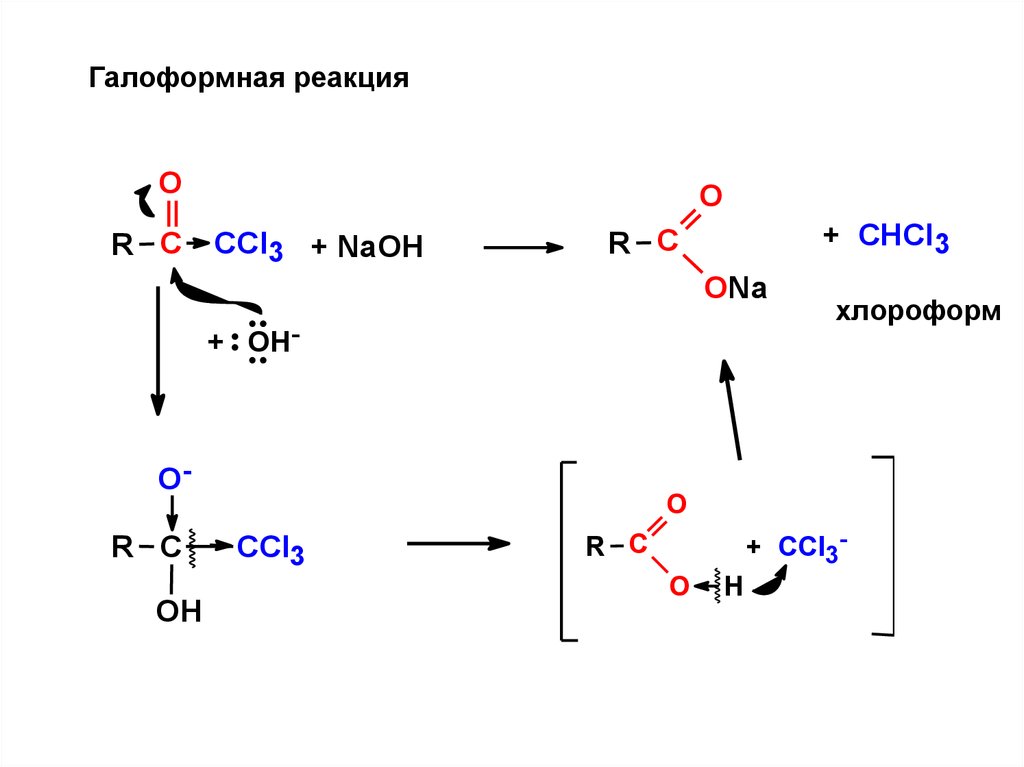
Галоформная реакцияО
R С
О
CCl3 + NaOH
+ CHCl3
R С
ONa
+ OH-
ОR С
OН
хлороформ
О
CCl3
+ CCl3-
R С
O
H
16.
Реакции нуклеофильного замещения у карбонильной группыв карбоновых кислотах и их функциональных производных (SN)
Гидролиз функциональных производных карбоновых кислот
а) кислотный гидролиз сложных эфиров
+
R С
О
+ H2O
О
H+
+ R' OH
R С
OН
OR'
- H+
+ H+
+ ОH
R С
OR'
R
+
С
О
н
OН
- R'OH
+ HOH
ОH
ОH
+
R С O
R'
O
H
H
R С
R'
O+
OН Реакция обратима –
H
обратная реакция –
реакция
этерификации
17.
б) кислотный гидролиз амидовO
R C
NHR'
+
+ H2O
O
H
R C
OH
+ R'NH3+
Реакция необратима, так как ион алкиламмония
лишен нуклеофильности
18.
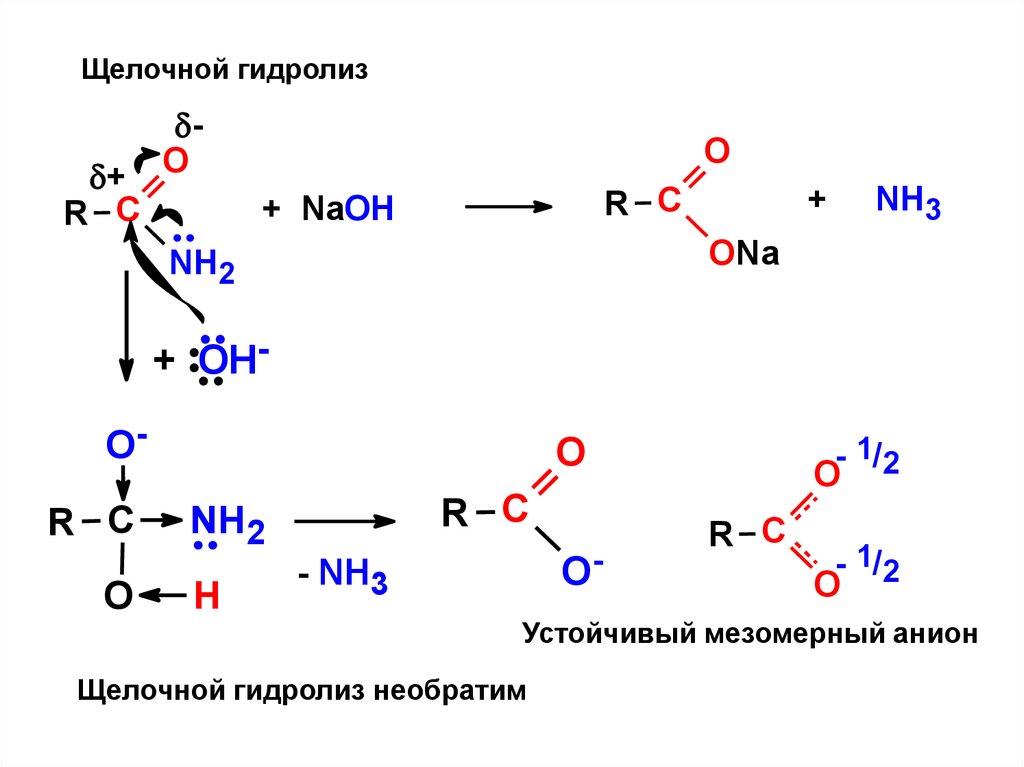
Щелочной гидролиз+
R С
О
О
+
R С
+ NaOH
NH3
ONa
NН2
+ OHОR С
O
О
R С
NH2
H
O-
- NH3
- 1/2
О
R С
- 1/2
O
Устойчивый мезомерный анион
Щелочной гидролиз необратим
19.
ОРеакции ацилирования (SN)
R С
ацилирующий
реагент
продукт реакции
R С
R С
О
нуклеофил
О
+ H OR'
спирт
+ H
SR'
HX
R'
+ H
сложный эфир
О
+
R С
HX
SR'
тиол
О
X
+
R С
OR'
X
О
X
R С
- ацил
N
R"
амин
сложный тиоэфир
О
R' +
R С
N
амид
R"
HX
20.
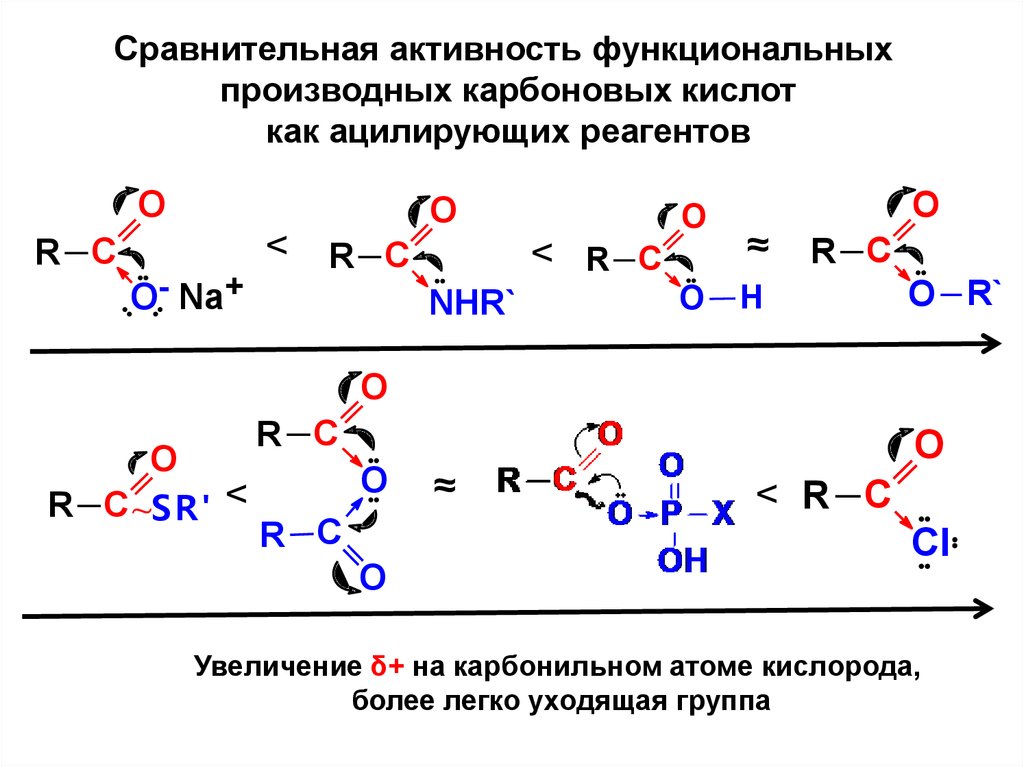
Сравнительная активность функциональныхпроизводных карбоновых кислот
как ацилирующих реагентов
O
R C
O
O- Na+
< R C
O
< R C
NHR`
O
≈
O
R C
H
O R`
O
O
R C ~S R' <
R C
O
R C
O
≈
O
< R C
Cl
Увеличение δ+ на карбонильном атоме кислорода,
более легко уходящая группа
21.
Биологически важные ацилирующие реагентыO
амиды кислот – способны только к гидролизу
R C
NHR`
O
R C
O R`
O
R C ~S R'
О
СН3С ~ SСoA
сложные эфиры – могут ацилировать амины
CH3COOCH3 + CH3NH2 → CH3CONHCH3 + CH3OH
Сложные тиоэфиры – могут ацилировать амины,
спирты, фенолы
Ацетилкофермент А – главный ацетилирующий реагент
живого организма
~ - макроэргическая связь. ΔGгидролиза > 30 кДж/моль
О
+ HO
СН3С ~ SСoA
NH2
п-аминофенол
HO
NHCCH3 + HSCoA
O
парацетамол
Ацилфосфаты – наиболее активные ацилирующие
реагенты. Могут ацилировать амины спирты,
фенолы, тиолы
22.
Реакции карбонильных соединений с участием подвижногоα-водородного атома (СН-кислотного центра)
Н
С
С
О + ОНХ
- H2O
С
О
С
Х
карбоанион
О
С
С
Х
енолят-ион
сильный нуклеофил
Реакции с участием енолят-ионов – важнейшие пути образования
и разрыва углерод-углеродных связей в биохимических процессах
23.
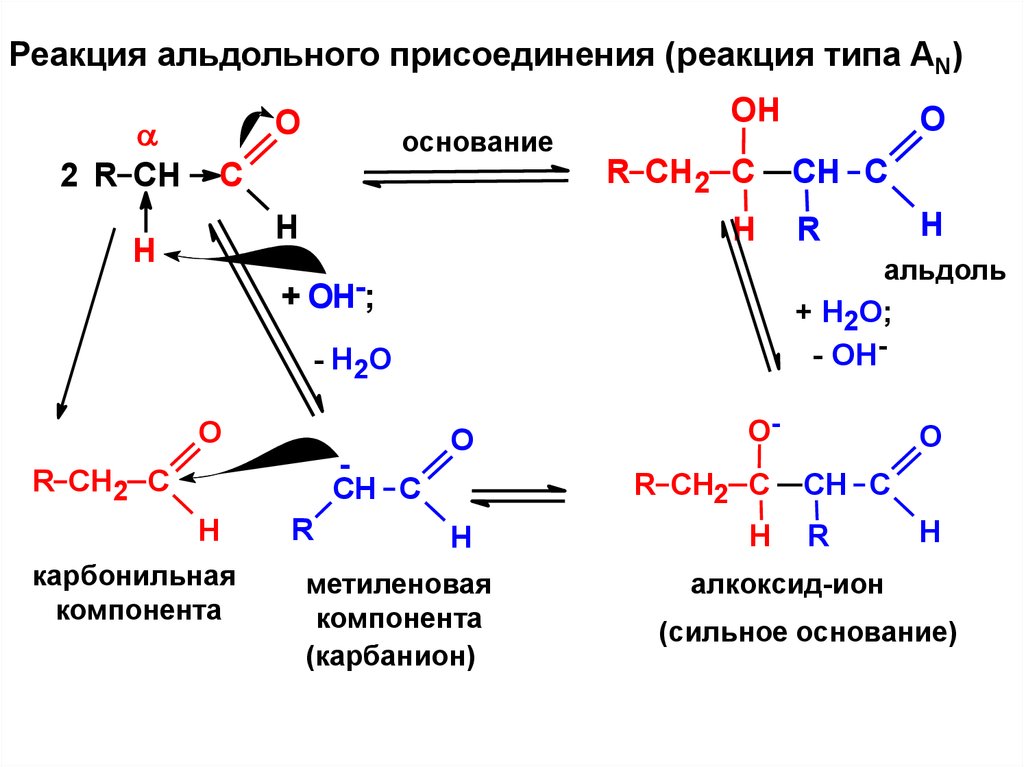
Реакция альдольного присоединения (реакция типа AN)2 R CH
O
основание
C
H
Н
OH
R CH2 C
H
CH C
H
карбонильная
компонента
R
H
R
+ Н2О;
- ОН-
- Н2О
R CH2 C
CH C
альдоль
+ ОН-;
O
O
O
H
метиленовая
компонента
(карбанион)
OR CH2 C
H
O
CH C
R
H
алкоксид-ион
(сильное основание)
24.
Карбонильнаякомпонента
Метиленовая
компонента
H
O
CH3CH2C
+ CH3CHC
H
H
C O+
H
O KOH
H
H
CH3
O
CC
CH3
H
О
+
С
Н
О
СН2 С СН3
H
KOH
KOH
HO CH3
CH3CH2CHCHC
O
H
CH3 O
HOCH2 C C
H
CH3
О
ОН
С СН2 С СН3
Н
Альдольное присоединение
Альдольное расщепление (ретроальдольный распад)
25.
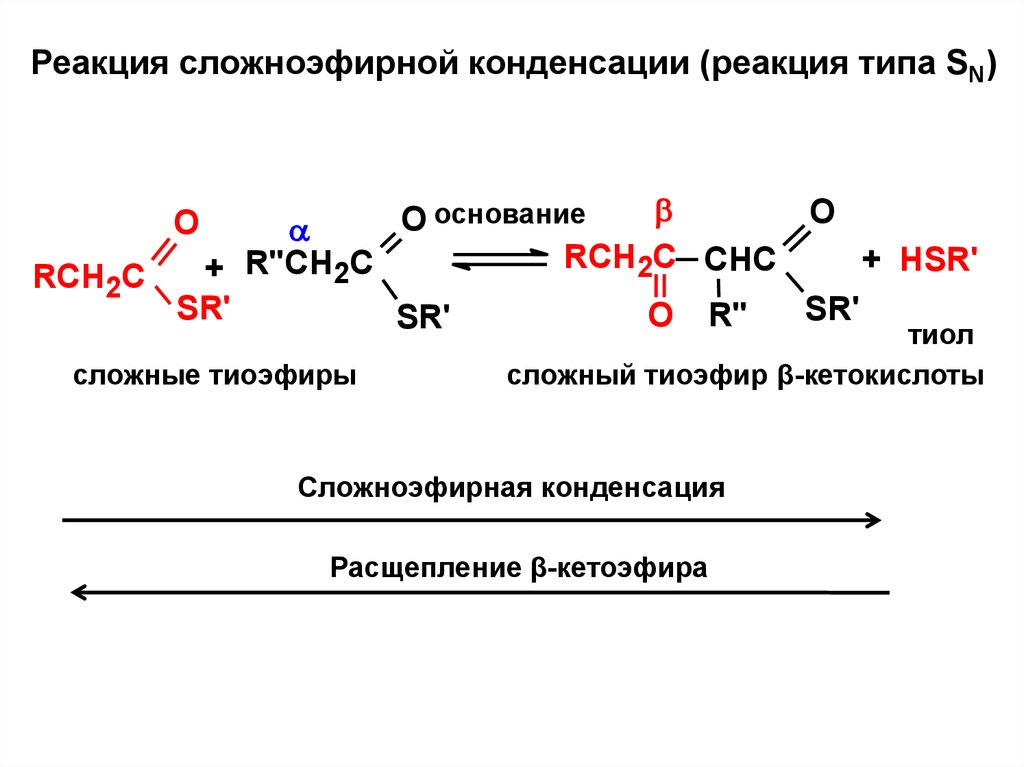
Реакция сложноэфирной конденсации (реакция типа SN)O
O основание
RCH2C CHC
+ HSR'
+ R"CH2C
RCH2C
SR'
SR'
О R"
SR'
тиол
O
сложные тиоэфиры
сложный тиоэфир β-кетокислоты
Сложноэфирная конденсация
Расщепление β-кетоэфира
26.
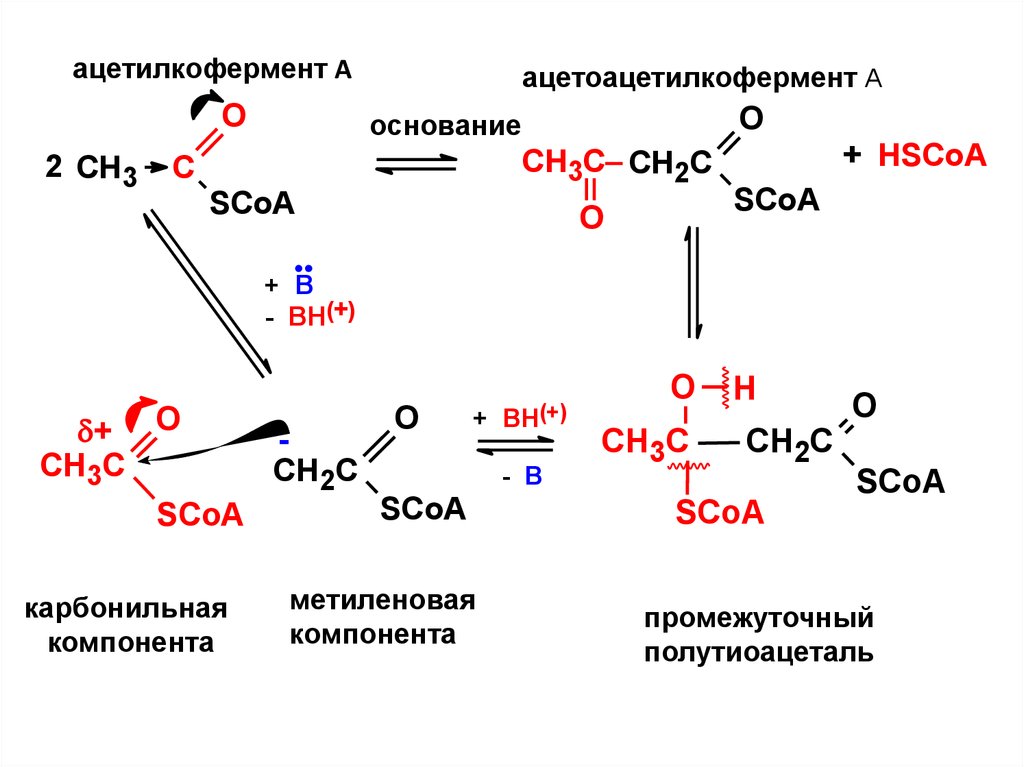
ацетилкофермент АO
2 СН3
ацетоацетилкофермент А
O
основание
CH3C CH2C
C
SСoA
О
+ HSСoA
SСoA
+ В
- ВН(+)
+
CH3C
O
SСoA
карбонильная
компонента
CH2C
O
+ ВН(+)
- В
SСoA
метиленовая
компонента
O
CH3C
Н
CH2C
SСoA
O
SСoA
промежуточный
полутиоацеталь
27.
Реакции карбоксилирования (введения карбоксильной группы)O
+
основание
+ O
+ О С О
C
RCH2
SR'
RCHC
НО
О
сложный тиоэфир
двухосновной кислоты
сложный тиоэфир
O
СН3СН2С
SR'
С
O
SCoA
+ CO2
карбоксилирование
декарбоксилирование
СН3СНС
SCoA
COOH










 Химия
Химия