Похожие презентации:
Валентность и степень окисления. Химическая связь
1.
Валентность и степеньокисления.
Химическая связь
06.09.2018
2. Важно!
• № группы = количеству электронов навнешнем уровне
• № периода = количеству электронных
уровней
от количества электронов на внешнем
уровне зависят валентность и степень
окисления
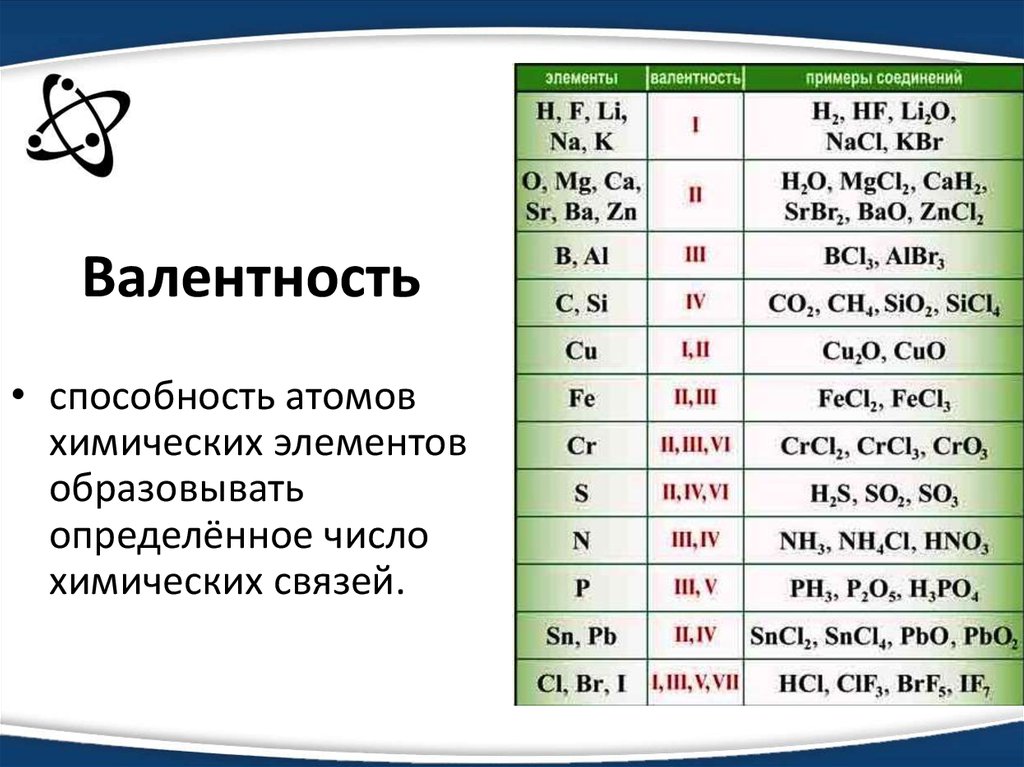
3. Валентность
• способность атомовхимических элементов
образовывать
определённое число
химических связей.
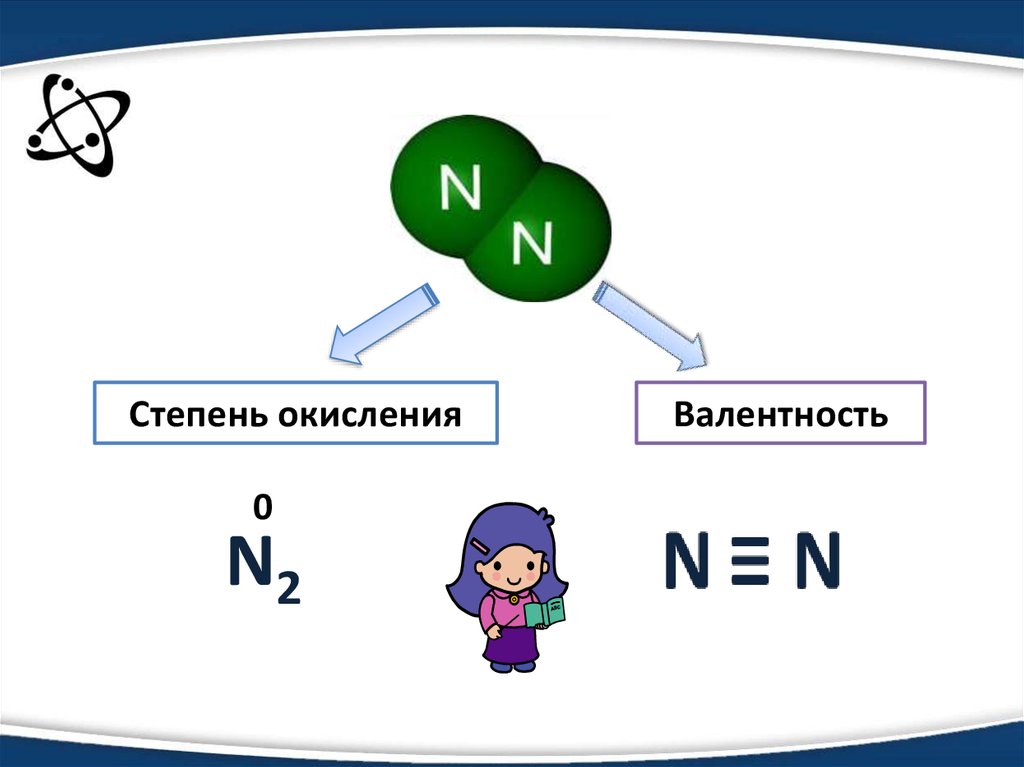
4.
Степень окисления0
N2
Валентность
5. Электроотрицательность
это способность атомов притягивать электроны присвязывании с другими атомами.
Окислитель –
забирает
электроны
(«окислитель
– грабитель»)
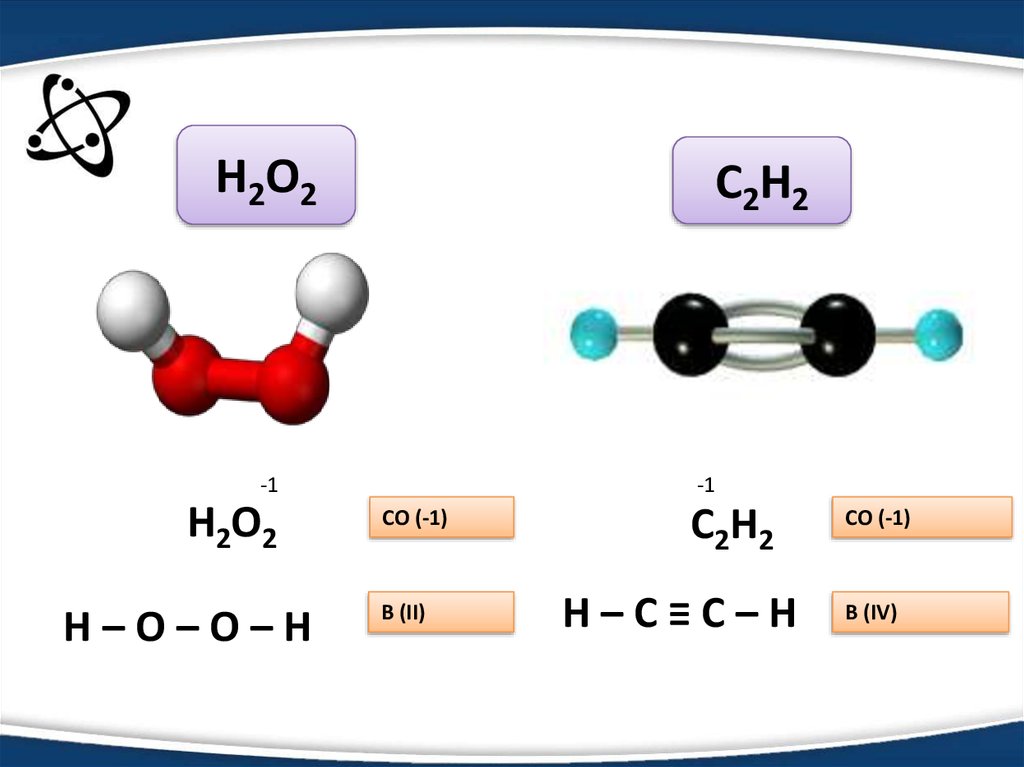
6.
Н2О2C2H2
-1
Н2О2
Н–О–О–Н
-1
СО (-1)
В (II)
C2H2
Н–С≡С–Н
СО (-1)
В (IV)
7.
Степень окисления – это условный зарядатомов химического элемента в
соединении, если предположить, что оно
состоит только из ионов.
Степень окисления может быть положительной,
отрицательной, нулевой
Степень окисления простых веществ равна 0: N2, H2, S8,
Cu, O3 и др.
F всегда имеет степень окисления -1
NaF →
F -1
О всегда имеет степень окисления -2, кроме
соединений со фтором СaO → (-2), OF2 → (+2)
8.
Степень окисления Н всегда (+1), исключения –соединения с металлами, где степень окисления Н (-1):
CaH2, KH, LiH и др.
У металлов степень окисления только положительная.
У металлов А групп она совпадает с валентностью
Минимальная степень окисления = № группы – 8, у N
(-3)
Максимальная степень окисления равна номеру
группы, например у N (+5)
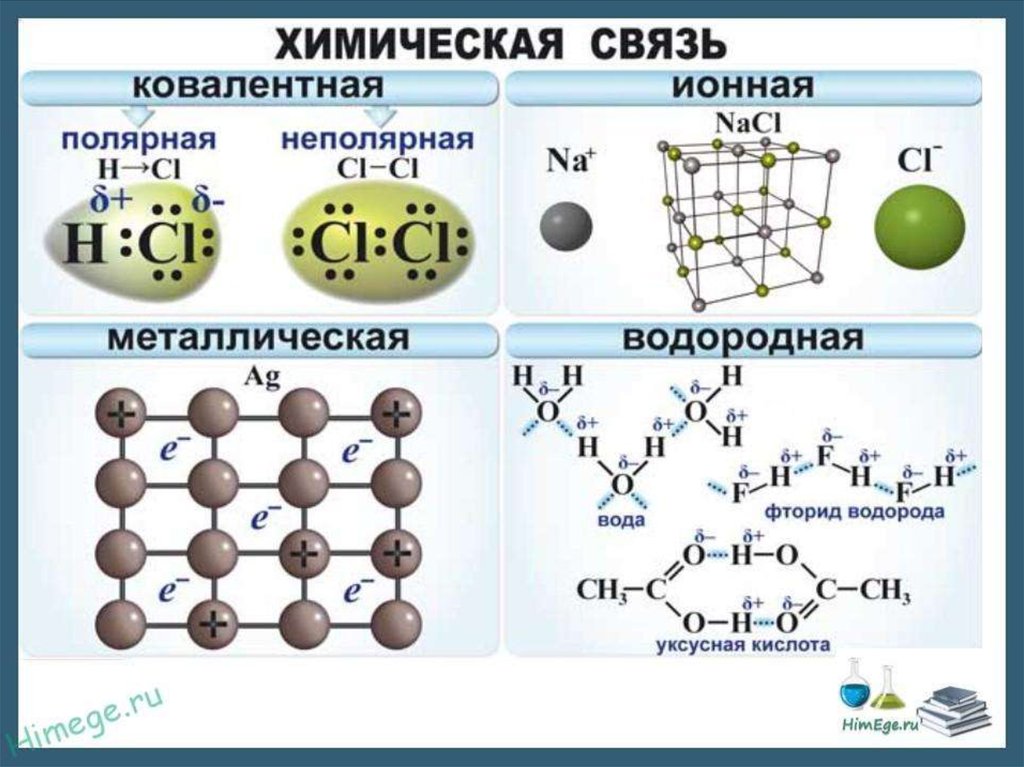
9.
• Образуется между ионами – заряженнымичастицами;
• Образуется между элементами,
Электроотрицательность которых сильно
отличается друг от друга;
• Существует в солях, основаниях и оксидах
металлов: NaCl, KOH, Na2O
• Металлы отдают электроны с последнего слоя.
Неметаллы принимают недостающие электроны.
10. Ковалентная неполярная связь
• Образуется между элементаминеметаллами с одинаковой
Электроотрицательность за счет
объединения неспаренных электронных
пар в общие пары:
Н-Н; О=О. Она образуется в простых
веществах неметаллах, а также в веществе
фосфин РН3
11. Ковалентная полярная связь
• Образуется между элементаминеметаллами, Электроотрицательность
которых незначительно отличается друг о
друга. Между неметаллами также
образуются общие электронные пары. Но
они будут смещаться в сторону боле
сильного неметалла:
Н→:Cl; H→O←H
12.
• Образуется между атомами и ионамиметаллов. Существует в простых веществах
металлах, а также в их сплавах. Занимает
промежуточное положение между ионной
и ковалентной связями: Ме0 – n e- ↔ Ме+n
13.
• Образуется между водородом и болееэлектроотрицательным элементом. Чаще всего
это кислород, азот, сера. Связь непрочная, но так
как она образуется между многими молекулами,
то она как бы «сшивает» их друг с другом:
Н-О …. Н-О
l
l
Н
Н











 Химия
Химия








