Похожие презентации:
Углеводороды ациклические, циклические
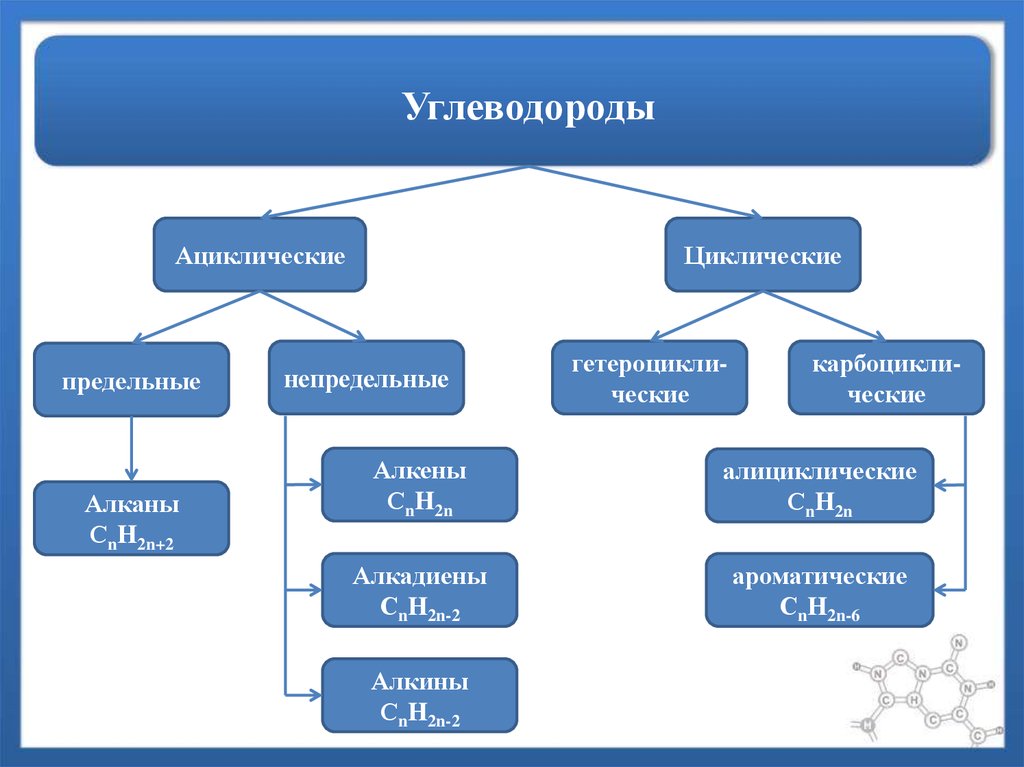
1. Углеводороды
2. Углеводороды
Ациклическиепредельные
Алканы
СnH2n+2
Циклические
непредельные
гетероциклические
карбоциклические
Алкены
СnH2n
алициклические
СnH2n
Алкадиены
СnH2n-2
ароматические
СnH2n-6
Алкины
СnH2n-2
3. АЛКАНЫ
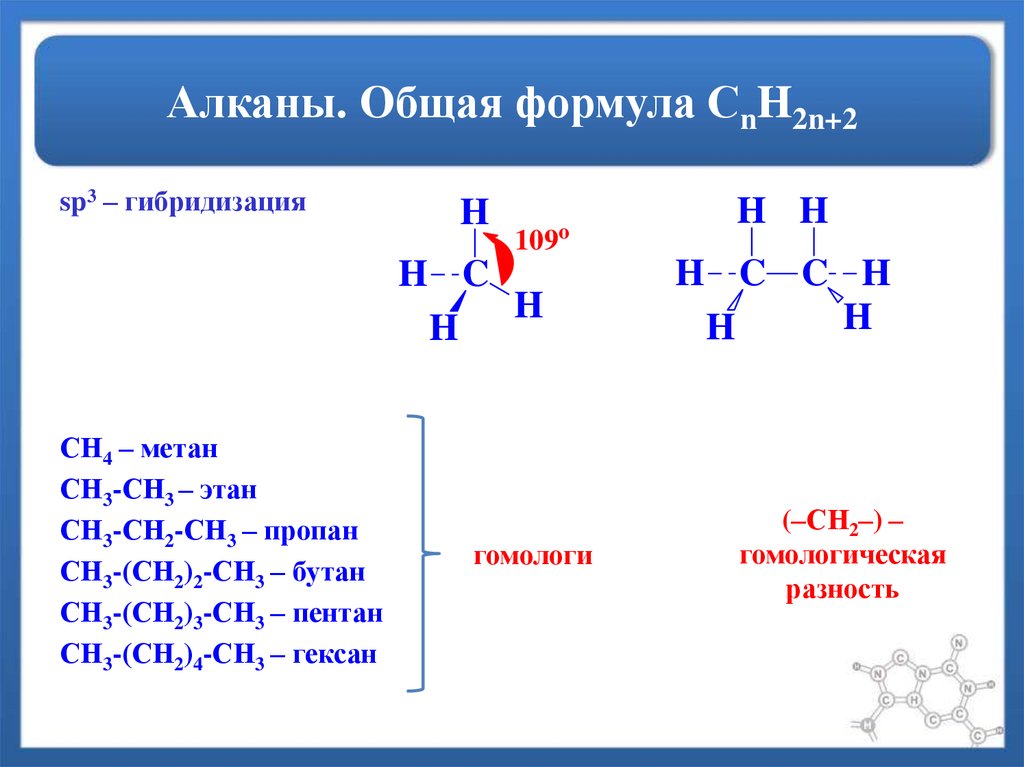
4. Алканы. Общая формула СnH2n+2
sp3 – гибридизацияH
109
o
H C
H
H
СН4 – метан
СН3-СН3 – этан
СН3-СН2-СН3 – пропан
СН3-(СН2)2-СН3 – бутан
СН3-(СН2)3-СН3 – пентан
СН3-(СН2)4-СН3 – гексан
гомологи
H H
H C C H
H
H
(–СН2–) –
гомологическая
разность
5. Алканы. Общая формула СnH2n+2
Радикал – нейтральный атом (группа атомов), имеющийнеспаренный электрон.
СН4
метан
СН3-СН3
этан
СН3–
метил
СН3-СН2–
этил
СН3-СН2-СН3
пропан
СН3-СН2-СН2–
пропил
СН3-СН-СН3
изопропил
6. Алканы. Общая формула СnH2n+2
Первичные, вторичные, третичные, четвертичные атомы углерода1
1
CH3
4
1
2
2
CH3
3
2
2
1
H3C C CH2 CH2 CH CH2 CH2 CH3
2
CH2
1
CH3
7. Алканы. Общая формула СnH2n+2
НоменклатураСистематическая
(ИЮПАК)
Рациональная
8. Алканы. Общая формула СnH2n+2
Систематическая номенклатура1.
2.
3.
4.
5.
Выбрать самую длинную углеродную цепь.
Пронумеровать её с того конца, к которому ближе заместитель.
Назвать заместители с указанием цифрой номера углеродного
атома, при котором они располагаются.
Если при одном атоме углерода есть два одинаковых заместителя,
то номер этого углеродного атома повторяется дважды, а перед
названием заместителя ставится умножающая приставка.
В конце дать название пронумерованной цепи с окончанием «-ан».
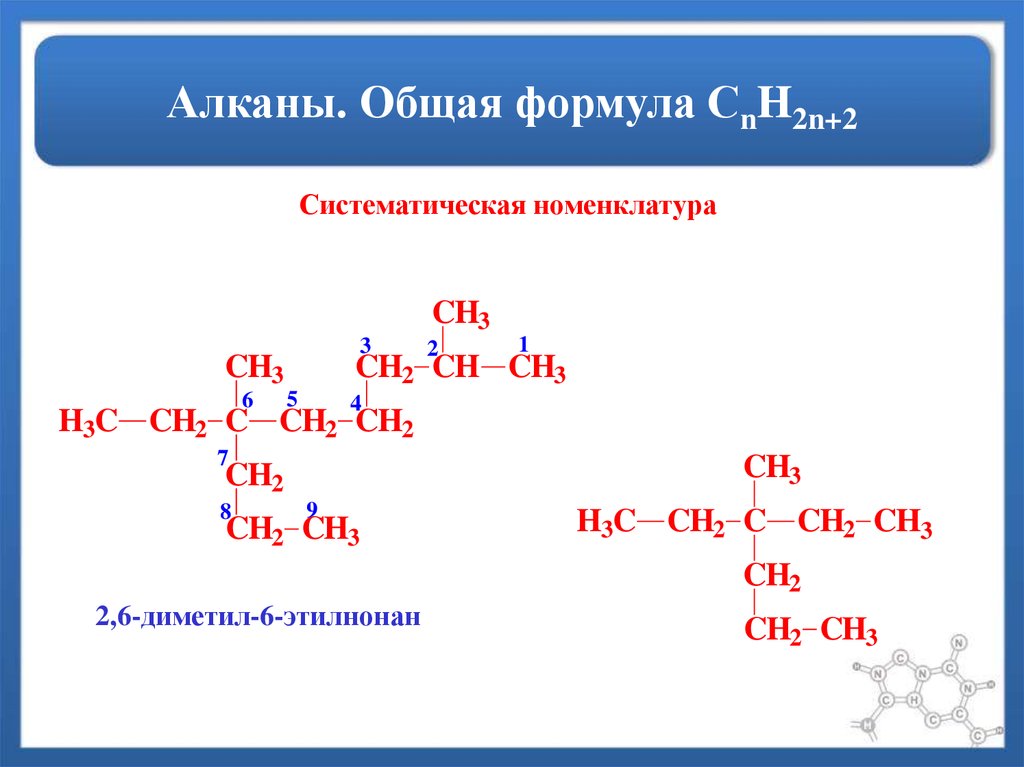
9. Алканы. Общая формула СnH2n+2
Систематическая номенклатураCH3
3
CH3
6
2
1
CH2 CH CH3
5
4
H3C CH2 C CH2 CH2
7
CH3
CH2
8
9
CH2 CH3
H3C CH2 C CH2 CH3
CH2
2,6-диметил-6-этилнонан
CH2 CH3
10. Алканы. Общая формула СnH2n+2
Рациональная номенклатура1.
2.
3.
Выбрать атом углерода с наибольшим числом заместителей.
Назвать все заместители около этого атома.
Составить название с окончанием «метан».
CH3
H3C CH2 C CH2 CH3
CH3
H3C CH2 C CH3
CH2
CH2
CH2 CH3
CH3
Метилдиэтилпропилметан
11. Алканы. Общая формула СnH2n+2
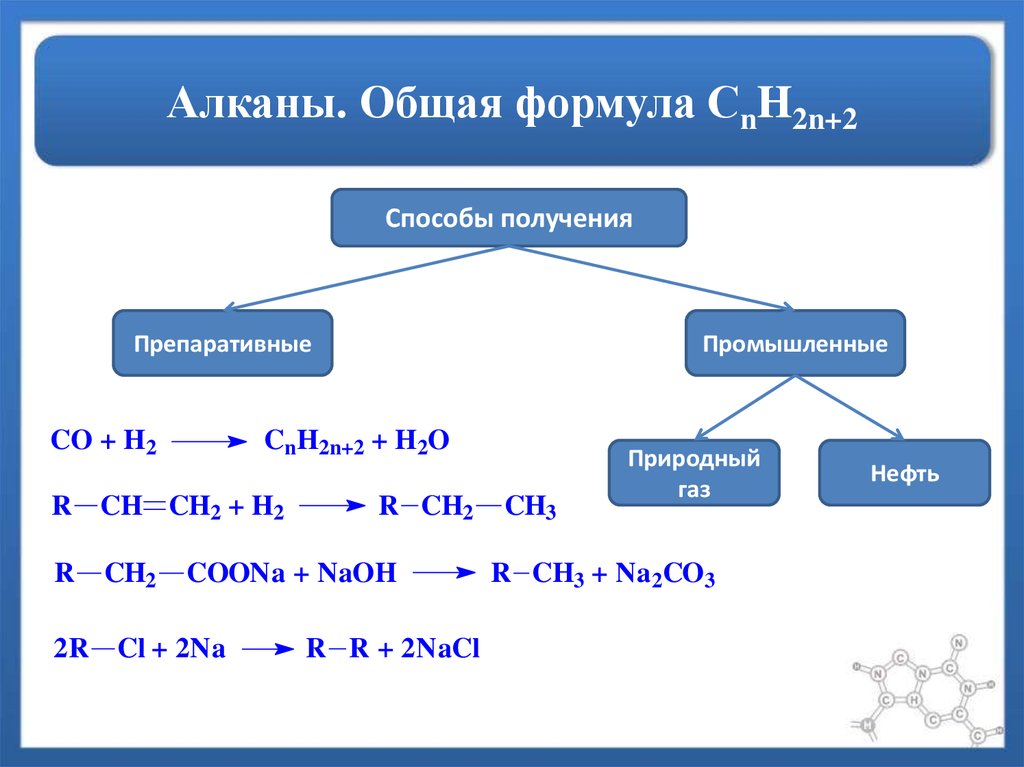
Способы полученияПрепаративные
CO + H2
CnH2n+2 + H2O
R CH CH2 + H2
R
CH2
Промышленные
R CH2
COONa + NaOH
2R Cl + 2Na
R R + 2NaCl
CH3
Природный
газ
R CH3 + Na2CO3
Нефть
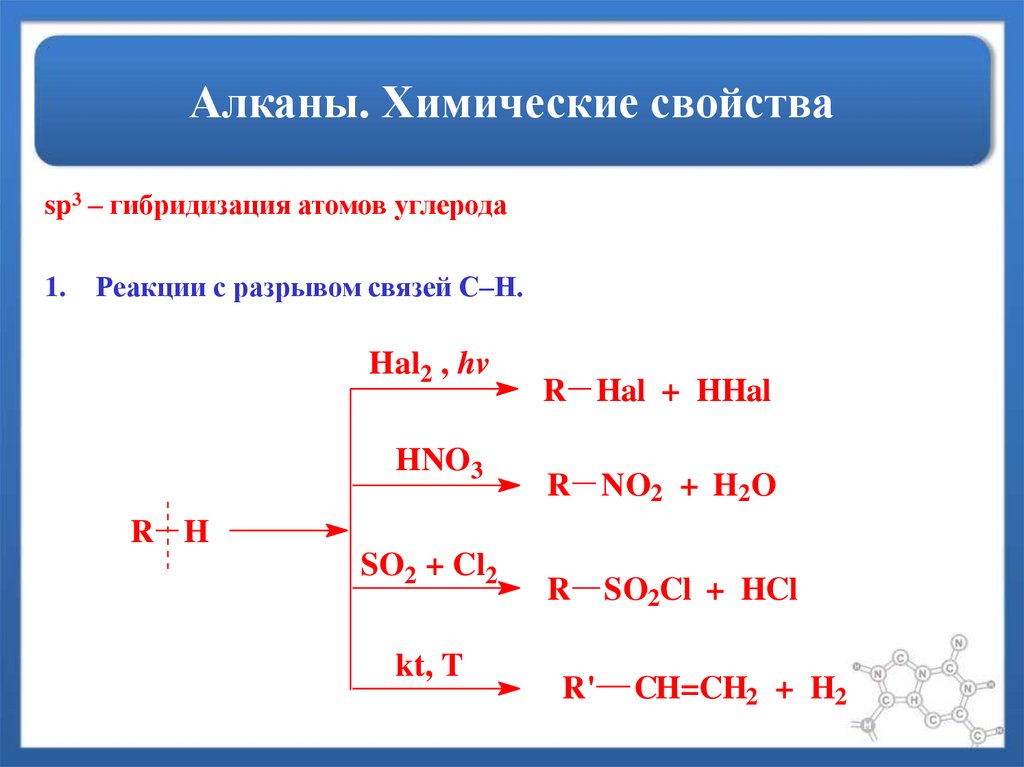
12. Алканы. Химические свойства
sp3 – гибридизация атомов углерода1.
Реакции с разрывом связей С–Н.
Hal2 , hv
HNO3
R Hal + HHal
R NO2 + H2O
R H
SO2 + Cl2
kt, T
R
R'
SO2Cl + HCl
CH=CH2 + H2
13. Алканы. Химические свойства
sp3 – гибридизация атомов углерода1.
Реакции с разрывом связей С–С.
R
CH2
CH2
H3C CH2
R
CH2
O2 , kt
CH3
R
kt, T
COOH + R
H3C CH
COOH
CH3
CH3
R CH2
CH2
CH2
R'
T
R CH CH2 + R' CH3
14. АЛКЕНЫ (ОЛЕФИНЫ)
15. Алкены. Общая формула СnH2n
sp2 – гибридизацияH
120
C
o
C
C
CH3
H 3C
C C
H
цис-2-бутен
H
H
1. hv
2. T
3. kt
H 3C
H
C C
H
CH3
транс-2-бутен
H
C
H
16. Алкены. Общая формула СnH2n
Номенклатура ИЮПАК1.
Выбрать самую длинную цепь с двойной связью.
2.
Пронумеровать её с того конца, к которому ближе двойная связь.
3.
Назвать заместители с указанием цифрой номера углеродного
атома, при котором располагается двойная связь.
4.
Дать название пронумерованной цепи с окончанием «-ен» и
указанием цифрой наименьшего углеродного атома, при котором
расположена двойная связь.
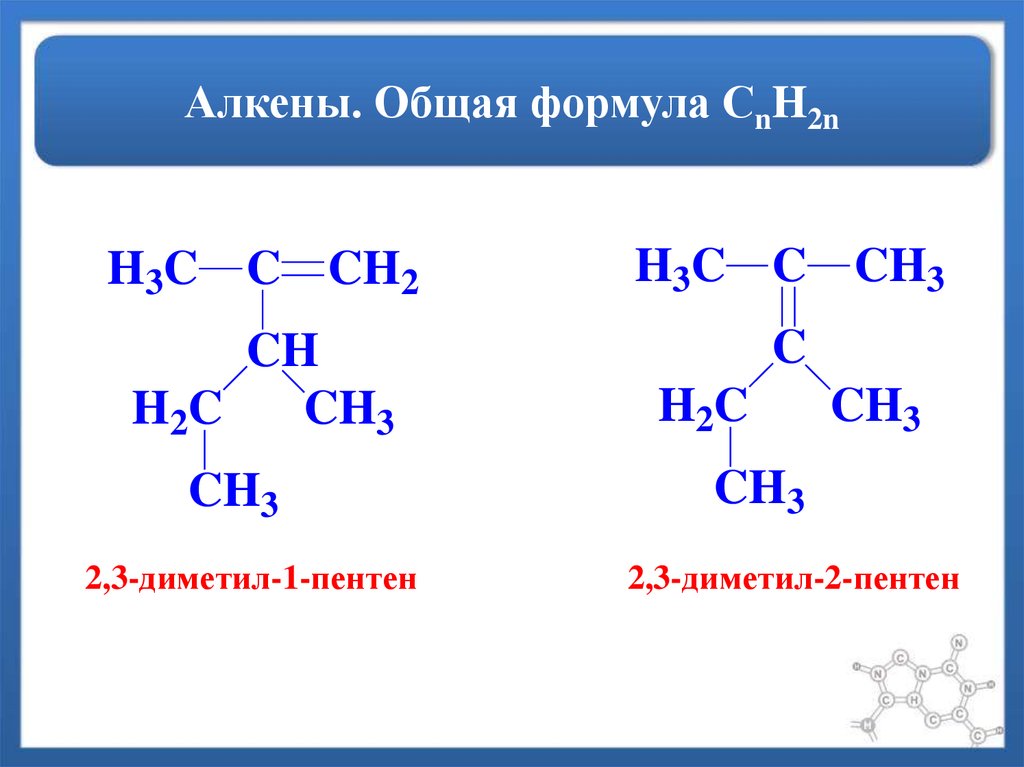
17. Алкены. Общая формула СnH2n
H3C C CH2H3C C CH3
CH
H 2C
CH3
C
CH3
2,3-диметил-1-пентен
H 2C
CH3
CH3
2,3-диметил-2-пентен
18. Алкены. Общая формула СnH2n
Рациональная номенклатура1.
Выделить углеродные атомы с двойной связью.
2.
Назвать все заместители, расположенные вокруг двойной связи.
3.
В конце дать название «этилен».
19. Алкены. Общая формула СnH2n
H3C C CH2H3C C CH3
CH
H 2C
CH3
C
CH3
H 2C
CH3
CH3
несимм. – метилвторбутилэтилен,
симм. – триметилэтилэтилен,
-метил- -вторбутилэтилен
, -диметил- -метил- -этилэтилен
20. Алкены. Химические свойства
1. Реакции радикального замещения (присоединения)H3C CH CH2
Cl
hv
Cl
H3C CH CH2 + Cl2
t
H2C CH CH2
Cl + HCl
21. Алкены. Химические свойства
2. Реакции электрофильногоприсоединения
Правило Марковникова
H2C CH CH3 + HBr
H2C CH CH3
-комплекс
H Br
H2C CH CH3
H3C
H Br
_
+
H3C CH CH3 + Br
_
+
CH CH3 + Br
карбкатион
H3C CH CH3
Br
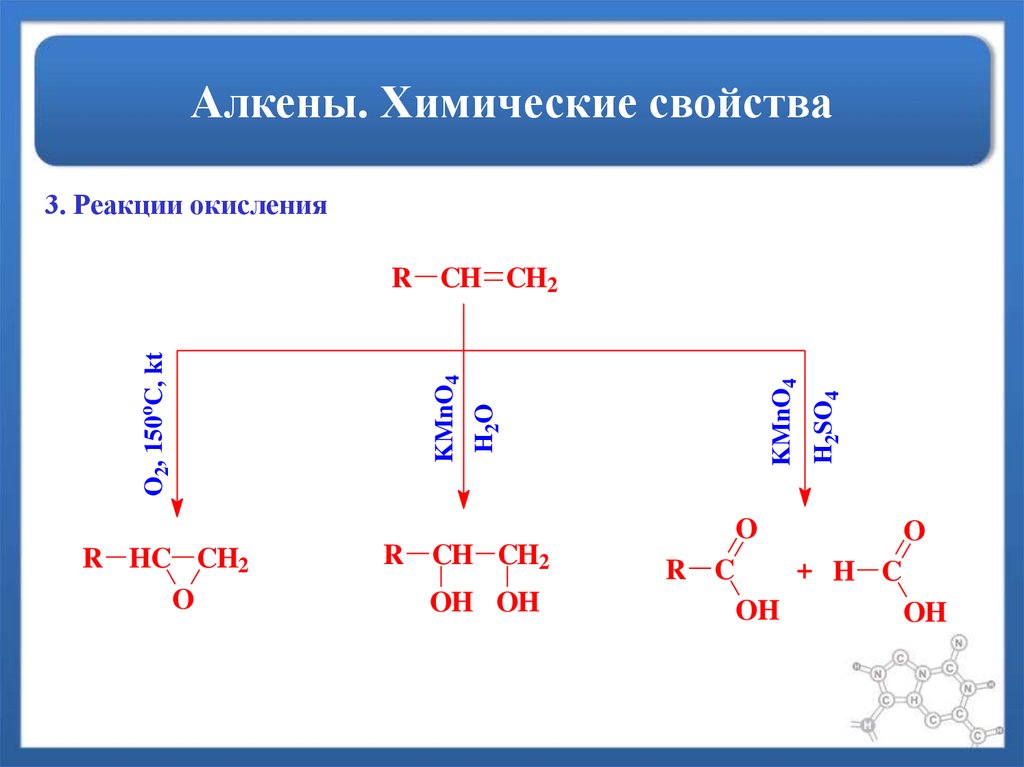
22. Алкены. Химические свойства
3. Реакции окисленияH2SO4
KMnO4
H 2O
KMnO4
O2, 150oC, kt
R CH CH2
O
R HC CH2
O
R CH CH2
OH OH
O
+ H C
R C
OH
OH
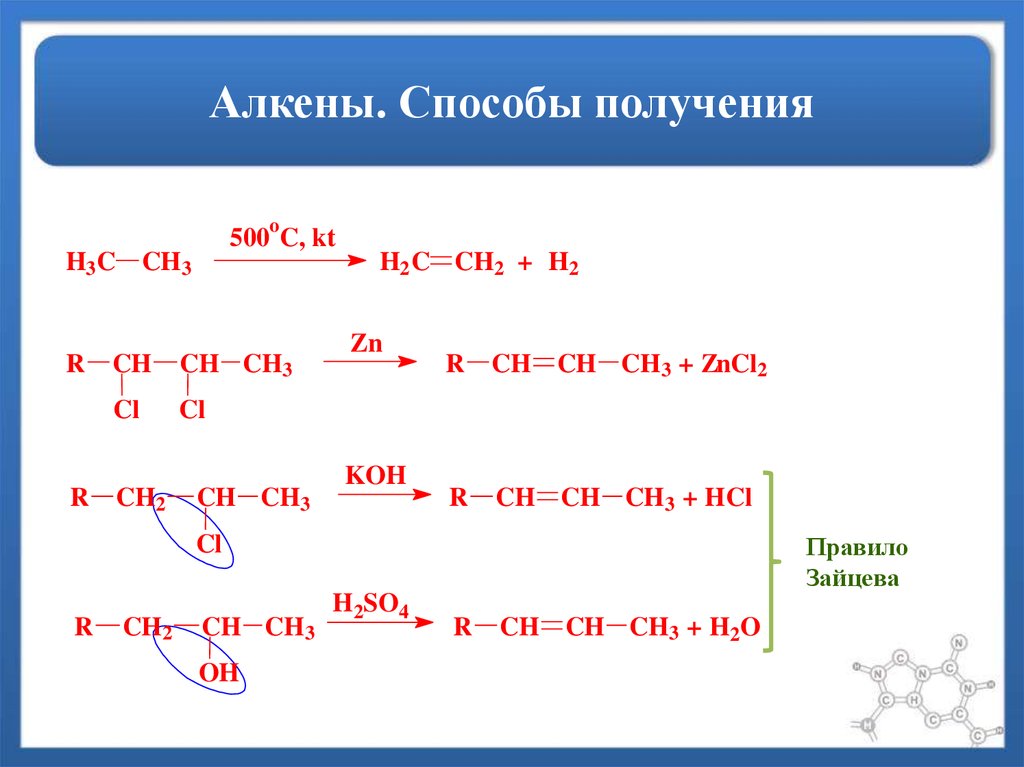
23. Алкены. Способы получения
o500 C, kt
H3 C CH3
R
R
H2 C CH2 + H2
CH
CH CH3
Cl
Cl
CH2
CH CH3
Zn
KOH
R
CH CH CH3 + ZnCl2
R
CH CH CH3 + HCl
Правило
Зайцева
Cl
R
CH2
CH CH3
OH
H2SO4
R
CH CH CH3 + H2O
24. АЛКИНЫ
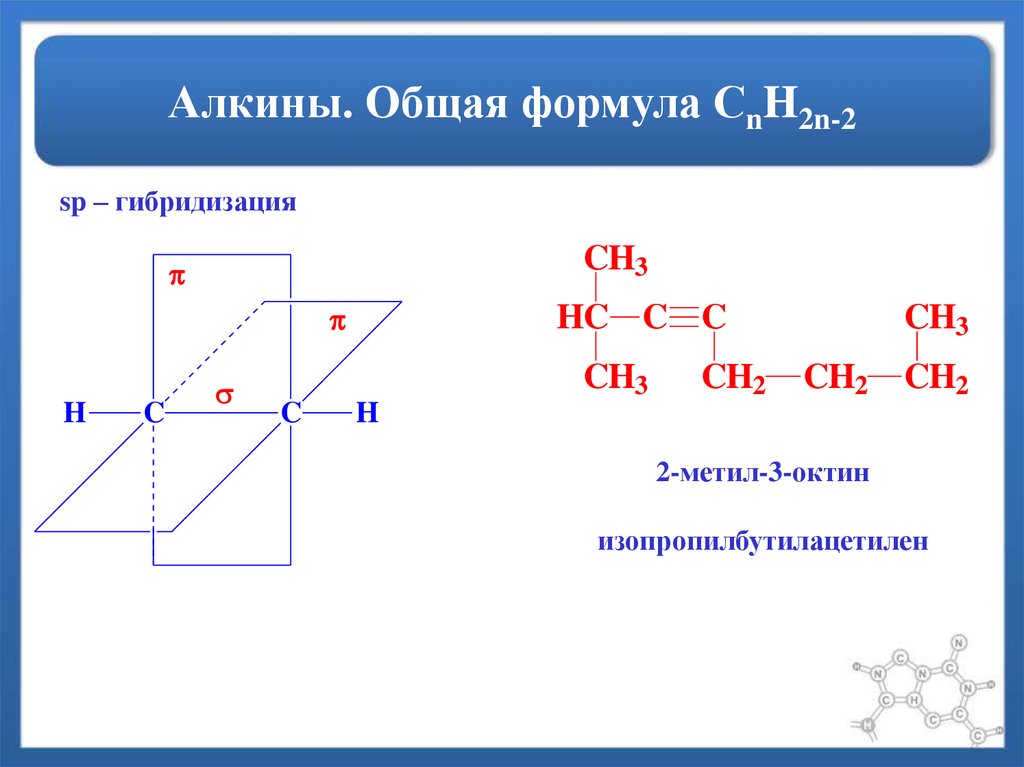
25. Алкины. Общая формула СnH2n-2
sp – гибридизацияCH3
H
C
HC C C
CH3
C
CH2
CH3
CH2
CH2
H
2-метил-3-октин
изопропилбутилацетилен
26. Алкины. Химические свойства
1. Реакции с разрушением -связей С–С.1.1 Реакции электрофильного присоединения
Br
Br2
H3C C CH
Br2
H3C CBr2
Br
H3C C CH
HCl (HgCl2)
H3C C CH2
Cl
2+
HOH (Hg )
H3C C CH2
OH
H3C C CH3
O
CBr2
27. Алкины. Химические свойства
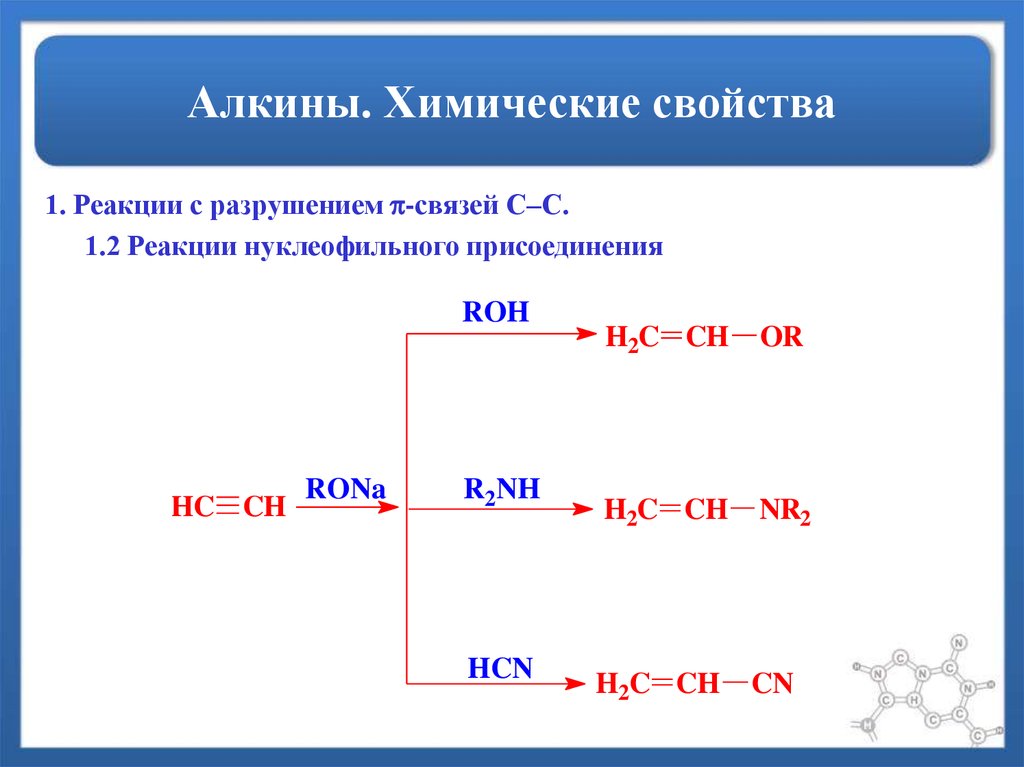
1. Реакции с разрушением -связей С–С.1.2 Реакции нуклеофильного присоединения
ROH
HC CH
RONa
R2NH
HCN
H2C CH
OR
H2C CH
NR2
H2C CH
CN
28. Алкины. Химические свойства
1. Реакции с разрушением -связей С–С.1.2 Другие реакции
CuCl (NH4Cl)
HC CH
HC C CH
CH2
kt
H2
H2C
CH2
H2
H3C
CH3
29. Алкины. Химические свойства
1. Реакции с разрушением связей Сsp–H.[Ag(NH3)2]OH
HC C Ag
O
HC
H
HC CH
[O]
HC
C
CH2OH
O
2 HC
OH
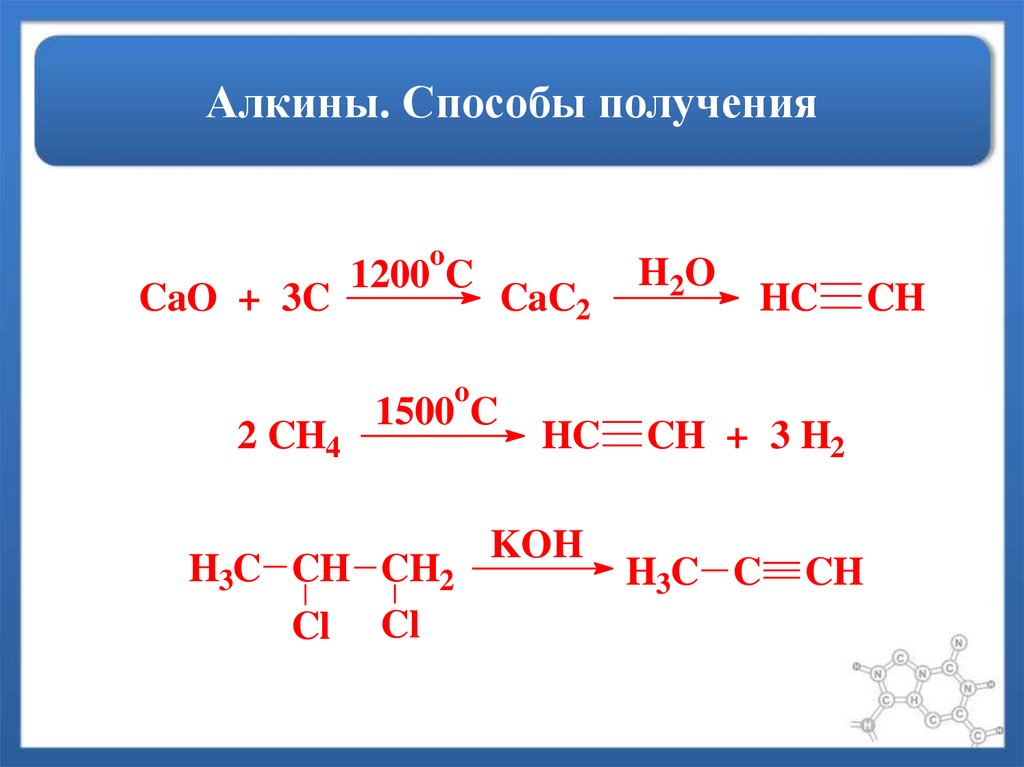
30. Алкины. Способы получения
oCaO + 3C
1200 C
CaC2
H2 O
HC
o
2 CH4
1500 C
H3C CH CH2
Cl Cl
HC
KOH
CH + 3 H2
H3C C
CH
CH

















 Химия
Химия








