Похожие презентации:
Алканы
1.
Радикалы и реактивные кислородные вещества• Радикалы – это недолго живущие (1,10ˉ³-10ˉсек) молекулы и ионы,
имеющие как минимум один непарный электрон на атомном
электронном уровне.
• Радикалы встречаются повсеместно
Радикал кислорода
Гидроксид радикал
Пероксид радикал
Пероксил радикал
Перекись водорода
Озон
Простой кислород
Водородный радикал
Метиловый радикал
O 2
HO
ROO
LOO
H2O2
O3
1O
2
H
CH 3
Эффект
• разрушение белков, ДНК, жировых компонентов клеточных
мембран
• Старение, рак, астма,атеросклероз, инфаркт миокарда, артрит
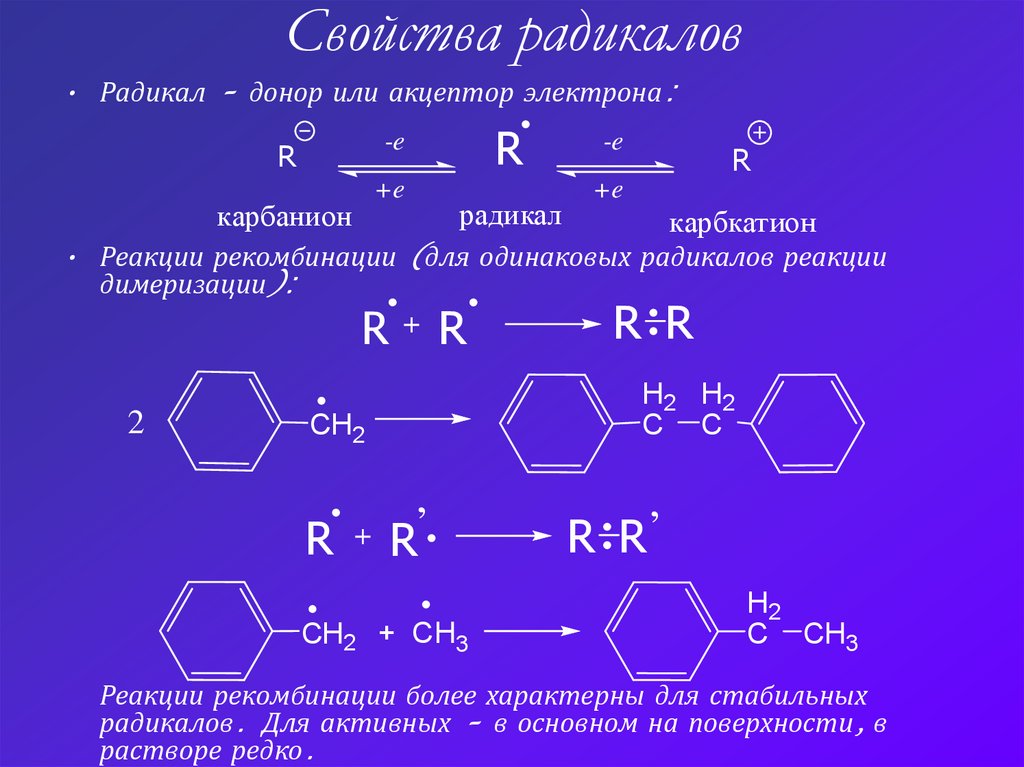
2. Свойства радикалов
• Радикал – донор или акцептор электрона:-e
R
+e
R
-e
R
+e
радикал
карбанион
карбкатион
• Реакции рекомбинации (для одинаковых радикалов реакции
димеризации):
R R
R+ R
2
H2 H2
C C
CH2
R
+
,
R
CH2 + CH3
R R
,
H2
C CH3
Реакции рекомбинации более характерны для стабильных
радикалов. Для активных – в основном на поверхности, в
растворе редко.
3.
АнтиоксидантыАнтиоксиданты – вещества, которые
даже если присутствуют в малой
концентрации, снижают или вообще
предотвращают окисление субстрата,
присутствующего в большем
количестве.
Энзиматические
Не энзиматические / Антиоксиданты АО
Супероксид дисмутазы Аскорбиновая кислота (Вит. C)
Глютатион пероксидазы -токоферол (Вит. E)
Провитамин A
Каталаза
Мочевая кислота
Билирубин (жёлчный красный пигмент)
Флавониды, стероиды
Убихинон
4.
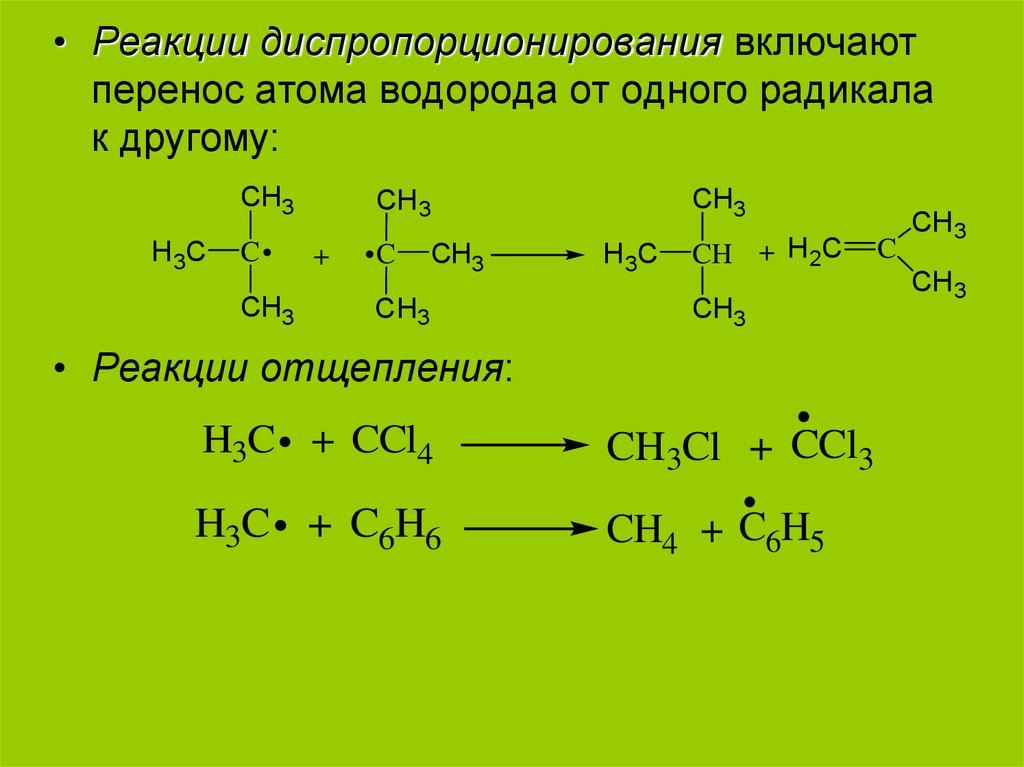
• Реакции диспропорционирования включаютперенос атома водорода от одного радикала
к другому:
CH3
H 3C
C
CH3
CH3
CH 3
+
C
CH3
CH3
H 3C
CH + H 2C
CH3
• Реакции отщепления:
H3C + CCl4
CH3Cl + CCl3
H3C + C6H6
CH4 + C6H5
C
CH 3
CH 3
5. Ион-радикалы
Ион –радикалы – одновременно несут заряд и
неспаренный электрон
1. Анион-радикалы образуются при
одноэлектронном восстановлении нейтральных
молекул, имеющих сродство к электрону:
M +e
K + O2
C2H5Cl
+
Na
C2H5Cl
M
O2 + K
+
C2H5Cl
C2H5
+
+
Cl
Na
6.
• Катион-радикалы образуются при одноэлектронномокислении нейтральных молекул, обладающих
электронной избыточностью:
M
-e
M
CH4
-e
CH4
(C6H5)3CH
(C6H5)3CH
-e
(C6H5)3CH
(C6H5)3C
+
H
+
Основное свойство катион-радикалов –
распад (фрагментация)
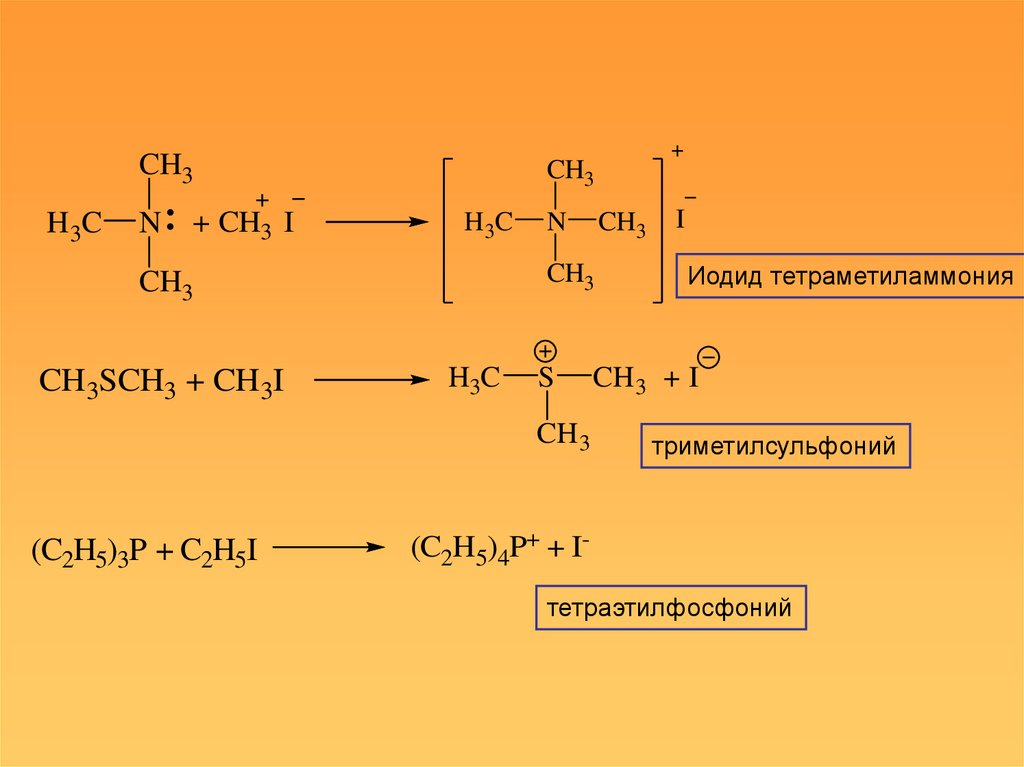
7. Онии
• Образуются по донорно-акцепторному механизму привзаимодействии электрофила с нуклеофилом
1. Нуклеофил – нейтральная молекула, электрофил –
катион.
Происходит образование катиона ониевого типа:
H
H
N
H
+
H+
H
H
H
+
O +H
Ион аммония. Все связи ковалентны
и равноценны
N H
H
H 3O
Ион гидроксония
H
C2H 5OH + H+
C2H 5O
H
H
Катион этилоксония
8.
CH3H 3C
N
+ CH3 I
CH3
H 3C
H3C
S
CH 3
(C2H5)3P + C2H5I
CH3
CH3
CH3
CH3SCH3 + CH3I
N
I
Иодид тетраметиламмония
CH 3 + I
триметилсульфоний
(C2H5)4P+ + Iтетраэтилфосфоний
9.
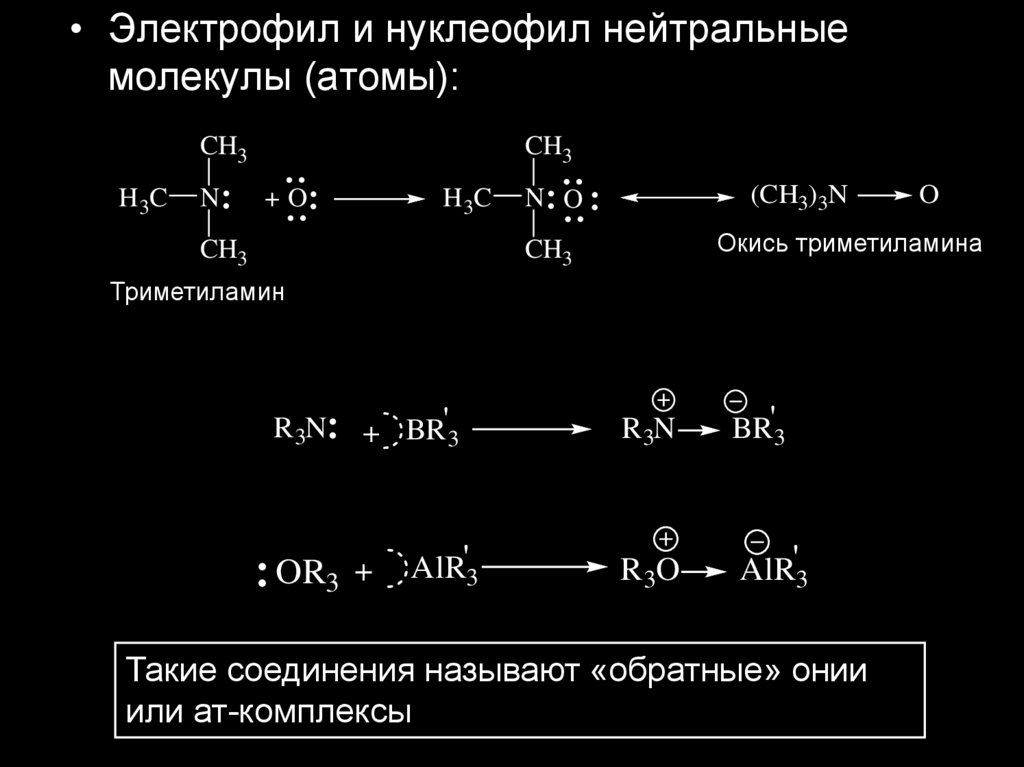
• Электрофил и нуклеофил нейтральныемолекулы (атомы):
CH3
H 3C
N
CH3
H 3C
+O
CH3
(CH3)3N
N O
Окись триметиламина
CH3
Триметиламин
R 3N
+ BR'3
OR3 +
AlR'3
O
R 3N
BR'3
R 3O
AlR'3
Такие соединения называют «обратные» онии
или ат-комплексы
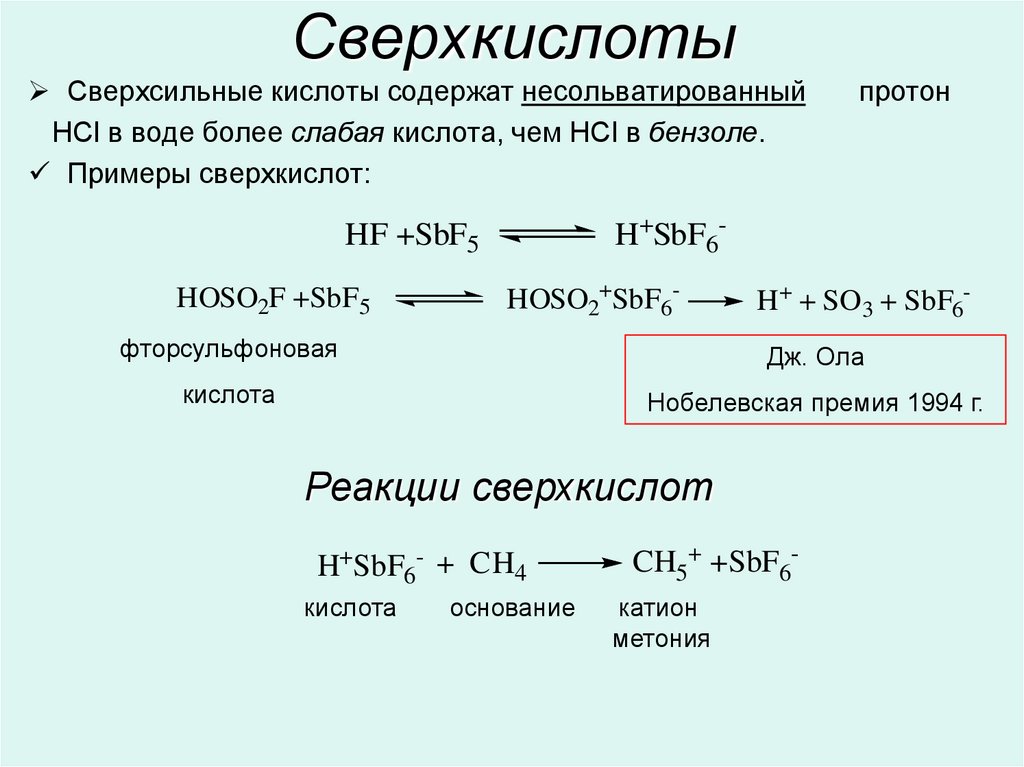
10. Сверхкислоты
Сверхсильные кислоты содержат несольватированныйHCl в воде более слабая кислота, чем HCl в бензоле.
Примеры сверхкислот:
H+SbF6-
HF +SbF5
HOSO2F +SbF5
протон
HOSO2+SbF6-
H+ + SO3 + SbF6-
фторсульфоновая
Дж. Ола
кислота
Нобелевская премия 1994 г.
Реакции сверхкислот
H+SbF6- + CH4
кислота
основание
CH5+ +SbF6катион
метония
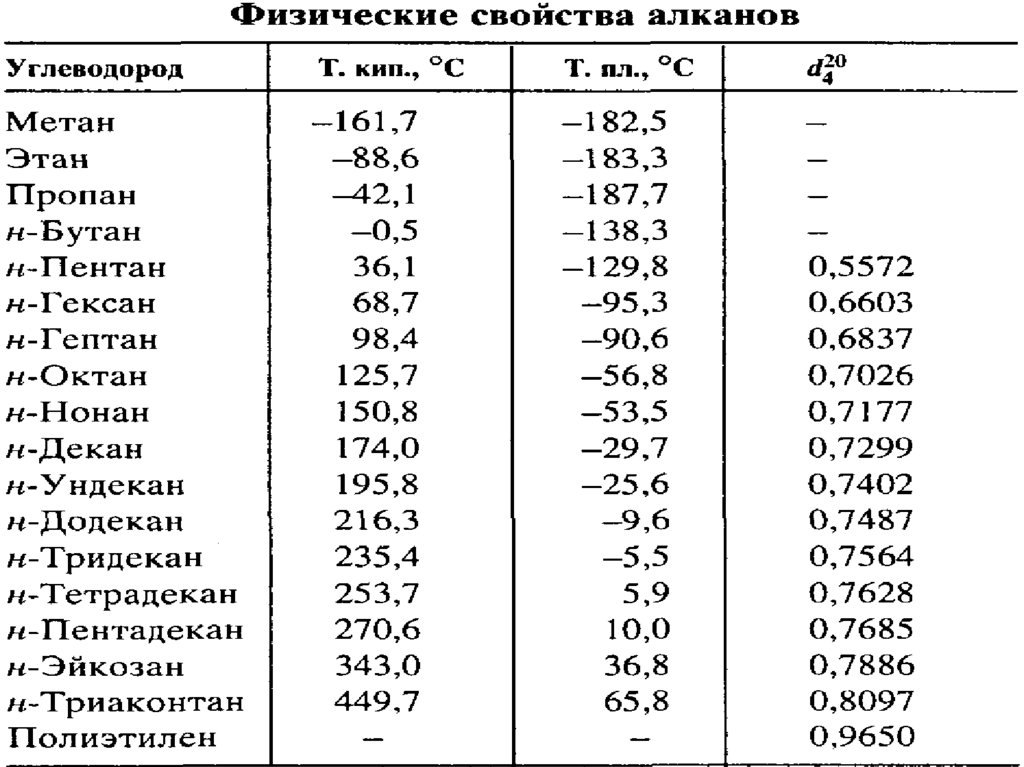
11. Алканы (СnH2n+2) Насыщенные углеводороды (парафины)
Csp3-конфигурация
12.
« Chem3D Embed »13.
НоменклатураА) Тривиальная (эмпирическая) – исторически
сложившаяся
Б) Рациональная
Основной принцип – обозначение всех изомеров
углеводородов как производных метана.
H
H3 C
C
CH3
CH3
H 3C
C
CH3
H
H
Диметилметан
Триметилметан
B) Международная систематическая
номенклатура ИЮПАК (IUPAC – International
Union of Pure and Applied Chemistry).
Основные принципы номенклатуры органических
соединений см. методичку на кафедре или учебник
В.Ф. Травеня «Органическая химия»
14.
15.
Молекула метана представляет собой тетраэдр.Это жесткая конструкция.
Расстояние C-H = 1,1 Å (данные РСА).
Длина связи в алканах 1,54
Å.
Все гомологи метана одарены внутренним
собственным движением его простых связей в
пространстве. В результате таких поворотов
углеродная цепь может принимать самые
разнообразные формы, вплоть до спиральной.
Такие
пространственные
вращения
называются конформациями (связь при этом
сохраняется).
16.
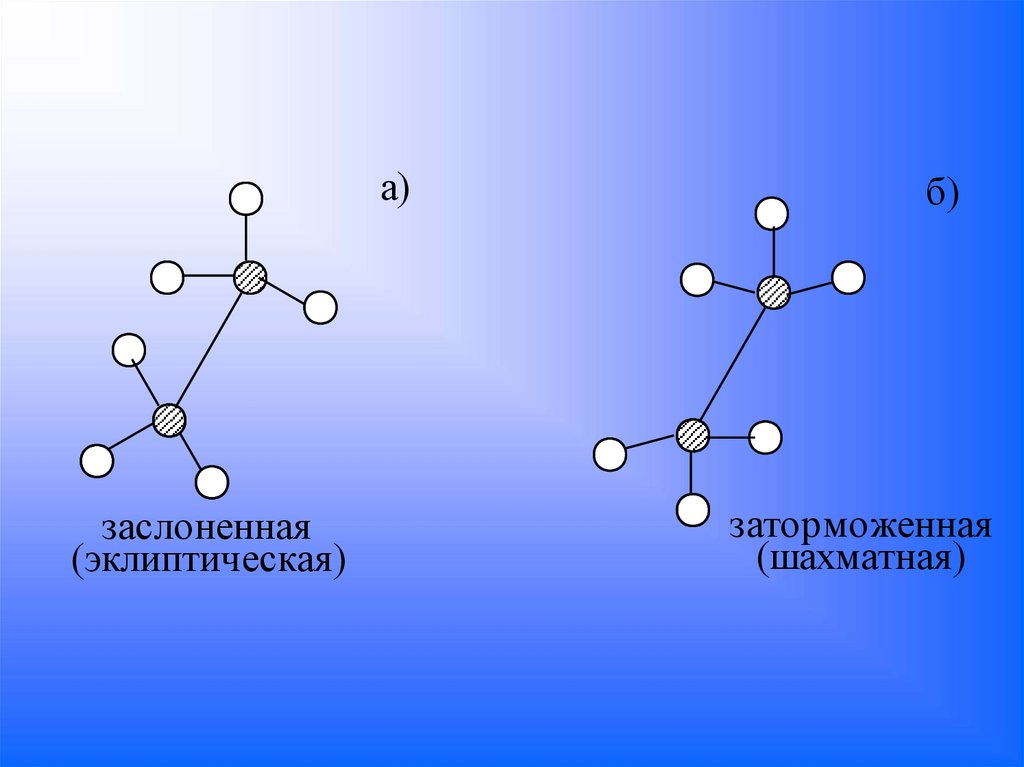
a)заслоненная
(эклиптическая)
б)
заторможенная
(шахматная)
17.
Графическая записьH
H
H
a)
H
H
H
H
H
H
заторможенная
H
H
H
заслоненная
б)
или так
a)
б)
18.
HH
a)
HH
б)
H
H
H
H
H
заслоненная
H
H
H
заторможенная
проекции Ньюмена
19.
а) В заслоненной конформации(эклиптической) все атомы водорода
лежат на одной линии, расстояние
между водородами минимальные.
б) В заторможенной (шахматной)
конформации
максимальное
несовмещение
водородов.
Это
конформация
выгоднее
энергетически, т.к. удаление между
водородами
максимальное,
следовательно, меньше.
20.
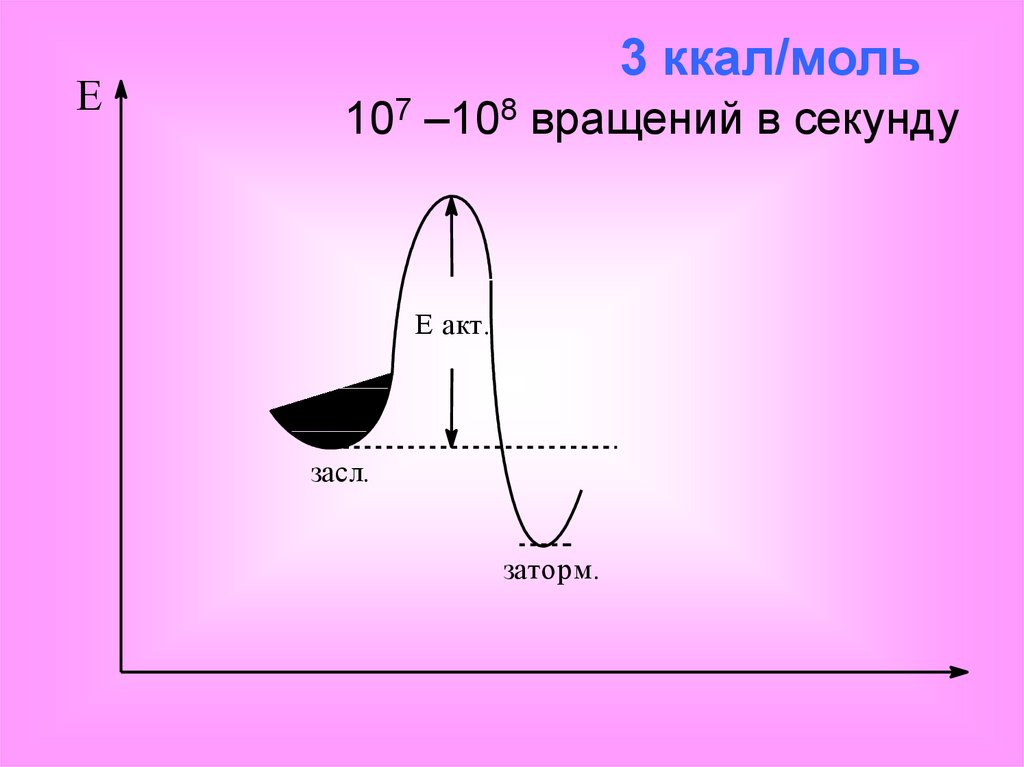
E3 ккал/моль
107 –108 вращений в секунду
E акт.
засл.
заторм.
21.
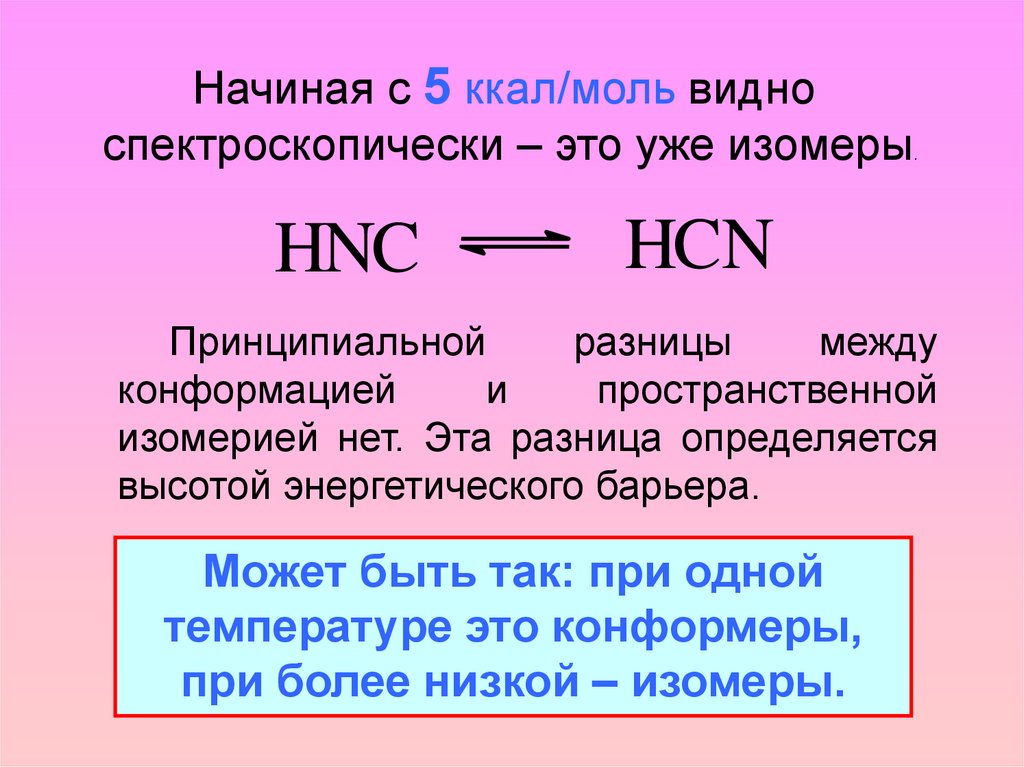
Начиная с 5 ккал/моль видноспектроскопически – это уже изомеры
HNC
.
HCN
Принципиальной
разницы
между
конформацией
и
пространственной
изомерией нет. Эта разница определяется
высотой энергетического барьера.
Может быть так: при одной
температуре это конформеры,
при более низкой – изомеры.












 Химия
Химия








