Похожие презентации:
Оксиды в свете ТЭД
1. ДЗ
2. Оксиды в свете ТЭД
22.04.20173. Разнообразие оксидов
АметистКварц
Вода
Песок
Бурый газ
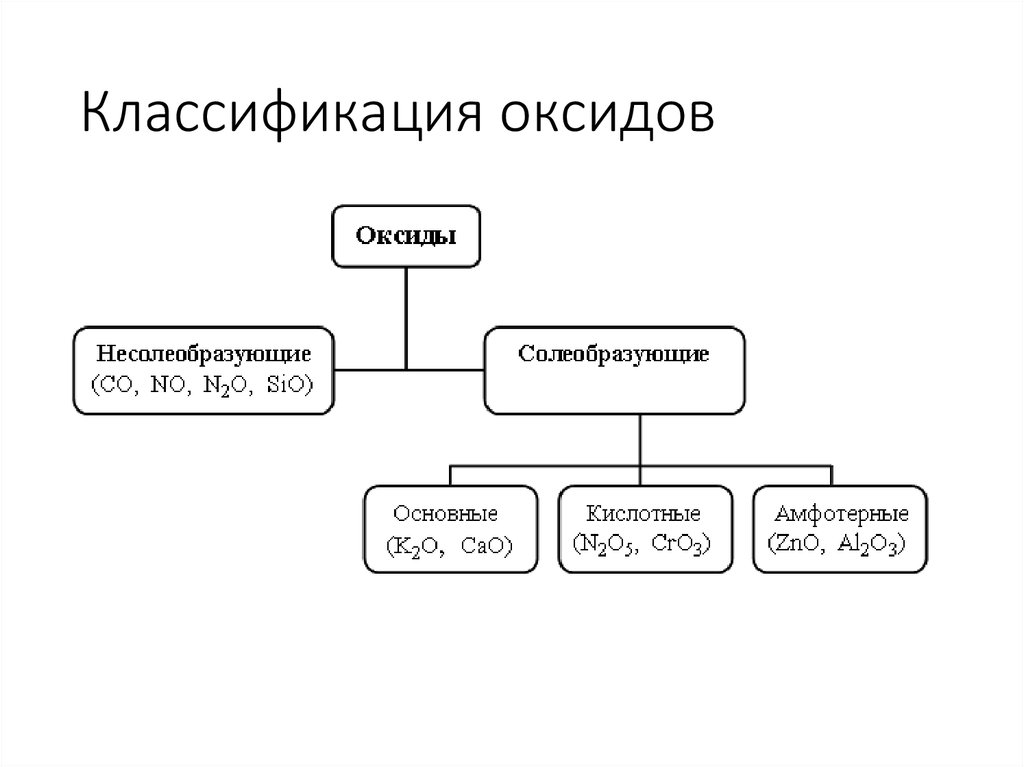
4. Классификация оксидов
5. Определения
Несолеобразующие оксиды – это оксиды, которые не взаимодействуют ни скислотами, ни с щелочами и не образуют солей
Солеобразующие оксиды – это оксиды, которые взаимодействуют с
кислотами или основаниями и образуют при этом соль и воду
Основные оксиды – это оксиды, которым соответствуют основания
Кислотные оксиды – это оксиды, которым соответствуют кислоты
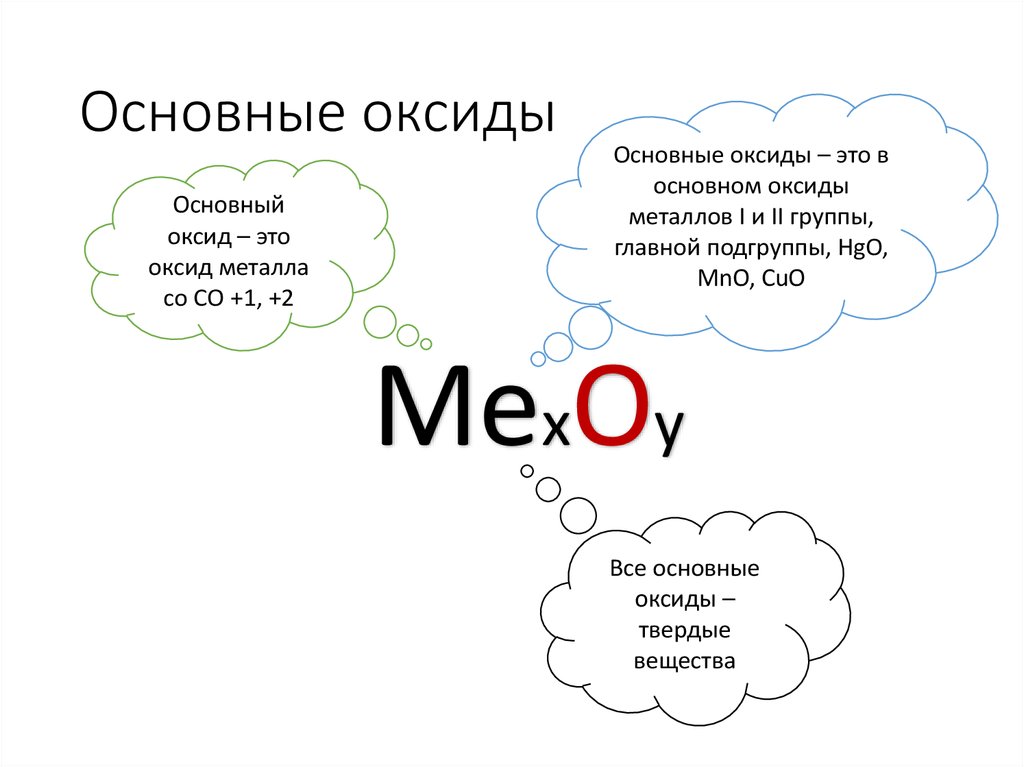
6. Основные оксиды
Основныйоксид – это
оксид металла
со СО +1, +2
Основные оксиды – это в
основном оксиды
металлов I и II группы,
главной подгруппы, HgO,
MnO, CuO
МехОу
Все основные
оксиды –
твердые
вещества
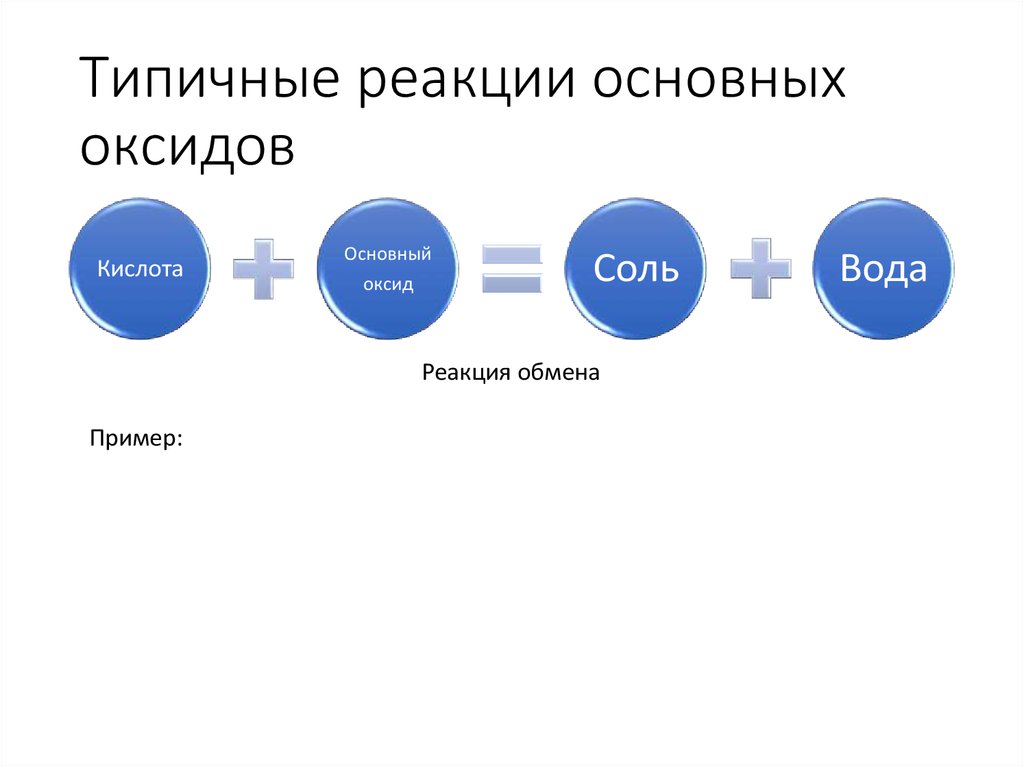
7. Типичные реакции основных оксидов
КислотаОсновный
оксид
Соль
Реакция обмена
Пример:
Вода
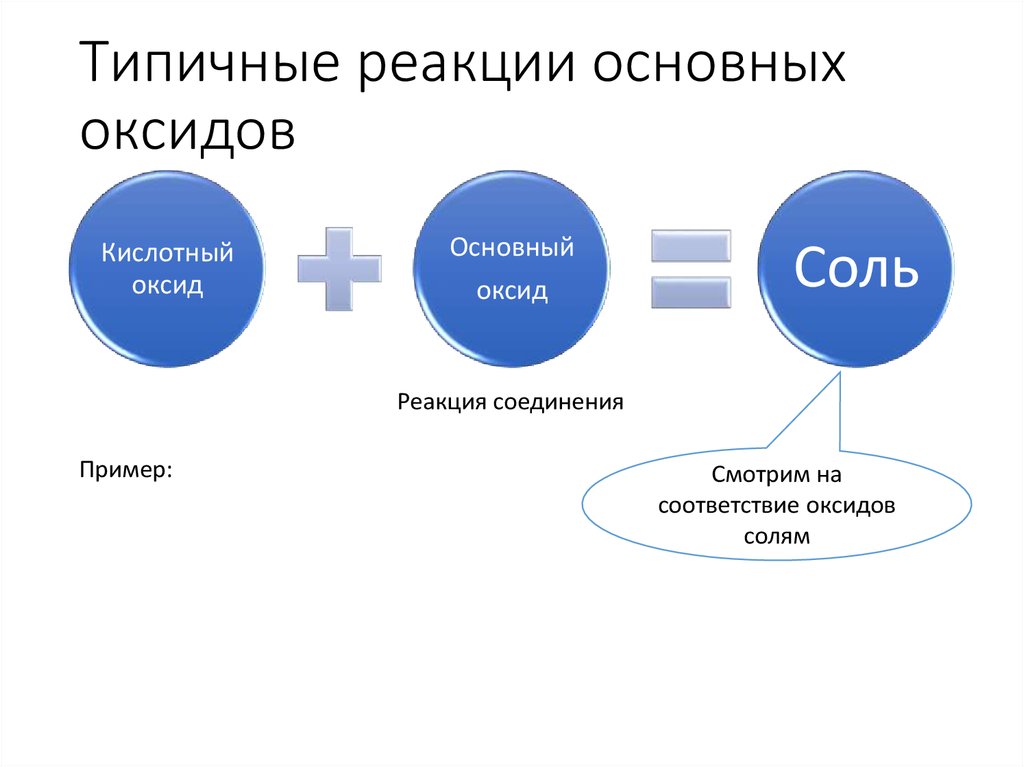
8. Типичные реакции основных оксидов
Кислотныйоксид
Основный
оксид
Соль
Реакция соединения
Пример:
Смотрим на
соответствие оксидов
солям
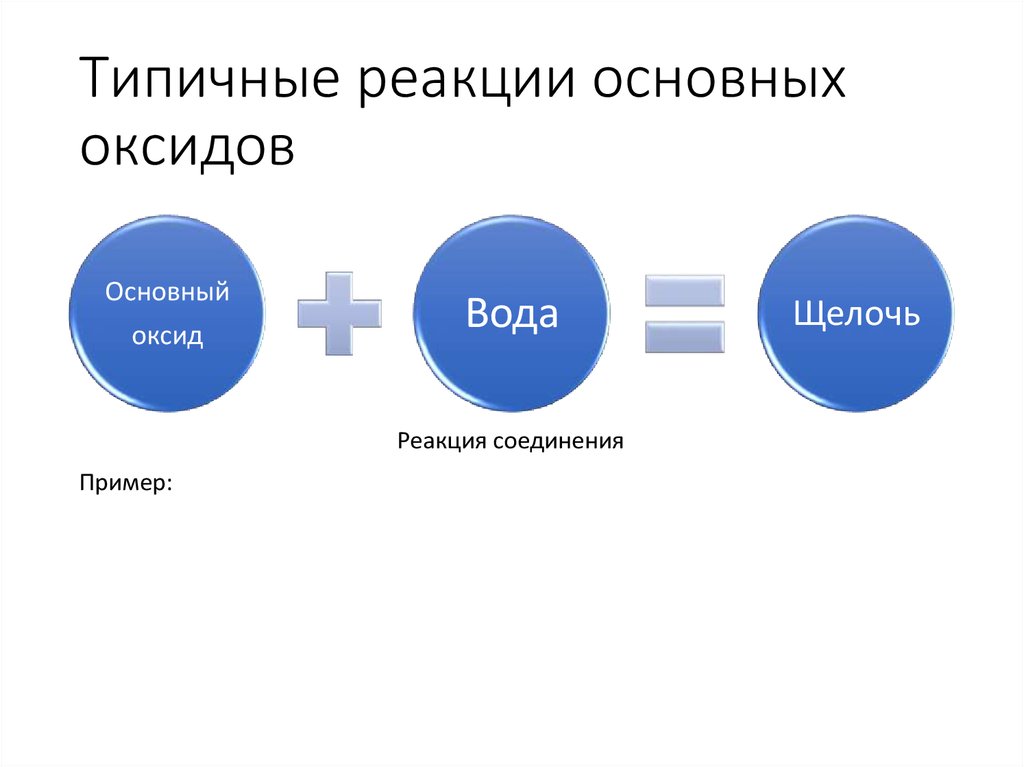
9. Типичные реакции основных оксидов
Основныйоксид
Вода
Реакция соединения
Пример:
Щелочь
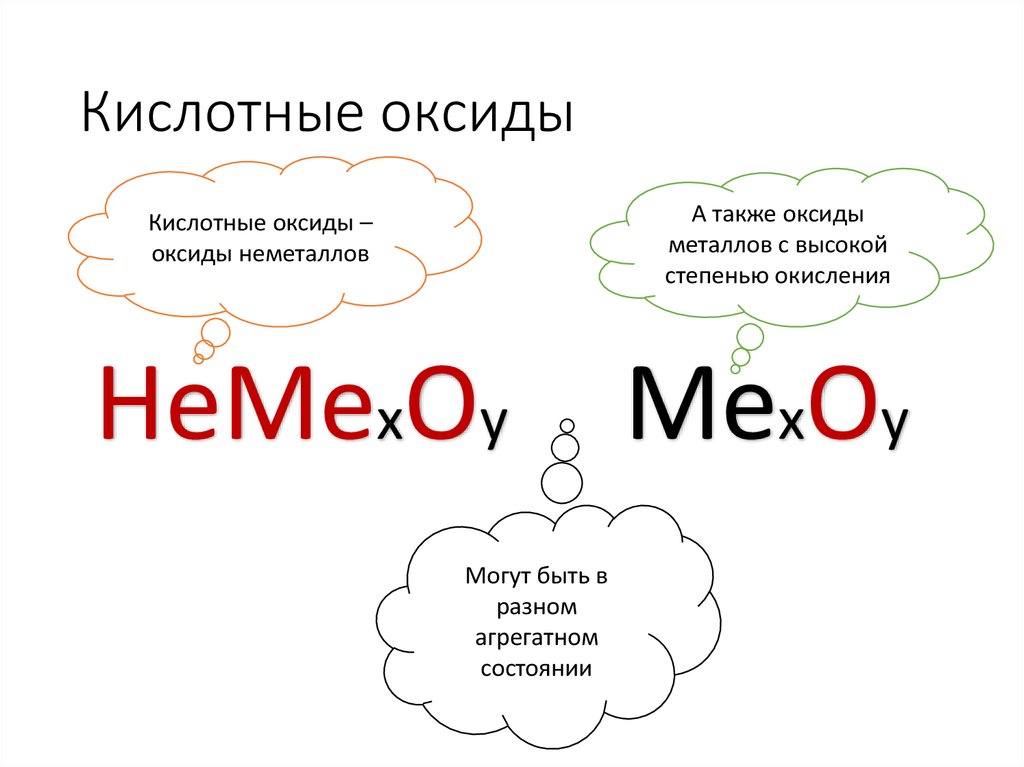
10. Кислотные оксиды
А также оксидыметаллов с высокой
степенью окисления
Кислотные оксиды –
оксиды неметаллов
НеМехОу
Могут быть в
разном
агрегатном
состоянии
МехОу
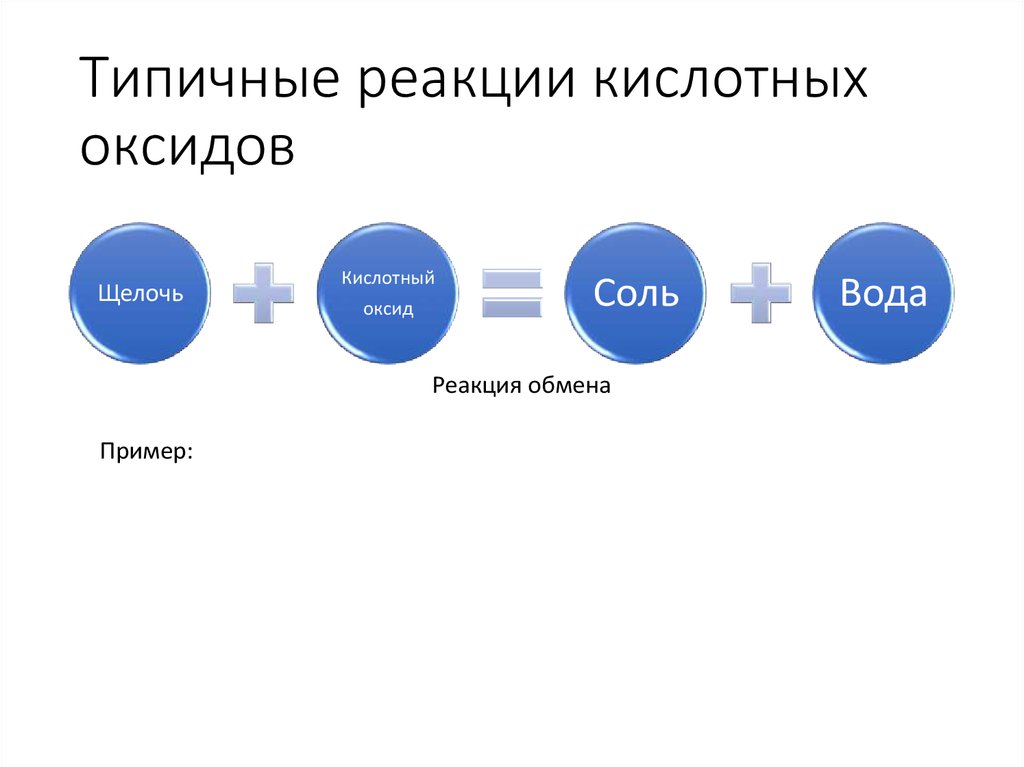
11. Типичные реакции кислотных оксидов
ЩелочьКислотный
оксид
Соль
Реакция обмена
Пример:
Вода
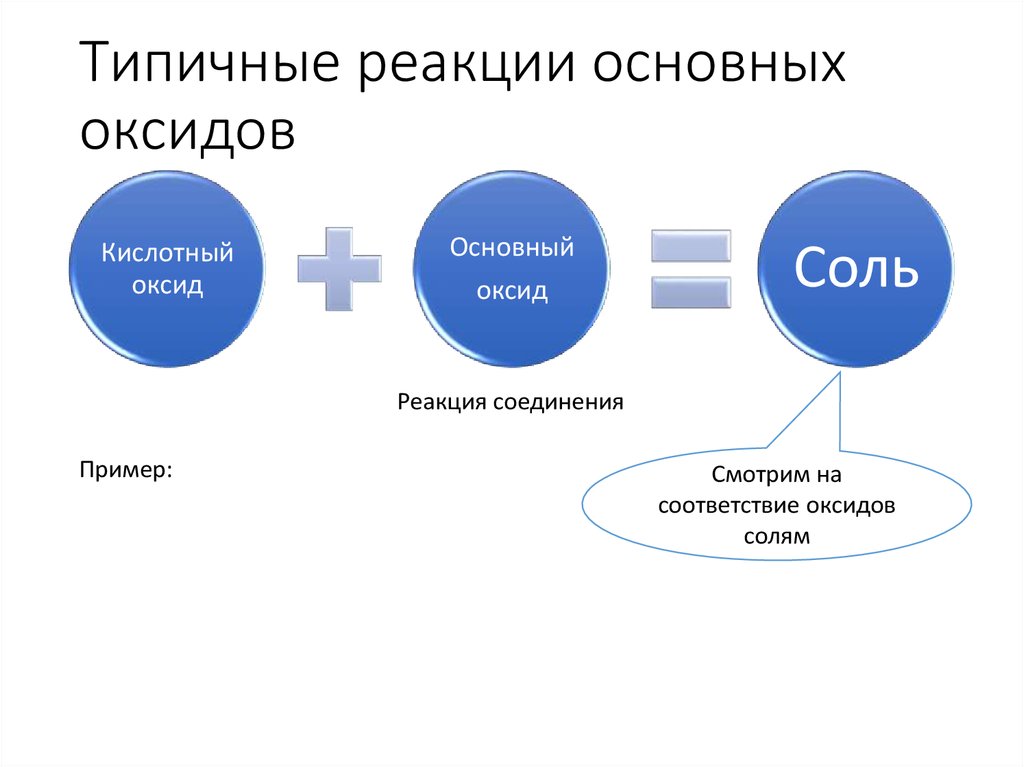
12. Типичные реакции основных оксидов
Кислотныйоксид
Основный
оксид
Соль
Реакция соединения
Пример:
Смотрим на
соответствие оксидов
солям
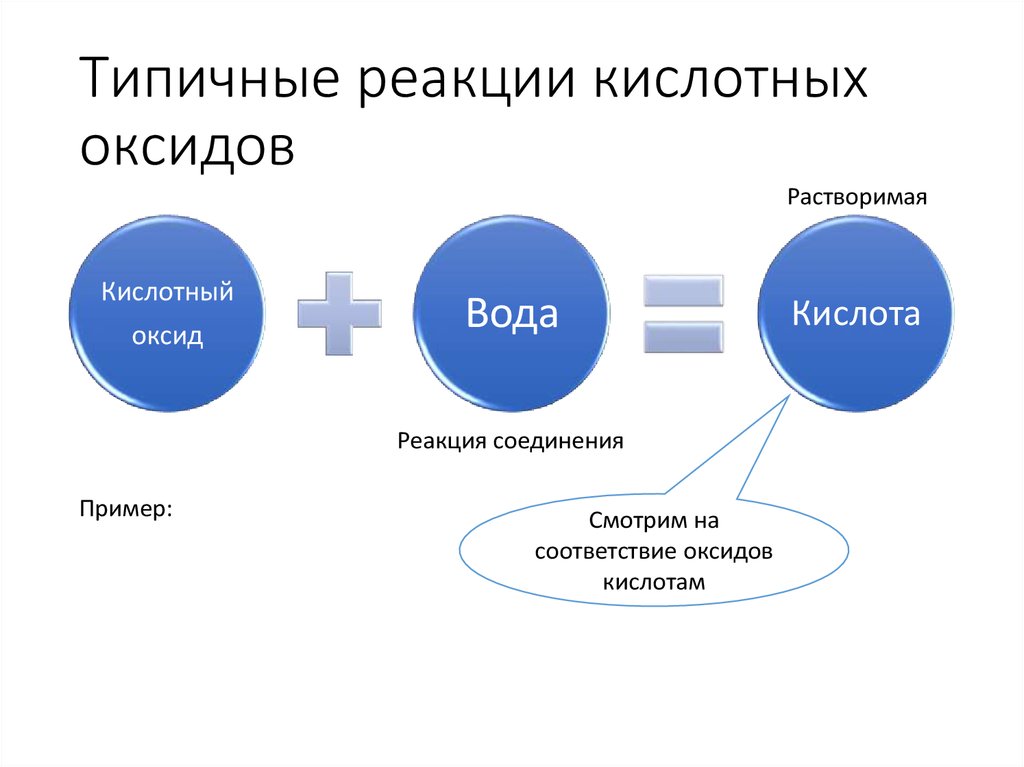
13. Типичные реакции кислотных оксидов
РастворимаяКислотный
оксид
Вода
Реакция соединения
Пример:
Смотрим на
соответствие оксидов
кислотам
Кислота





 Химия
Химия








