Похожие презентации:
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
1. Занятие 6 Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи.
2. ОКСИДЫ
3.
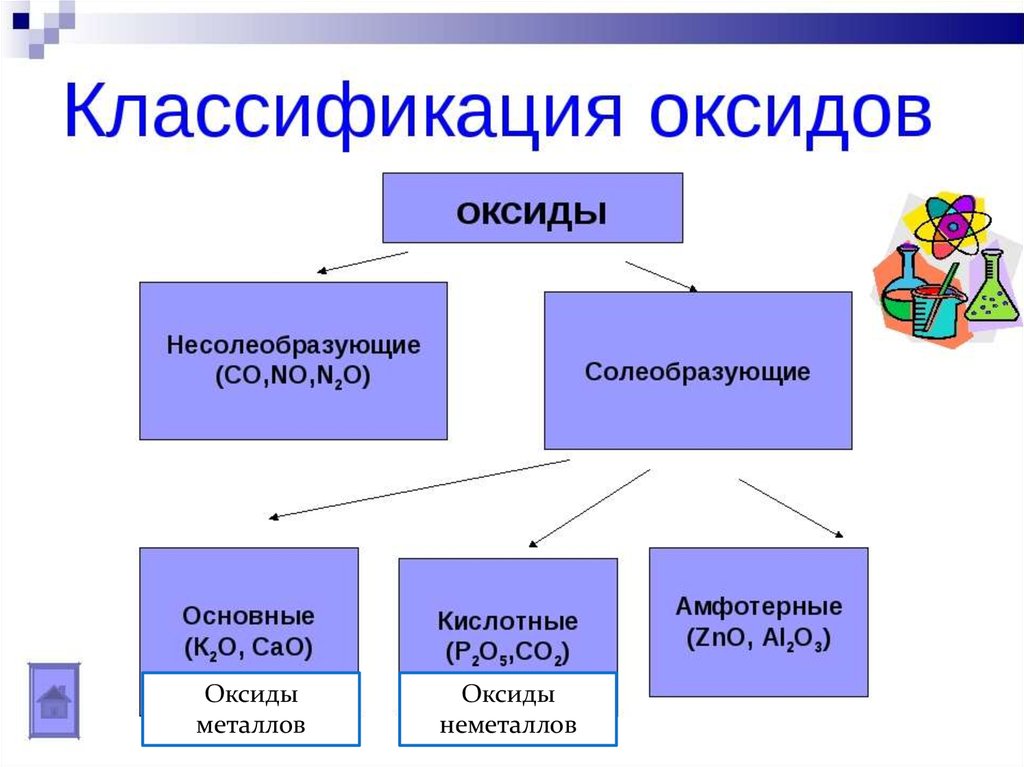
4. Классификация оксидов
Оксидыметаллов
Оксиды
неметаллов
5.
6.
7.
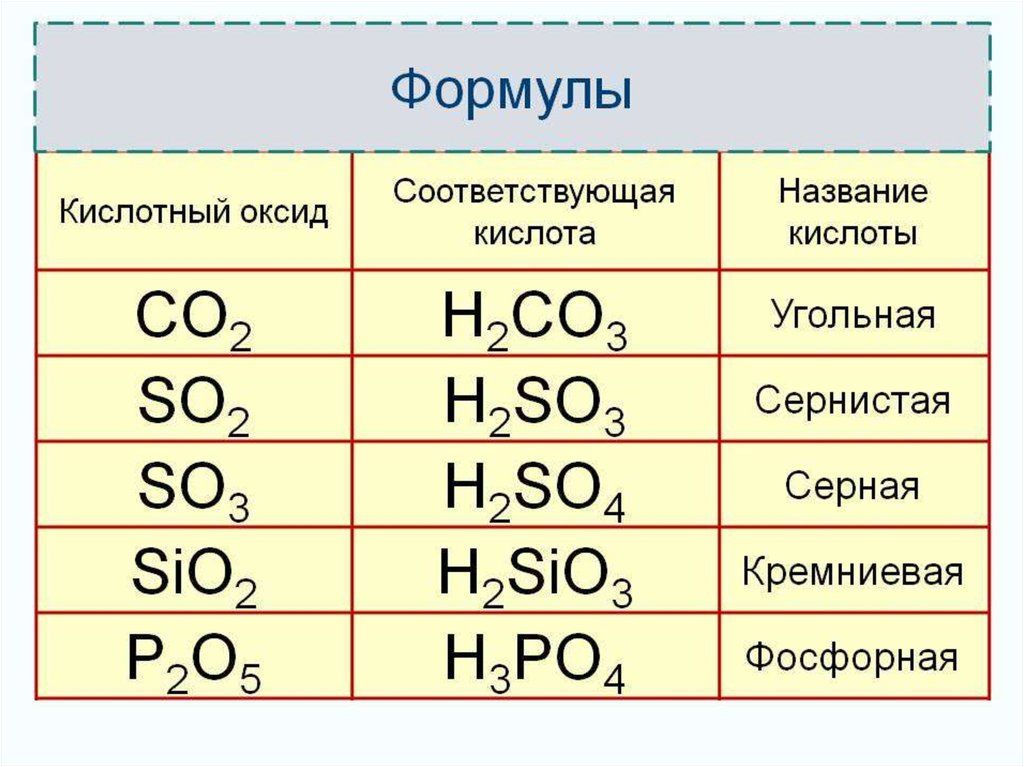
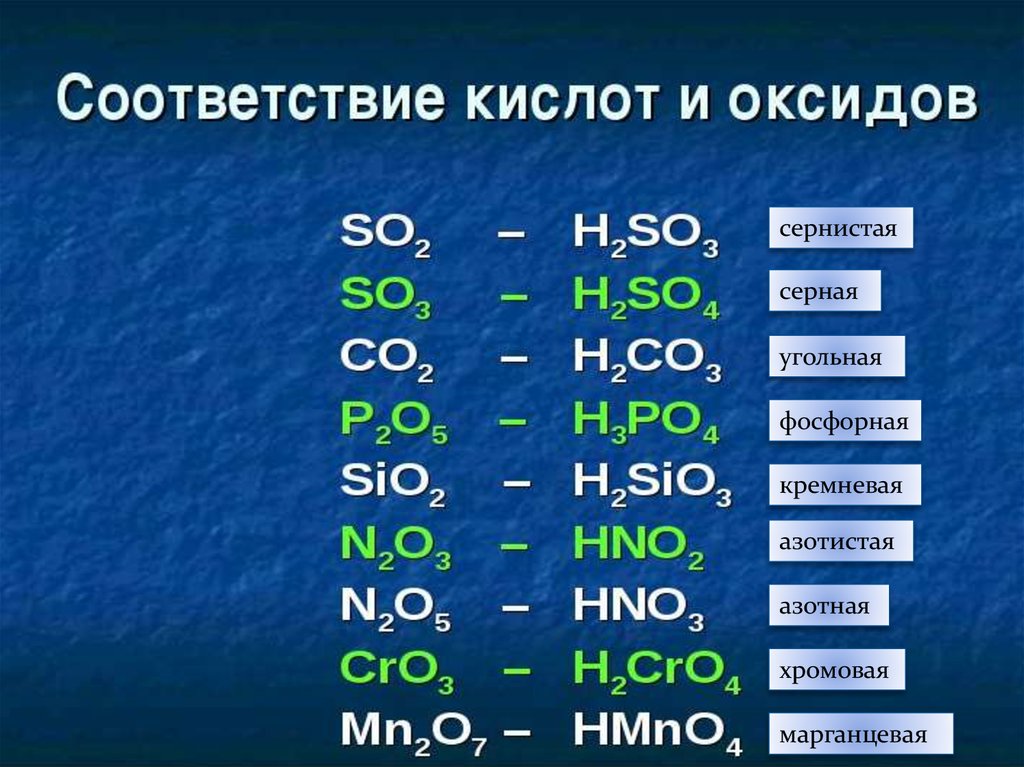
сернистаясерная
угольная
фосфорная
кремневая
азотистая
азотная
хромовая
марганцевая
8.
Гидроксид натрия9. Реакции оксидов с водой
10. Реакции оксидов с водой
11. ПОХИМИЧИМ!!!
12. Другие характерные реакции оксидов.
(кислотный О. + основный О.)13. Дальнейшее окисление оксидов
14. Взаимодействие оксидов с кислотами/щелочами.
15. Взаимодействие оксидов с элементами
16. Кислоты и щёлочи
Более подробно свойства этих классов соединенийбудут нами рассмотрены через урок.
Сейчас хотелось бы обратить ваше внимание
только на реакцию образования, характерную для
ещё одного класса химических соединений –
СОЛЕЙ.
17.
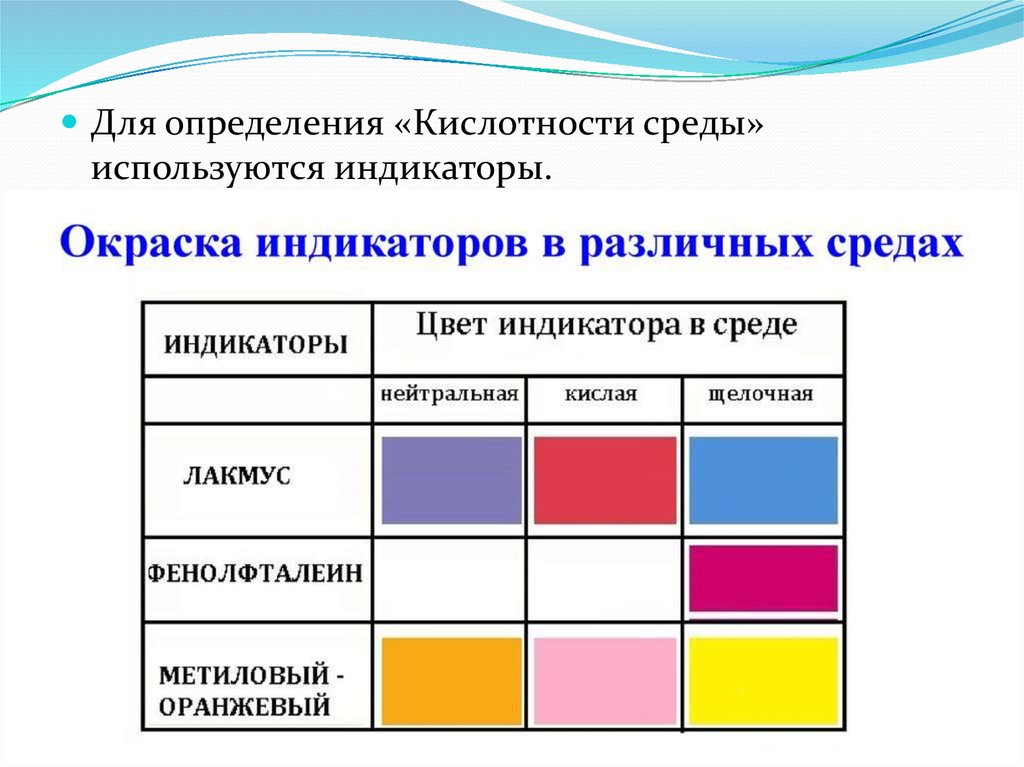
Для определения «Кислотности среды»используются индикаторы.
18. Получение солей
Реакция нейтрализацииСоли можно получить, например, при
взаимодействии кислот с щелочами (кислотноосновное взаимодействие).
(тут будут примеры реакций)
19. ПОХИМИЧИМ!!!
Посмотрим окраску индикаторов полученногораствора хромовой кислоты, гидроксида калия и
раствора, через который пропускают углекислый
газ.
А также изменение окраски индикатора при
нейтрализации раствора.
20. Вода
Кроме реакций с оксидами с образованием щелочейи кислот вода также может реагировать с
некоторыми элементами.
Так, вам будет полезно знать реакцию воды с
активными металлами.
21.
22. ПОХИМИЧИМ!!!
Посмотрим взаимодействие металлическогонатрия с водой, а также будем контролировать
щелочность раствора фенолфталеином.
23.
Пока что на этом всё…Переваривайте информацию, обязательно
откройте ещё разок дома эту презентацию и всё
повторите. Задавайте вопросы, спасибо за
внимание!



















 Химия
Химия








