Похожие презентации:
Типы химических реакций
1. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
2. Химические реакции
Cu(OH)2 → CuO + H2OFe + S → FeS
CuO → Cu + O2
По каким признакам
можно
классифицировать
приведённые
реакции?
Mg + HCl → MgCl2 + H2
AlCl3 + KOH → Al(OH)3 + KCl
CaO + H2O → Ca(OH)2
2 H2 + O2 → 2 H2O
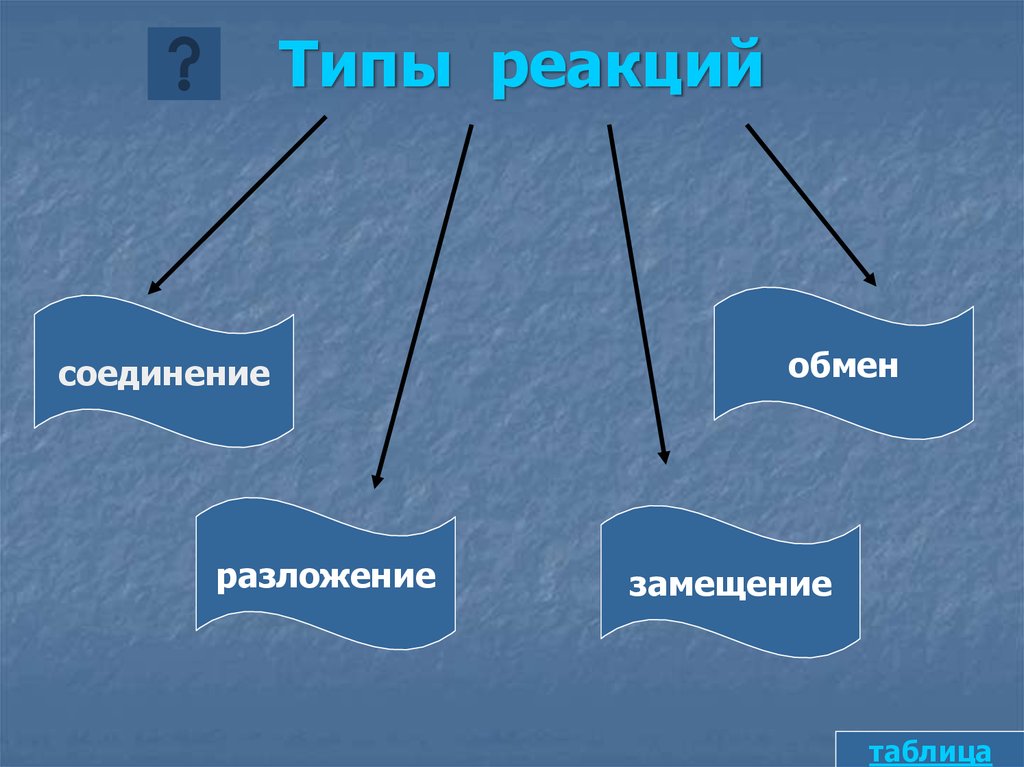
3. Типы реакций
соединениеразложение
обмен
замещение
таблица
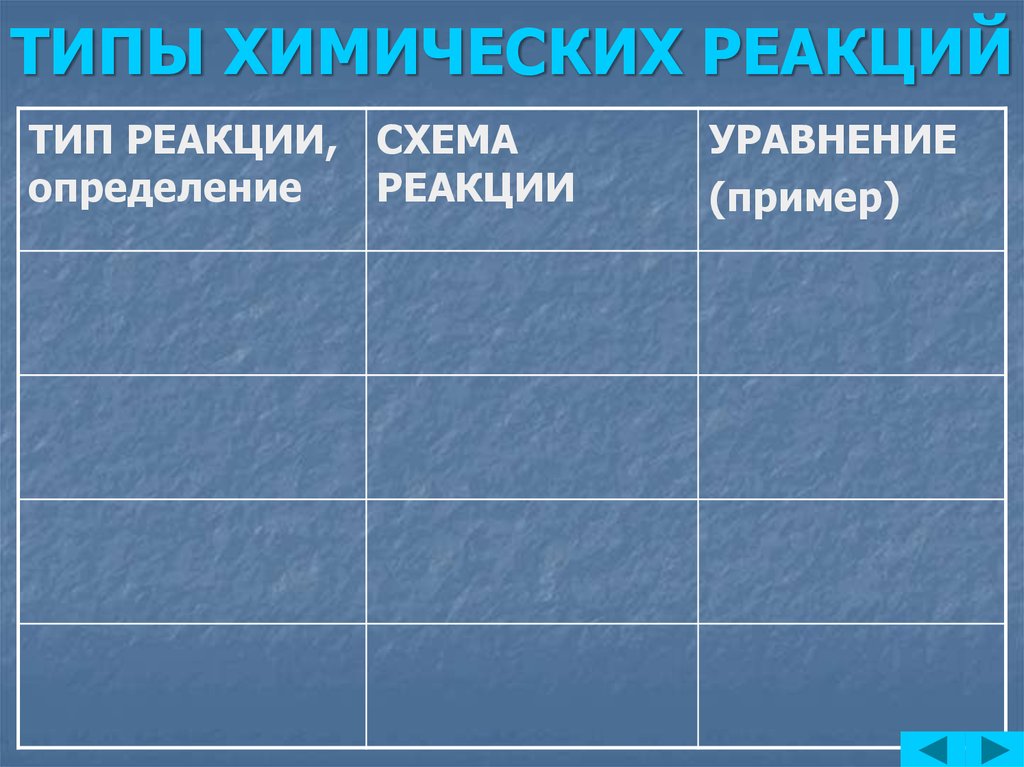
4. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
ТИП РЕАКЦИИ, СХЕМАопределение
РЕАКЦИИ
УРАВНЕНИЕ
(пример)
5. Взаимодействие меди и хлора
СОЕДИНЕНИЕCu + Cl2 → CuCl2
медь + хлор
→
хлорид
меди (II)
А + В → АВ
простое
вещество
простое
вещество
сложное
вещество
6. Нагревание дихромата аммония
РАЗЛОЖЕНИЕ(NH4)2Cr2O7 → Cr2O3 + N 2 + 4 H2O
дихромат
аммония
→
оксид + азот +
хрома(III)
вода
АВС → ВС + А + АС
сложное
вещество
менее сложное
вещество
АВ → А
сложное
вещество
простое
вещество
простое
вещество
+ В
простое
вещество
менее сложное
вещество
7. Взаимодействие меди и нитрата ртути
ЗАМЕЩЕНИЕCu + Hg (NO)2 → Cu(NO)2 + Hg
Медь + нитрат ртути → нитрат меди +
ртуть
А + ВС → АС + В
простое
вещество
сложное
сложное
простое
вещество вещество вещество
8. Взаимодействие кислоты и основания
ОБМЕНCu(OH)2 + H2SO4→CuSO4 + 2H2O
Гидроксид + серная → сульфат + вода
меди (II)
кислота
меди (II)
АВ + СД → АД + СВ
Сложное
вещество
сложное
вещество
сложное
вещество
сложное
вещество
9. Домашнее задание.
Прочитать §§ 30 – 33, заполнить таблицу,выполнить упражнения:
упр. 1 стр. 177
упр. 2 стр. 182
упр. 2 стр. 187
упр. 4 стр. 191-192
8АБГ, доделать таблицу начатую в классе,
8Б выполняет задание по презентации.







 Химия
Химия








