Похожие презентации:
Амины - производные аммиака
1.
2.
3.
Амины – это производные аммиака, в молекуле которого один,два или три атома водорода замещены на углеводородный
радикал.
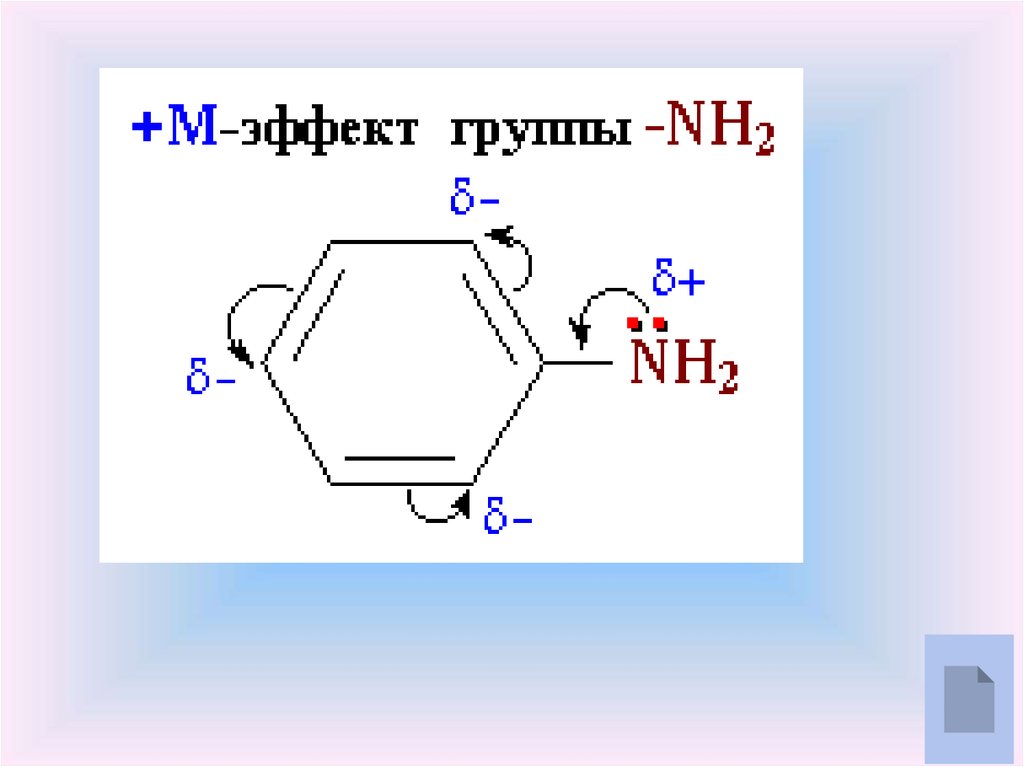
Наличие неподелённой пары электронов у атома азота объясняет общие
свойства аминов и аммиака
4.
Модель молекулы метиламина5.
6.
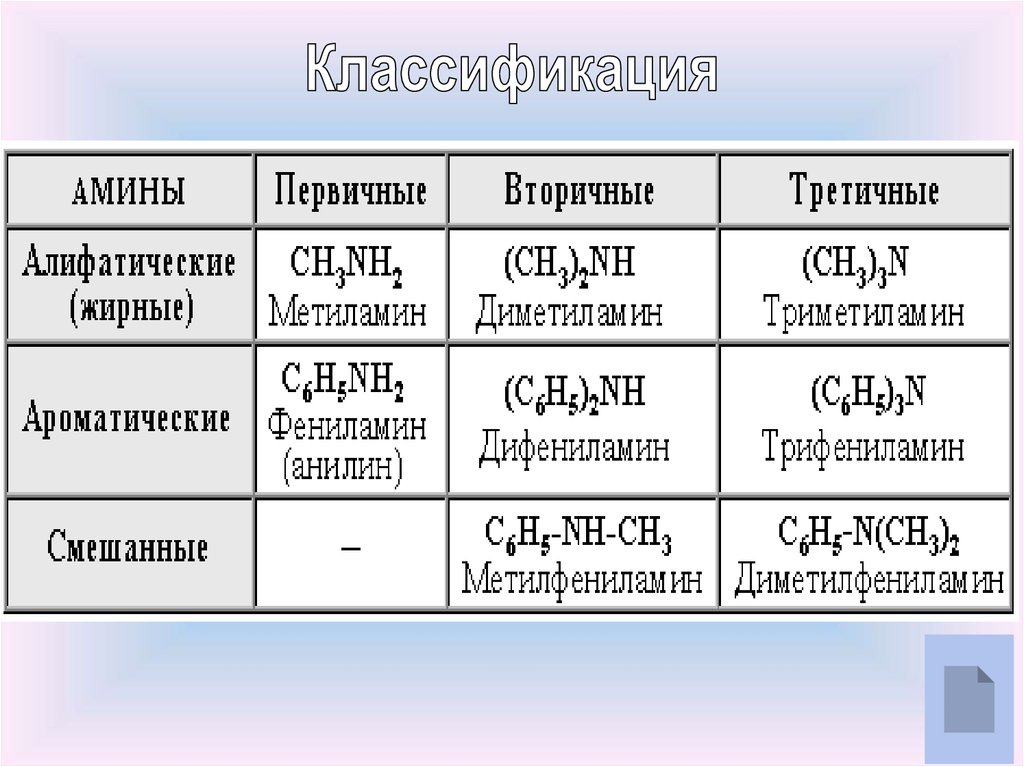
Номенклатура аминов7.
8.
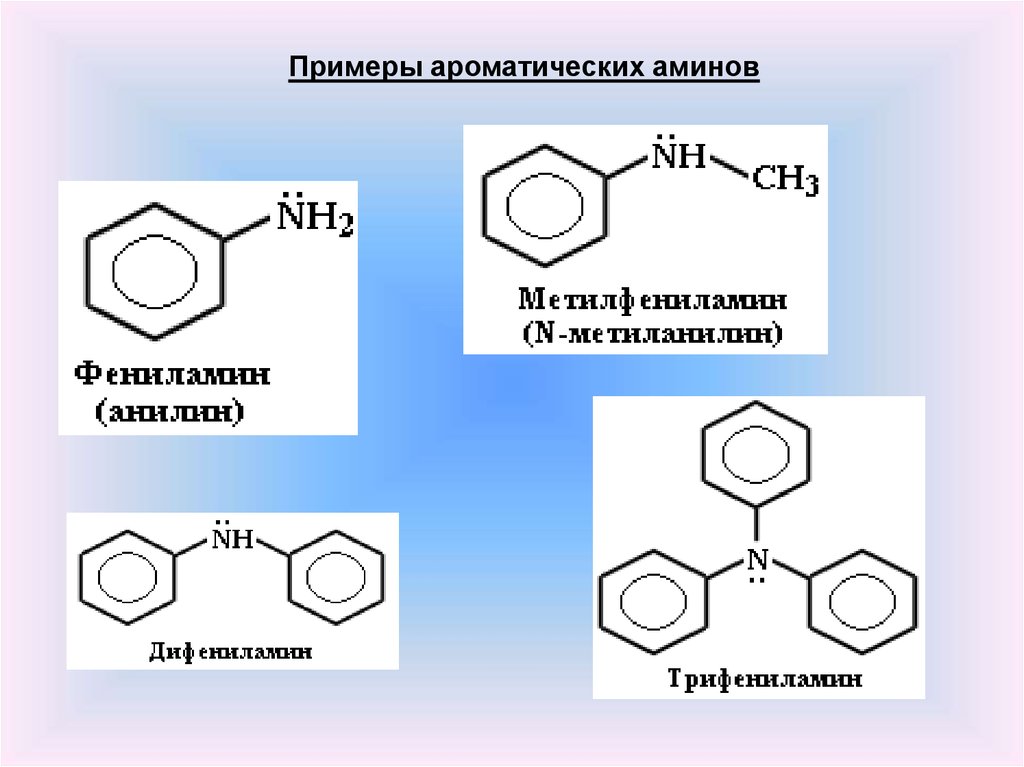
Примеры ароматических аминов9.
Модели молекул фениламина (анилина)10.
Структурная изомерия- углеродного скелета, начиная с С4H9NH2
- положения аминогруппы, начиная с С3H7NH2
- изомерия аминогруппы, связанная с изменением
степени замещенности атомов водорода при
азоте
Пространственная изомерия
Возможна оптическая изомерия, начиная с С4H9NH2
11.
При обычной температуре только низшиежирные амины CH3NH2, (CH3)2NH, (CH3)3N –
газы (с запахом аммиака), средние амины –
жидкости с резким запахом гниющей рыбы,
высшие – твердые вещества без запаха.
Амины способны к образованию водородных
связей с водой.
Поэтому низшие амины хорошо растворимы в
воде. С увеличением числа и размеров
углеводородных радикалов растворимость
аминов в воде уменьшается, т.к.
увеличиваются пространственные
препятствия к
образованию водородных связей.
Ароматические амины – бесцветные жидкости
и твердые вещества с неприятным запахом, в
воде практически не растворяются.
12.
Взаимодействие с кислотамиВзаимодействие с водой
Реакции окисления
13.
Основные свойства аминов:CH3-NH2 + HCl
метиламин
CH3-NH2 + H2O
метиламин
(CH3-NH3)Cl
хлорид метиламмония
(CH3-NH3)OH
гидроксид метиламмония
14.
Для ароматических аминов характерны также реакции замещения вбензольном ядре
Бромирование анилина
15.
Амины способны окисляться с образованием различных продуктов,строение которых зависит от типа амина и условий реакции.
Например, при действии перманганата калия на первичные
ароматические амины образуются нитропроизводные аренов:
KMnO4
С6H5NH2 + 3[O] С6H5NO2 + H2O
анилин
нитробензол
Ароматические амины легко окисляются на воздухе, приобретая при
этом темную окраску.
Полное окисление аминов происходит при их горении:
4СH3NH2 + 9O2 4CO2 + 10H2O + 2N2
В отличие от аммиака, амины способны воспламеняться от
открытого пламени.
16.
Амины получают из галогеноалканов и аммиака.Анилин в промышленности получают по реакции Зинина:
C6H5NO2 + 6H
нитробензол
C6H5NH2 + H2O
анилин
Атомарный водород образуется при действии соляной кислоты на
чугунную стружку
17.
Реакции алкилирования аминовЭтим способом получают из первичных аминов вторичные и
третичные, а из вторичных – третичные. Процесс идет через
образование солей алкиламмония, которые при нагревании
превращаются амины.
Например:
t C
CH3NH2 + C2H5Cl [(CH3)2NH2]+Cl– (CH3)2NH + HCl
метиламин
хлорид диметилдиметиламин
аммония
В избытке алкилгалогенида образуется третичные амины:
t C
CH3NH2 + 2C2H5Br
CH3N(C2H5)2 + 2HBr
метиламин
метилдиэтиламин














 Химия
Химия








