Похожие презентации:
Соединения галогенов
1. Соединения галогенов
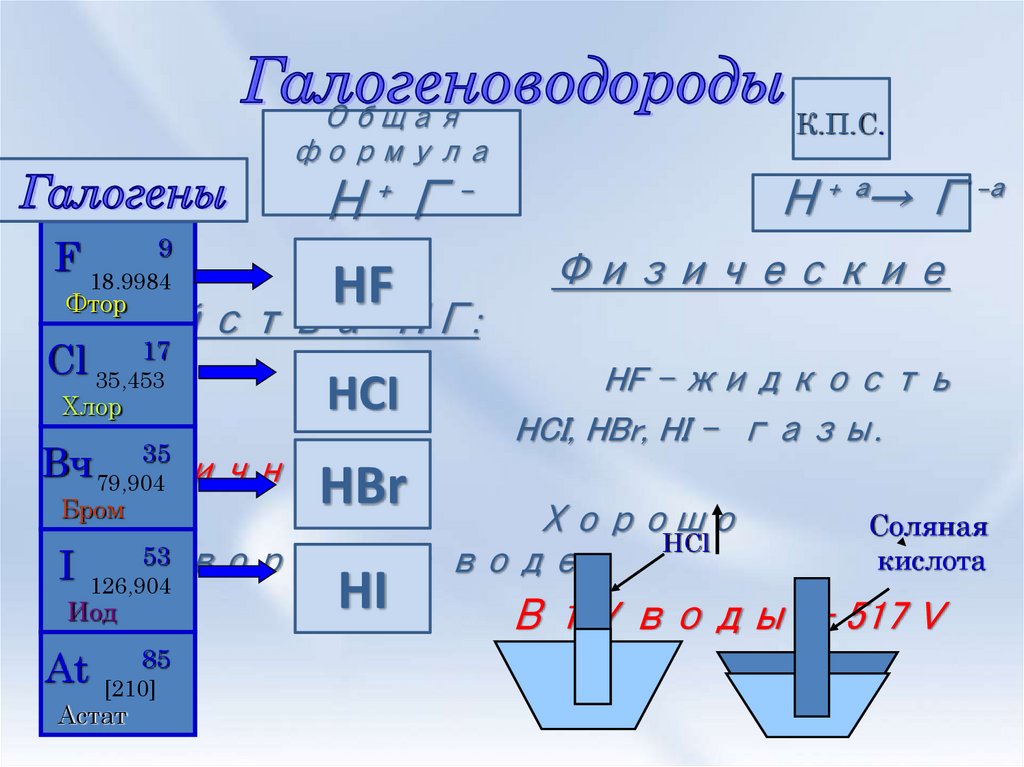
2. Галогеноводороды
Общаяформула
К.П.С.
Н⁺ Г⁻
F 18,99849
HF
Физические
HCI
HF – жидкость
HCI, HBr, HI - газы.
Фтор
свойства
НГ:
17
Cl 35,453
Хлор
35
Вч
Токсичны!!!
79,904
Бром
Н⁺ ª→ Г⁻ª
HBr
Хорошо
HCl
53
растворимы
в воде
I
126,904
Иод
HCI↑85
At
[210]
Астат
HI
Соляная
кислота
В 1 V воды - 517 V
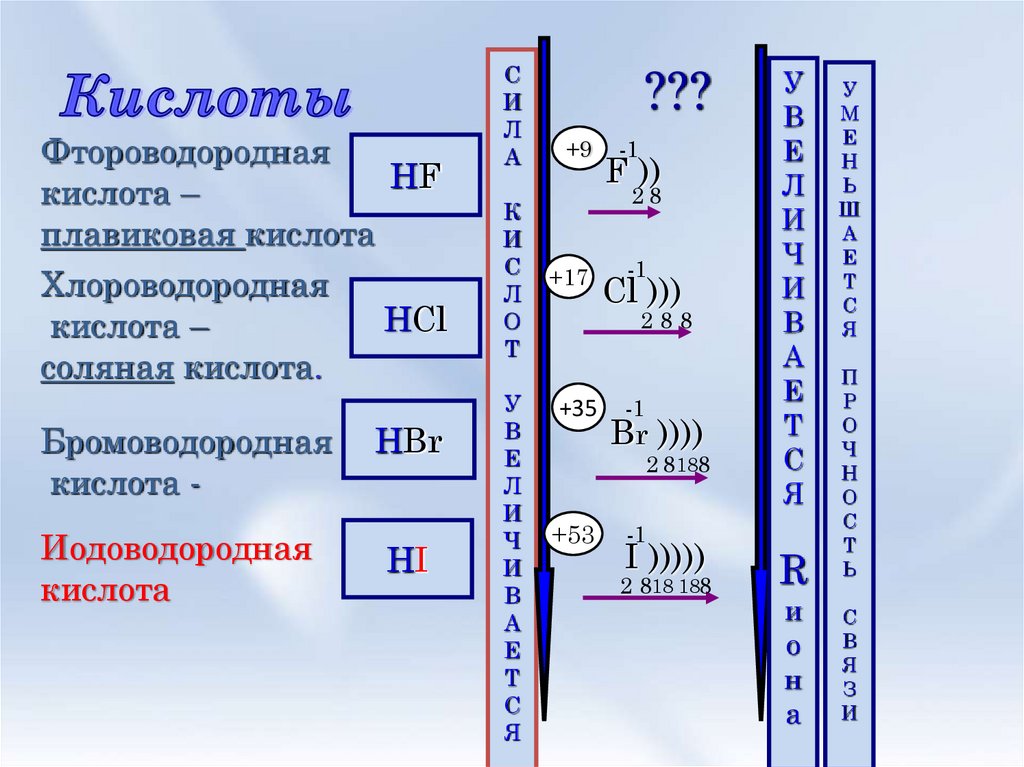
3. Кислоты
ФтороводороднаяHF
кислота –
плавиковая кислота
Хлороводородная
HCl
кислота –
соляная кислота.
Бромоводородная
кислота Иодоводородная
кислота
HBr
HI
С
И
Л
А
К
И
С
Л
О
Т
У
В
Е
Л
И
Ч
И
В
А
Е
Т
С
Я
???
+9
-1
F ))
28
+17
-1
Cl )))
288
+35
-1
Br ))))
2 8188
+53
-1
I )))))
2 818 188
У
В
Е
Л
И
Ч
И
В
А
Е
Т
С
Я
R
и
о
н
а
У
М
Е
Н
Ь
Ш
А
Е
Т
С
Я
П
Р
О
Ч
Н
О
С
Т
Ь
С
В
Я
З
И
4. Почему сила кислоты HJ>HF ?
Почему сила кислотыHJ>HF ?
F
J
+9
2
7
+53
2
Радиус атома
J>F
8
18 18 7
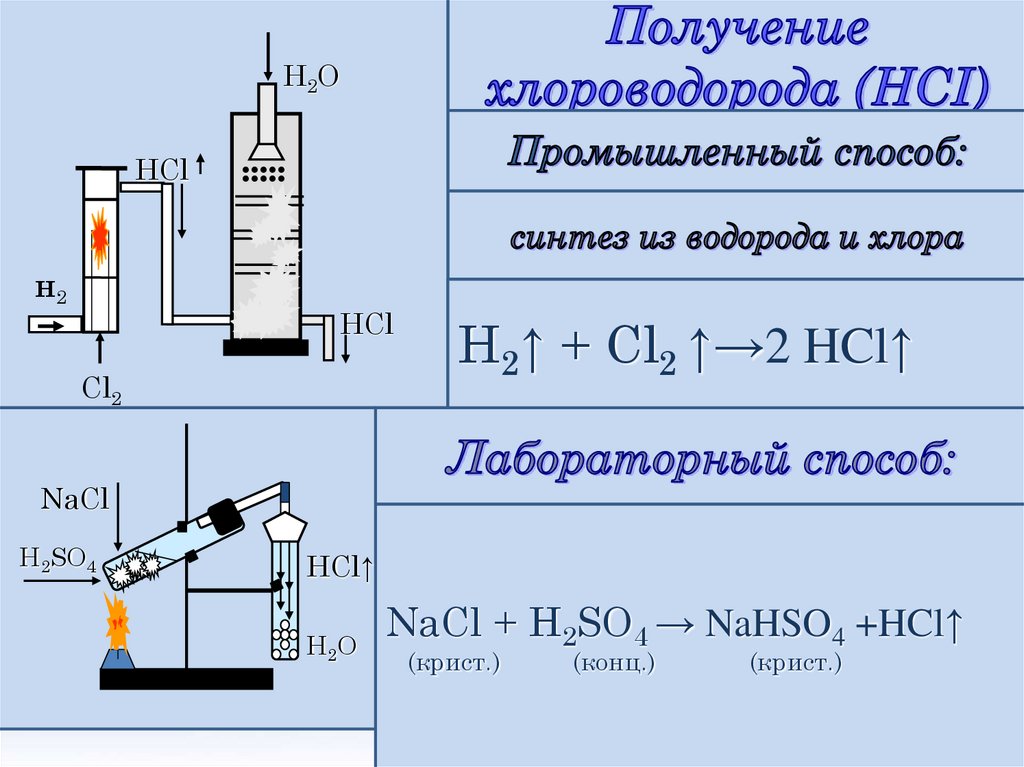
5.
H2OHCl
н2
••••
••••
HCl
Cl2
H2↑ + Cl2 ↑→2 HCl↑
NaCl
H2SO4
HCl↑
H2 O
NaCl + H2SO4 → NaHSO4 +HCl↑
(крист.)
(конц.)
(крист.)
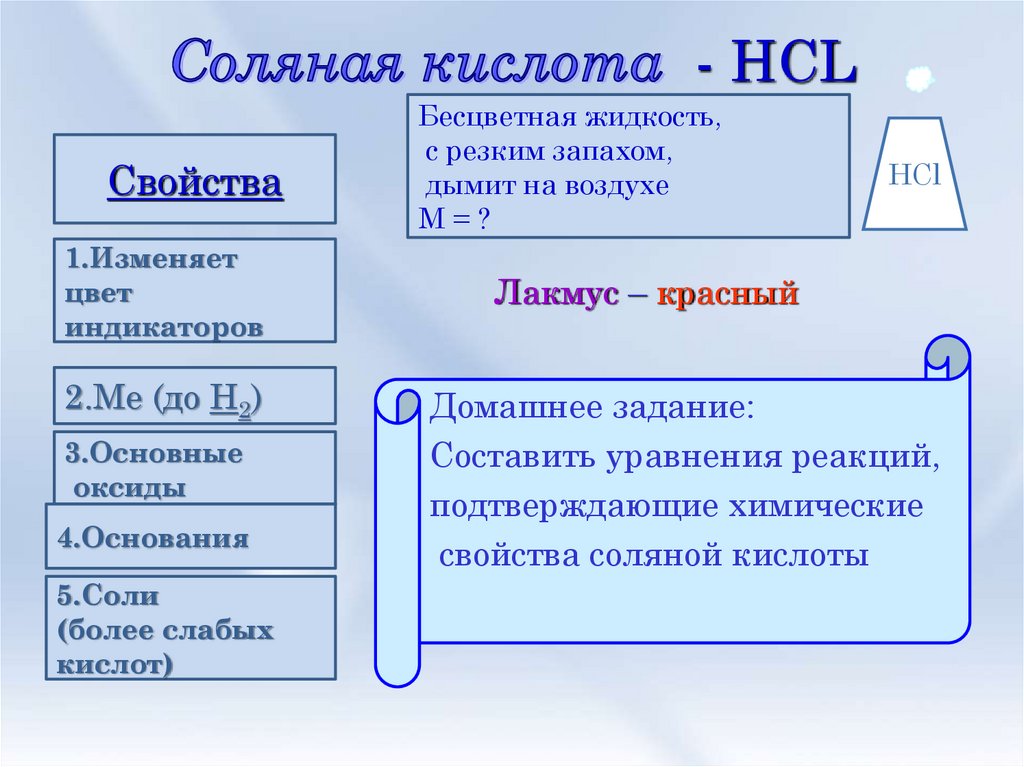
6. Соляная кислота - HCL
- HCLСвойства
1.Изменяет
цвет
индикаторов
2.Ме (до Н2)
3.Основные
оксиды
4.Основания
5.Соли
(более слабых
кислот)
Бесцветная жидкость,
с резким запахом,
дымит на воздухе
М=?
HCl
Лакмус – красный
Домашнее задание:
Составить уравнения реакций,
подтверждающие химические
свойства соляной кислоты
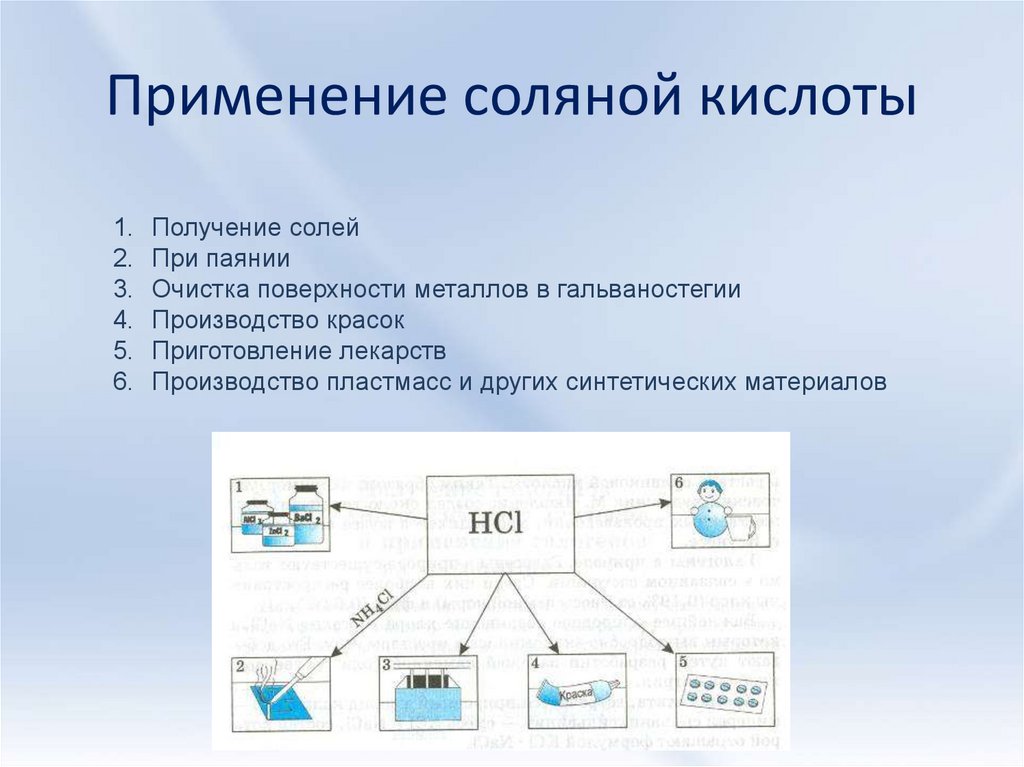
7. Применение соляной кислоты
1. Получение солей2. При паянии
3. Очистка поверхности металлов в гальваностегии
4. Производство красок
5. Приготовление лекарств
6. Производство пластмасс и других синтетических материалов
8. Галогеноводородные кислоты
Формула кислотыНазвание кислоты
Название солей
HF
Фтороводородная
Фториды
HCI
хлороводородная
Хлориды
HBr
бромоводородная
Бромиды
HI
иодоводородная
Иодиды
9.
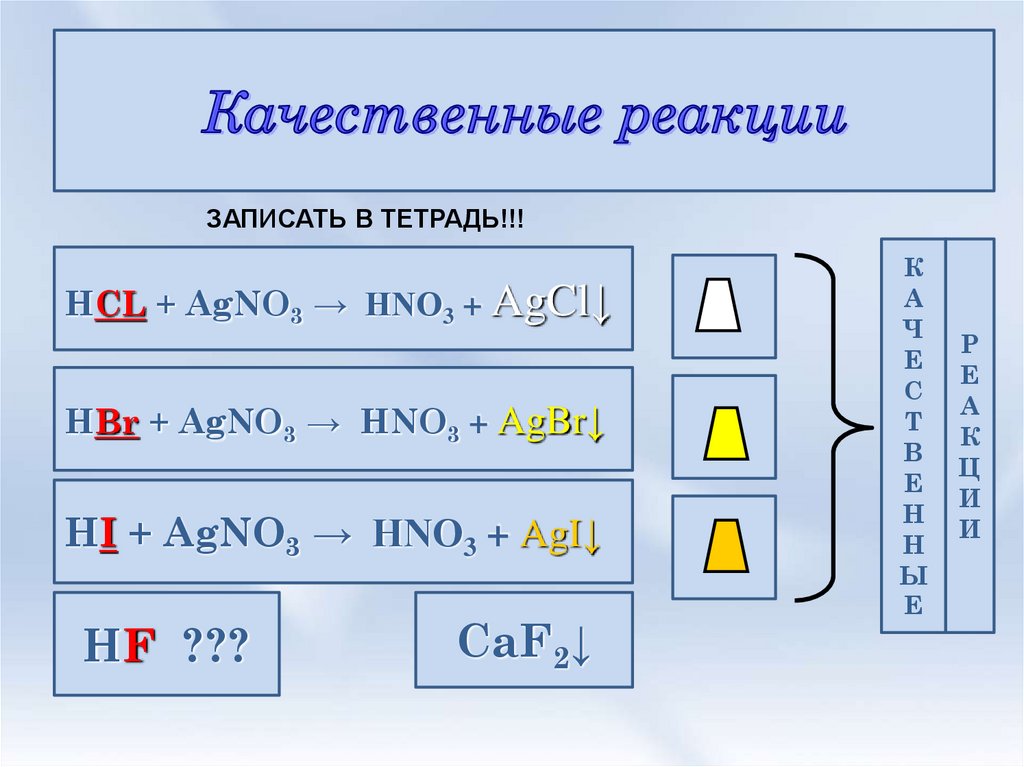
ЗАПИСАТЬ В ТЕТРАДЬ!!!HCL + AgNO3 → HNO3 + AgCl↓
HBr + AgNO3 → HNO3 + AgBr↓
HI + AgNO3 → HNO3 + AgI↓
HF ???
CaF2↓
К
А
Ч
Е
С
Т
В
Е
Н
Н
Ы
Е
Р
Е
А
К
Ц
И
И
10. Соли:
FCL
Соли:
фториды
фторид кальция(флюорид) CaF2
хлориды
хлорид натрия(галит)
NaCl
бромид серебра
AgBr
йодид калия
КJ
Br бромиды
J
йодиды
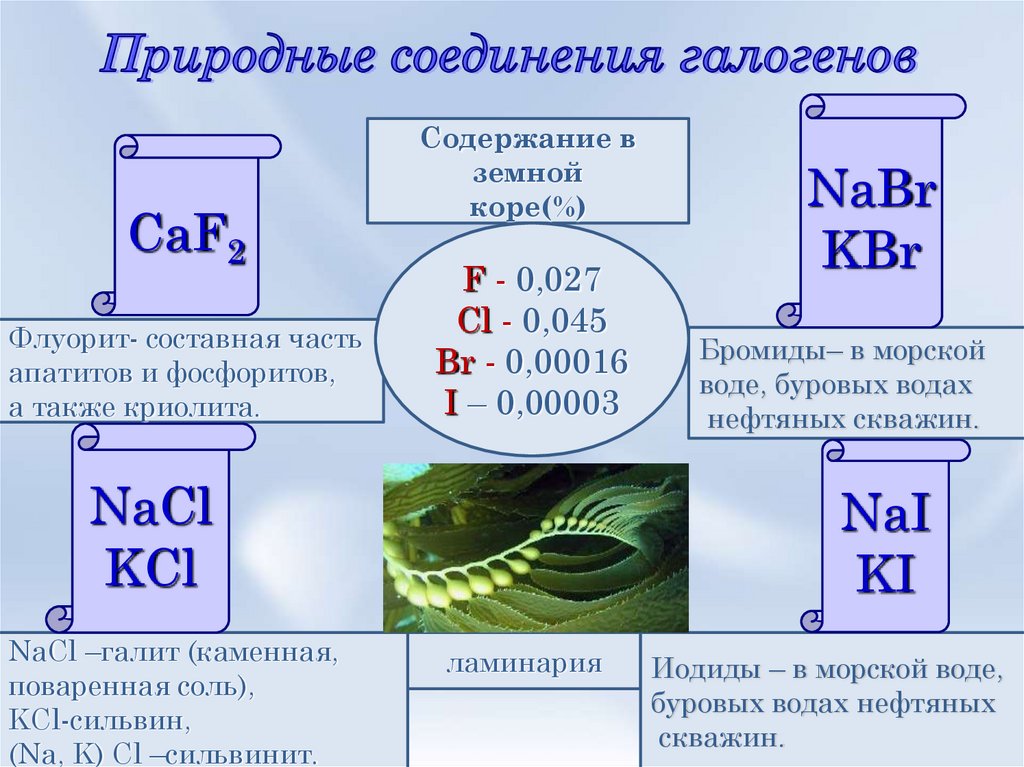
11. Природные соединения галогенов
CaF2Флуорит- составная часть
апатитов и фосфоритов,
а также криолита.
Содержание в
земной
коре(%)
F - 0,027
Cl - 0,045
Br - 0,00016
I – 0,00003
NaCl
KCl
NaCl –галит (каменная,
поваренная соль),
KCl-сильвин,
(Na, K) Cl –сильвинит.
NaBr
KBr
Бромиды– в морской
воде, буровых водах
нефтяных скважин.
NaI
KI
ламинария
Иодиды – в морской воде,
буровых водах нефтяных
скважин.
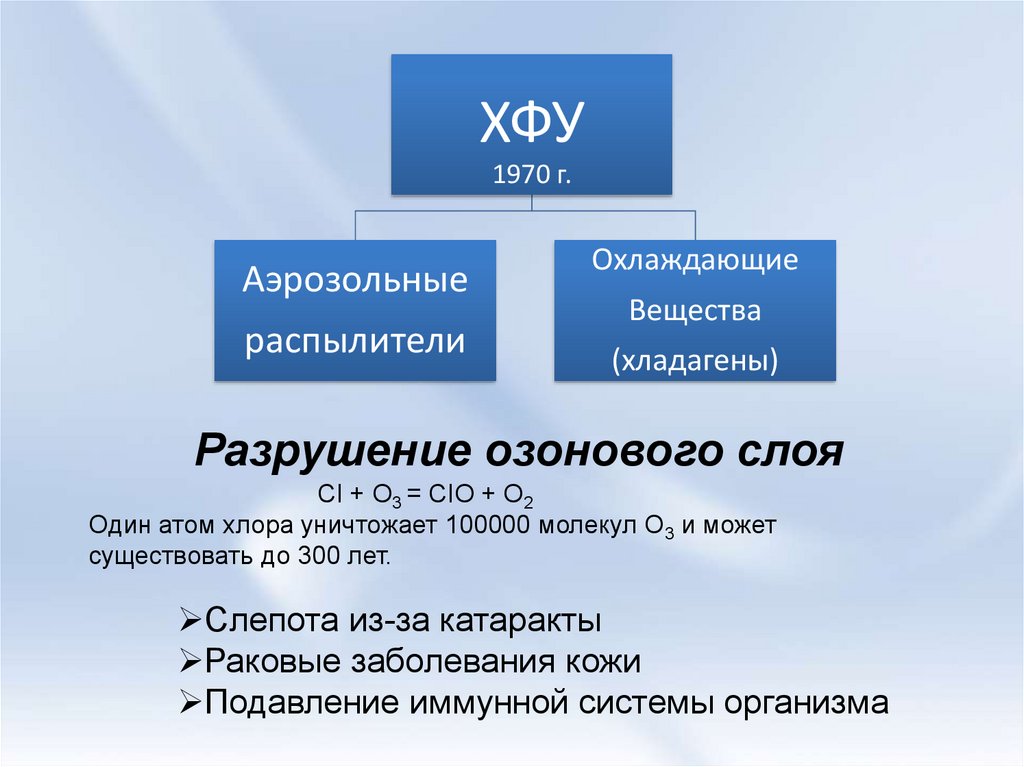
12.
ХФУ1970 г.
Аэрозольные
распылители
Охлаждающие
Вещества
(хладагены)
Разрушение озонового слоя
CI + O3 = CIO + O2
Один атом хлора уничтожает 100000 молекул O3 и может
существовать до 300 лет.
Слепота из-за катаракты
Раковые заболевания кожи
Подавление иммунной системы организма




 Химия
Химия








