Похожие презентации:
Механизмы органических реакций
1. Механизмы органических реакций
Санкт-Петербургский государственный университетМеханизмы
органических реакций
Карцова Анна Алексеевна
профессор СПбГУ,
доктор химических наук
Санкт-Петербург
2.
Механизм реакции- последовательность элементарных
стадий процесса, в результате
которого исходные вещества
превращаются в продукты
4
3.
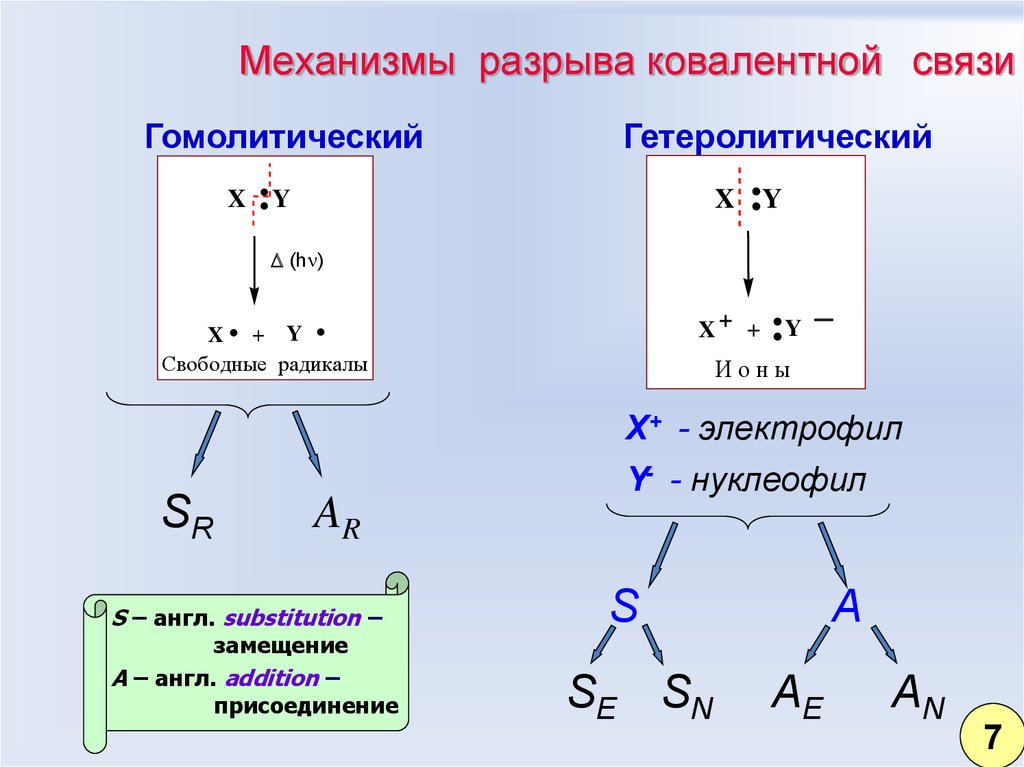
54. Механизмы разрыва ковалентной связи
ГомолитическийX
Гетеролитический
:Y
X
:Y
(h )
.
.
X+ +
X + Y
Свободные радикалы
:Y
Ионы
X+ - электрофил
SR
AR
S – англ. substitution –
замещение
A – англ. addition –
присоединение
Y- - нуклеофил
S
SE SN
A
AE
AN
7
5. Радикальное замещение SR
86.
CH4 + Cl2SR
h
CH3Cl + HCl
Механизм реакции замещения
I.
Cl Cl
h
1956 г. -
2Cl
(Начало цепи)
II. CH4 + Cl
CH3 + HCl
CH3Cl + Cl
CH3 + Cl2
……………………………………….
(рост цепи)
III. CH3 + Cl
Н.Н.
Семенов
(1896-1986)
Н.Н. Семенов,
С. Хиншельвуд
Нобелевская
премия по химии
«за исследования
в области механизма
химических реакций»
CH3Cl
(обрыв цепи)
9
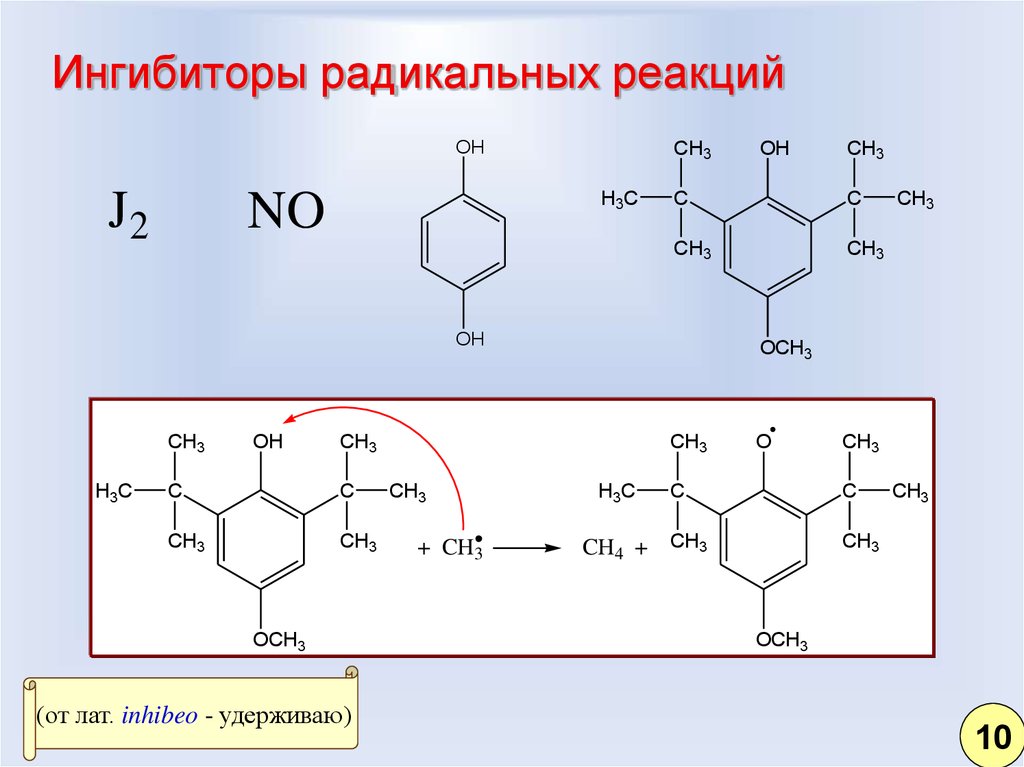
7. Ингибиторы радикальных реакций
OHJ2
CH3
H3C
NO
H3C
OH
C
CH3
CH3
C
CH3
CH3
OCH3
(от лат. inhibeo - удерживаю)
CH3
CH3
+ CH3
CH3
OCH3
CH3
C
CH3
C
OH
CH3
OH
H3C
O
C
CH3
C
CH4 + CH3
CH3
CH3
OCH3
10
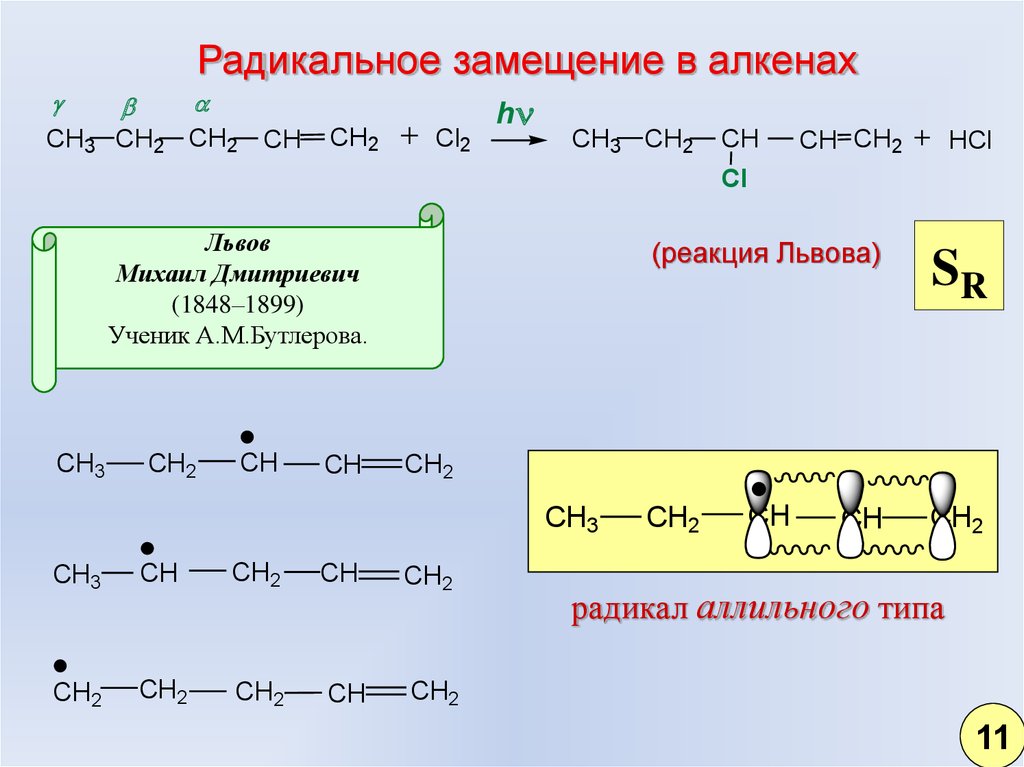
8.
Радикальное замещение в алкенахCH3 CH2 CH2
CH
CH2
Cl2
h
CH3 CH2
CH
CH CH2
HCl
Cl
Львов
Михаил Дмитриевич
(1848–1899)
Ученик А.М.Бутлерова.
CH3
CH2
CH
CH
(реакция Львова)
SR
CH
CH2
CH2
CH3
CH3
CH
CH2
CH
CH2
CH2
CH2
CH2
CH
CH2
CH2
CH
радикал аллильного типа
11
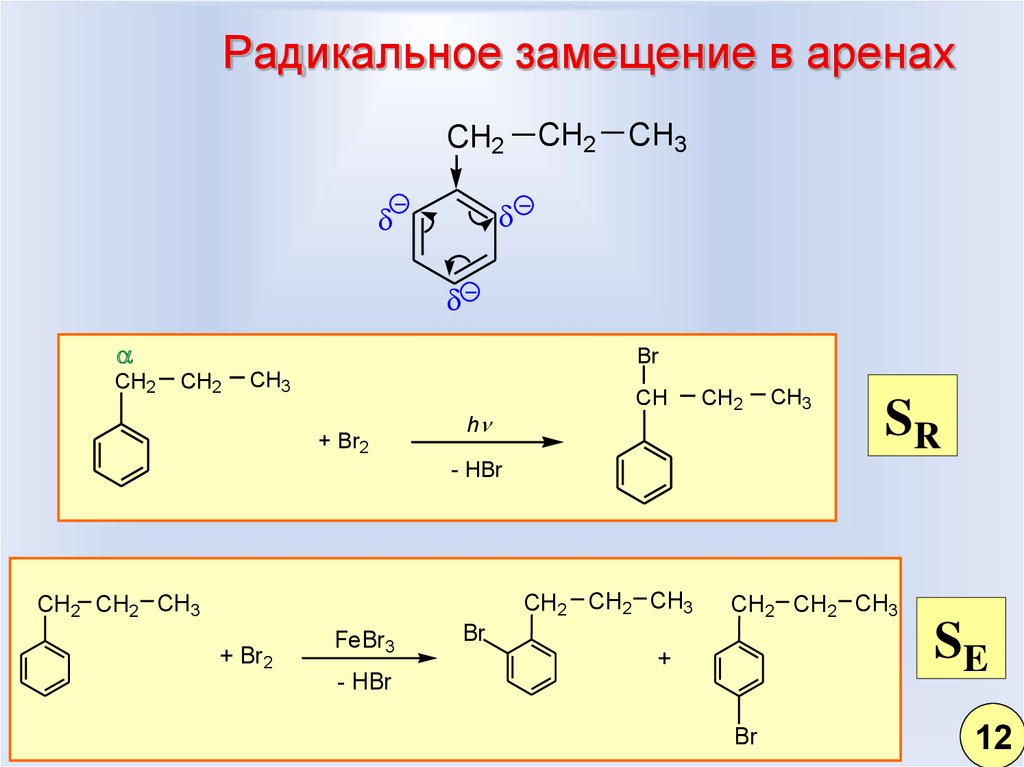
9. Радикальное замещение в аренах
CH2CH2
CH3
CH2
Br
CH2
CH3
+ Br2
h
CH
CH2
CH3
SR
- HBr
CH2 CH2 CH3
CH2 CH2 CH3
+ Br2
FeBr3
CH2 CH2 CH3
SE
Br
+
- HBr
Br
12
10.
HCH
CH2
CH3
CH2
CH
CH3
CH2
CH2
CH2
C
H
радикал бензильного типа
13
11.
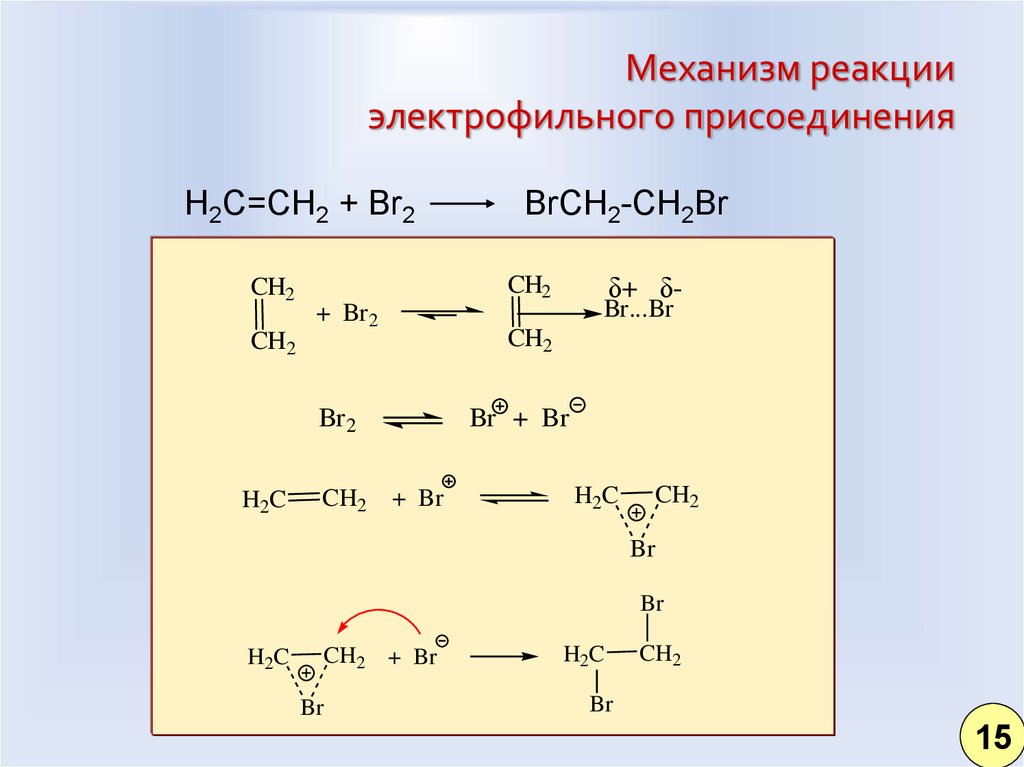
12. Механизм реакции электрофильного присоединения
H2C=CH2 + Br2CH2
δ+ δ-
CH2
+ Br 2
Br 2
CH2
Br...Br
CH2
CH2
H2C
BrCH2-CH2Br
Br + Br
+ Br
H2C
CH2
Br
Br
CH2 + Br
H2C
Br
H2C
CH2
Br
15
13.
1861 г. А.М. Бутлеров1869 г. В.В. Марковников
H3C
CH CH2
HBr
H3C
CH CH3
Br
F3C
CH CH2
HBr
F3C
(по правилу)
CH2 CH2Br
(против правила)
2
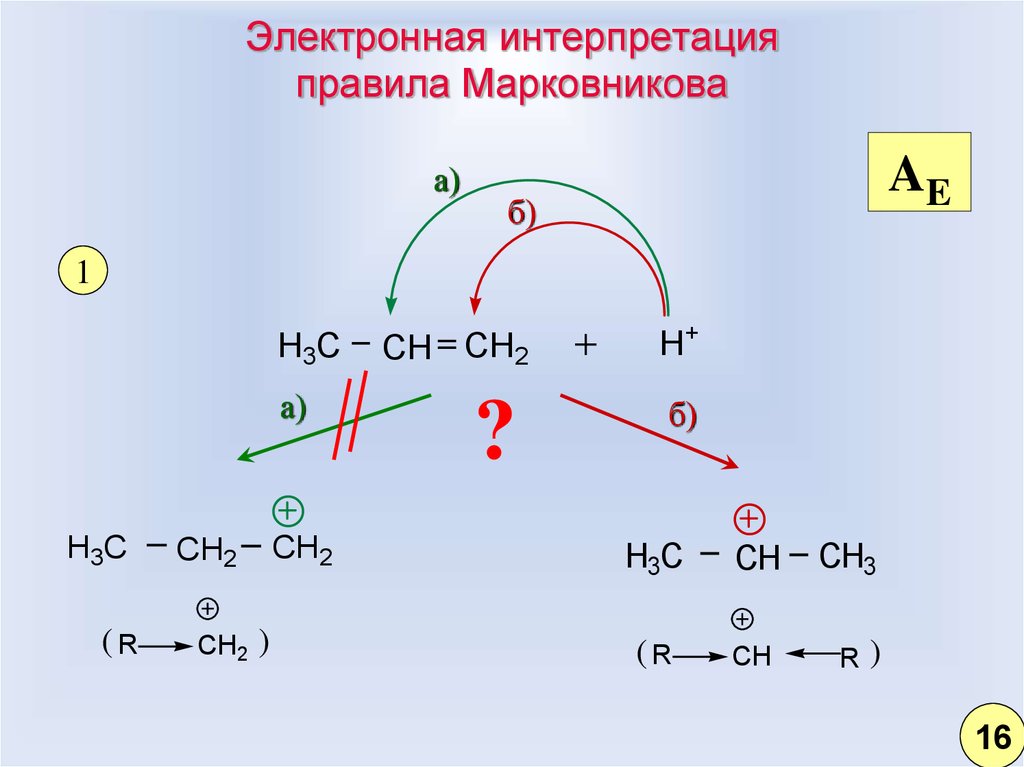
14. Электронная интерпретация правила Марковникова
а)AE
б)
1
H3C
а)
H3C
(R
CH2
CH2
CH2
)
CH CH2
?
H+
б)
H3C
CH
CH3
(R
CH
R
)
16
15.
2H3C
CH CH2 + H-Br
δ+
H3C CH CH3
Br
F3C
δ-
CH CH2 + H-Br
F3C CH2 CH2
Br
17
16.
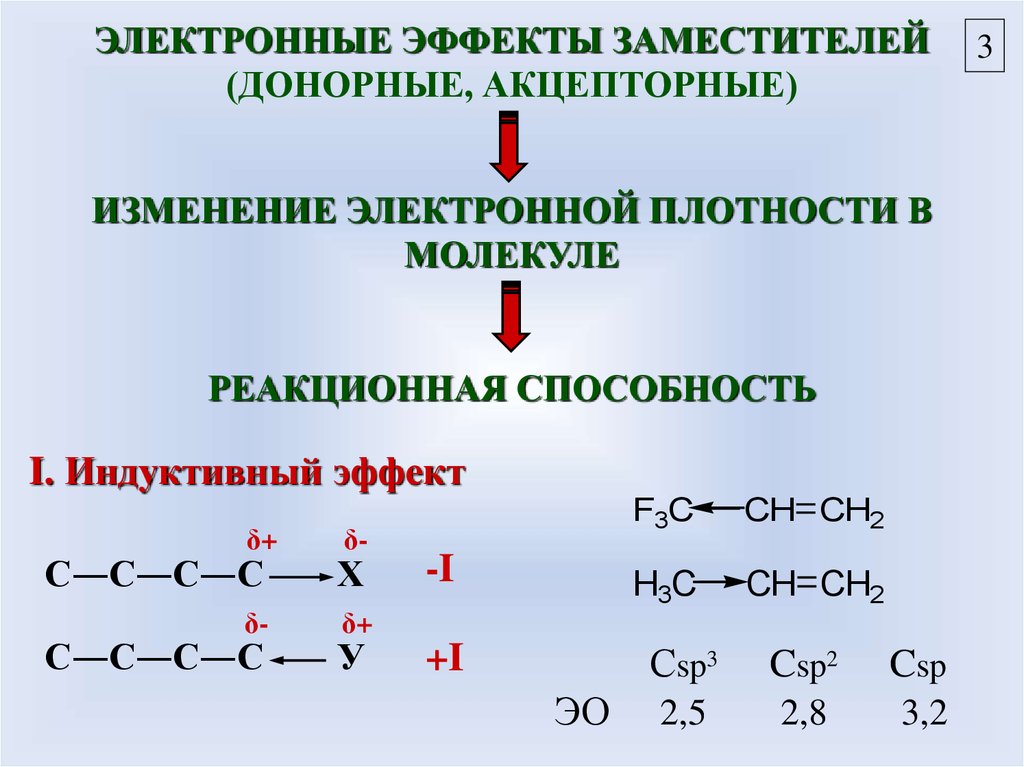
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ(ДОНОРНЫЕ, АКЦЕПТОРНЫЕ)
ИЗМЕНЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В
МОЛЕКУЛЕ
РЕАКЦИОННАЯ СПОСОБНОСТЬ
I. Индуктивный эффект
δ+
δ-
С―С―С―С
Х
δ-
δ+
С―С―С―С
У
-I
+I
ЭО
F3C
CH CH2
H3C
CH CH2
Сsp3
Csp2
Csp
2,5
2,8
3,2
3
17.
18.
Химические свойства бензолаBr
1.
CH2CH3
FeBr3
+ Br2
hν
+ HBr
1.
CHBrCH3
+ Br2
+ HBr
NO2
2.
+ HNO3
H2SO4(k)
+ H2O
Cl
2.
CH3
3.
+ CH3Cl
AlCl3
+ 3Cl2
hν
+ HCl
Cl
Cl
Cl
Cl
Cl
O
C
4.
+ H3C
C
O AlCl
3
CH3
+ HCl
Ñl
3.
+ 3H2
Ni, t
SO3H
5.
+ H2SO4 (êî í ö)
+ H2O
19
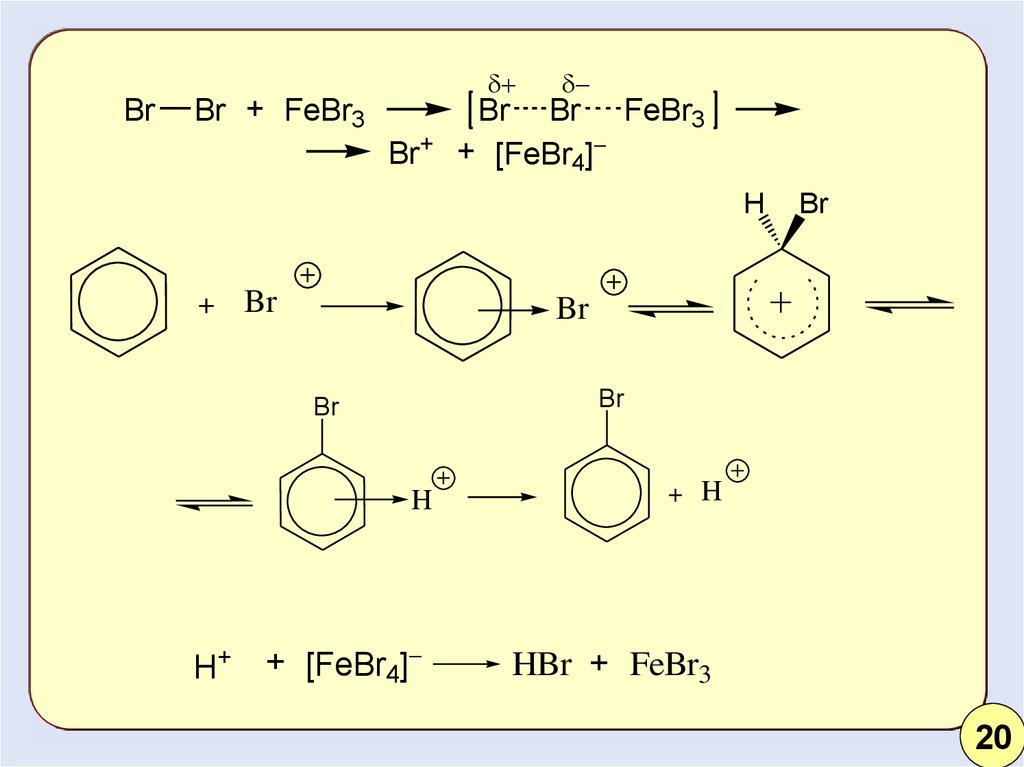
19.
BrBr + FeBr3
Br+
Br Br FeBr3
+ [FeBr4]
H
+
Br
Br
Br
Br
H
H+
Br
+ [FeBr4]
+ H
HBr + FeBr3
20
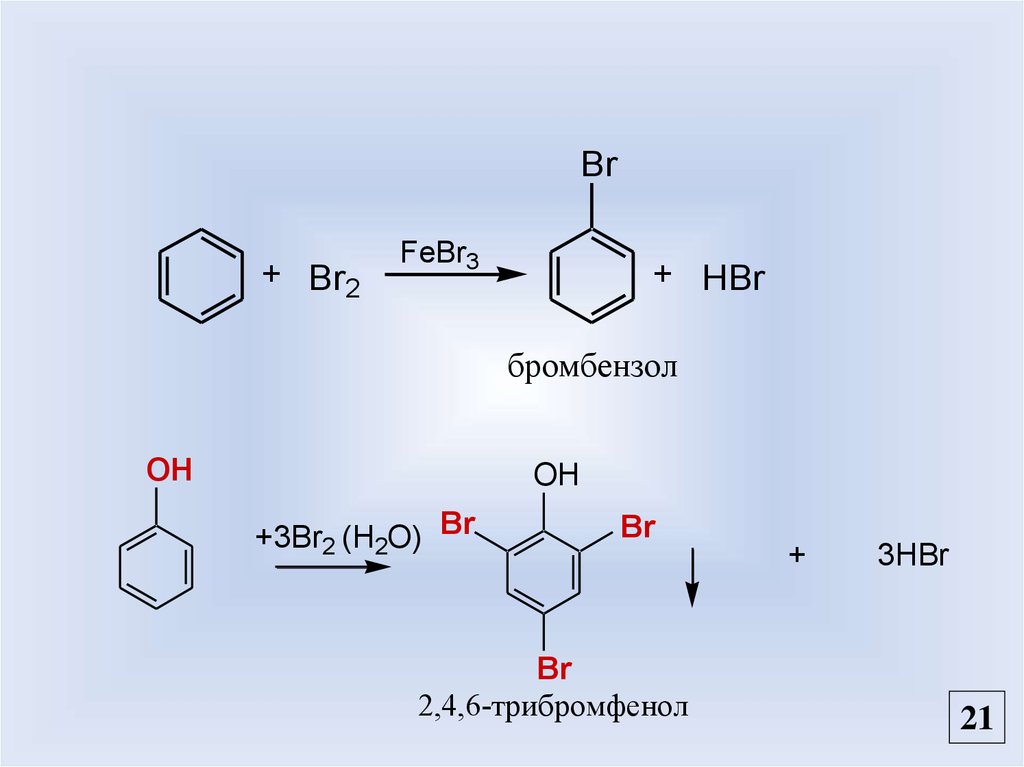
20.
Br+ Br2
FeBr3
+ HBr
бромбензол
OH
OH
+3Br2 (H2O) Br
Br
Br
2,4,6-трибромфенол
+
3HBr
21
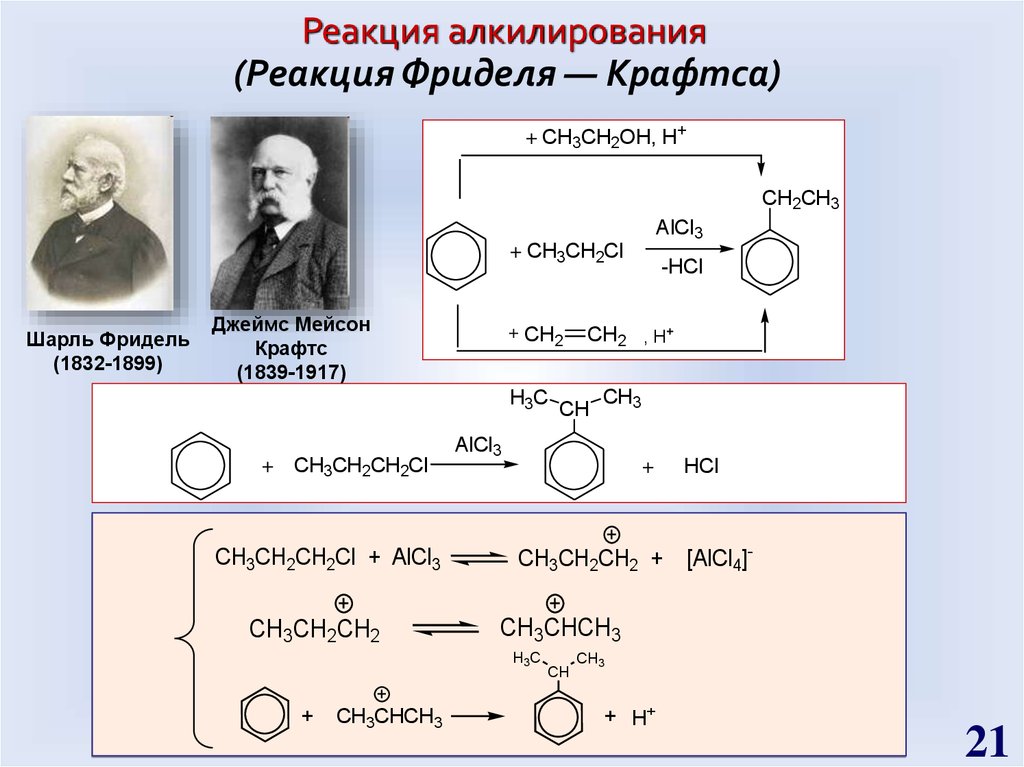
21.
Реакция алкилирования(Реакция Фриделя — Крафтса)
+ CH3CH2OH, H+
CH2CH3
AlCl3
+ CH3CH2Cl
Шарль Фридель
(1832-1899)
Джеймс Мейсон
Крафтс
(1839-1917)
+ CH2
H3C
+ CH3CH2CH2Cl
CH3CH2CH2Cl + AlCl3
CH3CH2CH2
CH3CHCH3
CH2 , H+
CH
CH3
AlCl3
+
CH3CH2CH2 +
HCl
[AlCl4]-
CH3CHCH3
H3C
+
-HCl
CH
CH3
+ H+
21
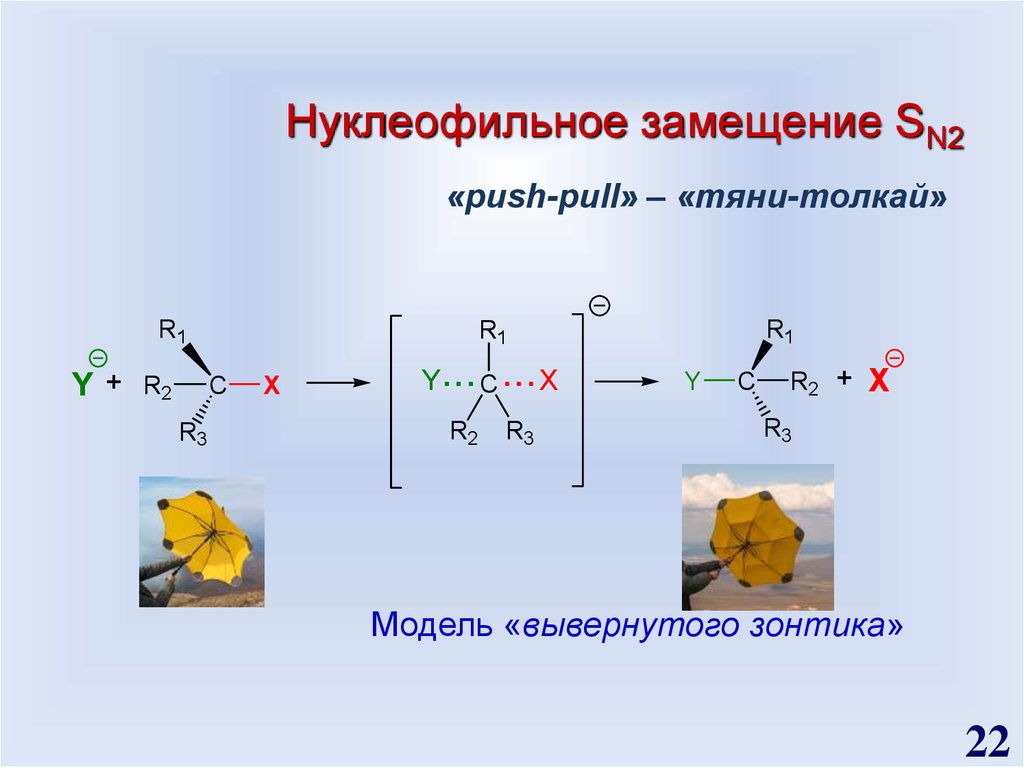
22.
Нуклеофильное замещение SN2«push-pull» – «тяни-толкай»
R1
Y+
R2
C
R3
R1
R1
X
Y... C ... X
R2
R3
Y
C
R2 +
X
R3
Модель «вывернутого зонтика»
22
23.
CH3CH3
KOH
CH3 C CH2
Cl
(водн.)
CH3 C CH2
CH3
OH
CH3
OH
KOH
(водн.)
CH3 C CH2 CH3
CH3
CH3
CH3
CH3 C CH2
Cl
CH3 C
CH3
CH2
CH3
менее стабильный
катион
OHCH3 C
CH2 CH3
CH3
более стабильный
катион
CH3
CH3 C CH2 CH3
CH3
23
24.
OHCH3
CH3
H2SO4
CH3
H3C
H3C
HO
CH3
CH3
OH2
CH3
CH3
- H2O
H3C
H3 C
CH3
CH3
H+
H3C
~ СH3
CH3
~ СH3
H3C
вторичный
катион
H3C
H
CH3
H3 C
третичный
катион
CH3
H3 C
24
25.
2,3-Дихлор-4-нитротолуол последовательно обработалиследующими реагентами:
а) смесью азотной и серной кислот при нагревании;
б) хлором в мольном соотношении 1 : 1 при освещении
ультрафиолетовым светом;
в) водным раствором гидроксида калия;
г) подкисленным серной кислотой водным раствором
перманганата калия при нагревании;
д) этанолом в присутствии серной кислоты;
е) железом в соляной кислоте;
ж) холодным раствором КОН.
Определите строение всех образующихся органических
соединений, напишите уравнения реакций.
25
26.
CH3CH3
O2N
Cl
CH2Cl
O2N
Cl
HNO3, H2SO4
конц.
Cl
Cl2, h
- H 2O
- HCl
Cl
Cl
Cl
NO2
NO2
NO2
CH2OH
O2N
COOH
Cl
KOH (водн.), t
O2N
Cl
KMnO4, H2SO4
- KCl
Cl
- MnSO4
- K2SO4
- H2O
Cl
NO2
NO2
COOC2H5
O2N
COOC2H5
HCl . H2N
Cl
+
COOK
Cl
CH3CH2OH, H
- H2O
Cl
- C2H5OH
- FeCl2
Cl
NO2
H2N
KOH (водн.)
Fe, HCl
Cl
NH2 . HCl
- KCl
Cl
NH2
26
27.
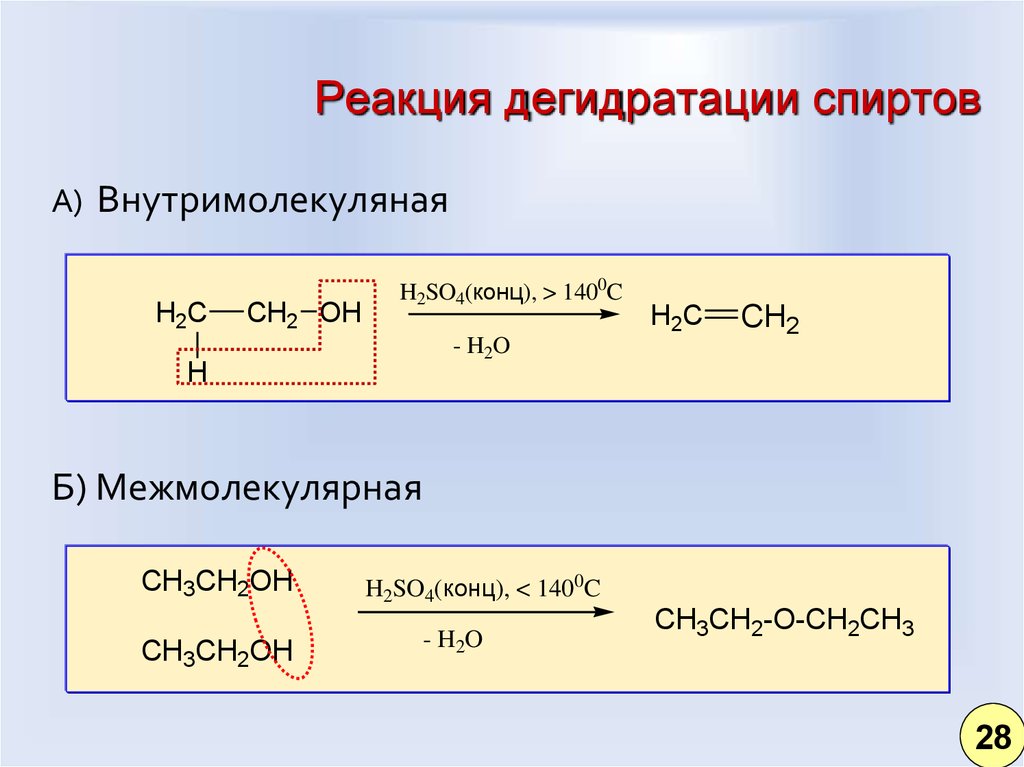
28. Реакция дегидратации спиртов
А) ВнутримолекулянаяH2C
CH2 OH
H2SO4(конц), > 1400C
- H2O
H
H2C
CH2
Б) Межмолекулярная
CH3CH2OH
CH3CH2OH
H2SO4(конц), < 1400C
- H2O
CH3CH2-O-CH2CH3
28
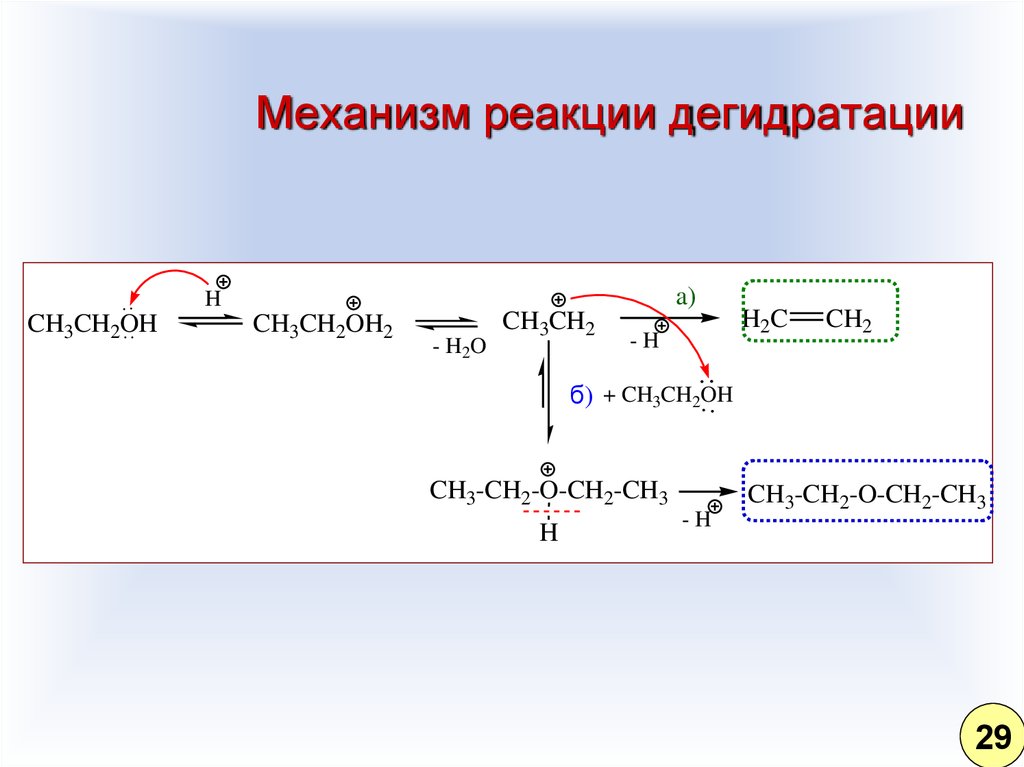
29. Механизм реакции дегидратации
a)H
CH3CH2OH
CH3CH2OH2
- H2O
CH3CH2
-H
H2C
CH2
б) + CH3CH2OH
CH3-CH2-O-CH2-CH3
H
-H
CH3-CH2-O-CH2-CH3
29
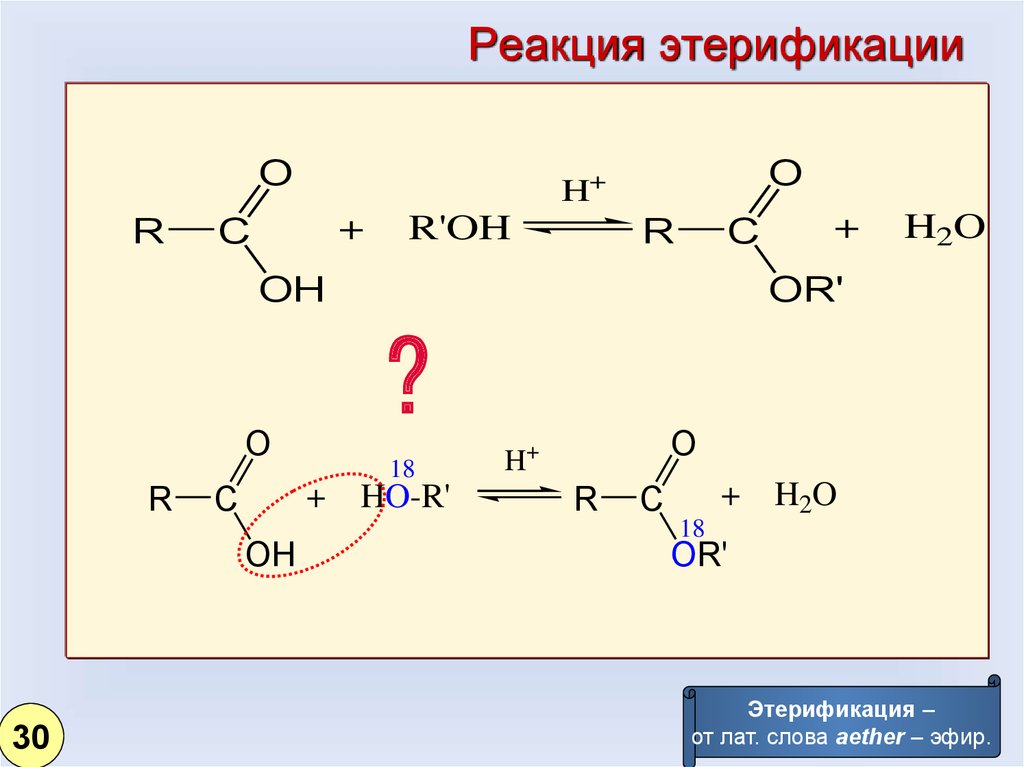
30.
Реакция этерификацииO
R
O
H+
+
C
R'OH
R
C
OH
+
H2O
OR'
?
O
R
+
C
OH
30
18
HO-R'
O
H+
R
+
C
H2O
18
OR'
Этерификация –
от лат. слова aether – эфир.
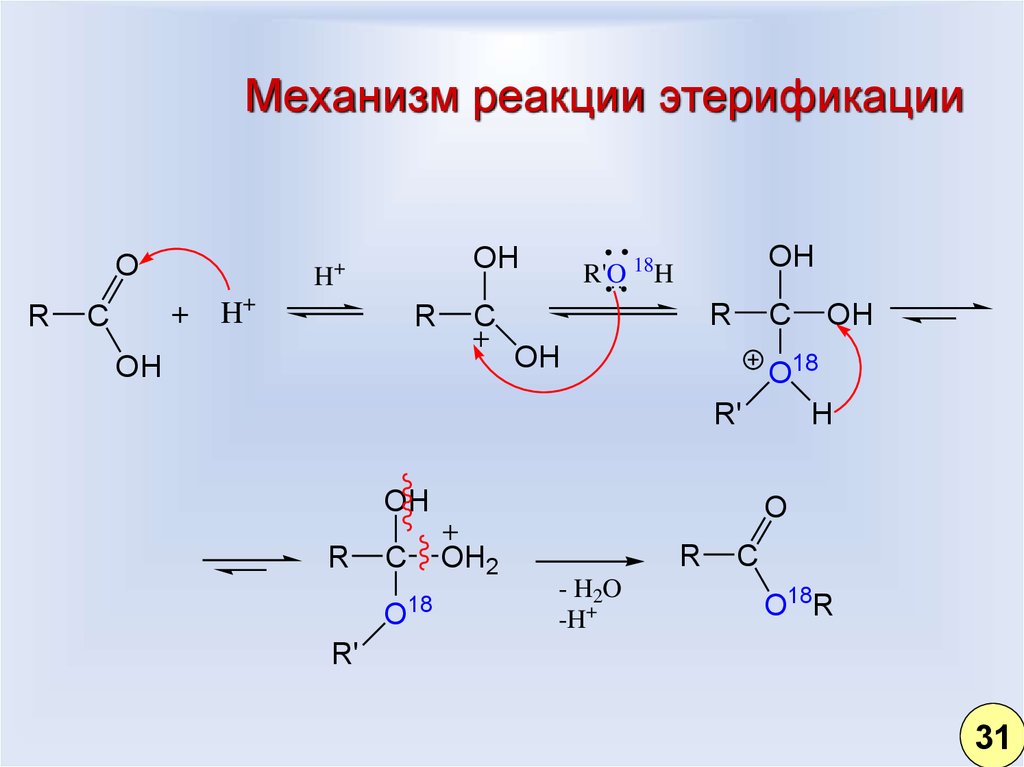
31. Механизм реакции этерификации
OR
H
+
C
OH
+
H+
R
OH
R'O 18H
R
C
OH
OH
C
O18
R'
H
OH
R
C
O
R
OH2
18
O
OH
- H2O
-H+
C
O18R
R'
31
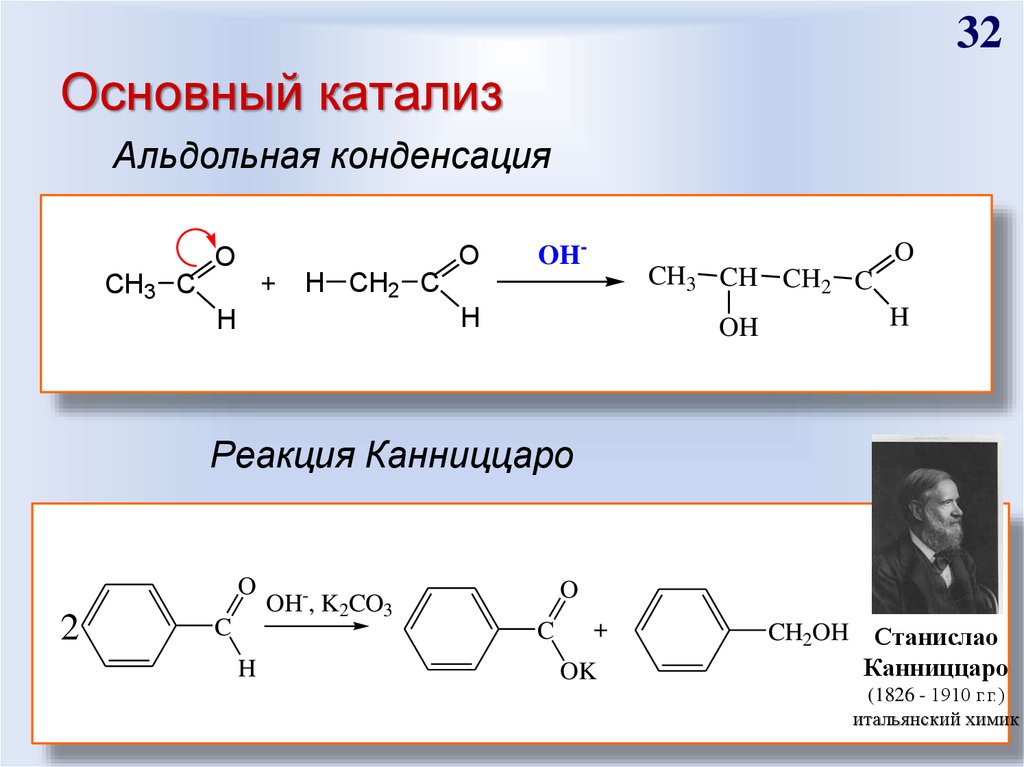
32. Основный катализ
32Основный катализ
Альдольная конденсация
O
O
+
CH3 C
OH-
O
CH3 CH CH2 C
H CH2 C
H
H
OH
H
Реакция Канниццаро
O
2
C
O
OH-, K2CO3
C
H
+
OK
CH2OH Станислао
Канниццаро
(1826 - 1910 г.г.)
итальянский химик
33.
Ru, 1000 атм, 1500CПАРАФИНЫ
ThO2, 600 атм, 4500 C
СO + H2
Fe/Al2O3, Ru,
Co, Ni
Cr2O3, 30 атм, 5000 C
Fe, 2000 атм, 1750 C
ИЗОПАРАФИНЫ
ТОЛУОЛ, КСИЛОЛЫ
ВЫСШИЕ СПИРТЫ
Реакция Фишера-Тропша
синтин
ZnO, Cr2O3, 250 атм, 2800 C
(синтетический бензин)
СH3OH
Ni/Al2O3, 8000C
CH4 + H2O
CO + H2
33
34.
Притча о катализеВот что рассказал на церемонии вручения высшей научной
награды королю Дании Христиану Х датский биохимик,
специалист в области химии ферментов Линдерстрём-Ланг
17 белых
верблюдов
+ 1 черный
верблюд
∑18
1/2
9 белых
1/3
6 белых
1/9
2 белых
∑ 17 белых
Кай Линдерстрём-Ланг
(1896-1959)
верблюдов
1 черный
верблюд
34
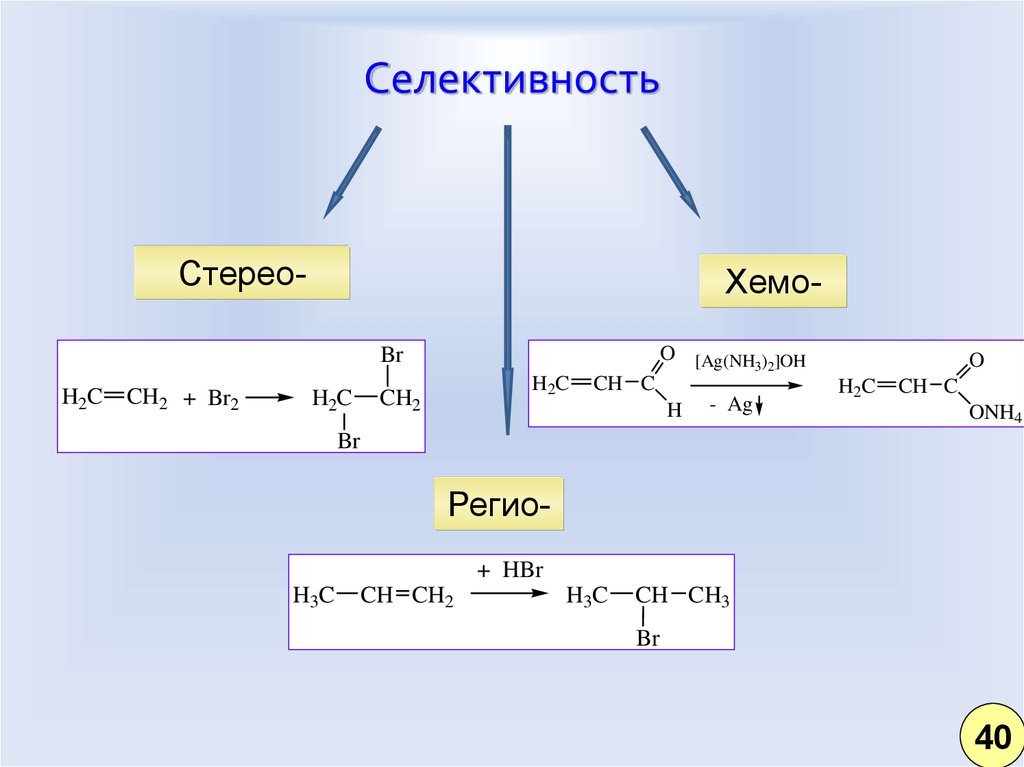
35. Селективность
Стерео-ХемоO [Ag(NH3)2]OH
Br
H2C
CH2 + Br2
H2C
H2C
CH2
CH C
H
- Ag
O
H2C
CH C
ONH4
Br
Регио+ HBr
H3C
CH CH2
H3C
CH CH3
Br
40
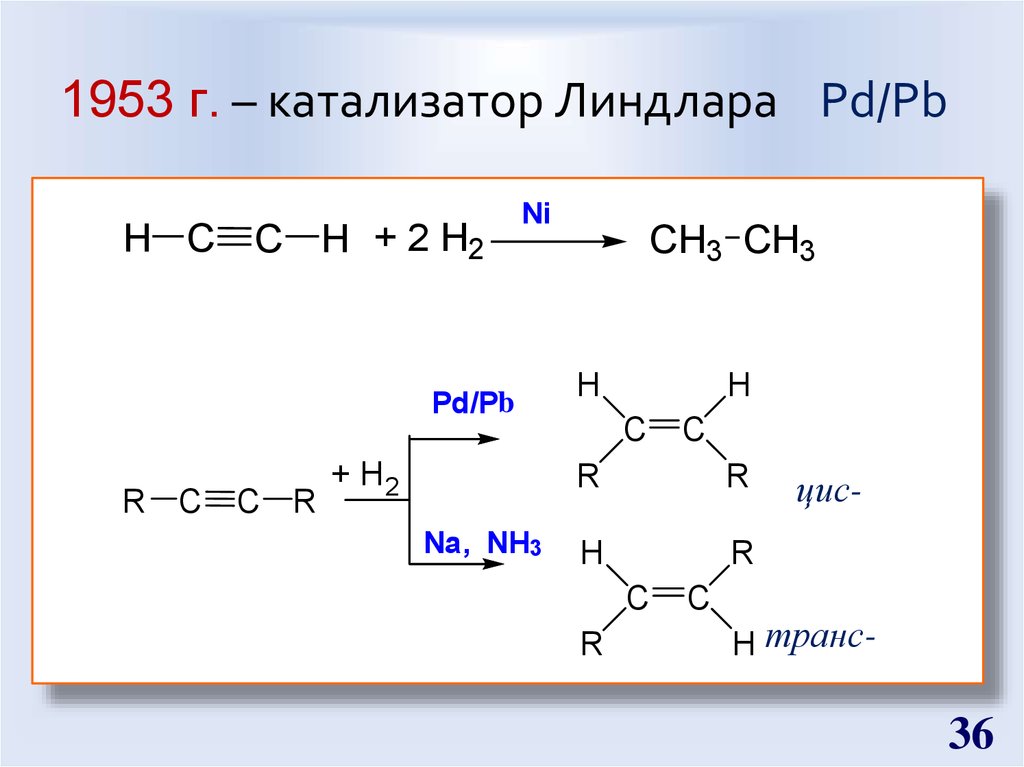
36. 1953 г. – катализатор Линдлара Pd/Pb
H C C H + 2 H2Ni
Pd/Pb
R C C R
+ H2
Na, NH3
CH3 CH3
H
H
C
C
R
R
H
R
C
R
C
цис-
H транс-
36
37.
n H2CC
CH CH2
TiCl4 . Al(C2H5)3
CH3
CH2
C
CH2
CH
H3C
n
Цис-полиизопрен
Катализатор Циглера - Натта
1963 г. –
НАТТА
Джулио
ЦИГЛЕР
Карл Вальдемар
(1903–1979)
(1898 –1973)
Нобелевская премия
по химии «за
открытия в области
химии и технологии
высокомолекулярны
х полимеров»
42
38. «Химия создает свой предмет. Эта творческая способность, подобная искусству, коренным образом отличает химию от остальных
естественных игуманитарных наук»
М. Бертло, 1860 г.
35





















 Химия
Химия








