Похожие презентации:
Концепция химической связи
1. Концепции химической связи
Лекцию подготовил: Шлапаков Никита,студент 6 курса Химического факультета МГУ.
Вороново, 2019
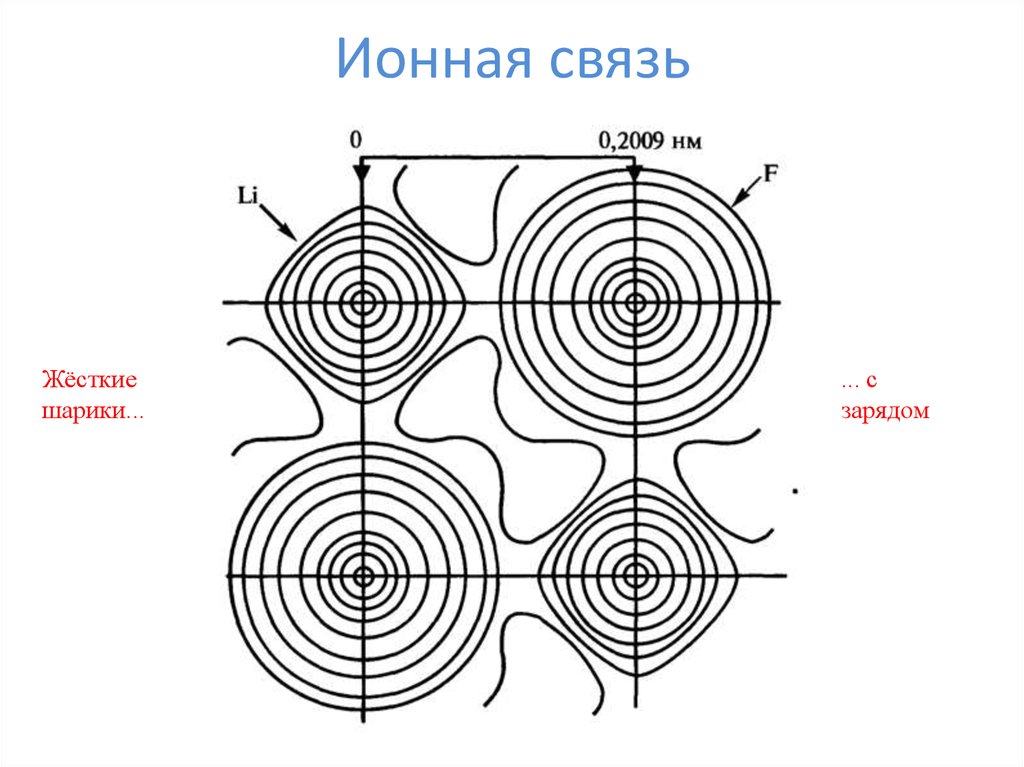
2. Ионная связь
Жёсткиешарики...
... с
зарядом
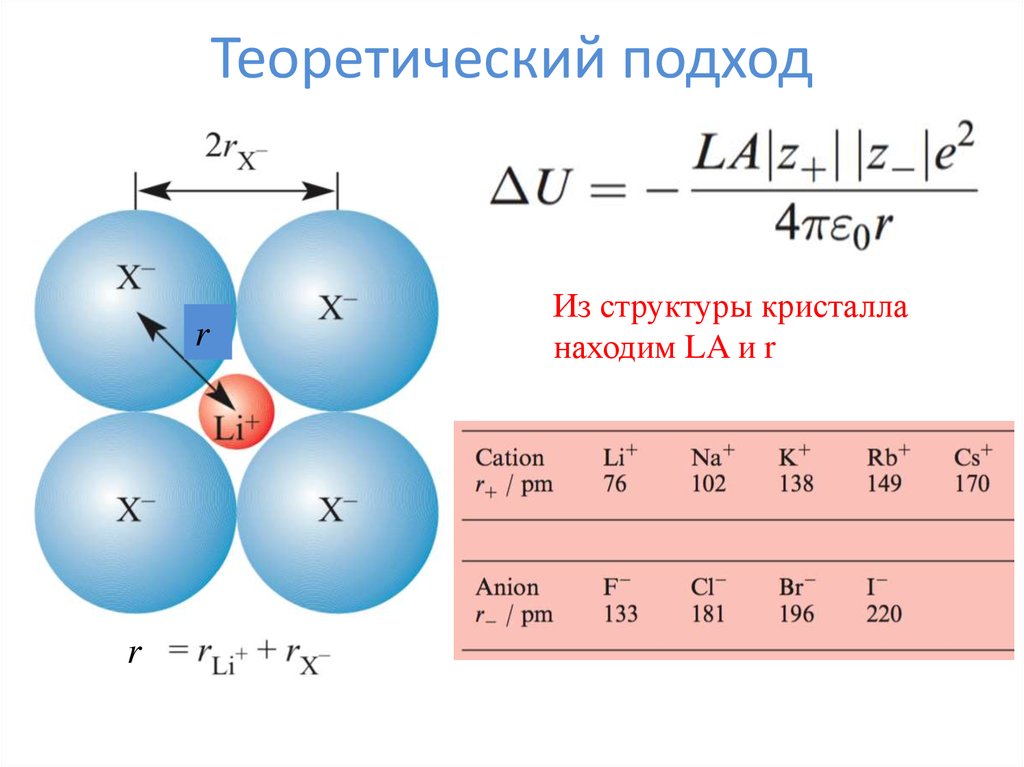
3. Теоретический подход
rr
Из структуры кристалла
находим LA и r
4. Экспериментальный подход
Цикл Борна-ГабераНесоответствие ΔHрассчёт - ΔHэксперимент
Что же делать???
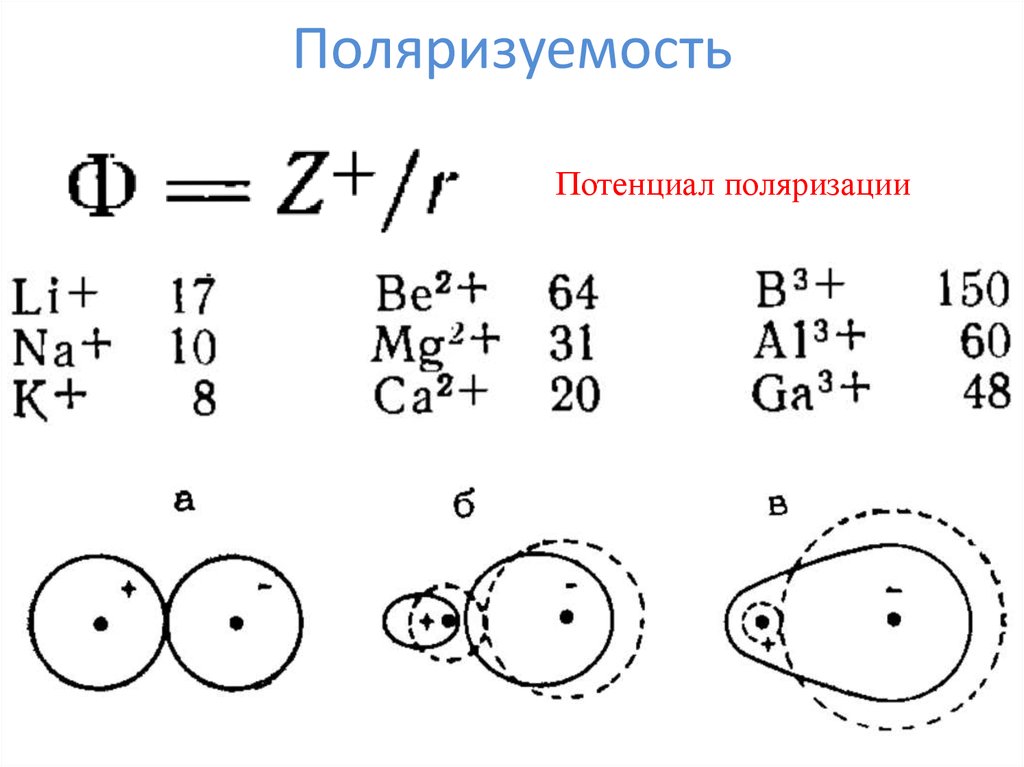
5. Поляризуемость
Потенциал поляризации6. Правила Фаянса
1. Поляризующая способность катионахарактеризуется величиной его потенциала
поляризации (чем меньше и беднее катион,
тем больше ему хочется чего-нибудь отнять)
2. Поляризуемость аниона выше с увеличением
заряда и размера аниона (чем больше и
богаче анион, тем легче он теряет своё добро)
3. Поляризующая способность катиона,
имеющего оболочку благородного газа ниже
по сравнению с катионом, имеющем частично
заполненную внешнюю электронную
оболочку (катионы d-элементов опаснее, чем
катионы s- и p-элементов)
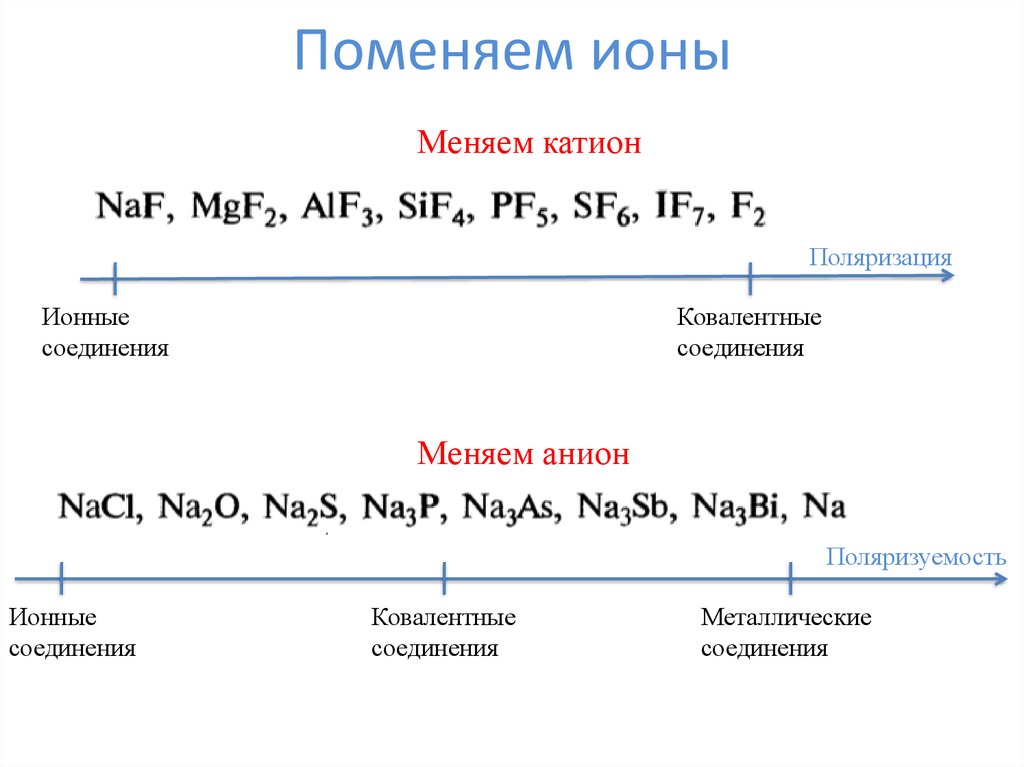
7. Поменяем ионы
Меняем катионПоляризация
Ионные
соединения
Ковалентные
соединения
Меняем анион
Поляризуемость
Ионные
соединения
Ковалентные
соединения
Металлические
соединения
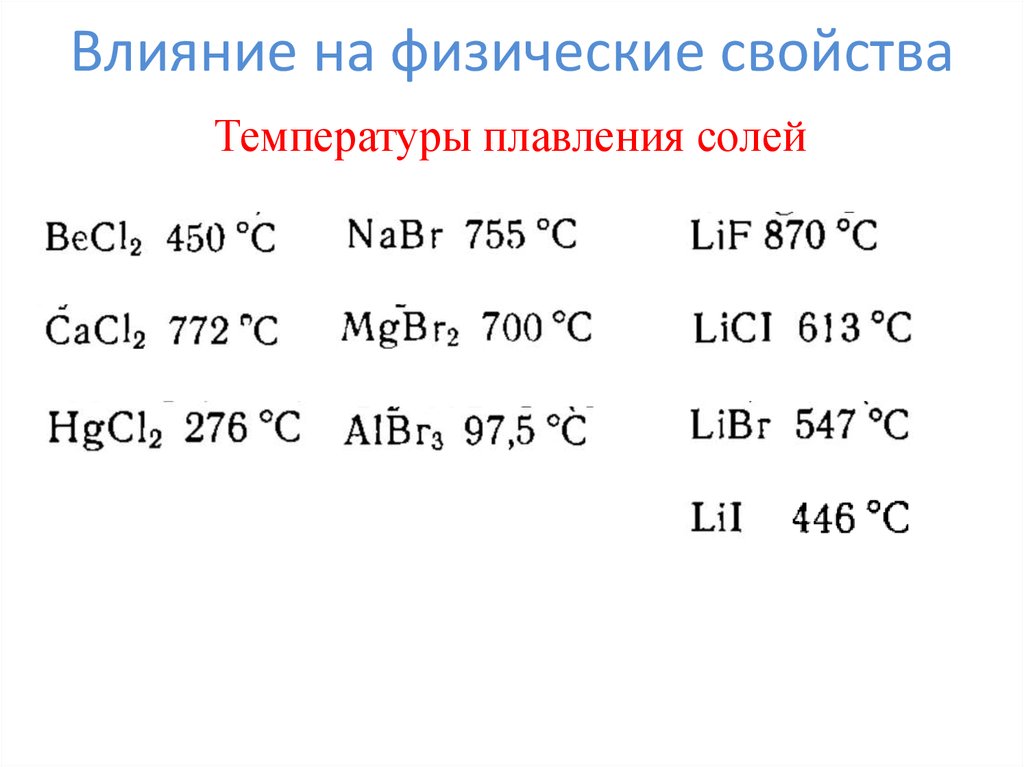
8. Влияние на физические свойства
Температуры плавления солей9. Влияние на химические свойства
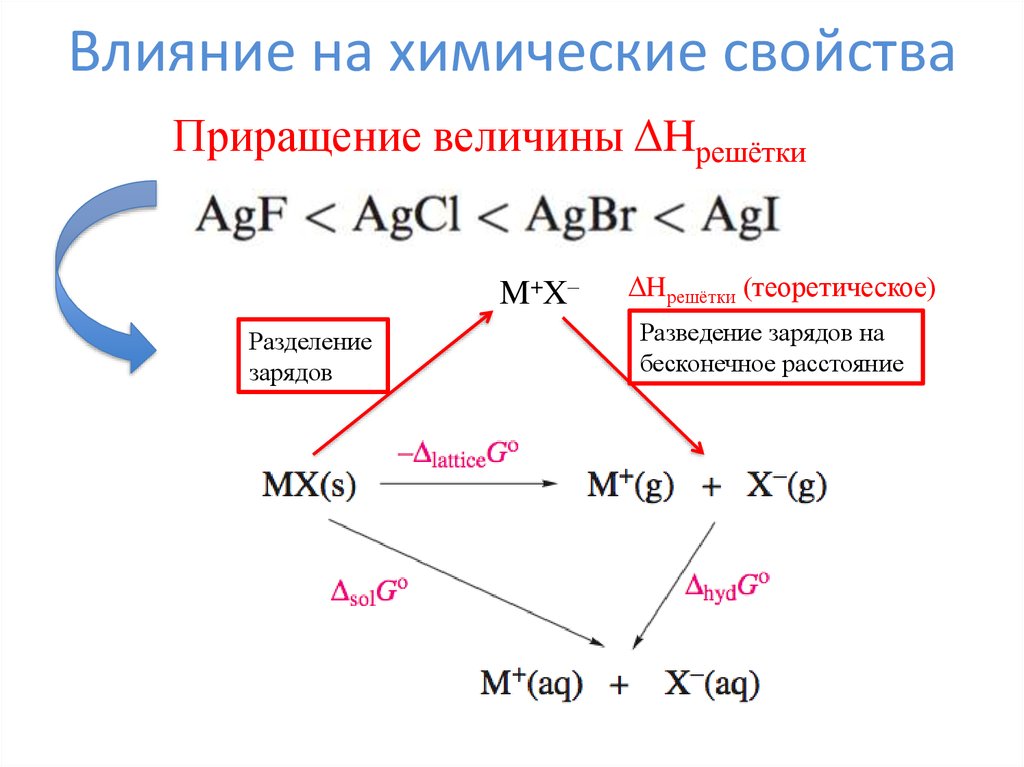
Температуры разложения карбонатов10. Влияние на химические свойства
Приращение величины ΔHрешёткиM+X–
Разделение
зарядов
ΔHрешётки (теоретическое)
Разведение зарядов на
бесконечное расстояние
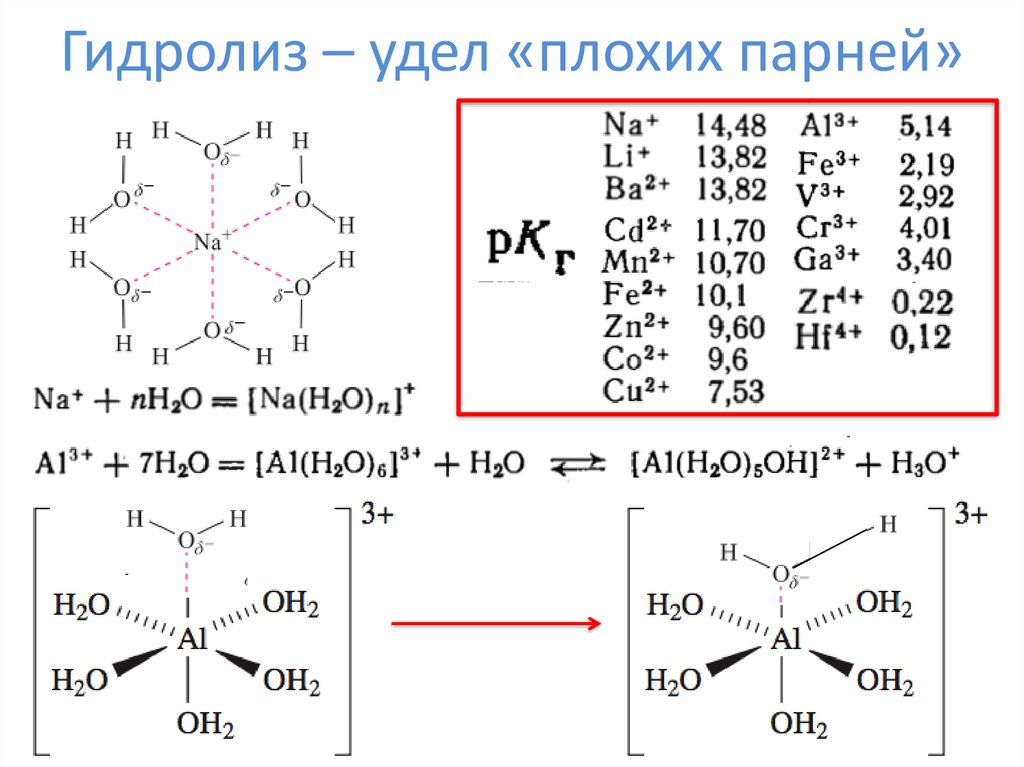
11. Гидролиз – удел «плохих парней»
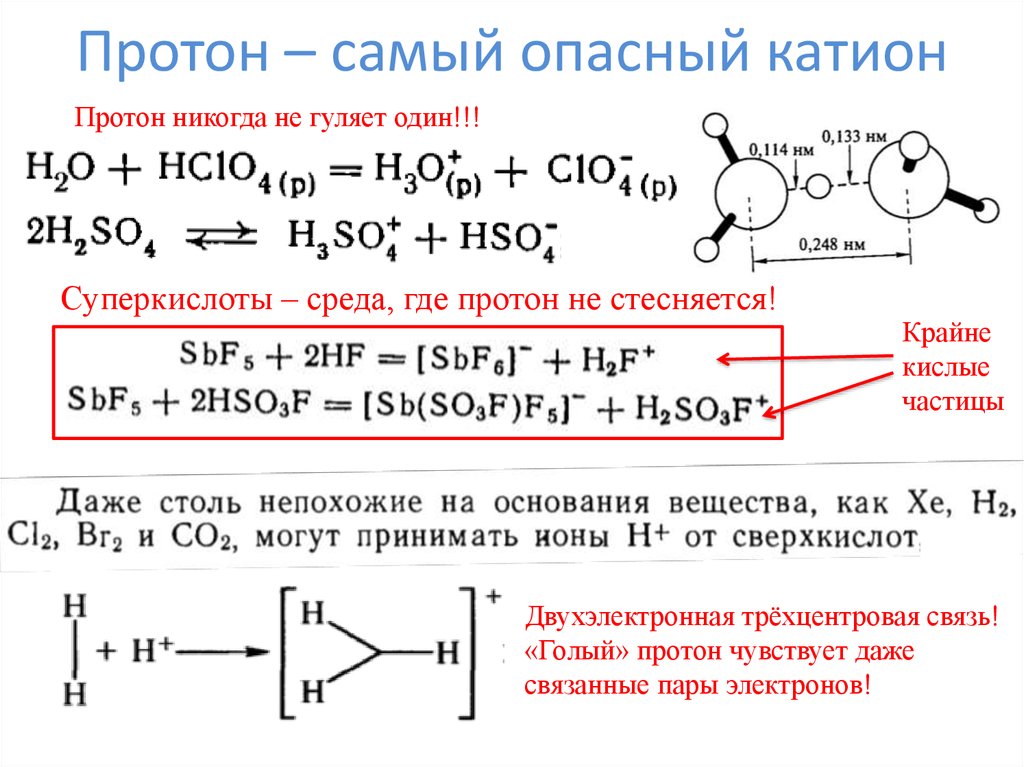
12. Протон – самый опасный катион
Протон никогда не гуляет один!!!Суперкислоты – среда, где протон не стесняется!
Крайне
кислые
частицы
Двухэлектронная трёхцентровая связь!
«Голый» протон чувствует даже
связанные пары электронов!
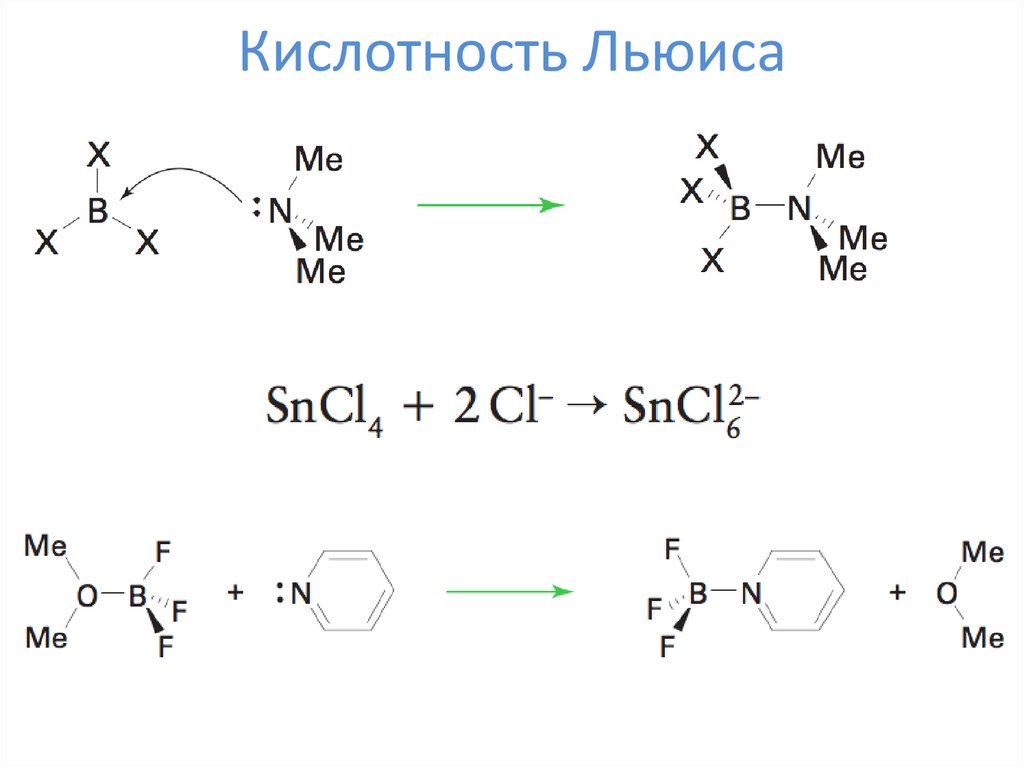
13. Кислотность Льюиса
14. Амфотерность повсюду!
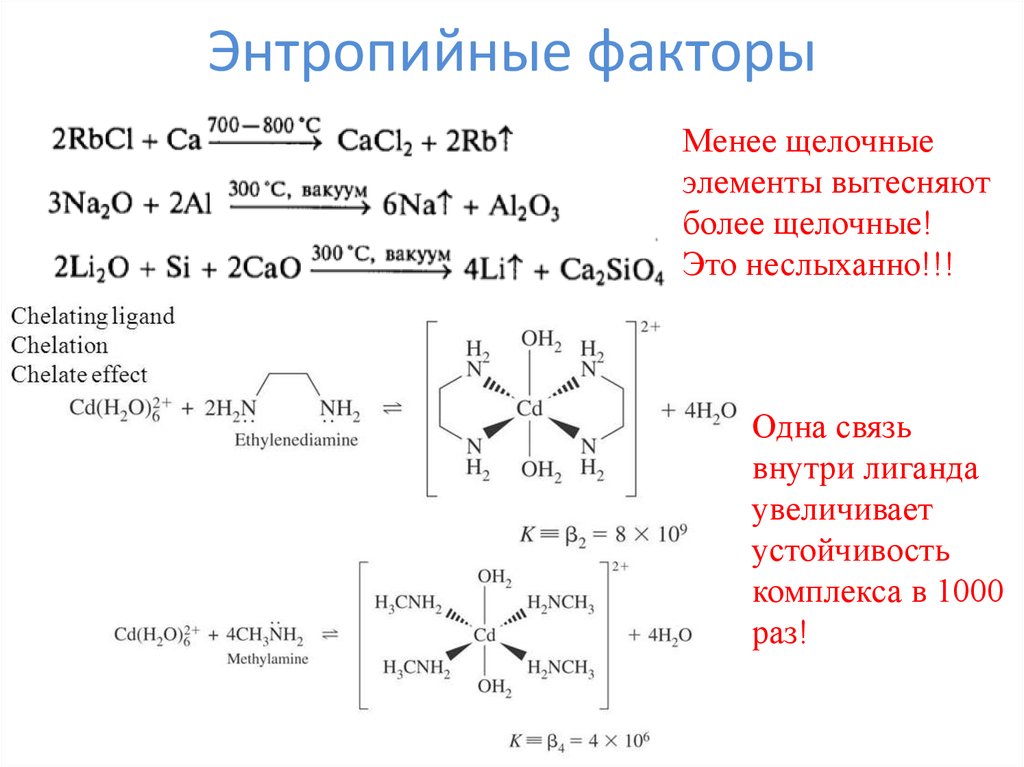
15. Энтропийные факторы
Менее щелочныеэлементы вытесняют
более щелочные!
Это неслыханно!!!
Одна связь
внутри лиганда
увеличивает
устойчивость
комплекса в 1000
раз!
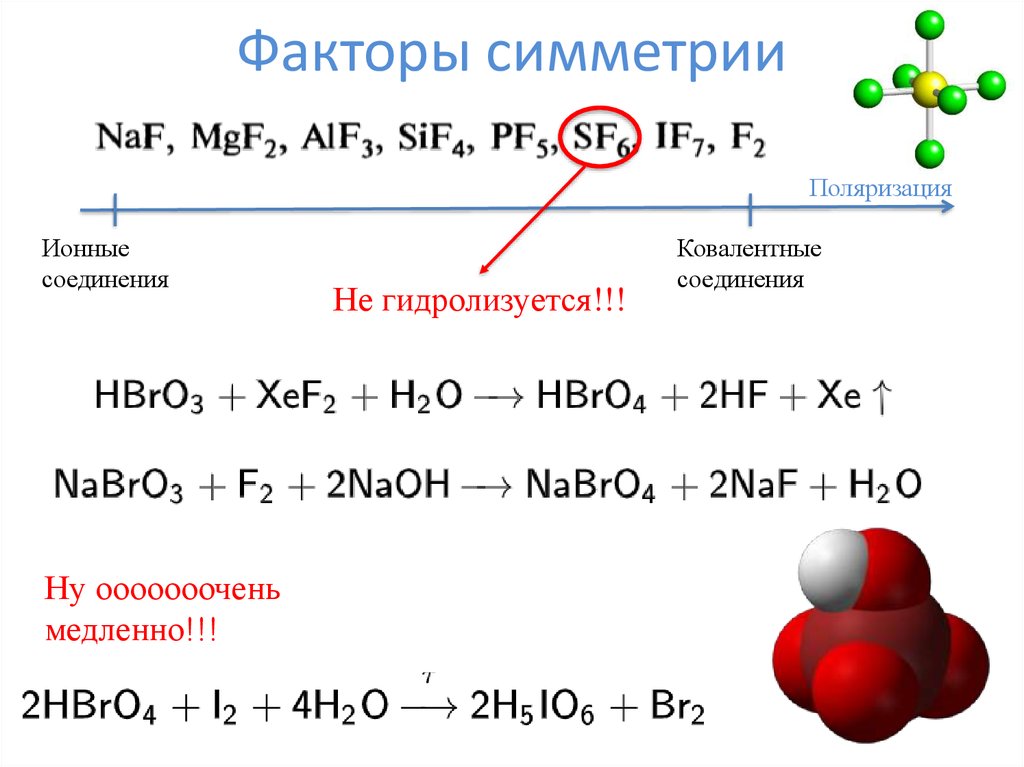
16. Факторы симметрии
ПоляризацияИонные
соединения
Ну ооооооочень
медленно!!!
Не гидролизуется!!!
Ковалентные
соединения
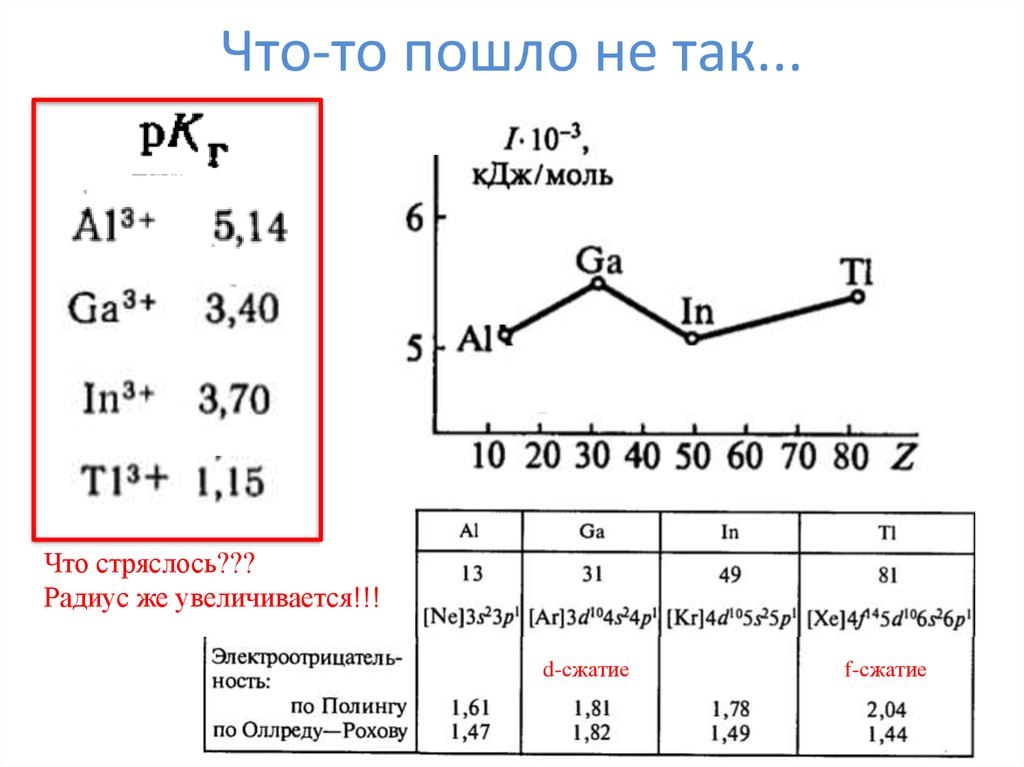
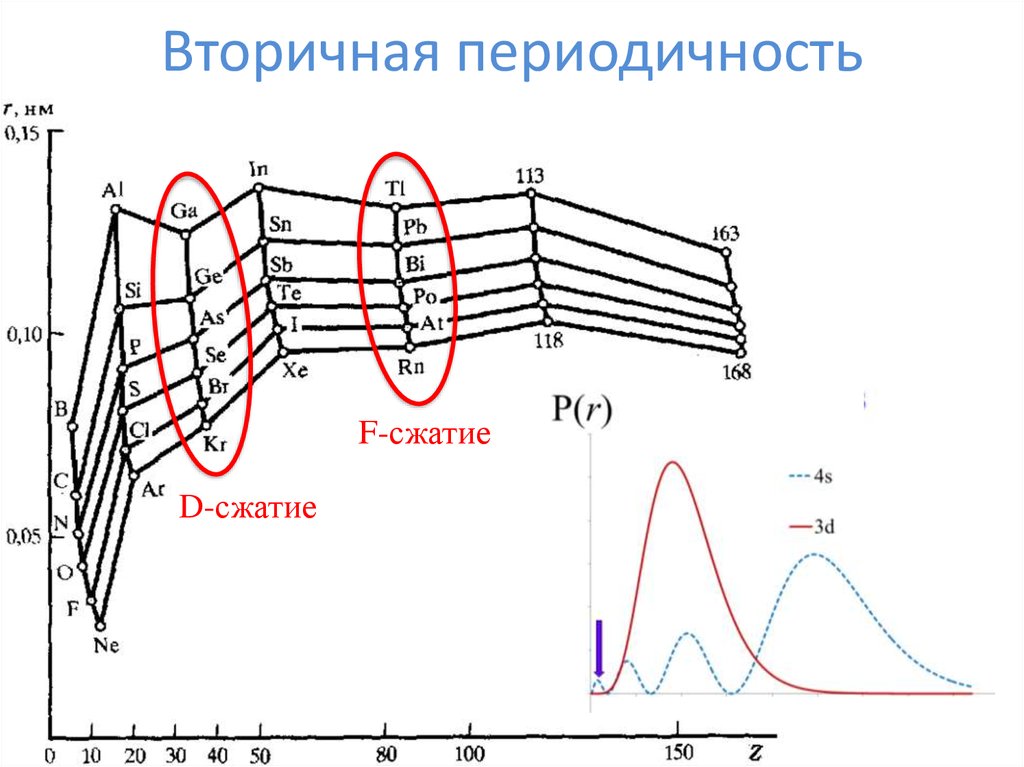
17. Что-то пошло не так...
Что стряслось???Радиус же увеличивается!!!
d-сжатие
f-сжатие
18. Вторичная периодичность
F-сжатиеD-сжатие





 Химия
Химия








