Похожие презентации:
Гидролиз солей
1.
Гидролиз солей1
2.
Гидролиз – это взаимодействие с молекуламиводы.
Гидролиз – это процесс, при котором молекулы
воды, взаимодействуя с ионами растворенного
вещества, разлагаются с выделением ионов
водорода или гидроксид-ионов, в результате
чего изменяется рН раствора.
2
3.
Гидролизу подвергаются соли:- образованные слабым основанием и
сильной кислотой NH4Cl, N2H4·HCl
- образованные сильным основанием и
слабой кислотой CH3COONa, C6H5COOK
- образованные слабым основанием и слабой
кислотой
3
4.
Расчет константы гидролиза Kh, pH истепени гидролиза h соли, образованной
сильным основанием и слабой кислотой
A–
BA B+ + A–
+ H2O HA + OH–
[HA] · [OH–]
Kh = ——————
[A–]
4
5.
[HA] · [OH–][H+]
Kw
Kh = —————— · ——— = ———
[A–]
[H+]
Kк-ты
[HA] · [OH–]
Kw
—————— = ———
[A–]
Kк-ты
[HA] = [OH–]
[A–] = Ссоли – [OH–] Ссоли
(h < 5%)
5
6.
[OH–]2Kw
———— = ———
Ссоли
Kк-ты
[ OH - ] =
Kw . Cc
Kk
pOH = ½ pKw – ½ pKк-ты – ½ lg Cсоли
pOH = 7 – ½ pKк-ты – ½ lg Cсоли
pH = 7 + ½ pKк-ты + ½ lg Cсоли
6
7.
Cгидр[OH–]
h = ———— = ————
Ссоли
Ссоли
Kw . Cc
[ OH - ] =
h
Kk
Kw . Cc
=
2
Kk. C
c
=
K w
Kk. C
c
7
8.
Стенень гидролиза зависит от:1. Ионного произведения воды
(чем to тем Kw тем h)
2. Природы кислоты
(чем слабее кислота, тем в большей
степени протекает гидролиз)
3. Концентрации соли
(чем Ссоли тем h)
8
9.
Расчет константы гидролиза Kh, pH истепени гидролиза h соли, образованной
слабым основанием и сильной кислотой
BA B+ + A–
B+ + H2O BOH + H+
[BOH] · [H+]
Kh = ——————
[B+]
9
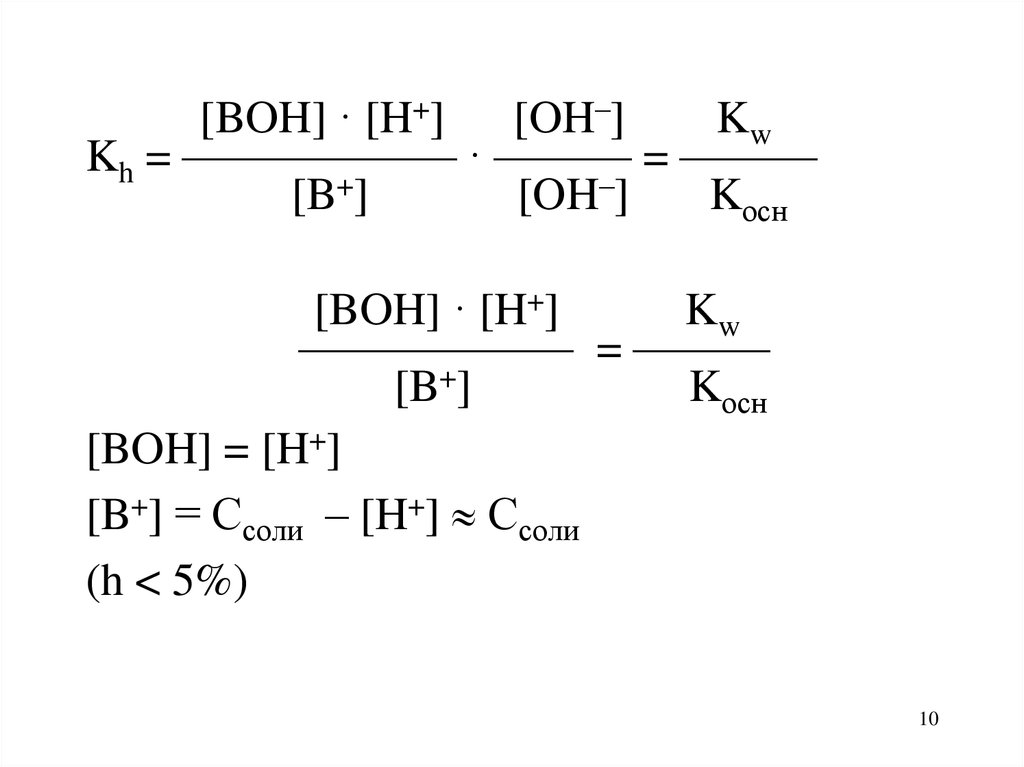
10.
[BOH] · [H+] [OH–]Kw
Kh = —————— · ——— = ———
[B+]
[OH–]
Kосн
[BOH] · [H+]
Kw
—————— = ———
[B+]
Kосн
[BOH] = [H+]
[B+] = Ссоли – [H+] Ссоли
(h < 5%)
10
11.
[H+] 2Kw
———— = ———
Ссоли
Kосн
[ H +] =
Kw . Cc
Ko
pH = ½ pKw – ½ pKосн – ½ lg Cсоли
pH = 7 – ½ pKосн – ½ lg Cсоли
11
12.
Cгидр[H+]
h = ———— = ————
Ссоли
Ссоли
[ H +] =
h
Kw . Cc
Ko
Kw . Cc
=
K o . C c2
=
K w
K o. C
c
12
13.
Стенень гидролиза зависит от:1. Ионного произведения воды
(чем to тем Kw тем h)
2. Природы основания
(чем слабее основание, тем в большей
степени протекает гидролиз)
3. Концентрации соли
(чем Ссоли тем h)
13
14.
Расчет константы гидролиза Kh, pH истепени гидролиза h соли, образованной
слабым основанием и слабой кислотой
BA B+ + A–
B+ + A– + H2O BOH + HA
[BOH] · [HA]
Kh = ——————
[B+] · [A–]
14
15.
[BOH] · [HA] [OH–] [H+]Kw
Kh = —————— · —— · —— = ————
[B+] · [A–] [OH–] [H+] Kк-ты · Kосн
[BOH] · [HA]
Kw
—————— = ————
[B+] · [A–]
Kк-ты · Kосн
[BOH] = [HA]
[B+] = Ссоли – [H+] Ссоли
[A–] = Ссоли – [OH–] Ссоли
(h < 5%)
15
16.
[HA] 2Kw
———— = ————
Ссоли2
Kк-ты · Kосн
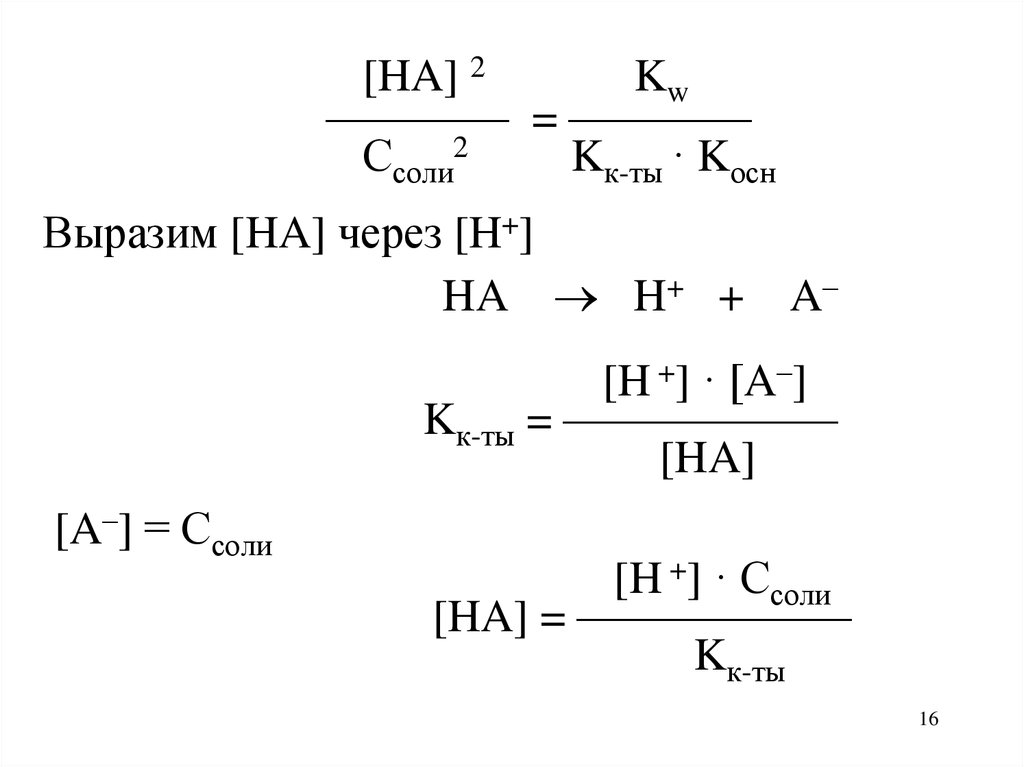
Выразим [HA] через [H+]
HA H+ + A–
[H +] · [A–]
Kк-ты = ——————
[HA]
[A–] = Ссоли
[H +] · Ссоли
[HA] = ——————
Kк-ты
16
17.
[HA] 2Kw
———— = ————
Ссоли2
Kк-ты · Kосн
[H +] · Ссоли
[HA] = ——————
Kк-ты
[H +]2 · Ссоли2
Kw
—————— = ————
Kк-ты2 · Ссоли2 Kк-ты · Kосн
[H +]2
Kw
———— = ———
Kк-ты
Kосн
17
18.
Kw · Kк-ты[H+]2 = ——————
Kосн
[ H +] =
Kw . K k
Ko
pH = ½ pKw + ½ pKк-ты – ½ pKосн
pH = 7 + ½ pKк-ты – ½ pKосн
18
19.
h=
Kw
K o. K k
=
Kh
Степень гидролиза соли зависит от
ионного произведения воды, силы
кислоты и силы основания
19
20.
Вычислить рН и степень гидролиза 0,35%раствора солянокислого гидразина N2H4·HCl
pH = 7 – ½ pKосн – ½ lg Cсоли
pKосн = 6,03
пересчитаем 0,35% = 0,05 М
pH = 7 – ½ · 6,03 – ½ · lg 0,05 = 4,63
h=
K w
K o. C
c
- 14
.
1 10
=
9,3 . 10 - 7 . 0,05
= 4,63 . 10 4
или 0,04%
20
21.
Равновесия в растворахкислых солей (NaHCO3)
21
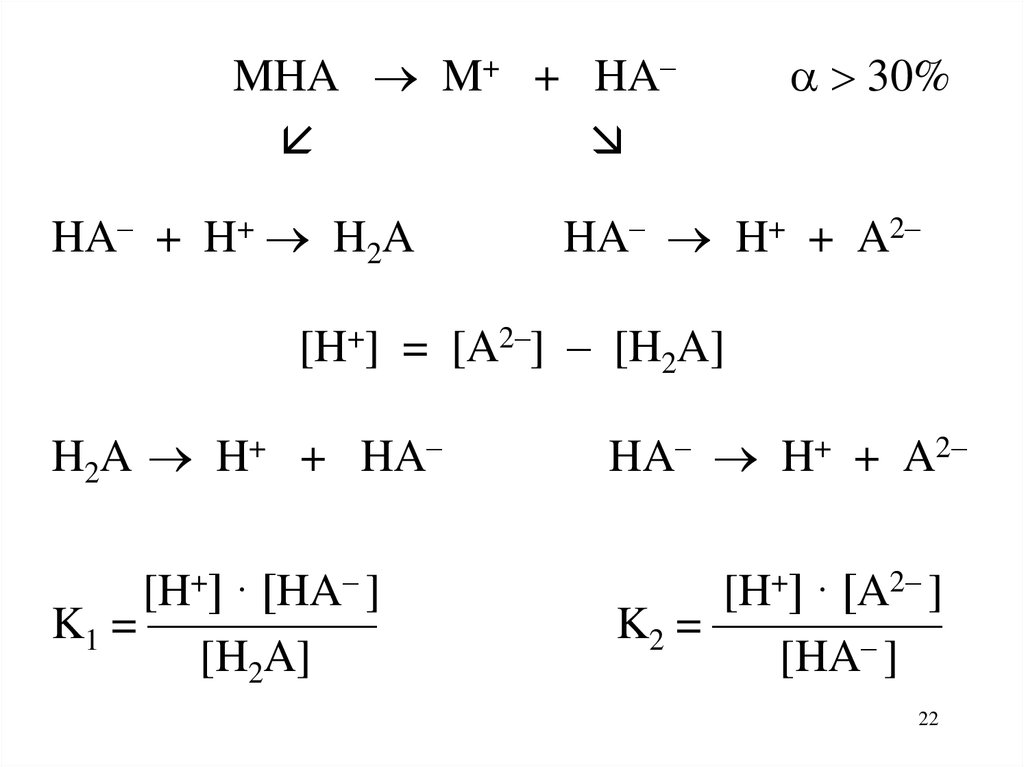
22.
MHA M+ + HA–HA– + H+ H2A
30%
HA– H+ + A2–
[H+] = [A2–] – [H2A]
H2A H+ + HA–
HA– H+ + A2–
[H+] · [HA– ]
K1 = —————
[H2A]
[H+] · [A2– ]
K2 = —————
[HA– ]
22
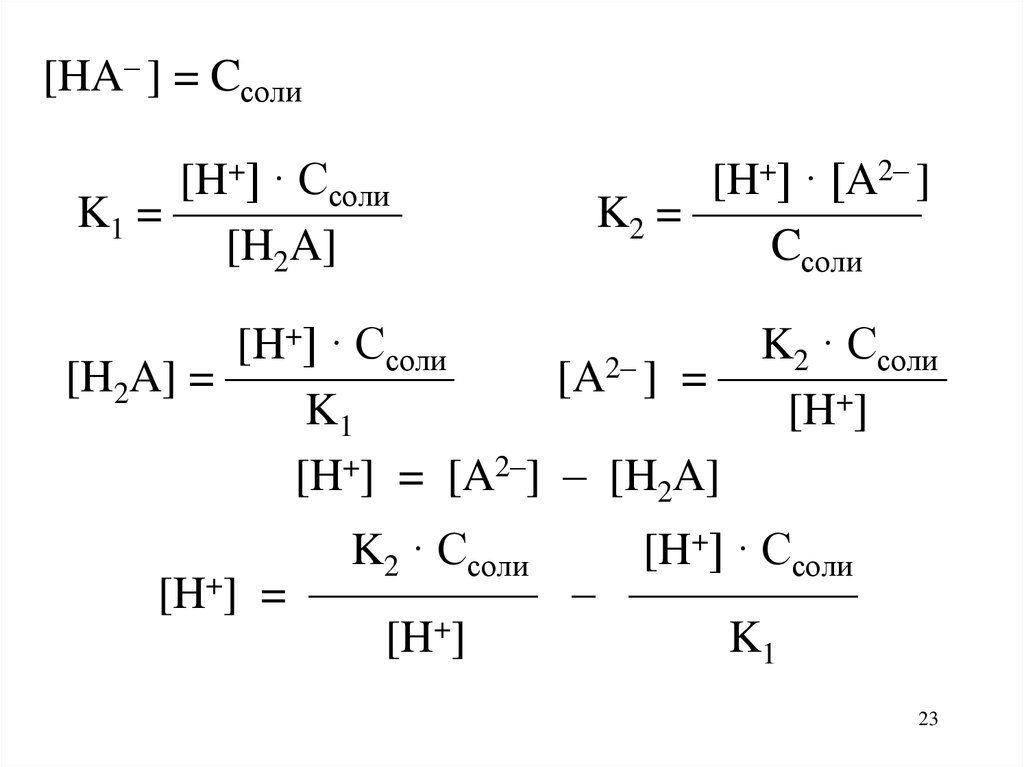
23.
[HA– ] = Cсоли[H+] · Cсоли
K1 = —————
[H2A]
[H+] · [A2– ]
K2 = —————
Cсоли
[H+] · Cсоли
K2 · Cсоли
2–
[H2A] = —————
[A ] = —————
K1
[H+]
[H+] = [A2–] – [H2A]
K2 · Cсоли
[H+] · Cсоли
[H+] = ————— – —————
[H+]
K1
23
24.
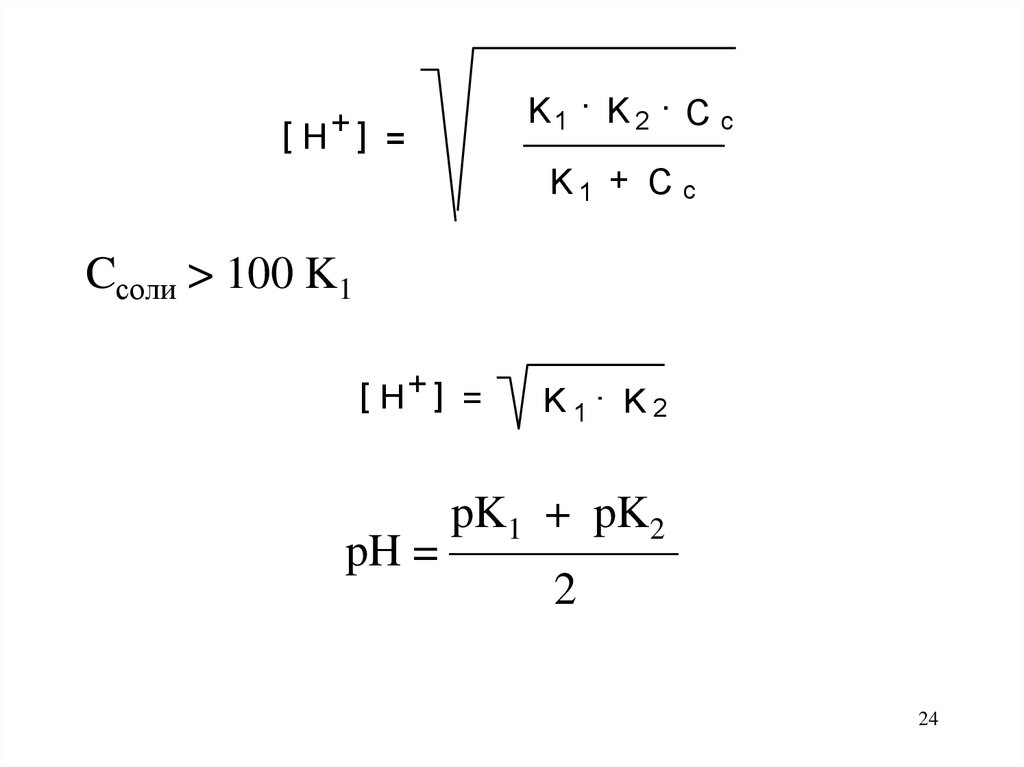
[ H+ ] =K1 . K 2 . C c
K1 + C c
Cсоли > 100 K1
[ H+ ] =
K1. K2
pK1 + pK2
pH = —————
2
24
25.
Вычислить рН раствора гидрокарбонатанатрия.
NaHCO3 – кислая соль pK1 = 6,35
pK2 = 10,32
pK1 + pK2
pH = —————
2
6,35 + 10,32
pH = —————— = 8,3
2
25
26.
К 50 мл 0,1 М раствора Na2CO3 добавлено 25 мл0,2 М раствора HCl. Вычислить рН раствора.
1. Na2CO3 + HCl NaHCO3 + NaCl
2. Na2CO3 + 2HCl H2CO3 + 2NaCl
(Na2CO3) = C(Na2CO3) · V = 50 · 0,1 = 0,5 мМ
(HCl) = C(HCl) · V = 25 · 0,2 = 0,5 мМ
26
27.
Идет реакция:Na2CO3 + HCl NaHCO3 + NaCl
В растворе кислая соль
pK1 + pK2
pH = —————
2
6,35 + 10,32
pH = —————— = 8,3
2
27






















 Химия
Химия








