Похожие презентации:
Основы химической кинетики. Лекция 6
1.
Лекция 6Основы химической кинетики
2.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТРаздел химии, изучающий механизмы химических реакций и скорости их
протекания, называется химической кинетикой.
Химические реакции классифицируют на гомогенные и гетерогенные:
Гомогенные реакции характеризуются отсутствием поверхности раздела
между реагентами, поэтому реакции протекают во всем объеме системы.
При гомогенных реакциях реагирующие вещества находятся в одном
агрегатном состоянии.
Например:
а) Реакции между газообразными веществами:
2 NO( г ) O2 ( г ) 2 NO2 ( г )
б) Реакции в растворах:
H 2 SO4 ( ж ) 2 NaOH ( ж ) Na2 SO4 2 H 2O
3.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТГетерогенные реакции характеризуются наличием поверхности раздела
фаз, где протекает взаимодействие субстрата и реагента.
При гетерогенных реакциях реагирующие вещества находятся в разных
агрегатных состояниях.
Например:
CaO( тв ) CO2 ( г ) CaCO3( тв )
4.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСкорость химической реакции определяется изменением концентрации
реагирующих веществ в единицу времени:
Скон Снач
кон нач
С
Если измерять концентрации веществ в молях на литр, а время – в секундах,
то единицей измерения скорости реакции будет моль/(л·с).
5.
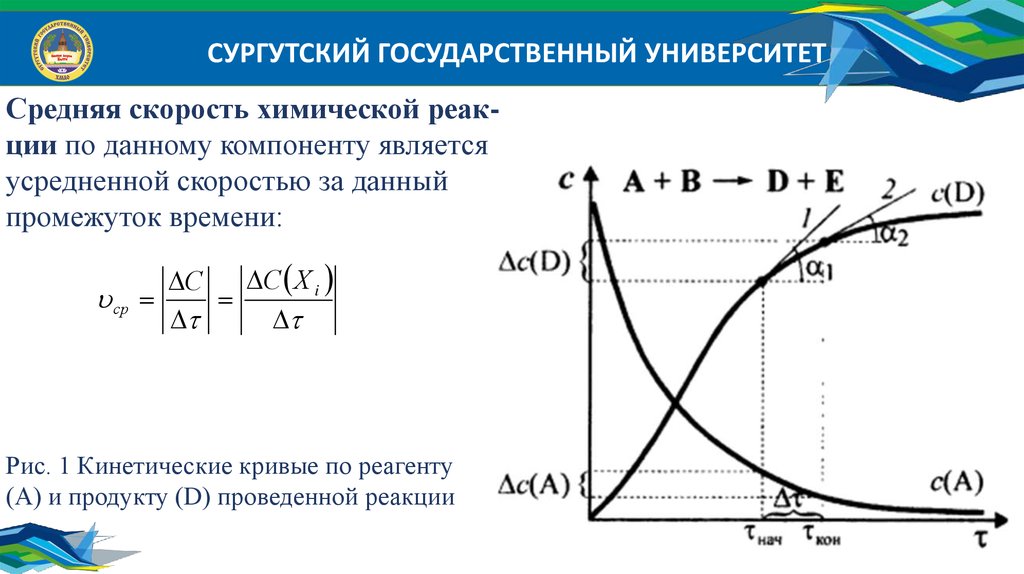
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСредняя скорость химической реакции по данному компоненту является
усредненной скоростью за данный
промежуток времени:
ср
С Х i
С
Рис. 1 Кинетические кривые по реагенту
(А) и продукту (D) проведенной реакции
6.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТИстинная скорость химической реакции характеризуется ее скорость в данный
промежуток времени 0 :
ист.
С X i dC X i
lim
0
d
Средняя скорость химической реакции по данному компоненту – это усредненная
скорость за данный промежуток времени
:
ср.
С
7.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМеханизм – это путь, т.е. последовательность элементарных актов
взаимодействия реагентов, через которые протекает реакция.
Классификация химических процессов по механизму:
1. Простые или элементарные реакции – это реакции, протекающие в одну
стадию.
Для таких реакций химическое уравнение полностью отражает, какие
частицы и в каких соотношения непосредственно участвуют в
элементарном акте взаимодействия.
Например:
а) I 2 I
2
б) H OH H O
2
в) O O O
2
3
8.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСложные реакции – это реакции, протекающие в несколько стадий,
каждая из которых является простой реакцией.
Например: реакция H 2 Cl2 2 HCl является сложной и протекает
через множество стадий, протекание которых идет по радикальному
механизму:
h
Cl2 Cl Cl 2Cl
Зарождение цепей:
Развитие (рост) цепей: Cl H 2 HCl H
H Cl2 HCl Cl
Обрыв цепей:
H Cl HCl
9.
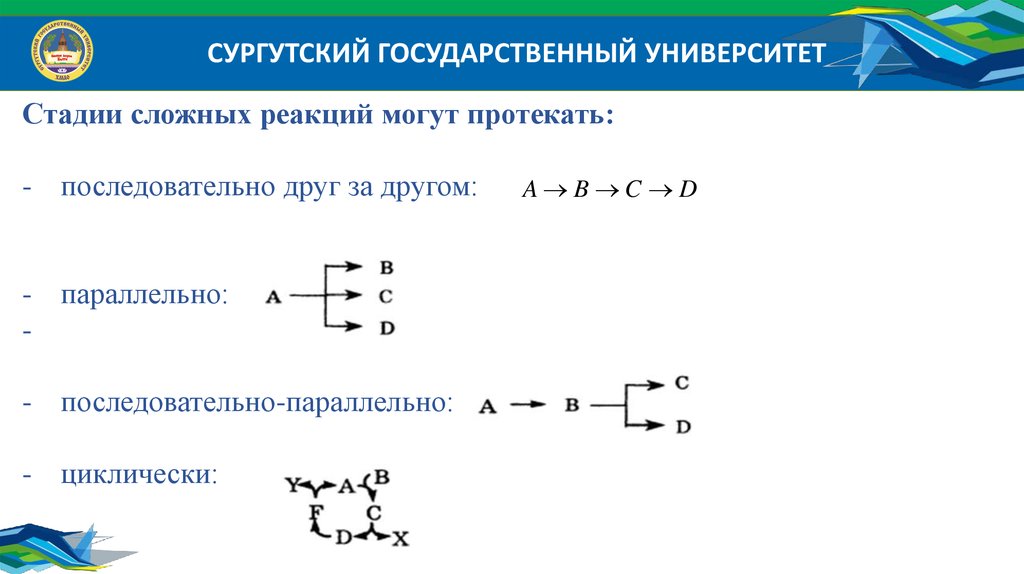
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСтадии сложных реакций могут протекать:
- последовательно друг за другом:
- параллельно:
- последовательно-параллельно:
- циклически:
A B C D
10.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ГОМОГЕННОЙ РЕАКЦИИ
1. Природа реагирующих веществ;
2. Концентрация реагентов;
3. Температура;
4. Катализатор.
11.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ
В зависимости от природы реагентов, скорость реакции будет меняться:
1. Реакции между молекулами и атомами протекают обычно медленно:
H 2 I 2
2 HI
медленно
2. Между ионами и радикалами – быстро:
H OH H 2O
быстро
H Cl HCl
быстро
12.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГЕНТОВ
Закон действующих масс: скорость простой гомогенной реакции при
постоянной температуре пропорциональна произведению концентрации
реагирующих веществ, возведенных в степени, численно равные их
стехиометрическим коэффициентам:
aA( ж ) bB( ж ) dD( ж ) fF( ж )
k A B
a
b
где a, b – стехиометрические коэффициенты;
[A], [B]- молярные концентрации реагентов, моль/л;
k – константа скорости реакции.
Значение константы скорости реакции численно равно скорости
реакции k при концентрациях реагентов, равных 1 моль/л.
13.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКинетическое уравнение химической гетерогенной реакции :
aA( тв ) bB( г ) dD( г )
имеет вид:
k B
nB
k - константа скорости реакции;
n B - порядок реакции по газообразному или растворенному
компоненту.
14.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКонстанта скорости реакции I порядка
A
субстрат
Р
k1
продукт
k1 A
моль
л
1
1
k1
,
с
A л с моль с
k1 , если А 1 моль/л
а - исходная концентрация субстрата;
(а-х) – текущая концентрация субстрата
х – концентрация продукта реакции, образующегося к моменту
времени τ;
15.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТТогда,
обр.прод.
dx
d
расх.субстр. k1 A тек. k1 a x
В состоянии равновесия:
обр.прод. расх.субстр.
т.е.
dx
k1 a x
d
16.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТИнтегрируем с разделением переменных:
x
dx
0 d 0 k1 a x
x
dx
0 a x 0 k1d
Получаем выражение:
ln a x k1 J
где J – постоянная интегрирования;
J ln a
при х=0 и τ=0
17.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПреобразуем:
ln a x k1 ln a
ln a x ln a k1
a
ln
k1
a x
Выразим константу скорости реакции:
1
a
k1 ln
a x
Проверить правильность анализа можно графическим
либо аналитическим методом.
18.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТln
a
f
a x
Рис. 2. Графическое определение порядка реакции
19.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТДля анализа удобно пользоваться полупериодом реакции, т.е. когда
прореагировало 0,5 субстрата.
1
k1
1
A
P
Тогда, 2
т.е. x a
2
1
a
2,3
a
k1 ln
lg
a x
a 0,5a
2,3
lg 2
2,3 0,301
0,693
Тогда время полупревращения будет:
;
0,693
k1
20.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКонстанта скорости реакции II порядка
2
A
субстрат
Р
k2
продукт
k 2 A
2
2
моль
л
л
k2
,
2
2
A л с моль моль с
а - исходная концентрация субстрата;
(а-х) – текущая концентрация субстрата;
х – концентрация продукта реакции, образующегося к
времени τ;
моменту
21.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТТогда,
обр.прод.
dx
d
расх.субстр. k2 A
2
тек.
В состоянии равновесия:
k2 a x
обр.прод. расх.субстр.
т.е.
dx
2
k 2 a x
d
2
22.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТИнтегрируем с разделением переменных:
2
x
dx
0 d 0 k2 a x
x
dx
0 a x 2 0 k2d
Получаем выражение:
1
k2 J
a x
1
где J – постоянная интегрирования J
a
при х=0 и τ=0
23.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПреобразуем:
1
1
k 2
a x
a
a a x
k 2
a a x
x
k2
a a x
1
x
Выразим константу скорости реакции: k2
a a x
Проверить правильность анализа можно графическим либо
аналитическим методом.
24.
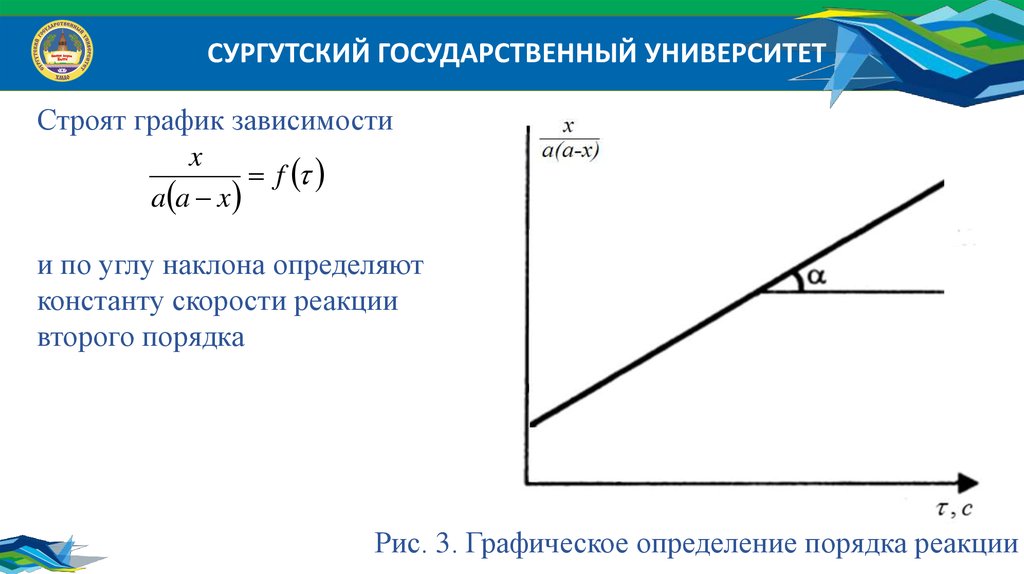
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСтроят график зависимости
x
f
a a x
и по углу наклона определяют
константу скорости реакции
второго порядка
Рис. 3. Графическое определение порядка реакции
25.
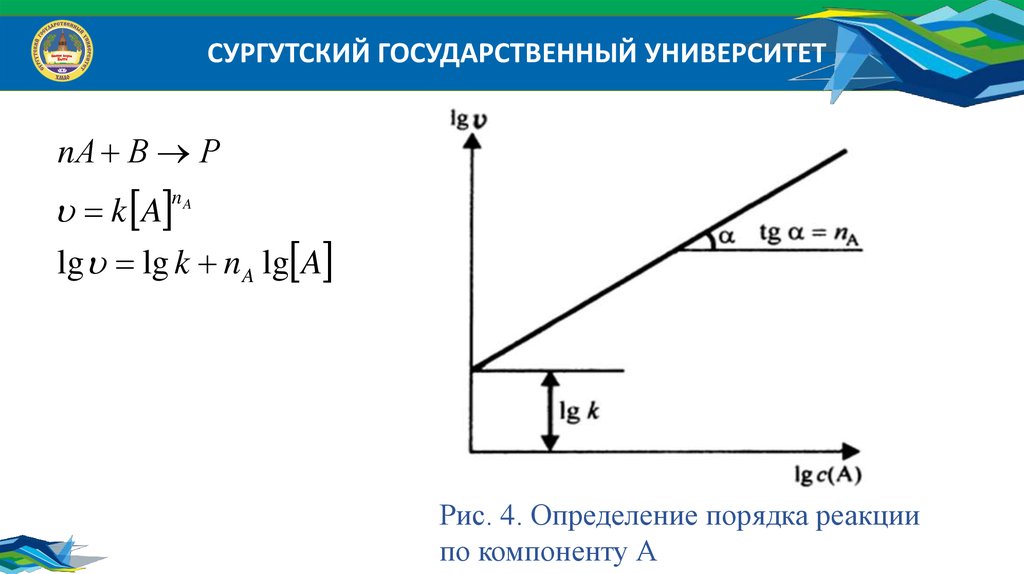
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПорядок реакции по реагенту равен показателю степени, в которую надо
возвести концентрацию данного реагента в кинетическом уравнении
сложной реакции, чтобы вычисленная по этому уравнению скорость была
равна скорости, найденной экспериментально.
k A B
nA
nB
где n A , nB - порядок реакции по реагентам А и В соответственно.
26.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТnА В Р
k A
lg lg k n A lg A
nA
Рис. 4. Определение порядка реакции
по компоненту А
27.
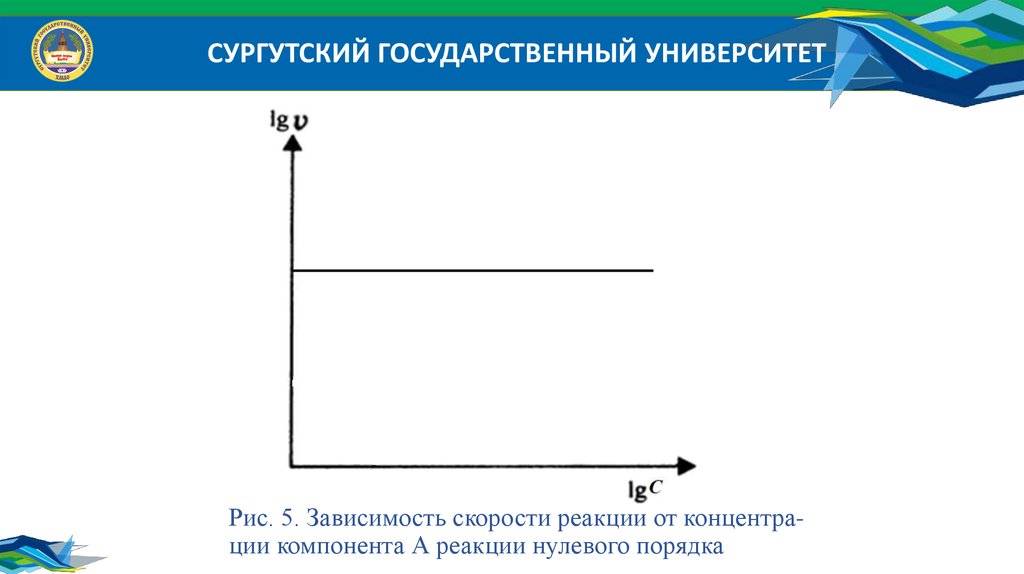
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТРис. 5. Зависимость скорости реакции от концентрации компонента А реакции нулевого порядка
28.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ2. Метод подстановки в формулы
Заключается в том, что опытные результаты (текущие концентрации
веществ в моменты времени (t) последовательно подставляются в
интегральные кинетические уравнения реакций нулевого ( k 0 a x
t
),
1
x
a
первого ( k1 ln
), второго ( k2
) порядков и
a a x
a x
1
определяется, какое из уравнений дает практически постоянную величину
константы скорости. Именно это уравнение и определяет порядок
исследуемой реакции.
29.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМолекулярность реакции
определяет число молекул, участвующих в элементарном
взаимодействия.
акте
Молекулярность часто не совпадает с порядком реакции, т.к. трудно
представить одновременное взаимодействие трех или более молекул
30.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТНапример:
R Cl NaOH R OH
субстрат
реагент
основн.продукт
NaCl
побочн.продукт
S N 1 - для третичных галоген производных углеводородов:
k1 CH 3 3 CCl
31.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТНапример:
R Cl NaOH R OH
субстрат
реагент
основн.продукт
NaCl
побочн.продукт
S N 2 - для первичных галоген производных углеводородов:
k 2 C 2 H 5 Cl OH
32.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКоличественные закономерности константы скорости реакции
от температуры
B
k константа скорости реакции;
RT
k
Ae
e экспонента;
A предэкспоненциальный множитель, равный числу соударений
молекул в реакционной смеси.
Аэксп < < < Атеор
A 4 1013 4 1014 см 3 / моль с
Aтеор 109 см 3 / моль с
A P z
z число соударений;
P число активных соударений.
33.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЧисло активных соударений представляет собой энтропийный фактор:
d ln K P H
2
dt
RT
Ea Ea 2 Ea1 H
Тогда получаем уравнение Вант-Гоффа:
k Ae
k Ae
Ea
RT
H
RT
34.
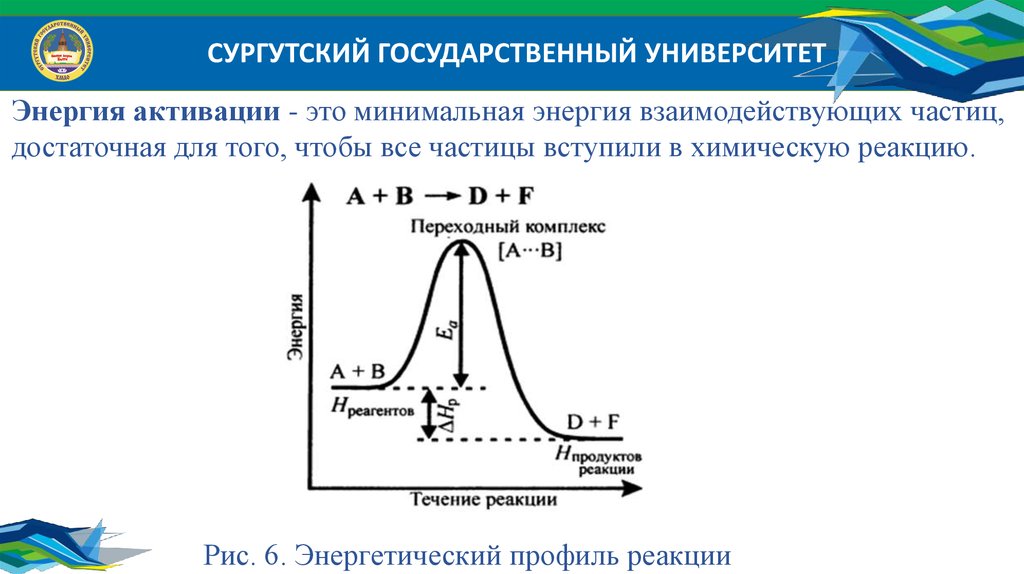
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭнергия активации - это минимальная энергия взаимодействующих частиц,
достаточная для того, чтобы все частицы вступили в химическую реакцию.
Рис. 6. Энергетический профиль реакции
35.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭнергия активации является очень важной энергетической характеристикой
реакции, которая связана с константой скорости реакции уравнением
Аррениуса:
Ea
k A e
где
RT
k константа скорости реакции при температуре Т, К;
A предэкспоненциальный коэффициент (коэффициент Аррениуса,
учитывающий частоту столкновения частиц, ориентированных
определенным образом;
e основание натурального логарифма;
E a энергия активации, Дж/моль;
R 8,31 Дж /( моль К ) - универсальная газовая постоянная.
36.
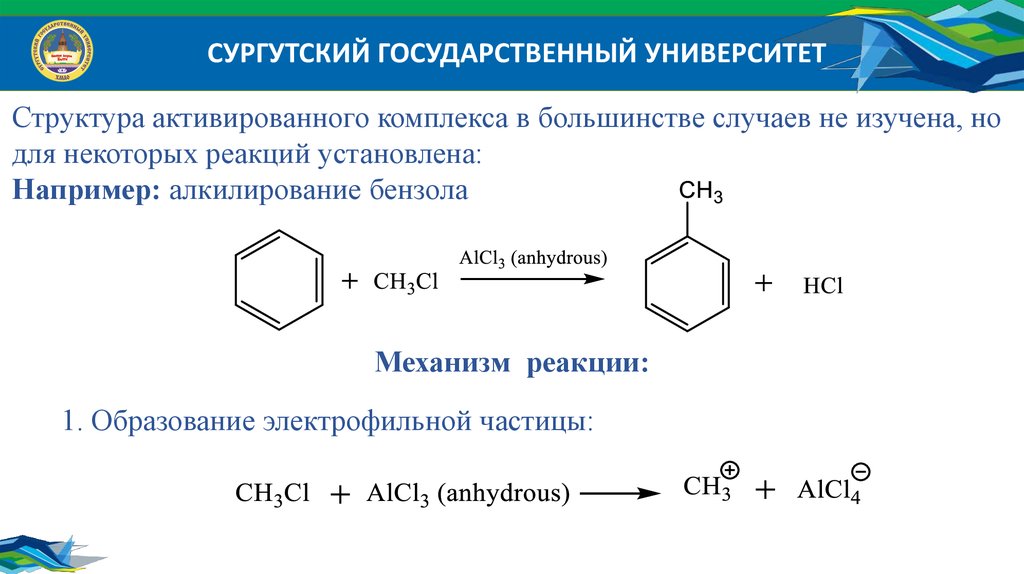
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСтруктура активированного комплекса в большинстве случаев не изучена, но
для некоторых реакций установлена:
Например: алкилирование бензола
Механизм реакции:
1. Образование электрофильной частицы:
37.
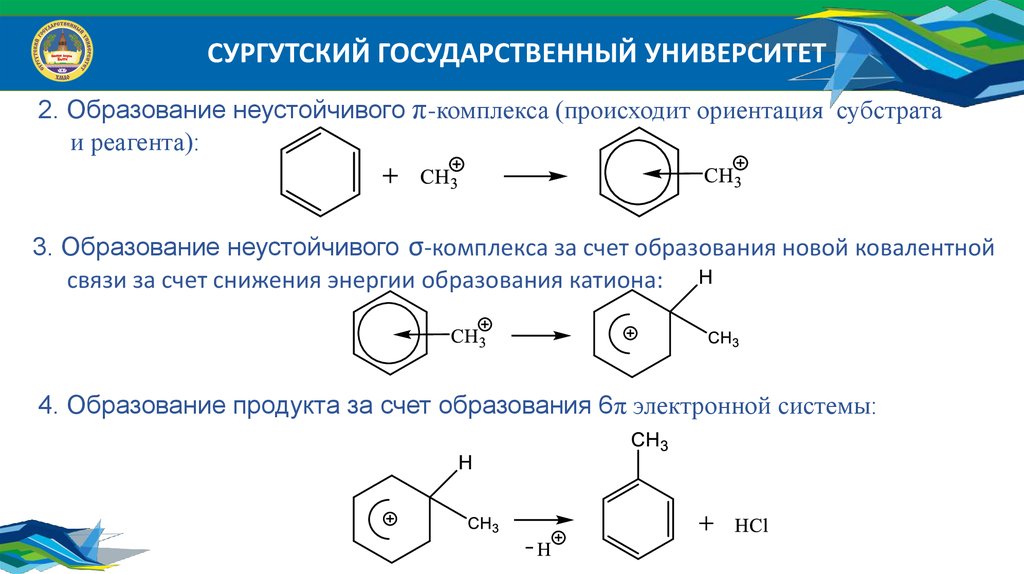
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ2. Образование неустойчивого π-комплекса (происходит ориентация субстрата
и реагента):
3. Образование неустойчивого σ-комплекса за счет образования новой ковалентной
связи за счет снижения энергии образования катиона:
4. Образование продукта за счет образования 6π электронной системы:
38.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЗначение энергии активации реакции можно определить, измерив
константы скорости этой реакции при двух разных температурах и
Ea1
E
a2
используя следующее уравнение:
RT1
kT 1 A e
kT 2 A e RT2
k1 , k 2 - константы скорости реакции при температурах Т 1 ,Т 2 .
Ea 2
RT2
k2 A e
Ea1
k1 A RT 1
e
k 2 Ea 2 Ea1
ln
k1 RT2 RT1
k 2 Ea 1 1
ln
k1
R T1 T2
39.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭнергия активации - это минимальная энергия взаимодействующих частиц,
достаточная для того, чтобы все частицы вступили в химическую реакцию:
RT1T2 k 2
Ea
ln
T2 T1 k1
где k константа скорости реакции при температуре Т, К;
Т1 , Т 2 абсолютные температуры, К;
Ea энергия активации, Дж/моль;
R 8,31 Дж /( моль К ) - универсальная газовая постоянная.
40.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РЕАКЦИИ
Уравнение Вант-Гоффа: с увеличением температуры на каждые 10°С (К)
скорость химической реакции возрастает в 2 – 4 раза:
2 1
Т 2 Т1
10
γ (гамма) температурный коэффициент скорости реакции,
показывающий, во сколько раз увеличивается скорость реакции при
увеличении температуры на каждые 10 К;
1 , 2 - скорости реакции при температурах Т1 ,Т 2 соответственно.
k 2 k1
Т 2 Т1
10
41.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТТеория активных столкновений
1. Не каждое столкновение приводит к акту химического
взаимодействия;
2. К химическому взаимодействию приводят только те
столкновения, в которых участвуют частицы, обладающие
энергией, необходимой для данного взаимодействия (энергией
активации);
3. При соударении частицы должны быть определенным образом с
ориентированы относительно друг друга.
42.
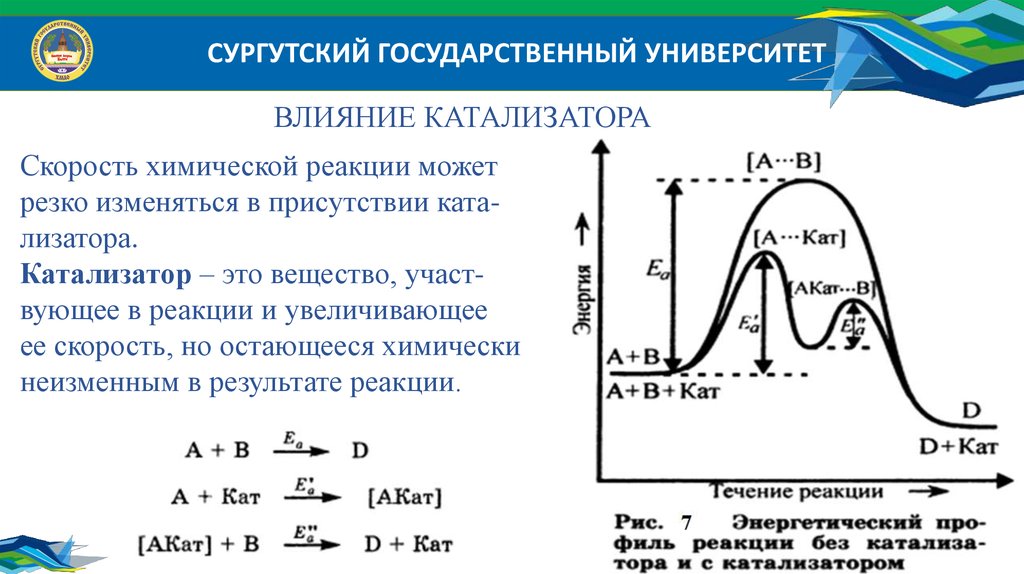
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВЛИЯНИЕ КАТАЛИЗАТОРА
Скорость химической реакции может
резко изменяться в присутствии катализатора.
Катализатор – это вещество, участвующее в реакции и увеличивающее
ее скорость, но остающееся химически
неизменным в результате реакции.
43.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химические реакции бывают необратимые и обратимые:
Необратимые химические реакции – это реакции, протекающие только
в одном направлении до полного израсходования одного из реагирующих
веществ.
44.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТОбратимые – это реакции, в которых одновременно протекают две
взаимно противоположные реакции – прямая и обратная.
Примером обратимых процессов являются реакции образования и
разложения иодоводорода или сложного эфира:
45.
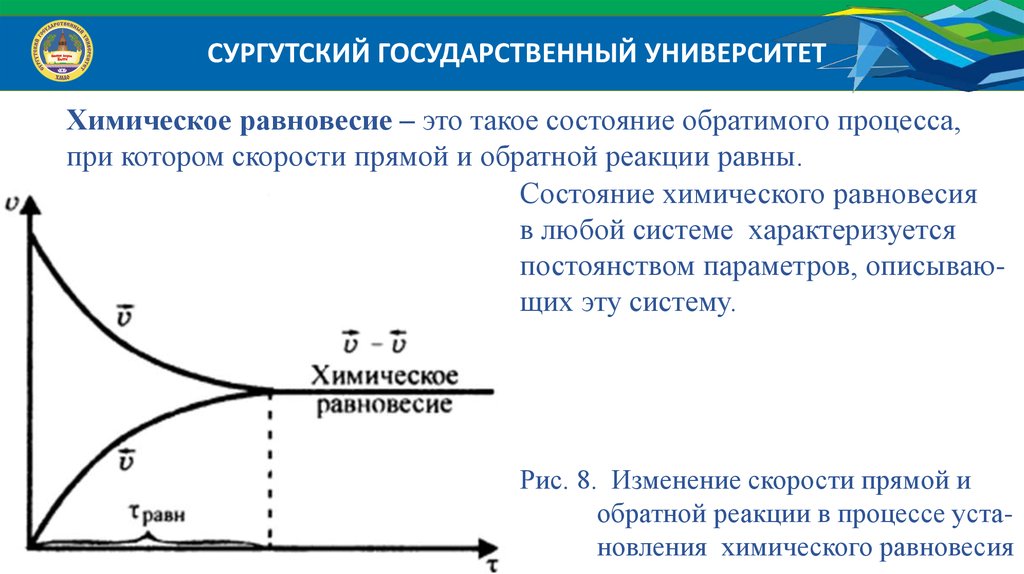
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТХимическое равновесие – это такое состояние обратимого процесса,
при котором скорости прямой и обратной реакции равны.
Состояние химического равновесия
в любой системе характеризуется
постоянством параметров, описывающих эту систему.
Рис. 8. Изменение скорости прямой и
обратной реакции в процессе установления химического равновесия
46.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ1.
2.
3.
4.
Особенности состояния химического равновесия
Динамический характер химического равновесия – прямая и обратная
реакции не прекращаются, а протекают с равными скоростями;
Постоянство состояния химического равновесия во времени – при
неизменных внешних условиях состав равновесной системы не
меняется (равновесные концентрации постоянны);
Подвижность равновесия – при изменении внешних условий
происходит смещение химического равновесия, т.е. установление
новых равновесных концентраций всех реагирующих веществ;
Возможность подхода к состоянию равновесия с двух сторон – как со
стороны исходных веществ, так и со стороны продуктов реакции.
47.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВыведем, чему равна константа равновесия процесса, протекающего
в гомогенной системе:
aA bB dD fF
В состоянии химического равновесия скорость прямой реакции равна
скорости обратной реакции:
k A B k D F
a
K равн.
b
k
k
d
D F
a
b
A B
d
f
f
48.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКонстанта химического равновесия обратимого процесса равна
отношению произведения равновесных концентраций продуктов реакции
к произведению концентраций исходных веществ в степенях их
стехиометрических коэффициентов:
aA( ж ) bB( ж ) сС( ж ) dD( ж )
C D
Kc
a
b
A B
c
d
Если Кравн > 1, то в системе выше содержание конечных продуктов, т.е.
равновесие смещено влево (←);
Если Кравн < 1, то в системе выше содержание исходных веществ, т.е.
равновесие смещено вправо (→);
49.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ1.
2.
3.
4.
Смещение химического равновесия
Влияние температуры;
Концентрации веществ;
Давления (в системах газообразных веществ);
Влияние катализатора.
Принцип Ле Шателье:
Если на систему, находящуюся в состоянии химического равновесия, оказывать воздействие путем изменения концентрации реагентов, давления
или температуры в системе, то равновесие всегда смещается в направлении той реакции, протекание которой ослабляет это воздействие.
50.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВлияние концентрации реагентов
на смещение химического равновесия
aA bB cC dD
C D
KС
a
b
A B
c
d
51.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВлияние давления реагентов
на смещение химического равновесия
aA г bB г cC г dD г
P P
Kp
P P
c
C
a
A
d
D
b
B
52.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВлияние температуры на состояние химического равновесия:
aA г bB г cC г dD г Q
P P
Kp
P P
c
C
a
A
aA г bB г cC г dD г Q
aA bB dD fF
d
D
b
B
k A B k D F
a
K равн.
b
k
k
d
D F
a
b
A B
d
f
f
53.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВлияние катализатора
Катализатор не вызывает смещения химического равновесия, а лишь
ускоряет его наступление
54.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПринцип адаптивных перестроек
Любая живая система при воздействии на нее перестраивается так,
чтобы уменьшить это воздействие.
55.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСпасибо за внимание!
Вопросы?













































 Химия
Химия








