Похожие презентации:
Электрофильное замещение в ароматических соединениях, SE
1.
Электрофильное замещениев ароматических
соединениях, SE.
1
2.
ОСОБЕННОСТИ СТРОЕНИЯ и РЕАКЦИОННОЙСПОСОБНОСТИ АРЕНОВ (Ar).
2
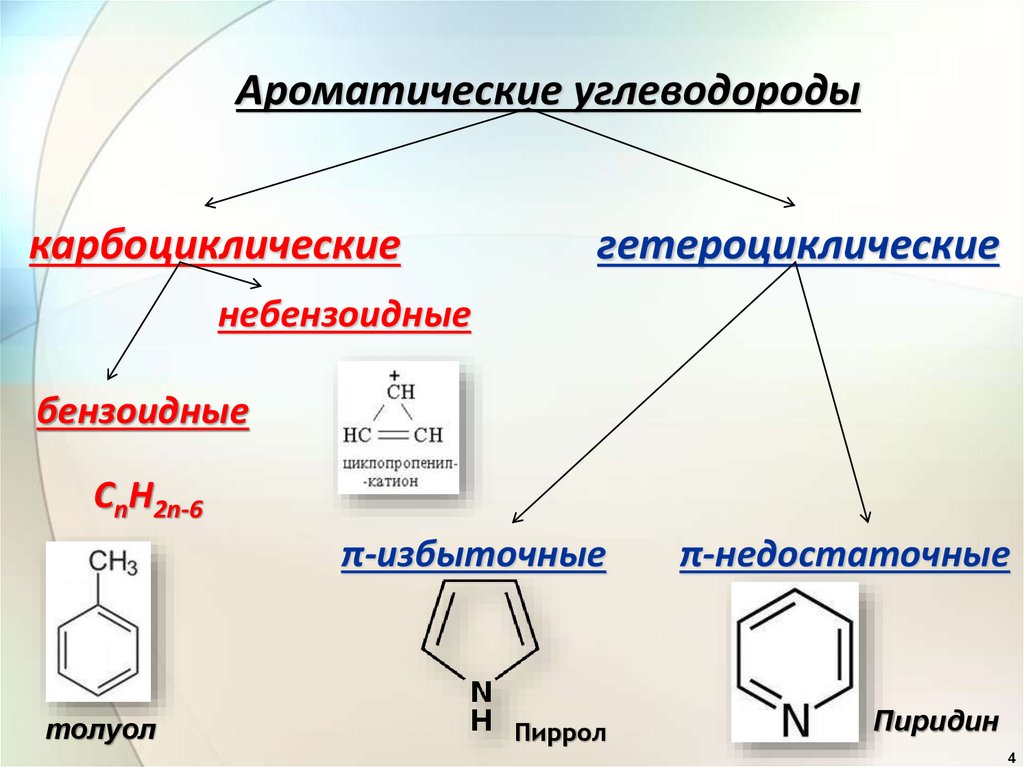
3.
Ароматические углеводороды (арены)одноядерные
многоядерные
бензол
8
1
7
2
3
6
5
4
нафталин
3
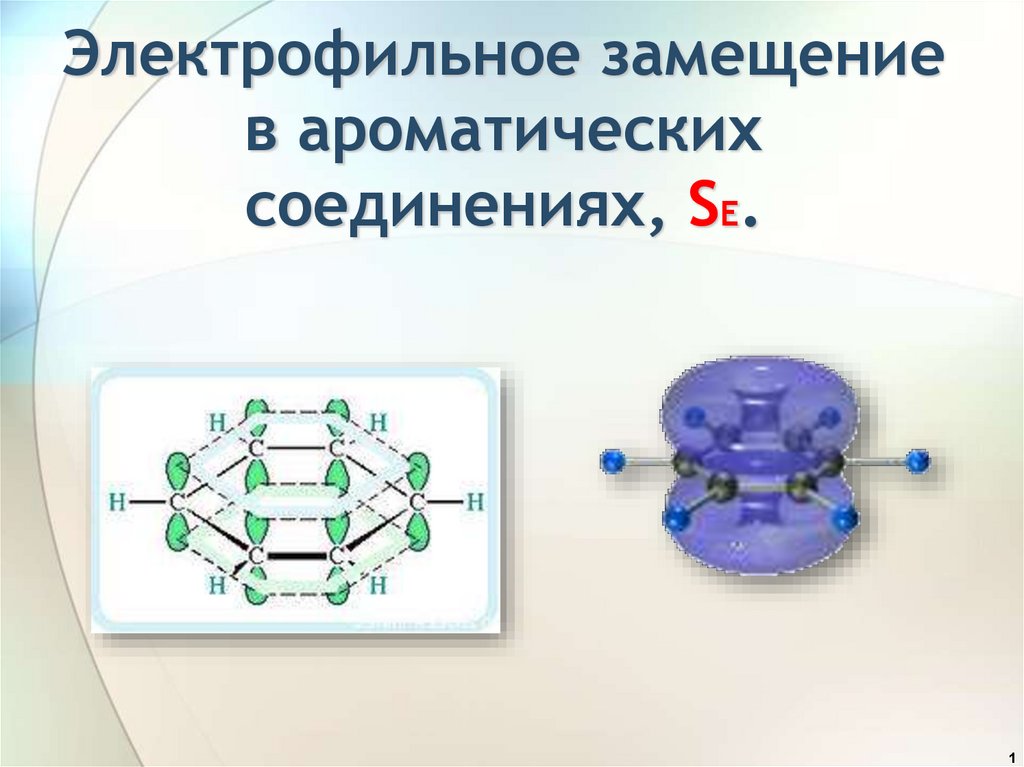
4.
Ароматические углеводородыкарбоциклические
гетероциклические
небензоидные
бензоидные
СnH2n-6
π-избыточные
толуол
Пиррол
π-недостаточные
Пиридин
4
5.
АреныСтроение молекулы бензола
H
H
C
H
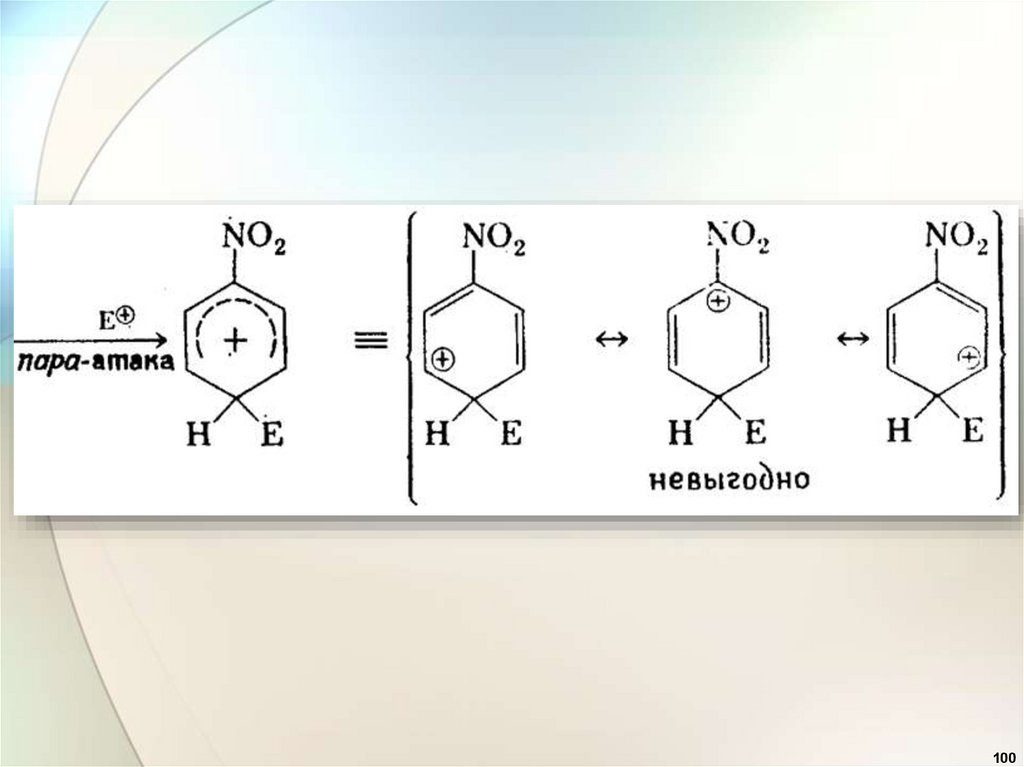
C
C
C
C
H
H
6 электронов в
делокализованной
- связи
C
H
5
6.
АреныСтроение молекулы бензола
6
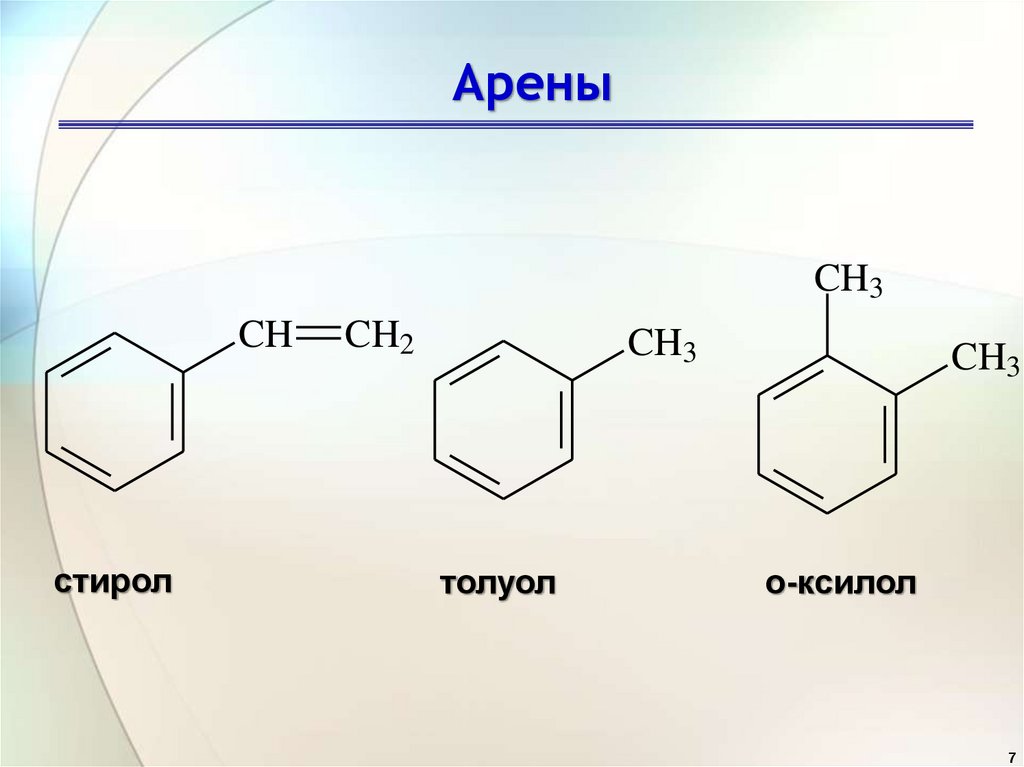
7.
АреныCH3
CH
стирол
CH2
CH3
толуол
CH3
о-ксилол
7
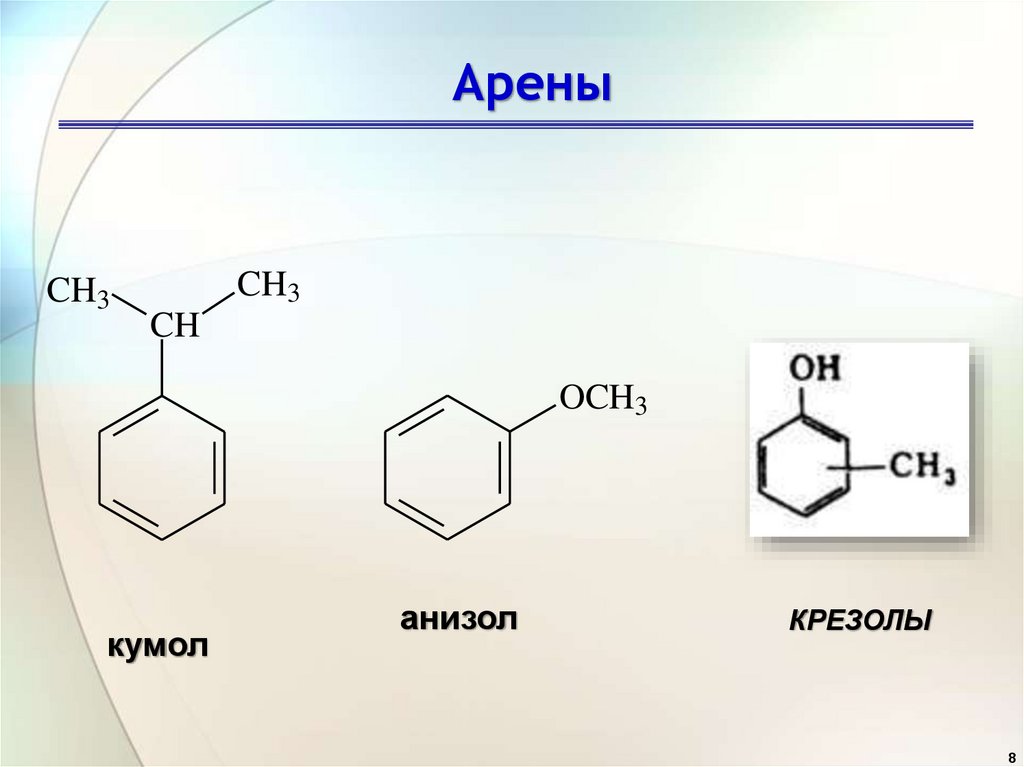
8.
АреныCH3
CH3
CH
OCH3
кумол
анизол
КРЕЗОЛЫ
8
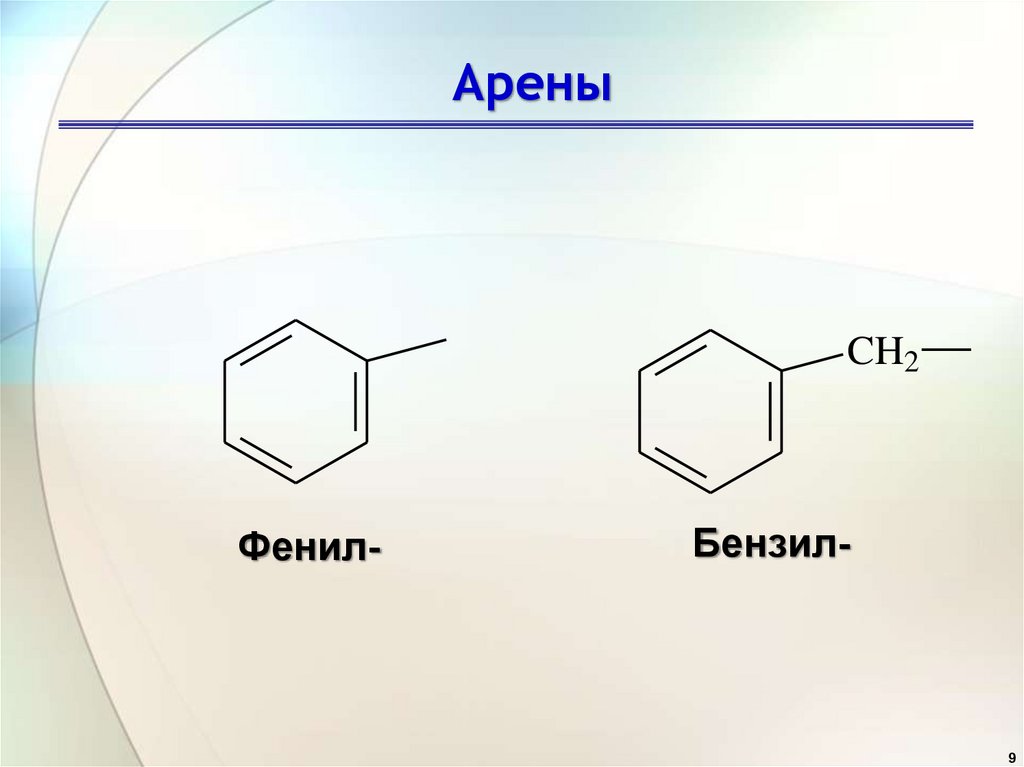
9.
АреныCH2
Фенил-
Бензил-
9
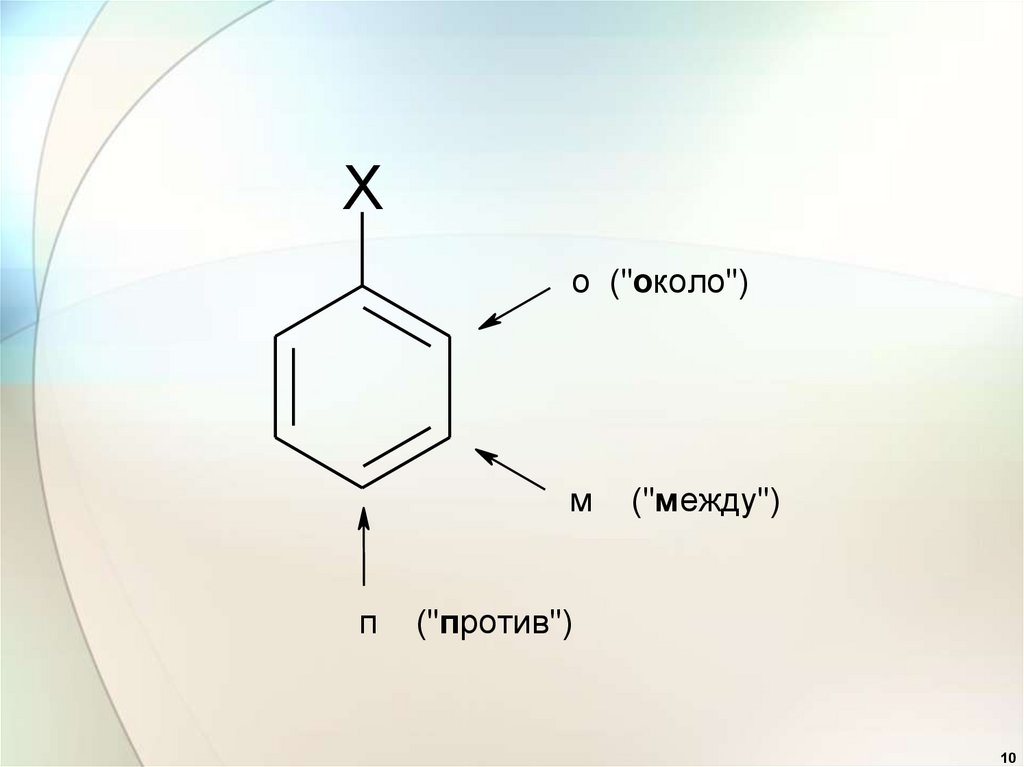
10.
Xо ("около")
м
п
("мeжду")
("против")
10
11.
Реакции электрофильногозамещения, SЕ
11
12.
SЕI.
12
13.
II.II. Образование -комплекса
13
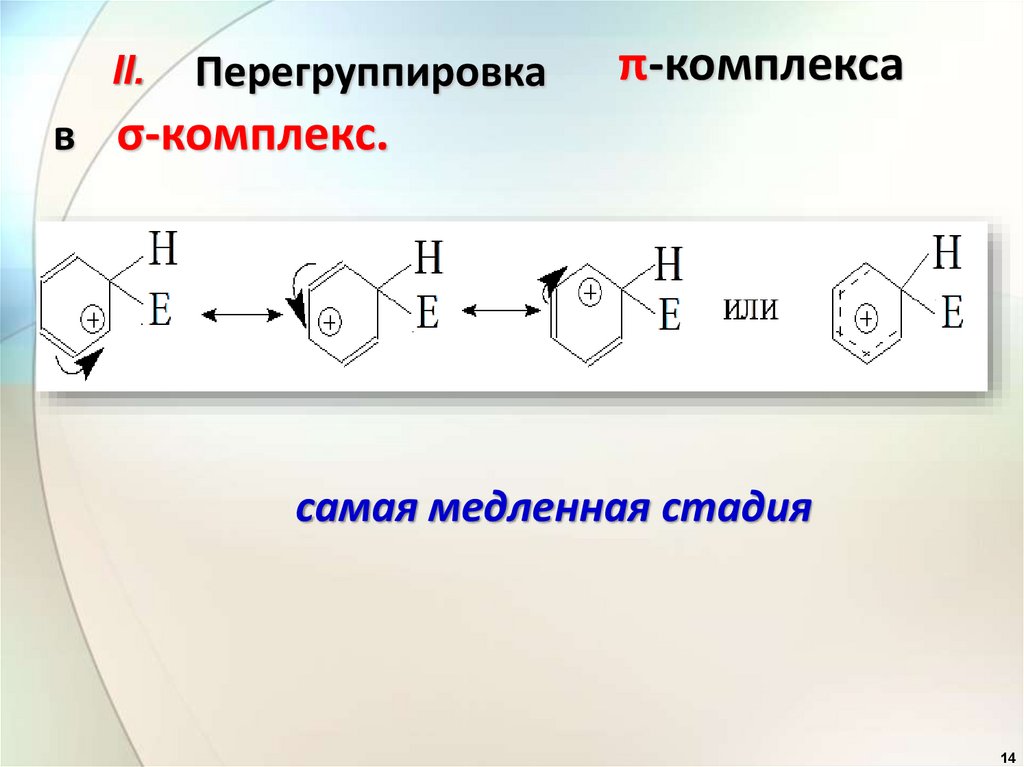
14.
II.Перегруппировка
π-комплекса
в σ-комплекс.
самая медленная стадия
14
15.
III.Реароматизация
- Н+
15
16.
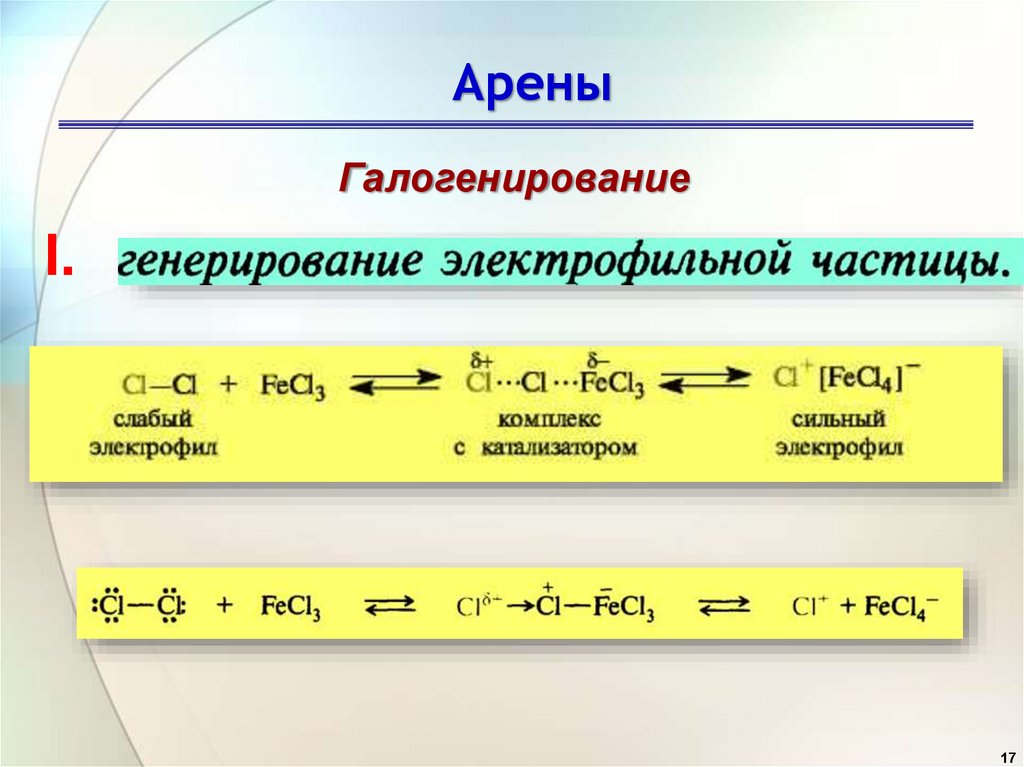
Арены1. Галогенирование
Cl
+ Cl2
FeCl3, 25°C
+ HCl
хлорбензол
16
17.
АреныГалогенирование
I.
17
18.
• Для хлорирования в лабораторных условияхиспользуют
смесь HOCl с кислотой (хлор газ!):
HO
Сl + H
Быстро
H
H
O
Сl
Медленно
Сl
+
H2O .
Хлорноватистая кислота
18
19.
АреныГалогенирование (Радикальное замещение)
CH3
+ Cl2
CH2Cl
hv
+ HCl
SR
19
20.
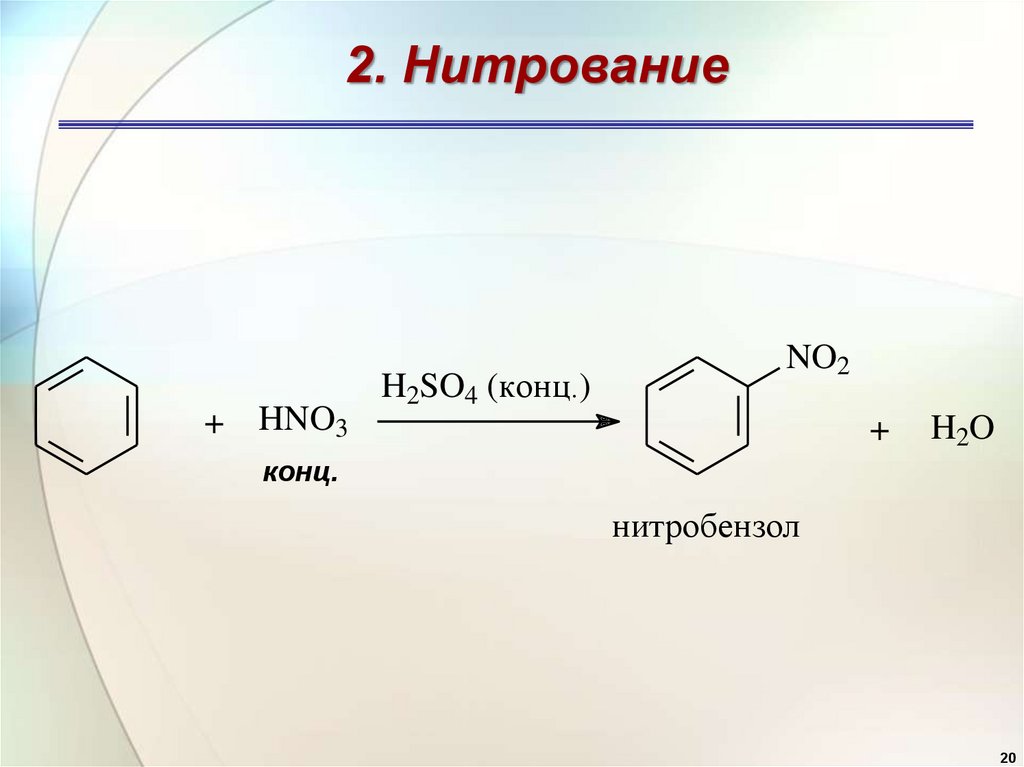
2. Нитрование+ HNO3
H2SO4 (конц.)
NO2
+
H2O
конц.
нитробензол
20
21.
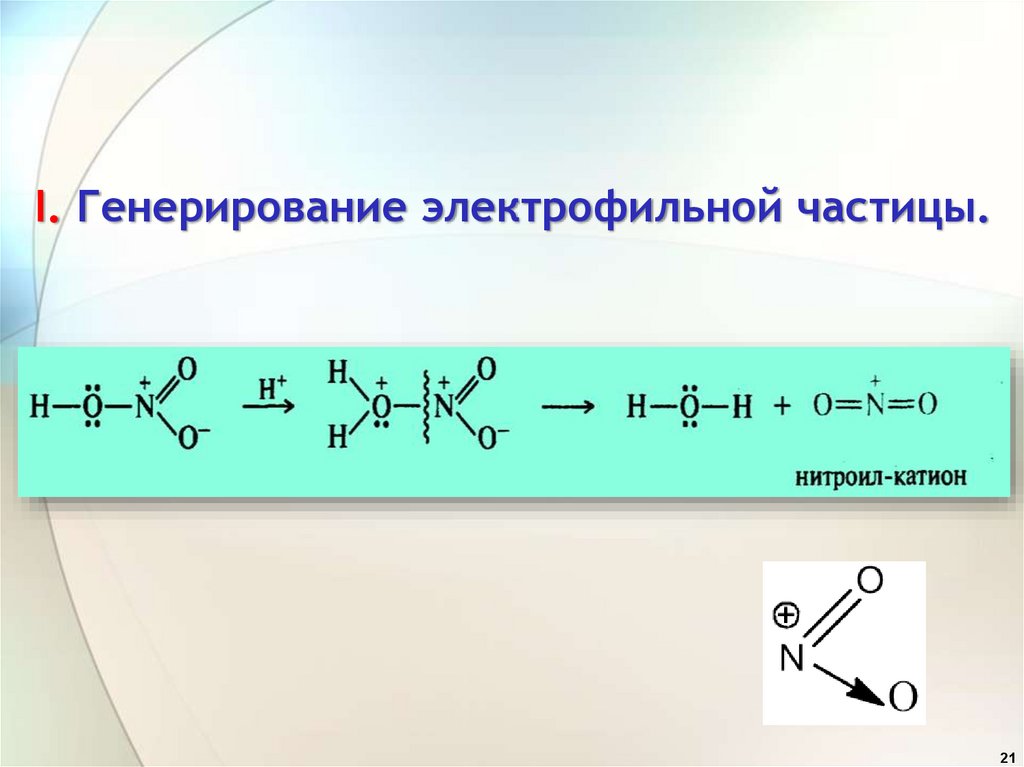
I. Генерирование электрофильной частицы.21
22.
CH3CH3
HNO3 H2SO4
NO2
O2N
-H2O
NO2
2,4,6-тринитротолуол
(тротил, тол, ТНТ)
Тротиловый эквивалент
антимикотик
используется для оценки энергии,
выделяющейся при ядерных
взрывах,
подрывах химических взрывчатых
устройств, падениях астероидов,
взрывах вулканов.
(противогрибковые препараты «Ликватол», «Унгветол»)
22
23.
3. Алкилирование по Фриделю - Крафтсу1877-1878 гг.
получение алкилбензолов
23
24.
Реакция Фриделя—КрафтсаСтраница из блокнота Фриделя
Крафтс (Crafts) Джеймс
Мейсон
(8.3.1839 — 20.6.1917, США)
Фридель (Friedel) Шарль
(12.3.1832 — 20.4.1899,
Франция)
24
25.
I. Генерирование электрофильной частицы.+
25
26.
I. Перегруппировки катионов1,2-гидридный
сдвиг
перв.
втор.
н.пропилхлорид
26
27.
2728.
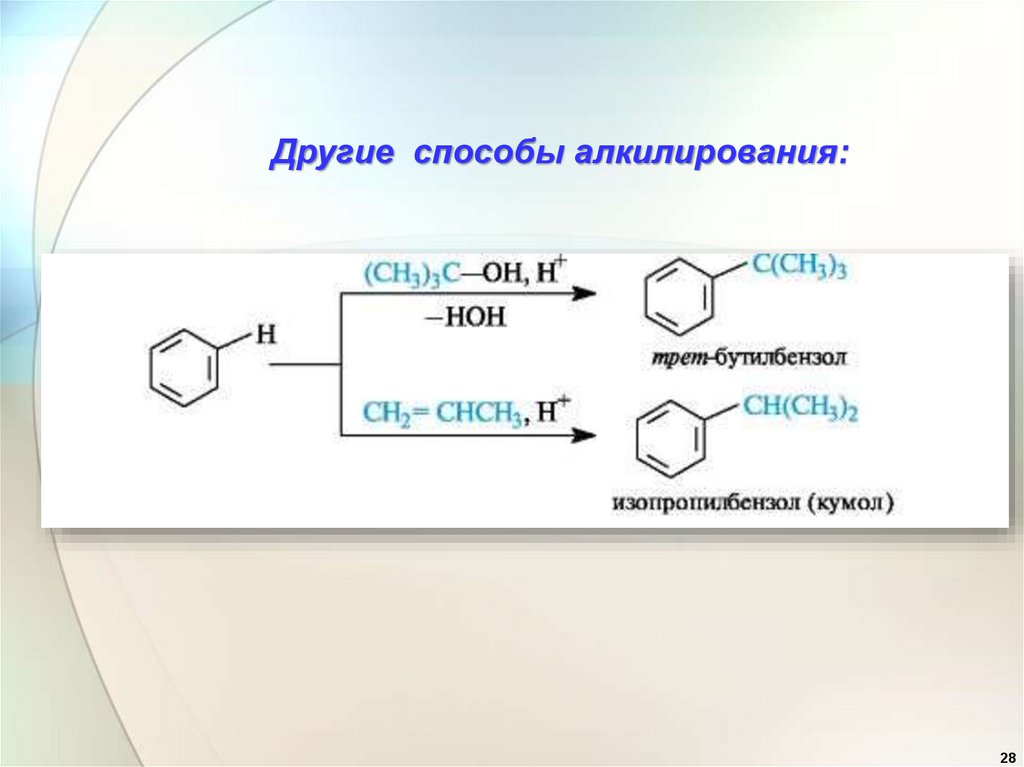
Другие способы алкилирования:28
29.
Полиалкилирование:29
30.
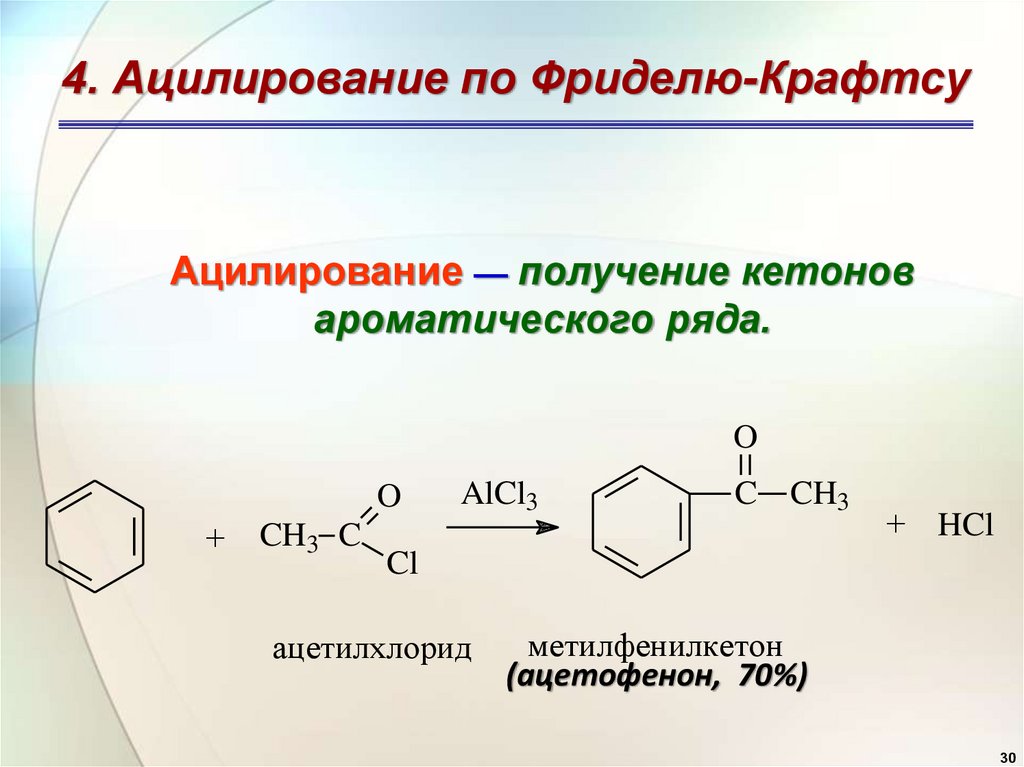
4. Ацилирование по Фриделю-КрафтсуАцилирование — получение кетонов
ароматического ряда.
O
O
+
CH3 C
AlCl3
C CH3
+ HCl
Cl
ацетилхлорид
метилфенилкетон
(ацетофенон, 70%)
30
31.
АцилированиеI. Генерирование электрофильной частицы.
Хлорангидрид
кислоты
↔
31
32.
•5.Сульфирование.
SO3H
олеум
SO3
H2SO4
дым.
бензолсульфоновая
кислота (55%)
32
32
33.
I. Сульфирующий агентОксид серы (VI)
SO3
O
δ+ S = O
O
33
34.
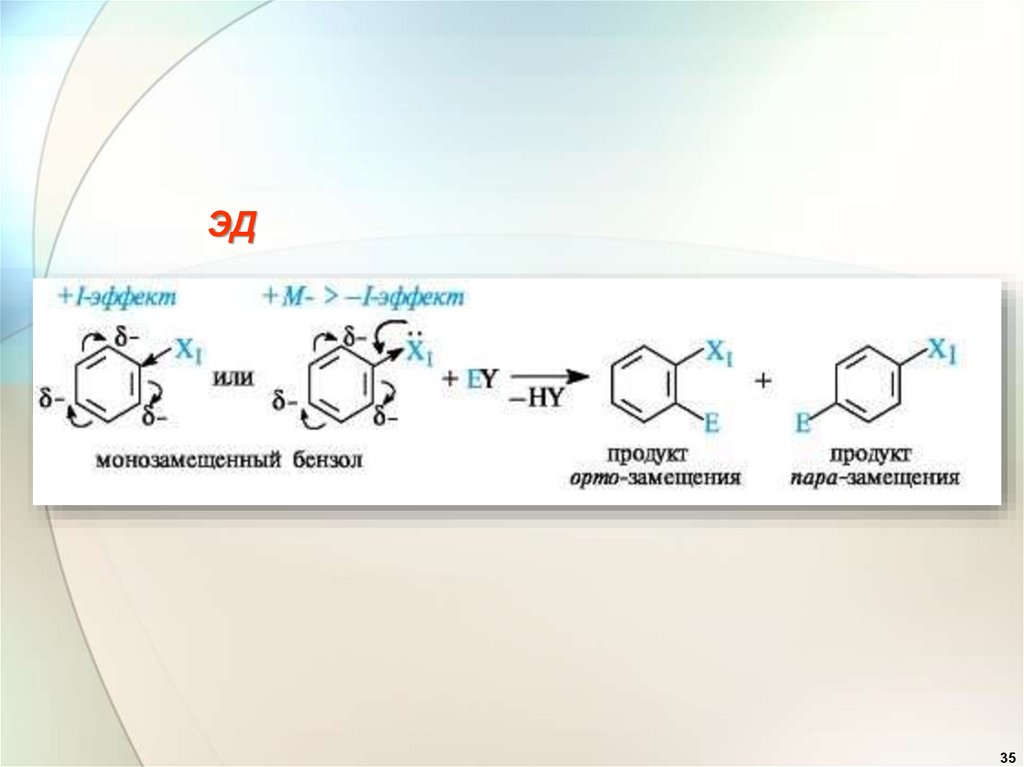
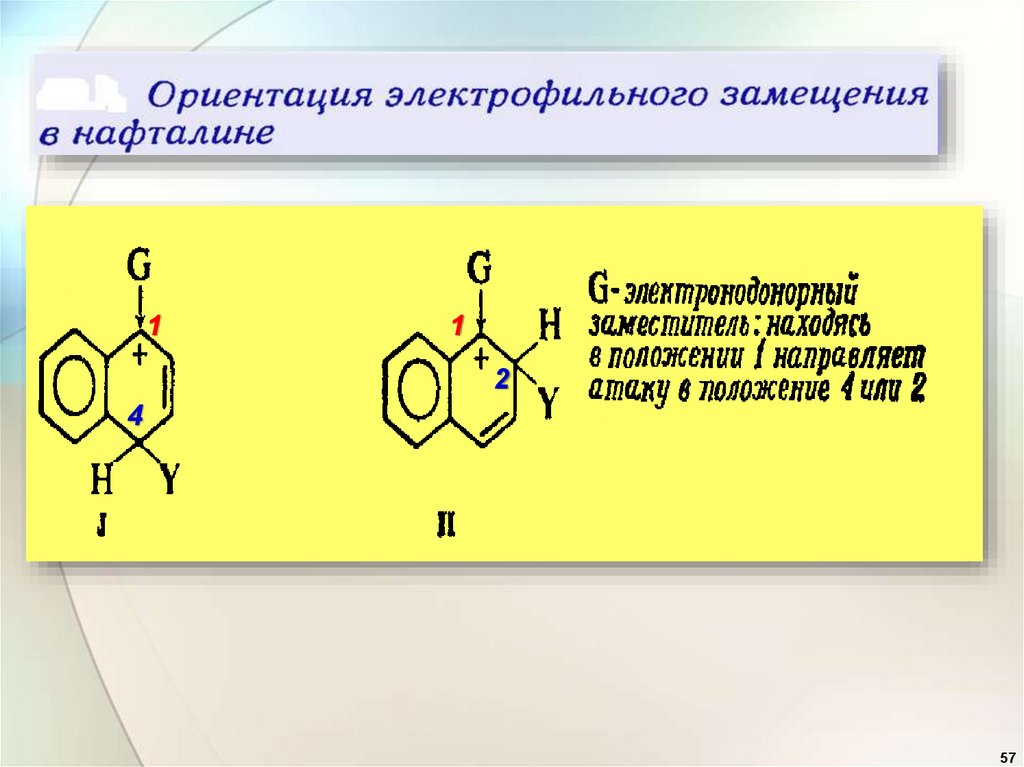
Ориентирующее действиезаместителей в бензольном
ядре.
34
35.
ЭД35
36.
Эффекты заместителей приэлектрофильном замещении
1. Заместители (ориентанты) первого рода
(доноры):
—ОН, —OR, —OCOR, —
SH,- SR, —NH2, —NHR, -NR2 ,
NHCOCH3 , -Alk, –C6H5,
Они активируют бензольное кольцо и
ориентируют новый заместитель в орто- и
пара-положения ( орто- и пара-ориентанты).
.
36
37.
3738.
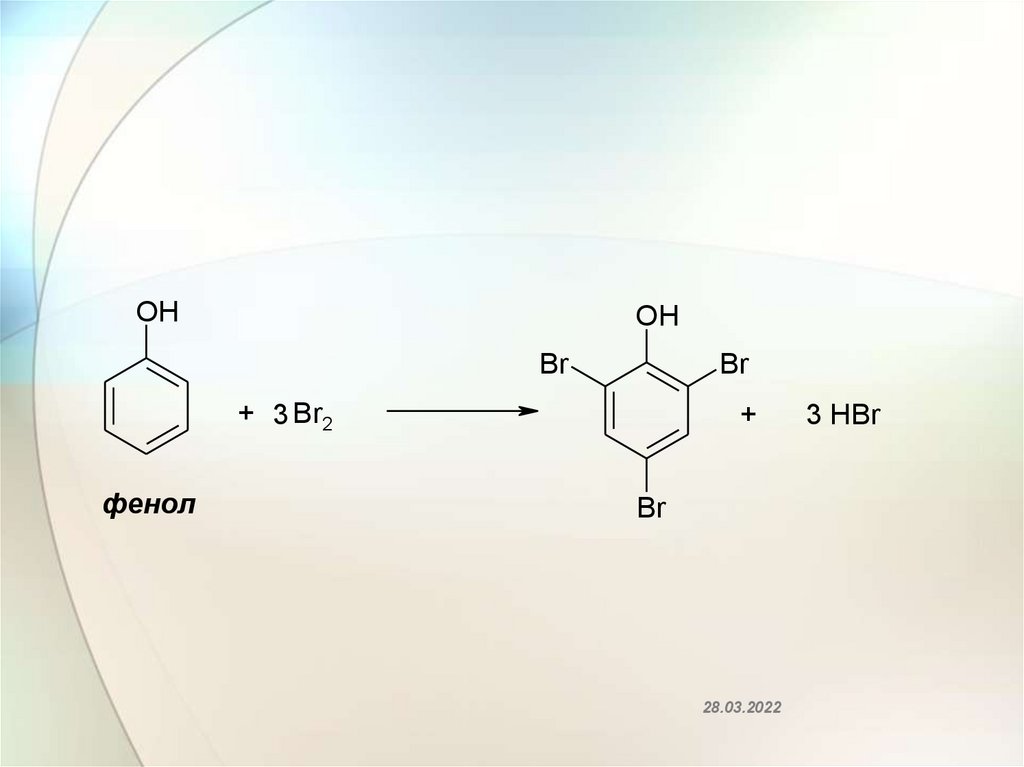
OHOH
Br
Br
+ 3 Br2
фенол
+
Br
28.03.2022
3 HBr
39.
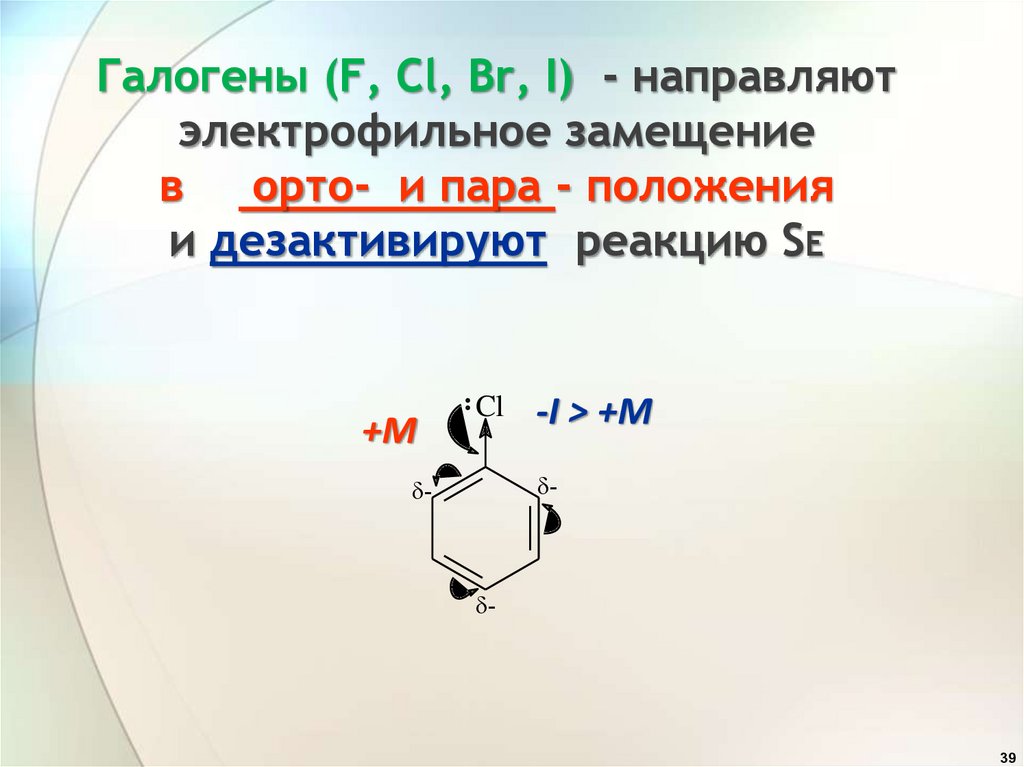
Галогены (F, Cl, Br, I) - направляютэлектрофильное замещение
в
орто- и пара - положения
и дезактивируют реакцию SE
+М
Cl
-I > +M
-
-
-
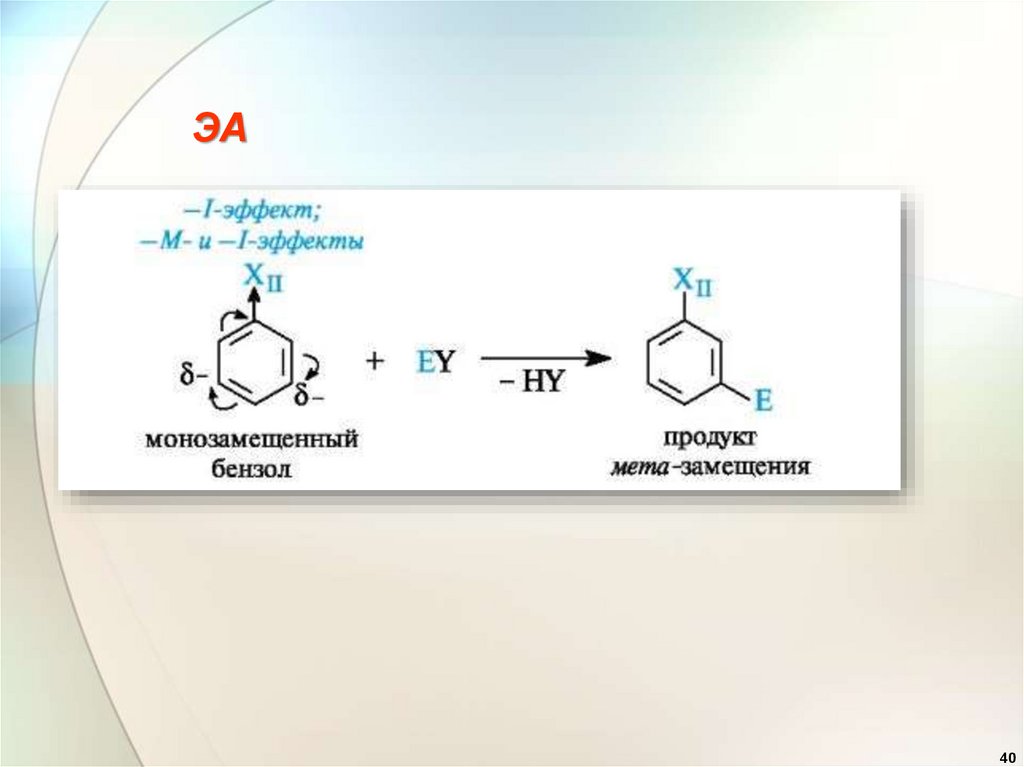
39
40.
ЭА40
41.
Эффекты заместителейпри электрофильном замещении
2. Заместители (ориентанты) второго рода
(акцепторы):
—CN, —СООН, —SO3H, —
СНО, —COR, —COOR, —NO2 дезактивируют
бензольное кольцо и вновь входящий
заместитель ориентируют в мета-положение
(мета-ориентанты).
41
42.
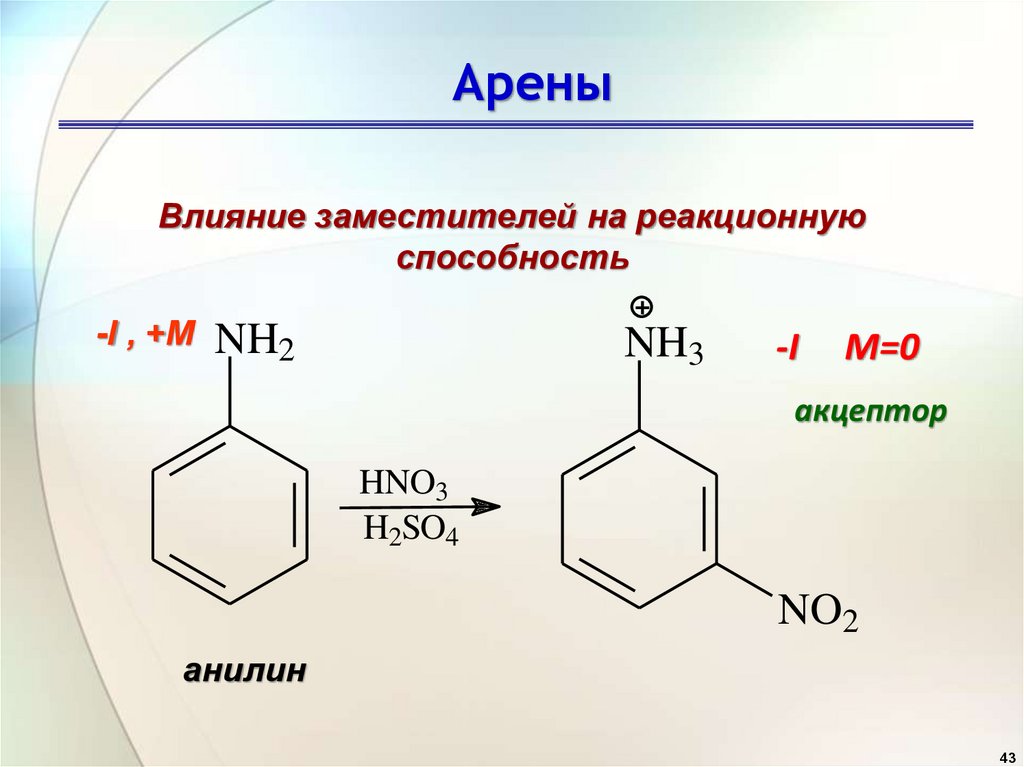
4243.
АреныВлияние заместителей на реакционную
способность
-I , +M
NH2
NH3
-I
M=0
акцептор
HNO3
H2SO4
NO2
анилин
43
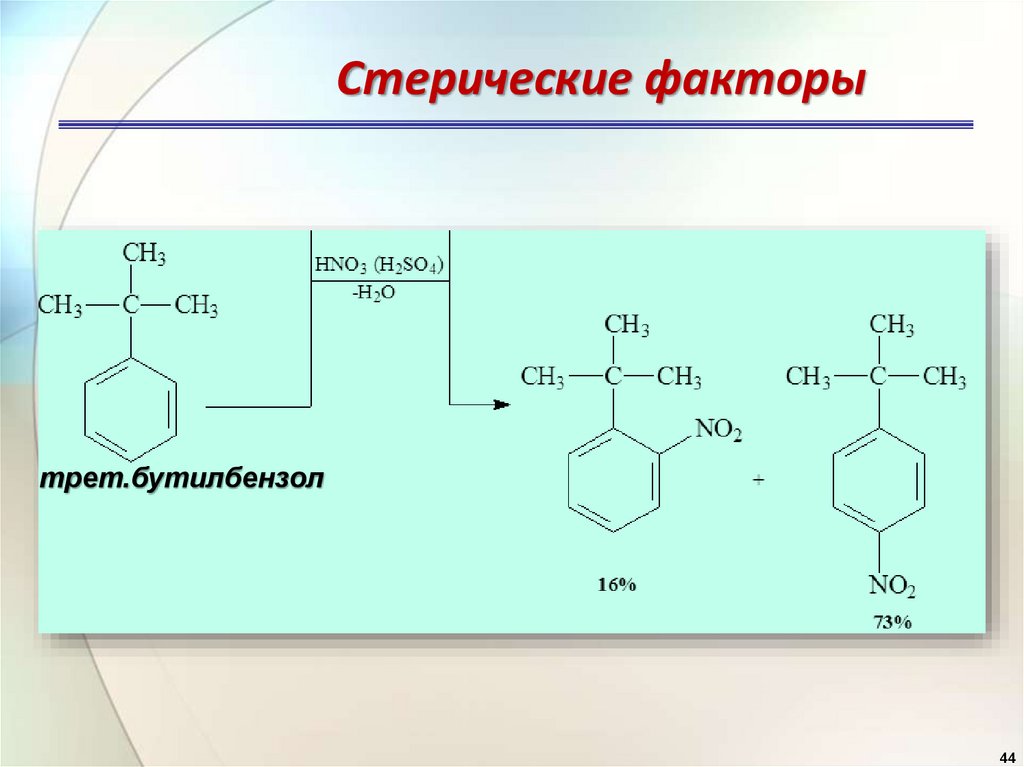
44.
Стерические факторытрет.бутилбензол
44
45.
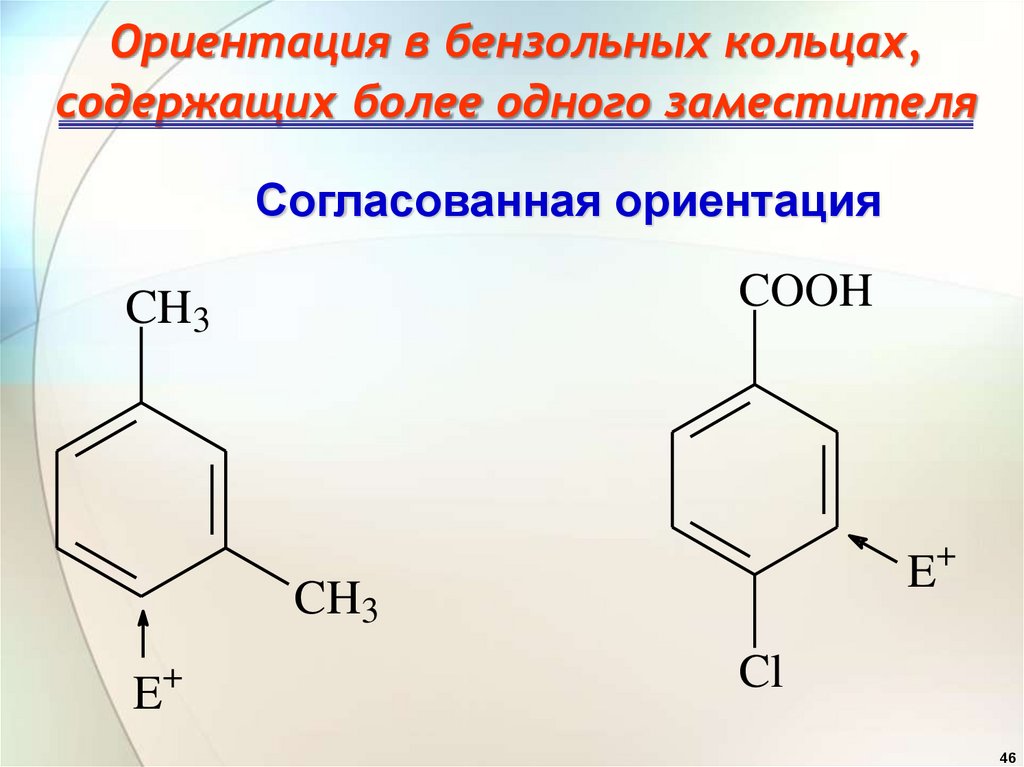
4546.
Ориентация в бензольных кольцах,содержащих более одного заместителя
Согласованная ориентация
COOH
CH3
+
E
CH3
+
E
Cl
46
47.
Несогласованная ориентацияOCH3
NHCOCH
3
___________
47
48.
Несогласованная ориентация1. Донор и донор
OH
OH
CH3
OH
CH3
Br2 (AlBr3)
-HBr
Br
CH3
+
Br
Более сильный донор
(орто- и пара-)
-O- >-NH2 > -OR > - OH > -Alk Сила активации растет
48
49.
2. Донор и акцептордонор (орто- и пара-)
49
50.
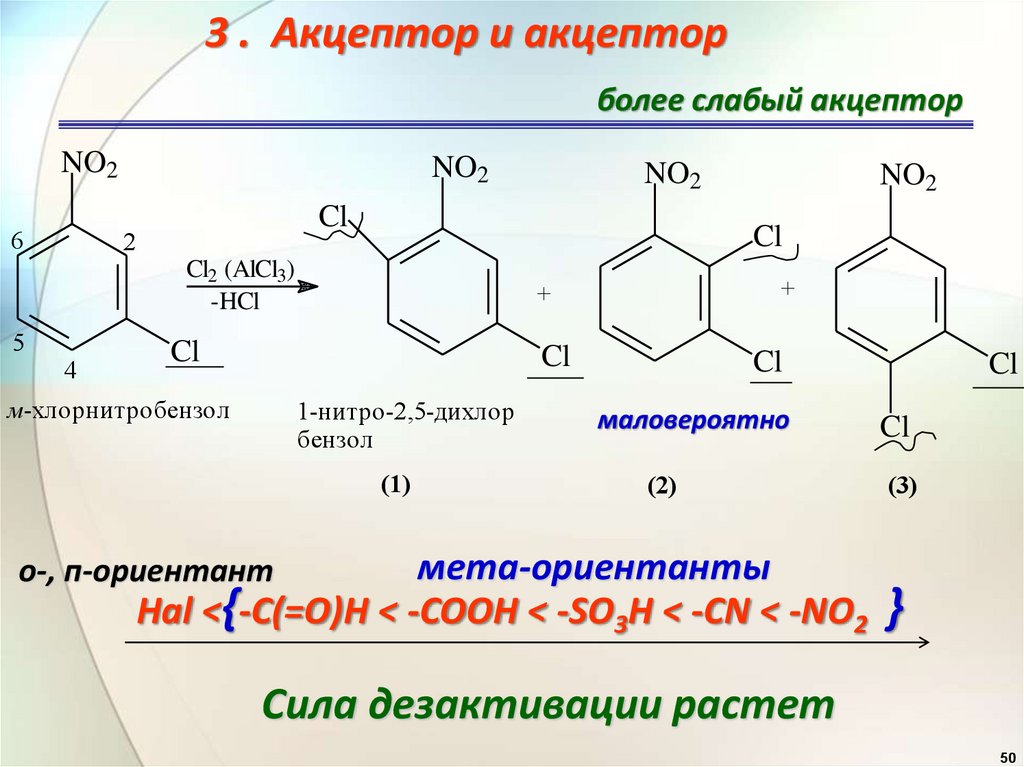
3 . Акцептор и акцепторболее слабый акцептор
NO2
6
NO2
Cl
2
4
+
+
Cl
Cl
м-хлорнитробензол
NO2
Cl
Cl2 (AlCl3)
-HCl
5
NO2
1-нитро-2,5-дихлор
бензол
(1)
Cl
маловероятно
(2)
мета-ориентанты
Hal <{-C(=O)H < -COOH < -SO3H < -CN < -NO2
о-, п-ориентант
Cl
Cl
(3)
}
Сила дезактивации растет
50
51.
5152.
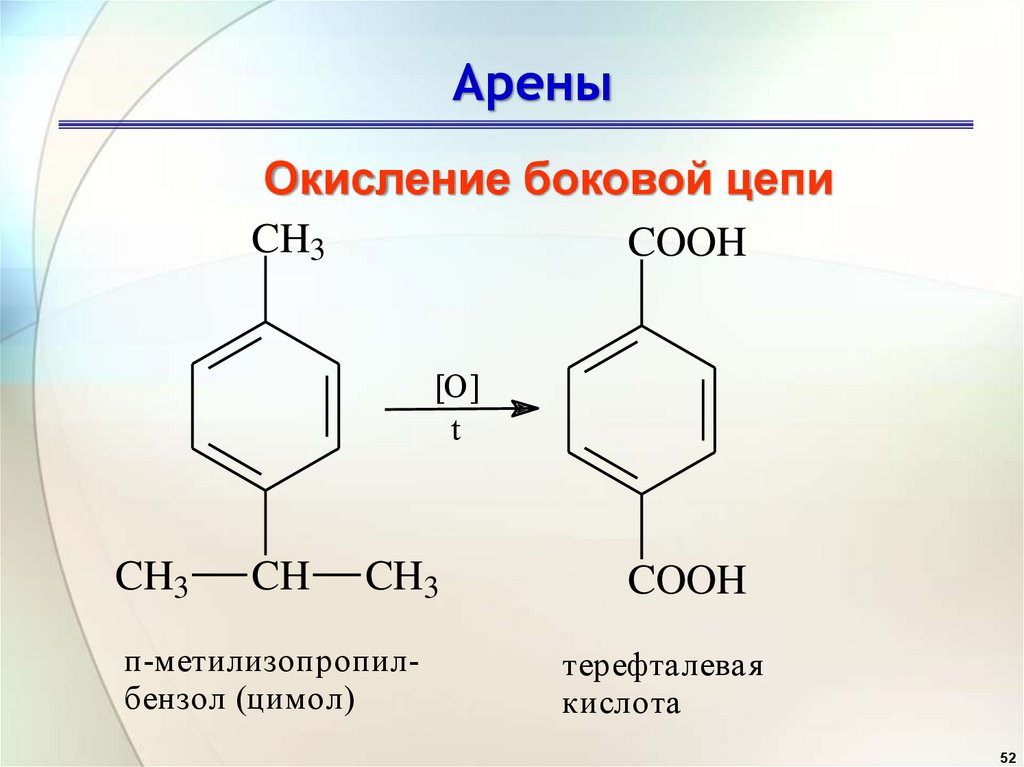
АреныОкисление боковой цепи
CH3
COOH
[O]
t
CH3
CH
CH3
п-метилизопропилбензол (цимол)
COOH
терефталевая
кислота
52
53.
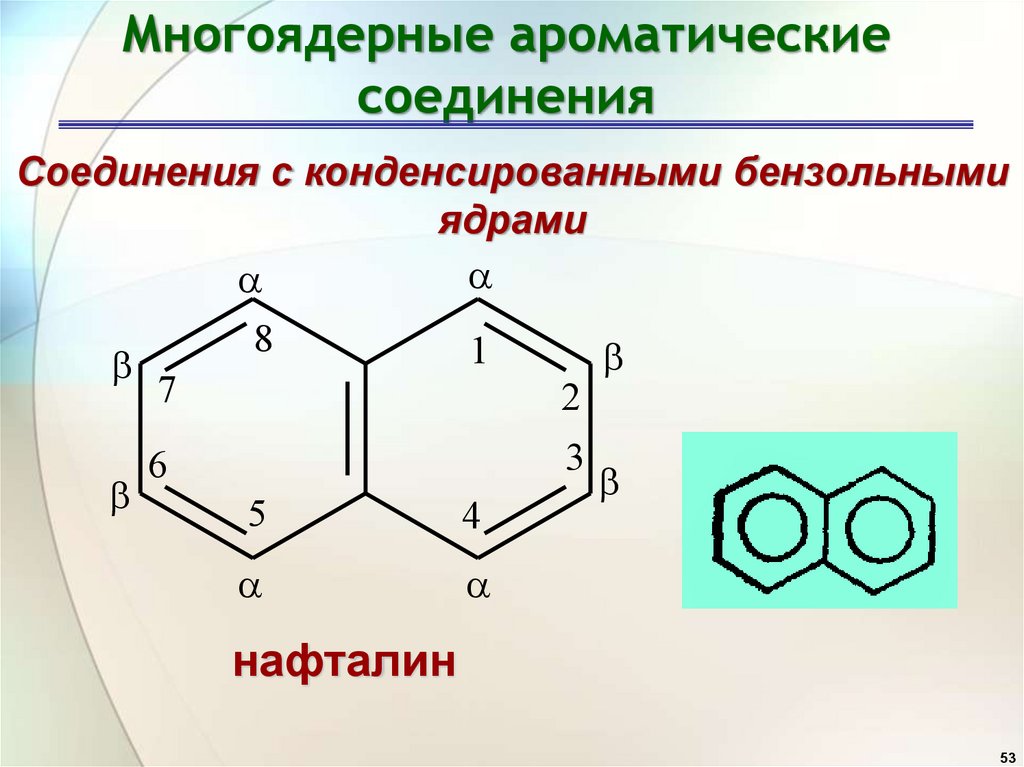
Многоядерные ароматическиесоединения
Соединения с конденсированными бензольными
ядрами
8
1
7
2
3
6
5
4
нафталин
53
54.
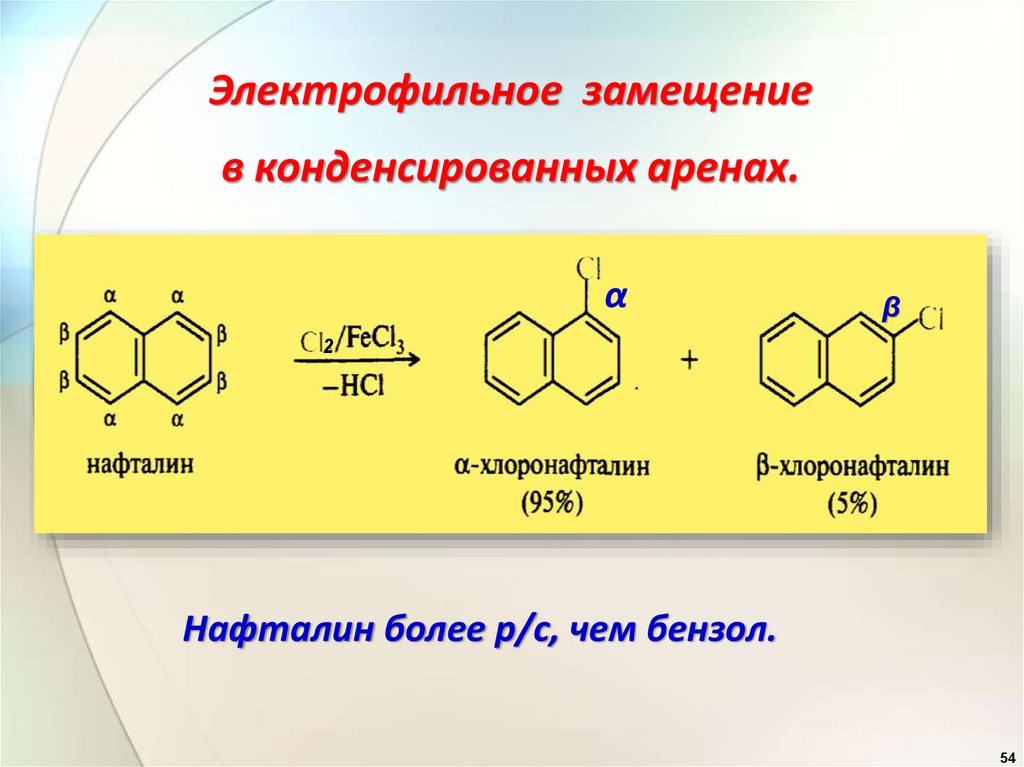
Электрофильное замещениев конденсированных аренах.
α
β
2
Нафталин более р/с, чем бензол.
54
55.
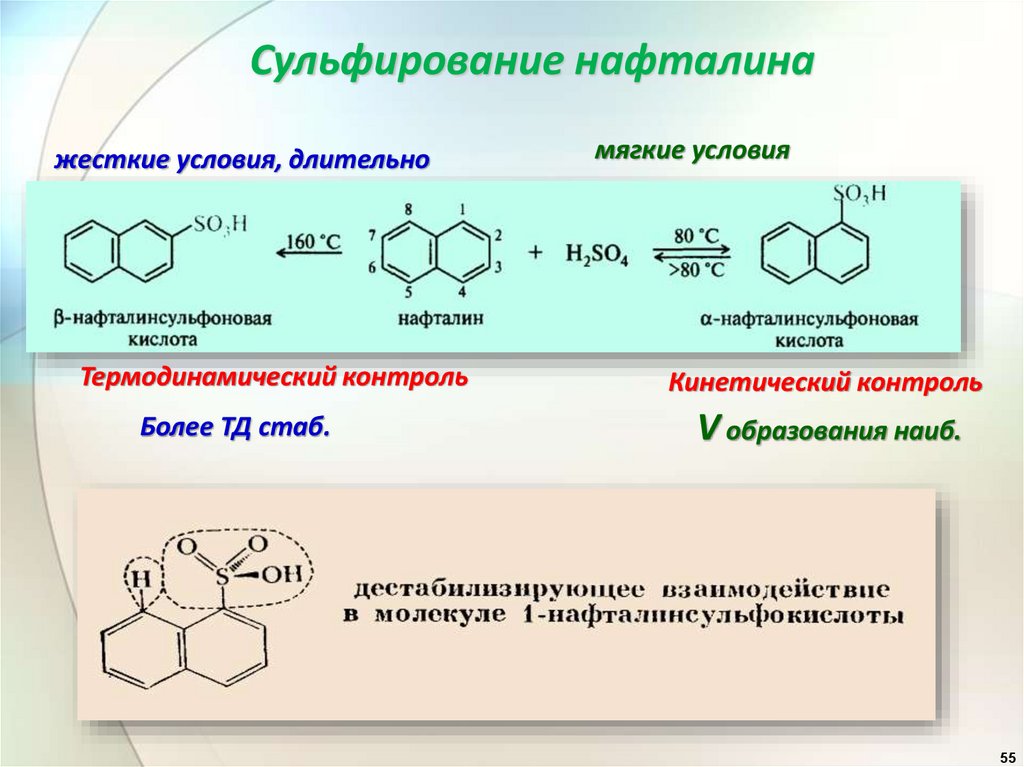
Сульфирование нафталинажесткие условия, длительно
Термодинамический контроль
Более ТД стаб.
мягкие условия
Кинетический контроль
V образования наиб.
55
56.
5657.
11
2
4
57
58.
12
58
59.
5960.
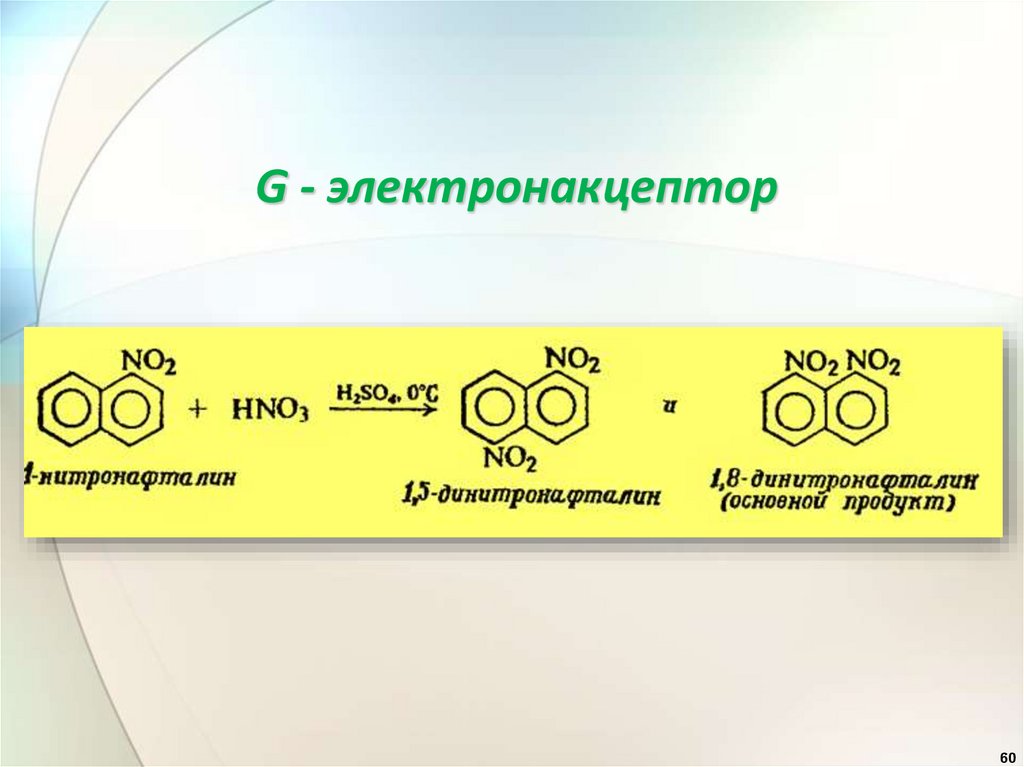
G - электронакцептор60
61.
6162.
Соединения с конденсированными бензольнымиядрами
8
9
1
7
6
2
3
5
10
4
антрацен
62
63.
АнтраценBr
Br
CH
Br2
9
10
-HBr
CH
Br
9,10-дибромантрацен
9-бромантрацен
63
64.
Фенантрен64
65.
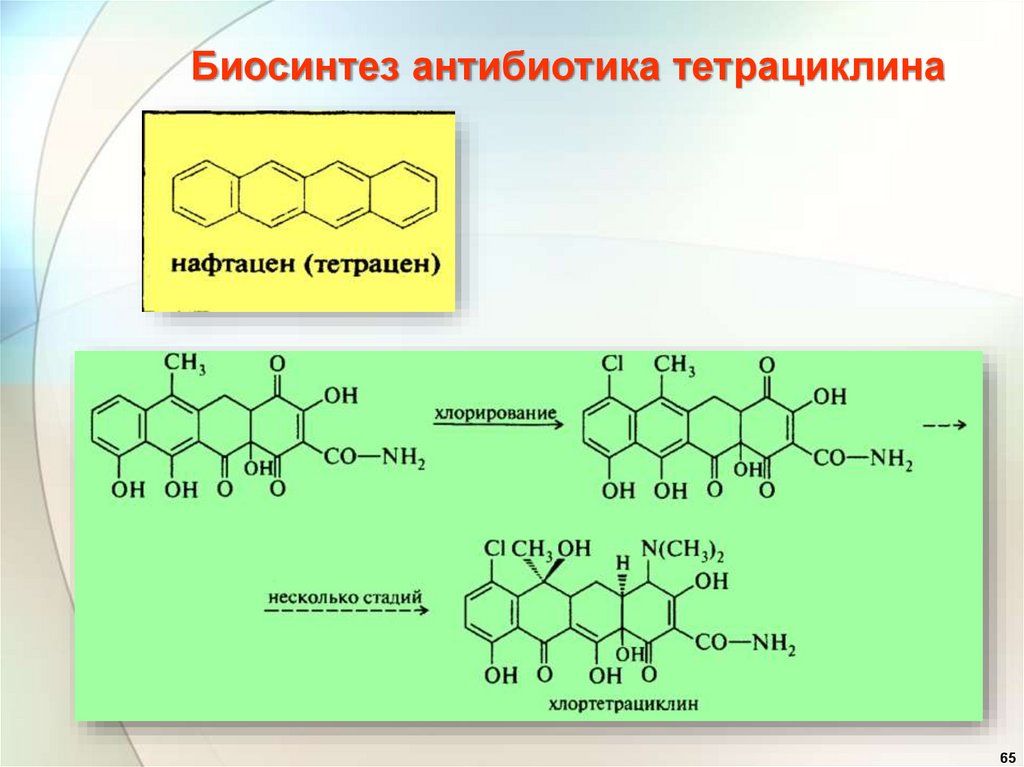
Биосинтез антибиотика тетрациклина65
66.
Физические и биологическиесвойства аренов.
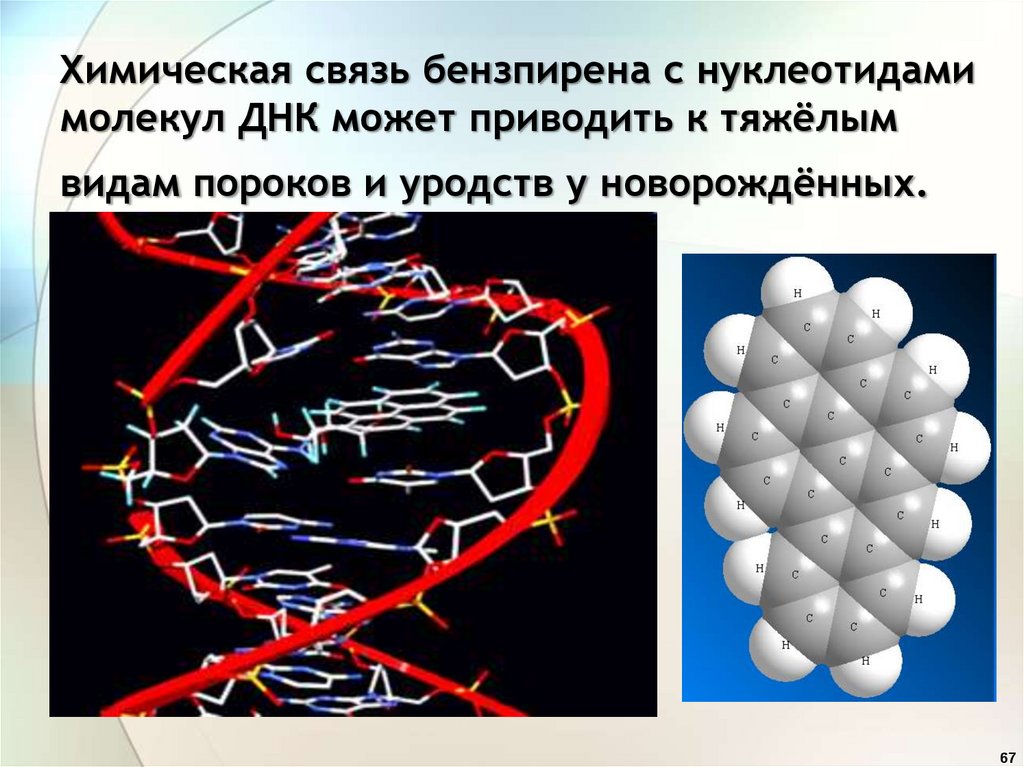
Бензпирен – мощный
канцероген!
66
28.03.2022
66
67.
Химическая связь бензпирена с нуклеотидамимолекул ДНК может приводить к тяжёлым
видам пороков и уродств у новорождённых.
67
68.
Значения энергии ароматизации
• Бензол 150 кДж/моль
Тиофен 120кДж/моль
• Пиррол 110 кДж/моль
Фуран 80 кДж/моль
π-избыточные системы
α
α
Бензол
68
69.
Ацидофобность – нестабильностьв сильнокислой среде
пиррольных и фурановых ядер.
69
70.
Реакции SE для пиррола:ацетилнитрат
α
CH3C(=O)O-NO2
Комплекс
пиридинсульфотриоксид
C5H5N × SO3
модифицированные реагенты
α
70
71.
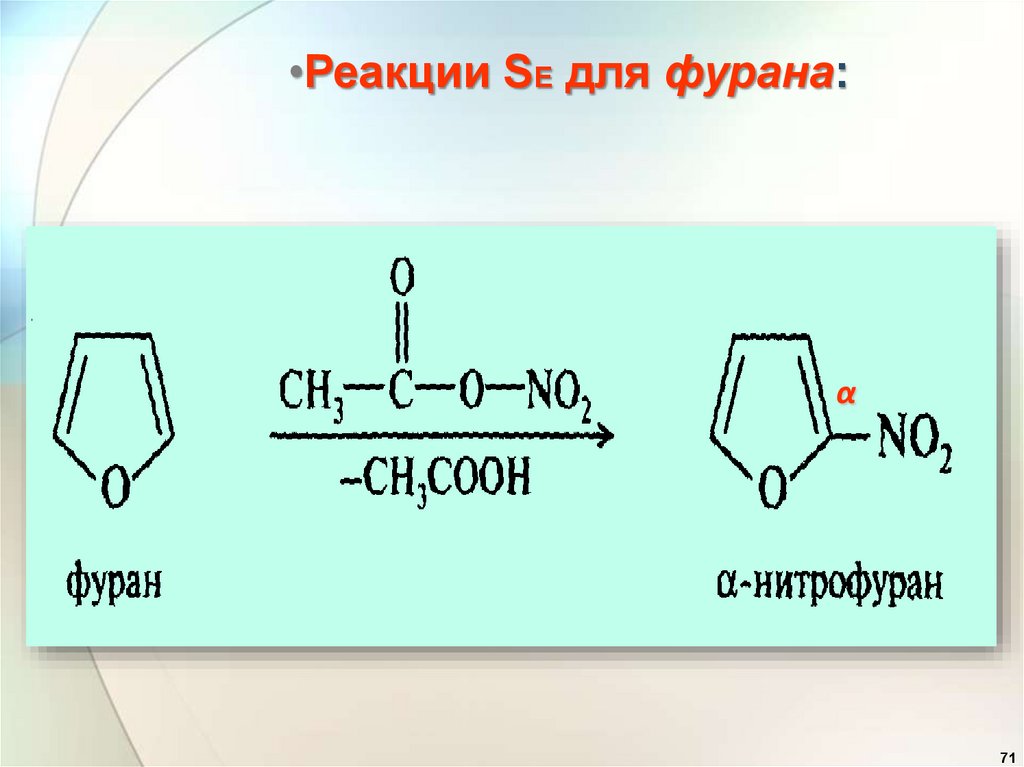
•Реакции SE для фурана:α
α
71
72.
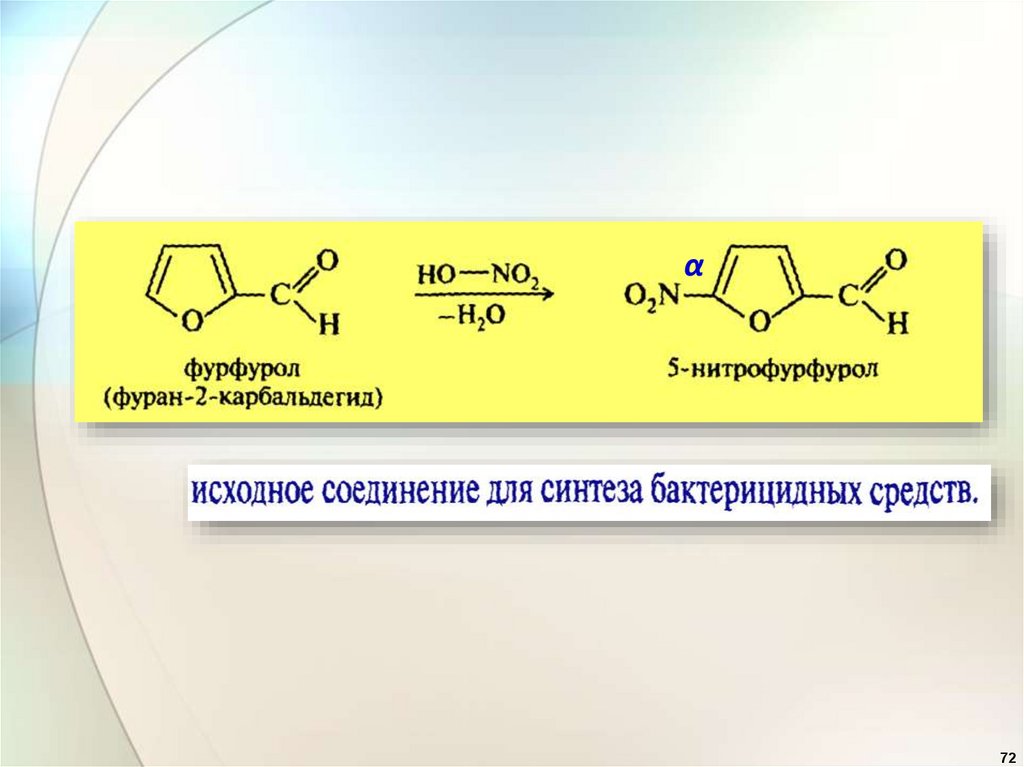
α72
73.
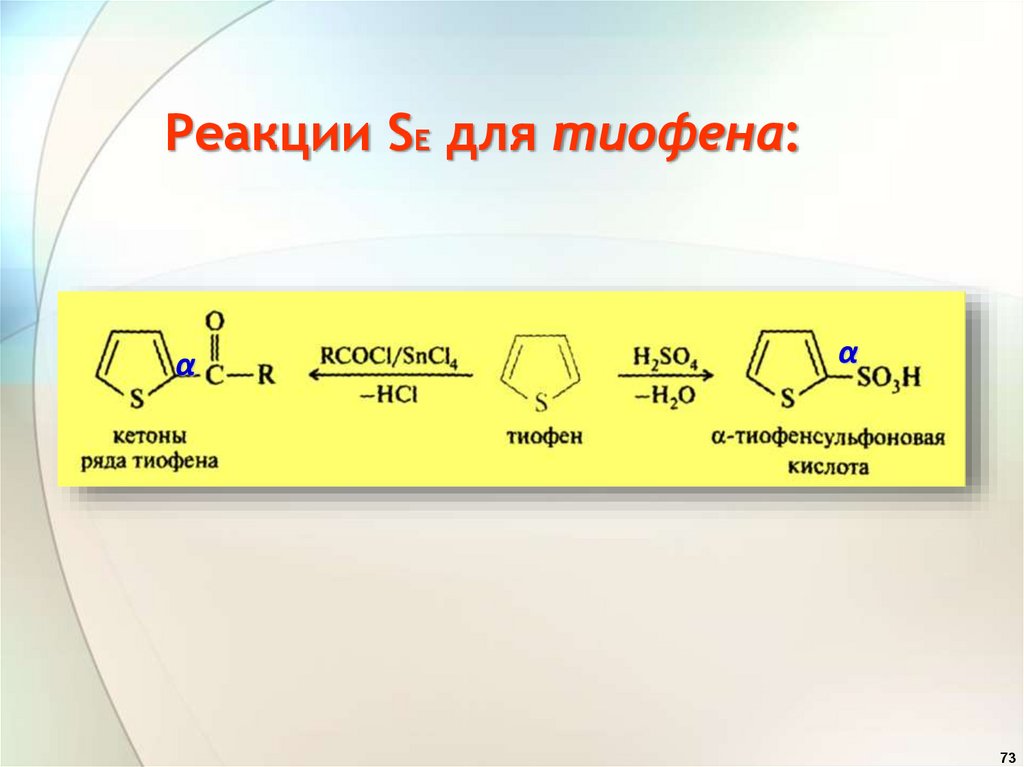
Реакции SE для тиофена:α
α
73
74.
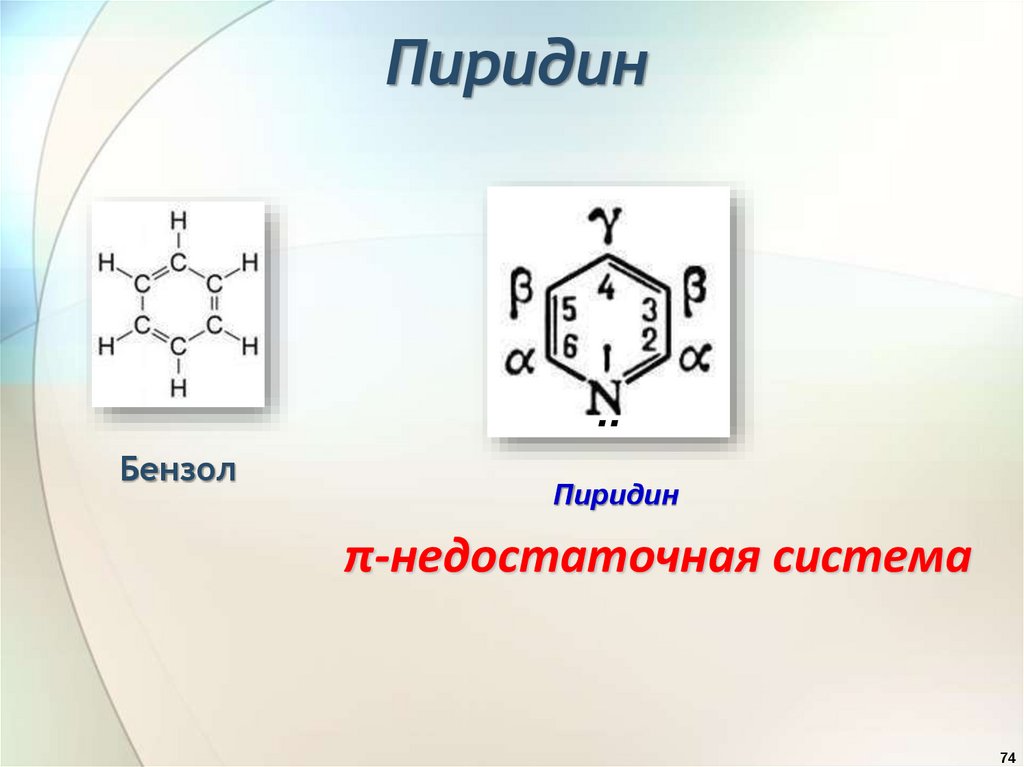
Пиридин..
Бензол
Пиридин
π-недостаточная система
74
75.
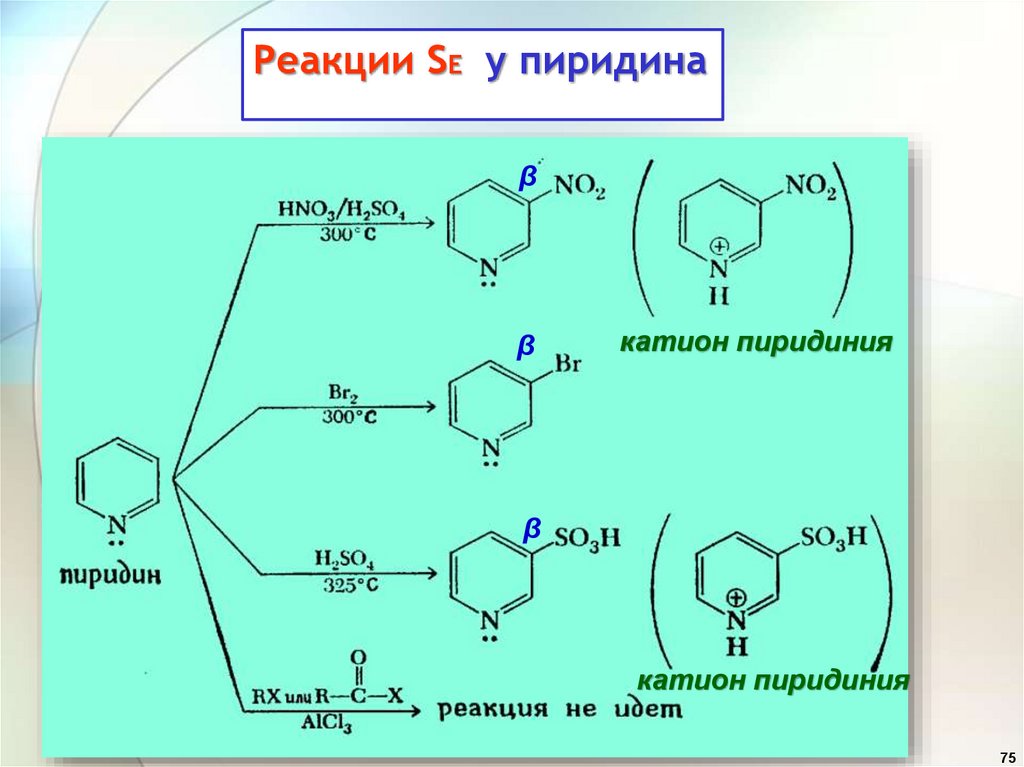
Реакции SE у пиридинаβ
β
катион пиридиния
β
катион пиридиния
75
76.
7677.
Реакции нуклеофильногозамещения, SN у пиридина
Реакция Чичибабина
α
α
2-аминопиридин
77
78.
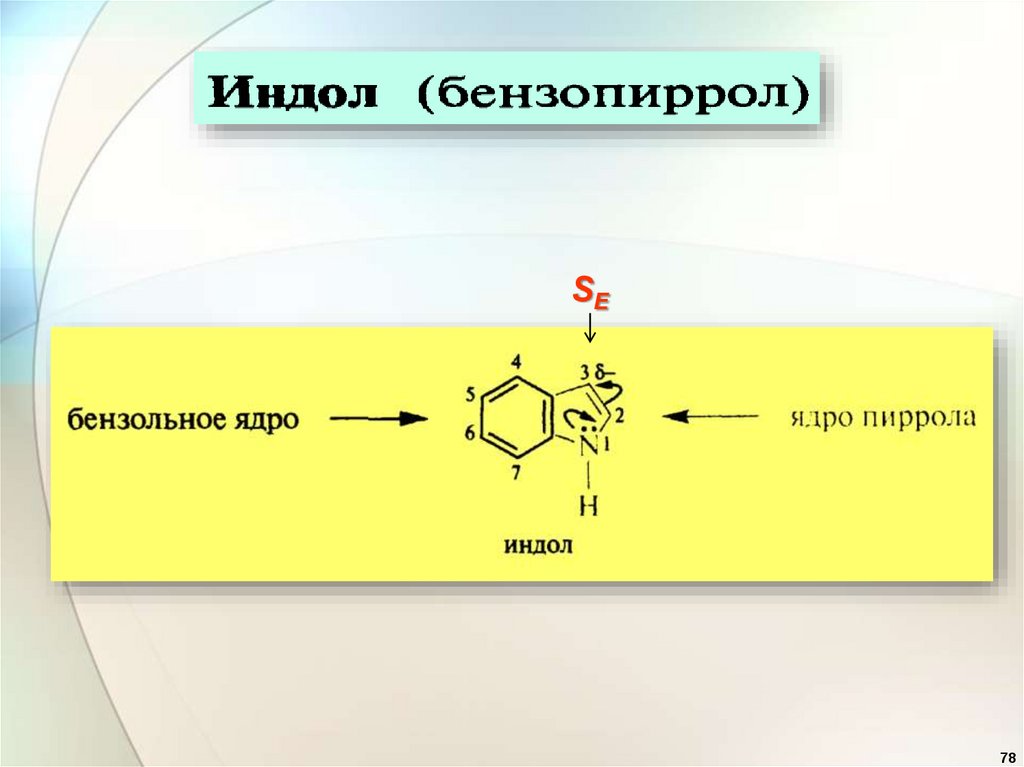
SE78
79.
SESSEE
79
80.
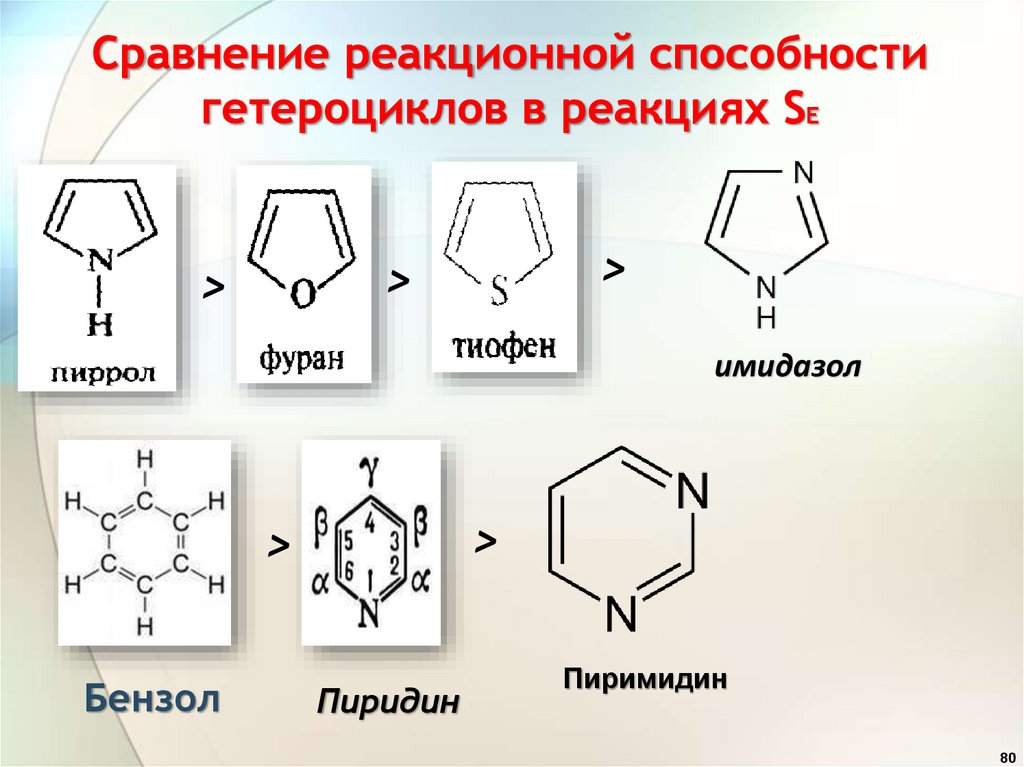
Сравнение реакционной способностигетероциклов в реакциях SE
>
>
>
имидазол
>
>
Бензол
Пиридин
Пиримидин
80
81.
Спасибоза
Ваше внимание!
81
28.03.2022
81
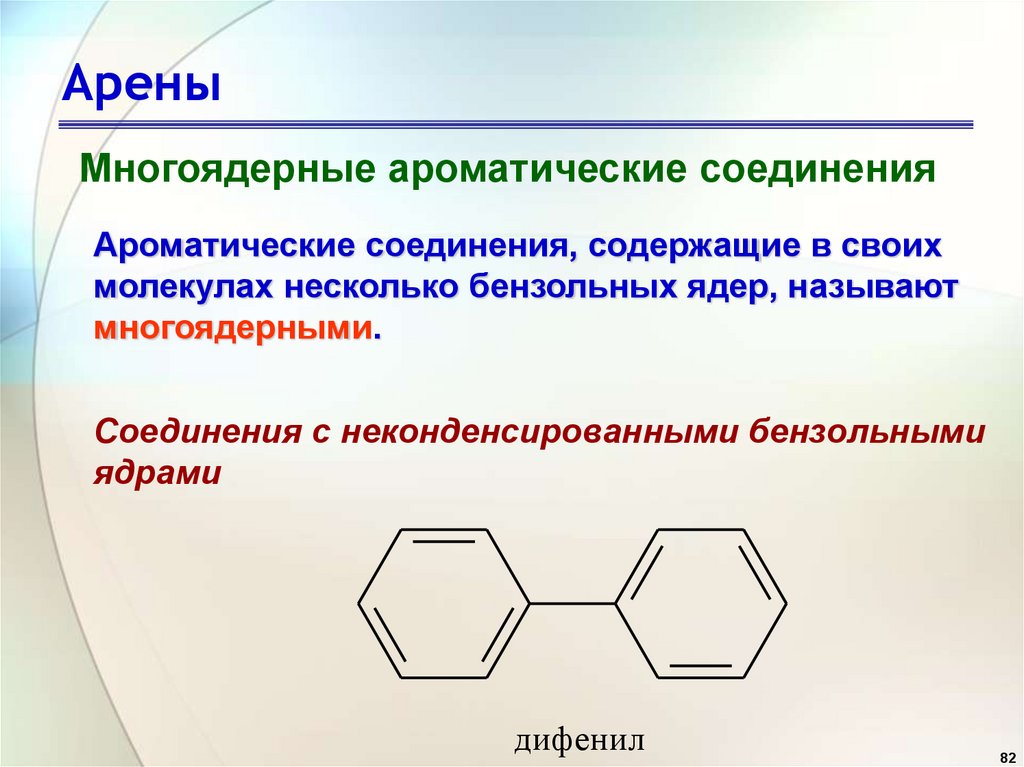
82.
АреныМногоядерные ароматические соединения
Ароматические соединения, содержащие в своих
молекулах несколько бензольных ядер, называют
многоядерными.
Соединения с неконденсированными бензольными
ядрами
дифенил
82
83.
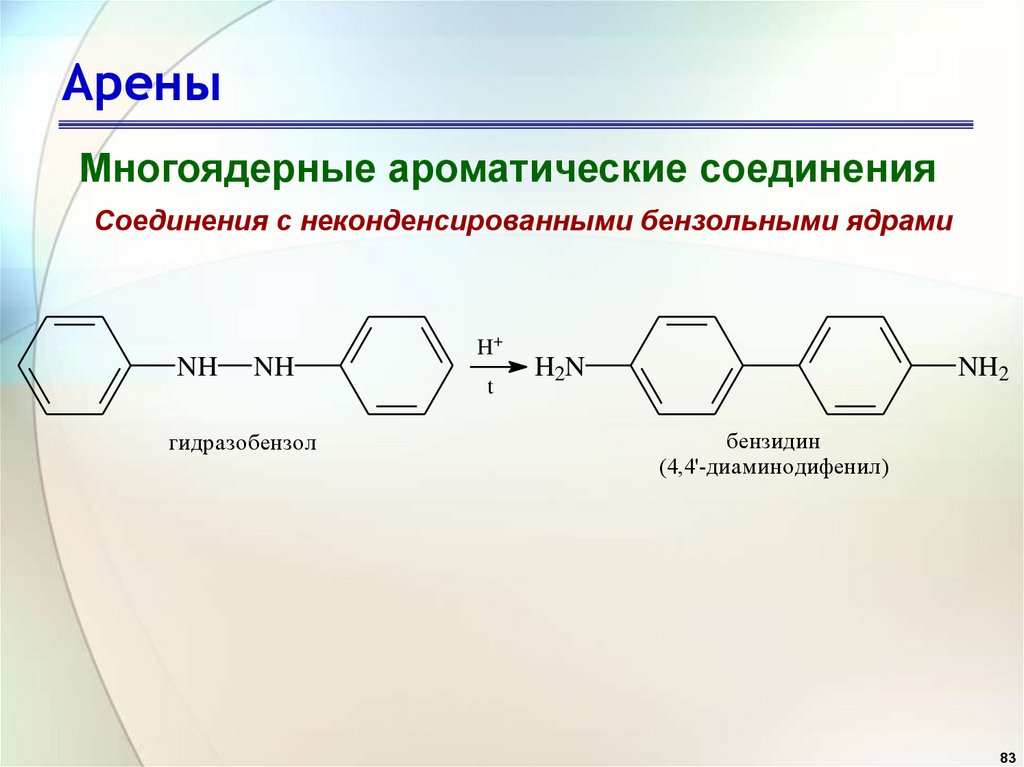
АреныМногоядерные ароматические соединения
Соединения с неконденсированными бензольными ядрами
NH
NH
гидразобензол
H+
t
H2N
NH2
бензидин
(4,4'-диаминодифенил)
83
84.
АреныМногоядерные ароматические соединения
Соединения с неконденсированными бензольными ядрами
CH2
дифенилметан
ClCH2
AlCl3
CH2
84
85.
АреныМногоядерные ароматические соединения
Соединения с неконденсированными бензольными ядрами
O
CH2
[O]
C
бензофенон
85
86.
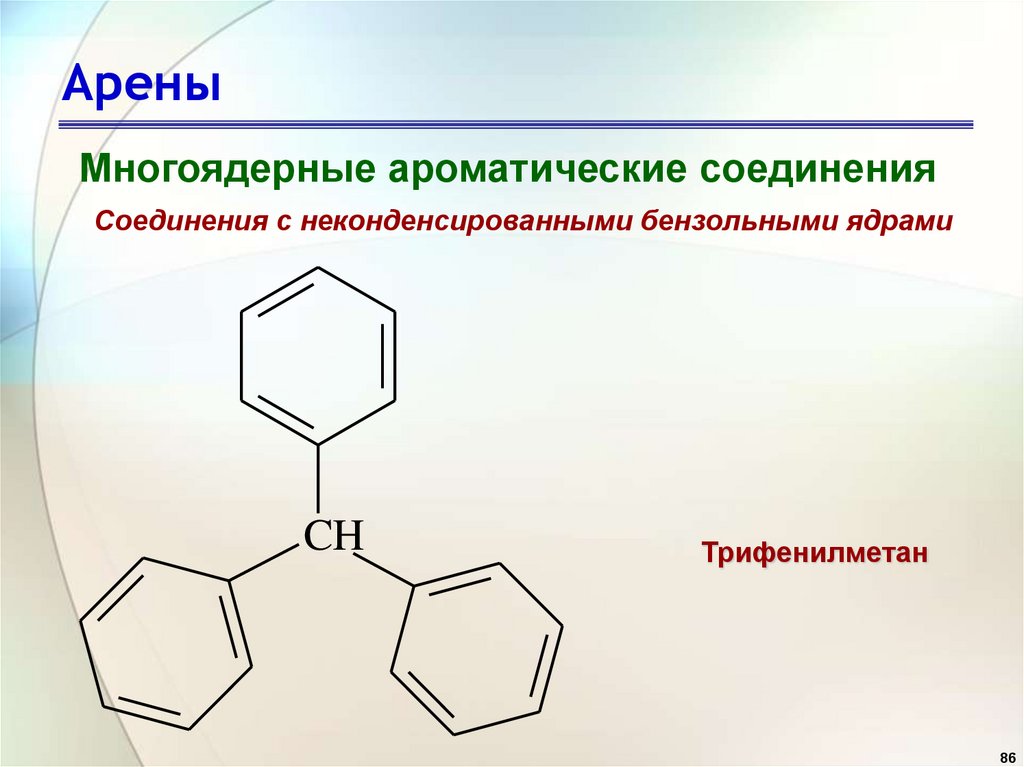
АреныМногоядерные ароматические соединения
Соединения с неконденсированными бензольными ядрами
CH
Трифенилметан
86
87.
АреныМногоядерные ароматические соединения
87
88.
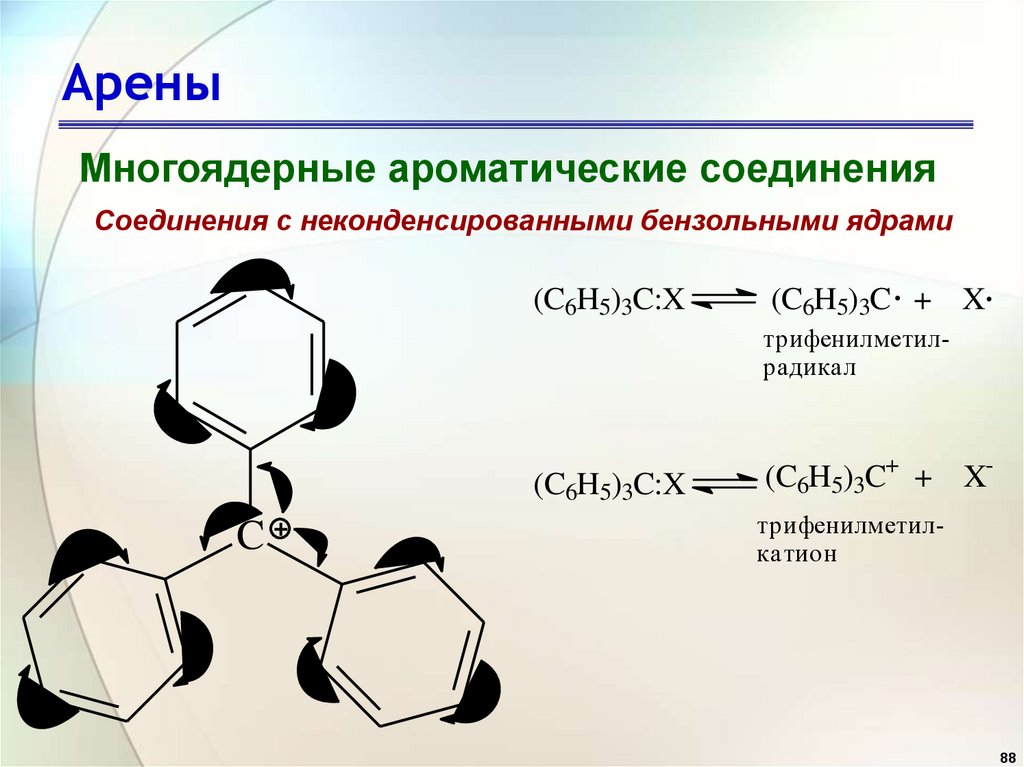
АреныМногоядерные ароматические соединения
Соединения с неконденсированными бензольными ядрами
(C6H5)3C:X
(C6H5)3C + X
трифенилметилрадикал
(C6H5)3C:X
C
(C6H5)3C+ + Xтрифенилметилкатион
88
89.
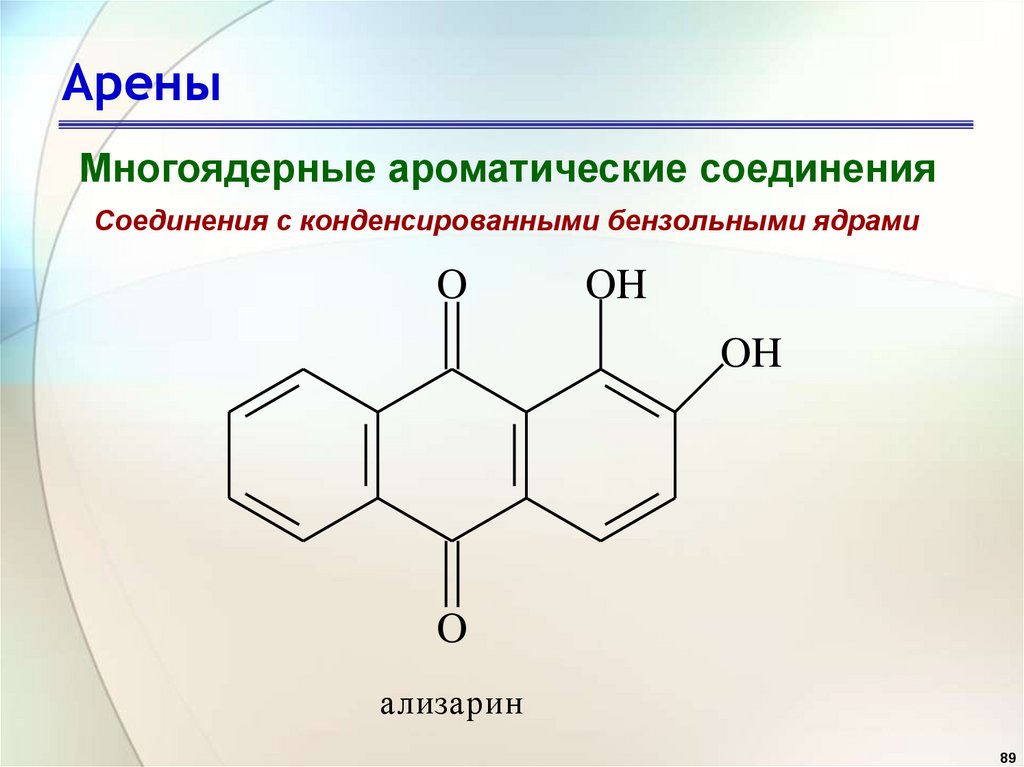
АреныМногоядерные ароматические соединения
Соединения с конденсированными бензольными ядрами
O
OH
OH
O
ализарин
89
90.
АреныМногоядерные ароматические соединения
Соединения с конденсированными бензольными ядрами
а) Линейно конденсированные циклы:
тетрацен
пентацен
гексацен
90
91.
АреныМногоядерные ароматические соединения
Соединения с конденсированными бензольными ядрами
а) Ангулярно конденсированные циклы:
перилен
коронен
91
92.
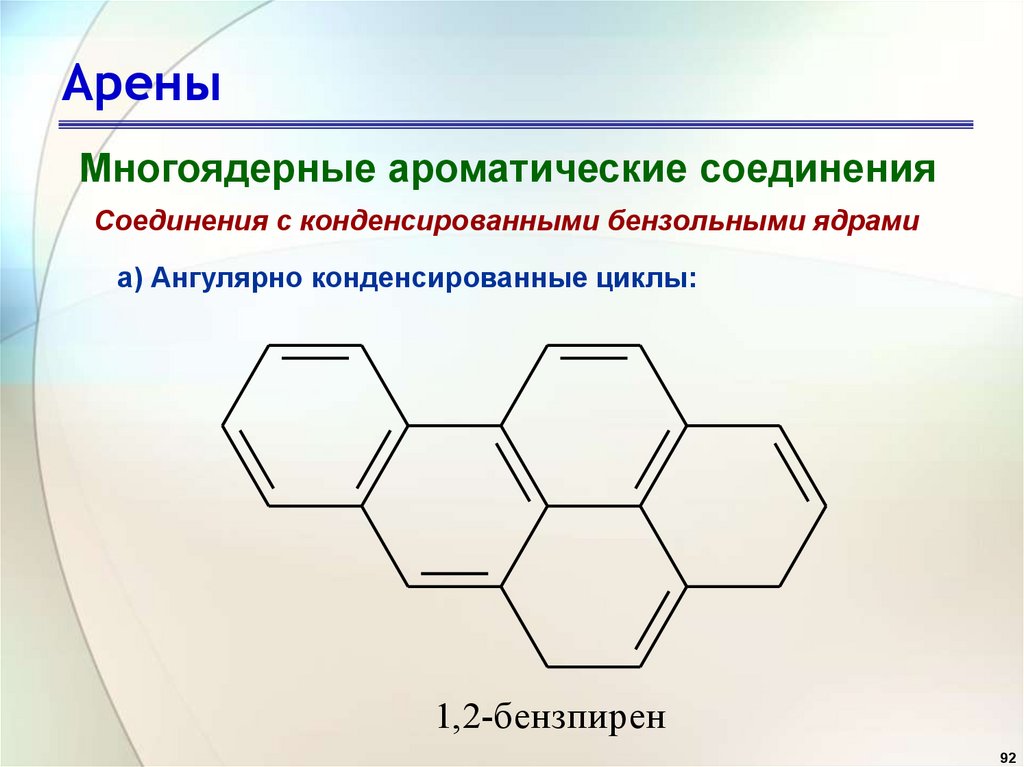
АреныМногоядерные ароматические соединения
Соединения с конденсированными бензольными ядрами
а) Ангулярно конденсированные циклы:
1,2-бензпирен
92
93.
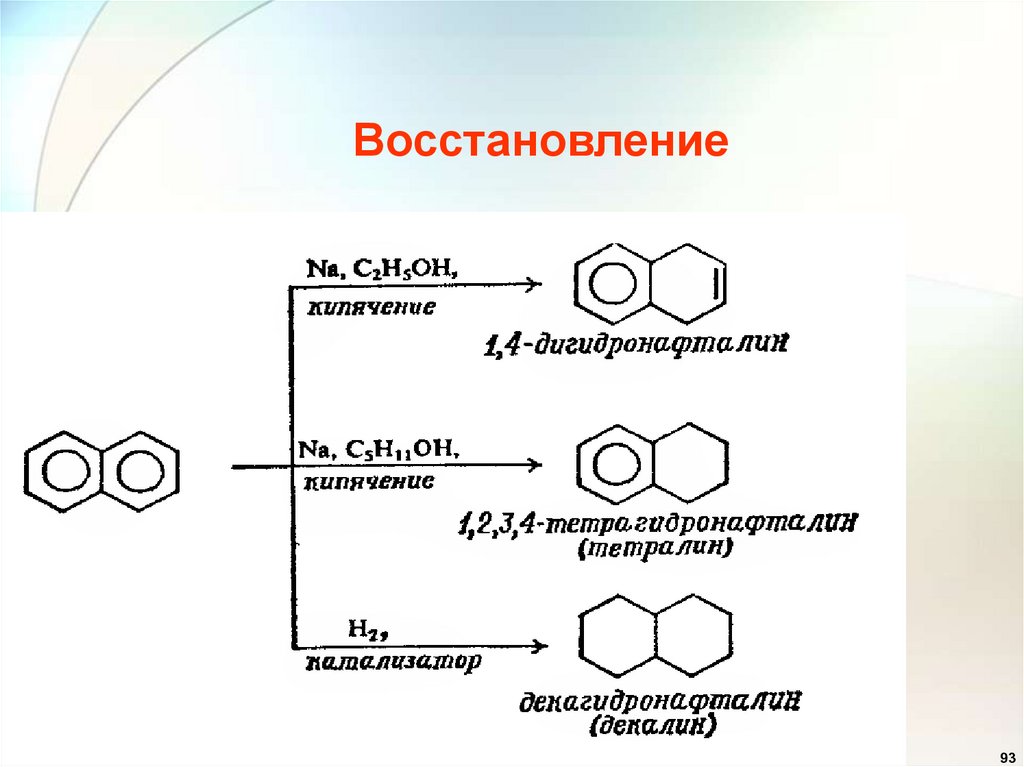
Восстановление93
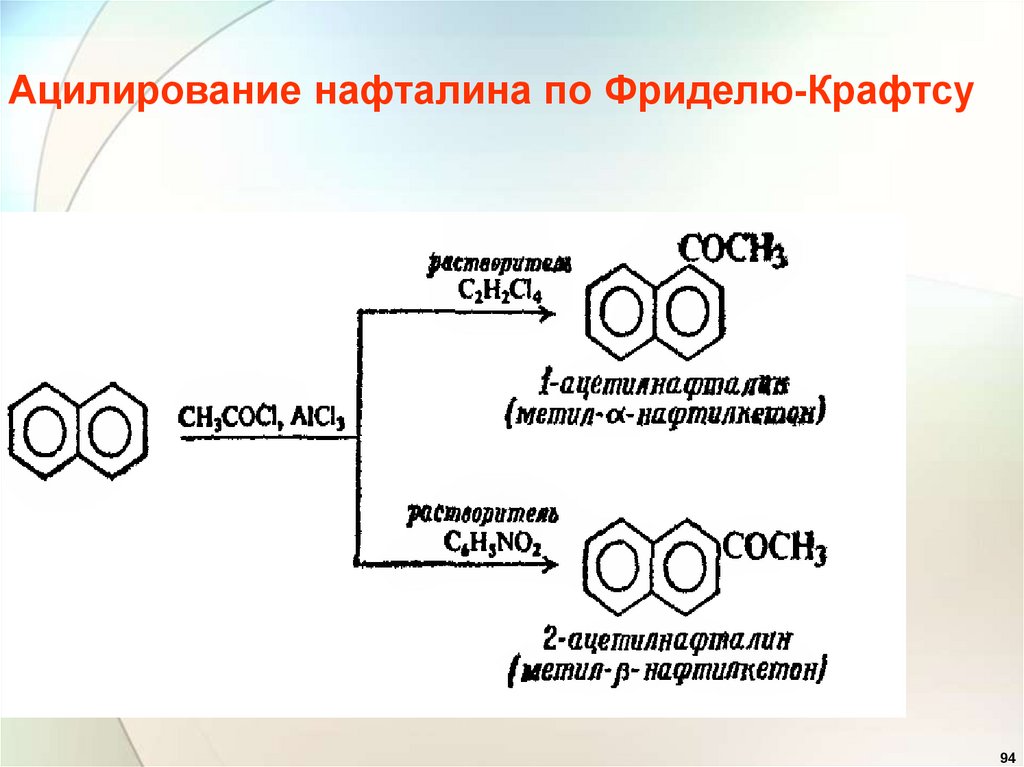
94.
Ацилирование нафталина по Фриделю-Крафтсу94
95.
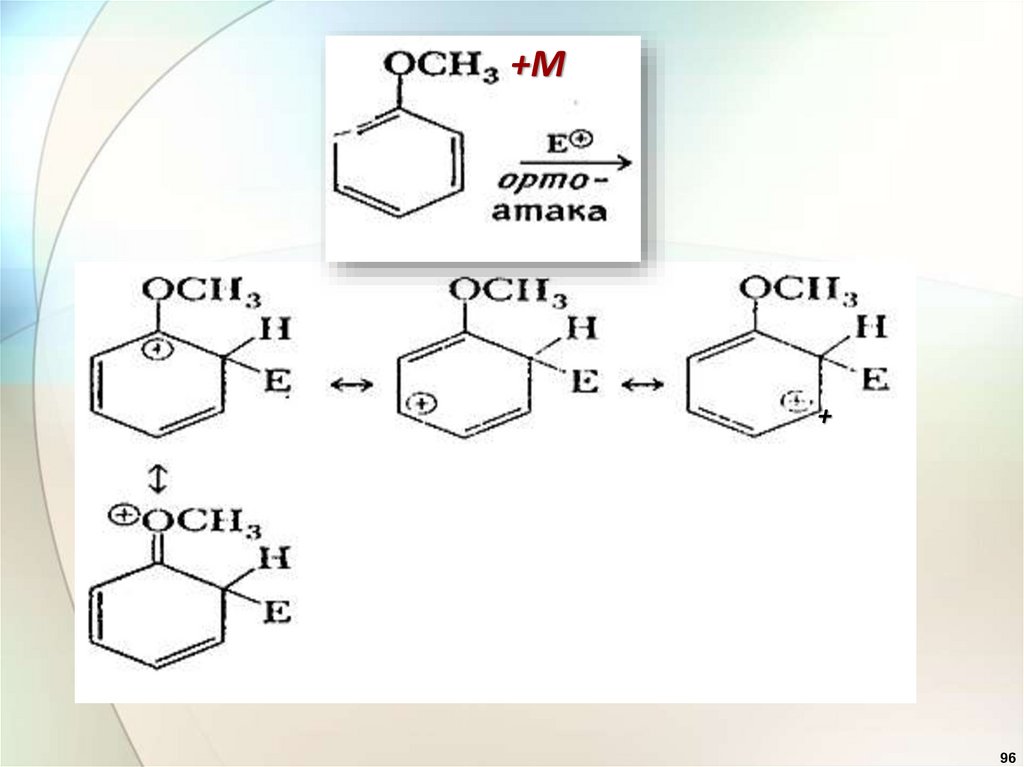
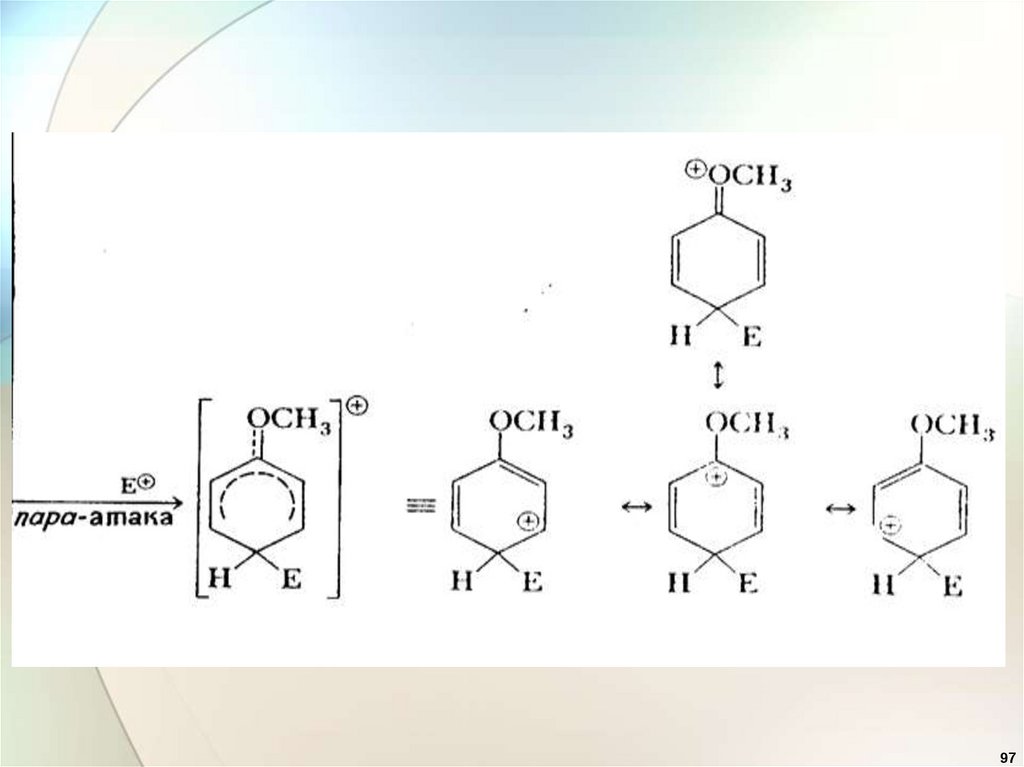
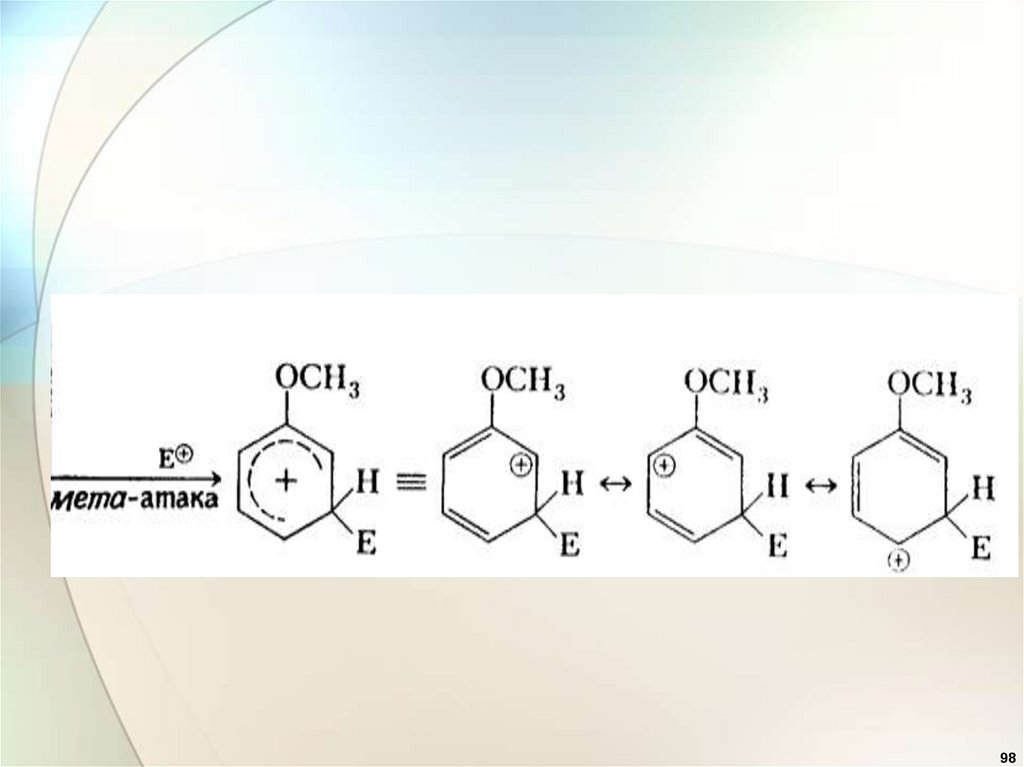
Электронодонорные заместители95
96.
+М+
96
97.
9798.
9899.
Электроноакцепторныезаместители
-I , -M
99





















































 Химия
Химия