Похожие презентации:
Возникновение биомолекул в пребиотическом бульоне
1. Лекция 1.
10/3/20192. Возникновение биомолекул в пребиотическом бульоне
Опыт Stenley Miller–Urey (Science,1953, V. 117. P. 528)эл. разряд
СH4 +
NH3 + H2
H2N
H2N
O
Н2О
OH
глицин
+
H2N
H2N
O
H3C
OH
аланин
+
O
O
OH
OH
аспарагиновая
к-та
+
O
O
OH
+
др. продукты
OH
глутаминовая
к-та
Идентификация продуктов проводилась методом бумажной хроматографии!
3.
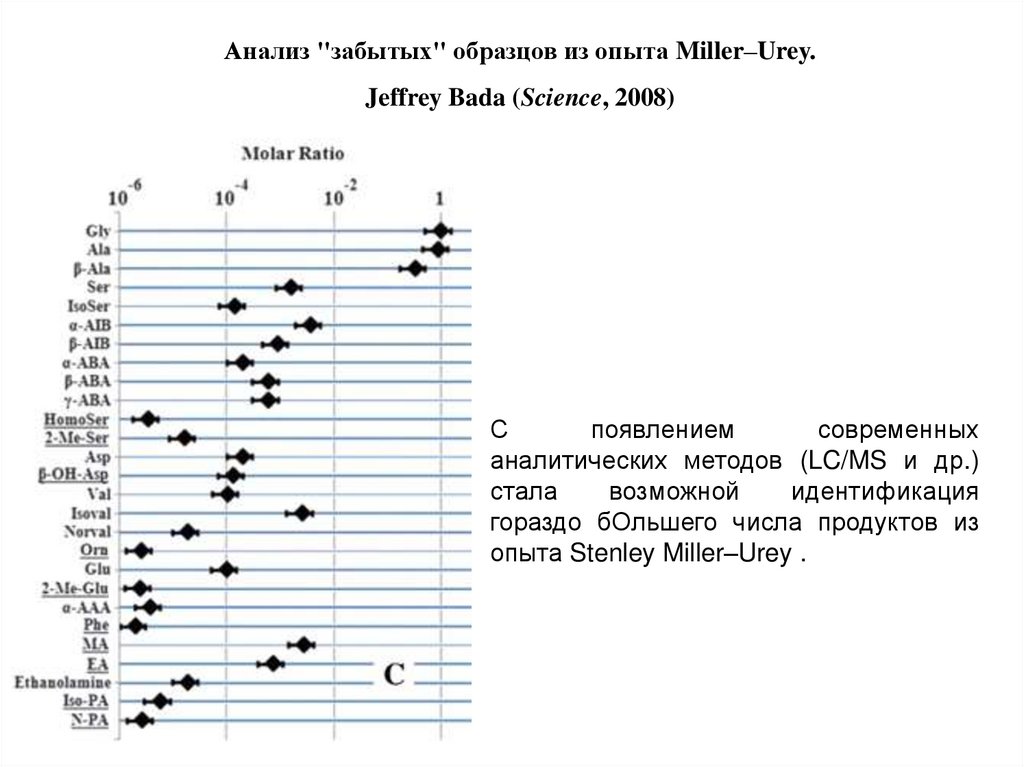
Анализ "забытых" образцов из опыта Miller–Urey.Jeffrey Bada (Science, 2008)
С
появлением
современных
аналитических методов (LC/MS и др.)
стала
возможной
идентификация
гораздо бОльшего числа продуктов из
опыта Stenley Miller–Urey .
10/3/2019
4.
Биохимик Роберт Шапиро:Аминокислоты, синтезированные Миллером и Юри, значительно менее
сложные молекулы, чем нуклеозиды и нуклеотиды. Но даже более
простые, нуклеиновые основания, в процессе подобных экспериментов
вообще никогда не образовывались.
10/3/2019
5.
Joan Oro (Nature. 1961. V. 191. P. 1193–1194) - ввел в установку Миллерасинильную кислоту и на выходе получил нуклеиновое основание аденин — одно
из четырех оснований, входящих в состав молекул ДНК и РНК.
N
NH2
H2O
NH2
N
UV
N
77%
NH
HCN
N
N
4 HCN
25 oC
N
NH2
DAMN
7%
NH2
AICN
АминоИмидазолКарбоНитрил
NH
N
Аденин
O
ДиАминоМалеоНитрил
H2NCONH2
5%
N
NH
NH
N
Гуанин
NH2
6.
ONH2
NH
N
N
H2O
H2N
NH2
NH
O
CH
H2O
N
NH
NH
O
O
урацил
цитозин
O
O
O
+
H
H
Са(ОН)2
HO
H
formose reaction
OH
формальдегид
H
гликолевый
альдегид
O
OH
H
H
OH
H
OH
+
H
OH
H
OH
H
OH
OH
OH
рибоза
глюкоза
HO
OH
O
OH OH
+
др. сахара
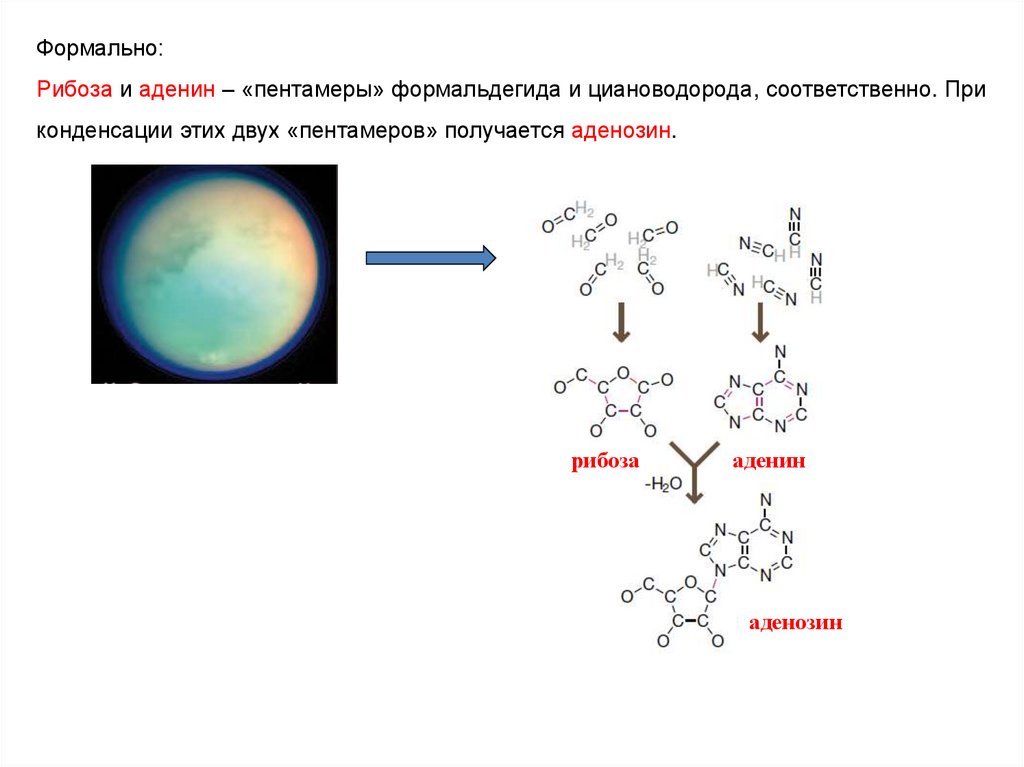
7.
Формально:Рибоза и аденин – «пентамеры» формальдегида и циановодорода, соответственно. При
конденсации этих двух «пентамеров» получается аденозин.
рибоза
аденин
аденозин
8.
Одним из основных аргументов критиков является отсутствие единой хиральности усинтезированных аминокислот. Действительно, полученные аминокислоты представляли
собой практически равную смесь стереоизомеров, в то время как для аминокислот
биологического происхождения, характерно преобладание одного из стереоизомеров.
Позже
стало
известно,
что
существует
возможность
спонтанного
возникновения
энантиомерных продуктов в обычных химических реакциях, и были найдены пути синтеза
ряда стереоизомеров (в том числе, углеводородов и аминокислот) в присутствии оптически
активных катализаторов.
В 2001 году, Алан Сагательян (Alan Saghatelian) показал, что самореплицирующиеся
пептидные системы в состоянии эффективно влиять на образование определенных
энантиомеров. Следовательно, преобладание одного из стереоизомеров могло возникнуть
естественным образом.
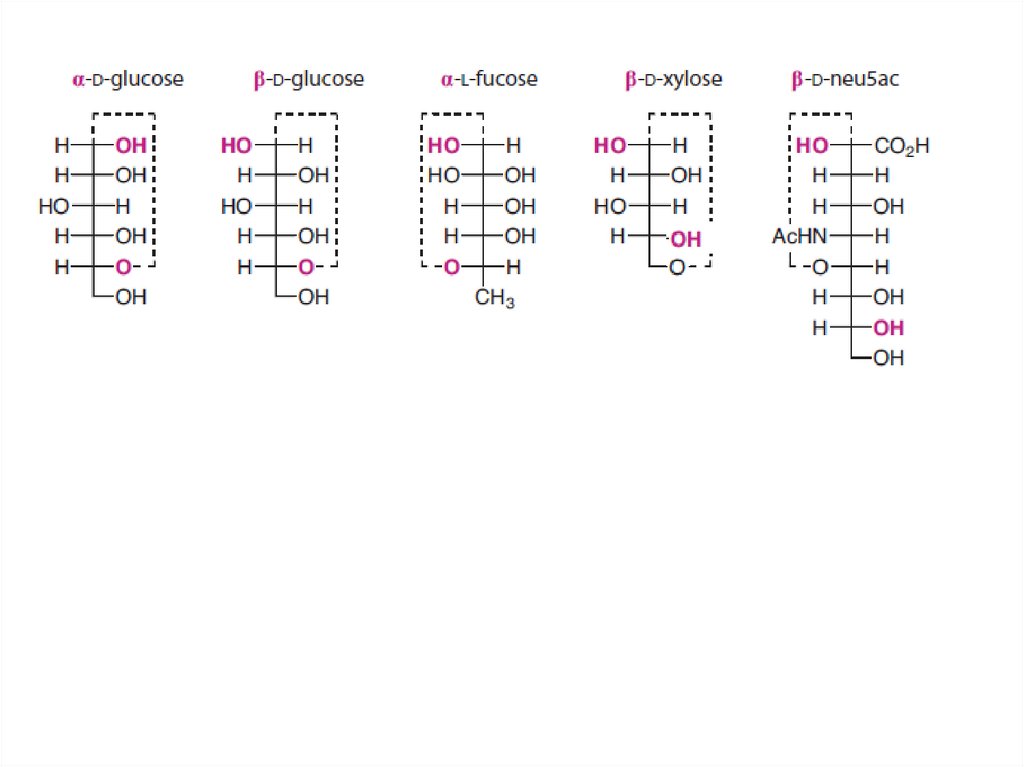
9. Начало гликобиологии и хиральность.
10. Углеводы
Первые из известных науке углеводов описывались брутто-формулой Cx(H2O)y –вещества, состоящие, формально, из угля и воды. Термин ,,углеводы” был введен
профессором Тартуcского университета К. Шмидтом в 1844 г.
Источник углеводов – процесс фотосинтеза.
С точки зрения сегодняшних знаний о строении, углеводы (сахара) – это
многоатомные альдегидо- или кетоспирты и их производные.
«Родоночальник» – глицериновый альдегид.
H
O
OH
СН2OH
H
11.
конец 17 века (Кристиан Хьюгенс) – плоскополяризованный свет
1815 г. (Жан Батист Биот) – обнаружение природных соединений,
обладающих способностью вращать плоскость поляризованного света
1819 г. (Carl Wilhelm Scheele) - выделил рацемат винной кислоты
1874 г. (Joesph Achille LeBel and Joobus Henricus van’t Hoff) - тетраэдрическая
модель углерода
с 1884 г. (Эмиль Фишер) – масштабные исследования углеводов, определение
состава и структуры, разработка номенклатуры
10/3/2019
12. Классификация моносахаридов (моноз)
• С учетом– природы карбонильной группы
• альдозы - содержащие альдегидную группу
• кетозы - содержащие кето-группу
– длины углеродной цепи (от 3 до 10 атомов)
триозы (глицериновый альдегид)
тетрозы
пентозы (альдопентозы, кетопентозы)
гексозы (альдогексозы, кетогексозы)
гептозы
октозы
нонозы
декозы
n=1-8
n=1-7
13. D/L-изомерия глицеринового альдегида (простейшего углевода) в проекциях Фишера
CHO1
OH
СН2OH
CHO
CHO
H
OH
HO
1
H
H
CH2OH
CH2OH
H
CHO
СН2OH
OH
2
2
В проекциях Фишера:
CHO
H
OH
CH2OH
CHO
(справа)
D-изомер
(по Фишеру "правовращающий")
(слева)
HO
L-изомер
(по Фишеру "левовращающий")
H
CH2OH
Для перевода в проекцию Фишера:
1.
тетраэдр поворачиваем так, чтобы две связи, лежащие в горизонтальной плоскости, были направлены "к нам", а две связи,
лежащие в вертикальной плоскости, - "от нас";
2.
проецируем на плоскость;
3.
располагаем группу CHO сверху, а СН2OH - снизу путем поворотов проекции или перестановок групп местами в соответствии
с правилами:
- любая проекционная формула с одним асимметрическим центром при перестановке двух стоящих у асимметрического
центра заместителей превращается в формулу антипода. Следствие - четное число перестановок не меняет
первоначальную конфигурацию.
- проекционные формулы можно переворачивать в плоскости чертежа только на 180 о, но нельзя поворачивать на 90о
или выводить из плоскости чертежа.
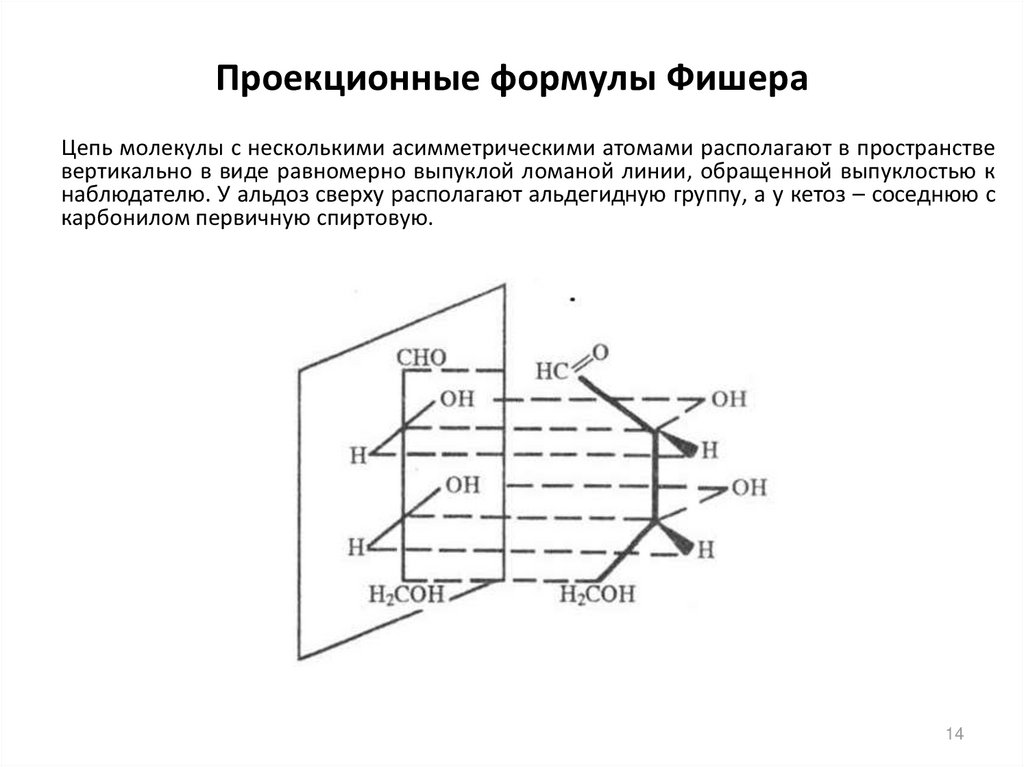
14. Проекционные формулы Фишера
Цепь молекулы с несколькими асимметрическими атомами располагают в пространствевертикально в виде равномерно выпуклой ломаной линии, обращенной выпуклостью к
наблюдателю. У альдоз сверху располагают альдегидную группу, а у кетоз – соседнюю с
карбонилом первичную спиртовую.
14
15. Стереохимия углеводов в проекциях Фишера
D-изомерный рядCHO
CHO
эта часть
определяет
принадлежность
изомерному
ряду
CHO
H
HO или Н
OH
H
CH2OH
OH или Н
HO или Н
OH или Н
HO или Н
OH или Н
OH
H
CH2OH
D-глицериновый
альдегид
OH
взаимное
расположение
ОН групп
определяет
название сахара
(см. след. слайд)
CH2OH
D-тетрозы
D-пентозы
L-изомерный ряд
CHO
CHO
HO
CHO
HO или Н
H
HO
CH2OH
L-глицериновый
альдегид
OH или Н
H
CH2OH
L-тетрозы
HO или Н
OH или Н
HO или Н
OH или Н
HO
H
CH2OH
L-пентозы
16. Генетическое родство D-ряда альдоз c D-глицериновым альдегидом
D(+)-аллозаD(+)-альтроза
D(+)-глюкоза
D(+)-манноза
D(-)-гулоза
D(-)-идоза
D(+)-галактоза
D(+)-таллоза
17.
Эпимеры и диастереомерыкетопентозы
альдопентозы
1
1
5
D-рибоза
D-ксилоза
D-рибУЛоза
эпимеры
эпимеры
альдогексозы
1
6
D-манноза
D-ксилУЛоза
D-глюкоза
D-галактоза
эпимеры
эпимеры
диастереомеры
18.
Относительная конфигурацияСистема Фишера описывает ОТНОСИТЕЛЬНУЮ конфигурацию.
стандарт – глицериновый альдегид. Каждому из возможных стереоизомеров
была ПРОИЗВОЛЬНО приписана одна абсолютных конфигураций.
конфигурацию всех других соединений соотносили со стандартом путем
химической корреляции (последовательность химических реакций, не затрагивающих
хиральный центр и ведущих к D- или L- “ стандарту”.
Система Фишера – не совершенна, например:
изомеры 1 и 2 (оба - производные D-стандарта) – имеют противоположную
конфигурацию.
D-изомер
1
2
19. Относительная конфигурация определяется химическими методами
Абсолютные и относительные конфигурацииОтносительная конфигурация определяется химическими методами
D - ряд
CHO
H
COOH
COOH
OH
H
H
OH
CH2OH
CH2NH2
CH2OH
(+)-D-глицериновый
альдегид
OH
(-)-D-глицериновая
кислота
(+)-D-изосерин
COOH
H
OH
CH3
(-)-D-молочная
кислота
Абсолютная конфигурация определяется РСА (или теоретическим расчетом величины
оптического вращения) и описывается по системе К-И-П (R/S)
CHO
CHO
OH
СН2OH
H
R-изомер
HO
H
СН2OH
S-изомер
Если абсолютная конфигурация не известна, то в названии вещества указывают знак
оптического вращения
20.
Стереохимия (R/S и D/L-изомерия).Правила Кана-Ингольда-Прелога.
Cahn–Ingold–Prelog priority rules, CIP system or CIP conventions.
Полезная ссылка для понимания и обучения.
http://www.chem.msu.su/rus/teaching/butin/p4.html
21.
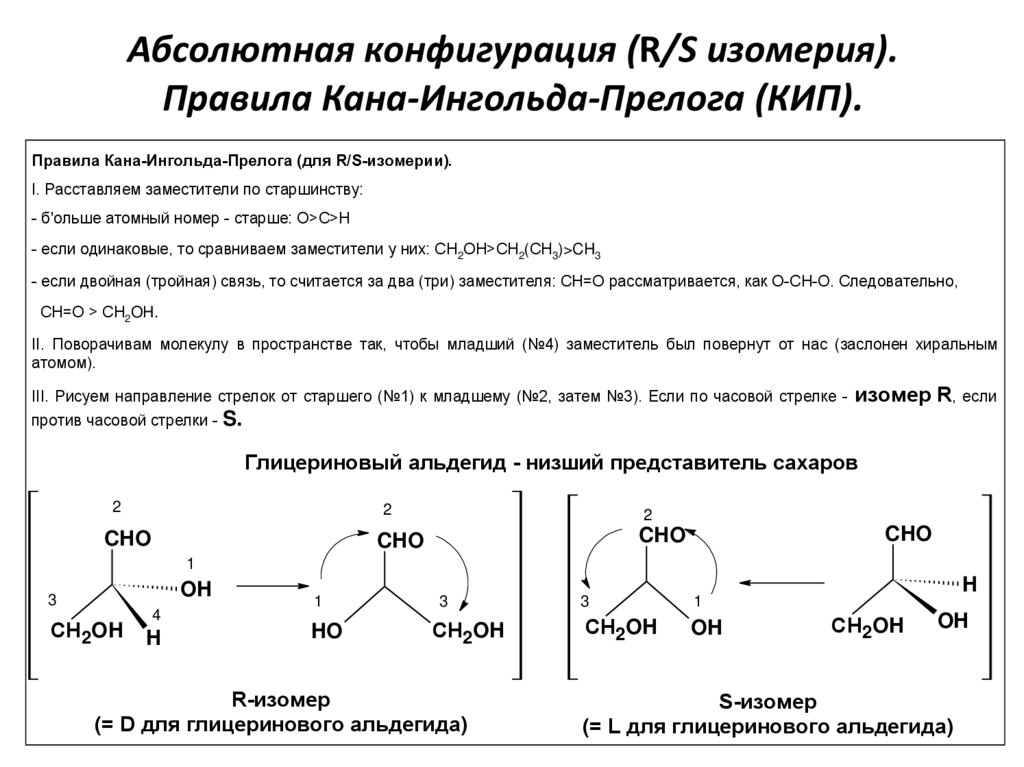
Абсолютная конфигурация (R/S изомерия).Правила Кана-Ингольда-Прелога (КИП).
Правила Кана-Ингольда-Прелога (для R/S-изомерии).
I. Расставляем заместители по старшинству:
- б'ольше атомный номер - старше: О>C>H
- если одинаковые, то сравниваем заместители у них: CH2OH>СН2(СН3)>CH3
- если двойная (тройная) связь, то считается за два (три) заместителя: СН=О рассматривается, как О-СН-О. Следовательно,
СН=О > CH2OH.
II. Поворачивам молекулу в пространстве так, чтобы младший (№4) заместитель был повернут от нас (заслонен хиральным
атомом).
III. Рисуем направление стрелок от старшего (№1) к младшему (№2, затем №3). Если по часовой стрелке -
изомер R, если
против часовой стрелки - S.
Глицериновый альдегид - низший представитель сахаров
2
2
CHO
2
CHO
CHO
CHO
1
OH
3
СН2OH
4
H
1
HO
3
СН2OH
R-изомер
(= D для глицеринового альдегида)
3
1
СН2OH
OH
H
СН2OH
OH
S-изомер
(= L для глицеринового альдегида)21
22.
D/L, R/S изомерия и оптическое вращениеВажно понимать:
1)Нет строгой корреляции между D/L и R/S изомерами
Для глицеринового
альдегида:
L-изомер = S
D-изомер = R
2)
Для цистеина:
D-изомер = S
L-изомер = R
Нет корреляции между D/L, R/S изомерами и знаком оптического вращения
COOH
H3C
H
COOH
H2N
D
L-изомер
COOMe
H3C
H
NH2
D
H
CH3
NH2
COOH
H3C
S-изомер
COOMe
H2N
NH2
COOMe
H
CH3
L-изомер
(-)-L-аланин
(-)-S-аланин
H3C
NH2
S-изомер
(+)-метиловый эфир L-аланина
(+)-метиловый эфир S-аланина
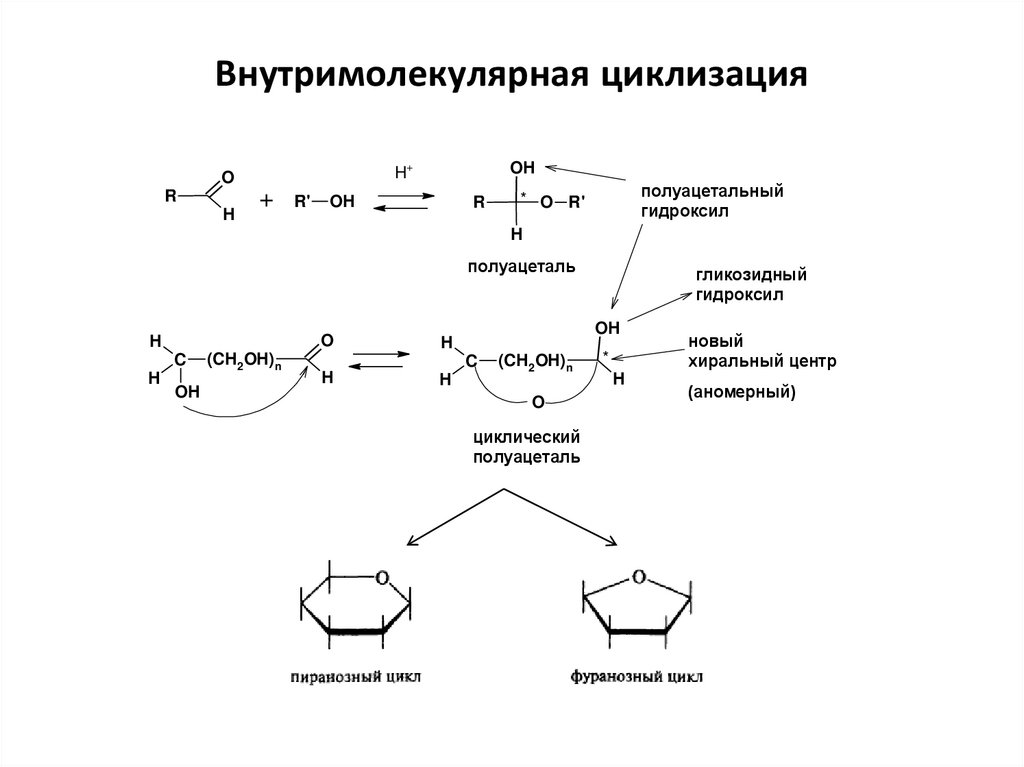
23. Внутримолекулярная циклизация
RH
OH
H+
O
+
R'
OH
R
полуацетальный
гидроксил
* O R'
H
полуацеталь
O
H
C
H
OH
(CH2OH)n
OH
H
C
H
H
гликозидный
гидроксил
(CH2OH)n
O
циклический
полуацеталь
*
H
новый
хиральный центр
(аномерный)
24.
Проекции Фишера и перспективныеформулы Хеуорса (Haworth).
5
HO
O H
O
4
H
H
1
H
H
3
2
OH
OH
Перспективная формула Хеуорса
D-рибофураноза
H
O
1
H
2
OH
H
3
OH
H
4
O H
5
OH
Проекция Фишера
D-рибоза
24
25.
Перевод проекций Фишера в перспективныеформулы Хеуорса (Haworth) на примере D-глюкозы.
две перестановки заместителей в
положении 5
2
H
3
HO
4
H
H
5
1
O
OH
HO
1
OH
CH2OH
2
H
3
HO
H
OH
H
таутомерное
равновесие
4
H
HO
OH
H
2a
OH
5
H
3
HO
4
H
5
HO
H
2
H
H
CH2OH
1
2б
OH
H
OH
CH2OH
H
HO
H
HOH2C
Формула Хеуорса
1
H
2
3
4
5
6
OH
H
OH
H
O
1
O
H
O
Фишеровская проекция
3
H
4
OH
5
H
OH H
HO
3
H
2
OH
Для перевода проекции Фишера в формулу Хеуорса:
1.
Нарисовать связь между атомами 5-О и 1-С
2.
Согласно правилу, что четное число перестановок в проекции Фишера не меняет конфигурации, сделать две (!) перестановки у
атома 5-C так, чтобы в итоге кольцевая 5-C-O связь стала продолжением вертикальной линии снизу. Например, перестановки:
а) между СН2ОН и линией кольцевой 5-C - O связи; б) между СН2ОН и Н.
3.
O
При переводе в формулу Хеуорса:
- атом 1-С расположить справа в кольце;
- кислород в кольце должен быть в правом верхнем углу пиранозного цикла и направлен "от нас". С-С связи в кольце
выделяются жирными линиями - для обозначения пространственной перспективы.
- группы, расположенные справа от вертикальной линии в проекции Фишера, нужно помещать снизу от плоскости кольца, а
расположенные слева - сверху.
1
OH
H
26.
Перевод проекций Фишера в перспективныеформулы Хеуорса (Haworth) на примере D-рибозы.
две перестановки заместителей в
положении 4
2
H
3
H
4
H
5
1
O
HO
1
OH
2
H
3
H
OH
OH
H
таутомерное
равновесие
CH2OH
Открытая форма
(цепочка) -
OH
HO
2a
OH
4
H
5
CH2OH
H
H
H
1
H
2
3
4
OH
OH
CH2OH
5
HO
2б
H
H
HOH2C
Формула Хеуорса
1
HO
H
2
3
4
OH
OH
H
5
3
O H
O
4
O
1
O
H
O
Фишеровская проекция
1
H
H
H
H
3
2
5
OH
OH
Кольцо
доминирующая форма
в незамещенных по
1-О (1-ОН) пентозах
Для перевода проекции Фишера в формулу Хеуорса:
1.
Нарисовать связь между атомами 4-О и 1-С
2.
Согласно правилу, что четное число перестановок в проекции Фишера не меняет конфигурации, сделать две (!) перестановки у
атома 4-C так, чтобы в итоге кольцевая 4-C-O связь стала продолжением вертикальной линии снизу. Например, перестановки:
а) между СН2ОН и линией кольцевой 4-C - O связи; б) между СН2ОН и Н.
3.
При переводе в формулу Хеуорса:
- атом 1-С расположить справа в кольце;
- кислород в кольце должен быть направлен "от нас". С-С связи в кольце выделяются жирными линиями - для
пространственной перспективы.
обозначения
- группы, расположенные справа от вертикальной линии в проекции Фишера, нужно помещать снизу от плоскости кольца, а
расположенные слева - сверху.
26
27.
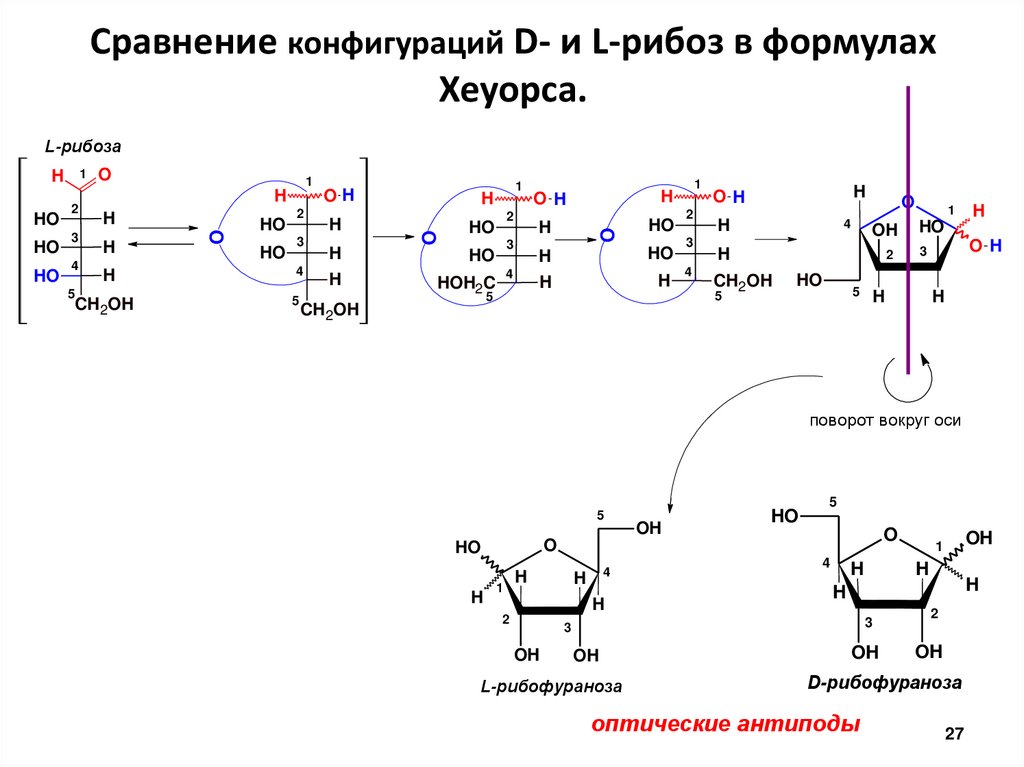
Сравнение конфигураций D- и L-рибоз в формулахХеуорса.
L-рибоза
HO
4
5
OH
H
H
H
CH2OH
HO
HO
2
3
4
5
H
1
H
O
HO
3
1
H
O
HO
2
O
2
HO
H
HO
H
HOH2C
H
3
4
HO
H
HO
H
H
2
3
4
H
OH
H
4
O
OH
H
2
CH2OH
HO
5
5
5
CH2OH
1
H
OH
O
1
H
1
H
HO
O H
3
H
H
поворот вокруг оси
5
5
O
O
HO
H
OH
HO
1
H
4
H
H
2
4
H
H
3
OH
L-рибофураноза
H
H
3
OH
OH
1
OH
2
OH
D-рибофураноза
оптические антиподы
27
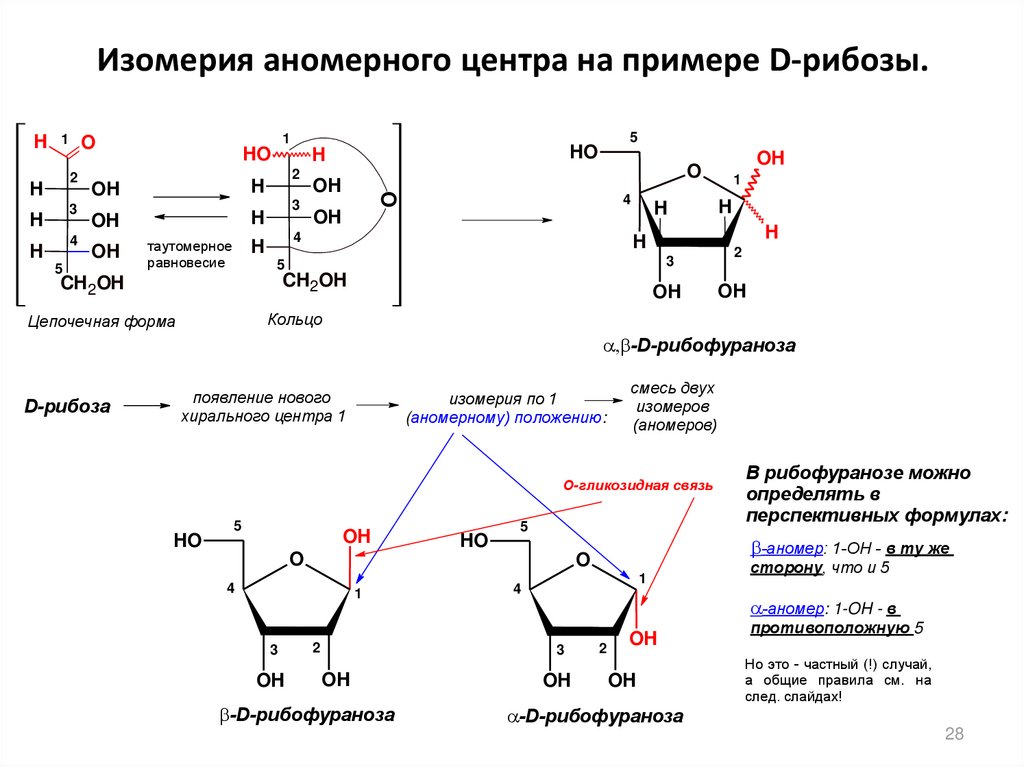
28. Изомерия аномерного центра на примере D-рибозы.
12
H
3
H
4
H
1
O
HO
H
OH
5
3
H
OH
OH
2
таутомерное
равновесие
5
HO
H
OH
4
H
OH
4
H
3
CH2OH
1
H
H
H
5
CH2OH
OH
O
O
H
OH
2
OH
Кольцо
Цепочечная форма
-D-рибофураноза
D-рибоза
появление нового
хирального цeнтра 1
изомерия по 1
(аномерному) положению:
смесь двух
изомеров
(аномеров)
О-гликозидная связь
HO
5
OH
HO
5
O
1
3
OH
-аномер: 1-ОH - в ту же
O
4
2
1
4
-D-рибофураноза
сторону, что и 5
-аномер: 1-OH - в
3
OH
В рибофуранозе можно
определять в
перспективных формулах:
OH
2
OH
OH
-D-рибофураноза
противоположную 5
Но это - частный (!) случай,
а общие правила см. на
след. слайдах!
28
29.
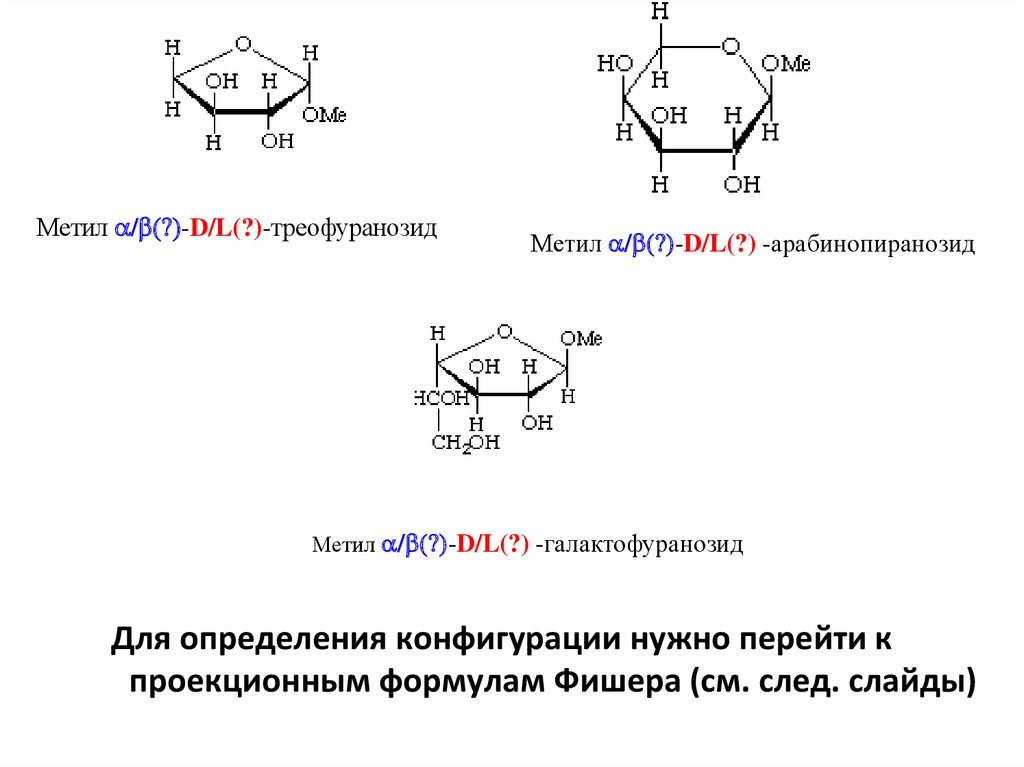
Метил / (?)-D/L(?)-треофуранозидМетил / (?)-D/L(?) -арабинопиранозид
Метил / (?)-D/L(?) -галактофуранозид
Для определения конфигурации нужно перейти к
проекционным формулам Фишера (см. след. слайды)
30. Номенклатура IUPAC
http://www.chem.qmul.ac.uk/iupac/2carb/06n07.htmlThe anomeric centre
• The new centre of chirality generated by hemiacetal ring closure is called the anomeric
centre. The two stereoisomers are referred to as anomers, designated α or β according to
the configurational relationship between the anomeric centre and a specified anomeric
reference atom.
The anomeric reference atom and the anomeric configurational symbol (α or β)
• The anomeric reference atom is the configurational atom of the parent. In the α anomer, the
exocyclic oxygen atom at the anomeric centre is formally cis, in the Fischer projection, to the
oxygen attached to the anomeric reference atom; in the β anomer these oxygen atoms are
formally trans.
The anomeric symbol α or β, followed by a hyphen, is placed immediately before the
configurational symbol D or L of the trivial name or of the configurational prefix denoting the
group of chiral carbon atoms that includes the anomeric reference atom.
31.
Метил β-L-треофуранозидМетил α-L-арабинопиранозид
Метил β-D-галактофуранозид
32.
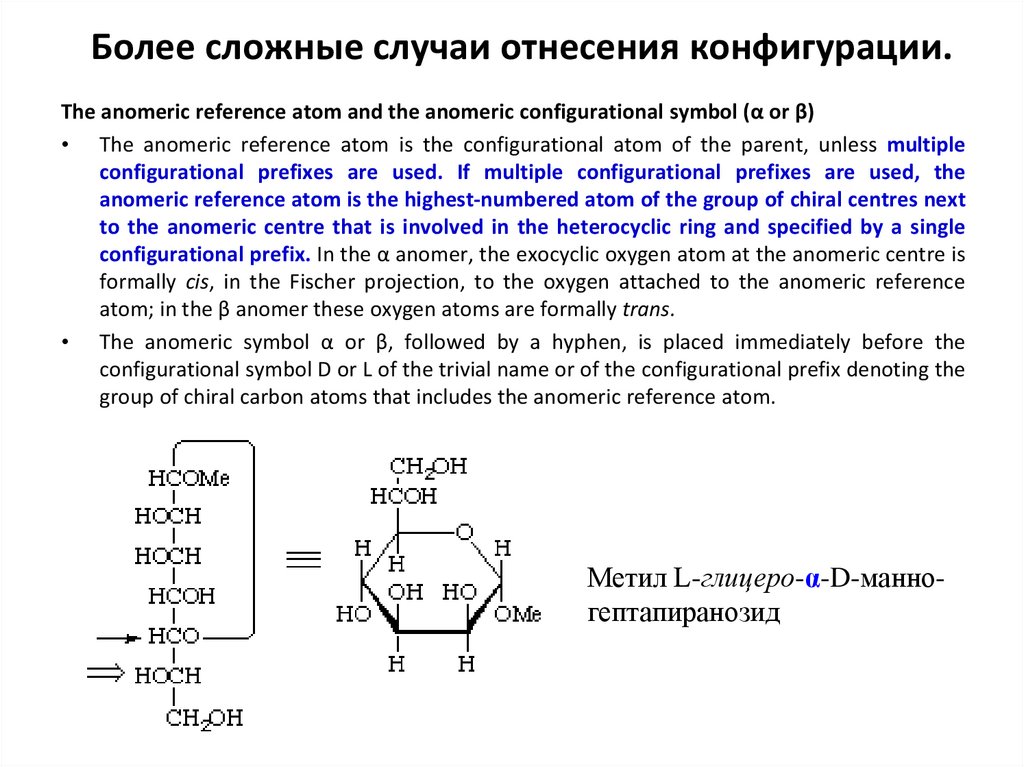
33. Более сложные случаи отнесения конфигурации.
The anomeric reference atom and the anomeric configurational symbol (α or β)• The anomeric reference atom is the configurational atom of the parent, unless multiple
configurational prefixes are used. If multiple configurational prefixes are used, the
anomeric reference atom is the highest-numbered atom of the group of chiral centres next
to the anomeric centre that is involved in the heterocyclic ring and specified by a single
configurational prefix. In the α anomer, the exocyclic oxygen atom at the anomeric centre is
formally cis, in the Fischer projection, to the oxygen attached to the anomeric reference
atom; in the β anomer these oxygen atoms are formally trans.
• The anomeric symbol α or β, followed by a hyphen, is placed immediately before the
configurational symbol D or L of the trivial name or of the configurational prefix denoting the
group of chiral carbon atoms that includes the anomeric reference atom.
Метил L-глицеро-α-D-манногептапиранозид
34.
R/S изомерия. Правила Кана-Ингольда-Прелога. Еще раз…Рассматриваем молекулу (часть молекулы с хиральным центром и его заместителями) в
пространстве.
Расставляем нумерацию у атомов, соединенных с хиральным центром по правилам старшинства:
- б'ольше атомный номер - старше: S > O > N > C > H
- если одинаковые, то сравниваем заместители у них: CH2OH>СН2(СН3)>CH3 ;СН2SH>COOH
- если опять одинаковые, то последовательно идем по цепочке дальше, пока не появятся различия
- если появляется раздвоение в цепочке, то идти по той, в которой появится «старший» атом
- если двойная (тройная) связь, то считается за два (три) заместителя: СН=О рассматривается, как
О-СН-О, следовательно: СООН > СН=О > CH2OH.
Поворачивам молекулу в пространстве так, чтобы младший заместитель был повернут от нас
(заслонен хиральным атомом).
Рисуем направление стрелок от старшего (№1) к младшему (№2, затем №3). Если вправо (по
часовой стрелке) - изомер R, если влево (против часовой стрелки) - S
35.
R/S изомерия.H
5
4
HO
OH
O
4
1
3
2
H
OH
OH
OH
H
1.изображаем
конфигурацию С(4)
в пространстве
1
4
2.определяем
старшинство
заместителей
C(4)
3
3."разворачиваем"
тетраэдр так, чтобы
младший смотрел "от
нас" = был заслонен
хиральным центром
3 C(5)
O(4)
C(5)
2 С(3)
С(2)
3
на
C(5)
5. рисуем стрелки от
старшего к младшему
2
С(3)
H
4. проецируем
плоскость
C(4)
1
O(4)
2
C(4)
С(3)
1
O(4)
H
OH
по часовой = R
C(4) - R
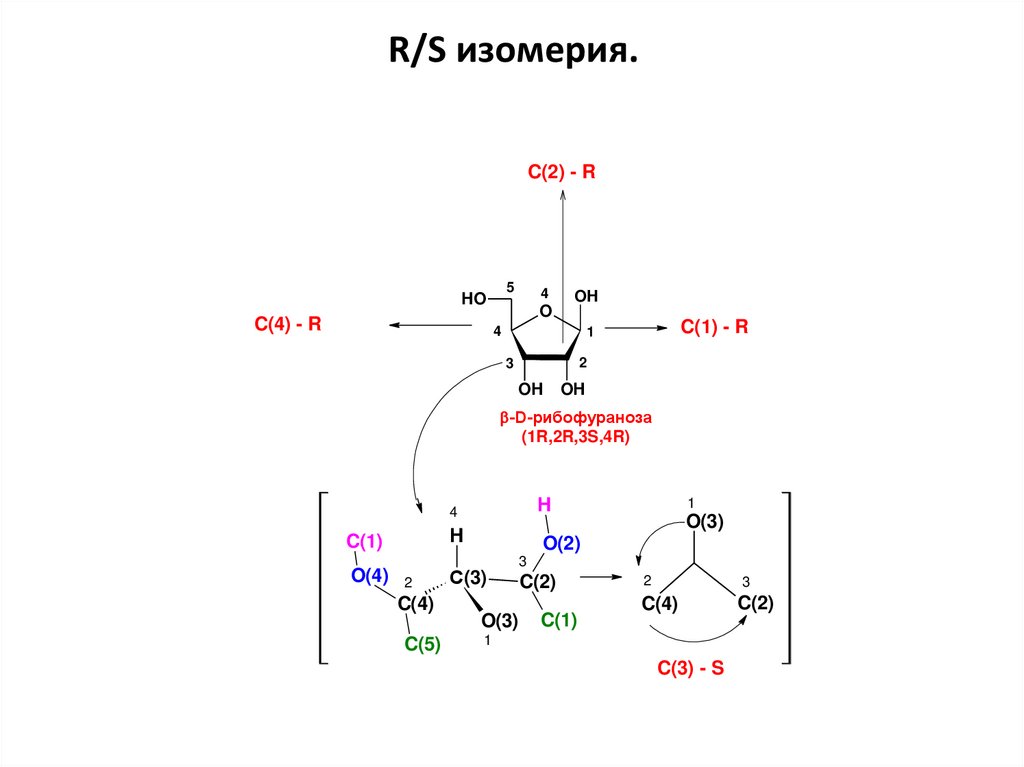
36.
R/S изомерия2
H
O(1)
2
5
HO
C(4) - R
4
O
OH
4
1
1
С(4)
O(4)
С(1)
2
3
OH
OH
3
O(1)
4
H
1
3
O(4)
C(2)
С(2)
C(1) - R
37.
R/S изомерия1
4
O(2)
H
H
2
3
(4)C
C(1) H
С(2)
С(3)
O(1)
O(4)
1
O(3)
2
3
C(3)
C(1)
O(2)
C(2) - R
5
HO
C(4) - R
4
O
OH
4
1
2
3
OH
OH
C(1) - R
38.
R/S изомерия.C(2) - R
5
HO
C(4) - R
4
O
OH
4
C(1) - R
1
2
3
OH
OH
-D-рибофураноза
(1R,2R,3S,4R)
H
4
H
C(1)
O(4)
2
C(4)
C(5)
1
O(3)
O(2)
С(3)
3
O(3)
C(2)
C(1)
2
3
C(4)
1
C(3) - S
C(2)



























 Биология
Биология Химия
Химия








