Похожие презентации:
Гидроксипроизводные углеводородов. Спирты. Фенолы
1.
ГИДРОКСИПРОИЗВОДНЫЕУГЛЕВОДОРОДОВ.
СПИРТЫ. ФЕНОЛЫ.
2.
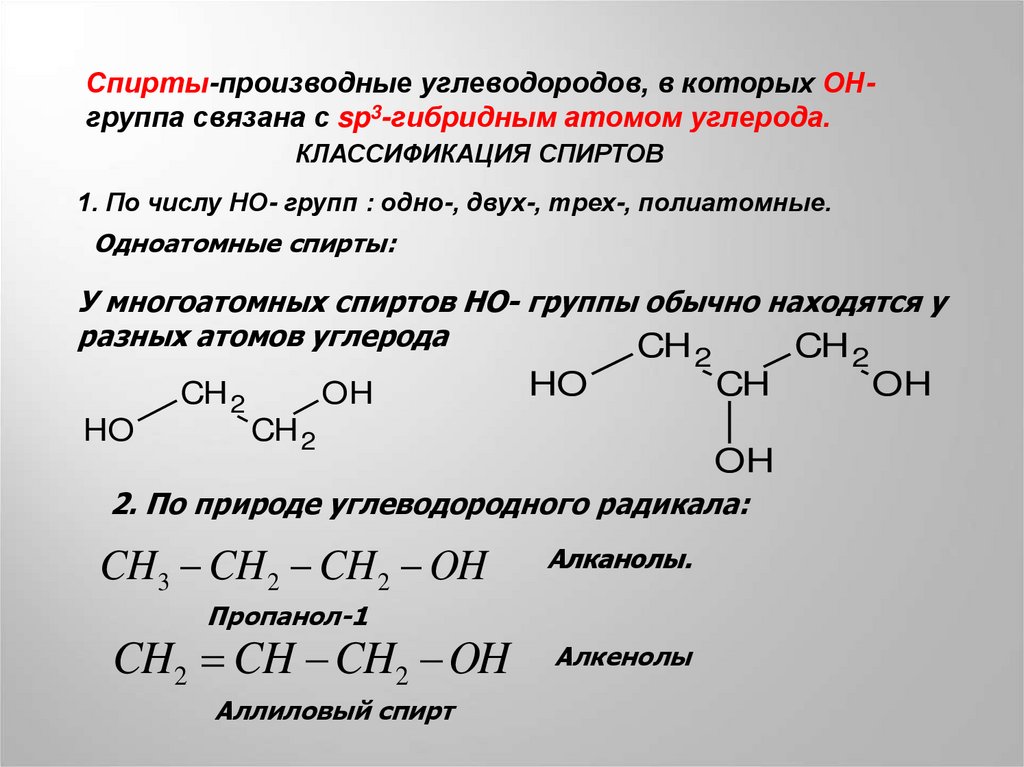
Спирты-производные углеводородов, в которых ОНгруппа связана с sp3-гибридным атомом углерода.КЛАССИФИКАЦИЯ СПИРТОВ
1. По числу НО- групп : одно-, двух-, трех-, полиатомные.
Одноатомные спирты:
У многоатомных спиртов НО- группы обычно находятся у
разных атомов углерода
CH
CH
CH 2
HO
OH
HO
CH 2
2
CH
OH
2. По природе углеводородного радикала:
CH3 CH2 CH2 OH
Алканолы.
Пропанол-1
CH2 CH CH2 OH
Аллиловый спирт
Алкенолы
2
OH
3.
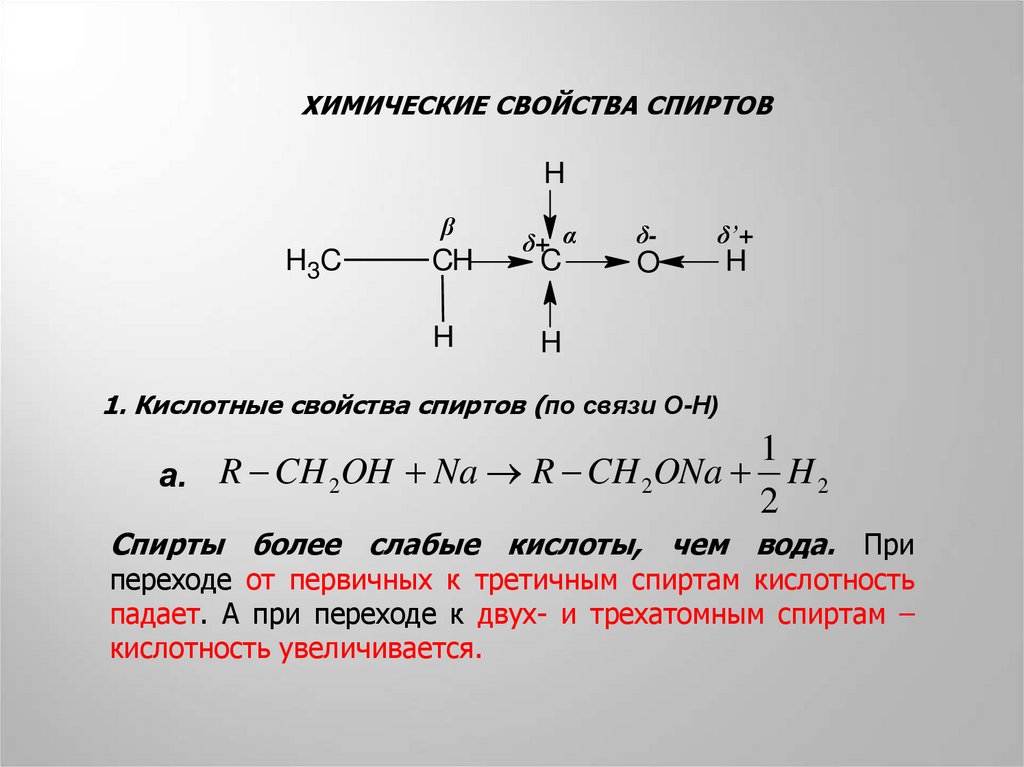
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВH
β
H3C
CH
H
δ+ α
C
δ-
δ’+
O
H
H
1. Кислотные свойства спиртов (по связи О-Н)
1
а. R CH 2OH Na R CH 2ONa H 2
2
Спирты более слабые кислоты, чем вода. При
переходе от первичных к третичным спиртам кислотность
падает. А при переходе к двух- и трехатомным спиртам –
кислотность увеличивается.
4.
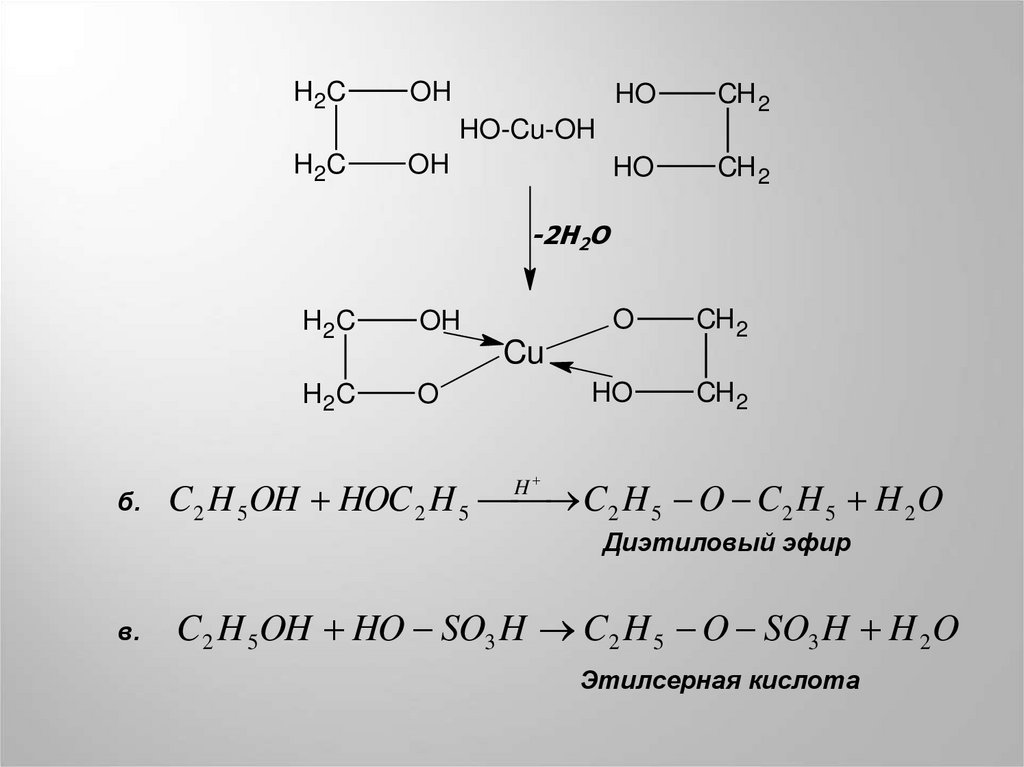
H2COH
HO
CH 2
HO
CH 2
HO-Cu-OH
H2C
OH
-2H2O
б.
H2C
OH
H2C
O
O
CH 2
HO
CH 2
Cu
H
C2 H 5OH HOC 2 H 5 C2 H 5 O C2 H 5 H 2 O
Диэтиловый эфир
в.
C2 H 5OH HO SO3 H C2 H 5 O SO3 H H 2 O
Этилсерная кислота
5.
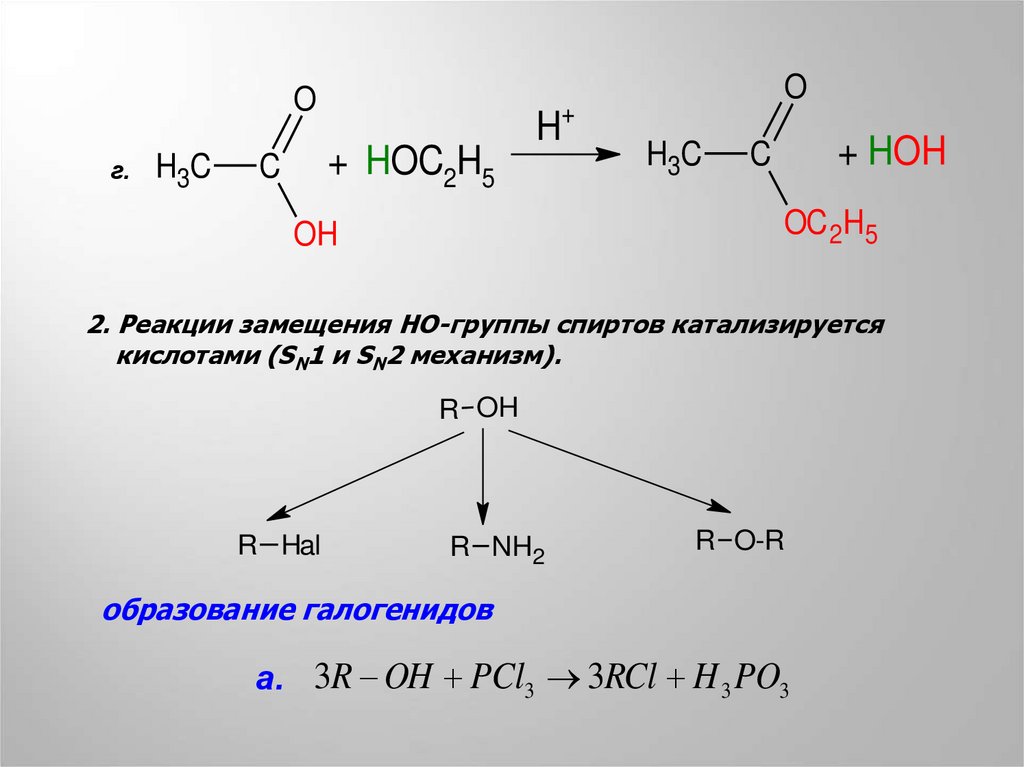
Oг.
H3C
+ HOC2H5
C
H+
O
H3C
+ HOH
C
OC 2H5
OH
2. Реакции замещения HO-группы спиртов катализируется
кислотами (SN1 и SN2 механизм).
R OH
R Hal
R NH2
R O-R
образование галогенидов
а. 3R OH PCl3 3RCl H 3 PO3
6.
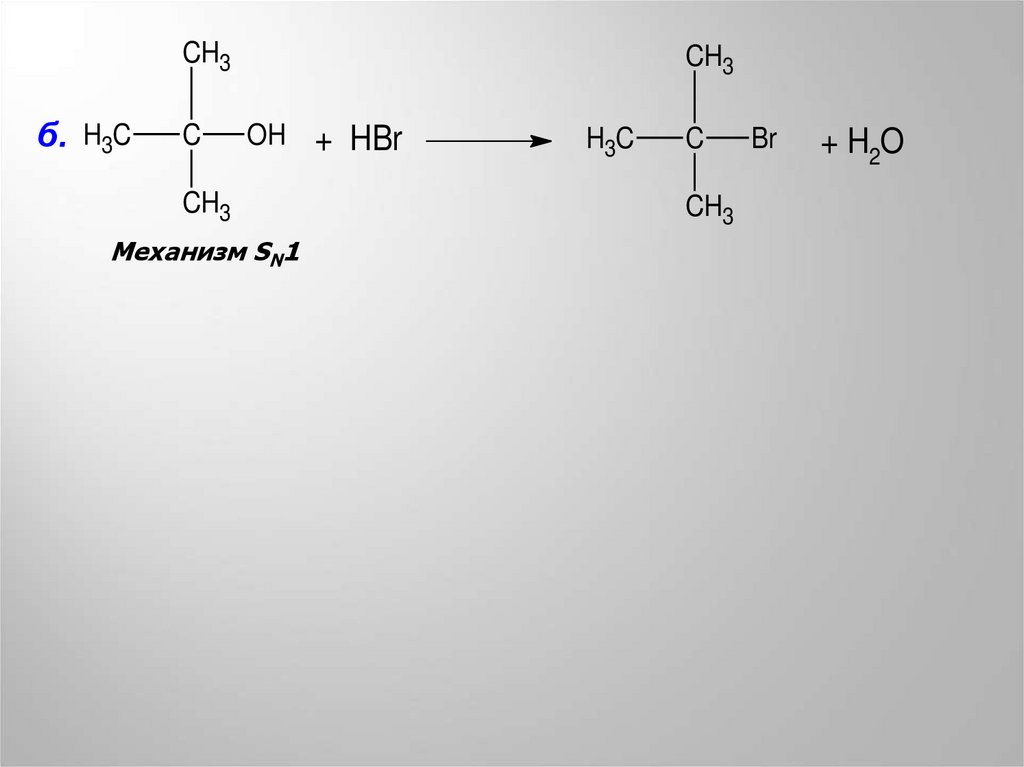
CH3б. H3C
C
CH3
OH + HBr
CH3
Механизм SN1
H3C
C
CH3
Br
+ H2O
7.
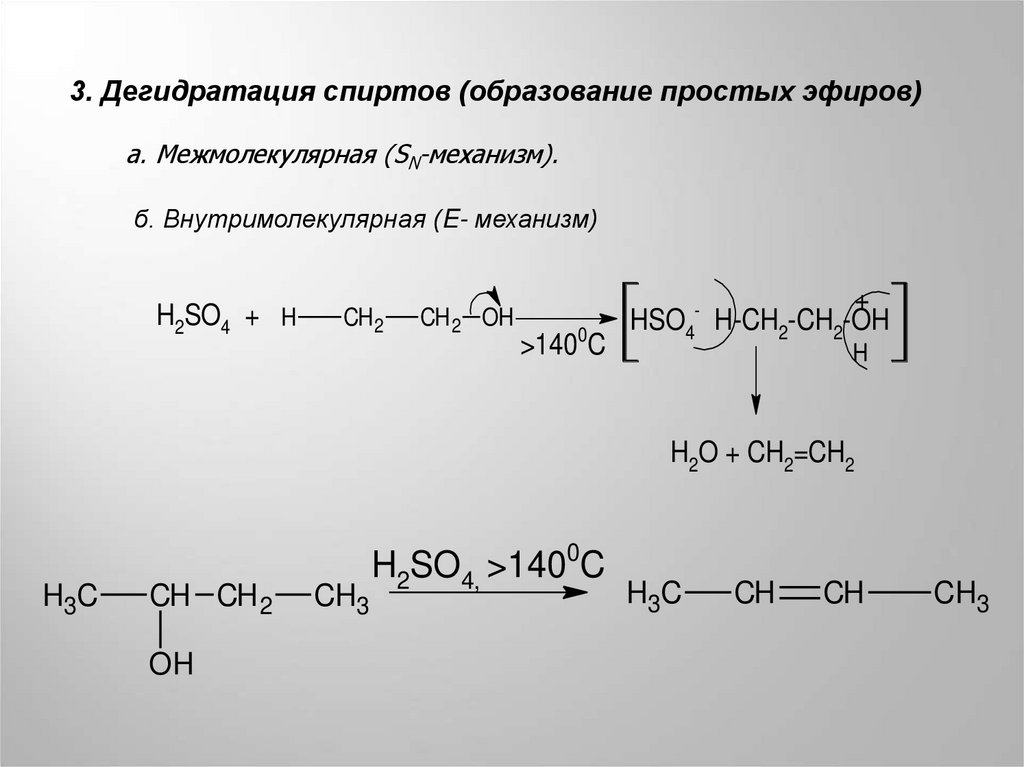
3. Дегидратация спиртов (образование простых эфиров)а. Межмолекулярная (SN-механизм).
б. Внутримолекулярная (E- механизм)
H2SO4 + H
CH 2
CH 2 OH
>1400C
HSO4-
+
H-CH2-CH2-OH
H
H2O + CH2=CH2
H3C
CH CH 2
OH
CH3
H2SO4, >1400C
H3C
CH
CH
CH3
8.
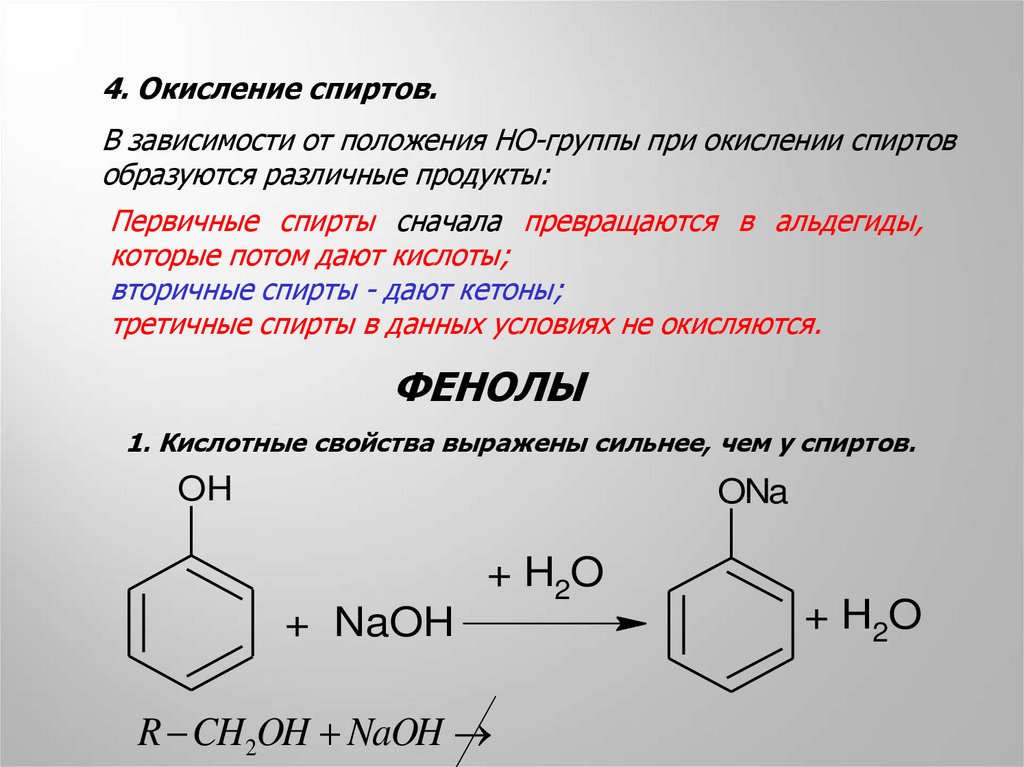
4. Окисление спиртов.В зависимости от положения HO-группы при окислении спиртов
образуются различные продукты:
Первичные спирты сначала превращаются в альдегиды,
которые потом дают кислоты;
вторичные спирты - дают кетоны;
третичные спирты в данных условиях не окисляются.
ФЕНОЛЫ
1. Кислотные свойства выражены сильнее, чем у спиртов.
OH
ONa
+ H2O
+ NaOH
R CH2OH NaOH
+ H2O
9.
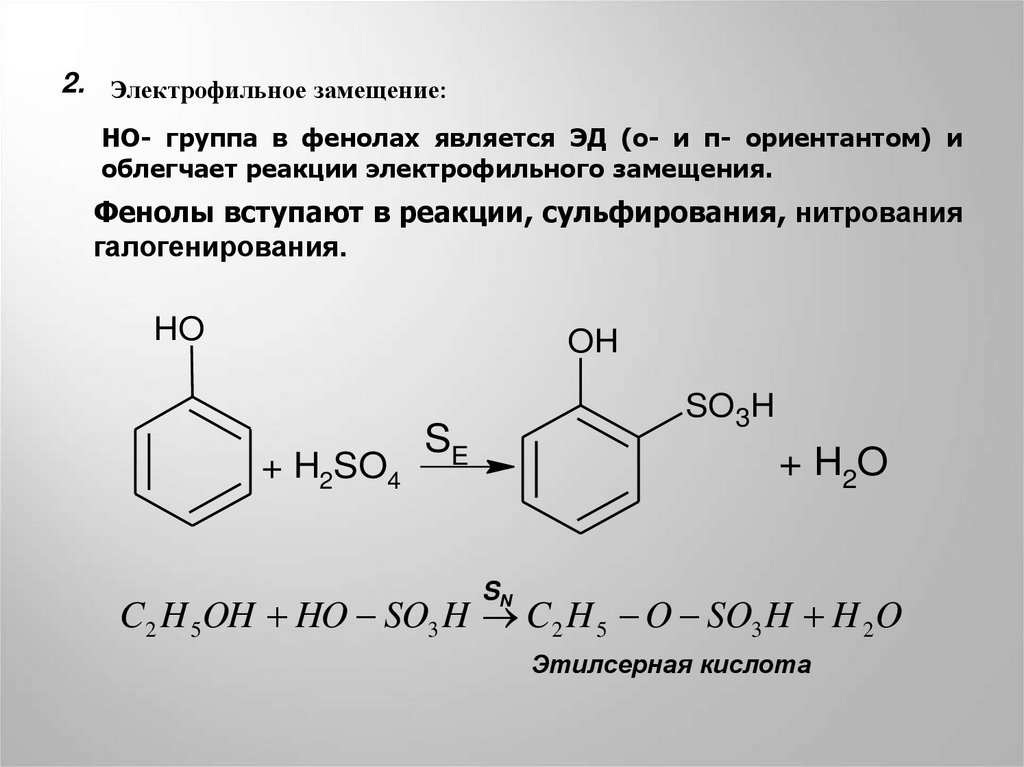
2. Электрофильное замещение:HO- группа в фенолах является ЭД (о- и п- ориентантом) и
облегчает реакции электрофильного замещения.
Фенолы вступают в реакции, сульфирования, нитрования
галогенирования.
HO
OH
+ H2SO4
SO3H
SE
+ H2O
SN
C2 H 5OH HO SO3 H C2 H 5 O SO3 H H 2 O
Этилсерная кислота
10.
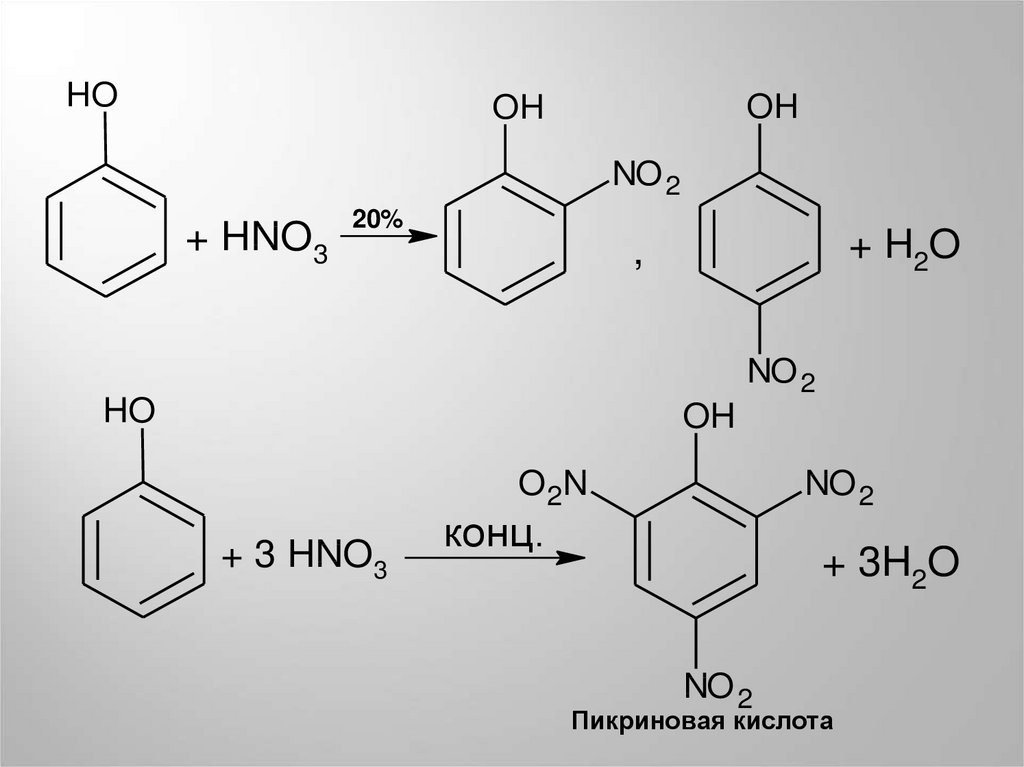
HOOH
OH
NO 2
+ HNO3
20%
+ H2O
,
NO 2
HO
OH
O 2N
+ 3 HNO3
NO 2
конц.
+ 3H2O
NO 2
Пикриновая кислота
11.
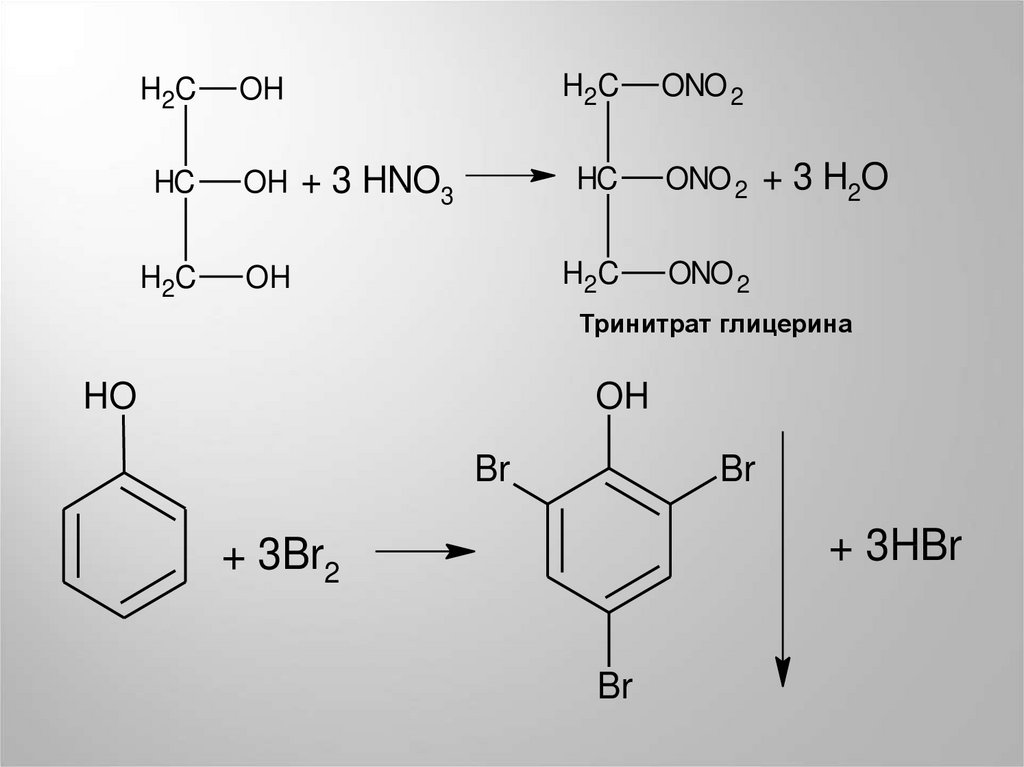
H2CHC
H2C
H2 C
OH
OH + 3 HNO3
HC
H2 C
OH
ONO 2
ONO 2 + 3 H2O
ONO 2
Тринитрат глицерина
HO
OH
Br
Br
+ 3HBr
+ 3Br2
Br
12.
2OC 2 H 5 OH Br2 H
3. C6 H 5 OH HBr
C2 H 5OH HBr C2 H 5 Br H 2 O
4.
C6 H 5OH CH 3COOH
H
C2 H 5 OH CH 3COOH CH 3COOC 2 H 5 H 2 O
13.
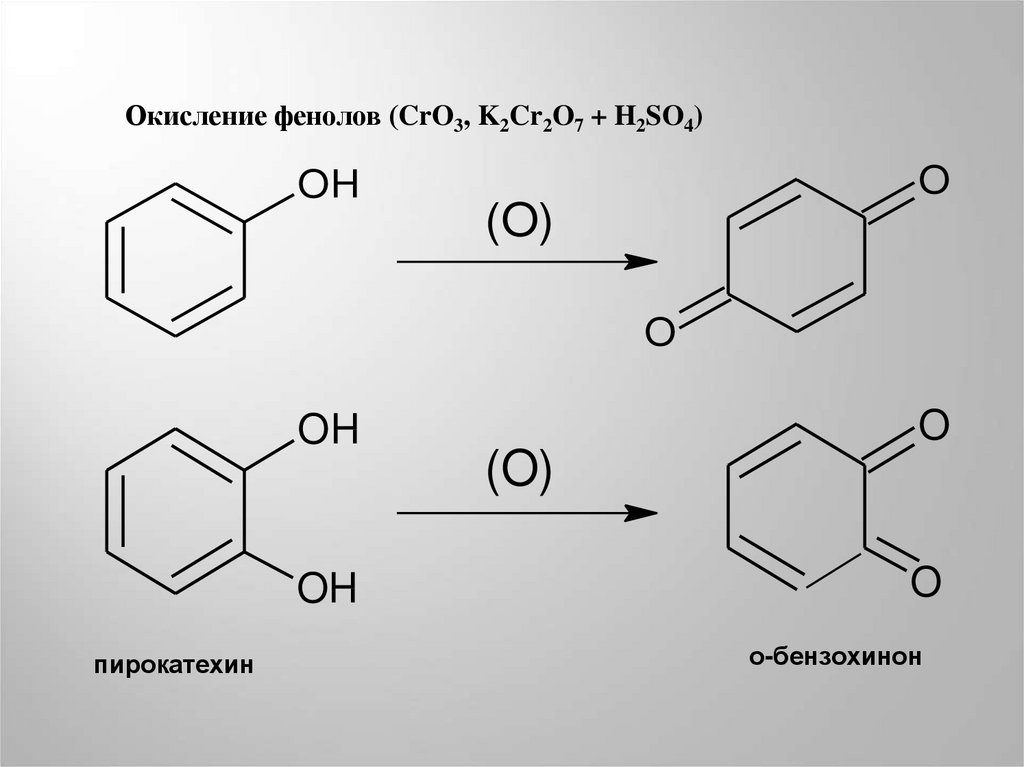
Окисление фенолов (CrO3, K2Cr2O7 + H2SO4)OH
O
(O)
O
OH
OH
пирокатехин
O
(O)
O
о-бензохинон
14.
OHO
(O)
O
HO
гидрохинон
п-бензохинон
O
OH
CrO3
легко
α-нафтол
O
нафтохинон
15.
Кислотно-основныесвойства
органических соединений
Кислотность и основность – важнейшие понятия, которые
определяют многие свойства и биологическую активность
органических соединений.
Существует несколько теорий, которые дают возможность
классифицировать химические соединения на кислоты и
основания.
В органической химии для объяснения кислотно-основных свойств
применяют две основные теории:
1. Протолитическая теория Бренстеда-Лоури;
2. Теория Льюиса.
16.
ТЕОРИЯ БРЕНСТЕДА-ЛОУРИЭта теория связана с
(протолитическая теория).
переносом
протона,
Н+
Согласно этой теории
Кислоты – вещества, которые в данной
способны отдавать протон ( доноры протонов)
реакции
Основания – вещества, которые в данной реакции
способны пронимать протон (акцепторы протонов).
В общем виде для реакции:
HА
кислота
+
:B
=
A-
+
основание oснование’
HB
кислота’
17.
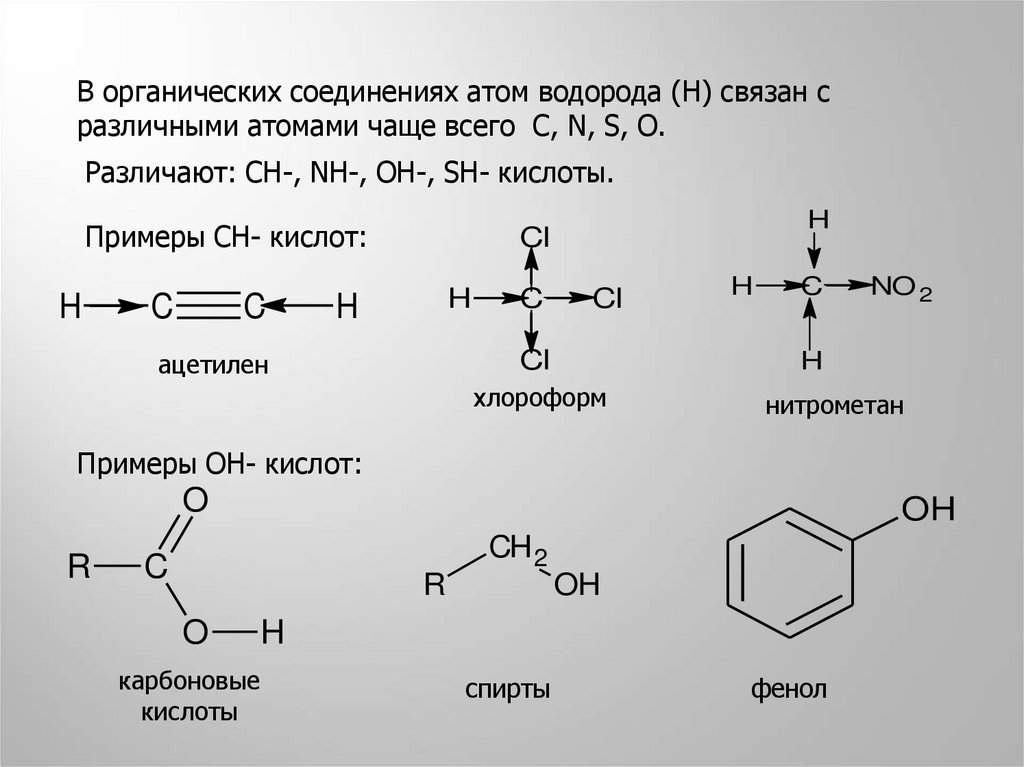
В органических соединениях атом водорода (Н) связан сразличными атомами чаще всего С, N, S, O.
Различают: CH-, NH-, OH-, SH- кислоты.
Примеры СН- кислот:
H
C
C
H
Cl
H
H
ацетилен
C
Cl
Cl
H
C
NO 2
H
хлороформ
нитрометан
Примеры ОН- кислот:
O
R
OH
CH 2
C
R
O
карбоновые
кислоты
OH
H
спирты
фенол
18.
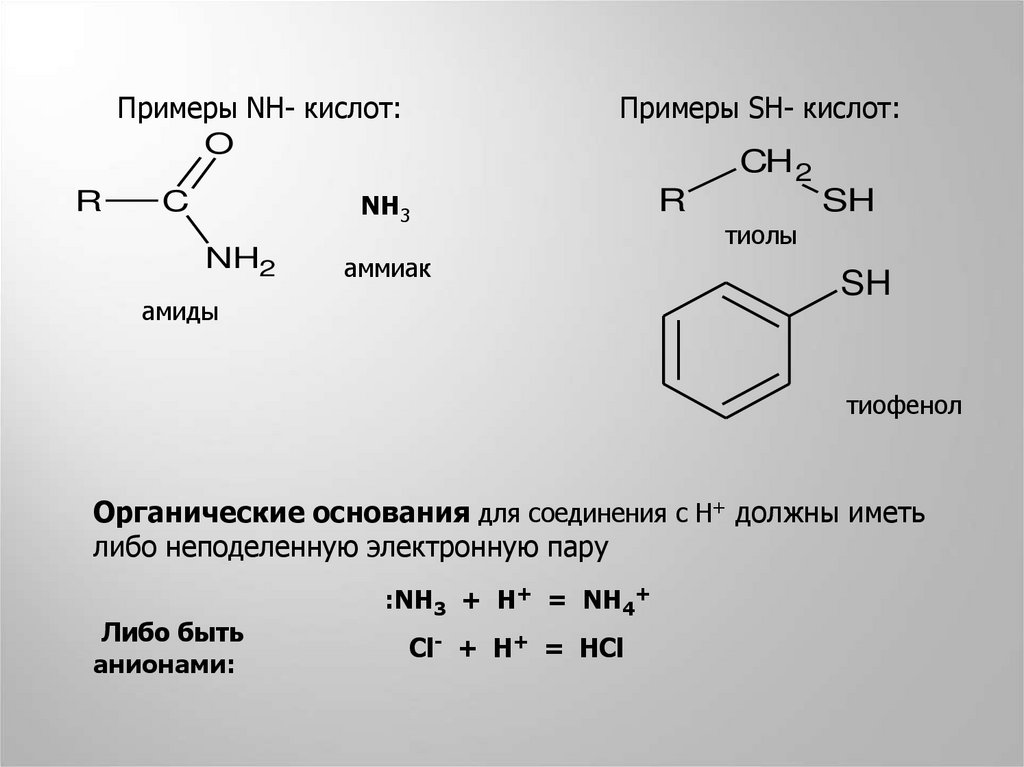
Примеры NН- кислот:O
R
Примеры SН- кислот:
CH 2
NH3
C
NH2
аммиак
амиды
R
SH
тиолы
SH
тиофенол
Органические основания для соединения с Н+ должны иметь
либо неподеленную электронную пару
Либо быть
анионами:
:NH3 + H+ = NH4+
Cl- + H+ = HCl
19.
Т.к. органических соединений много и не все они растворимы вводе или других полярных растворителях (например, жидкий
аммиак),
невозможно
для
каждого
вещества
иметь
количественную характеристику кислотных свойств.
Поэтому чаще используют качественный подход к оценке
кислотных свойств , который основан на оценке стабильности
сопряженного основания
Сила кислоты определяется стабильностью сопряженного
основания (аниона), который образуется из этой кислоты.
Чем стабильнее анион, тем сильнее кислота.
С другой стороны, кислоты – это доноры протонов. Чем легче
оторвать протон, тем сильнее кислота.
От чего зависит легкость отдачи протона?
Рассмотрим факторы, влияющие на кислотность органических
соединений.
20.
1. Природа атома в кислотном центре.Этот
фактор
связан
с
поляризуемостью
электроотрицательностью элемента в кислотном центре.
R-CH2-CH2-H,
R-CH2-NH-H,
R-CH2-O-H,
и
R-CH2-S-H
По возрастанию кислотности кислоты Бренстеда располагаются в
следующем порядке
C-H < N-H < O-H < S-H
В таком же порядке возрастает стабильность соответствующих
анионов (сопряженных оснований):
R-CH2-CH2- <
R-CH2-NH- < R-CH2-O- < R-CH2-SАтом серы больше по размеру и легче поляризуется, чем
элементы второго периода. Отрицательный заряд на атоме серы
делокализуется в большей степени. Поэтому тиолят-анион (RS-)
стабильнее, чем алкоксид-анион (RO-).
21.
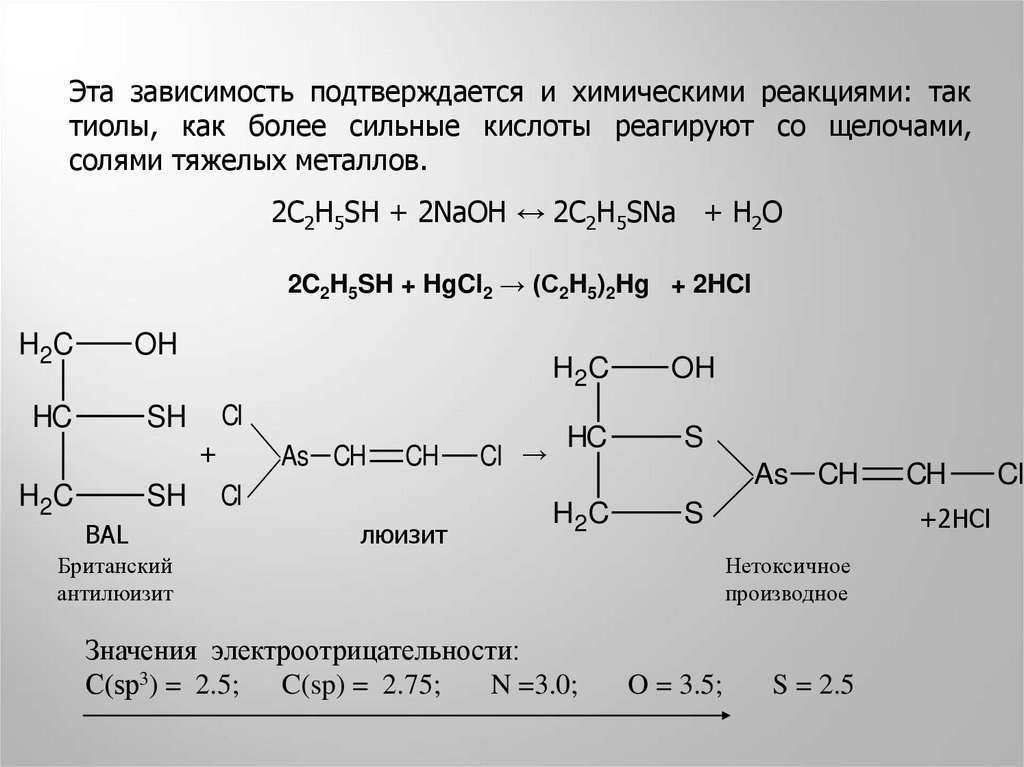
Эта зависимость подтверждается и химическими реакциями: тактиолы, как более сильные кислоты реагируют со щелочами,
солями тяжелых металлов.
2C2H5SH + 2NaOH ↔ 2C2H5SNa + H2O
2C2H5SH + HgCl2 → (C2H5)2Hg + 2HCl
H2C
OH
HC
SH
Cl
+
H2C
SH
BAL
As CH
CH
Cl
люизит
Cl →
H2C
OH
HC
S
As CH
H2C
S
Британский
антилюизит
Значения электроотрицательности:
С(sp3) = 2.5; C(sp) = 2.75;
N =3.0;
+2HCl
Нетоксичное
производное
O = 3.5;
CH
S = 2.5
Cl
22.
Чем более электроотрицательным является элемент в кислотномцентре, тем прочнее он несет отрицательный заряд и тем
стабильнее образующийся анион. При этом способность отдачи
протона усиливается, а значит усиливаются и кислотные свойства
вещества.
Спирты, как слабые кислоты практически не реагируют со щелочами, но
реагируют с активными металлами:
C2H5OH + Na → C2H5ONa + ½H2
Амидами металлов:
гидридами металлов:
C2H5OH + NaNH2 → C2H5ONa + NH3
C2H5OH + NaH → C2H5ONa + H2
Амины и углеводороды не проявляют заметных кислотных свойств.
23.
2. Влияние на кислотность электронных эффектовзаместителей.
Независимо от механизма передачи электронного эффекта
заместителя в общем случае выполняется правило:
Электроноакцепторные заместители усиливают кислотность,
Формула
Ка
pKa
ClCH2COOH
1.38 10-3
2.86
BrCH2COOH
1.26 10-3
2.90
FCH2COOH
2.17 10-3
2.66
Cl2CHCOOH
5.62 10-2
1.25
Cl3CCOOH
2.19 10-1
0.66
24.
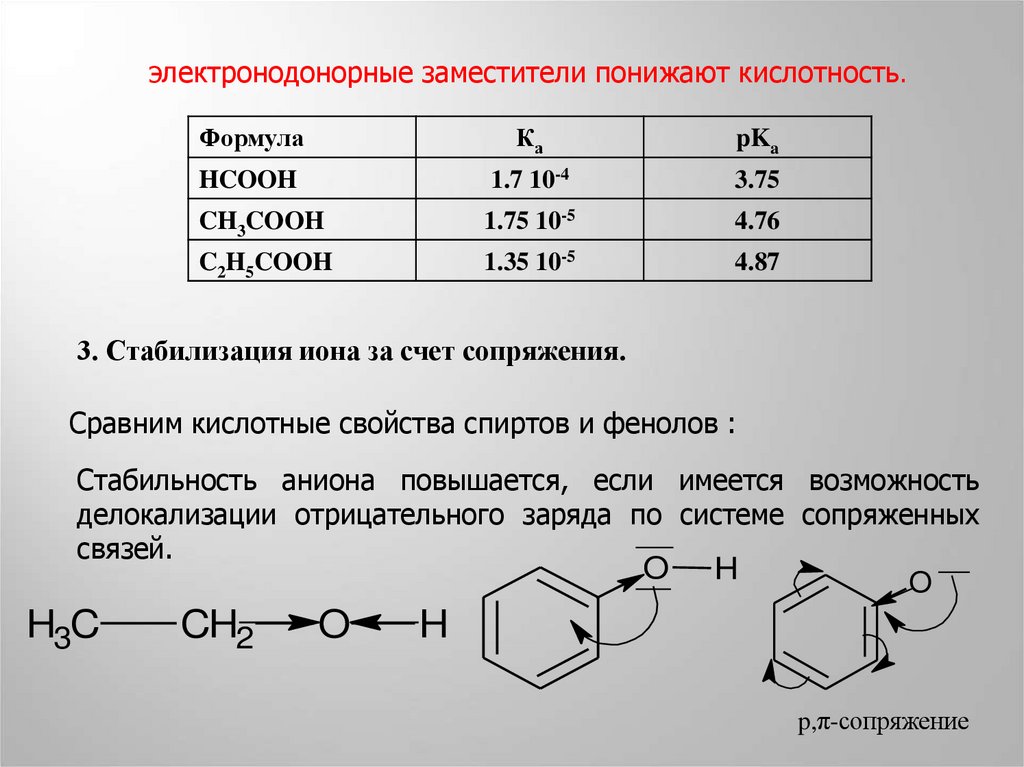
электронодонорные заместители понижают кислотность.Формула
Ка
pKa
HCOOH
1.7 10-4
3.75
CH3COOH
1.75 10-5
4.76
C2H5COOH
1.35 10-5
4.87
3. Стабилизация иона за счет сопряжения.
Сравним кислотные свойства спиртов и фенолов :
Стабильность аниона повышается, если имеется возможность
делокализации отрицательного заряда по системе сопряженных
связей.
O H
O
H3C
CH2
O
H
p,π-сопряжение
25.
И в фенолах заместители влияют на кислотные свойства по темже правилам.
OH
OH
O 2N
OH
OH
CH3
NH 2
10,1
10,5
NO 2
NO 2
pKa
OH
0,8
NO 2
7,1
10










 Химия
Химия








