Похожие презентации:
Спирты и фенолы
1.
Министерство науки и высшего образования РФ ФГБОУ ВО«Самарский государственный технический университет»
Химико-технологический факультет
Кафедра органической химии
Органическая химия
Тема: Спирты и фенолы.
Преподаватель: д.х.н., профессор Климочкин Ю.Н
1
2.
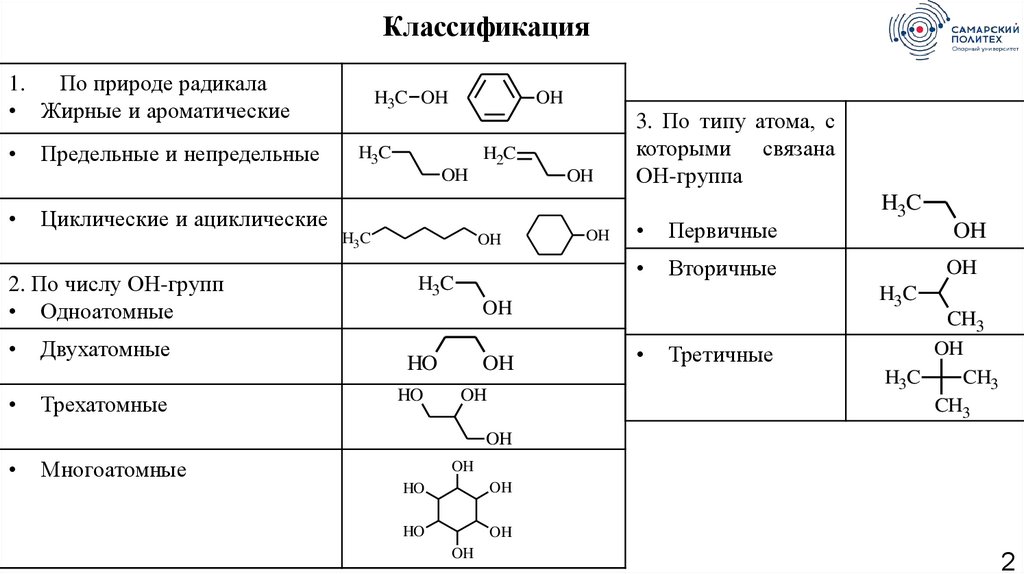
Классификация1.
По природе радикала
• Жирные и ароматические
Предельные и непредельные
H3C OH
OH
H3C
H2C
OH
OH
Циклические и ациклические
H3C
2. По числу ОН-групп
• Одноатомные
Двухатомные
Трехатомные
OH
H3C
OH
3. По типу атома, с
которыми связана
ОН-группа
Первичные
Вторичные
HO
OH
OH
OH
OH
H3C
OH
HO
H3C
Третичные
CH3
OH
H3C
CH3
CH3
OH
Многоатомные
OH
HO
OH
HO
OH
OH
2
3.
НоменклатураАлифатические спирты (предельные, одноатомные) - это
соединения, содержащие гидроксильную группу (-ОН), связанную с
углеводородным радикалом. Общая формула CnH2n+1OH.
Называют по IUPAC, рациональной и тривиальной
номенклатурам.
IUPAC - спирты называют алканолами, прибавляя суффикс -ол к
названию соответствующего алкана (метанол, этанол).
При этом за основу названия принимают наиболее длинную
углеродную цепь, содержащую ОН-группу.
Атомы углерода основной цепи нумеруют таким образом, чтобы
атом, связанный с гидроксильной группой, получил наименьший
номер.
3
4.
НоменклатураСогласно карбинольной (рациональной) системе, метанол называют
карбинолом, а остальные спирты рассматривают как производные карбинола.
Например, этанол называют метилкарбинолом, а 2-метил-2-пропанол –
триметилкарбинолом и т.д.
Часто спирты называют, прибавляя к названию соответствующей
алкильной группы слово «спирт». Например, бутиловый спирт.
Низшие спирты обычно имеют тривиальные названия (метанол древесный спирт, этанол - винный спирт и т.д.).
H3C OH
метиловый спирт,
метанол, карбинол
H3C
OH
этиловый (винный) спирт,
метилкарбинол
H3C
OH
н-пропиловый спирт,
этилкарбинол
3
5.
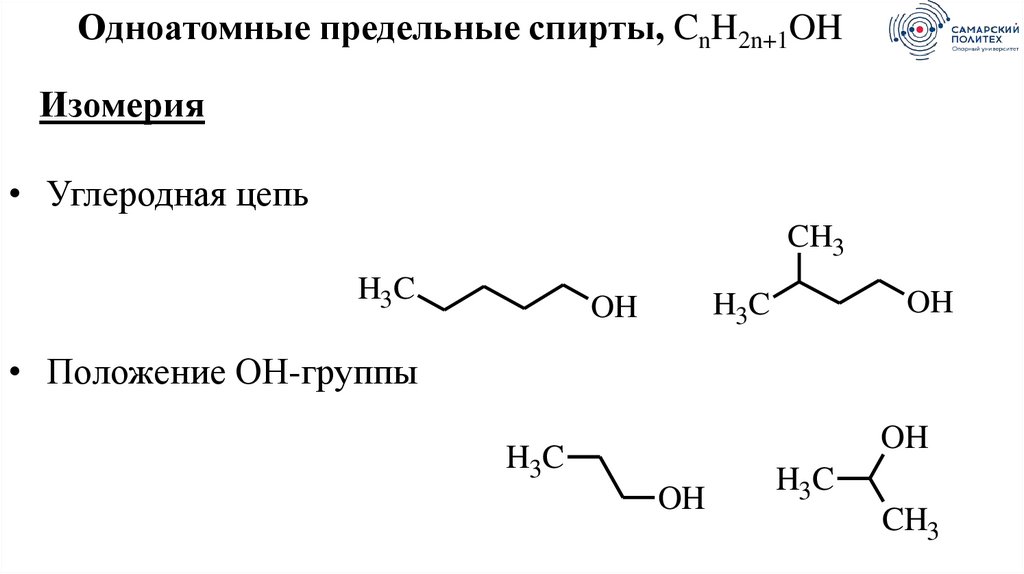
Одноатомные предельные спирты, CnH2n+1OHИзомерия
• Углеродная цепь
CH3
H3C
OH
H3C
OH
• Положение ОН-группы
OH
H3C
OH
H3C
CH3
6.
ПолучениеИз оксида углерода
Брожение глюкозы (C6H12O6):
O
H
H
OH
HO
H
H
OH
H
OH
CH 2OH
D-глюкоза
C6 H12O6
дрожжи
2 C 2H5OH + 2 CO 2
7.
Методы полученияГидролиз галогеналканов в водных растворах щелочей происходит по
механизму нуклеофильного замещения
H2O
H3C CH CH3 + NaOH
H3C CH CH3 + NaBr
OH
Br
H3C Br
H3C
H3C
H3C
+ H2O
Br
+ H2O
SN2
SN1
H3C OH
H3C
H3C
H3C
+ HBr
OH
+ HBr
3
8.
Гидратация алкенов
Методы получения
Присоединение воды протекает в присутствии кислотных катализаторов (H2SO4, H3PO4,
оксид алюминия и другие носители, обработанные кислотами).
H2SO4
R CH CH2 + H2O
R CH CH3
или Al2O3
OH
Этим методом в крупных масштабах получают низшие спирты, из них важнейшим
продуктом является этанол:
300 °C
CH2 CH2 + H2O
CH3 CH2 OH
кат.
из пропилена и н-бутилена - изопропиловый и втор-бутиловый спирты:
CH3 CH2 CH CH2 + H2O
t, Al2O3
CH3 CH2 CH CH3
OH
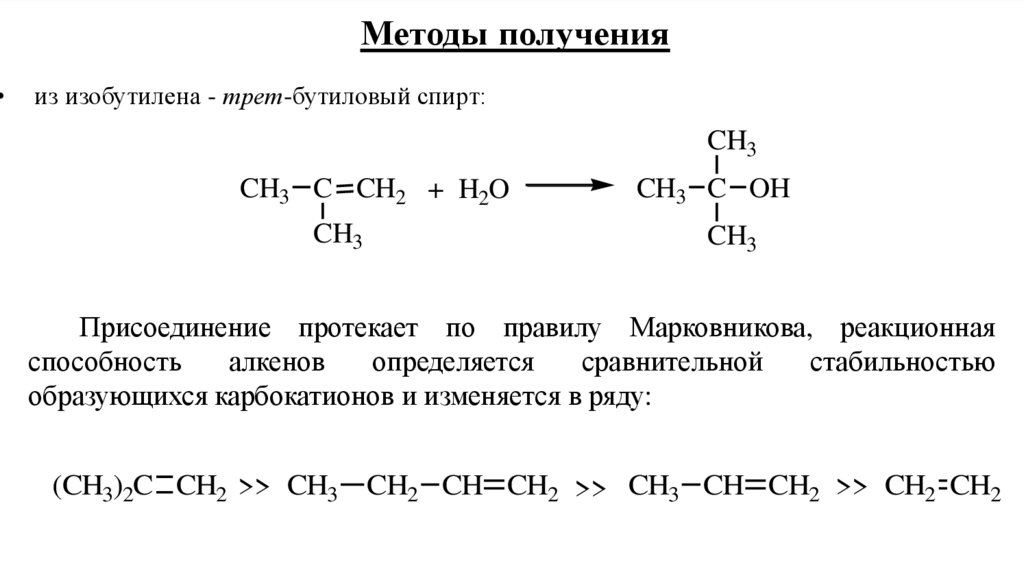
9.
Методы получения
из изобутилена - трет-бутиловый спирт:
CH3
CH3 C CH2 + H2O
CH3
CH3 C OH
CH3
Присоединение протекает по правилу Марковникова, реакционная
способность
алкенов
определяется
сравнительной
стабильностью
образующихся карбокатионов и изменяется в ряду:
(CH3)2C CH2 >> CH3 CH2 CH CH2 >> CH3 CH CH2 >> CH2 CH2
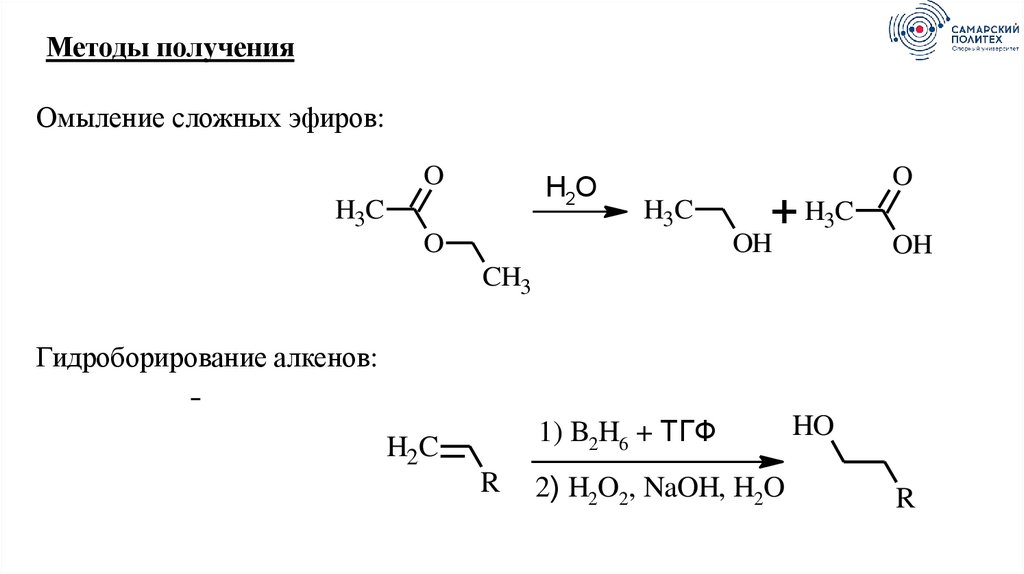
10.
Методы полученияОмыление сложных эфиров:
O
H2O
H3C
O
H3C
O
H3C
+
OH
OH
CH3
Гидроборирование алкенов:
1) B2H6 + ТГФ
H2C
R
2) H2O2, NaOH, H2O
HO
R
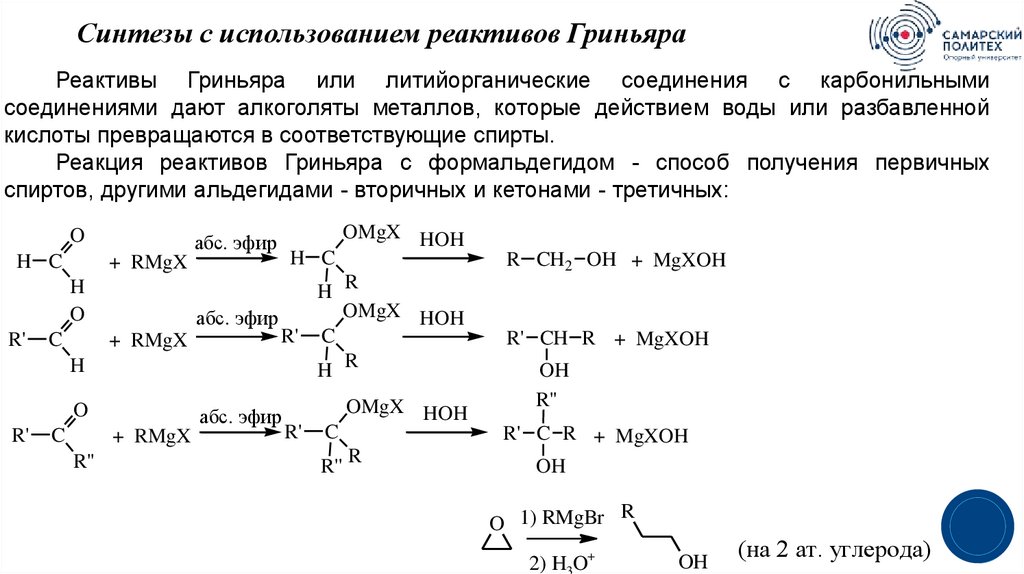
11.
Синтезы с использованием реактивов ГриньяраРеактивы Гриньяра или литийорганические соединения с карбонильными
соединениями дают алкоголяты металлов, которые действием воды или разбавленной
кислоты превращаются в соответствующие спирты.
Реакция реактивов Гриньяра с формальдегидом - способ получения первичных
спиртов, другими альдегидами - вторичных и кетонами - третичных:
O
H C
+ RMgX
H
O
R'
абс. эфир
C
H
C
абс. эфир
+ RMgX
R''
R CH2 OH + MgXOH
H R
OMgX HOH
абс. эфир
R' C
+ RMgX
H R
O
R'
H C
OMgX HOH
R'
C
OMgX HOH
R'' R
R' CH R + MgXOH
OH
R''
R' C R + MgXOH
OH
R
O 1) RMgBr
+
2) H3O
OH
(на 2 ат. углерода)
3
12.
Методы полученияВосстановление
карбонильных
соединений.
Альдегиды
и
кетоны
легко
восстанавливаются водородом в присутствии катализаторов (Ni, Pd, Pt) в первичные и
вторичные спирты:
O
kat
CH3 CH2 C
CH3 CH2 CH2 OH
+ H2
O
OH
[H]
H
R C R
R CH R
пропионовый альдегид
пропанол-1
O
[H]
R CH2 OH + R'OH
R C
OR'
O
H
H2, Pt, 3 атм
OH
25oC, C2H5OH
циклогексанон
циклогексанол
Для восстановления карбонильной группы также широко используются комплексные гидриды
металлов - боргидрид натрия NaBH4 (растворитель - вода, этанол) или алюмогидрид лития
LiAlH4 (растворитель - абсолютный эфир).
Карбонильные соединения также можно восстанавливать атомарным водородом,
образующимся при взаимодействии металлического натрия с этиловым спиртом.
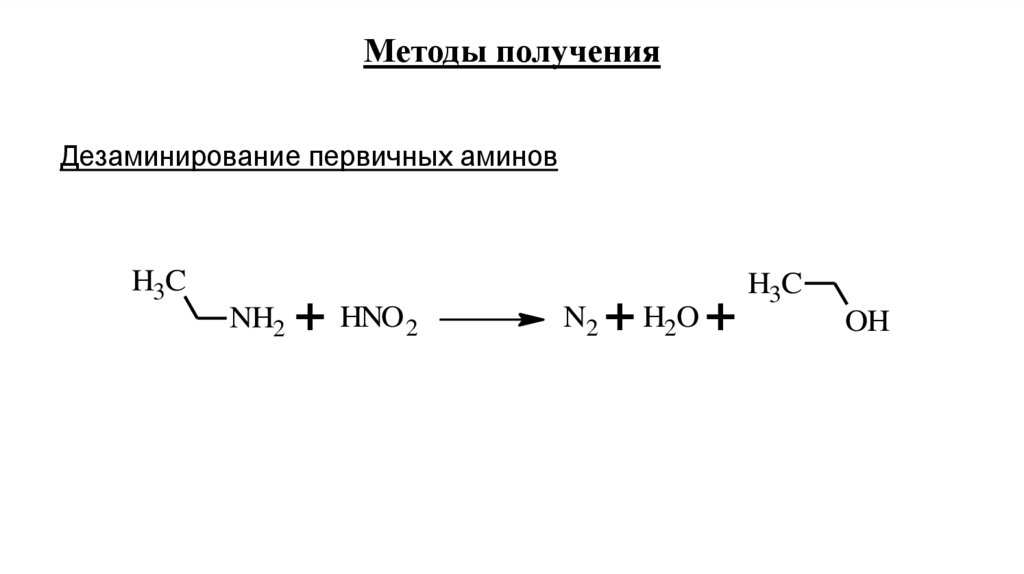
13.
Методы полученияДезаминирование первичных аминов
H3C
NH2
+ HNO 2
N2
+ H2O +
H3C
OH
14.
Промышленные методы получения спиртовОкисление алканов (синтез спиртов С10-С20). Спирты нормального
строения С10-С20 представляют интерес в качестве сырья для синтеза
поверхностно-активных веществ.
Окисление ведут кислородом воздуха в присутствии 4-5% борной
кислоты, которая связывает образующиеся спирты в эфиры, не
подвергающиеся дальнейшему окислению:
Полученные спирты, образующиеся без деструкции углеродной
цепи, являются преимущественно вторичными.
3
15.
Синтез спиртов по методу Фишера-Тропша.При высоком давлении СО и Н2 образует смесь кислородсодержащих
соединений (синтол) - спиртов, альдегидов, кетонов, карбоновых кислот и
сложных эфиров.
Этот метод нашел широкое применение для синтеза метанола:
CO + 2 H2
CH3OH
3
16.
Процесс оксосинтеза – получение из алкенов и синтезгаза (СО+Н2) альдегидов и их гидрирование до спиртов:CH2 CH2 + CO + 2 H2
CH3 CH2 CHO + H2
[Co(CO)4]2
Ni (Pd, Pt)
CH3 CH2 CHO
CH3 CH2 CH2OH
Первичные спирты С10-С18 линейного строения являются сырьем для
производства ПАВ типа алкилсульфатов, которые отличаются высоким
индексом биоразлагаемости, спирты С7-С9 служат полупродуктами для
получения сложноэфирных пластификаторов, особенно фталатов.
Ферментативный гидролиз углеводов под действием бактерий
Clostridium acetobutilicum. Этим методом получают н-бутанол в смеси с
ацетоном.
3
17.
Физические свойстваC1-C10 – жидкости, характеризуются специфическим запахом
С4-С10 – неприятный запах, сивушные масла
d<1
С1-С3 – растворимы в воде
Т.кип: первичные > вторичные > третичные
Многие физические свойства спиртов обусловлены способностью гидрокисльной
группы образовывать межмолекулярные водородные связи.
Ткип., 0С
этан
EtBr
EtOH
-88
38
78
18.
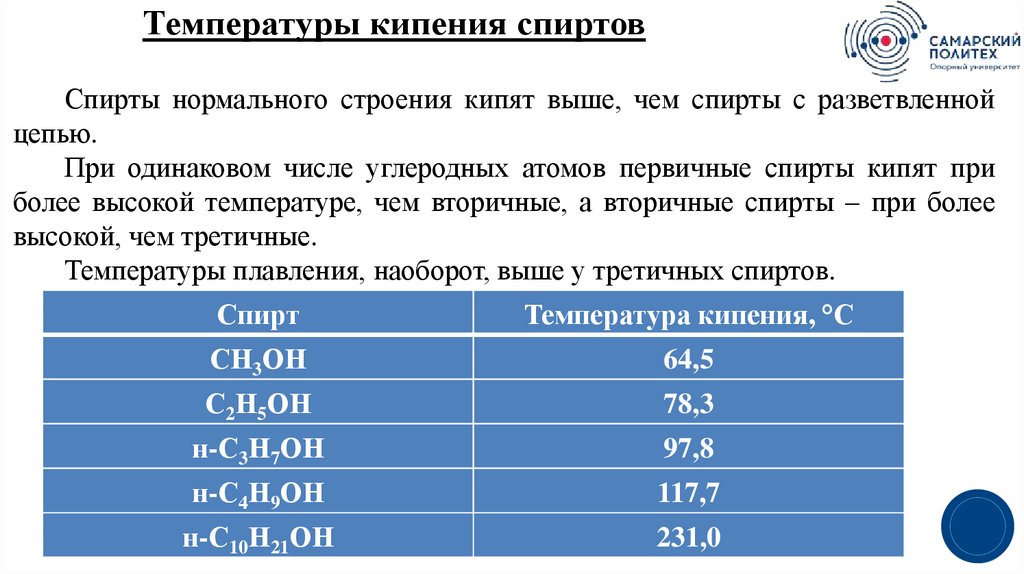
Температуры кипения спиртовСпирты нормального строения кипят выше, чем спирты с разветвленной
цепью.
При одинаковом числе углеродных атомов первичные спирты кипят при
более высокой температуре, чем вторичные, а вторичные спирты – при более
высокой, чем третичные.
Температуры плавления, наоборот, выше у третичных спиртов.
Спирт
Температура кипения, °С
СН3ОН
64,5
С2Н5ОН
78,3
н-С3Н7ОН
97,8
н-С4Н9ОН
117,7
н-С10Н21ОН
231,0
3
19.
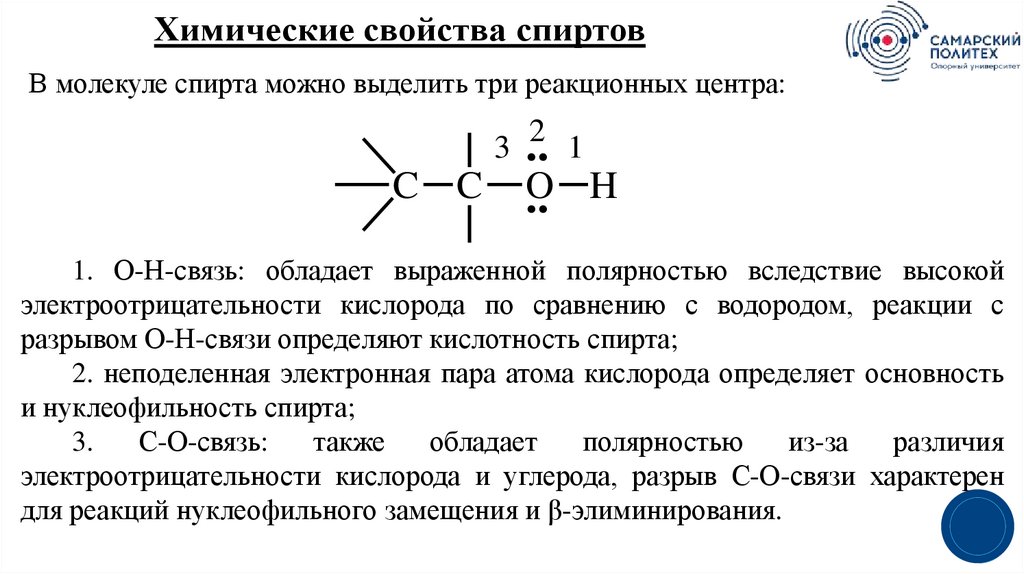
Химические свойства спиртовВ молекуле спирта можно выделить три реакционных центра:
..2 1
C C O
.. H
3
1. О-Н-связь: обладает выраженной полярностью вследствие высокой
электроотрицательности кислорода по сравнению с водородом, реакции с
разрывом О-Н-связи определяют кислотность спирта;
2. неподеленная электронная пара атома кислорода определяет основность
и нуклеофильность спирта;
3.
С-О-связь:
также
обладает
полярностью
из-за
различия
электроотрицательности кислорода и углерода, разрыв С-О-связи характерен
для реакций нуклеофильного замещения и β-элиминирования.
3
20.
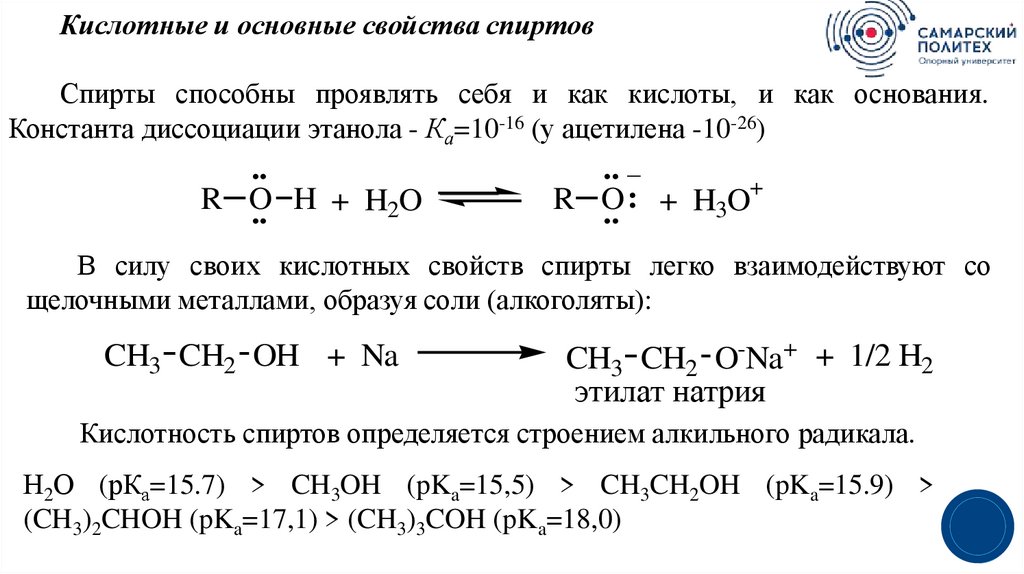
Кислотные и основные свойства спиртовСпирты способны проявлять себя и как кислоты, и как основания.
Константа диссоциации этанола - Ка=10-16 (у ацетилена -10-26)
..
R O
.. H + H2O
.. _
+
:
R O
+
H
O
3
..
В силу своих кислотных свойств спирты легко взаимодействуют со
щелочными металлами, образуя соли (алкоголяты):
CH3 CH2 OH + Na
CH3 CH2 O-Na+ + 1/2 H2
этилат натрия
Кислотность спиртов определяется строением алкильного радикала.
Н2О (рКа=15.7) > CH3OH (pKa=15,5) > CH3CH2OH (pKa=15.9) >
(CH3)2CHOH (pKa=17,1) > (CH3)3COH (pKa=18,0)
3
21.
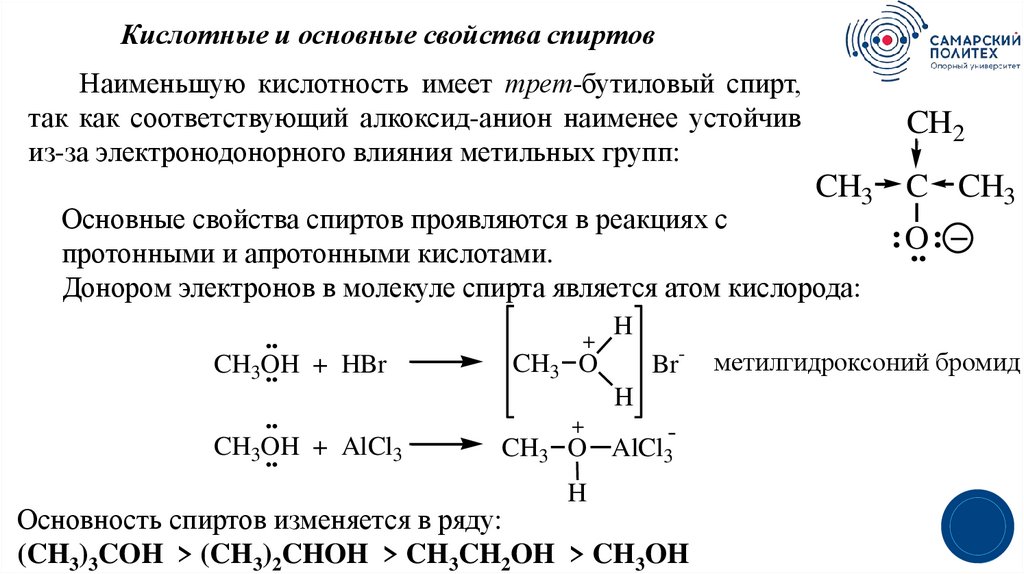
Кислотные и основные свойства спиртовНаименьшую кислотность имеет трет-бутиловый спирт,
так как соответствующий алкоксид-анион наименее устойчив
из-за электронодонорного влияния метильных групп:
CH2
CH3 C CH3
Основные свойства спиртов проявляются в реакциях с
протонными и апротонными кислотами.
Донором электронов в молекуле спирта является атом кислорода:
..
CH3OH
.. + HBr
..
CH3OH
.. + AlCl3
+
:O
.. :
H
Br-
CH3 O
метилгидроксоний бромид
H
+
CH3 O AlCl3
H
Основность спиртов изменяется в ряду:
(CH3)3COH > (CH3)2CHOH > CH3CH2OH > CH3OH
3
22.
Нуклеофильное замещение гидроксильной группы на галогенК реакциям нуклеофильного замещения относятся замещение
гидроксильной группы на галоген, аминогруппу и др.
Гидроксильная группа относится к числу трудно замещаемых.
Чтобы осуществить нуклеофильное замещение гидроксильной группы в
спиртах, последние необходимо модифицировать, чтобы гидроксид-анион не
выступал в роли уходящей группы.
Реакции проводят в присутствии сильных кислот, в этом случае
гидроксильная группа протонируется и затем отщепляется в виде молекулы
воды.
Замещение гидроксильной группы на галоген возможно под действием
галогенводородных кислот (HCl, HBr) и галогенидов фосфора и серы.
H
CH3CH2OH
H
CH3CH2 O H
3
23.
Наиболее важные химические превращения спиртов связаныс заменой гидроксильной группы на галоген под действием
галогенводородных кислот:
CH3CH2Br + H2O
CH3CH2OH + HBr
Реакция протекает по механизму нуклеофильного замещения. В случае
первичных спиртов реализуется SN2 механизм:
H
CH3CH2OH
CH3CH2 O H + Br
H
H
Br
C
OH2
H
CH3
H
CH3CH2 O H
=
CH3CH2Br + H2O
3
24.
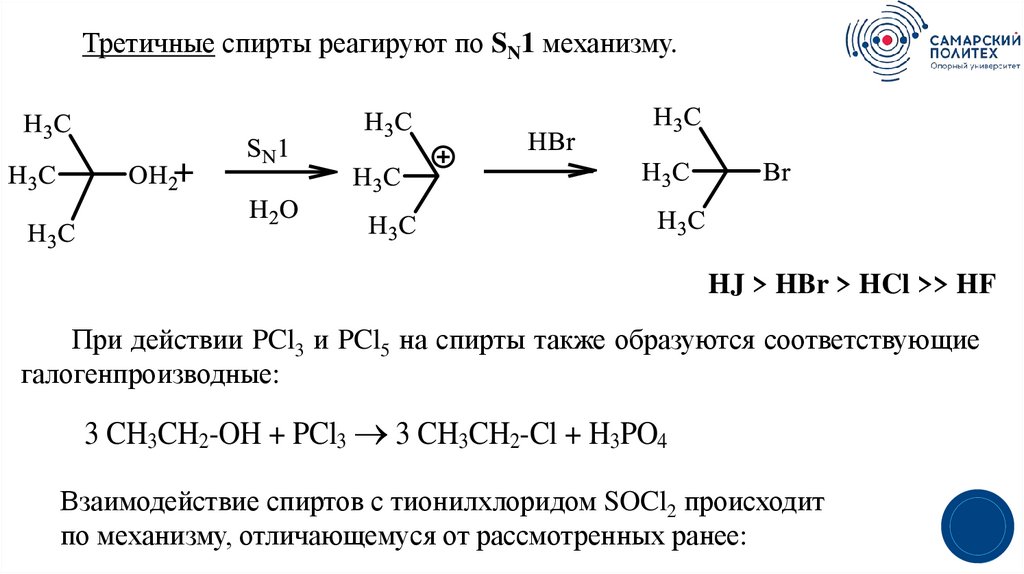
Третичные спирты реагируют по SN1 механизму.HJ > HBr > HCl >> HF
При действии PCl3 и PCl5 на спирты также образуются соответствующие
галогенпроизводные:
3 CH3CH2-OH + PCl3 3 CH3CH2-Cl + H3PO4
Взаимодействие спиртов с тионилхлоридом SOCl2 происходит
по механизму, отличающемуся от рассмотренных ранее:
3
25.
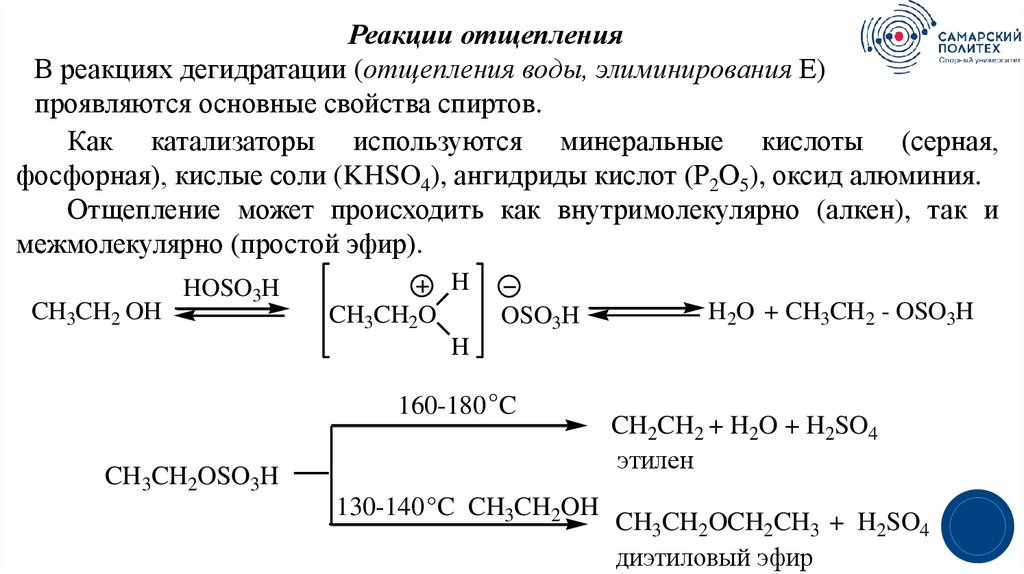
Реакции отщепленияВ реакциях дегидратации (отщепления воды, элиминирования Е)
проявляются основные свойства спиртов.
Как катализаторы используются минеральные кислоты (серная,
фосфорная), кислые соли (KHSO4), ангидриды кислот (Р2О5), оксид алюминия.
Отщепление может происходить как внутримолекулярно (алкен), так и
межмолекулярно (простой эфир).
CH3CH2 OH
HOSO3H
H
CH3CH2O
OSO3H
H2O + CH3CH2 - OSO3H
H
160-180 °C
CH3CH2OSO3H
130-140 °C CH3CH2OH
CH2CH2 + H2O + H2SO4
этилен
CH3CH2OCH2CH3 + H2SO4
диэтиловый эфир
3
26.
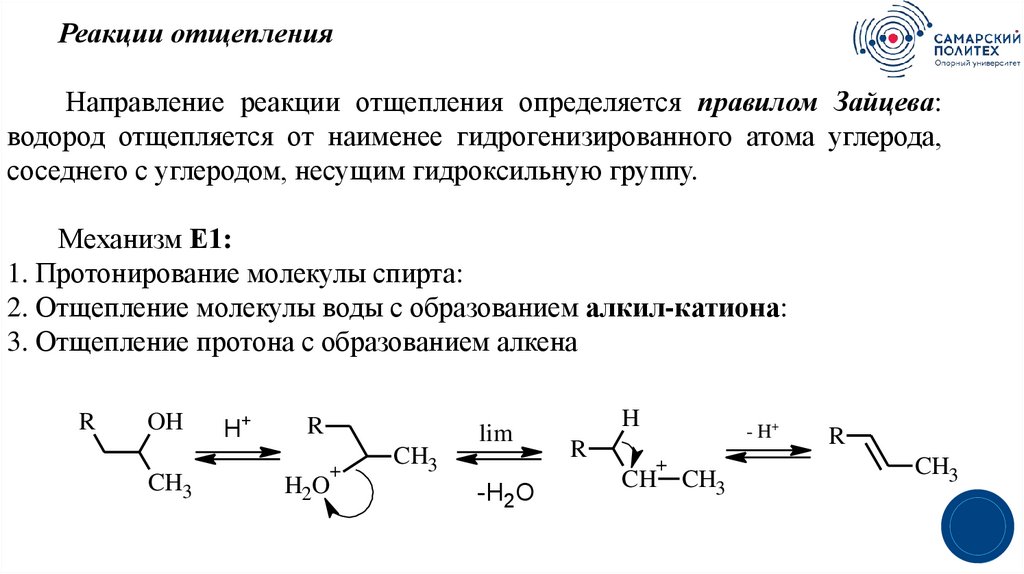
Реакции отщепленияНаправление реакции отщепления определяется правилом Зайцева:
водород отщепляется от наименее гидрогенизированного атома углерода,
соседнего с углеродом, несущим гидроксильную группу.
Механизм Е1:
1. Протонирование молекулы спирта:
2. Отщепление молекулы воды с образованием алкил-катиона:
3. Отщепление протона с образованием алкена
R
OH
CH3
H+
R
lim
+
H2O
CH3
-Н2О
H
R
- H+
+
CH
CH3
R
CH3
3
27.
Механизм Е1:Любое влияние, делокализующее положительный заряд карбкатиона,
ведет к его стабилизации. Это связано с индукционной стабилизацией и
стабилизацией за счет сверхсопряжения С-Н связей с вакантной орбиталью
атома углерода, несущего положительный заряд:
H
+
CH3
C+ <
H
CH3
C
H
+
CH3 < CH3
C
CH3
CH3
Образующиеся катионы способны к перегруппировкам. Так,
например, 3-метил-2-бутанол дает вторичный карбениевый катион,
склонный к перегруппировке в более стабильный – третичный.
3
28.
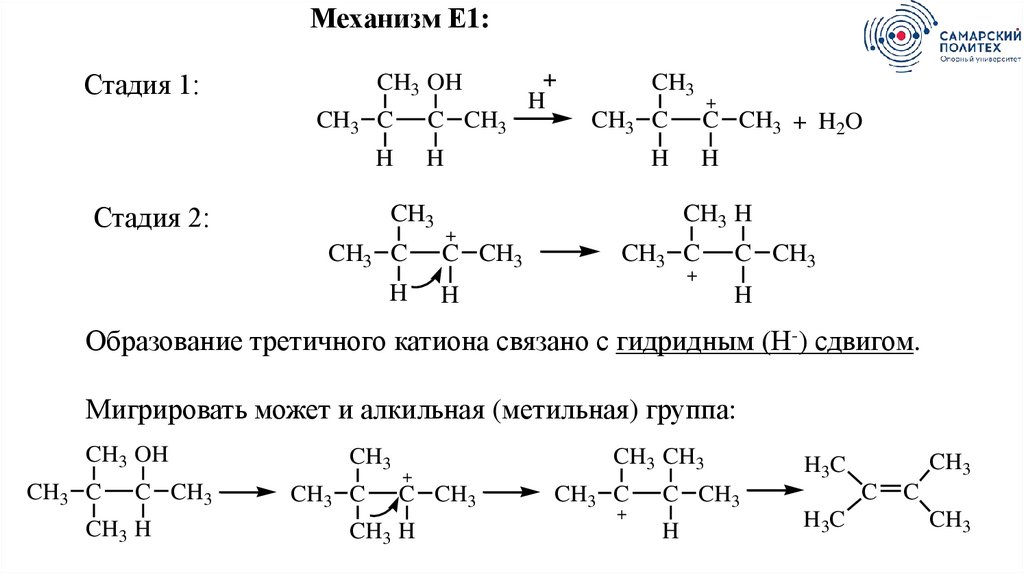
Механизм Е1:Стадия 1:
CH3 OH
CH3 C
C CH3
H
Стадия 2:
H
CH3
CH3 C
H
CH3
CH3 C
H
H
+
C CH3
+
C CH3 + H2O
H
CH3 H
CH3 C
+
H
C CH3
H
Образование третичного катиона связано с гидридным (Н-) сдвигом.
Мигрировать может и алкильная (метильная) группа:
CH3 OH
CH3 C
C CH3
CH3 H
CH3
CH3 C
+
C CH3
CH3 H
CH3 CH3
CH3 C
+
C
C CH3
H
CH3
H3C
H3C
C
CH3
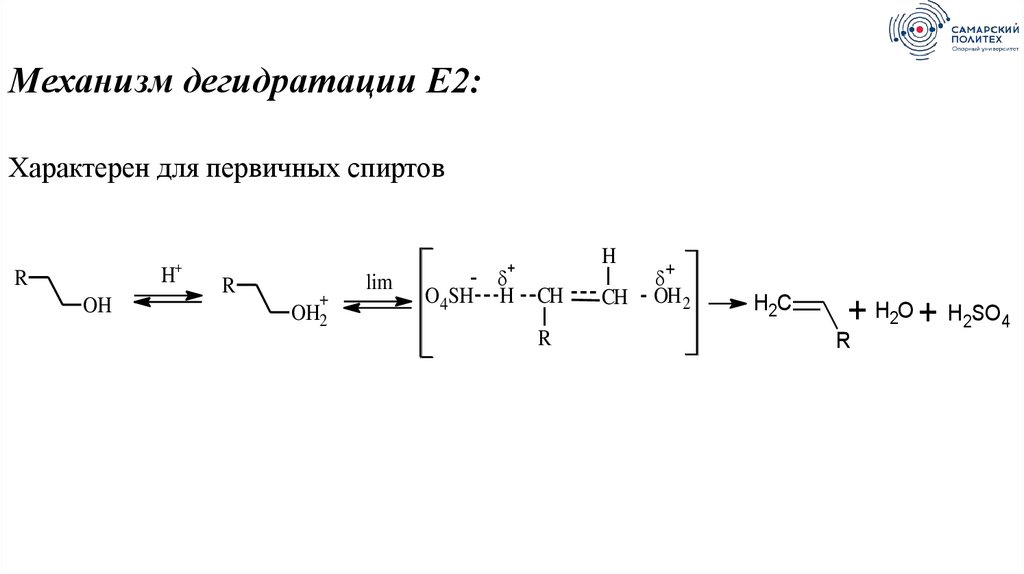
29.
Механизм дегидратации Е2:Характерен для первичных спиртов
H+
R
OH
R
+
OH2
lim
H
+
-
O4SH H
CH
R
CH
+
OH 2
H2C
+ H2O + H2SO4
R
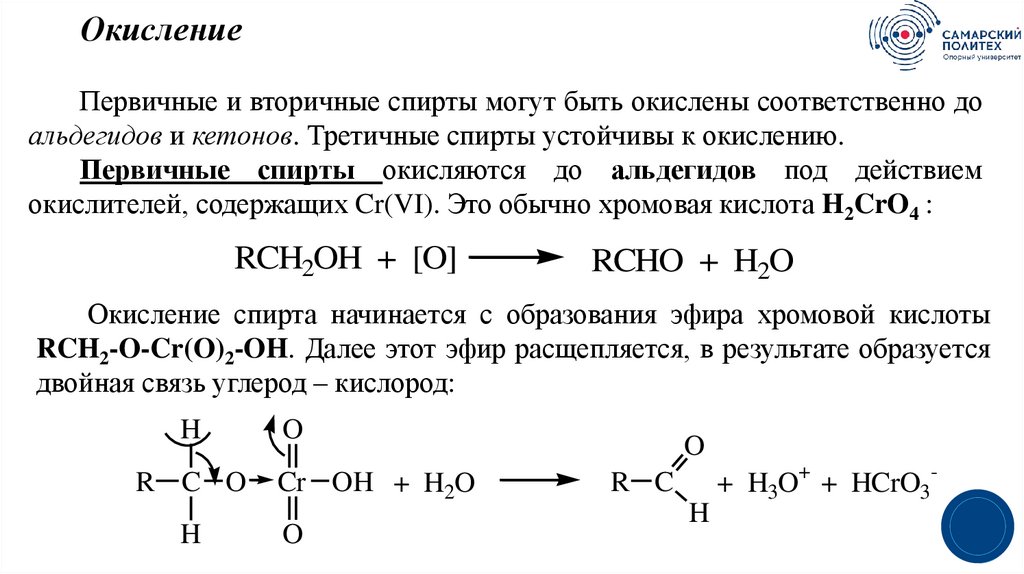
30.
ОкислениеПервичные и вторичные спирты могут быть окислены соответственно до
альдегидов и кетонов. Третичные спирты устойчивы к окислению.
Первичные спирты окисляются до альдегидов под действием
окислителей, содержащих Cr(VI). Это обычно хромовая кислота H2CrO4 :
RCH2OH + [O]
RCHO + H2O
Окисление спирта начинается с образования эфира хромовой кислоты
RCH2-O-Cr(O)2-OH. Далее этот эфир расщепляется, в результате образуется
двойная связь углерод – кислород:
H
R C O
H
O
Cr OH + H2O
O
O
R C
H
+ H3O+ + HCrO3-
3
31.
ОкислениеВторичные спирты окисляются до кетонов под действием:
K2Cr2O7 в разбавленной серной кислоте, CrO3 в уксусной кислоте
и KMnO4 в кислой среде:
R
R
3 CH OH + K2Cr2O7 + 4 H2SO4
R'
R
3 CH OH + 2 CrO3 + 6 CH3COOH
R'
C O + K2SO4 + Cr2(SO4)3 + 7 H2O
R'
R
C O + 2 Cr(CH3COO)2 + 6 H2O
R'
Механизм окисления вторичных спиртов подобен окислению
первичных спиртов.
3
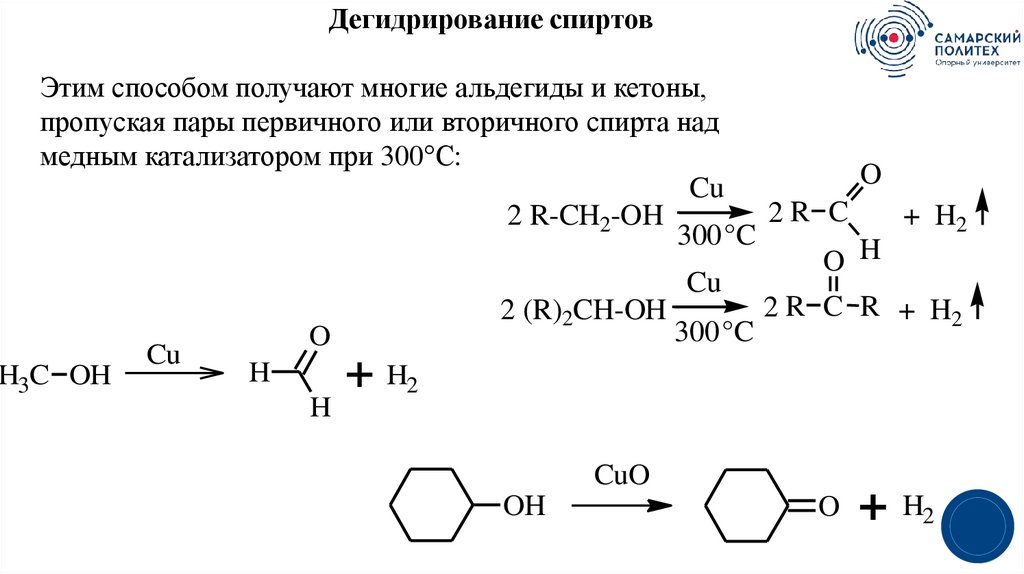
32.
Дегидрирование спиртовЭтим способом получают многие альдегиды и кетоны,
пропуская пары первичного или вторичного спирта над
медным катализатором при 300°С:
O
Cu
2R C
2 R-CH2-OH
+ H2
300 °C
O H
Cu
2 R C R + H2
2 (R)2CH-OH
300 °C
O
Cu
H
H3C OH
H2
H
+
CuO
OH
O
+ H2
3
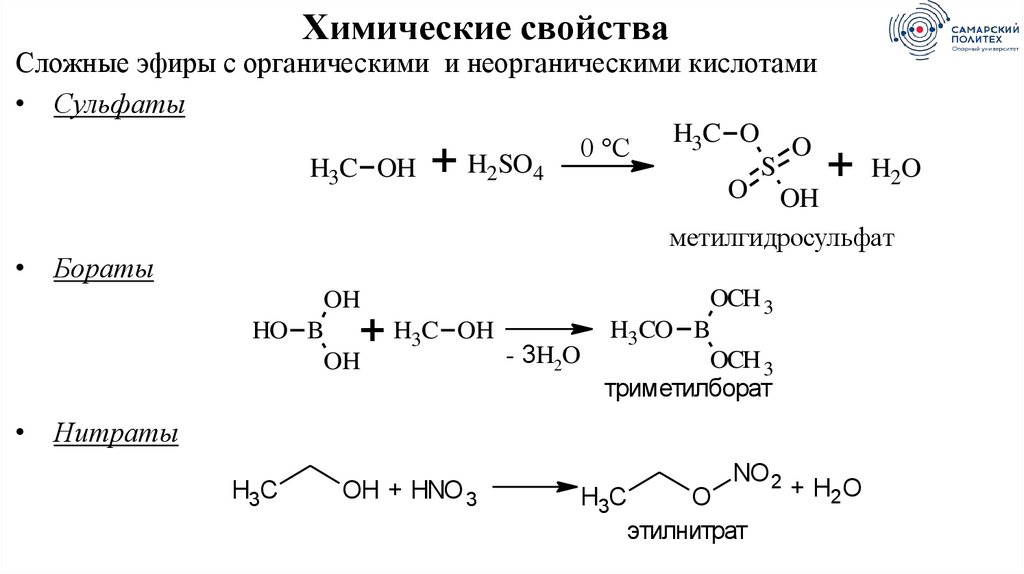
33.
Химические свойстваСложные эфиры с органическими и неорганическими кислотами
• Сульфаты
H3C O
O
0 °C
H
SO
S
H3C OH
2
4
O OH
+
+
H2O
метилгидросульфат
• Бораты
OH
HO B
OH
+
OCH 3
H3 CO B
H3C OH
- 3H2O
OCH 3
триметилборат
• Нитраты
H3C
OH + HNO 3
NO 2
H3C
O
этилнитрат
+ H2O
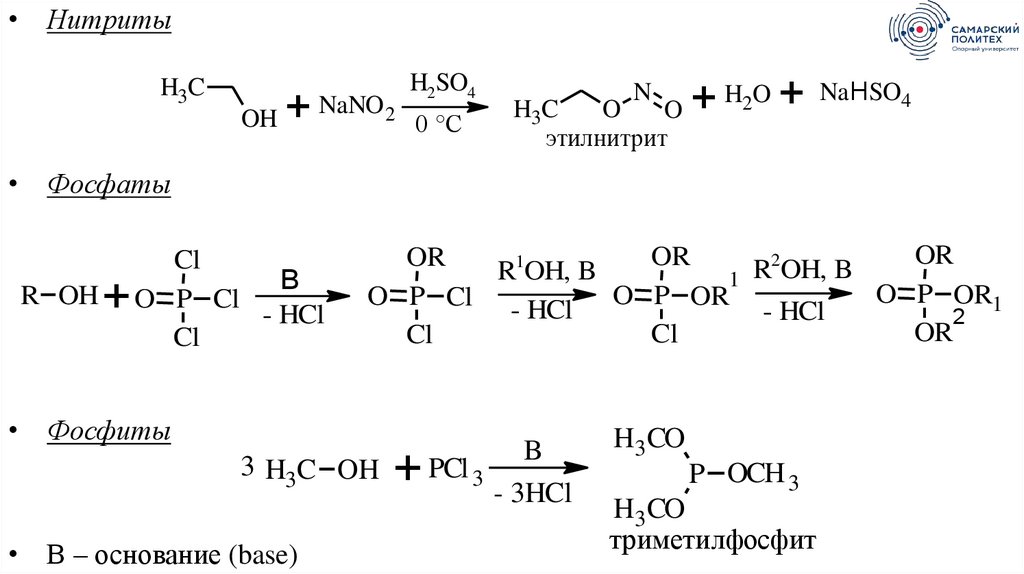
34.
• НитритыH3C
OH
+
NaNO 2
H2SO4
0 °C
N
H3C
O
O
этилнитрит
+ H2O +
NaНSO4
• Фосфаты
R OH
+
Cl
B
O P Cl
- HCl
Cl
OR
OR
OR
2
R
OH,
B
R1OH, B
1
O P OR1
O P OR
O P Cl
- HCl
- HCl
2
OR
Cl
Cl
• Фосфиты
3 H3C OH
• В – основание (base)
+
B
PCl 3
- 3HCl
H3 CO
P OCH 3
H3 CO
триметилфосфит
35.
Сложные эфиры с органическими кислотамиO
H3C
R
R
OH
OH H2SO4
+
Механизм:
O
O
+ H2O
CH3
36.
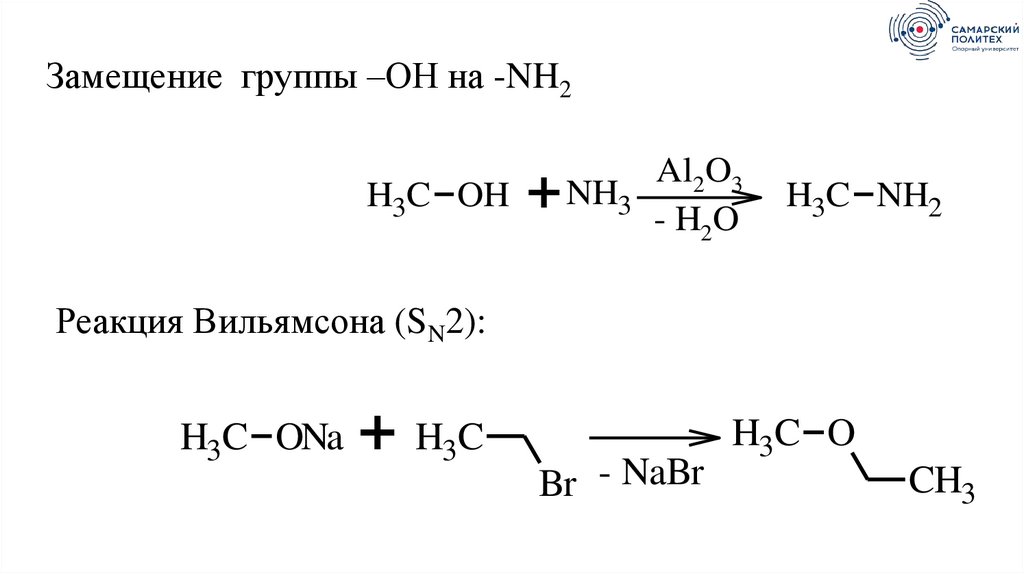
Замещение группы –ОН на -NH2H3C OH
+
Al2O3
NH3
- H2O
H3C NH2
Реакция Вильямсона (SN2):
H3C ONa
+ H3C
Br - NaBr
H3C O
CH3
37.
Отдельные представителиМетанол (метиловый, древесный спирт) – бесцветная
жидкость со слабым спиртовым запахом.
Используют в производстве формальдегида, муравьиной
кислоты, метил- и диметиланилина, метиламинов и
красителей,
фармацевтических
препаратов,
душистых
веществ.
Метанол - хороший растворитель, широко применяется в
лакокрасочной
промышленности,
в
нефтяной
промышленности при очистке бензинов от меркаптанов, при
выделении толуола азеотропной ректификацией.
3
38.
Этанол (этиловый, винный спирт) – бесцветная жидкостьс характерным спиртовым запахом.
Этиловый спирт используется в производстве дивинила, диэтилового эфира,
хлороформа, хлораля, этилена высокой чистоты, этилацетата и других сложных
эфиров, применяемых в качестве растворителей лаков и как душистые вещества
(фруктовые эссенции).
В качестве растворителя этиловый спирт широко применяется в
производстве фармацевтических, красящих и других веществ.
Этанол – хорошее антисептическое средство.
Пропиловый и изопропиловый спирты.
Эти спирты, а также их сложные эфиры применяются как растворители. В
ряде случаев они заменяют этиловый спирт.
Изопропиловый спирт используют для получения ацетона.
3
39.
Бутиловый спирт и его сложные эфиры применяют какрастворители лаков и смол
Изобутиловый спирт применяется для получения изобутилена,
изомасляного альдегида, изомасляной кислоты, а также в качестве растворителя.
Первичные амиловые и изоамиловые спирты составляют основную часть
сивушного масла (побочные продукты при получении этилового спирта из
картофеля или злаков).
Амиловые спирты и их эфиры – хорошие растворители.
Изоамилацетат (грушевая эссенция) применяется при изготовлении
прохладительных напитков и некоторых кондитерских изделий.
3
40.
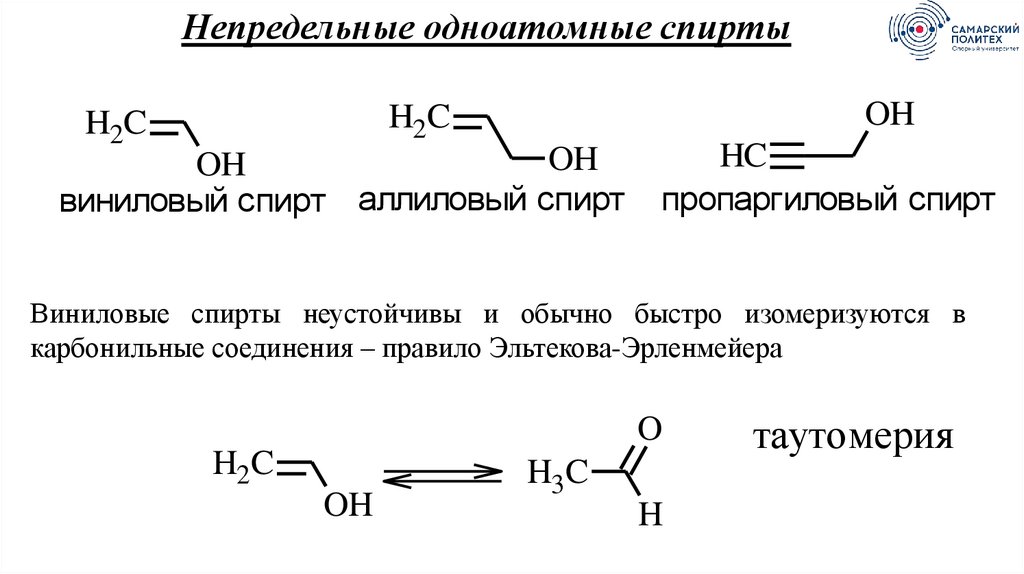
Непредельные одноатомные спиртыOH
H2C
H2C
OH
OH
виниловый спирт аллиловый спирт
HC
пропаргиловый спирт
Виниловые спирты неустойчивы и обычно быстро изомеризуются в
карбонильные соединения – правило Эльтекова-Эрленмейера
O
H2C
OH
H3C
H
таутомерия
41.
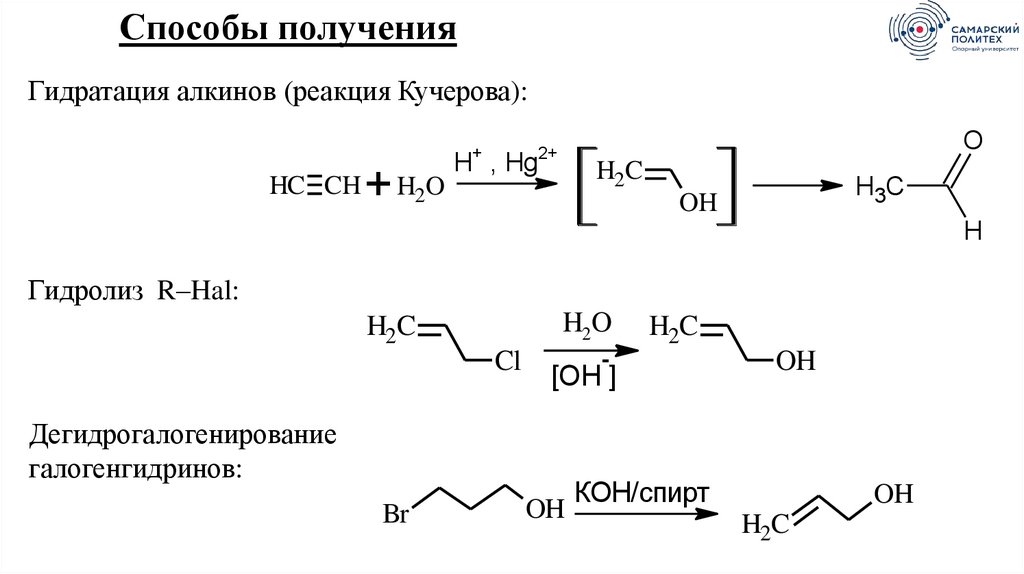
Способы полученияГидратация алкинов (реакция Кучерова):
+
HC CH
+
H2O
O
2+
H , Hg
H2C
H3C
OH
H
Гидролиз R–Hal:
H2O
H2C
Cl
-
[OH ]
Дегидрогалогенирование
галогенгидринов:
Br
H2C
OH
OH
КОН/спирт
OH
H2C
42.
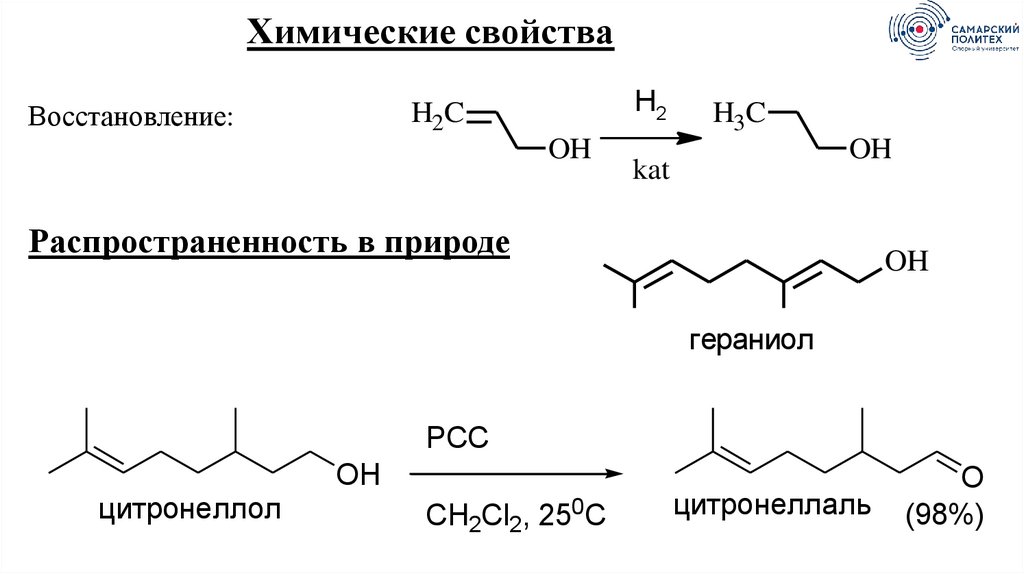
Химические свойстваВосстановление:
H2
H2C
OH
H3C
OH
kat
Распространенность в природе
OH
гераниол
PCC
OH
цитронеллол
CH2Cl2, 250C
цитронеллаль
O
(98%)
43.
Двухатомные спиртыСпирты, содержащие несколько гидроксильных групп, называются
многоатомными спиртами. Двухатомные спирты называются гликолями,
общая формула - СnH2n(OH)2.
OH
Две гидроксильные группы не могут находиться
у одного атома углерода, такие соединения легко
теряют воду, превращаясь в альдегиды или кетоны.
H C OH
H
- H2O
O
H C
H
OH
Cl3 C
OH
Устойчивость гем-диолов повышается при наличии
электроноакцепторных заместителей. Примером
гем-диола является хлоральгидрат:
Гликоли, содержащие гидроксильные группы у разных
углеродных атомов, устойчивы.
хлоральгидрат
OH
F3 C
OH
CF 3
гексафторацетона гидрат
44.
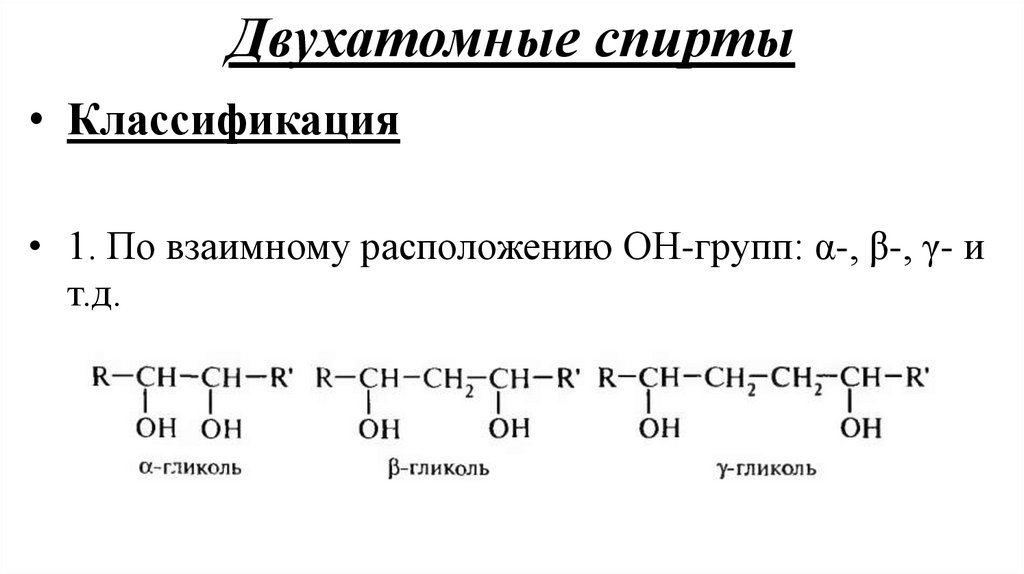
Двухатомные спирты• Классификация
• 1. По взаимному расположению ОН-групп: α-, β-, γ- и
т.д.
45.
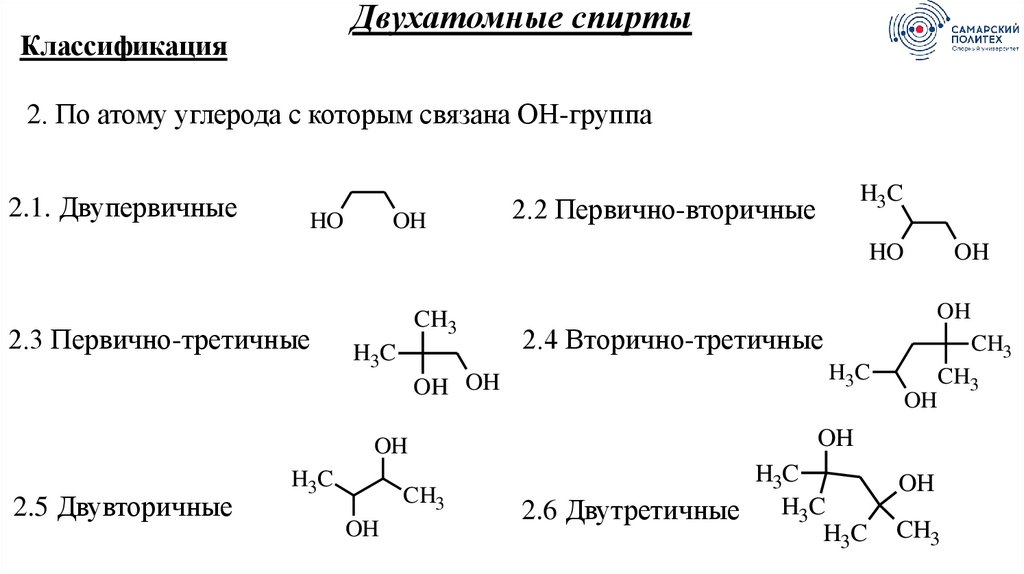
Двухатомные спиртыКлассификация
2. По атому углерода с которым связана ОН-группа
2.1. Двупервичные
HO
OH
H3C
2.2 Первично-вторичные
HO
2.3 Первично-третичные
CH3
H3C
OH OH
OH
2.5 Двувторичные
H3C
CH3
OH
OH
OH
2.4 Вторично-третичные
CH3
H3C
OH
CH3
OH
H3C
2.6 Двутретичные H3C
H3C
OH
CH3
46.
Изомерия и номенклатура гликолейИзомерия гликолей связана с изомерией углеродного скелета и взаимным
расположением гидроксильных групп (α-, β-, γ-гликоли и т.д.)
CH2 CH2 CH2
CH2 CH CH3
OH
OH
OH
OH
CH3 CH CH CH3
OH OH
Тривиальные названия двухатомных спиртов производятся от названия двухатомного
радикала с прибавлением слова гликоль, например этиленгликоль, пропиленгликоль.
По систематической номенклатуре пользуются окончанием -ол с указанием числа
гидроксильных групп – диол и цифр, указывающих положения гидроксильных групп:
CH2 CH CH2 CH3
OH OH
CH2 CH2 CH2 CH2
OH
OH
OH OH
бутандиол-1,2
H3C
CH3
-первичновторичный бутиленгликоль
CH3 CH3
2,3-диметилбутандиол-2,3
бутандиол-1,4
(пинакон)
-двупервичный бутиленгликоль
47.
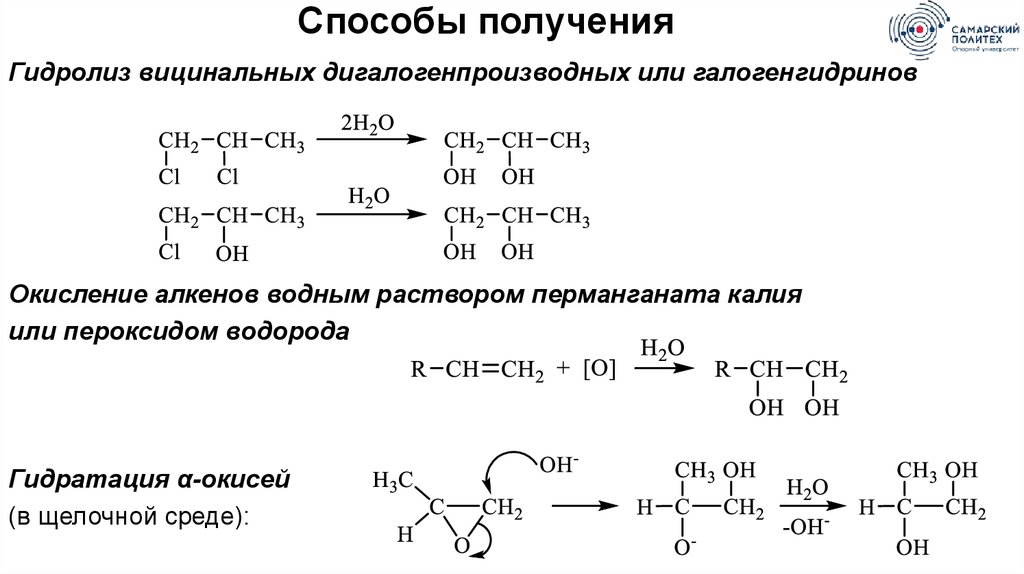
Способы полученияГидролиз вицинальных дигалогенпроизводных или галогенгидринов
Окисление алкенов водным раствором перманганата калия
или пероксидом водорода
Гидратация α-окисей
(в щелочной среде):
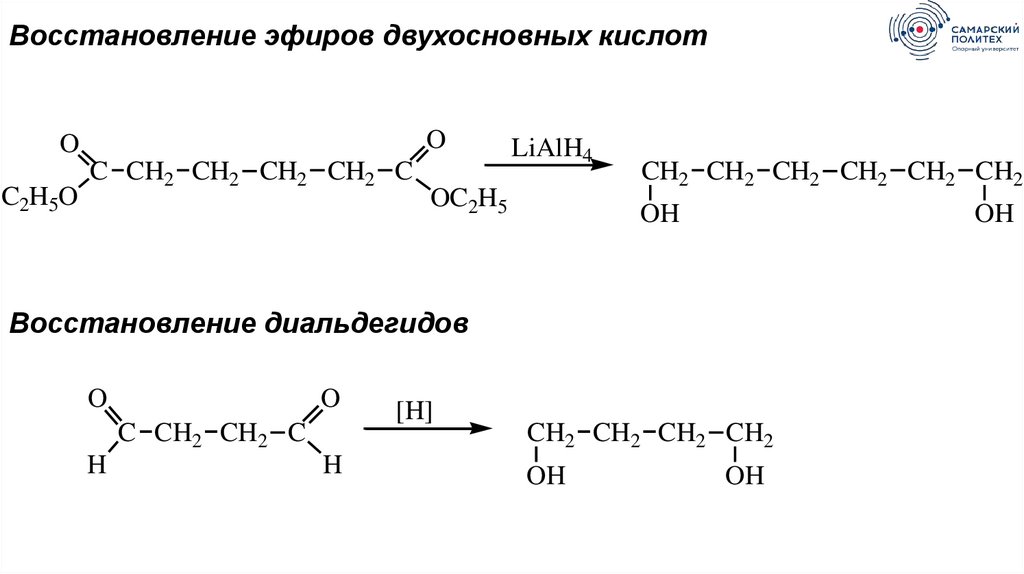
48.
Восстановление эфиров двухосновных кислотO
O
C2H5O
C CH2 CH2 CH2 CH2 C
LiAlH4
OC2H5
CH2 CH2 CH2 CH2 CH2 CH2
OH
OH
Восстановление диальдегидов
O
O
C CH2 CH2 C
H
H
[H]
CH2 CH2 CH2 CH2
OH
OH
49.
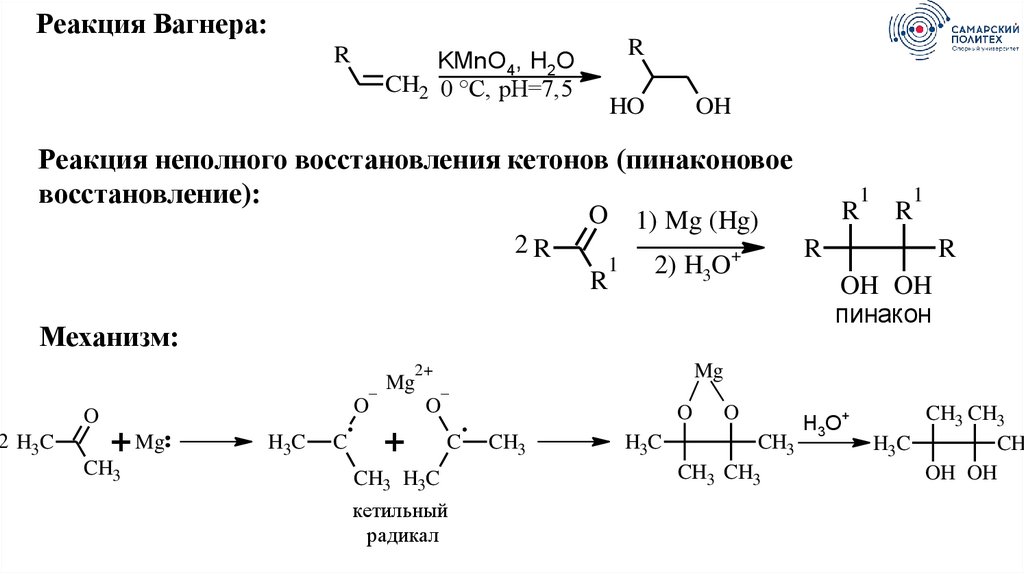
Реакция Вагнера:R
R
KMnO4, H2O
CH2 0 °C, pH=7,5
HO
OH
Реакция неполного восстановления кетонов (пинаконовое
восстановление):
O
2R
R
1
1) Mg (Hg)
2 H3C
–
O
+ Mg
CH3
H3C
C
1
R
OH OH
пинакон
–
O
+
R
Mg
2+
O
1
R
2) H3O+
Механизм:
Mg
R
O
C
CH3 H3C
кетильный
радикал
CH3
H3C
O
CH3
CH3 CH3
Н3О+
CH3 CH3
H3C
CH3
OH OH
50.
Физические свойстваБлагодаря наличию межмолекулярных и внутримолекулярных
водородных связей и большому числу полярных ОН-групп гликоли имеют
более высокие температуры кипения, чем одноатомные спирты, хорошо
растворимы в воде.
Низкомолекулярные диолы – густые жидкости, высокомолекулярные –
твердые вещества.
Кислотность выше, чем у одноатомных спиртов.
СН3СН2ОН
СН2(ОН)-СН2ОН
т. кип. 78.3°С
т. кип. 197.5°С
51.
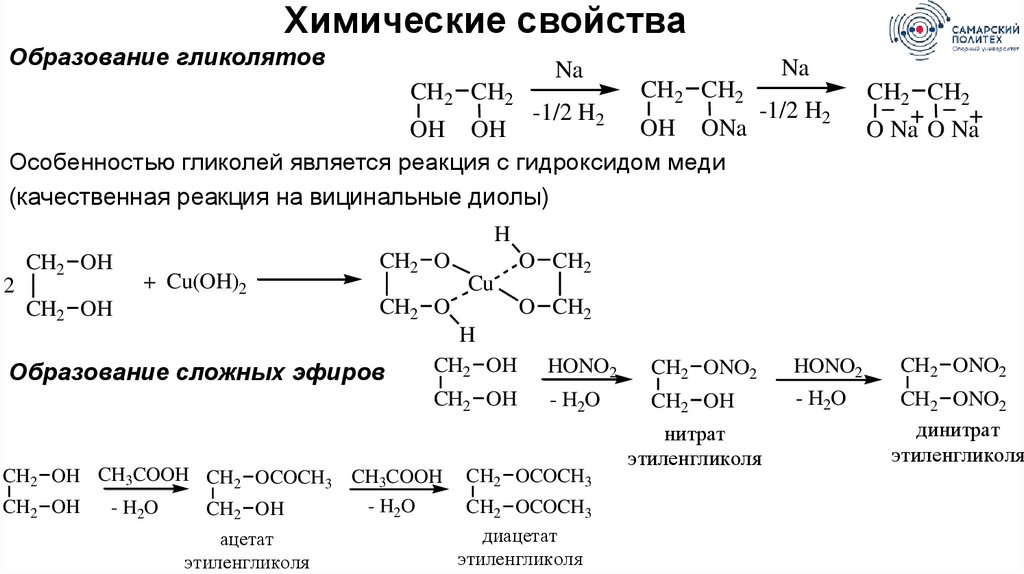
Химические свойстваОбразование гликолятов
CH2 CH2
Na
CH2 CH2
-1/2 H2
OH ONa
OH OH
Особенностью гликолей является реакция с гидроксидом меди
(качественная реакция на вицинальные диолы)
Na
-1/2 H2
CH2 CH2
O Na O Na
H
2
CH2 OH
+ Cu(OH)2
CH2 O
Cu
CH2 O
CH2 OH
Образование сложных эфиров
O CH2
H
CH2 OH
HONO2
CH2 ONO2
HONO2
CH2 OH
- H2O
CH2 OH
- H2O
CH2 OH CH3COOH CH2 OCOCH3 CH3COOH
- H2O
CH2 OH
- H2O
CH2 OH
ацетат
этиленгликоля
O CH2
CH2 OCOCH3
CH2 OCOCH3
диацетат
этиленгликоля
нитрат
этиленгликоля
CH2 ONO2
CH2 ONO2
динитрат
этиленгликоля
52.
Образование простых эфировДегидратация. Характерны
дегидратации
внутримолекулярные
и
межмолекулярные
CH3 CH3
HBr(48%),t° H3C
H3C
CH3
или
OH OH
Al2O3, 450 °C H2C
OH
+
OH
H2SO4(к)
+
+
OH
HO
OH2 HO
..
-H2O
реакции
O
H
- H+
O
тетрагидрофуран
(ТГФ)
CH3
CH2
HO
H2SO4
O
HO
- 2H2O
O
1,4-диоксан
53.
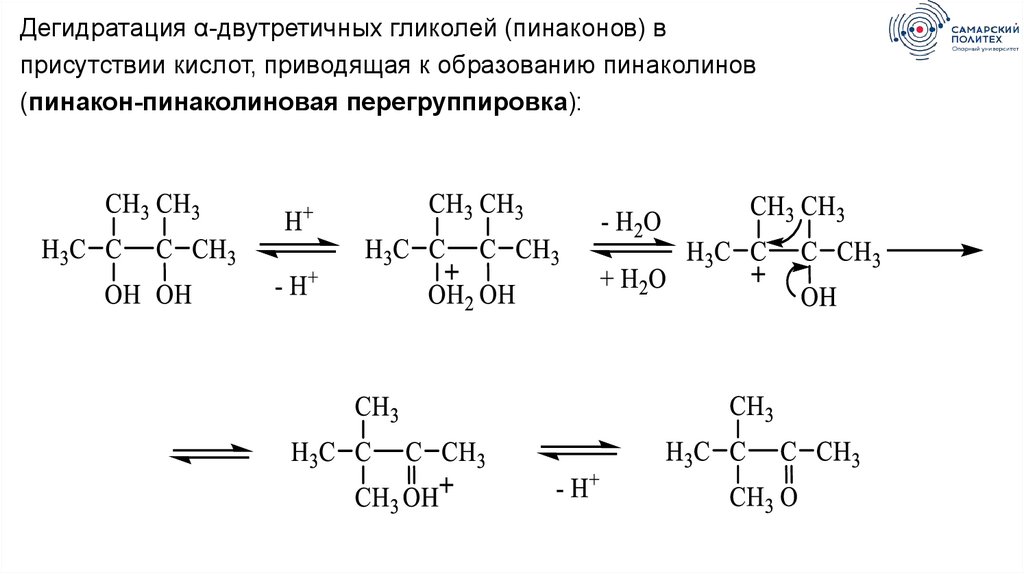
Дегидратация α-двутретичных гликолей (пинаконов) вприсутствии кислот, приводящая к образованию пинаколинов
(пинакон-пинаколиновая перегруппировка):
54.
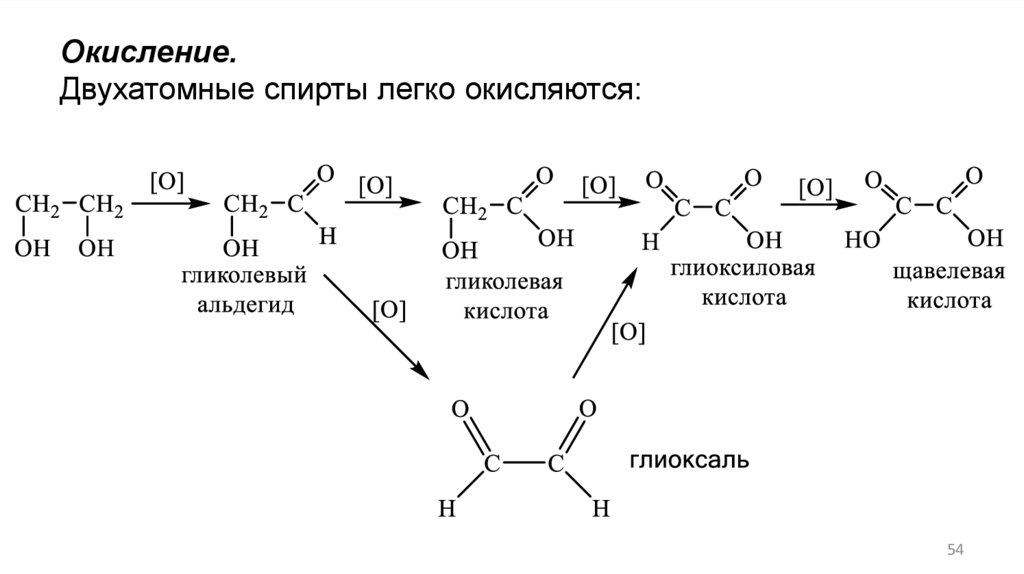
Окисление.Двухатомные спирты легко окисляются:
54
55.
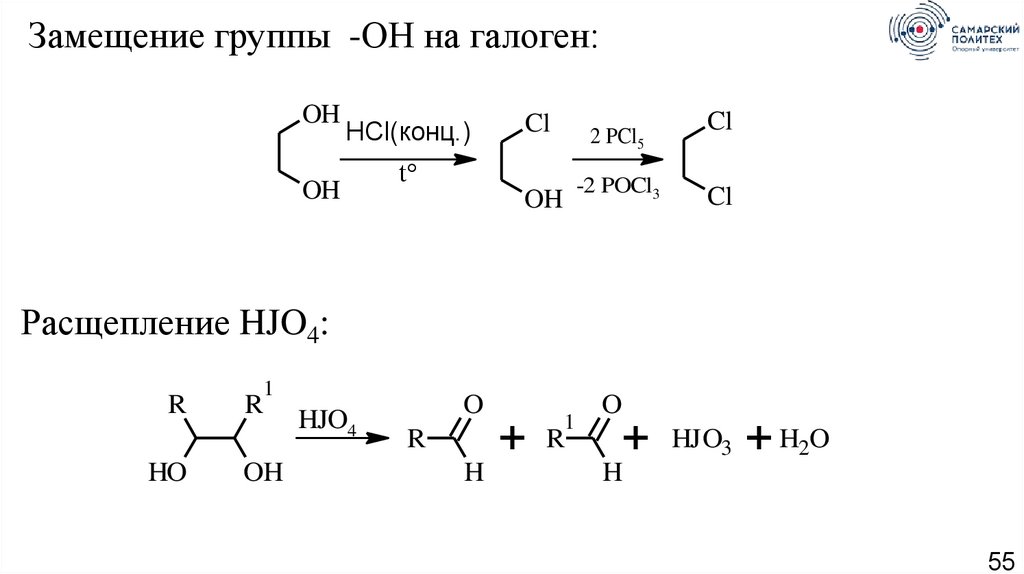
Замещение группы -ОН на галоген:OH
HCl(конц.)
OH
Cl
2 PCl5
t°
-2 POCl3
OH
Cl
Cl
Расщепление HJO4:
R
HO
1
R
OH
HJO4
O
R
H
+
1
R
O
+
H
HJO3
+ H2O
55
56.
Отдельные представителиЭтиленгликоль и пропиленгликоль используют в производстве
антифризов. Этиленгликоль применяется в синтезе полимеров –
полиэтилентерефталата (лавсан), ненасыщенных полиэфиров, полиуретанов,
алкидных полимеров. Из него получают этиленгликольдинитрат (для
взрывчатых веществ и порохов), а также моно- и диацетаты этиленгликоля,
являющимися хорошими растворителями.
Простые моноэфиры этиленгликоля формулы ROCH2-CH2OH называются
целлозольвы. «Целлозольв» - 2-этоксиэтанол. Это хорошие растворители
для эфиров целлюлозы.
Бутилцеллозольв
–
хороший
растворитель;
используется
в
гидравлических жидкостях и добавляется к авиационному топливу в качестве
антифриза.
Карбитолы -моноалкиловые эфиры диэтиленгликоля, применяются в
качестве растворителей и при изготовлении лаков
Карбоваксы (полимеры) получают реакцией этиленоксида с виц-диолами.
Карбоваксы находят применение в качестве смазочных масел, компонентов
мазей, в газожидкостной хроматографии.
57.
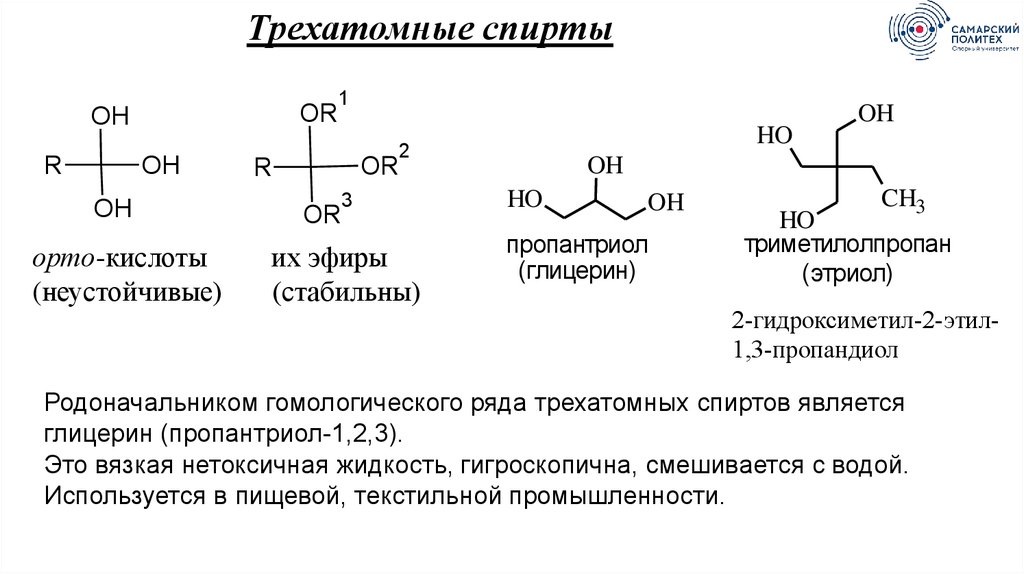
Трехатомные спиртыOR
OH
R
OH
OH
орто-кислоты
(неустойчивые)
1
OR
R
OR
HO
2
3
их эфиры
(стабильны)
OH
OH
HO
OH
пропантриол
(глицерин)
CH3
HO
триметилолпропан
(этриол)
2-гидроксиметил-2-этил1,3-пропандиол
Родоначальником гомологического ряда трехатомных спиртов является
глицерин (пропантриол-1,2,3).
Это вязкая нетоксичная жидкость, гигроскопична, смешивается с водой.
Используется в пищевой, текстильной промышленности.
58.
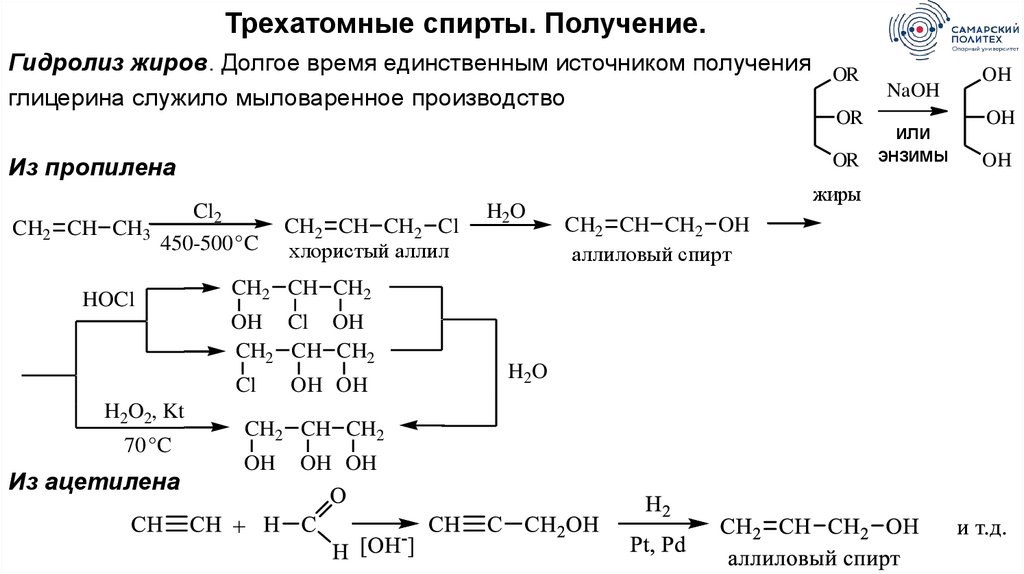
Трехатомные спирты. Получение.Гидролиз жиров. Долгое время единственным источником получения OR
глицерина служило мыловаренное производство
OR
или
OR энзимы
Из пропилена
CH2 CH CH3
Cl2
450-500 °C
HOCl
CH2 CH CH2 Cl
хлористый аллил
Cl
70 °C
Из ацетилена
H2O
CH2 CH CH2
OH Cl OH
CH2 CH CH2
H2O2, Kt
NaOH
OH OH
CH2 CH CH2
OH
OH OH
H2O
жиры
CH2 CH CH2 OH
аллиловый спирт
OH
OH
OH
59.
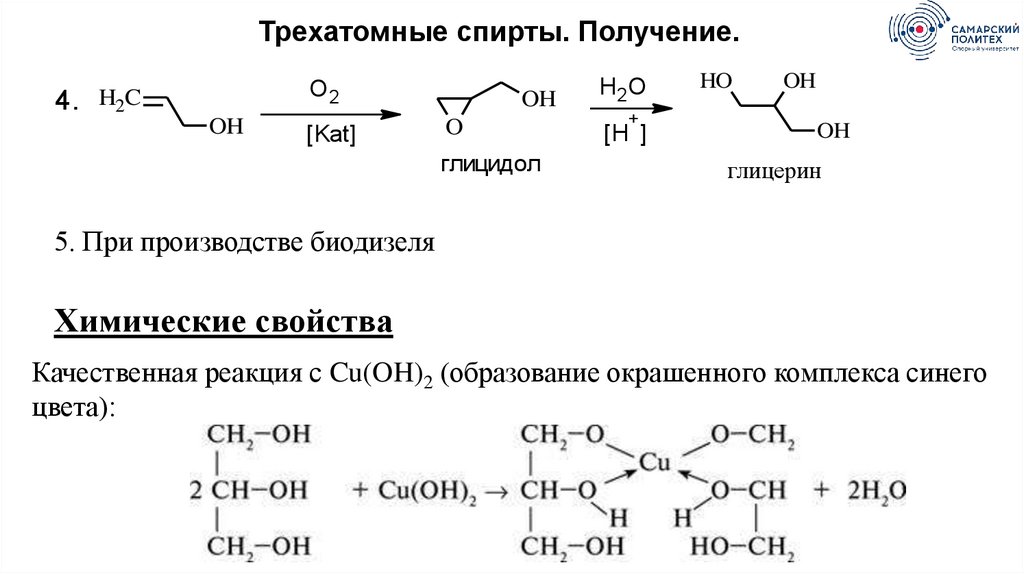
Трехатомные спирты. Получение.О2
4. H2C
OH
[Kat]
OH
O
глицидол
H2O
+
[H ]
HO
OH
OH
глицерин
5. При производстве биодизеля
Химические свойства
Качественная реакция с Cu(OH)2 (образование окрашенного комплекса синего
цвета):
60.
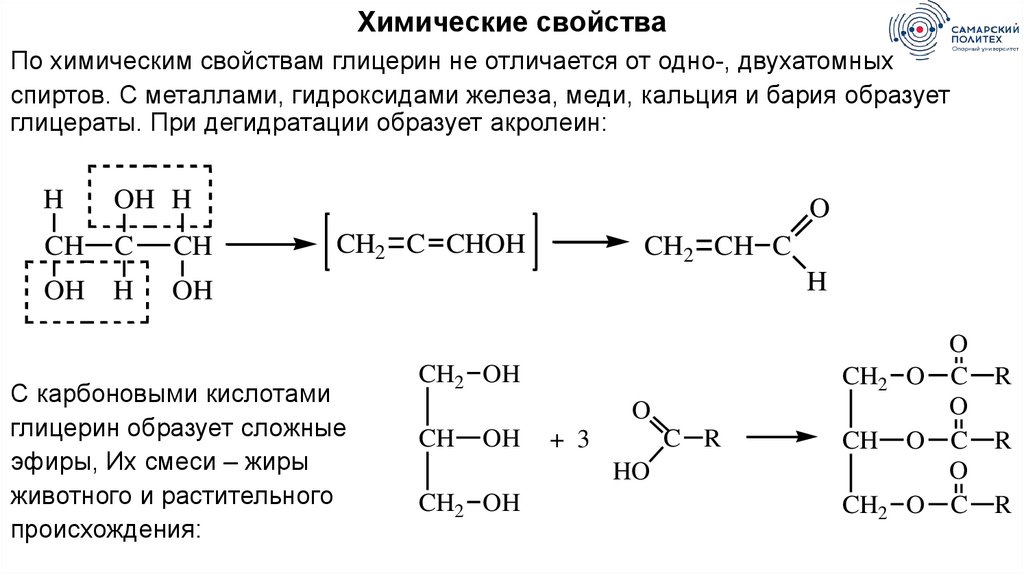
Химические свойстваПо химическим свойствам глицерин не отличается от одно-, двухатомных
спиртов. С металлами, гидроксидами железа, меди, кальция и бария образует
глицераты. При дегидратации образует акролеин:
H
OH H
CH
C
CH
OH
H
OH
O
CH2 C CHOH
С карбоновыми кислотами
глицерин образует сложные
эфиры, Их смеси – жиры
животного и растительного
происхождения:
CH2 CH C
H
CH2 OH
CH2
O
CH
OH
C R
+ 3
CH
HO
CH2 OH
CH2
O
O C
O
O C
O
O C
R
R
R
61.
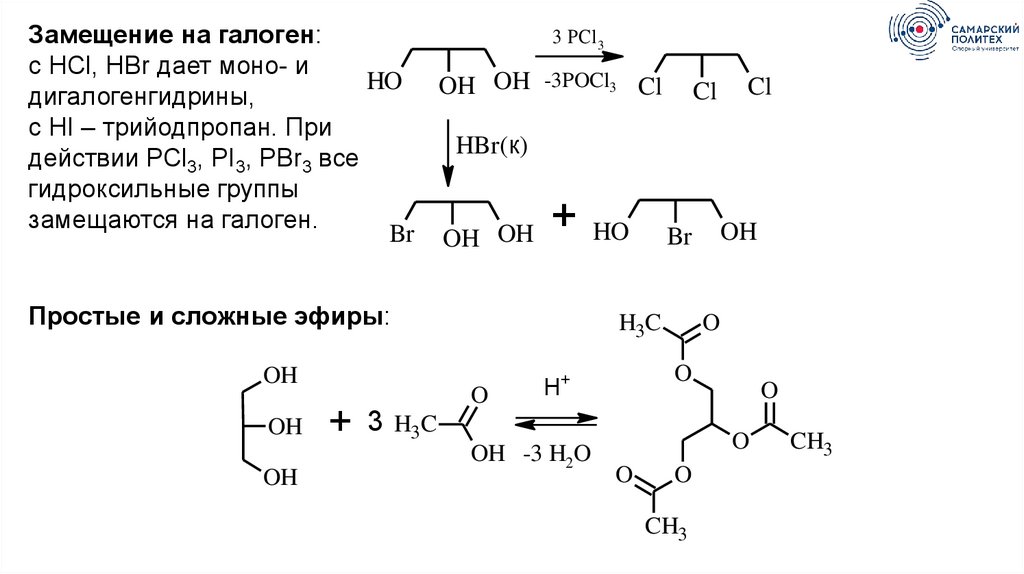
3 PCl 3Замещение на галоген:
с HCl, HBr дает моно- и
HO OH OH -3POCl3 Cl Cl Cl
дигалогенгидрины,
с HI – трийодпропан. При
HBr(к)
действии PCl3, PI3, PBr3 все
гидроксильные группы
замещаются на галоген.
HO Br OH
Br OH OH
+
Простые и сложные эфиры:
OH
OH
OH
+
H3C
O
O
O
H+
3 H3C
OH -3 H2O
O
O
O
O
CH3
CH3
62.
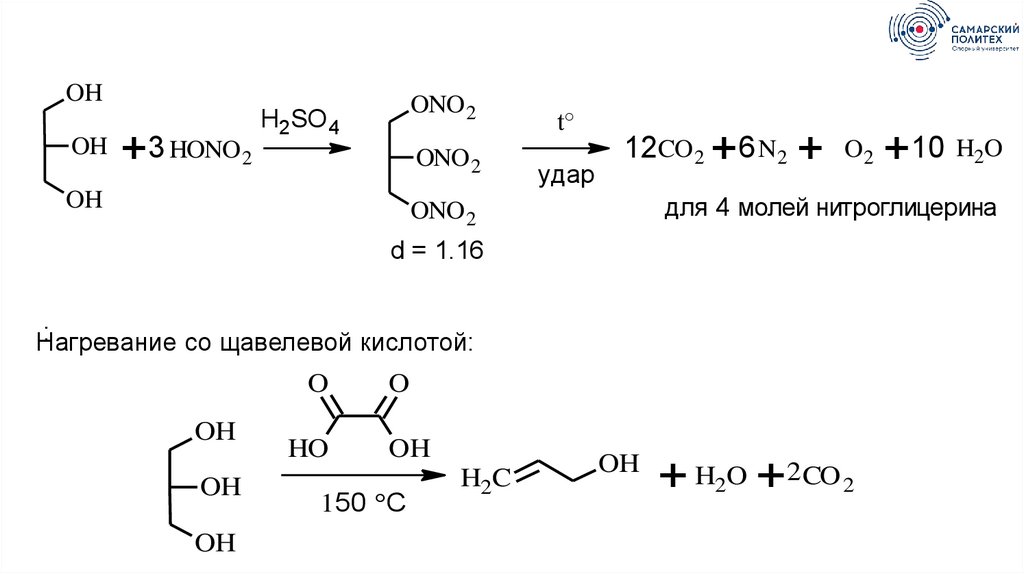
OHOH
+3 HONO 2
ONO 2
H2SO 4
ONO 2
OH
t°
удар
12CO 2 + 6 N2
+
O2
для 4 молей нитроглицерина
ONO 2
d = 1.16
:
Нагревание
со щавелевой кислотой:
O
OH
OH
OH
HO
O
OH
150 °C
H2C
+10 H2O
OH
+ H2O + 2CO 2
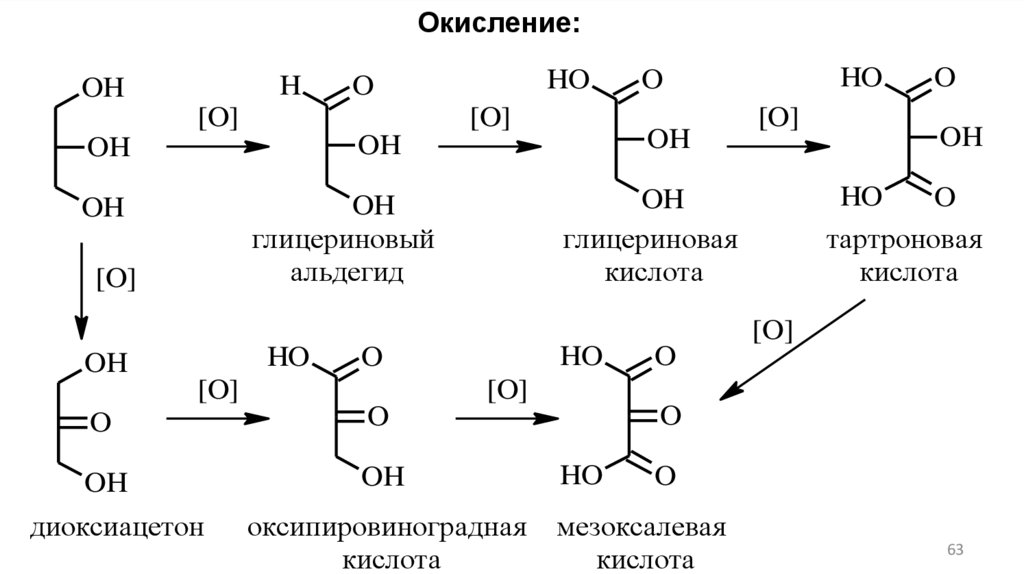
63.
Окисление:H
OH
HO
O
[O]
[O]
OH
OH
OH
[O]
[O]
O
OH
HO
O
тартроновая
кислота
OH
глицериновая
кислота
OH
глицериновый
альдегид
OH
HO
O
[O]
HO
OH
[O]
O
[O]
O
O
OH
OH
диоксиацетон
HO
O
оксипировиноградная
кислота
O
HO
O
мезоксалевая
кислота
63
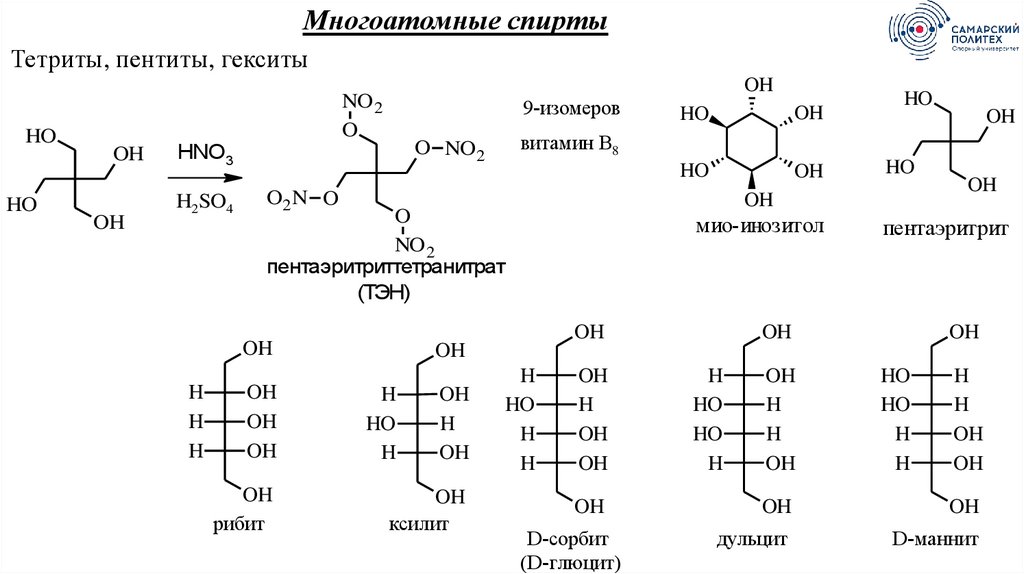
64.
Многоатомные спиртыТетриты, пентиты, гекситы
HO
HO
OH
NO 2
O
OH
OH
9-изомеров
H2SO4
O2 N O
OH
OH
OH
OH
рибит
HO
OH
HO
HO
OH
O
NO 2
пентаэритриттетранитрат
(ТЭН)
мио-инозитол
OH
OH
H
H
H
OH
OH
витамин В8
O NO 2
HNO3
HO
OH
пентаэритрит
OH
OH
OH
H
HO
H
OH
H
OH
OH
ксилит
H
HO
H
H
OH
H
OH
OH
OH
D-сорбит
(D-глюцит)
H
HO
HO
H
OH
H
H
OH
HO
HO
H
H
H
H
OH
OH
OH
OH
дульцит
D-маннит
65.
ФенолыOH
Особое место в органической химии занимают фенолы:
органические соединения ароматического ряда, в
молекулах которых гидроксильные группы связаны с
атомами углерода ароматического кольца
6
5
1
4
2
3
Фенол – тривиальное название, которое принято и в номенклатуре ИЮПАК.
Многие фенолы сохраняют тривиальные названия:
OH
OH
OH
OH
CH3
OH
Cl
CH3
CH3
фенол
о-крезол
о-метилфенол
2-метилфенол
м-крезол
п-крезол
2-хлорфенол
м-метилфенол п-метилфенол
3-метилфенол 4-метилфенол
66.
КлассификацияФенолы
OH
Одноатомные:
OH
CH3
фенол
о,м,п-крезолы
OH
Двухатомные:
OH
OH
OH
OH
пирокатехин
Трехатомные:
резорцин
OH гидрохинон
67.
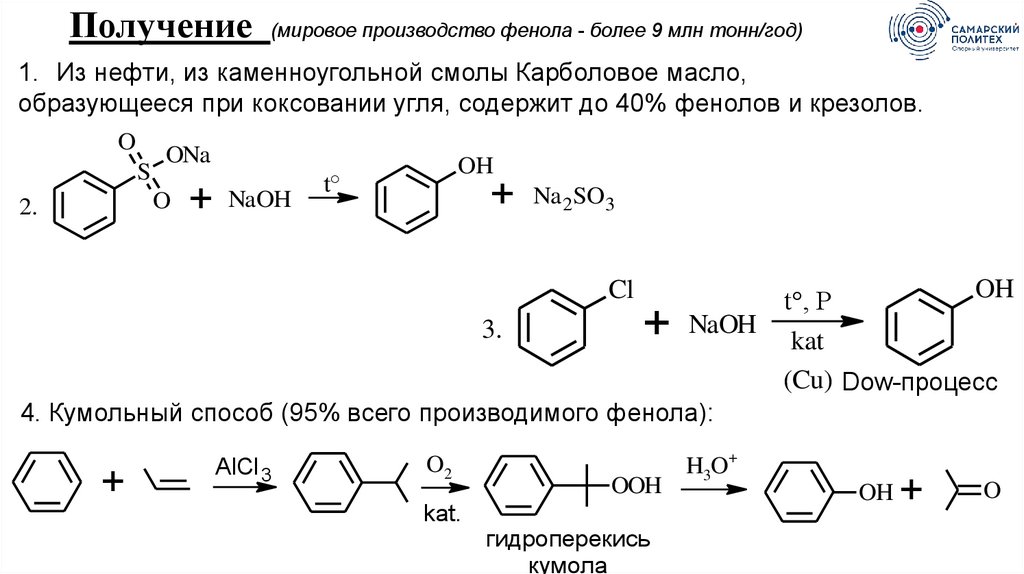
Получение(мировое производство фенола - более 9 млн тонн/год)
1. Из нефти, из каменноугольной смолы Карболовое масло,
образующееся при коксовании угля, содержит до 40% фенолов и крезолов.
O
S
ONa
O
2.
+
NaOH
OH
t°
+
Na 2 SO3
OH
t°, P
NaOH
3.
kat
(Cu) Dow-процесс
4. Кумольный способ (95% всего производимого фенола):
Cl
+
+
AlCl 3
O2
kat.
OOH
гидроперекись
кумола
H3O+
OH
+
O
68.
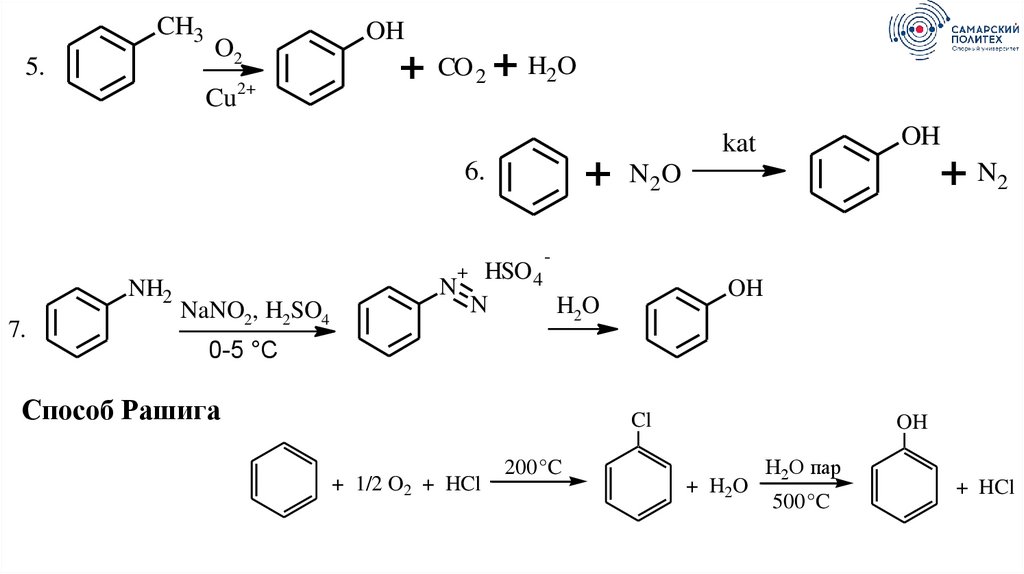
CH35.
O2
2+
Cu
OH
+ CO 2 + H2O
+
6.
NH2
7.
NaNO2, H2SO4
+ N2
N2 O
-
HSO 4
N
N
H2O
+
OH
kat
OH
0-5 °C
Способ Рашига
Cl
+ 1/2 O2 + HCl
200 °C
OH
+ H2O
Н2О пар
500 °C
+ HCl
69.
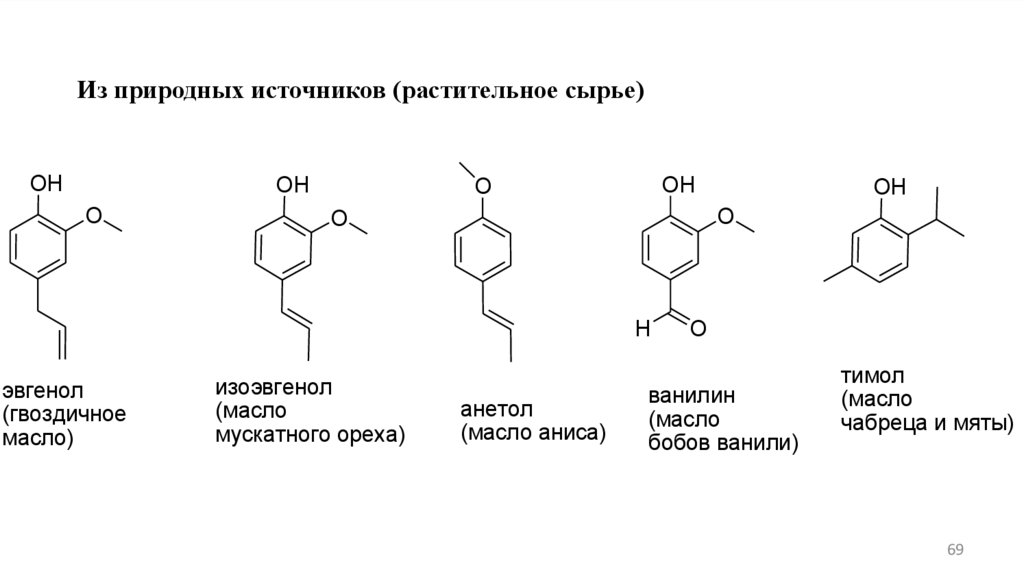
Из природных источников (растительное сырье)OH
OH
O
OH
O
O
O
H
эвгенол
(гвоздичное
масло)
изоэвгенол
(масло
мускатного ореха)
OH
анетол
(масло аниса)
O
ванилин
(масло
бобов ванили)
тимол
(масло
чабреца и мяты)
69
70.
+M..
:OH
-I
Химические свойства
–
O
O
-
Дип.момент -1.55 Д
рКа = 10
Химические свойства фенолов
определяются наличием в молекуле
гидроксильной группы и бензольного
кольца
Кдисс.=1,3*10-10
R-OH < Ar-OH < R-COOH
Для карбоновых кислот - Кдисс =10-5
71.
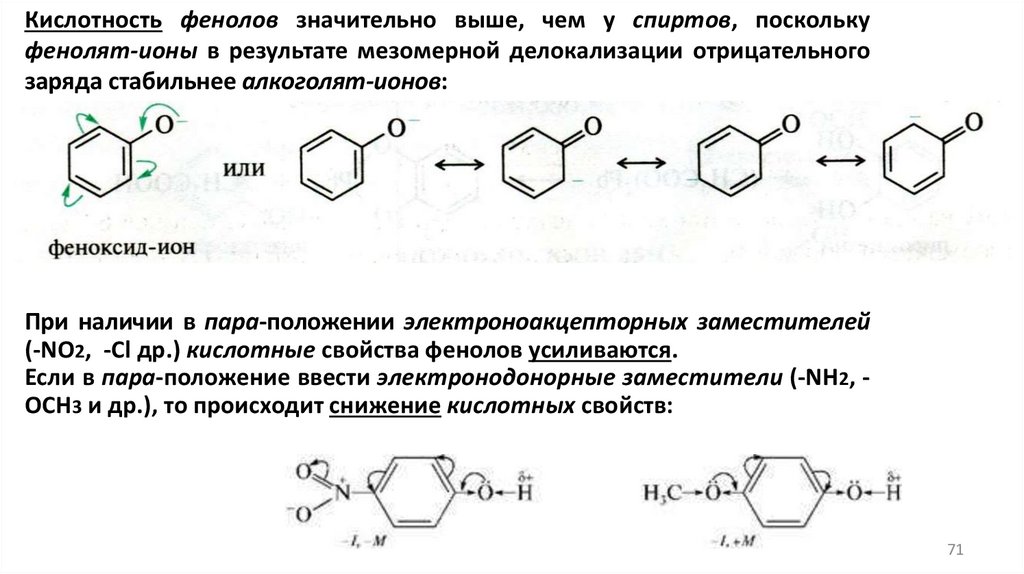
Кислотность фенолов значительно выше, чем у спиртов, посколькуфенолят-ионы в результате мезомерной делокализации отрицательного
заряда стабильнее алкоголят-ионов:
При наличии в пара-положении электроноакцепторных заместителей
(-NO2, -Сl др.) кислотные свойства фенолов усиливаются.
Если в пара-положение ввести электронодонорные заместители (-NН2, ОСН3 и др.), то происходит снижение кислотных свойств:
71
72.
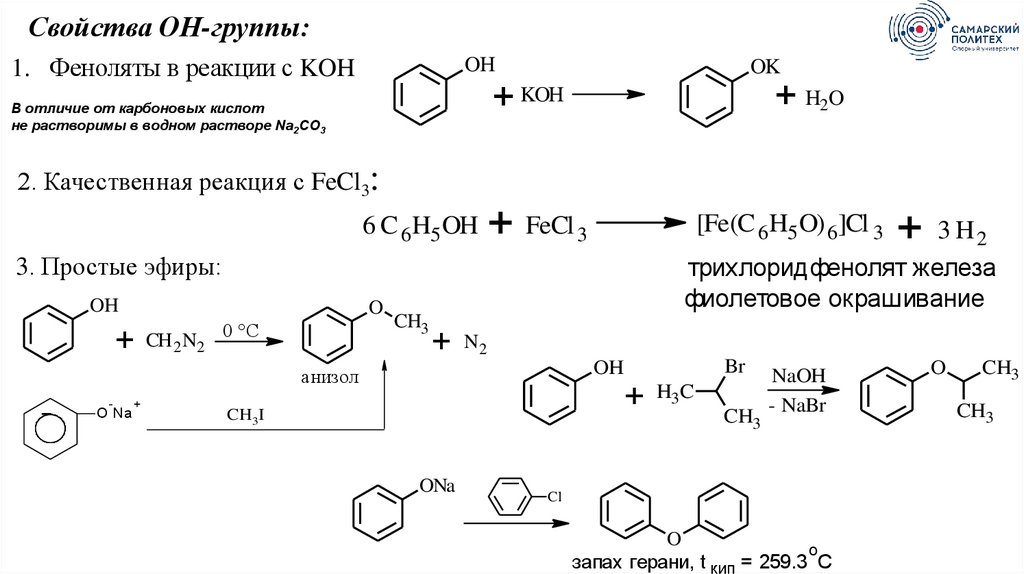
Свойства ОН-группы:1. Феноляты в реакции с KOH
OH
OK
+ H2O
+ KOH
В отличие от карбоновых кислот
не растворимы в водном растворе Na2CO3
2. Качественная реакция с FeCl3:
6 C 6 H5 OH
+ FeCl 3
[Fe(C 6 H5 O) 6 ]Cl 3
3 H2
трихлоридфенолят железа
фиолетовое окрашивание
3. Простые эфиры:
OH
O
+
CH 2 N2 0 °C
CH3
+
N2
-
+
+
CH3I
ONa
Br
OH
анизол
O Na
+
H3C
CH3
NaOH
- NaBr
Cl
O
о
запах герани, t кип = 259.3 С
O
CH3
CH3
73.
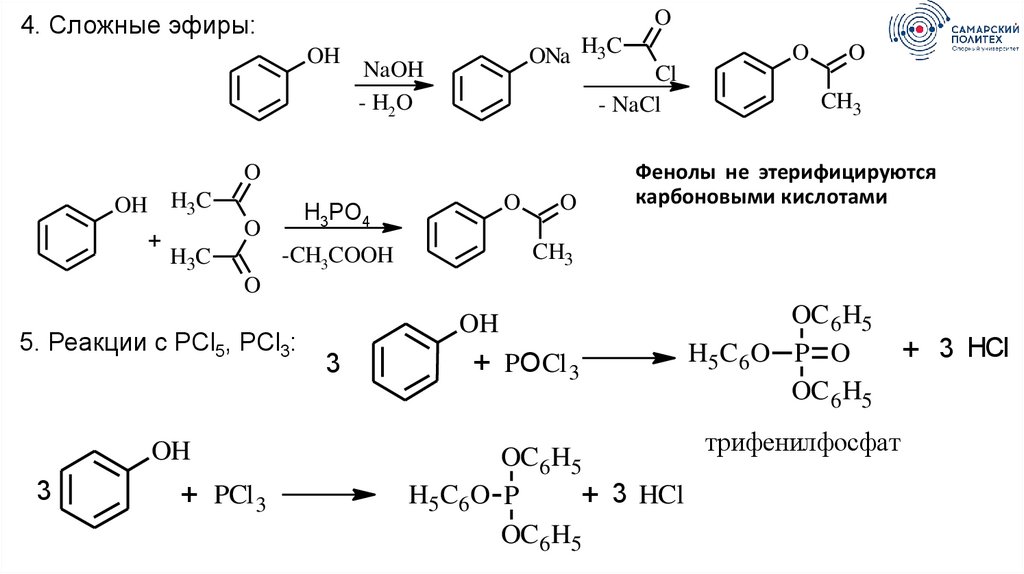
O4. Сложные эфиры:
OH
ONa H3C
NaOH
- H2O
Cl
- NaCl
O
OH H3C
+
O
H3PO4
O
O
O
CH3
Фенолы не этерифицируются
карбоновыми кислотами
CH3
-CH3COOH
H3C
O
O
5. Реакции с PCl5, PCl3:
OH
3
+ PCl 3
OH
3
+ PОCl 3
OC 6 H5
H5 C6 O P
+ 3 HCl
OC 6 H5
OC 6 H5
H5 C6 O P O
OC 6 H5
трифенилфосфат
+ 3 HCl
74.
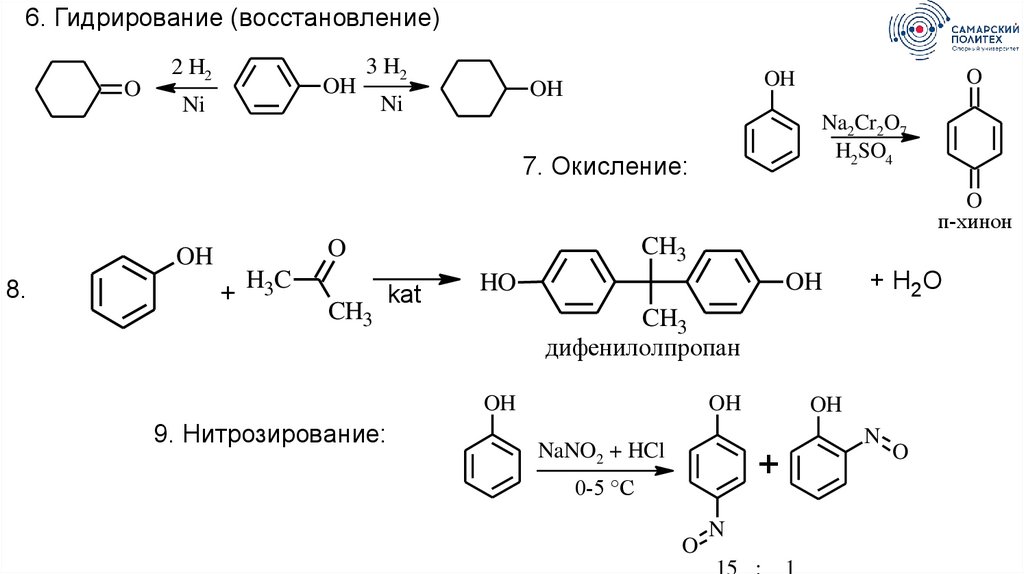
6. Гидрирование (восстановление)O
2 H2
OH
Ni
3 H2
Ni
O
OH
OH
Na2Cr2O7
H2SO4
7. Окисление:
O
п-хинон
8.
CH3
O
OH
+
H3C
CH3
kat
OH
HO
CH3
дифенилолпропан
OH
9. Нитрозирование:
+ H2O
OH
OH
N
NaNO2 + HCl
+
0-5 °C
O
N
15 :
1
O
75.
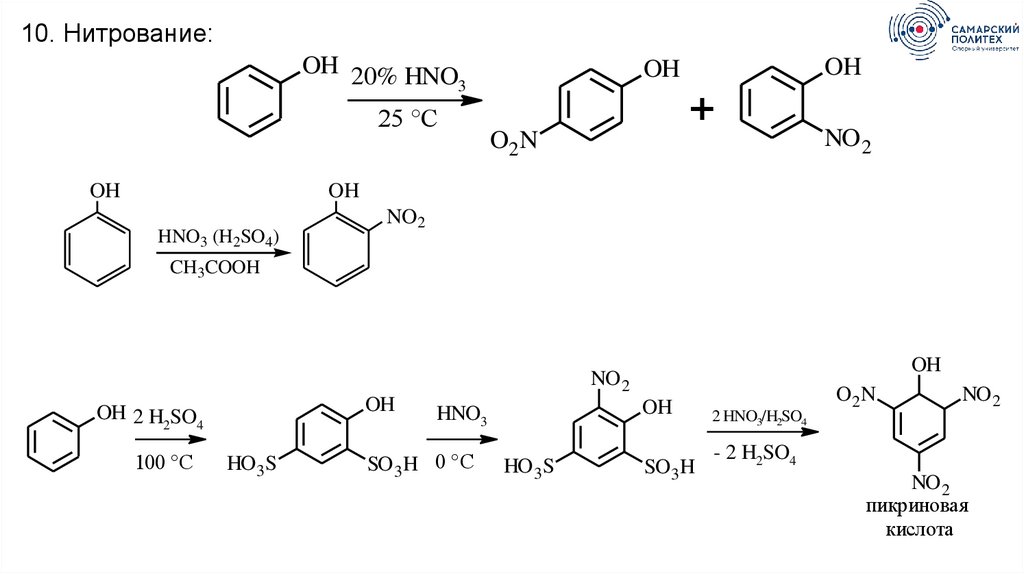
10. Нитрование:OH 20% HNO
3
25 °C
OH
OH
OH
+
O2N
NO 2
OH
HNO3 (H2SO4)
NO2
CH3COOH
OH
NO 2
OH
OH 2 H SO
2
4
100 °C
HO 3 S
OH
HNO3
SO 3 H 0 °C
HO 3 S
SO 3 H
2 HNO3/H2SO4
O2 N
NO 2
- 2 H2SO4
NO 2
пикриновая
кислота
76.
11. Галогенирование. Скорость галогенирования фенолят иона в 1000 раз больше скоростигалогенирования фенола:
Br
OH
OH
+
O
3 Br 2
- HBr
Br
Br
белого цвета
Br2
Br
Br
- HBr
Br Br
желтого цвета
2,4,4,6-тетрабромциклогекса-2,5-диенон
Монобромирование можно провести
в присутствии HBr:
OH
+ Br 2
OH
OH
Cl2
OH
Cl
Cl
5 °C
Br
OH
Cl2
+
OH
HBr
Cl
Cl
2,4-дихлорфенол
76
77.
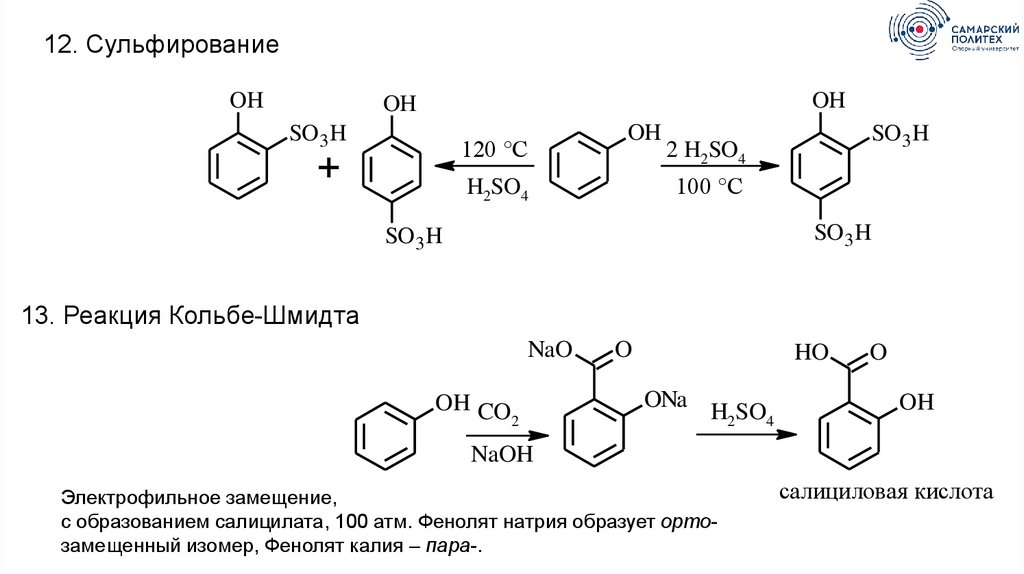
12. СульфированиеOH
OH
OH
SO 3 H
120 °C
+
OH
SO 3 H
2 H2SO4
100 °C
H2SO4
SO 3 H
SO 3 H
13. Реакция Кольбе-Шмидта
NaO
OH CO
2
O
HO
ONa
H2SO4
O
OH
NaOH
Электрофильное замещение,
с образованием салицилата, 100 атм. Фенолят натрия образует ортозамещенный изомер, Фенолят калия – пара-.
салициловая кислота
78.
Алкилирование и ацилирование по Фриделю-КрафтсуOH
OH
OH
H+
CH2CH3
+
+ CH3CH2OH
о-этилфенол
CH2CH3
п-этилфенол
79.
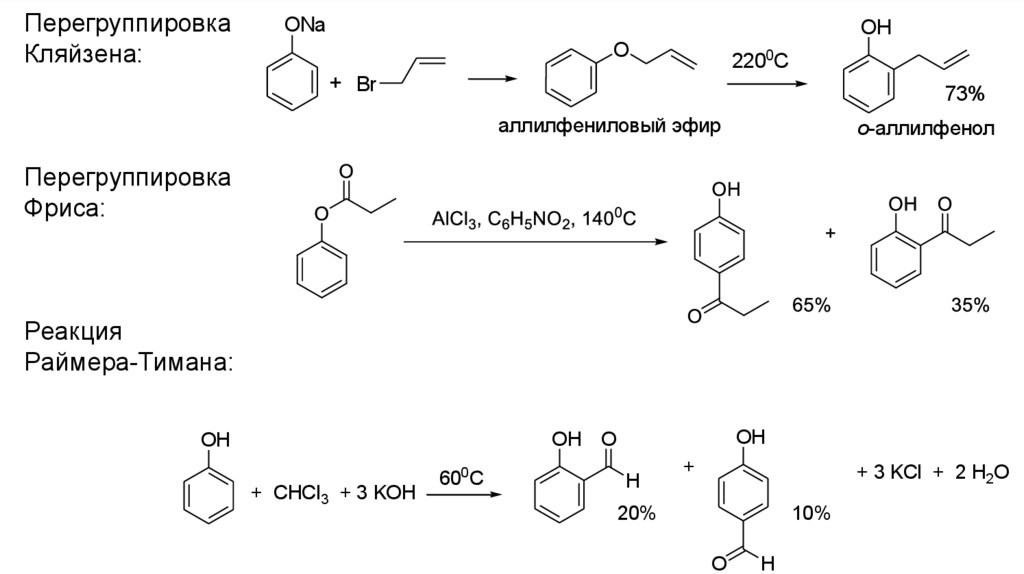
ПерегруппировкаКляйзена:
ONa
OH
O
2200C
+ Br
73%
аллилфениловый эфир
о-аллилфенол
Перегруппировка
Фриса:
Реакция
Раймера-Тимана:
OH
OH O
OH
+ CHCl3 + 3 KOH
600C
H
+
+ 3 KCl + 2 H2O
20%
10%
O
H
80.
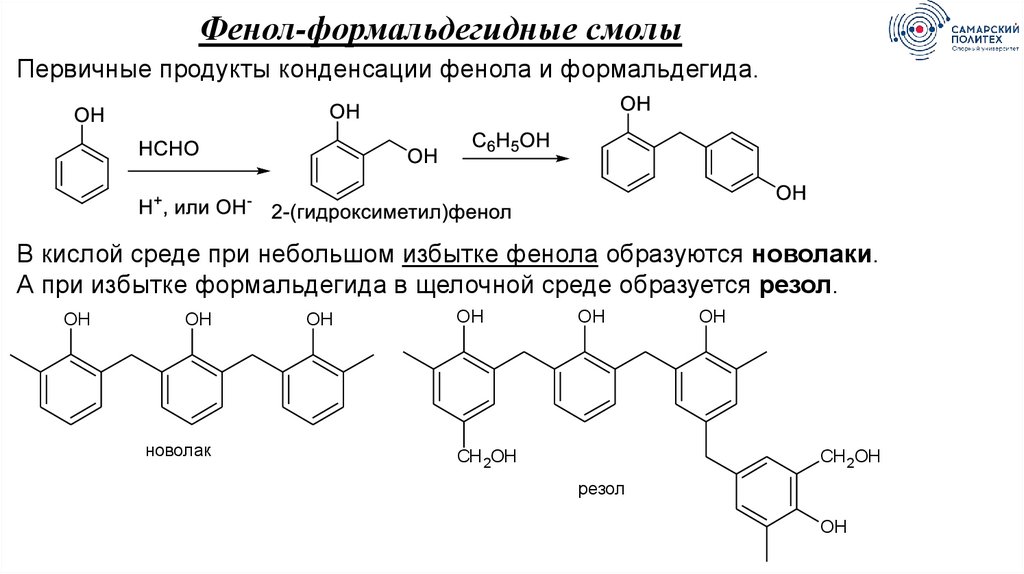
Фенол-формальдегидные смолыПервичные продукты конденсации фенола и формальдегида.
В кислой среде при небольшом избытке фенола образуются новолаки.
А при избытке формальдегида в щелочной среде образуется резол.
OH
OH
новолак
OH
OH
OH
CH 2OH
OH
CH 2OH
резол
OH
81.
Двухатомные фенолы.Трехатомные фенолы.
Нафтолы.
(Самостоятельно)
81
82.
Отдельные представителиФенол – кристаллическое вещество с т. пл. 43°С, обладает характерным едким
запахом, вызывает ожоги на коже. токсичное вещество, вызывает нарушение
функций нервной системы.
Пыль, пары и раствор фенола раздражают слизистые оболочки глаз,
дыхательных путей, кожу (ПДК 5мг/м³, в водоёмах 0,001 мг/л).
Один из первых примененных в медицине антисептиков.
Применяется для получения красителей, взрывчатых веществ (пикриновая
кислота).
Метиловый эфир фенола – анизол – применяется для получения душистых
веществ и красителей.
Этиловый эфир фенола – фенетол.
Крезолы применяются в производстве пластических масс, красителей,
дезинфицирующих средств.
2,4,6-Триалкилфенолы, особенно с третичными алкильными группами, являются
антиоксиданнтами.
Они предотвращают окислительные процессы путем связывания свободных
радикалов, вызывающих рост цепи в цепных реакциях.
83.
Использование фенола:Более 40 % мирового производства - на производство дифенилолпропана
(бисфенола А), который используется для производства эпоксидных смол,
антиоксидантов, гербицидов.
30 % - производство фенолформальдегидных смол
12 % фенола гидрированием превращается в циклогексанол (используемый
для получения полиамидов)
14 % - на другие нужды, в том числе на производство антиоксидпнтов
(ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов
(неонолы), других фенолов (крезолов), присадок к смазочным маслам,
лекарственных препаратов, антисептиков (ксероформа) и пестицидов.
Фенол и его производные обуславливают консервирующие свойства
коптильного дыма.
Фенол используют в качестве консерванта в ветеринарных вакцинах.
83
































 Химия
Химия