Похожие презентации:
Химическая связь
1.
Химическая связьВзаимодействие атомов, которое связывает их
в молекулы, ионы, радикалы, кристаллы
2.
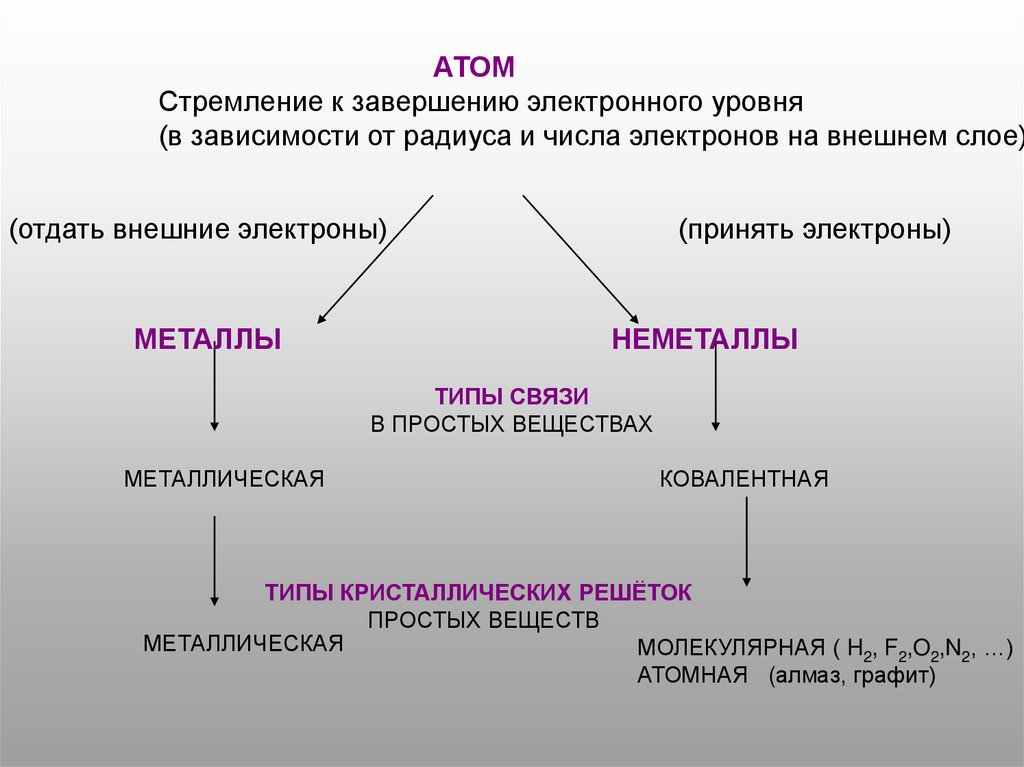
АТОМСтремление к завершению электронного уровня
(в зависимости от радиуса и числа электронов на внешнем слое)
(отдать внешние электроны)
МЕТАЛЛЫ
(принять электроны)
НЕМЕТАЛЛЫ
ТИПЫ СВЯЗИ
В ПРОСТЫХ ВЕЩЕСТВАХ
МЕТАЛЛИЧЕСКАЯ
КОВАЛЕНТНАЯ
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
ПРОСТЫХ ВЕЩЕСТВ
МЕТАЛЛИЧЕСКАЯ
МОЛЕКУЛЯРНАЯ ( H2, F2,O2,N2, …)
АТОМНАЯ (алмаз, графит)
3.
ТИПЫ СВЯЗИВ СЛОЖНЫХ ВЕЩЕСТВАХ
МЕТАЛЛ-НЕМЕТАЛЛ
ИОННАЯ
K2O NaCl
КОВАЛЕНТНАЯ ПОЛЯРНАЯ
CrO3,Mn2O7
НЕМЕТАЛЛ-НЕМЕТАЛЛ
КОВАЛЕНТНАЯ ПОЛЯРНАЯ
HCl SO2
4.
5.
Типы химической связи( по природе образования):
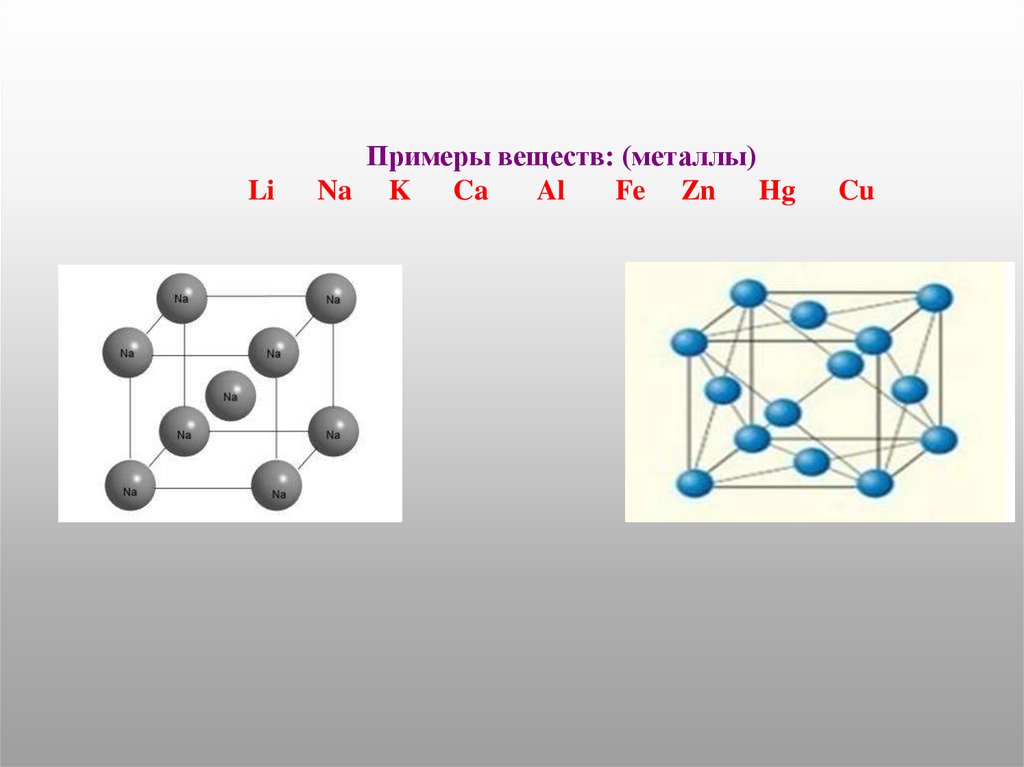
Металлическая
-обобществление электронов внешнего слоя
между всеми ионами в кристаллической решётке
металла.
6.
LiПримеры веществ: (металлы)
Na K Ca
Al
Fe Zn
Hg
Cu
7.
Ионная(электростатическое притяжение
противоположно заряженных ионов).
металл + неметалл + большая разница в
электроотрицательности
NaCl
Li•+•F
K2 O
CaF2
+
→Li +[
F
] →LiF
8.
Молекулыхлороводорода
Ионная
кристаллическая решётка
9.
10. ковалентная связь - обобществление электронов с образованием общих электронных пар
Н● + ●НН Н
11.
_++
_
+
Н● + ●Н
+
Н
Н
электронная
формула
+
12.
+Н● + ●Н
+
Н
Н
электронная
формула
13.
Формы атомных орбиталей14.
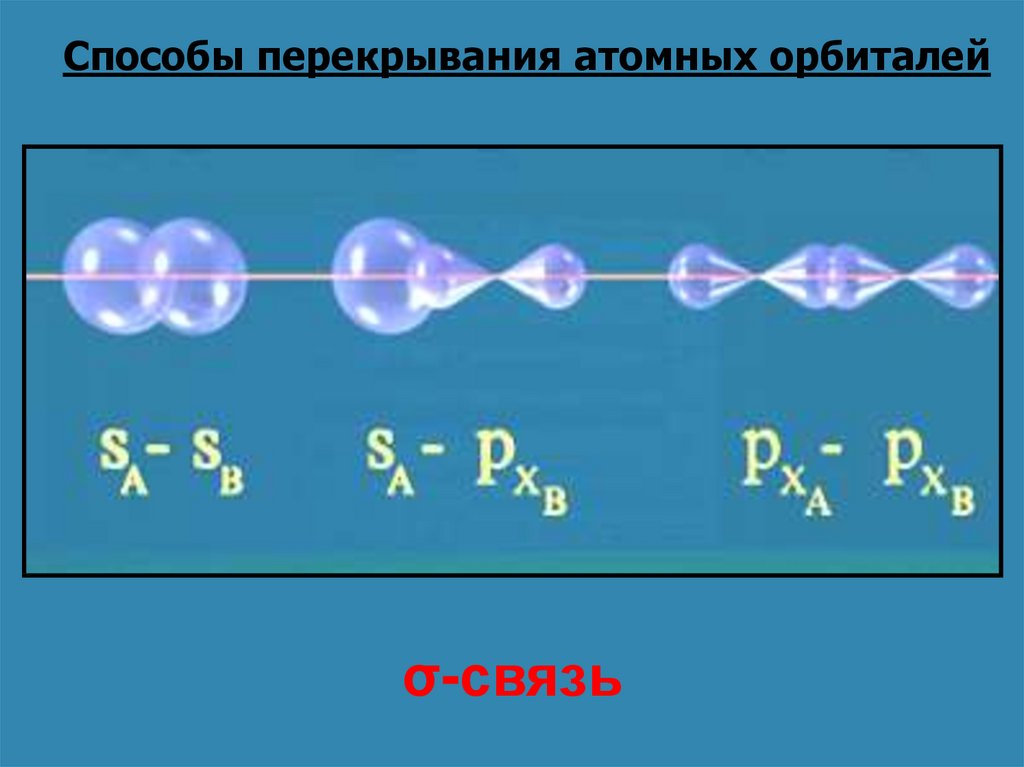
Способы перекрывания атомных орбиталейσ-связь
15. π-связь
Способы перекрывания атомных орбиталейπ-связь
16. Способы перекрывания атомных орбиталей
17.
Ковалентная(обобществление двух электронов за счёт
перекрывание электронных орбиталей атомов).
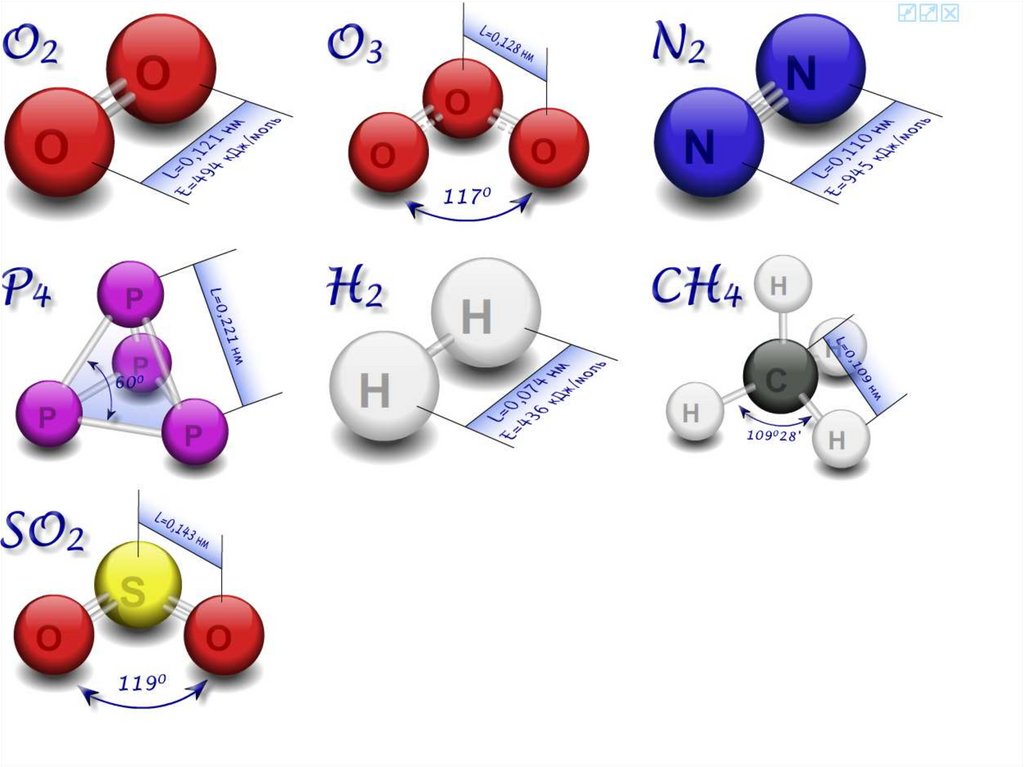
Примеры веществ: (неметаллы)
H2 H-H
O2 O=O
N2 N≡N
F2 F-F
Cl2 Cl-Cl
Br2 Br-Br
I2
I-I
Н – Н 436,0 кДж/моль
О= О 646,3 кДж/моль
N ≡N 945,3 кДж/моль
4,5 эВ
6,7 эВ
9,8 эВ
18.
• Направленность – соединение атомовмежду собой при образовании общих
электронных пар в определённых
направлениях.
• Насыщаемость – способность атомов
присоединять к себе определённое число других
атомов (ограничено валентными возможностями)
• Полярность связи – неравномерное
распределение электронной плотности между
атомами в молекуле.
19.
σ-связиМеханизмы образования связи:
обменный и донорно-акцепторный
20.
Энергия разрыва химических связей в некоторых молекулахМолекула
H2
N2
O2
Cl2
Br2
I2
HF
HCl
HBr
HI
CO
Энергия, кДж/моль
436,0
945,3
646,3
239,2
201
151,1
568,5
431,6
366,1
298,3
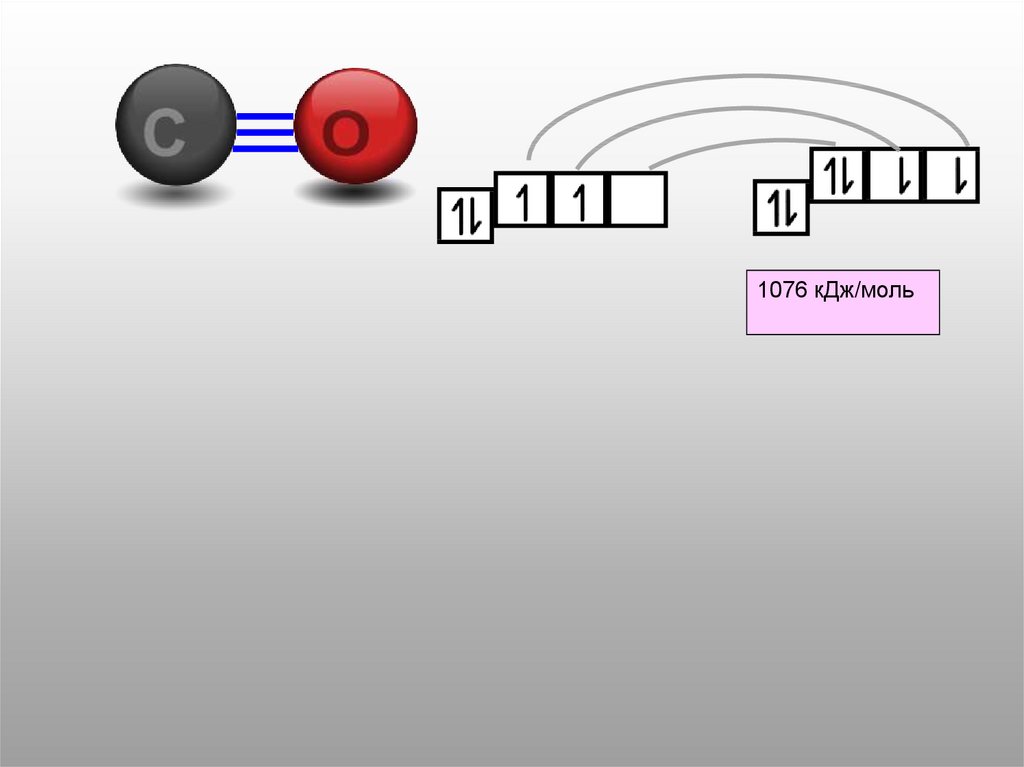
1076,4
21.
1076 кДж/моль22.
23.
24.
25.
26.
К вопросу о строении бурого газа+4
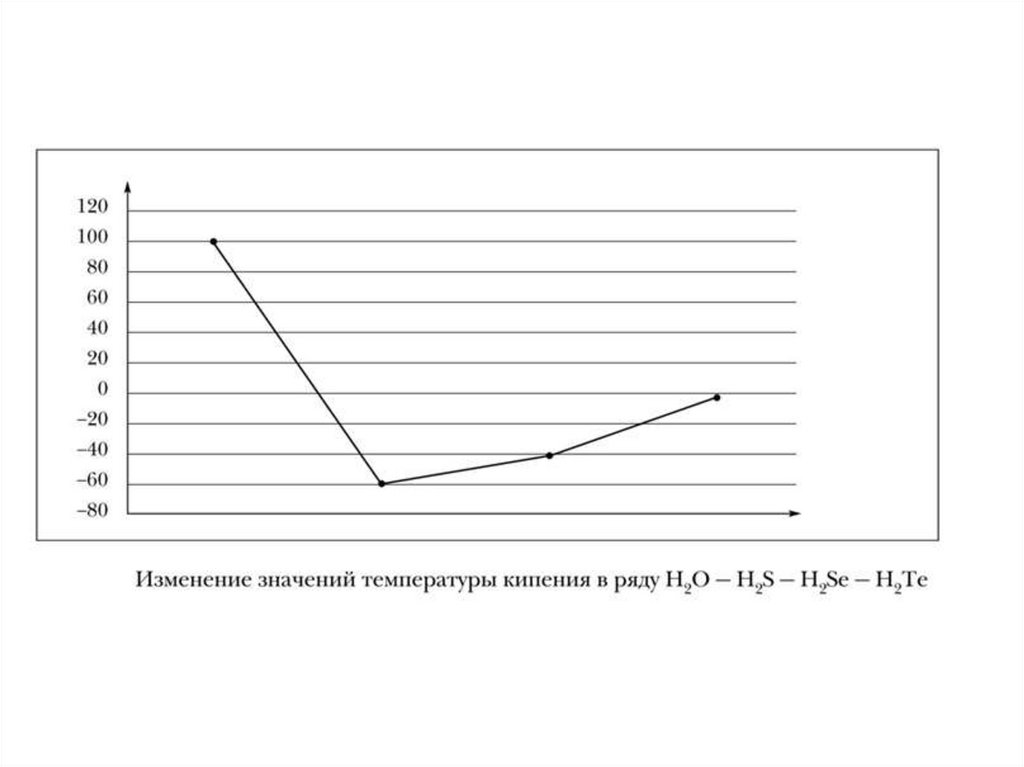
27. Водородная связь
Для образования необходимоналичие в одной молекуле связи
Н – сильно электроотрицательный
элемент (F,O,N)
Примеры: HF, H2O, CH3OH, NH3
28.
Образование межмолекулярнойводородной связи.
Н
Н
Н
H O: - H + O: - H + O:
29.
30.
Водородная связьможет быть и
внутримолекулярной.
В частности у белков
вторичная структура
поддерживается
водородными связями.
























 Химия
Химия








