Похожие презентации:
Теория электролитической диссоциации. Контрольный тест
1. Теория электролитической диссоциации
Выпишите формулыэлектролитов и неэлектролитов
КОН
Вещества
Электролиты
- Неэлектролиты
KNO3
- вещества,
Cвещества,
H
O
Электролиты
Неэлектролиты
6 12 6
растворы
растворы
или
C 6H
H2SO4 или КОН
12O6
расплавы которых расплавы которых
O2
LiCl
KNO3
проводят
не
проводят
CaCO3
O2
H2SO4
электрический
электрический
CaCO3
LiCl
ток.
ток.
Ba(OH)2
Ba(OH)2
http://mirhim.ucoz.ru
2. Теория электролитической диссоциации
Составьте уравнения диссоциацииследующих электролитов
Последовательность написания уравнений диссоциации:
в левой части уравнения записать формулу
электролита,
поставить
знак
равенства
или
3 определяется силой электролита;
обратимости, что
КОН
NaNO
+
FeCl
3
+
–
NaHCO → Na + HCO3
в правой части 3уравнения записать количество
22SO3 3 положительно+
3
H
+
образующихся
и
отрицательно
+
3+
23+
Al2NaCl
( SO
)
→2Al
+3SO
+
заряженных
ионов
(числа
ставятся
перед
ионами);
4
3
43
33+
2HCO
↔
H
+
CO
–
+
указать
величину
и
знак
заряда
ионов;
3
3 2Al2( SO4)3
3
3
HClсумму положительных и отрицательных
проверить
зарядов (она должна быть равна нулю).
NaHCO3
H SO ↔ H + HSO
NaCl
→
Na
+
Cl
NaNO
→
Na
+
NO
FeCl
→
Fe
+
3Cl
КОН
→
K
+
OH
HCl → H + Cl
HSO
↔ H + SO
http://mirhim.ucoz.ru
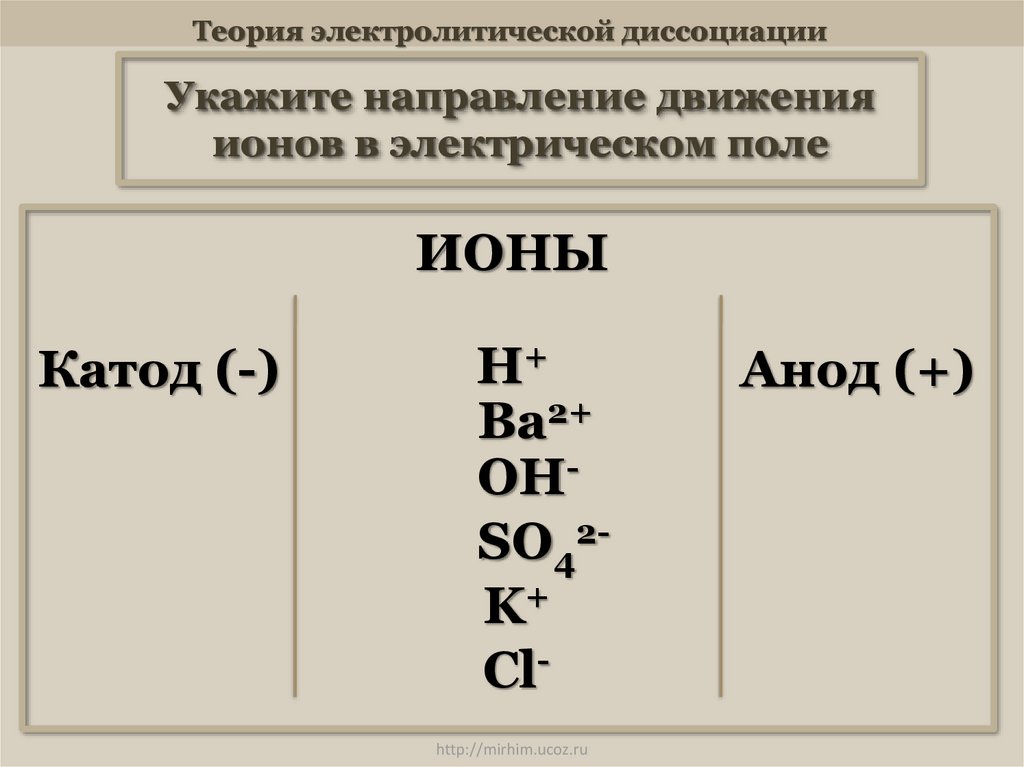
3. Теория электролитической диссоциации
Укажите направление движенияионов в электрическом поле
ИОНЫ
Катод (-)
Н+
Ba2+
OНSO42K+
Clhttp://mirhim.ucoz.ru
Анод (+)
4. Теория электролитической диссоциации
Выпишите формулысильных и слабых электролитов
Сильные электролиты – Слабые электролиты – в
Н
O
2
при растворении в воде Электролиты
водных растворах лишь
H2S полностью частично (обратимо0
практически
диссоциируют
LiOH на ионы диссоциируют на ионы
Сильные(почти
Слабые
независимо от их
все
K2SO4
концентрации
органические кислоты,
H2O
LiОН
NaCl
(растворимые
соли,
вода, некоторые
H
S
K
SO
2
многие
неорганические
неорганические
2
4
HNO3
кислоты, основания NaCl кислоты,
H2CO3
H
CO
2
3
щелочных
и
нерастворимые
NH
OH
HNO
NH4OH
4
щелочноземельных
гидроксиды
металлов).
3
металлов).
Fe(OH)
Fe(OH)
2
2
http://mirhim.ucoz.ru
5. Теория электролитической диссоциации
Составьте уравненияреакций ионного обмена
между парами веществ
Последовательность написания ионно-молекулярного
HNO и NaOH уравнения:
3 молекулярное уравнение реакции и подобрать
составить
коэффициенты;
найти среди3продуктов реакции вещество, образование
которого
3
2 2 4
H
SO
и
BaCl
4
3
4
3
4
2
2
2
3
2
4
2
4
2
2
34
3 электролит);
вызывает
протекание
реакции
(осадок, газ, слабый
указать в молекулярном уравнении под каждым веществом: силу
кислот и оснований, растворимость для средней соли;
++SO
+
-+
+
22+
2+
++
3- - 2+++
+O
2- +CO
-2-2-+2H
+ 4)22Na
и
HCl
2Na
++полное
CO
=2Na
2Cl
+
H
+
CO
2H
+2Cl
SO
+2H
2Cl
3Mg
3SO
+ 6K
+ 2PO--=Ba
6K
+-+виде
3SO
составить
ионно-молекулярное
уравнение.
В
3+
+
+
4 +Ba
4- = Mg+
3(PO
4ионов
3
2
4
4
2
3
3 3K + 3OH = Al(OH)3 + 3K
3
22 Al
+
3Cl
+
+
3Cl
пишут только: сильные кислоты и основания, растворимые
средние соли;
AlCl3 иизKOH
исключить
обеих
частей
уравнения
+2+
2- ионно-молекулярного
2+
3--2+
3+(подчеркнуть
одинаковые ионы
их);
3 44
2 32
44 22
3 получить
выписать оставшиеся ионы и в результате
сокращённое
уравнение, которое выражает
MgSO4 иионно-молекулярное
K3 PO4
сущность данной реакции.
HNO
NaOH
=
NaNO
++3K
H
O
H
+2K
BaCl
BaSO
+
2HCl
3MgSO
PO ==
=2NaCl
Mg
(PO
+
Na SO
CO
+
2HCl
+ H) O
COSO
AlCl
+++
3KOH
Al(OH)
+
3KCl
H +NO +Na +OH =Na +NO +H O
2H
+
CO
=
H
O
+
CO
Ba
+
SO
=
BaSO
3Mg
+
2PO
=
Mg
(PO
)
H
+
OH
=
H
O
Al + 3OH = Al(OH)
http://mirhim.ucoz.ru
6.
Список использованных ресурсовЕмельянова Е.О., Иодко А.Г. «Организация познавательной
деятельности учащихся на уроках химии в 8-9 классах. Опорные
конспекты, практические задания, тесты: в 2- частях. Часть II. –
М: Школьная Пресса, 2002.
Каверина А.А., Корощенко А.С., Яшукова А.В. Химия: 8-9
классы: тематические и итоговые контрольные работы:
дидактические материалы. – М: Вентана-Граф, 2009.
Новошинский И.И., Новошинская Н.С. Химия. 8 кл. Учебник
для общеобразовательных учреждений. 3-е изд., испр. И доп. –
М: ООО»Издательство Оникс»: ООО «Издательство «Мир и
Образование», 2006.
http://mirhim.ucoz.ru





 Химия
Химия








