Похожие презентации:
Фенолы. Классификация и изомерия
1.
Фенолы- это кислородсодержащие производные
ароматических углеводородов, содержащие одну или
несколько гидроксильных групп -OH.
1
2.
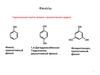
I.Классификация и изомерия
Фенолы бывают одноатомными и многоатомными:
OH
OH
OH
CH3
CH3
о-крезол
CH3
м-крезол
п-крезол
одноатомные фенолы (СnН2n-7ОН)
OH
OH
OH
OH
OH
OH
OH
пирокатехин
OH
резорцин
двухатомные фенолы
(СnН2n-8(ОН)2)
OH
гидрохинон
пирогаллол
трехатомный фенол
(СnН2n-9(ОН)3)
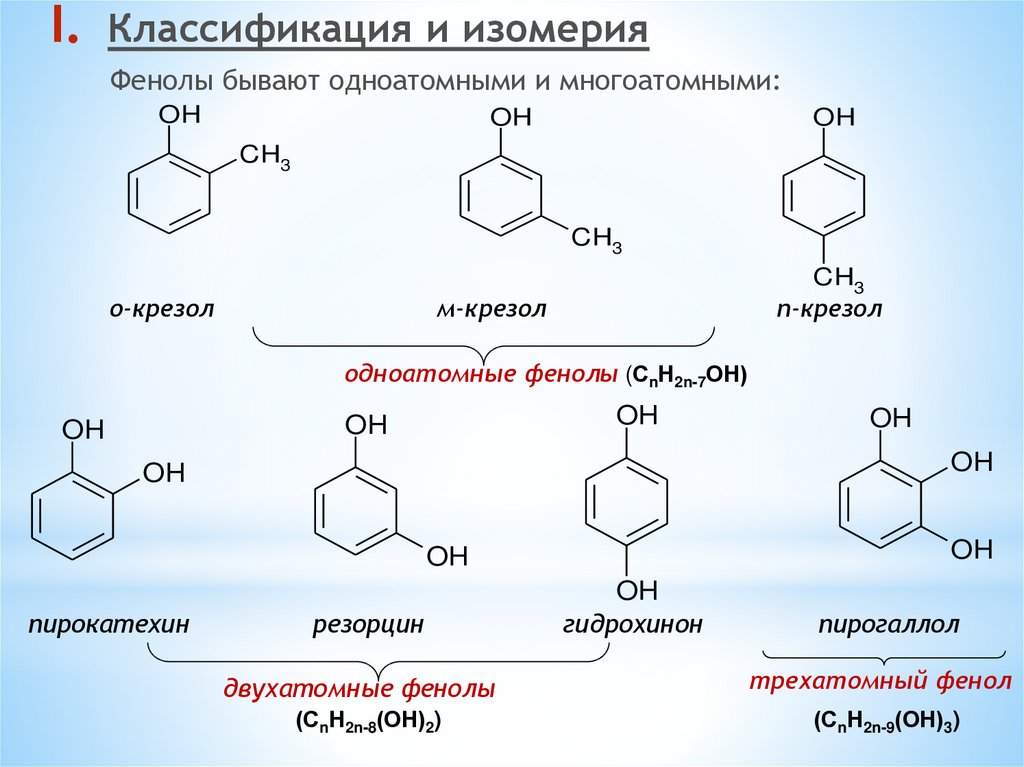
3.
Для фенолов характерна структурная изомерия:положения OH-группы и межклассовая изомерия
OH
O CH3
CH2OH
CH3
о-крезол
(фенол)
бензиловый спирт
(ароматический спирт)
анизол
(простой эфир)
Межклассовые изомеры одноатомных фенолов
3
4.
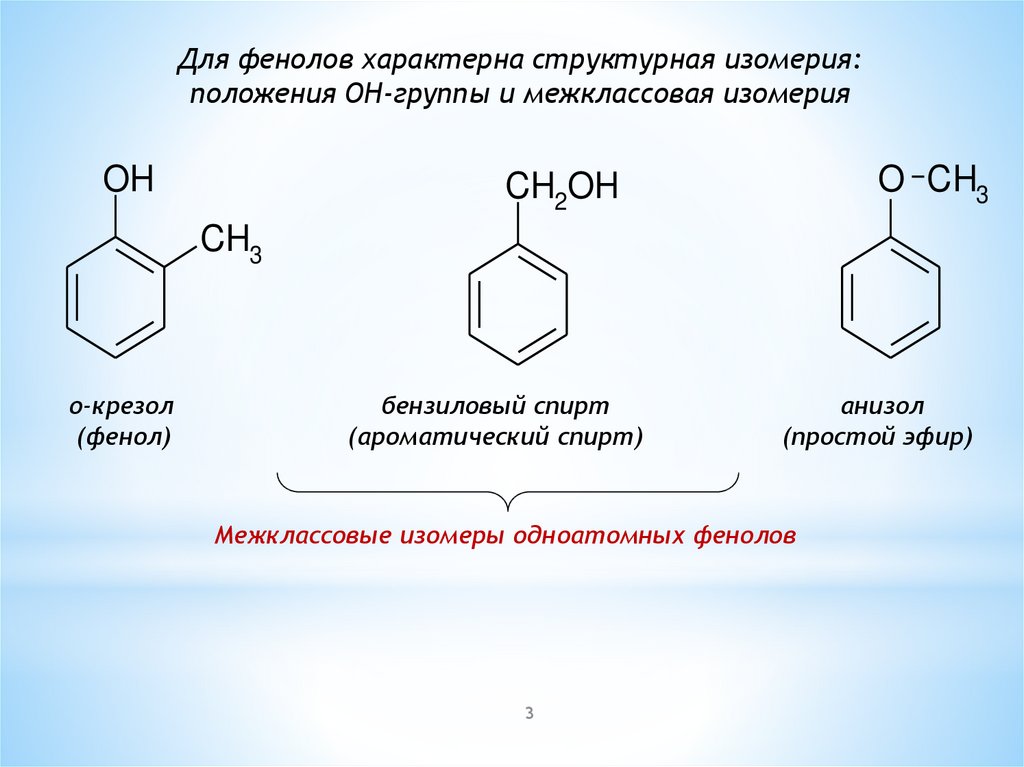
II. Физические свойства феноловФенол – белое кристаллическое вещество с характерным запахом.
На воздухе розовеет. Плохо растворим в воде, но при повышении
температуры до 70 0С растворяется полностью. Такие особенности
фенола объясняются наличием межмолекулярной водородной связи:
4
5.
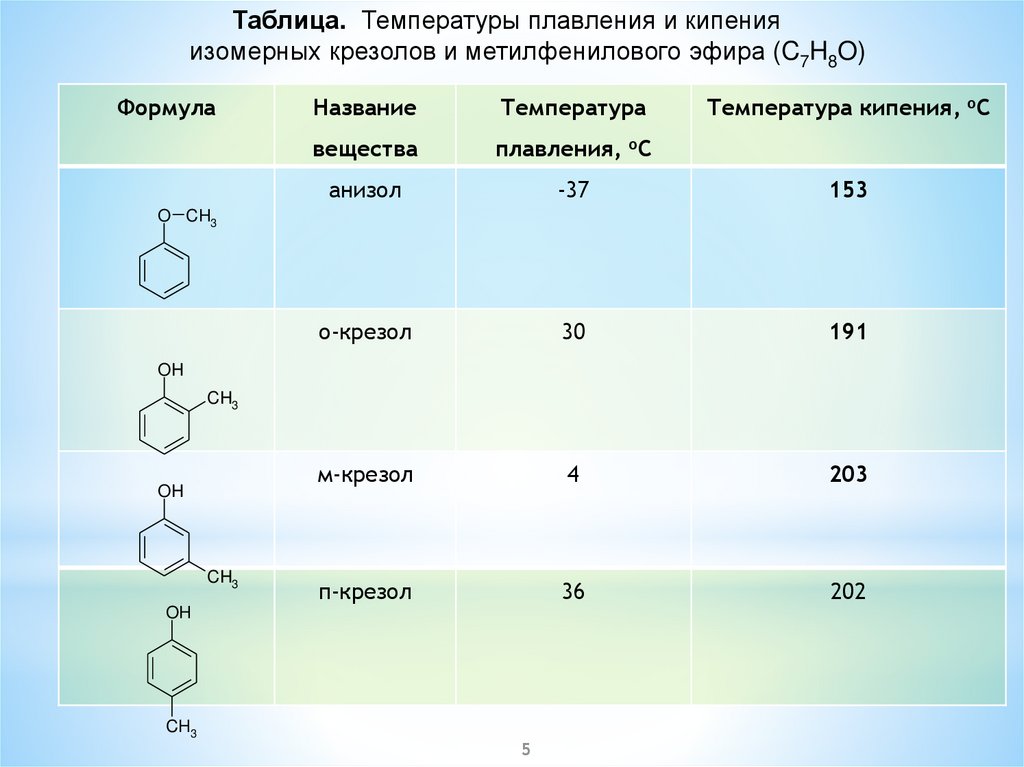
Таблица. Температуры плавления и кипенияизомерных крезолов и метилфенилового эфира (C7H8O)
Формула
Название
Температура
Температура кипения, oC
вещества
плавления, oC
анизол
-37
153
о-крезол
30
191
м-крезол
4
203
п-крезол
36
202
O CH3
OH
CH3
OH
CH3
OH
CH3
5
6.
* Фенол очень токсичен, при попадании на кожу вызываетожоги. Фенол обладает хорошими дезинфицирующими
свойствами; это было первое вещество, которое
использовалось для дезинфекции (Дж. Листер, 1867)
* Фенолы входят в состав креозота – жидкости, получаемой из
каменноугольной смолы и используемой для пропитки шпал
для предотвращения их гниения. Очищенный креозот
используется как антисептик в медицине.
* Пентахлорфенол применяется для пропитки древесины как
антисептик, инсектицид и фунгицид. Пентахлорфенолятом
натрия обработаны брёвна Кижских церквей.
7.
8.
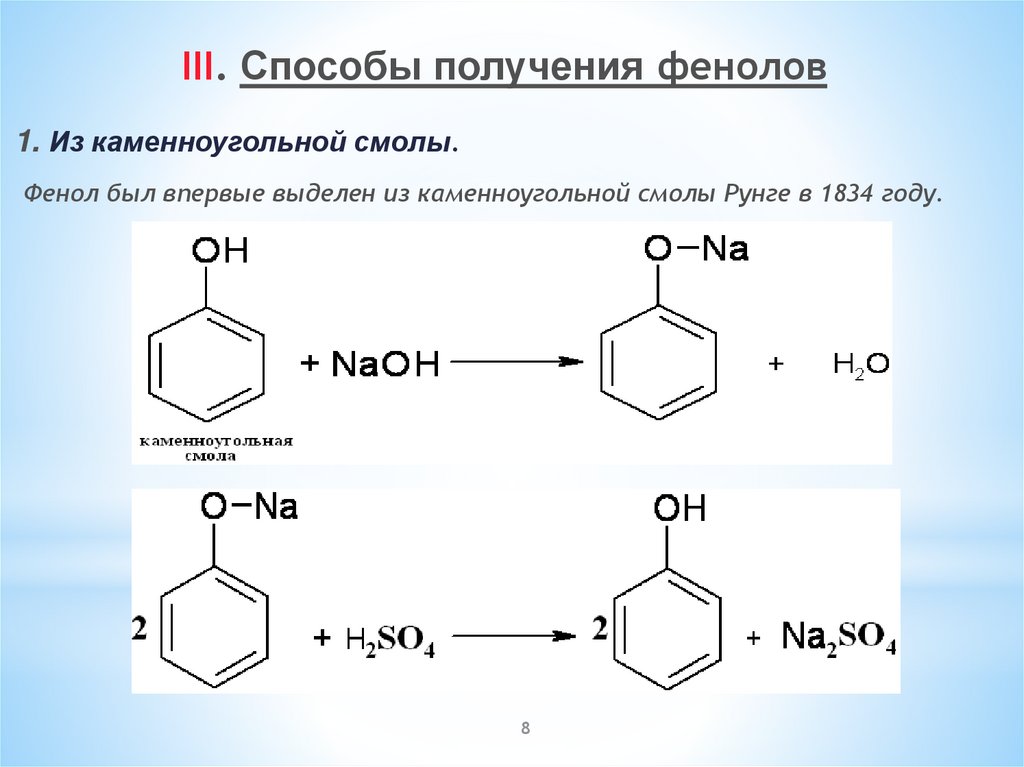
III. Способы получения фенолов1. Из каменноугольной смолы.
Фенол был впервые выделен из каменноугольной смолы Рунге в 1834 году.
8
9.
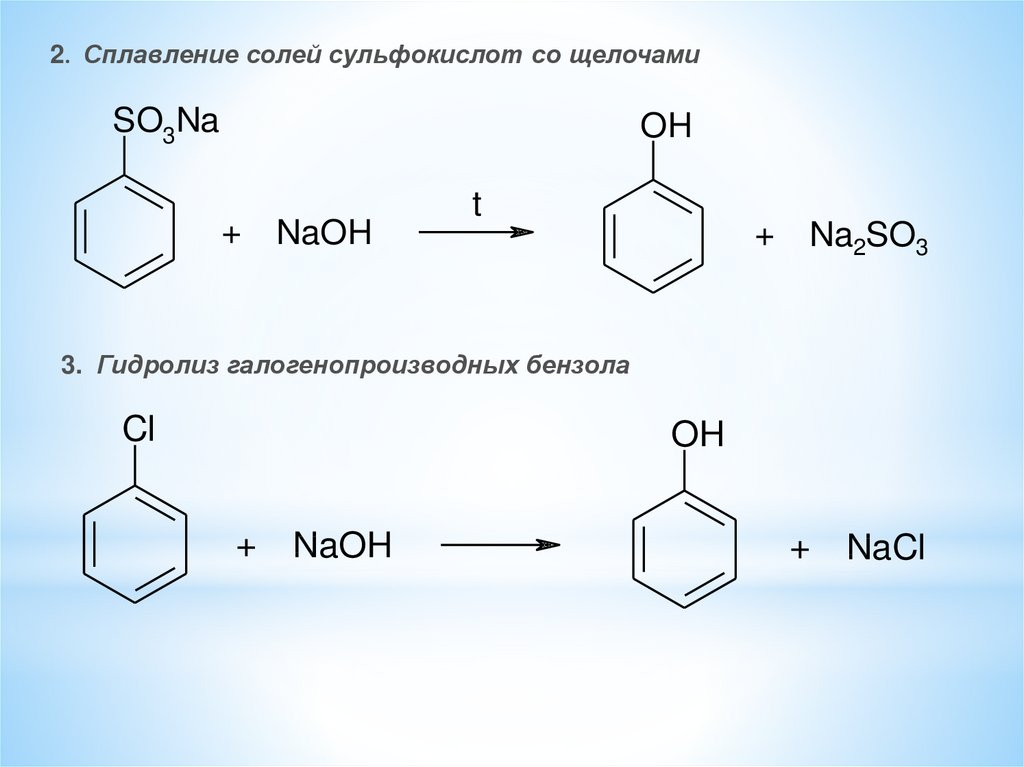
2. Сплавление солей сульфокислот со щелочамиSO3Na
OH
+
NaOH
t
+
Na2SO3
3. Гидролиз галогенопроизводных бензола
Cl
OH
+
NaOH
+
NaCl
10.
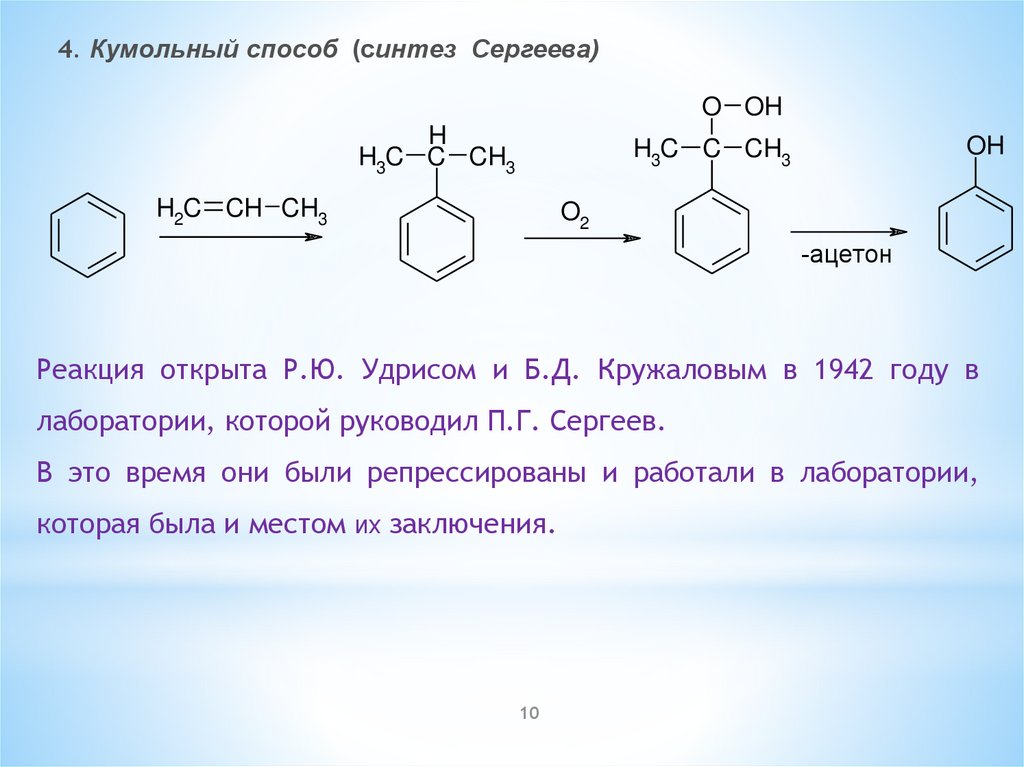
4. Кумольный способ (синтез Сергеева)O OH
H
H3C C CH3
OH
H3C C CH3
H2C CH CH3
O2
-ацeтон
Реакция открыта Р.Ю. Удрисом и Б.Д. Кружаловым в 1942 году в
лаборатории, которой руководил П.Г. Сергеев.
В это время они были репрессированы и работали в лаборатории,
которая была и местом их заключения.
10
11.
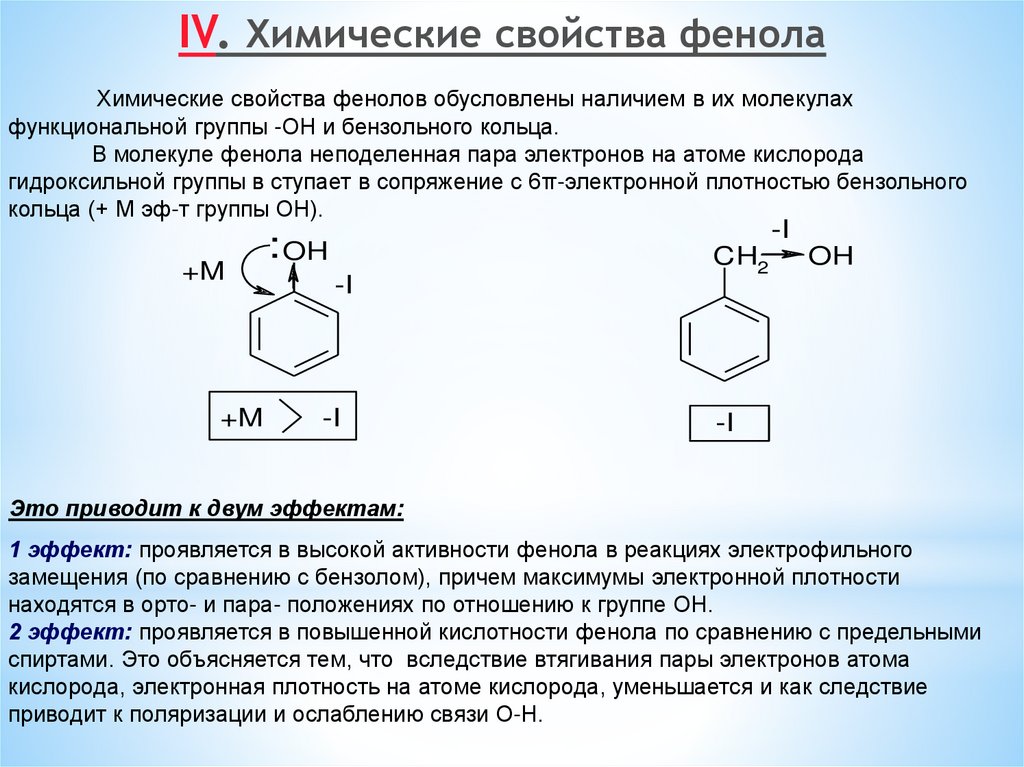
IV. Химические свойства фенолаХимические свойства фенолов обусловлены наличием в их молекулах
функциональной группы -ОН и бензольного кольца.
В молекуле фенола неподеленная пара электронов на атоме кислорода
гидроксильной группы в ступает в сопряжение с 6π-электронной плотностью бензольного
кольца (+ М эф-т группы ОН).
+M
+M
-I
: OH
-I
-I
CH2
OH
-I
Это приводит к двум эффектам:
1 эффект: проявляется в высокой активности фенола в реакциях электрофильного
замещения (по сравнению с бензолом), причем максимумы электронной плотности
находятся в орто- и пара- положениях по отношению к группе ОН.
2 эффект: проявляется в повышенной кислотности фенола по сравнению с предельными
спиртами. Это объясняется тем, что вследствие втягивания пары электронов атома
кислорода, электронная плотность на атоме кислорода, уменьшается и как следствие
приводит к поляризации и ослаблению связи О-Н.
12.
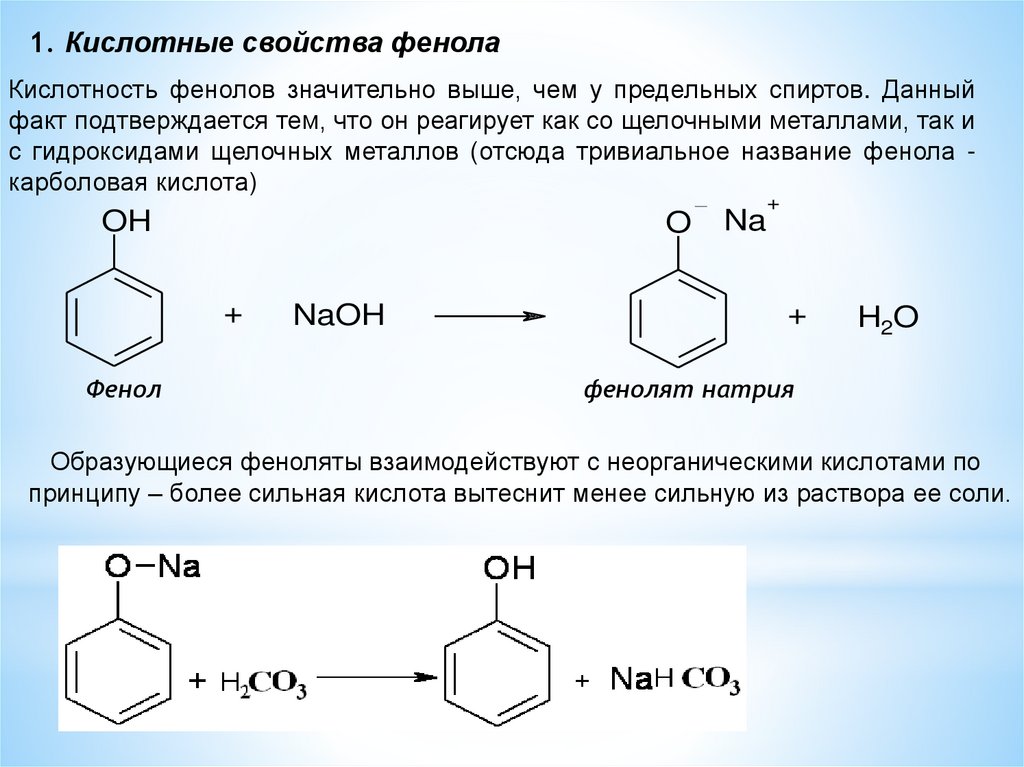
1. Кислотные свойства фенолаКислотность фенолов значительно выше, чем у предельных спиртов. Данный
факт подтверждается тем, что он реагирует как со щелочными металлами, так и
с гидроксидами щелочных металлов (отсюда тривиальное название фенола карболовая кислота)
OH
O
+
Фенол
NaOH
Na
+
+
H2O
фенолят натрия
Образующиеся феноляты взаимодействуют с неорганическими кислотами по
принципу – более сильная кислота вытеснит менее сильную из раствора ее соли.
13.
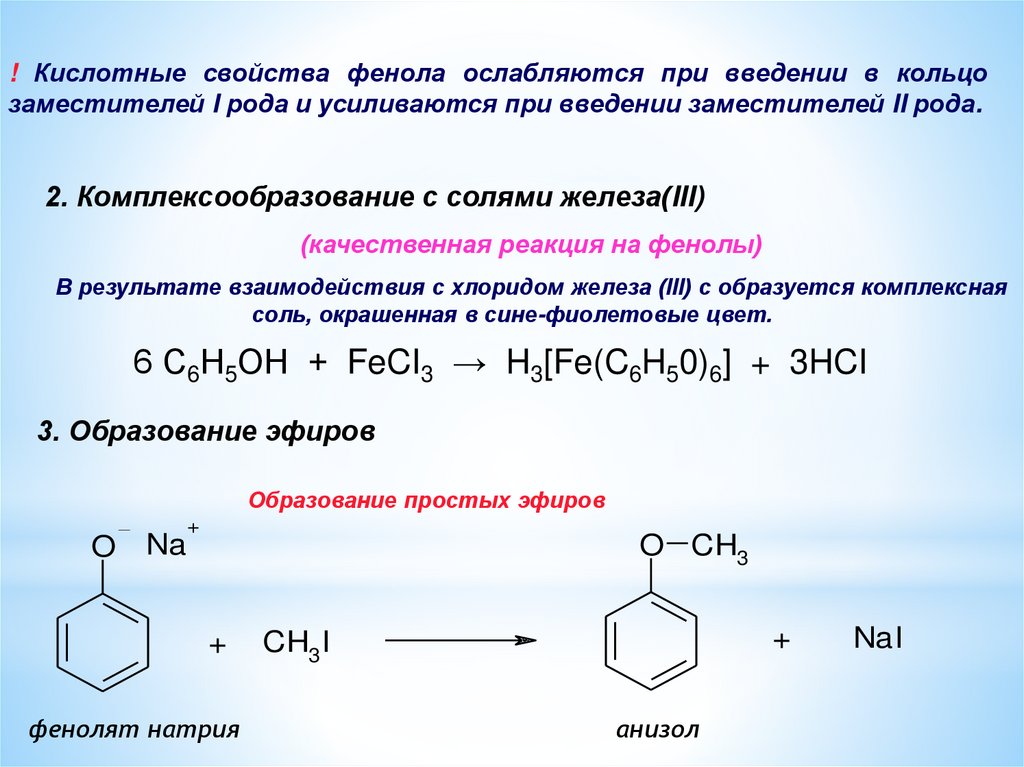
! Кислотные свойства фенола ослабляются при введении в кольцозаместителей I рода и усиливаются при введении заместителей II рода.
2. Комплексообразование с солями железа(III)
(качественная реакция на фенолы)
В результате взаимодействия с хлоридом железа (III) с образуется комплексная
соль, окрашенная в сине-фиолетовые цвет.
6 С6Н5ОН + FeCI3 → H3[Fe(C6H50)6] + 3HCI
3. Образование эфиров
Образование простых эфиров
O
Na
+
O CH3
+
фенолят натрия
+
CH3 I
анизол
NaI
14.
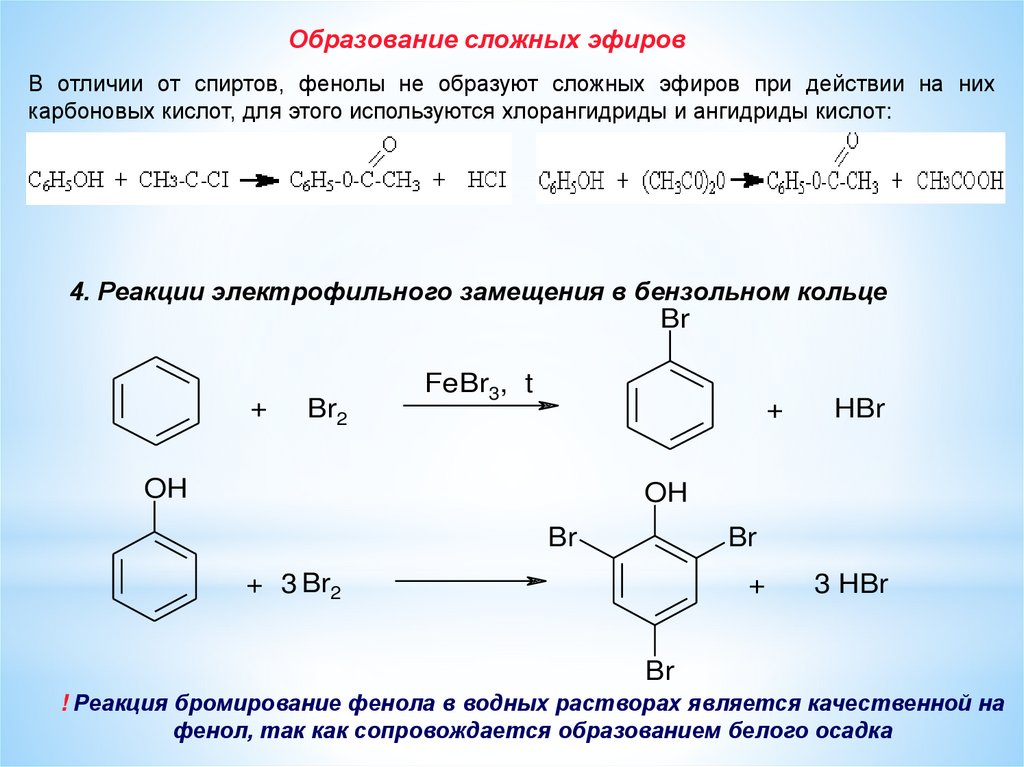
Образование сложных эфировВ отличии от спиртов, фенолы не образуют сложных эфиров при действии на них
карбоновых кислот, для этого используются хлорангидриды и ангидриды кислот:
4. Реакции электрофильного замещения в бензольном кольце
Br
+
Br2
FeBr3, t
+
OH
HBr
OH
Br
Br
+ 3 Br2
+
3 HBr
Br
! Реакция бромирование фенола в водных растворах является качественной на
фенол, так как сопровождается образованием белого осадка
15.
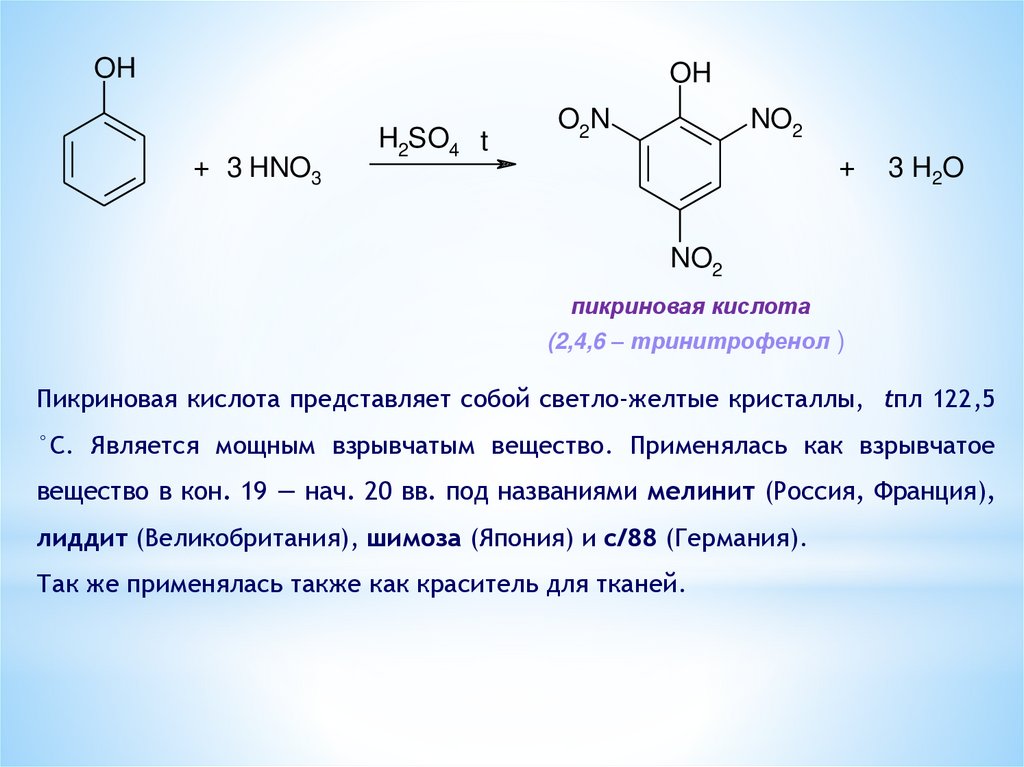
OHOH
+ 3 HNO3
H2SO4 t
NO2
O2N
+
3 H2O
NO2
пикриновая кислота
(2,4,6 – тринитрофенол )
Пикриновая кислота представляет собой светло-желтые кристаллы, tпл 122,5
°С. Является мощным взрывчатым вещество. Применялась как взрывчатое
вещество в кон. 19 — нач. 20 вв. под названиями мелинит (Россия, Франция),
лиддит (Великобритания), шимоза (Япония) и с/88 (Германия).
Так же применялась также как краситель для тканей.
16.
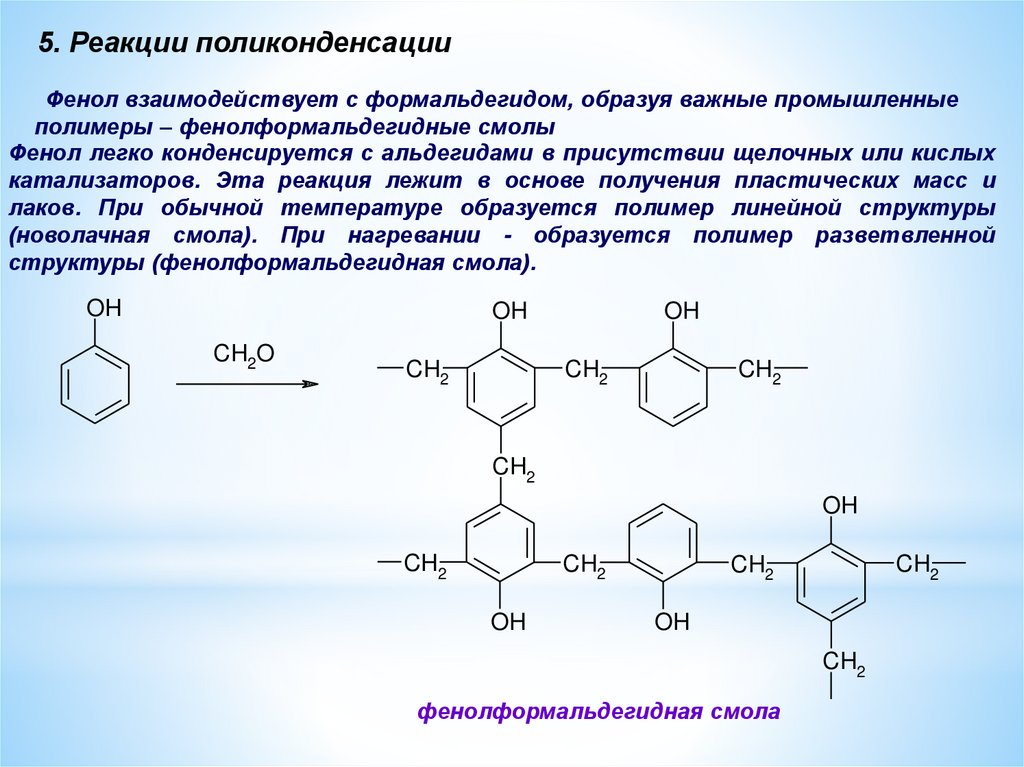
5. Реакции поликонденсацииФенол взаимодействует с формальдегидом, образуя важные промышленные
полимеры – фенолформальдегидные смолы
Фенол легко конденсируется с альдегидами в присутствии щелочных или кислых
катализаторов. Эта реакция лежит в основе получения пластических масс и
лаков. При обычной температуре образуется полимер линейной структуры
(новолачная смола). При нагревании - образуется полимер разветвленной
структуры (фенолформальдегидная смола).
OH
OH
CH2O
CH2
OH
CH2
CH2
CH2
OH
CH2
CH2
OH
CH2
CH2
OH
CH2
фенолформальдегидная смола
17.
* Фенолформальдегидные смолы являются вязкими жидкостями илитвердыми веществами. Отвержденные фенолоформальдегидные
смолы обладают электроизоляционными и механическими
свойствами. Применяются в производстве фенопластов, клеев,
лаков, герметиков, фанеры, фенолформальдегидного волокна
(кайнол).
*
Фенолформальдегидные смолы являлись первыми
промышленными синтетическими смолами; их производство под
названием “бакелит” было начато в 1909 году.
* Также, в промышленности используются крезоло-
формальдегидные смолы, резорцино-формальдегидные смолы,
феноло-анилино-формальдегидные смолы, фенологексаметилентетраминовые смолы, феноло-фурфурольные смолы
и смешанные смолы.
18.
6. Реакции окисленияФенол легко окисляется даже при действии кислорода воздуха. Так, при стоянии на воздухе
фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении
фенола хромовой смесью основным продуктом окисления является хинон. Двух и
трехатомные фенолы окисляются еще легче.
OH
O
AgNO3
-Ag
OH
O
хинон
O
OH
H2
O
OH
19.
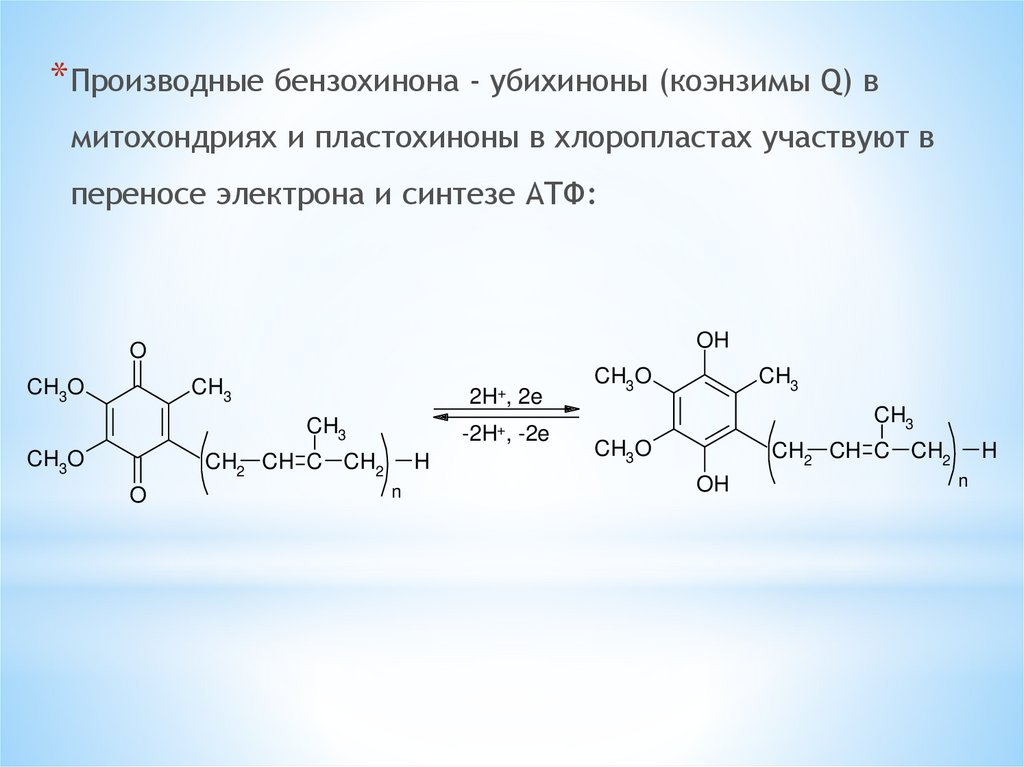
* Производные бензохинона - убихиноны (коэнзимы Q) вмитохондриях и пластохиноны в хлоропластах участвуют в
переносе электрона и синтезе АТФ:
OH
O
CH3
CH3O
2H+,
CH3
CH3O
-2H+, -2e
CH2 CH C CH2
O
2e
H
n
CH3
CH3O
CH3
CH3O
CH2 CH C CH2
OH
H
n





 Химия
Химия